UNIVERSITA’ DI PISA
DIPARTIMENTO DI ENDOCRINOLOGIA E METABOLISMO
Dottorato di Ricerca in Scienze Endocrine e Metaboliche
(SSD MED/13)
“Alterazioni cardiache precoci nell’ipotiroidismo subclinico: nuove tecniche
diagnostiche non invasive”
INTRODUZIONE 1. CUORE E APPARATO CARDIOVASCOLARE
Cuore e tiroide sono legati da strette interazioni già ben documentate in epoche precedenti lo sviluppo dell’endocrinologia moderna. A Flajani si deve la prima descrizione di gozzo associato a cardiopalmo e nel 1825 Sir Caleb Parry segnalava la presenza di alcuni casi di grave scompenso cardiaco in presenza di gozzo. Nel 1883 Kocher segnalava come -dopo tiroidectomia- fosse comune osservare la comparsa di aterosclerosi (1). Successivamente è stato chiarito che la sintomatologia cardiocircolatoria osservata in corso di ipertiroidismo ed ipotiroidismo è conseguente all’eccesso o difetto di ormoni tiroidei circolanti.
Un altro aspetto delle complesse interazioni tra tiroide ed apparato cardiovascolare è rappresentato dal fatto che la concomitante presenza di tireopatie e cardiopatie può vicendevolmente influenzare le rispettive manifestazioni cliniche e -fatto ancor più importante- complicarne l’approccio terapeutico.
EFFETTI DEGLI ORMONI TIROIDEI SULL’APPARATO CARDIOVASCOLARE
Il sistema cardiovascolare è influenzato dalle modificazioni della funzione tiroidea con tre meccanismi: a) effetti diretti dell’ormone tiroideo biologicamente attivo, triiodotironina (T3) sui tessuti cardiaci; b) interazione tra la T3 ed il sistema simpato-adrenergico che promuove l’azione delle catecolamine; c) effetti indiretti degli ormoni tiroidei attraverso modificazioni emodinamiche a livello periferico che risultano in un incremento del riempimento cardiaco ed in modificazioni della contrattilità cardiaca (2-4).
a) Azione diretta degli ormoni tiroidei
Gli ormoni tiroidei esercitano la loro azione biologica legandosi a specifici recettori nucleari dei miociti cardiaci, attivando la trascrizione genica e stimolando la sintesi di specifiche proteine (effetto genomico) (2-3). Esistono almeno due forme (e) di recettore per gli ormoni tiroidei che sono strutturalmente correlate al recettore per gli ormoni corticosteroidei e ad altri recettori ormonali nucleari. Sono state inoltre identificate diverse isoforme dei recettori ed in particolare TR1 e TR presenti nel cuore umano, che sarebbero responsabili del 40% della capacità di legame della T3. I principali effetti metabolici diretti degli ormoni tiroidei sono: 1) sintesi di enzimi miocardici, quali la ATPasi sarcoplasmatica e la ATPasi di membrana; 2) sintesi di miosina (isoforma V1); 3) sintesi del fattore natriuretico Atriale (ANF). L’azione metabolica diretta degli ormoni tiroidei determina complessivamente uno stimolo della contrazione (effetto inotropo positivo) ed un aumento della eccitabilità (effetto cronotropo positivo) della fibrocellula miocardica
(2-3). Alcuni effetti diretti degli ormoni tiroidei si esercitano a livello extranucleare (effetti non genomici). Tali effetti, in quanto non dipendenti dalla sintesi proteica, dal legame T3/recettore nucleare e dalla conseguente sintesi di proteine, si verificano molto rapidamente. Esempi di queste azioni rapide degli ormoni tiroidei sono ad esempio la stimolazione della attività Ca++ATPasica
attraverso la membrana cellulare in seguito a modificazioni dei canali del calcio (2-3, 5). Tuttavia gli effetti extranucleari nell’uomo sono soltanto parzialmente conosciuti rispetto alle interazioni degli ormoni tiroidei con i recettori nucleari.
b) Interazione degli ormoni tiroidei con il sistema simpato-adrenergico
L’interazione tra ormoni tiroidei e sistema simpatico si esprime attraverso un’aumentata sensibilità dei tessuti ad una normale stimolazione adrenergica (6). L’interazione degli ormoni tiroidei con il sistema simpatico si esplica mediante l’incremento del numero dei recettori -adrenergici, che si determina sia per sintesi di nuovirecettori che per trasformazione di-recettori in-recettori (7). c) Effetti degli ormoni tiroidei sul sistema vascolare
La T3 regola in maniera diretta le resistenze vascolari periferiche determinando il rapido rilasciamento delle cellule muscolari lisce, e le conseguenti modificazioni della pressione sanguigna e della gettata cardiaca (8-9). Questa azione endoteliale diretta si esplica mediante la ridotta disponibilità di ossido nitrico (10-11). I meccanismi attraverso i quali la T3 è in grado di influenzare le resistenze periferiche non sono solo diretti, ma anche indiretti, mediante effetti inotropici e cronotropici nonchè stimolando la secrezione del peptide natriuretico, un neuro-ormone secreto sia a livello atriale che ventricolare in risposta all’espansione del volume plasmatico e all’aumento della pressione arteriosa. Questo fattore risulta essere infatti più elevato nell’ipertirodismo e ridotto nell’ipotiroidismo (12).
MANIFESTAZIONI CARDIOVASCOLARI NELL’IPOTIROIDISMO Ipotiroidismo clinico
Le manifestazioni cardiovascolari clinicamente rilevanti, descritte per la prima volta da Zondek nel 1918 (13) con la definizione di “cuore mixedematoso”, sono presenti in pazienti affetti da ipotiroidismo conclamato e di lunga durata e costituiscono ormai un’evenienza clinica molto rara. Nell’ipotiroidismo clinico è costantemente presente bradicardia sinusale, con frequenza cardiaca compresa tra 45 e 60 battiti/minuto, per l’effetto cronotropo negativo sulle cellule del nodo seno-atriale. La riduzione della velocità di ripolarizzazione diastolica e l’allungamento della durata dei potenziali d’azione sono responsabili non solo della bradicardia ma anche della ridotta incidenza di
stimolazione adrenergica. Oltre alla bradicardia sinusale il quadro elettrocardiografico nell’ipotiroidismo può mostrare appiattimento delle onde T e riduzione dei voltaggi dell’onda P, del QRS e delle onde T. Meno frequentemente si può osservare la presenza di blocchi atrio-ventricolari, blocco di branca destro e “torsione di punta”. La riduzione dei voltaggi viene generalmente considerata espressione del versamento pericardico che in forma lieve si osserva quasi costantemente nei pazienti ipotiroidei e solo occasionalmente può manifestasi in forma conclamata. Raramente il versamento pericardico è causa di polso paradosso e di tamponamento cardiaco, poiché anche se la effusione pericardica è estesa, il suo lento accumulo permette il progressivo adattamento del pericardio. La prevalenza e l’entità del versamento pericardico sono correlati alla severità dell’ipotiroidismo, e sono reversibili dopo 2-3 mesi di terapia sostitutiva con L-tiroxina. Raramente l’ipotiroidismo manifesto può essere di per sé causa di insufficienza cardiaca, soprattutto in pazienti con ipotiroidismo grave e prolungato (2,4). Gli indici di funzione ventricolare, pur essendo ridotti in condizioni di riposo, aumentano sotto sforzo, indicando che - a differenza di quanto osservato nell’ipertiroidismo - nell’ipotiroidismo la riserva cardiaca è sufficientemente conservata. Pertanto, lo scompenso cardiaco congestizio è raro, e quando presente è espressione di concomitanti cardiopatie organiche. Tuttavia, recenti studi del consumo di ossigeno mediante PET in pazienti con mixedema hanno dimostrato che l’efficienza contrattile, e quindi di pompa, è ridotta rispetto a quanto osservato in soggetti normali (14).
Tra le varie condizioni cardiovascolari che possono essere associate all’ipotiroidismo, un problema particolare è rappresentato dalla cardiopatia ischemica. Nonostante i molti studi, i rapporti tra ipotiroidismo e coronaropatia non sono stato ancora sufficientemente chiariti. Il principale argomento a sostegno di un rapporto causale tra ipotiroidismo e cardiopatia ischemica è rappresentato dalle alterazioni del metabolismo lipidico che si osservano nei pazienti ipotiroidei e che sono notoriamente fattori favorenti lo sviluppo di ipertensione ed aterosclerosi (15). Il deficit di ormoni tiroidei determina un aumento delle concentrazioni di colesterolo, lipoproteine a bassa densità (LDL) e di apolipoproteina B (apo B) a causa del ridotto catabolismo dovuto ad una riduzione dei recettori per le LDL sugli epatociti (2-3). Pertanto gli aumentati livelli di colesterolo totale e di LDL nei pazienti ipotiroidei rappresentano un aumentato fattore di rischio per la patologia coronaria (Tabella Duntas 2002). A rendere ancora più complicata l’interpretazione dei rapporti tra ipotiroidismo e cardiopatia ischemica, l’osservazione della non infrequente associazione con l’ipertensione arteriosa. Circa il 20-40% dei pazienti con ipotiroidismo manifesto ha valori di pressione diastolica aumentati (16). I meccanismi che stanno alla base dell’ipertensione arteriosa nell’ipotiroidismo sono l’aumento delle resistenze periferiche, che gioca il ruolo prominente, la rigidità delle arterie centrali e la disfunzione endoteliale. L’endotelio vasale contribuisce alla
regolazione della pressione ed al mantenimento della fluidità del sangue. L’ipotiroidismo determinerebbe una ridotta disponibilità di ossido nitrico che è ha un ruolo fondamentale nei processi che inducono la vasodilatazione (2,4). L’osservazione dell’aumento dei fattori di rischio contrasta con la relativa bassa incidenza di infarto del miocardio ed angina nei pazienti ipotiroidei. Infatti, solo il 7% dei pazienti con ipotiroidismo clinico presenta angina e l’infarto miocardio è un’evento raro. Da segnalare tuttavia, che quando si manifesta, presenta incidenza elevata di complicanze nella fase acuta. Questa discrepanza è verosimilmente spiegata dalla ridotta domanda metabolica del miocardio conseguente agli effetti inotropo e cronotropo negativi.
Ipotiroidismo subclinico (lieve)
Gli studi di popolazione hanno chiaramente messo in evidenza come l’ipotiroidismo subclinico sia molto più frequente di quanto si ritenesse fino a pochi anni fa. Nello studio noto come “Colorado Survey”, è stato documentato nel 9.5% della popolazione soprattutto femminile e con un progressivo incremento in rapporto con l’età. Nelle femmine di oltre 65 anni è il 18% e nelle ultrasettantaquattrenni è il 21% (17). Nello studio di Framingham, l’ipotiroidismo subclinico è stato documentato nel 12% delle donne in post-menopausa e nel 4-5% degli uomini. Nella grande maggioranza dei casi l’etiologia dell’ipotiroidismo subclinico è autoimmune e in più del 75% dei soggetti non è evidente alcuna sintomatologia.
L’ipotiroidismo subclinico, a meno che non coesista una cardiopatia di base, non presenta sintomi riferibili ad una compromissione cardiaca a riposo. Tuttavia, è stata documentata una ridotta tolleranza cardio-respiratoria allo sforzo (18-19). Gli studi della funzione ventricolare sinistra, condotti con ecocardiografia convenzionale, hanno fornito risultati non univoci, ma hanno comunque permesso di evidenziare la presenza di una disfunzione diastolica a riposo, evidenziata da un ritardato rilasciamento ventricolare ed una disfunzione sistolica sotto sforzo. Tutte queste alterazioni emodinamiche sono reversibili con la terapia sostitutiva. L’introduzione di nuove è più fini metodiche diagnostiche (la videodensitometria ed il back scatter, che consentono anche un’analisi strutturale del miocardio, ventricolografia, risonanza magnetica e più di recente la tomografia assiale a positroni (PET), hanno permesso di confermare la presenza di disfunzione sisto-diastolica ventricolare sinistra, dimostrando anche che le alterazioni diastoliche possono essere presenti anche nelle fasi molto precoci dell’ipotiroidismo (2,4).
La presenza di disfunzione ventricolare, eventualmente associata alle alterazioni dell’assetto lipidico e alla disfunzione endoteliale, rendono ragione della più elevata morbilità e mortalità per l’aterosclerosi e le malattie cardiovascolari osservate anche nei pazienti con ipotiroidismo
peraltro osservare che il reale significato di queste osservazioni è di difficile interpretazione perché l’ipotiroidismo subclinico, in particolare quello a patogenesi autoimmune e manifesto è una condizione tipicamente documentata in età avanzata, quando è elevata anche l’incidenza di aterosclerosi. Un recente studio di popolazione condotto su un’ampia casistica di donne in menopausa, ha dimostrato che l’ipotiroidismo subclinico ma non l’autoimmunità tiroidea -costituisce un fattore di rischio indipendente per lo sviluppo di aterosclerosi ed infarto del miocardio, addirittura superiore al fumo ed al diabete mellito (21).
A differenza di quanto chiaramente documentato nell’ipotiroidismo manifesto, i rapporti tra ipotiroidismo subclinico ed assetto lipidico restano ancora molto controversi (2-4, 22-24). Tuttavia, è stato osservato un aumento di colesterolo HDL e una riduzione del colesterolo LDL correlata ai livelli di TSH, suggerendo che anche minime variazioni della funzione tiroidea possono modificare il metabolismo lipidico. Una meta-analisi molto accurata ha evidenziato come anche nell’ipotiroidismo subclinico la terapia sostitutiva con L-tiroxina determini una riduzione dei livelli di colesterolo totale e colesterolo LDL senza modificare tuttavia i livelli di trigliceridi e HDL, e che tale riduzione è direttamente proporzionale ai loro livelli basali e delle concentrazioni di TSH circolante (23-25). Le modificazioni dell’assetto lipidico indotte dal trattamento sostitutivo con L-T4 non riguardano tutti i pazienti con ipotiroidismo subclinico. Questo diverso comportamento potrebbe essere spiegato da fattori genetici quali alcuni polimorfismi (25). Recentemente, è stato riportato che nell’ipotiroidismo manifesto e in minor misura nel subclinico, il ridotto catabolismo del colesterolo aumenta la suscettibilità alla ossidazione delle LDL (Oxi-LDL). Le Oxi-LDL potrebbero costituire il fattore iniziale della lesione endoteliale e favorire così lo sviluppo dell’aterosclerosi (23-26).
Analogamente a quanto osservato nell’ipotiroidismo clinico, anche nel subclinico è comune il rilievo di ipertensione arteriosa. Anche in questo caso, l’aumento dei valori pressori - in particolare diastolici - è conseguente all’incremento delle resistenze periferiche, alla ridotta elasticità delle arterie ed alla disfunzione endoteliale. Un recente studio ha documentato l’ispessimento dell’intima-media delle pareti vasali in un gruppo di pazienti con ipotiroidismo subclinico ed aumentati livelli sierici del colesterolo LDL. La correzione dell’ipotiroidismo era associata alla correzione sia delle alterazioni del profilo lipidico che delle alterazioni della parete vasale, suggerendo che l’infiltrazione lipidica della parete arteriosa potrebbe avere un ruolo nello sviluppo dell’ipertensione e dell’aterosclerosi nei pazienti con ipotiroidismo subclinico (27). Altri studi non hanno tuttavia confermato questo rilievo.
Negli ultimi anni l’attenzione si è focalizzata sui rapporti tra ipotiroidismo e i cosiddetti fattori “non tradizionali” di rischio aterosclerotico, quali l’omocisteina, la Proteina C reattiva, il fibrinogeno, la
lipoproteina (a), il Fattore VII della coagulazione, il fattore di von Willebrand (28). I risultati degli studi condotti a tal proposito sono molto discordanti e l’opinione corrente è che le modificazioni di alcuni di tali fattori (Proteina C Reattiva, Fattori della coagulazione e Omocisteina) possono avere un peso come fattori di rischio cardiovascolare nell’ipotiroidismo clinico, ma che non altrettanto possa dirsi per l’ipotiroidsmo subclinico (28).
Se l’ipotiroidismo subclinico sia realmente un fattore di rischio cardiovascolare è stato di recente oggetto di numerosi studi e meta-analisi che hanno portato a conclusioni tra loro discordanti (29-33). Le motivazioni di queste discrepanze possono essere molteplici. La selezione dei pazienti in rapporto all’età, al sesso, lo stile di vita, il livello di TSH circolante scelto per la definizione stessa di ipotiroidismo subclinico, la dimostrazione dell’esistenza di una soglia individuale dell’asse ipotalamo-ipofiso-tiroidea (34), i metodi di valutazione delle condizioni cardiache e vascolari, la presenza ed il peso di altri fattori di rischio cardiovascolare (4). Tuttavia, l’evidenza di modificazioni sia pur minime e clinicamente silenti della struttura e della funzione ventricolare, l’aumento delle resistenze periferiche e la riduzione di elasticità della pareti vascolari, la presenza di disfunzione endoteliale e le modificazioni dell’assetto lipidico, suggeriscono che l’aumento del TSH non è una semplice alterazione di laboratorio ma una vera e propria condizione di un deficit funzionale tiroideo potenzialmente in grado di determinare un danno a livello dell’apparato cardiovascolare. L’ipotiroidismo subclinico (sHT) è una condizione apparentemente asintomatica definita da lievi aumenti serici di ormone tireo-stimolante (TSH) rispetto a valori normali di ormoni tiroidei liberi (40,41). Come riportato, in aree ad adeguata provvigione iodica, il sHT si verifica 4-9.5% della popolazione generale, più di frequente nelle donne e negli anziani (42-44). Nella prospettiva della lieve riduzione ormonale e l’apparente mancanza di sintomatologia, il bisogno di un trattamento vita natural durante con levotiroxina (LT4) è materia controversa. Tuttavia, questa condizione può essere rilevante su organi bersaglio in un periodo di molti anni. Il sistema cardiovascolare è molto sensibile a minime riduzioni di ormoni tiroidei circolanti, e disfunzioni cardiovascolari sono usualmente associate ad ipotiroidismo franco (45-47). Inoltre, le anomalie nella contrattilità miocardia ed i cambiamenti del profilo lipoproteico sono stati riportati frequentemente negli ipotiroidei (45,47,48). Quindi, il sHT può essere considerato un vero fattore di rischio per lo sviluppo di malattia delle coronarie (45-52). In fatti, una progressione di lesioni coronarie angiografiche è stata riportata in pazienti sHT non trattati rispetto a quelli trattati (53). Di recente, tramite caratterizzazione tissutale ultrasonografica (videodensitometria) è stato osservato che il sHT è associato a precoci anomalie sia nella funzione e struttura miocardia, reversibile con terapia sostitutiva (54,55).
TERAPIA DELL’IPOTIROIDISMO NEL CARDIOPATICO
In generale, la necessità di trattare l’ipotiroidismo clinico è universalmente accettata. La presenza di una cardiopatia in un paziente ipotiroideo rende tuttavia più delicata la decisione relativa al trattamento sostitutivo. Infatti, se da un lato la somministrazione di ormoni tiroidei consente di normalizzare le anomalie cardiovascolari tipiche dell’ipotiroidismo, dall’altro può aggravare coesistenti cardiopatie organiche. Ne consegue l’importanza di valutare molto attentamente il rischio cardiaco prima di intraprendere la terapia sostitutiva con ormoni tiroidei.
La necessità di trattare l’ipotiroidismo manifesto -anche in questa particolare situazione clinica- è comunque universalmente accettata. La differenza tra effetti benefici e conseguenze negative sulla situazione cardiovascolare del paziente dipende dalla dose e soprattutto dalla modalità di somministrazione della L-tiroxina. Occorre infatti iniziare con dosi molto basse e procedere con minimi incrementi graduali. Si inizia con dosi di 12,5-25 g/die con incrementi graduali (12,5-25 g/die) ogni 4-8 settimane.
Il trattamento sostitutivo con L-tiroxina in un paziente con ipotiroidismo manifesto e coronaropatia rende necessare alcune valutazioni aggiuntive. Se il paziente è “a basso rischio coronario” si può procedere nel modo sopra descritto. In presenza di “elevato rischio coronario” occorre stabilire preventivamente se è indicato un intervento di rivascolarizzazione con angioplastica o by-pass coronario. In caso affermativo, la rivascolarizzazione deve essere eseguita prima di intraprendere la terapia sostitutiva ormonale. In pazienti ipotiroidei sottoposti a rivascolarizzazione coronaria non è stato osservato un incremento della mortalità perioperatoria (35). Sono state tuttavia riportate un’aumentata incidenza di ipotensione intraoperatoria ed insufficienza cardiaca perioperatoria. Per quanto riguarda l’angioplastica percutanea transluminale, sia la percentuale di successo che il rischio di complicanze sono sovrapponibili nei pazienti ipotiroidei ed in quelli eutiroidei, sebbene nel gruppo di pazienti ipotiroidei sia maggiore il rischio di ematomi (36). La necessità di trattare l’ipotiroidismo sub-clinico, soprattutto nel cardiopatico, è ancora oggetto di discussione e con essa anche la necessità di eseguire lo screening dell’ipotiroidismo subclinico (37-39). Il rilievo nei
pazienti con ipotiroidismo subclinico di alterazioni dell’assetto lipidico, di precoci alterazioni sistoliche e diastoliche della funzione ventricolare, di alterazioni altrettanto precoci a livello endoteliale dei vasi arteriosi e la loro correzione con il trattamento riportata da molti, anche se non da tutti gli studi, appare opportuno per quanto ancora molto dibattuto, consigliare o per lo meno non scoraggiare il trattamento dell’ipotiroidismo subclinico anche nei pazienti cardiopatici.
Riassunto
Lo scopo del presente studio era di valutare la funzione ed il tessuto cardiaco in pazienti con Ipotiroidismo subclinico (sHT), con metodiche sia convenzionali che recenti ultrasoniche intramiocardiche. Il sHT era caratterizzato da normali valori serici di tetraiodotironina e triiodotironina libere e valori di TSH lievemente aumentati. Ventiquattro pazienti affetti da sHT e 24 controlli selezionati per sesso ed età sono stati studiati. Tutti i soggetti sono stati studiati con ecocardiografia color doppler convenzionale bidimensionale (2D) e diagnostica Doppler tissutale ad onda pulsata (PWTDI), per l’analisi della funzione diastolica; diagnostica miocardica color doppler (CDMI) per l’analisi della tensione regionale ed il suo ritmo ed immagini a retroproiezione integrata (IBS) per la valutazione della contrattilità intrinseca e caratterizzazione tissutale. I risultati del presente studio: (a) il rilievo di sHT in soggetti con indice di variazione ciclico minore (CVI), indicante una contrattilità miocardia intrinseca alterata; (b) una riflessività ultrasonica miocardica aumentata in relazione a tessuto miocardio alterato; (c) il rilievo di una tensione sistolica ed il suo ritmo indicante un’alterazione della deformabilità regionale; (d) un iniziale ostacolo della funzione diastolica sinistra indicata da una diminuzione del picco di velocità E del flusso mitralico ed un aumento del picco di velocità A di flusso mitralico. Tutti i parametri studiati con eco convenzionale 2D nei pazienti sHT erano compatibili con i controlli, eccezion fatta per una modesta alterazione nella funzione diastolica. E’ stata rilevata una significativa correlazione tra le alterazioni sisto-diastoliche rilevata al CDMI ed IBS con i livelli serici di TSH. Il CVI al setto, l’onda S di picco PWTDI e lo sforzo sistolico al setto erano inversamente correlati ai livelli serici di TSH. In conclusione, le nuove tecniche ultrasonografiche intramiocardiche confermano ed estendono la precedente letteratura sugli effetti del sHT sul cuore, consentendo il rilievo di anomalie precoci ultrastrutturali e funzionali sisto-diastoliche.
PAZIENTI E METODI Soggetti
Lo studio condotto ha coinvolto 24 pazienti (19 donne; età media 34.8 ± 6.3 anni) con neodiagnosi di sHT non trattato. I livelli medi serici di FT4 ed FT3 erano 8.9±1.8 e 3.5±0.7 pg/ml rispettivamente. La concentrazione serica media di TSH era 5.3 ± 1.1 mU/l (valore normale 0.4-3.4 mU/l). In tutti i pazienti, l’eziologia del sHT era la tiroidite cronica autoimmune, diagnosticata da elevati livelli di anti-perossidasi e/o anticorpi anti-tireoglobulina e diffusa ipoecogenicità agli ultrasuoni. I criteri di inclusione erano: età minore di 45 anni e livelli di TSH leggermente aumentati tra 3.5 e 7.5 mU/l). Pazienti con funzione ventricolare sinistra ostacolata (frazione di eiezione < 50%); patologie valvolari significative; cardiomiopatia e diabete mellito sono stati esclusi. Tutti i sHT avevano normale PA, normali livelli sia di colesterolo (LDL ed HDL) e trigliceridi ed una storia negativa per infarto miocardico o malattia delle coronarie. Il gruppo di controllo includeva 24 volontari selezionati per età e sesso (19 donne; età media 30.8 ± 6.7 anni). Patologie cardiovascolari e respiratorie sono state escluse sia nei pazienti che nei controlli tramite un’indagine clinica completa. La chimica di laboratorio di routine era normale in tutti, e nessuno assumeva farmaci. L’indice di massa corporeo (BMI) era 22.3 ± 2.6 nei controlli e 24.5 ± 3.0 nei sHT.
Procedimento sperimentale
Profilo ormonale e metabolico. Sono stati raccolti campioni di sangue tra le ore 0:00 e le 09:00 per
la FT3, FT4 e TSH. L’FT3 ed FT4 sierico sono stati misurati usando un metodo a chemiluminescenza (Vitros Eci-Ortho-Clinical Diagnostic Spa). I valori normali erano compresi tra 7.0-17.0 pg/ml per l’FT4 e 2.7-5.7 pg/ml per l’FT3. Il TSH sierico è stato determinato con un metodo ultra-sensibile a chemiluminescenza (IMMULITE 2000-Diagnostic Products Corporation Analyzer), con valori normali compresi tra 0.4-3.4 mU/l. La determinazione del titolo sierico anti-tireoglobulina (Tg-Ab), anti-perossidasi (TPO-Ab) è stata valutata con metodo ad immunofluorescenza (AIA 21 TOSOH-Italia). La diagnosi di sHT è stata basata sulla base di valori di TSH compresi tra 3.5 e 7.5 mU/l e valori normali di ormoni tiroidei liberi.
Analisi Ecocardiografica. Tutti i pazienti ed i controlli sono stati sottoposti in cieco a
ecocardiografia convenzionale, Doppler imaging tissutale ad onda pulsata (PWTDI), CDMI e densitometria acustica.
Ecocardiografia convenzionale 2D. Valutazione ecocardiografica convenzionale è stata eseguita
come già riportato in dettaglio (54,55).
Diagnostica per immagini tissutale ad onda pulsata (PWTDI).
Nella veduta apicale a quattro camere, sono stati valutati due loci dell’anello mitrale: il setto e la parete laterale. La vista a quattro camere è stata scelta per ottenere una valutazione quantitativa della funzione diastolica sinistra globale, quasi simultaneamente all’afflusso ventricolare sinistro Doppler e per minimizzare l’angolo di incidenza tra il raggio Doppler ed il moto longitudinale dell’anulus mitralico (61,62). PWTD dell’anulus settale è stato usato per la misurazione del picco di velocità diastolica precoce all’anulus mitralico (Es). Le pressioni di riempimento del ventricolo sinistro sono state estrapolate dal rapporto E/Es (E derivato dalla velocità di flusso mitralico) (61).
Indici di derivazione CDMI: velocità medie, tensione e ritmo di tensione regionali. I dati CDMI
sono stati analizzati usando un software dedicato (AMID, Firenze, Italia). I profili di velocità, tensione e ritmo di tensione sono stati calcolati in media su tre cicli cardiaci per calcolare la velocità media (VEL) e la curva del ritmo di tensione su intervallo R-R medio. I profili e valori di tensione naturale media (ε) sono stati ottenuti integrando il profilo medio di tensione del tempo via software AMID. Il ritmo della frequenza variava tra 75 e 90 Hz. Un’area d’interesse (ROI) consiste in un segmento miocardico legato ad altri quattro segmenti, due dei quali attraverso il tessuto e gli altri due paralleli al segmento, in modo che l’area circoscritta contenesse sempre il segmento d’interesse durante il movimento. Il software riconosce automaticamente il tessuto in movimento nell’area circoscritta e l’analisi è calcolata sul segmento della parete miocardica contenuta dentro l’area. In questa maniera, la ROI diventa un’area responsiva che segue continuamente la parete. La tensione (calcolato da un’integrazione temporale del ritmo di tensione) ed il ritmo di tensione sono stati calcolati come descritto (56,57).
La motilità e la deformazione in senso longitudinale, sia al setto posteriore medio e parete media laterale, sono stati descritti dai seguenti parametri calcolati da una vista da camera apicale: tempo di rilassamento isovolumetrico (VEL ivrt); tempo di contrazione isovolumetrico (VEL ivct); massima velocità sistolica (VELsys); picco di velocità diastolica precoce (VELe); picco di velocità diastolica tardiva (VELa); tensione massima (sys); massimo ritmo di tensione (SR sys); picco diastolico
coefficiente di correlazione intraclasse (ri) è stato calcolato secondo il procedimento di Bland e Altman (65). Tre valori di tensione e ritmo di tensione sono stati valutati per ogni paziente e per ogni segmento: settale e laterale; il coefficiente di correlazione (ri) era di 0.86 per il setto e 0.89 per il laterale.
Densitometria Acustica. La tecnologia IBS ad alta frequenza di immagine è stata commercialmente
applicata per fornire un più robusto segnale (calibrato in decibels, dB), con un sostanziale miglioramento nella sequenzialità del segnale a retroproiezione, ulteriormente ottimizzata per la ricerca tissutale (60-62). La misurazione della densitometria acustica è indipendente da compressione non lineare e funzioni di valutazione a seguire nella sequenza rappresentativa ultrasonografica. Le immagini sono state ottenute usando una metodica di rappresentazione armonica. Altri parametri di impostazione importanti come la pre-valutazione; la posizione del fuoco; la persistenza; la compressione; la sequenza ad alta frequenza e valutazione a posteriori sono stati mantenuti costanti per tutti i pazienti, evitando accuratamente la saturazione del segnale (es. il valore di retroproiezione campionato al massimo valore per la gamma dinamica del sistema) ad ogni livello (pericardio, valvole, miocardio) per possibili errori di stima. Parametri di IBS telediastolica (IBSed) sono stati indicizzati per i valori IBS pericardici sia al setto (IBS setto) e alla parete posteriore (IBS parete post.). Le misurazioni ottenute per ogni ciclo cardiaco erano l’intensità dell’IBS telediastolico (IBS ed), intensità IBS telesistolico (IBS es). L’indice di variazione ciclica al setto (CVI septum) e a livello della parete posteriore (CVI par.post.), che sono stati calcolati usano la seguente formula: (IBSed-IBSes)/IBSed X 100 (62).
Analisi statistica. Variabili continue sono state espresse come media D.S. Il test t di student è stato usato per quantificare le variabili tra i gruppi. Il coefficiente di correlazione intraclasse (ri) è stato calcolato secondo il procedimento di Bland ed Altman (64), usando una ANOVA a senso unico per misurazioni ripetute. La relazione tra le misurazioni ecocardiografiche bidimensionali (2-D) ed i valori di TSH sono state valutate in termini di analisi in regressione lineare. Un valore di P < 0.05 è stato considerato significativo.
Risultati
I dati clinici e ormonali dei pazienti sHT e dei controlli sono mostrati in Tabella 1. Valori pressori sistolici e diastolici medi, frequenza cardiaca e indice di massa corporea (BMI) erano sovrapponibili in entrambi i gruppi, rimanendo nella fascia della normalità. I valori sierici di TSH erano significativamente più elevati nei soggetti sHT rispetto ai controlli (P<0.001), mentre non
sono state trovate differenze nei livelli di FT4 di FT3. Tutti i soggetti sHT avevano alti livelli di Ab-TG e/o Ab-TPO.
Tabella 1
Parametri clinici e ormonali nei soggetti sHT e controlli. sHT(n=24), media ±D.S. Controlli (n=24) media ± D.S. P ETA’ BMI SBP (mmHg) DBP (mmHg) MBP (mmHg) HR (b/min) FT4 (pg/ml) FT3 (pg/ml) TSH (µU/ml) 34.8±6.2 22.33±2.6 117.2±9.9 73.2±5.6 90.3±5.9 78.9±12.4 8.9±1.8 3.5±0.7 5.3±1.1 33.9±6.4 24.5±3.0 119.9±8.2 74.8±7.4 92.9±10.5 75.9±11.7 12.2±2.7 3.9±3.4 1.4±0.8 NS NS NS NS NS NS NS NS <0.001
BMI (indice di massa corporeo); SBP (P.A. Sistolica); DBP (P.A. diastolica); MBP (P.A. media); HR (requenza cardiaca).
Dati ecodoppler convenzionali
I dati derivanti dall’analisi ecocardiografica convenzionale sono riassunti in Tabella 2. Lo spessore del setto e della parete posteriore erano aumentati in modo significativo nei sHT mentre il diametro ventricolare telediastolico sinistro (LV) era sovrapponibile. La massa ventricolare sinistra (LVM)bs era leggermente ma significativamente aumentata nei sHT, seppur ancora nella gamma della normalità. La gittata cardiaca e le resistenze vascolari periferiche erano sovrapponibili nei due gruppi. Riguardo alla LV funzione sistolica, i valori della frazione di accorciamento (FS) e della frazione di eiezione (EF) rientravano nei valori normali. Il tempo di contrazione isovolumetrico ed il periodo di pre-eiezione (PEP) erano più alti in modo significativo nei sHT paragonati ai controlli (rispettivamente P<0.01 e P<0.05). Di conseguenza il rapporto PEP/ tempo di eiezione ventricolare sn (LVET) era più alto nei sHT che nei controlli (p<0.05). La funzione ventricolare diastolica sn. mostrava una differenza significativa tra i pazienti sHT ed i controlli a causa di una diminuzione del picco E (P<0.05) e un incremento del picco A di velocità di flusso, che era aumentato nei sHT
(P<0.01) nei pazienti sHT che nei controlli (Fig.1 pannello A). Il tempo di rilassamento isovolumetrico (IVRT) era aumentato significativamente nei sHT rispetto ai controlli (P<0.01). Tabella 2
Parametri Convenzionali Echo-Doppler in pazienti sHT e in controlli. sHT (n=24) mean ±SD Controls (n=24) mean ±SD p EDD (cm) 46,2 ± 4.8 48.2 ± 4.7 NS FS (%) 42.8 ± 5.3 39.5 ± 8.2 NS EF (%) 65.4 ± 8.2 62.5 ± 9.5 NS DSth(mm) 8.2 ± 1.3 9.8 ± 1.4 0.05 DPWth(mm) 8.3 ± 1.1 9.5 ± 1.6 0.05 LVMbs(g/m2) 88.2 ± 11.7 98.5 ± 12.1 0.01 EDV (cm3) 83.6 ± 4.3 86.3 ± 6.5 NS CO (l/min) 5.2 ± 1.2 5.3 ± 1.3 NS SPR 1364.6 ± 331.2 1382.2 ± 312.6 NS Peak E (cm/sec) 81.2 ± 13.0 71.2 ± 15.7 0.05 Peak A (cm/sec) 52.4 ± 9.6 67.5 ± 10.7 0.01 E/A ratio 1.5 ± 0.3 1.1 ± 0.2 0.02
Mitral Dec time (msec) 170.6 ± 23.9 143.6 ± 34.6 0.05
IVRT (msec) 71.3 ± 10.5 86.2 ± 16.3 0.01
IVCT (msec) 53.6 ± 8.3 63.5 ±12.5 0.05
LVET (msec) 276.6 ± 25.5 279.6 ± 25.9 NS
PEP (msec) 80.6 ± 10.8 88.2 ± 11.6 0.05
PEP/LVET 0.28 ± 0.05 0.35 ± 0.06 0.02
EDD, diametro telediastolico; FS, frazione d’accorciamento; EF, frazione d’eiezione; DPW, parete posteriore diastolica; LVM, massa ventriculare sinistra; EDV, volume telediastolico; CO, gittata cardiaca; SPR, resistenze periferiche sistemiche; IVRT, tempo di rilassamento isovolumetrico; IVCT, tempo di contrazione isovolumetrico; LVET, tempo di eiezione ventricolare sinistro; PEP, periodo di pre-eiezione.
Diagnostica Tissutale Doppler a Onda Pulsata (PWTDI)
I dati derivanti dalla PWTDI sono riassunti nella Tabella 3. Il picco di velocità medio proto diastolico (PWTDI Es e Ei) era minore nei pazienti sHT rispetto ai controlli (P<0.01 e <0.03 rispettivamente); il picco di velocità tele diastolico (PWTDI As e Al) era aumentato nei sHT che nei controlli (P<0.03). Il rapporto tra le velocità E ed A (PWTDI E/As e E/Al), espressione della funzione diastolica globale ventricolare sinistra, era significativamente più bassa nei sHT che nei controlli (P<0.04 e 0.01 rispettivamente). Il PWTDI-IVRT sia a livello del setto che della parete anulare laterale erano significativamente aumentati nei pazienti sHT che nei controlli (P<0.03 e <0.02 rispettivamente).
Tabella 3
Diagnostica tissutale Doppler ad onda pulsate (PW-TDI): risultati in pazienti sHT e nei controlli. PWTDI Parameteri sHT (n=24) MEDIA ±SD Controlli (n=24) media ±SD p PWTDI Ss 8.0 ± 1.1 7.9 ± 2.2 NS PWTDI Es 11.4 ± 2.0 9.8 ± 2.7 0.01 PWTDI As 7.7 ± 1.7 8.9 ± 2.4 0.03 PWTDI E/As 1.5 ± 0.3 1.1 ± 0.2 0.04 PWTDI IVRTs 74.4 ± 9.2 85.5 ± 13.5 0.03 PWTDI Sl 10.6 ± 2.1 9.9 ± 1.9 NS PWTDI EL 15.7 ± 2.6 13.9 ± 3.5 0.03 PWTDI AL 8.1 ± 2.5 10.3 ± 4.3 0.03 PWTDI E/AL 1.6 ± 0.4 1.2 ± 0.5 0.01 PWTDI IVRTL 73.6 ± 10.3 87.4 ± 10.6 0.02 E/Es 5.2 ± 0.9 5.6 ± 2.1 NS
PWTDI Ss: picco di velocità sistolica (onda S) a livello dell’anulus mitralico settale; PWTDI Es, picco precoce di velocità diastolica longitudinale dell’anello mitralico a livello del setto; PWTDI As, picco di velocità tardivo diastolico longitudinale a livello dell’anulus mitralico settale; PWTDI IVRTs, tempo di rilassamento isovolumico dell’anulus mitralico a livello settale; PWTDIL, gli
stessi parametri sopracitati a livello della parete laterale; E/Es rapporto tra picco E di flusso
Indici di derivazione CDMI: velocità regionali medie, tensione e ritmo di tensione
I dati degli indici CDMI sono riassunti in Tabella 4. La VELsys(s) e VELsys(l) erano significativamente più bassi nei sHT rispetto ai controlli (P<0.05 e <0.02 rispettivamente); la velocità regionale media proto diastolica, sia a livello del setto medio che della parete laterale era minore nei sHT che nei controlli (P<0.01 e <0.05 rispettivamente); la velocità regionale tele diastolica, sia a livello del setto medio che della parte laterale era aumentata nei sHT che nei controlli (P<0.01 <0.05 rispettivamente); il rapporto VEL e/a era significativamente inferiore nei sHT che nei controlli (P<0.01). I rilevamenti della tensione regionale sistolica valutati sia al setto medio e parte laterale erano significativamente inferiori nei sHT che nei controlli (P<0.05 e <0.02 rispettivamente). Il ritmo di tensione sistolico regionale sia al setto medio e parte laterale erano significativamente inferiori nei sHT che nei controlli (P<0.05). Considerando lo SR diastolico, la fase tardiva era compromessa nei sHT rispetto ai controlli (P<0.05 e <0.02 rispettivamente).
Tabella 4.
Controlli vs sHT: Diagnostica Miocardica Color Doppler (CDMI); Retroproiezione Integrata (IBS).
CDMI Parametri Controlli sHT p
VEL sys (S) 3.1 ± 0.6 2.4 ± 0.8 0.05 VEL E (S) -4.9 ± 1.2 -5.9 ± 1.0 0.05 VEL A (S) -2.8 ± 1.0 -4.5 ± 1.8 0.01 VEL E/A (S) 1.8 ± 0.4 1.1 ± 0.4 0.01 sys (S) -23.3 ± 5.4 -19.2 ± 4.2 0.05 SR sys (S) -1.2 ± 0.4 -0.7 ± 0.2 0.05 SR E (S) 1.5 ± 0.6 1.0 ± 0.4 0.01 SR A (S) 0.6 ± 0.4 0.9 ± 0.3 0.05 VEL sys (L) 4.3 ± 1.5 3.0 ± 1.1 0.02 VEL E (L) -5.4 ±1.3 -4.2 ± 1.6 0.05 VEL A (L) -2.5 ± 1.2 -3.4 ± 1.3 0.05 VEL E/A (L) -2.1 ± 0.8 -1.6 ± 0.7 0.01 sys (L) -23.1 ± 5.6 -18.4 ± 3.7 0.02 SR sys (L) -1.25 ± 0.2 -1.05 ± 0.2 0.05 SR E (L) 1.17 ± 0.5 1.09 ± 0.4 NS SR A (L) 0.5 ± 0.2 0.8 ± 0.3 0.02
IBS Parametri controlli sHT p
CVI setto 37.2 ± 9.5 22.6 ± 10.2 0.0001
CVI parete posteriore 42.5 ± 8.6 32.2 ± 11.2 0.001 IBS settoper 45.5 ± 8.2 53.8 ± 7.3 0.05
Parametri CDMI: VEL sys (S), picco di velocità sistolica regionale (onda S) a livello del setto; VEL E (S), picco precoce di velocità diastolica regionale a livello settale; VEL A (S), picco tardivo di velocità diastolica longitudinale regionale a livello settale;sys (S), tensione regionale sistolica a livello settale; SR sys (S): ritmo di tensione regionale sistolico a livello settale; SR E (S), tasso di tensione precoce diastolico longitudinale regionale sistolico a livello settale; SR A (S), tasso di tensione tardivo diastolico longitudinale regionale sistolico a livello settale. (L) Tutti i sopracitati parametri a livello della parete regionale laterale.
Parametri IBS: CVI setto, indice di variazione ciclica a livello settale; CVI parete posteriore, indice di variazione ciclica a livello della parete posteriore; IBS settoper, riflessività ultrasonica a livello
settale riferito alla riflettività dell’interfaccia pericardica; IBS parete posteriore per, riflessività
ultrasonica a livello della parete posteriore riferito alla riflettività dell’interfaccia pericardica.
Fig.1. Rapporto E/A ottenuto tramite ecocardiografia convenzionale 2D (pannello A) e indice di
variazioni cicliche a livello settale ottenuto tramite IBS (pannello B) in pazienti con sHT e controlli
Densitometria acustica
I principali risultati parametrici IBS sono stati riassunti in tabella 4. CVI sia del setto (fig.1 pannello B) che della parete posteriore erano significativamente più bassi nei sHT rispetto ai controlli
60 50 40 30 20 10 0 CVI septum (%) sHT Controls 2.5 2.0 1.0 0.5 sHT Controls 1.5 Pannello A Pannello B 60 50 40 30 20 10 0 CVI septum (%) sHT Controls 2.5 2.0 1.0 0.5 E/A RATIO RATIO sHT Controls 1.5
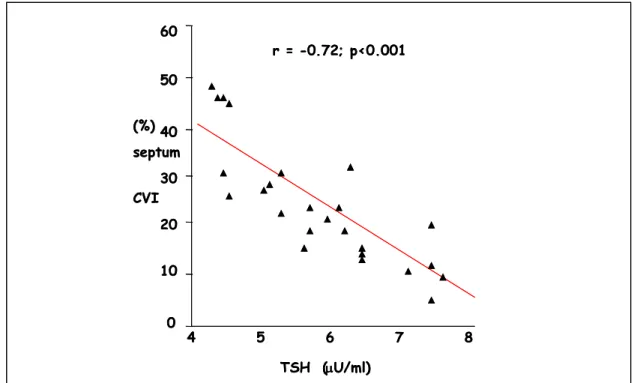
controlli (P<0.05). Non sono state trovate differenze nei valori IBS della parete posteriore tra gruppo sHT e controlli. Correlati ai valori di TSH erano il CVI a livello settale (P<0.001); tensione sistolica al setto (P<0.04) e livello laterale (P<0.05). Il CVI par.post. era inversamente correlato ai valori di TSH (P<0.01). In Fig.2 è riportata la correlazione tra CVI al setto e livelli sierici di TSH. Nel presente studio, non sono state rilevate relazioni tra auto-anticorpi tiroidei e CVI setto (%) e rapporto E/A.
Figura 2. Relazione tra indice di variazione ciclica (CVI) a livello del setto e livelli TSH in soggetti con sHT;
Discussione
I risultati del presente studio indicano che le metodiche non invasiva IBS e CDMI permettono di rilevare in soggetti sHT, anomalie miocardiche coesistenti tissutali e funzionali parzialmente non rilevabili tramite ecocardiografia convenzionale 2D. Un grande numero di studi sono stati esperiti per valutare la capacità cardiaca in soggetti sHT, ma i risultati erano contrastanti (65-69), il quesito se il sHT fosse correlato a rischio cardiovascolare è controverso. Questi risultati contrastanti possono essere spiegati da un diverso criterio di reclutamento dei soggetti (campione numerico, età, tipo e durata dell’sHT); diversi criteri diagnostici (variabilità di livelli TSH); differenti tecniche e indici per valutare le capacità cardiache. Un precedente studio ha mostrato che il sHT è associato
60 50 40 30 20 10 0 CVI septum (%) TSH (U/ml) r = -0.72; p<0.001 4 5 6 7 8 60 50 40 30 20 10 0 CVI septum (%) TSH (U/ml) r = -0.72; p<0.001 4 5 6 7 8
con alterazioni precoci sia della funzione che della struttura cardiaca, se analizzati tramite ecocardiografia convenzionale e analisi videodensitometrica (54). Anomalie miocardiche erano reversibili con terapia sostitutiva LT4 (55).
Il presente studio controllato è stato condotto in una serie di 24 giovani sani con sHT non trattato autoimmune di recente diagnosi e valori di TSH varianti tra 4.5 e 7.5 mU/l. La funzione intramurale ed il tessuto miocardico sono stati studiati tramite densitometria acustica con tecniche IBS e CDMI. La tecnica IBS rappresenta un’evoluzione dell’analisi videodensitometrica, che permette una caratterizzazione più forte della contrattilità miocardica intrinseca e del tessuto (56). Il CDMI permette l’analisi della tensione regionale miocardica ed il ritmo di tensione (57,58). I vantaggi di queste metodiche sono l’indipendenza dalle condizioni di carico e, per la CDMI, l’indipendenza dal moto roto-traslazionale.
Nella presente serie di soggetti sHT, i risultati confermano ed estendono la riduzione della funzione miocardica sisto-diastolica già descritta (55,56). La presenza di un minore CVI indicante ridotta contrattilità intrinseca ed una maggiore riflettività ultrasonica ad alte frequenze suggerisce un’alterazione del tessuto miocardico. Il rilevamento in soggetti sHT di una minore tensione sistolica e ritmo di tensione in paragone ai controlli suggerisce un’alterazione della deformabilità locale. Gli indici di ecocardiografia convenzionale della funzione ventricolare sistolica sinistra, come la frazione di eiezione e l’accorciamento segmentario, sono parzialmente incapaci di differenziare il tessuto miocardico dei soggetti sani rispetto ai sHT, mentre i nuovi indici di funzionalità sistolica ultrasonici hanno un alto potere discriminante tra i due gruppi. Tra tutti i nuovi parametri ultrasonografici, il CVI a livello settale ha mostrato il più alto potere discriminante (86%) tra i gruppi, mentre al Doppler convenzionale il rapporto del flusso mitralico E/A ha mostrato un potere discriminatorio molto basso (33%) (comparazione tra i due metodi, P<0.001). In altro studio precedente condotto su pazienti sHT con approccio videodensitometrico, un CVI significativamente inferiore è stato riscontrato nei sHT rispetto ai controlli (53). Queste fini alterazioni miocardiche erano reversibili dopo terapia sostitutiva con LT4 (54). Le variazioni cicliche LT4 reversibili dell’amplitudine eco rispetto a normali indici funzionali carico-dipendenti, suggeriscono che i cambiamenti nell’amplitudine del CVI possono essere un precoce indice autonomo di contrattilità miocardica ostacolata (54-55). I dati presenti suggeriscono che la disfunzione miocardica nei sHT è anche associata con modificazioni sia delle proprietà acustiche (IBS), che della velocità del moto delle fibre miocardiche (CDMI). Molte componenti possono influenzare sia le proprietà acustiche che la velocità delle fibre miocardiche: il collagene; l’orientamento delle fibre muscolari ventricolari; il contenuto nei tessuti di acque ed albumina; la distribuzione del flusso vascolare
capillare (44,60). La disposizione micro strutturale di cellule miocardiche incastonate in una matrice collagenica può fornire un “salto” di impedenza acustica locale sufficiente a giustificare il discostamento dal miocardio normale (45, 59).
Il PWTD, come espressione di funzionalità globale longitudinale sinistra, è già stata usata per identificare anomalie miocardiche ventricolari sinistre nel sHT. In effetti, usando PWTD in soggetti sHT, Vitale e coll. (67) hanno riportato sia un impedimento della funzione ventricolare longitudinale globale che un’alterazione dei tempi di intervallo miocardici. Zoncu e coll. (68) hanno dimostrato cambiamenti sisto-diastolici in soggetti con alterazioni borderline ipotiroidee. Questo studio conferma la letteratura PWTDI pioneristica citata, ed estende in modo originale l’osservazione del coinvolgimento subclinico miocardico in uno stato di sHT se studiato con metodica di caratterizzazione tissutale ultrasonica (IBS) e con CDMI, che permette l’analisi della tensione locale longitudinale e del tasso di tensione. Precedenti studi di caratterizzazione tissutale tramite video densitometria hanno documentato una frazione collagenica ad ampio spettro di banda e di volume più alto – indicante aumentata fibrosi intramiocardica – solo negli ipotiroidei conclamanti, non nei sHT (70). Diminuzioni minime nell’attività ormonale a livello miocardico possono nel tempo condurre ad effetti funzionali e biochimici qualitativamente simili a quelli dell’ipotiroidismo conclamato, responsabile delle alterazioni funzionali miocardiche. Queste alterazioni precoci del tessuto e della funzione miocardica, rafforzano l’opinione che il sHT è fortemente associato al rischio di eventi cardiovascolari (45). Il ruolo dell’autoimmunità tiroidea nello sviluppo di eventi cardiovascolari è ancora discusso. Nel presente studio, non sono state riscontrate correlazioni tra autoanticorpi tiroidei e CVI septum (%) ed il rapporto E/A. Questi dati suggeriscono che le alterazioni cardiache osservate erano correlate all’ipotiroidismo in maniera indipendente da fenomeni di autoimmunità.
In conclusione, i dati presenti confermano ed estendono la precedente osservazione che entrambe le fasi del ciclo cardiaco sono precocemente e contemporaneamente coinvolte nel sHT, causando decremento della contrattilità intramiocardica e ostacolazione di entrambe le fasi attiva e passiva della diastole. L’applicazione di nuove tecniche sensibili e non invasive, maggiormente indipendenti dal carico e dal moto roto-traslazionale, come il CDMI e l’IBS, ha permesso di rilevare fini alterazioni funzionali e tissutali del miocardio intramurale, parzialmente non riscontrabili tramite ecocardiografia Doppler convenzionale 2D. In effetti, l’alta sensibilità dei nuovi indici ultrasonici intramiocardici della funzione ventricolare sinistra globale o distrettuale, in confronto con i parametri convenzionali ecografici può contribuire a spiegare i dati differenti presenti in letteratura riguardo le conseguenze cardiache nei soggetti sHT.
BIBLIOGRAFIA
1. Kocher T. Arteriosclerosis commonly occurred after thyroid extirpation. Arch Klin Chir
1883, 29:254-337.
2. Kahaly GJ, Dillmann WH. Thyroid hormone action in heart. Endoc.Rev 2005; 26:704-28. 3. DillmannWH. 2002 Cellular action of thyroid hormones in the heart. Thyroid 12:447-452. 4. Biondi B and Cooper DS The clinical significance of subclinical thyroid dysfunction 2007
Endocrine Review
5. Davis PJ, Davis FB. Nongenomic actions of thyroid hormone on the heart. Thyroid 2002;
12: 459-66.
6. Coulombe P, Dusault JH, Walker P. Plasma catecholamine concentrations in hyperthyroidism and hypothyroidism. Metabolism 1976, 25:973-979.
7. Stiles GL, Lefkowitz -adrenergic receptor interactions in RJ. Thyroid hormone modulation of agonist- the rat heart. Life Sci 1981; 28: 2: 2529-36.
8. Danzi S, Klein I. Thyroid hormone- regulated cardiac gene expression and cardiovascular disease. Thyroid. 2002 Jun;12(6):467-72.
9. Napoli R, Biondi B, Guardasole V, Matarazzo M, Pardo F, Angelini V, Fazio S, Saccà I. 2001 Impact of hyperthyroidism and its correction on vascular reactivity in humans. Circulation
104:3076-3080.
10. Lekakis J, Papamichael C, Alevizaki M, Piperingos G, Marafelia P, Mantzos J, Stamioatelopoulos S, Koutras DA 1997 Flow-mediated endothelium-dependent vasodilatation is impaired in subjects with hypothyroidism, borderline hypothyroidsm, and high –normal serum thyrotropin (TSH) values. Thyroid 7:411-414.
11. Taddei S, Caraccio N, Virdis A, Dardano A, Versari D, Ghiadoni L, Solvetti D, Ferranini E, Monzani F 2003 Impaired endothelium-dependent vasodilatation in subclinical hypothyroidism: beneficial effect of levothyroxine therapy. J Clin Endocrinol Metab 88:3731-3737.
12. Christ-Crain M, Morgenthaler NG, Meier C, Nussbaumer C, Bergmann A, Staub JJ, Muller B Pro-Atype and N-terminal pro-B-type natriuretic peptides in different thyroid function states.
2005 Swiss Med Wkly 135:549-554.
13. Zondek H. Das myxodemherz 1918 Munk Med Wschr 65:1180-1183
14. Bengel FM, Nekolla SG, Ibrahim T, Weniger C, Ziegler SI, Schwaiger M. Effects of thyroid hormones on cardiac function, geometry, and oxidative metabolism assessed noninvasively by positron emission tomography and magnetic resonance imaging. J Clin Endoc Metab 2000; 85:
16. Danzi S, Klein I Thyroid hormone and blood pressure regulation. 2003 Curr.Hypert.
513-520.
17. Canaris GJ, Manowitz NR, Mayor GM, Ridgway EC 2000 The Colorado thyroid disease prevalence study. Arch Intern Med 160:526-534.
18. Arem R, Rockey R, Kiefe C, Escalante DA, Rodriguez A 1996 cardiac systolic and diastolic function at rest and exercise in subclinical hypothyroidism: effect of thyroid hormone therapy. Thyroid 6:397-402.
19. Turhan S, Tulunay C, Ozduman Cin M, Gursoy A, Kilickap M, Dincer I, Candemir B, Gullu S, Erol C. Effects of LT4 therapy on right ventricular systolic and diastolic function in patients with subclinical hypothyroidism: a study by pulsed wave tissue Doppler imaging. J Clinical Endocrinol
Metab;2006 Sep;91(9):3490-3
20. Erkan G, Erkan AF, Cemri M, Karaahmetoglu S, Cesur M, Cengel A. The evaluation of diastolic dysfunction with tissue Doppler echocardiography in women with subclinical hypothyroidism and the effect of L-thyroxine treatment on diastolic dysfunction: a pilot study. J
Thyroid Res; 2011; 2011:654304.
21. Hak AE, Polse HAP, Visser TJ, Drexhage HA, Hofmann A, Witteman JC 2000 Subclinical hypothyroidism is an independent risk factor for atherosclerosis and myocardial infarction in elderly women: the Rotterdam study. Ann Intern Med 132:270-278.
22. Kahaly GJ 2000 Cardiovascular and atherogenic aspects of subclinical hypothyroidism.
Thyroid 10:665-679.
23. Duntas LH. Thyroid disease and lipids. Thyroid 2002; 12: 287-92.
24. Danese MD, Ladenson PW, Meinert CL, Powe NR. 2000. Cloinical Review 115: Effect of L-thyroxine therapy on serum lipoprotein in patients with mild thyroid failure: a quantitative review of the literature. J Clin Endocrinol Metab 85:2993-3001.
25. Wiseman SA, Powell JT, Humphries SE et al. 1993. The magnitudo of the hypercholesterolemia of hypothyroidism is associated with variation in the low density lipoprotein receptor gene. J Clin Endocrinol Metab. 77:108-112.
26. Diekman T, Demacker M, Wiersinga W. Increased oxidability of LDL in hypothyroidism. 1998, J Clin Endocrinol Metab 83:1752-55.
27. Monzani F, Caraccio N, Kozakowa M, Dardano A, Vittone F, Virdis A, Taddei S, Palombo C, Ferranini E 2004 Effect of L-thyroxine replacement on lipid profile and intima-media thickness in subclinical hypothyroidism: a duble blind placebo-controlled study. J Clin Endocrinol Metab
28. Wang TJ, Gona P, Larson MG,Tofler GH, Levy D,Newton-Cheh C,Jacques, PF, Rifai N, Selhub J, Robins SJ, Benjamin EJ, D'Agostino RB, Vasan RS 2006 Multiple biomarkers for the prediction of first major cardiovascular events and death. N Engl J Med. 21;355(25):2631-9.
29. Imaizumi M, Akahoshi M, Ichimaru S, Nakashima E, Hida A, Soda M, Usa T, Ashizawa K, Yokoyama N, Maeda R, Nagataki S, Eguchi K 2004 Risk for ischemic heart disease and all-cause mortality in subclinical hypothyroidism. J Clin Endocrinol Metab 89:3365-3370.
30. Rodondi N, Newman AB, Vittinghoff E, de Rekeneire N, Satterfield S, Harris TB, Bauer DC 2005 Subclinical hypothyroidism and the risk of heart failure, other cardiovascular events, and death. Arch Intern Med 165:2460-2466.
31. Cappola A, Fried L, Arnold A, Danese M, Kuller L, Burke R, Ladenson P Thyroid status, cardiovascular risk and mortality in older adults. 2006 JAMA 295:1033-1041
32. Singh S, Duggal J, Molnar J, Maldonado F, Barsano C, Arora R 2007 Impact of subclinical disorders on coronary heart disease, cardiovascular and all-cause mortality: a meta-analysis. Int J
Cardiol.
33. Walsh J, Bremner AP,. Bulsara MK, O'Leary P, Leedman PJ, Feddema P, Michelangeli V. 2006 Subclinical thyroid dysfunction and blood pressure: a community-based study. Clin Endocrinol 65(4):486-91.
34. Andersen S, Pedersen KM, Bruun NH, Laurberg P 2002. Narrow individual variations in serum T(4) and T(3) in normal subjects: a clue to the understanding of subclinical thyroid disease. J
Clin Endocrinol Metab 87:1068-1072.
35. Ladenson PW, Levin AA, Ridgway EC, Daniels GH. Complications of surgery in hypothyroid patients. Am J Med 1984; 77:261-6.
36. Sherman SI, Ladenson PW. Percutaneous transluminal angioplasty in hypothyroidis. Am J
Med 1991; 90: 367-70.
37. Surks MI, Ortiz E, Daniels GH, Sawin CT, Col NF, Cobin RH, Franklyn JA, Hershman JM, Burman KD, Denke MA, Gorman C, Cooper RS, Weissman NJ 2004 Subclinical thyroid disease: scientific review and guidelines for diagnosis and management. JAMA 291:228-238.
38. Gharib H, Tuttle RM, Baskin HJ, Fish LH, Singer PA, McDermott MT 2005 American Association of Clinical Endocrinologists; American Thyroid Association; The Endocrine Society Consensus Statement #1: Subclinical thyroid dysfunction: a joint statement on management from the American Association of Clinical Endocrinologists, the American Thyroid Association, and The Endocrine Society. J Clin Endocrinol Metab 90:581-585.
40. Evered DC, Ormston EJ, Smith PA, Hall R, Bird T. Grades of hypothyroidism. Br J Med
1973 1 657-662.
41. Surks MI, Ortiz E, Daniels GH, Sawin CT, Col NF, Cobin RH, Franklyn JA, Burman KD, Denke MA, Cooper RS, Weissman NJ. Subclinical thyroid disease. Scientific review and guidelines for diagnosis and management. JAMA 2004 291 228-238.
42. Tumbridge WMG, Evered DC, Hall R, Appleton D, Brewis M, Clark F, Grimley Evans J, Young E, Bird T. The spectrum of thyroid disease in a community: the Whickham survey. Clin
Endocrinol (Oxf) 1977 7 481-493.
43. Sawin CT, Chopra D, Azizi F, Mannix JE, Bacharach P. The aging thyroid. Increase prevalence of elevate serum thyrotropin levels in the elderly. JAMA 1979 242 247-250.
44. Canaris GJ, Manowitz NR, Mayor G, Ridgeway EC. The Colorado thyroid disease prevalence study. Arch Intern Med 2000 160 526-534.
45. Kahaly GJ, Dillmann WH. Thyroid hormone action in the heart. Endocr Rev 2005 26
704-728.
46. Toft AD, Boon NA. Thyroid disease and the heart. Heart 2000 84 455-460.
47. Klein J, Ojamaa K. Thyroid hormone and the cardiovascular system. N Eng J Med 2001 344
501-509.
48. Sahin I, Turan N, Kosar F, Tascapan C, Gunen H. Evaluation of autonomic activity in patients with subclinical hypothyroidism. J Endocrinol Invest 2005 28 209-13.
49. Forfar JC, Walhen CG, Todd TA, Bell GM, Hannan WJ, Muir AL, Toft AD. Left ventricular performance in subclinical hypothyroidism. Q J Med 1985 224 857-865.
50. Ridgway EC, Ladenson PW, Cooper DS, Daniels GH, Francis GS, Maloof F. Cardiac function in mild and severe hypothyroidism. Life Sci 1982 30 651-658.
51. Biondi B, Palmieri EA, Lombardi G, Fazio S. Effects of subclinical thyroid dysfunction on the heart. Ann Inter Med 2002 137 904-914.
52. Fazio S, Palmieri EA, Lombardi G, Biondi B. Effects of thyroid hormone on the cardiovascular system. Rec Prog Horm Res 2004 59 31-50.
53. Perk M, O’Neill BJ. The effects of thyroid hormone therapy on angiographic coronary artery disease progression. Can J Cardiol 1997 13 273-276.
54. Di Bello V, Monzani F, Giorgi D, Bertini A, Caraccio N, Valenti G, Talini E, Paterni M, Ferranini E, Giusti C. Ultrasonic myocardial textural analysis in subclinical hypothyroidism. J Am
55. Monzani F, Di Bello V, Caraccio N, Bertini A, Giorgi D, Giusti C, Ferranini E. Effect of levothyroxine on cardiac function and structure in subclinical hypothyroidism: a double blind, placebo-controlled study. J Clin Endocrinol Metab 2001 86 1110-1115.
56. Holland MR, Wallace KD, Miller JG. Potential relationships among myocardial stiffness, the measured level of myocardial backscatter (“image brightness”) and the magnitude of the systematic variation of backscatter (cyclic variation) over the heart cycle. J Am Soc Echocardiogr
2004 17 1131-1137.
57. Edvardsen T, Gerber BL, Garot J, Bluemke DA, Lima JAO, Smiseth OA. Quantitative assessment of intrinsic regional myocardial deformation by Doppler strain rate echocardiography in humans. Circulation 2002 106 50-56.
58. Sutherland GR, Di Salvo G, Claus P, D’hooge J, Bijnens B. Strain and strain rate imaging: a new clinical approach to quantifying regional myocardial function. J Am Soc Echocardiogr 2004 17
788-802.
59. Di Bello V, Giorgi D, Talini E, Dell'Omo G, Palagi C, Romano MF, Pedrinelli R, Mariani M. Incremental value of ultrasonic tissue characterization (backscatter) in evaluation of left ventricular myocardial structure and mechanics in essential arterial hypertension. Circulation 2003
107 74-80.
60. Di Bello V, Giorgi D, Viacava P, Talini E, Nardi C, Palagi C, Delle Donne MG, Verunelli F, Mariani MA, Grandjean J, Dell'Anna R, Di Cori A, Zucchelli G, Romano MF, Mariani M. Severe aortic stenosis and myocardial function: diagnostic and prognostic usefulness of ultrasonic integrated backscatter analysis. Circulation 2004 110 849-855.
61. Bogazzi F, Di Bello V, Palagi C, Delle Donne MG, Di Cori A, Gavioli S, Talini E, Cosci C, Sardella C, Brogioni S, Mariani M, Martino E. Improvement of intrinsic myocardial contractility and cardiac fibrosis degree in acromegalic patients treated with somatostatin analogues: a prospective study. Clin Endocrinol (Oxf) 2005 62 590-596.
62. Oki T, Tabata T, Yamada H, Wakatsuki T, Mishiro Y, Abe M, Onose Y, Iuchi A, Fukuda N, Ito S. Left ventricular diastolic properties of hypertensive patients measured by pulsed Tissue Doppler Imaging. J Am Soc Echocardiogr 1998 11 1106-1112.
63. Di Bello V, Giorgi D, Pedrinelli R, Talini E, Palagi C, Delle Donne MG, Zucchelli G, Dell'Omo G, Di Cori A, Dell'Anna R, Caravelli P, Mariani M. Left ventricular hypertrophy and its regression in essential arterial hypertension: a Tissue Doppler Imaging study. Am J Hypertens 2004
17 882-890.
65. Arem K, Rokey R, Kiefe C, Escalante DA, Rodriguez A. Cardiac systolic and diastolic function at rest and exercise in subclinical hypothyroidism: effect of thyroid hormone therapy.
Thyroid 1996 6: 397-402.
66. Biondi B, Fazio S, Palmieri EA, Carella C, Panza N, Cittadini A, Bonè F, Lombardi G, Saccà L. Left ventricular diastolic dysfunction in patients with subclinical hypothyroidism. J Clin
Endocrinol Metab 1999 84 2064-2067.
67. Vitale G, Galderisi M, Lupoli GA, Celentano A, Pietropaolo I, Parenti N, de Vitis O, Lupoli G. Left ventricular myocardial impairment in subclinical hypothyroidism assessed by a new ultrasound tool: pulsed tissue doppler. J Clin Endocrinol Metab 2002 87 4350-4355.
68. Zoncu S, Pigliaru F, Puzzu C, Pisano L, Vargiu S, Deidda M, Mariotti S, Mercuro G. Cardiac function in borderline hypothyroidism: a study by pulsed wave tissue Doppler imaging. Eur
J Endocrinol 2005 152: 527-533.
69. Brenta G, Mutti LA, Schnitman M, Fretes O, Perrone A, Matute ML. Assessment of left ventricular diastolic dysfunction by radionuclide ventriculography at rest and exercise in subclinical hypothyroidism, and its response to L-thyroxine therapy. Am J Cardiol 2003 91 1327-1330.
70. Ciulla M, Paliotti R, Tortora R, Valentini P, Cortelazzi B, Beck-Peccoz P Myocardial ultrasonic reflectivity in patients with thyroid dysfunction: a tissue characterization study.