Alla mia famiglia
e
al Nencio:
“Insieme la vita lo sai bene, ti viene come viene, ma brucia nelle vene, e
viverla insieme, è un brivido, una cura, serenità e paura, coraggio ed
avventura da vivere insieme a te”
INDICE RIASSUNTO 1 INTRODUZIONE 1 1.1 CHINOLONI E FLUOROCHINOLONI 1 1.1.1 Caratteristiche chimiche 1 1.1.2 Relazioni struttura-attività 3
1.1.3 Classificazione ed evoluzione dei fluorochinoloni 4
1.1.4 Enrofloxacina e ciprofloxacina 5 1.1.5 Meccanismo d’azione 5 1.1.6 Spettro d’azione 7 1.1.7 Resistenza 8 1.1.8 Effetti tossici 10 1.1.9 Farmacocinetica 11 1.1.10 Farmacodinamica 12 1.1.11 Uso clinico 13 1.1.12 Tempi di sospensione e LMR 14
1.2 TARTARUGHE TRACHEMIS SCRIPTA SCRIPTA:
CARATTERISTICHE E TRATTAMENTO IN LABORATORIO 15
1.2.1 Ruolo delle tartarughe Trachemis Scripta Scripta
nell’ecosistema 17
2 SCOPO DELLA TESI 18
3 MATERIALI E METODI 19
3.1 Trattamento animale 19
3.2 Prodotti chimici e reagenti 20
3.3 Soluzioni standard e rette di taratura 20
3.4 Fase sperimentale 22
3.5 Preparazione dei campioni ed estrazione 23 3.6 Sistema High Performance Liquid Chromatography (HPLC) 25
3.7 Validazione del metodo 26 3.8 Parametri farmacocinetici 29 4 RISULTATI 32 5 DISCUSSIONE 45 6 CONCLUSIONI 57 7 BIBLIOGRAFIA 58
INDEX
ABSTRACT
1 INTRODUCTION 1
1.1 QUINOLONES AND FLUOROQUINOLONES 1
1.1.1 Chemical features 1
1.1.2 Structure-activity relationship 3 1.1.3 Classification and evolution of fluoroquinolones 4
1.1.4 Enrofloxacin and ciprofloxacin 5
1.1.5 Mechanism of action 5 1.1.6 Range of action 7 1.1.7 Resistance 8 1.1.8 Toxic effects 10 1.1.9 Pharmacokinetics 11 1.1.10 Pharmacodynamics 12 1.1.11 Clinical use 13
1.1.12 Withdrawal periods and MRLs 14
1.2 TURTLE TRACHEMIS SCRIPTA SCRIPTA: FEATURES AND
ANIMAL HANDLING 15
1.2.1 Role of the turtle Trachemis Scripta Scripta ecosystem 17
2 AIM OF THE THESIS 18
3 MATERIALS AND METHODS 19
3.1 Animal housing 19
3.2 Chemicals and reagents 20
3.3 Standard solutions and calibration curves 20
3.4 Animal treatment and blood collection 22
3.5 Sample preparation and extraction 23
3.7 Method’s validation 26 3.8 Pharmacokinetic parameters 29 4 RESULTS 32 5 DISCUSSION 45 6 CONCLUSION 57 7 REFERENCES 58
ELENCO DELLE ILLUSTRAZIONI
Figura 1 Struttura S-ofloxacina 2
Figura 2 Struttura generale dei chinoloni 3
Figura 3 Evoluzione strutturale ei chinoloni 4
Figura 4 Struttura enrofloxacina e ciprofloxacina 5
Figura 5 Interazione fluorochinoloni-DNA girasi 6
Figura 6 Interazione ciprofloxacina-DNA girasi 7
Figura 7 E.Coli prima e dopo trattamento con fluorochinoloni 8
Figura 8 Meccanismi di resistenza batterica agli antibiotici 9
Figura 9 Tartarughe Trachemis Scripta Scripta 16
Figura 10 Tartarughe durante la sperimentazione 19
Figura 11 Rette di taratura 21
Figura 12 Soluzione di enrofloxacina e campione di sangue 22
Figura 13 Prelievo di sangue dai seni venosi cervicali 23
Figura 14 Schema estrazione 24
Figura 15 Rappresentazione schematica di un sistema HPLC 25
Figura 16 Cromatogramma di una soluzione di ciprofloxacina,
enrofloxacina, sarafloxacina alla concentrazione 3,3 µg/mL 32
Figura 17 Cromatogramma di un campione di bianco 33
Figura 18 Cromatogramma di un campione di sangue trattato 34
Figura 19 Andamento ciprofloxacina ed enrofloxacina a tre tempi differenti 34
Figura 20 Curva concentrazione-tempo enrofloxacina e ciprofloxacina
Figura 21 Curva concentrazione-tempo enrofloxacina e ciprofloxacina
delle tartarughe n° 4, 5, 6 37
Figura 22 Curva concentrazione-tempo enrofloxacina e ciprofloxacina
delle tartarughe n° 7, 8, 9 38
Figura 23 Curva concentrazione-tempo enrofloxacina e ciprofloxacina
delle tartarughe n° 10, 11, 12 39
Figura 24 Curva concentrazione-tempo enrofloxacina e ciprofloxacina
delle tartarughe n° 13, 14 40
Figura 25 Curva concentrazione-tempo media di enrofloxacina e
ciprofloxacina 41
Tabella 1 Parametri farmacocinetici dell’enrofloxacina per ogni tartaruga 43
Tabella 2 Parametri farmacocinetici medi enrofloxacina 44
Tabella 3 Parametri farmacocinetici medi ciprofloxacina 44
RIASSUNTO
Parole chiave: Enrofloxacina, tartaruga, Trachemis Scripta Scripta, intramuscolare, farmacocinetica.
Le concentrazioni sanguigne e la farmacocinetica di enrofloxacina e del suo metabolita ciprofloxacina (fluorochinoloni, inibitori della DNA girasi) sono state determinate in 14 tartarughe Trachemis Scripta Scripta, dopo somministrazione intramuscolare alla dose 10 mg/kg di enrofloxacina. Il sangue è stato prelevato dai seni venosi della zona cervicale prima della somministrazione e a 0,5, 2, 4, 8, 12, 24, 48, 72, 96, 120, 144, 168 e 192 ore dopo la somministrazione. La concentrazione di enrofloxacina e ciprofloxacina è stata determinata usando una metodica FL-HPLC. La concentrazione massima media dell’enrofloxacina e della ciprofloxacina riscontrata nel sangue (C max) è stata rispettivamente 10,3 µg/mL e 0,3 µg/mL. Il tempo di emivita medio riscontrato è 47,6 ore per l’enrofloxacina e 37,4 ore per la ciprofloxacina, mentre il tempo durante il quale il farmaco permane nell’organismo è 56,6 ore per l’enrofloxacina e 59 ore per la ciprofloxacina. Questo studio ha dimostrato che tale dosaggio è ottimale nel trattamento di infezioni batteriche nelle tartarughe. La cinetica lunga nel tempo è vantaggiosa da un punto di vista terapeutico, mentre è da chiarire se essa può essere vantaggiosa nel caso in cui le tartarughe entrino a far parte della catena alimentare umana.
ABSTRACT
Key words: enrofloxacin, turtle, Trachemis Scripta Scripta, intramuscular, pharmacokinetics.
Blood concentrations of enrofloxacin and his active metabolite ciprofloxacin (fluoroquinolones that inhibit DNA gyrase), were determined in 14 turtles Trachemis Scripta Scripta, after intramuscular administration of enrofloxacin 10 mg/kg. The blood was collected from cervical sinus prior drug administration and at 0.5, 2, 4, 8, 12, 24, 48, 72, 96, 120, 144, 168, and 192 hours after administration. The concentrations of enrofloxacin and ciprofloxacin were detected by an FL-HPLC method. The mean peak’s concentration of enrofloxacin and ciprofloxacin (C max) is 10.3 µg/mL and 0,3 µg/mL respectively. The mean half-life was 47.6 h for enrofloxacin and 37.4 h for ciprofloxacin, while the mean residence time is 56.6 h for enrofloxacin and 59 h for ciprofloxacin. The present study demonstrated that this dosage is suitable for turtles affected by bacterial infections. If from one side the long-lasting kinetics profile of enrofloxacin is advantageous in therapy, on the other side it might be of concern if treated turtles are used as food producing animals
1
1.1 CHINOLONI E FLUOROCHINOLONI
I fluorochinoloni sono la classe di antibiotici di origine sintetica più usata in medicina veterinaria negli ultimi 15 anni. Ancora oggi vengono sviluppati molti studi per capire meglio il loro meccanismo d’azione, lo spettro antibatterico, la farmacocinetica e l’uso clinico in specie animali sempre più varie. I vantaggi di questi antibiotici sono la loro rapida azione battericida contro una vasta gamma di batteri clinicamente importanti, la potenza d’azione, una buona tolleranza e la possibile somministrazione per diverse vie, quali la via orale (compresse o tramite l’acqua da bere), sottocutanea, endovenosa, intramuscolare e topica. I fluorochinoloni approvati per la medicina veterinaria includono enrofloxacina, difloxacina, orbifloxacina e marbofloxacina. In particolare l’enrofloxacina è la molecola più usata nei bovini, nei suini e nel pollame, mentre il fluorochinolone più frequentemente usato sia per gli animali che per l’uomo è invece la ciprofloxacina (Papich, Riviere, 2009).
1.1.1 CARATTERISTICHE CHIMICHE
I fluorochinoloni appartengono ad una classe abbastanza insolubile in acqua. Tutti sono presenti come zwitterioni per la presenza contemporanea di un acido carbossilico e di un’ammina basica; i valori di pKa variano da 5,5-6,3 per l’acido carbossilico e 7,6-9,3 per il gruppo amminico. A pH acido entrambi i gruppi si trovano protonati, mentre a pH basico l’acido carbossilico è sotto forma di anione. Per questo i fluorochinoloni tendono ad essere più idrosolubili a pH acido e basico mentre a pH fisiologico presentano una minima idrosolubilità, abbassata ulteriormente dalla presenza di nuclei
2
aromatici. La misura della solubilità acquosa è importante per le formulazioni per via endovenosa. Nel caso in cui la solubilità sia veramente bassa, si ricorre alla strategia del profarmaco, chelando peptidi solubili alla molecola, che una volta immessi nella circolazione ematica si idrolizzano, rilasciando quindi il farmaco vero e proprio (Riley et al.,1989).
I fluorochinoloni hanno un elevato punto di fusione, generalmente maggiore di 200° C, quindi la forma cristallizzata è molto stabile (Brighty, Gootz, 2000).
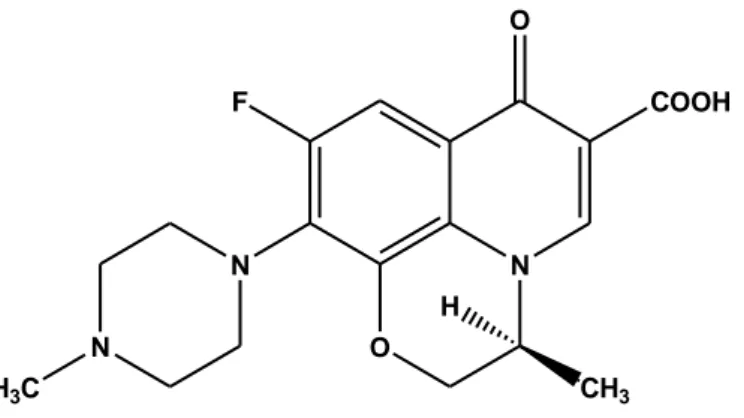
Per quanto riguarda la stereochimica, i primi fluorochinoloni, così come quelli più recenti, sono stati sviluppati come miscele racemiche. È stato comunque osservato che l’attività antibatterica di alcuni fluorochinoloni è fortemente influenzata dalla presenza di carboni chirali. Nella ofloxacina, per esempio (figura 1), che presenta uno stereocentro in posizione 1, lo stereoisomero S presenta maggior attività dello stereoisomero R (Hayakawa et al.,1986).
Figura 1 Struttura S ofloxacina
N O COOH F N N H3C O CH3 H
3
1.1.2 RELAZIONI STRUTTURA-ATTIVITA’
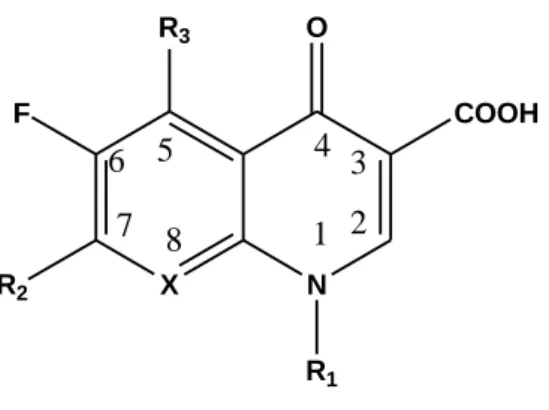
Figura 2 Struttura generale dei chinoloni
La figura 2 mostra la struttura generale dei chinoloni. Il gruppo carbossilico in posizione 3 e il chetone in posizione 4 sono essenziali per l’attività antibatterica. Il fluoro in posizione 6 differenzia i chinoloni dai fluorochinoloni, i quali mostrano spettro d’azione più ampio, maggiore potenza, maggiore capacità di ingresso nella cellula batterica. Anche sostituzioni sull’N in posizione 1 con un etile, ciclopropile, fluorofenile portano ad uno spettro d’azione più ampio. La sostituzione in posizione 7, con una piperazina, incrementa l’attività antibatterica contro lo Pseudomonas e tale attività aumenta ulteriormente se, oltre alla piperazina è presente un altro anello a 3 o 5 fuso a questa. In posizione 8 è preferibile la presenza di un carbonio, anziché di un azoto per limitare gli effetti collaterali a livello del sistema nervoso centrale e aumentare l’attività contro gli Stafilococchi, mentre sostituzioni con un gruppo metossilico o ciano in questa posizione aumenta l’attività contro batteri anaerobi (Papich, Riviere, 2009).
X N O COOH R3 F R2 R1 1 2 3 4 5 6 7 8
4
1.1.3 CLASSIFICAZIONE ED EVOLUZIONE DEI CHINOLONI
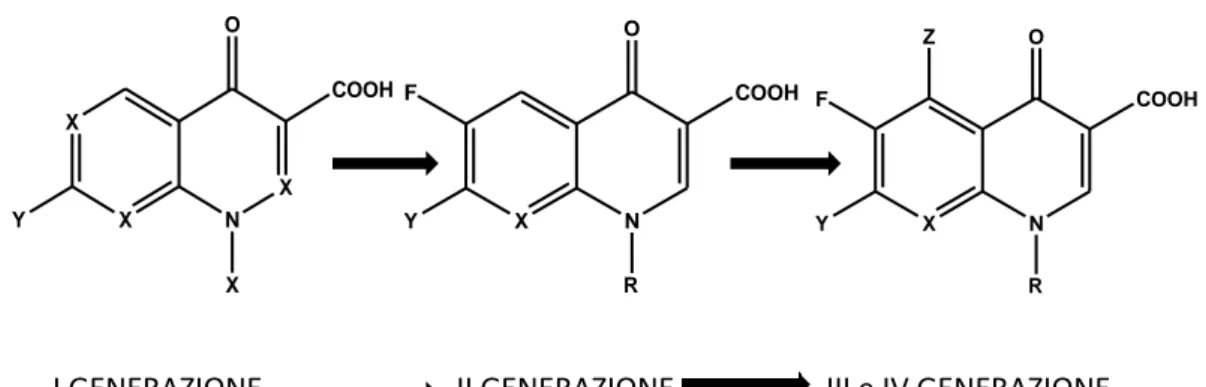
In base alla struttura chimica è possibile distinguere composti in varie generazioni come mostrato in figura 3:
I GENERAZIONE: il cui il capostipite è l’acido nalidixico, attivo solo contro i batteri gram – e usato esclusivamente per il trattamento delle infezioni delle vie urinarie.
II GENERAZIONE: ovvero i fluorochinoloni, caratterizzati dalla presenza del F in 6. L’esponente più importante di questa classe è la ciprofloxacina. Usati per infezioni a livello sistemico anche da gram +.
III e IV GENERAZIONE: usati per infezioni da Streptococco Piogenes e batteri anaerobi. Appartengono a questa generazione molecole approvate anche per l’utilizzo in medicina veterinaria come l’enrofloxacina.
I GENERAZIONE II GENERAZIONE III e IV GENERAZIONE
X X N X O COOH X Y X N O COOH Y F R X N O Z F Y R COOH
5
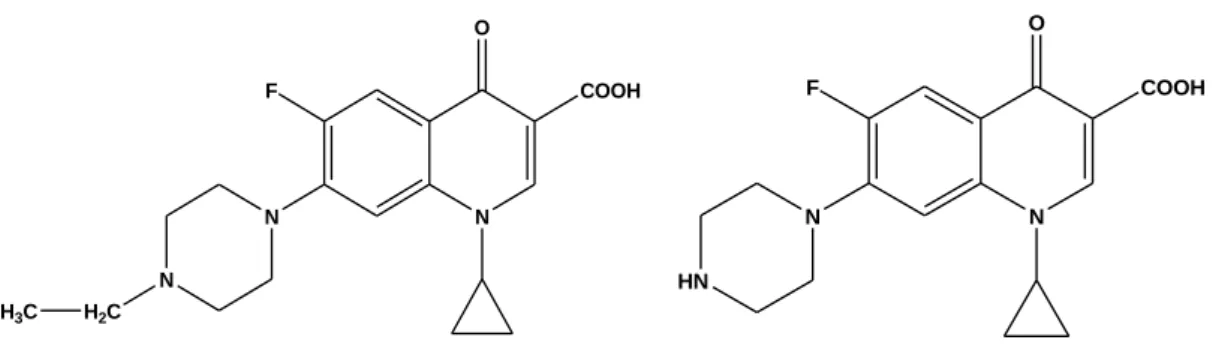
1.1.4 ENROFLOXACINA e CIPROFLOXACINA
Tra tutti i fluorochinoloni sono degni di nota le molecole enrofloxacina [1-cyclopropyl-7-(4-ethyl-1-piperazinyl)-6-fluoro-1,4-dihidro-4-oxo-3-quinoline carboxylic acid] e ciprofloxacina [1-cyclopropyl-6-fluoro-1,4-dihidro-4-oxo-7-(1-piperazinyl)-3-quinoline carboxylic acid]. La prima è impiegata nei bovini, suini, pollame, pesci, cani e gatti (Choma et al., 2004). La seconda è usata sia negli animali che nell’uomo e deriva dalla reazione di deetilazione dell’enrofloxacina. Entrambe sono gli antibiotici più popolari e più usati sia nella medicina veterinaria che nella medicina umana (Choma et al., 2004).
Figura 4 Struttura enrofloxacina (a sinistra) e ciprofloxacina (a destra)
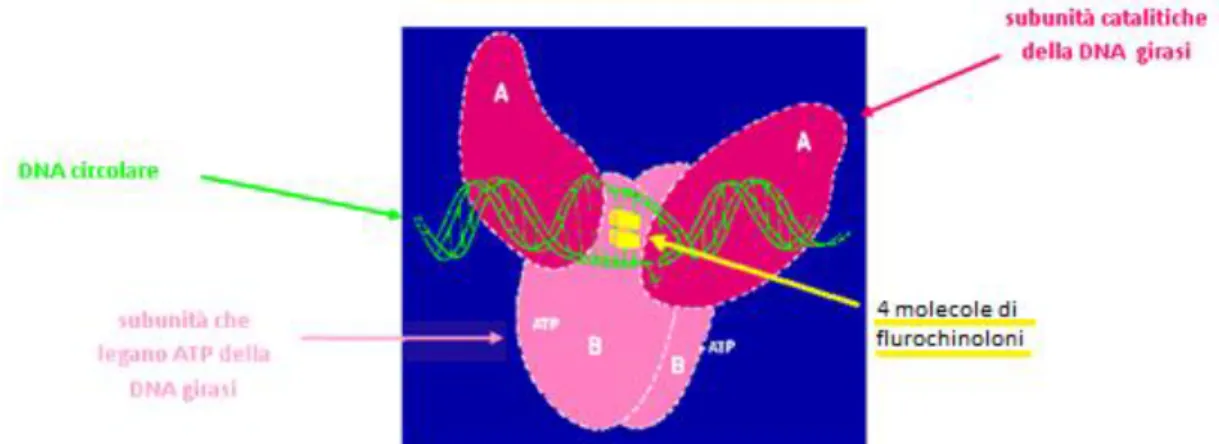
1.1.5 MECCANISMO D’AZIONE
I fluorochinoloni sono battericidi in quanto inibiscono la replicazione e la trascrizione del DNA batterico, portando il microrganismo alla morte. Il doppio filamento nella cellula è strettamente avvolto e deve essere separato per la trascrizione e la traduzione. Per facilitare l’avvolgimento e lo svolgimento dei filamenti, l’enzima batterico DNA girasi aiuta i filamenti a separarsi e successivamente a riconnettersi impedendo superavvolgimenti
N O COOH F N HN N O COOH F N N H2C H3C
6
negativi, quindi catalizza gli eventi responsabili della compattazione del doppio filamento del DNA batterico. È un enzima che fa parte della classe delle topoisomerasi ed è composto da 2 subunità: A e B. L’azione dei fluorochinoloni si basa principalmente sull’inibizione della subunità A, ma questi farmaci hanno anche leggera attività inibitoria nei confronti della subunità B come mostrato nelle figure 5 e 6. Le cellule umane sono resistenti ai fluorochinoloni, poiché la topoisomerasi II nei mammiferi non viene inibita, finché la concentrazione di farmaco non raggiunge 100-1000 µg/mL, mentre i batteri sono inibiti a concentrazioni molto più basse (0,1-10 µg/mL). Un altro target dei fluorochinoloni è la topoisomerasi IV, enzima composto dalle subunità parC e parE. Questo sito di azione è meno importante per i gram - , mentre è un bersaglio significativo nei gram + come Streptococchi e Stafilococchi (Papich, Riviere, 2009).
7
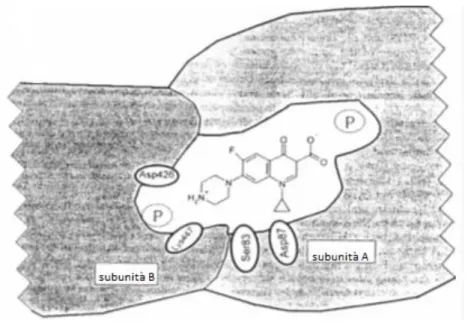
Figura 6 Interazione ciprofloxacina e DNA girasi, in particolare le molecole di farmaco attraverso il sostituente R7 formano legami a idrogeno con i residui Asp426 e Lys447 della subunità B e attraverso il sostituente R1
interagisce con i residui amminoacidici della subunità A.
1.1.6 SPETTRO D’AZIONE
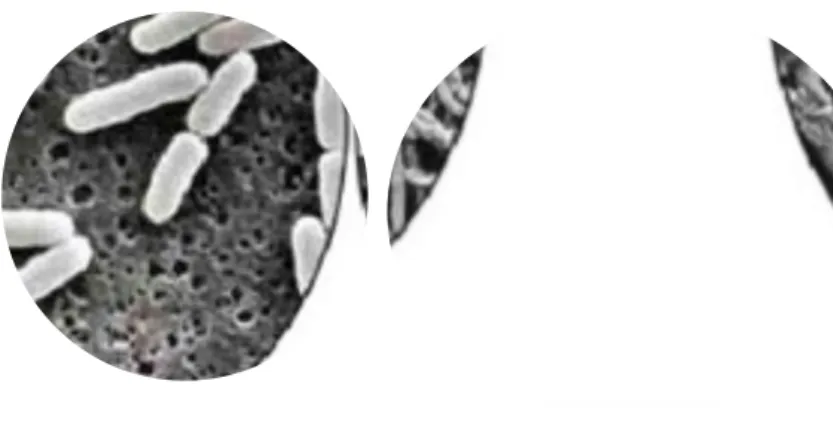
In generale i fluorochinoloni agiscono contro i batteri gram +, gram -, specialmente gli Enterobatteri (figura 7). Infatti questo è dimostrato dai valori di Minima Concentrazione Inibitoria, (MIC), riportati da Rubin et al. (2008). Per gli Escherichia coli l’enrofloxacina e la ciprofloxacina hanno valori di MIC molto bassi, rispettivamente 0,03 e 0,06 µg/mL, quindi questi batteri sono altamente suscettibili al farmaco. Tra tutti i gram- fa eccezione lo Pseudomonas aeruginosa, che ha valori di MIC più alti (0,5-2,0 µg/mL) e contro di esso, solo la ciprofloxacina risulta efficace. Tra i gram +, tutte le specie di Stafilococco sono suscettibili ai fluorochinoloni, tuttavia i valori di MIC per questi batteri sono più alte rispetto ai gram – perché sono specie batteriche più resistenti. Infatti la resistenza degli Stafilococchi ai fluorochinoloni è un problema per i pazienti trattati. Le nuove generazioni di
8
fluorochinoloni, presentano una spiccata attività anche contro i batteri anaerobi, ma nei confronti dello Pseudomonas non risultano tanto attivi quanto la ciprofloxacina (Behra-Miellet et al., 2002). Queste molecole ad oggi sono impiegate per sostituire i classici trattamenti con gli antibiotici beta-lattamici, tuttavia anche la loro attività può diminuire, poiché ci sono fattori che possono ostacolarne l’azione. Cationi come Al³⁺, Mg²⁺, Fe³⁺ e Ca²⁺ possono legare il gruppo carbossilico che, non trovandosi più in forma anionica non risulta più attivo. Un altro fattore che può diminuire l’attività è il pH acido nel sito di infezione, che può far aumentare la MIC, soprattutto a livello delle urine, e quindi il farmaco può diminuire la sua attività (Fernandes, 1988; Ross, Riley, 1994).
Figura 7 Escherichia coli prima (sinistra) e dopo (destra) il trattamento con fluorochinoloni
1.1.7 RESISTENZA
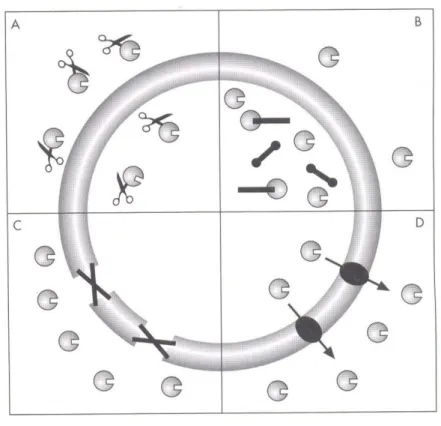
Nel corso degli anni i batteri hanno elaborato sistemi sempre più complicati per “sfuggire” all’azione degli antibiotici (figura 8); il più comune è
9
rappresentato dalla sintesi di enzimi in grado di inattivare il farmaco (figura 8 A).
Figura 8 Esempi di meccanismi di resistenza batterica agli antibiotici: A) sintesi di enzimi in grado di inattivare l’antibiotico; B) modificazione dei bersagli molecolari; C) e D) modificazione della permeabilità cellulare.
Altri meccanismi sono rappresentati da:
modificazione della permeabilità, sia impedendo l’ingresso dell’antibiotico (figura 8 C), sia facilitandone l’espulsione (figura 8 D); modificazione della struttura bersaglio (Figura 8 B); over-espressione della struttura bersaglio.
Non è facile valutare per quanto tempo perduri la resistenza ad un antibiotico, perché si tratta di un fenomeno basato su complessi meccanismi genetici. Generalmente, l’effetto insorge molto velocemente mentre la remissione richiede tempi più lunghi. Fra i fattori che possono favorire la comparsa della resistenza ci sono: le caratteristiche farmacocinetiche degli antibiotici, errori di posologia (dosi troppo basse, durata del trattamento non
10
sufficiente o troppo lunga), la concentrazione nel sito d’azione e la via di escrezione del farmaco. Un altro importante fattore è che la maggior parte degli antibiotici impiegati in Medicina Veterinaria presenta caratteristiche strutturali del tutto simili a quelli utilizzati in Medicina Umana e di conseguenza è concepibile che possano insorgere resistenze crociate tra principi attivi impiegati nell’uomo o negli animali (Badino, Odore, 2009). La resistenza più frequentemente sviluppata per i fluorochinoloni si basa sulla modificazione della struttura bersaglio. In particolare, mutazioni del gene gyrA, che codifica per la subunità A della DNA girasi, porta alla trascrizione di una subunità diversa che non viene più riconosciuta dal fluorochinolone. Un’altra forma di resistenza riguarda la mutazione del gene che codifica per la subunità parC della topoisomerasi IV, ma è una forma di resistenza che riguarda maggiormente i batteri gram + (Ferrero et al., 1995). Un meccanismo di resistenza differente è stato trovato invece per lo Pseudomonas. Esso è in grado di resistere ai fluorochinoloni grazie ad un meccanismo di espulsione del farmaco all’esterno della cellula. Inoltre, poiché questo meccanismo riguarda altri farmaci, è possibile instaurare una resistenza crociata con altri antibiotici. Questo spiega il motivo per il quale lo
Pseudomonas aeruginosa è più resistente di tutti gli altri batteri gram – nei
confronti degli antibiotici (Zhanel et al., 2004).
1.1.8 EFFETTI TOSSICI
Negli animali i più frequenti effetti collaterali sono rappresentati da disturbi gastrointestinali (vomito, diarrea), reazioni allergiche,
11
fotosensibilizzazione ed erosioni a livello articolare nei soggetti in accrescimento. Alcuni fluorochinoloni si comportano anche come inibitori enzimatici, in particolare del citocromo P450, quindi possono alterare la cinetica di eventuali farmaci somministrati in associazione e metabolizzati per tale via (Odore, Badino, 2009).
1.1.9 FARMACOCINETICA
ASSORBIMENTO: i fluorochinoloni vengono completamente e rapidamente assorbiti sia in seguito alla somministrazione per via orale, via intramuscolare e sottocutanea. Fattori che possono rallentare l’assorbimento sono: l’assunzione di cibo per quanto riguarda la via orale, e la possibilità di legame con le proteine tessutali per quanto riguarda la via intramuscolare.
DISTRIBUZIONE: i fluorochinoloni di II, III, IV generazione hanno un elevato volume di distribuzione. Le concentrazioni più elevate si ritrovano nel fegato e nel rene, comunque possono raggiungere anche concentrazioni maggiori della concentrazione nel plasma anche nei macrofagi e neutrofili. L’elevata concentrazione intracellulare è dovuta al fatto che i fluorochinoloni sono altamente lipofili, oltrepassano facilmente le membrane e non sono facilmente espulsi all’esterno. Inoltre la capacità di concentrarsi maggiormente nei leucociti, permette loro di essere trasportati fino al sito di infezione, per cui agiscono maggiormente sui tessuti infettati piuttosto che quelli sani (Papich, Riviere, 2009).
12
METABOLISMO: prevalentemente di fase I, in particolare idrossilazioni che possono portare a metaboliti farmacologicamente attivi e di fase II, con formazione di metaboliti più idrosolubili e più facilmente eliminabili.
ESCREZIONE: la principale via di eliminazione è quella renale. Avendo un carattere parzialmente acido vengono eliminati per secrezione tubulare attiva, raggiungendo concentrazioni urinarie superiori a quelle sieriche. Vengono riassorbite in percentuale maggiore nelle specie o categorie che hanno urine acide, mentre negli erbivori l’alcalinità delle urine condiziona un’eliminazione più rapida. I fluorochinoloni e i loro metaboliti possono anche essere eliminati tramite la via biliare (Odore, Badino, 2009).
1.1.10 FARMACODINAMICA
I fluorochinoloni hanno un’azione battericida concentrazione dipendente, piuttosto che tempo dipendente, cioè la loro azione aumenta all’aumentare della concentrazione, piuttosto che del tempo di esposizione (contatto) con i batteri. Il parametro usato per misurare il contatto con i batteri è descritto dal rapporto Cmax/MIC, mentre il parametro per valutare l’effetto terapeutico è il rapporto AUC/MIC. Quando questi parametri sono bassi, i ceppi batterici mutati manifestano resistenza, poiché generalmente la specie mutata presenta valori di MIC dalle 4 alle 8 volte maggiore della MIC della specie wild type (Papich, Riviere, 2009).
13
1.1.11 USO CLINICO
MAMMIFERI: l’enrofloxacina è il fluorochinolone più frequentemente usato,
impiegato per il trattamento delle infezioni delle vie urinarie, della pelle, dei tessuti molli, delle ossa e della cavità orale (Ihrke, 1996). Le specie mammifere trattate sono cani, gatti, conigli, ratti. Il farmaco in questi animali risulta molto vantaggioso perché è totalmente assorbito per via orale (Gobel 1999), tuttavia le dosi consigliate vanno da 2,5-5,0 mg/kg a 10-20 mg/kg per via intramuscolare, sottocutanea o orale (Papich, Riviere, 2009).
UCCELLI: i fluorochinoloni sono usati per trattare sia i “pet-birds” che le
specie esotiche tenute in cattività negli zoo, mentre negli Stati Uniti questi farmaci sono proibiti per il pollame. La somministrazione si effettua per via orale (tramite acqua da bere o gavaggio) o via iniettabile, soprattutto per le infezioni da Chlamydia Psittaci, gram - che nei volatili provoca epatotossicità e danni vascolari. L’enrofloxacina in queste specie riesce a diminuire i sintomi clinici, ma non rimuove completamente l’infezione. Inoltre viene somministrata a dosaggi maggiori rispetto ai mammiferi, poiché sia la clearance che il metabolismo in queste specie sono più rapidi (Flammer, 1998).
PESCI: l’enrofloxacina è somministrata per via orale nelle trote, mentre nei
salmoni può essere somministrata anche per via intraperitoneale o intramuscolare. Nonostante l’assorbimento orale sia inferiore rispetto ai mammiferi, il farmaco raggiunge bene la concentrazione efficace nel plasma (Bowser et al., 1992). Inoltre, data la clearance rapida, la dose consigliata per avere un buon effetto antibatterico va da 2,5-5,0 mg/kg ogni 12 ore (Gore et al. 2005).
14
1.1.12 TEMPI DI SOSPENSIONE e LMR
Il D.L. n. 119 del 27/12/1992 che ha sancito la nascita del farmaco veterinario, attraverso alcuni aggiornamenti, fissa per alcuni medicamenti ad uso veterinario il limite massimo residuale (LMR), cioè la massima concentrazione di residui di un determinato farmaco e/o dei suoi metaboliti ammessa in un dato tessuto animale, nel latte, nelle uova e nel miele. Le industrie farmaceutiche devono stabilire i tempi di sospensione adeguati per ogni molecola farmacologica ad uso veterinario in modo che dal momento in cui l’alimento di origine animale perviene al consumatore contenga residui di concentrazione non superiori agli LMR consentiti. Questo garantisce la salute del consumatore e assicura la circolazione di alimenti di origine animale nei Paesi comunitari. Inoltre in questi ultimi anni ciascun Paese della Comunità Europea, in osservanza alla direttiva CEE 86/469, ha elaborato un piano di ricerca dei residui che stabilisce: la natura dei residui da ricercare, il numero di campioni da esaminare, le modalità di prelievo del campione, i tessuti e/o fluidi biologici sui quali eseguire le analisi in rapporto ai vari tipi di residui , le metodiche analitiche da utilizzare nei laboratori ufficiali preposti all’esecuzione delle analisi.
I tempi di sospensione dei fluorochinoloni variano a seconda della preparazione farmaceutica, della specie animale e del genere alimentare considerato. Per l’enrofloxacina il tempo di sospensione per le carni varia da 3 giorni nel pollo e nel tacchino in seguito a somministrazione per via orale, a 14 giorni nel bovino in seguito ad inoculazione per via sottocutanea. Tuttavia esistono anche Limiti Massimi Residuali per la flumechina, l’acido ossolinico, l’enrofloxacina, la danofloxacina, la marbofloxacina, la sarafloxacina nella
15
carne, nei visceri e nel latte di diverse specie animali. Non esistono invece LMR relativamente alle uova. Per l’enrofloxacina il residuo marcatore è rappresentato dalla somma delle concentrazioni di enrofloxacina e del metabolita N-deetilato ciprofloxacina (Odore, Badino, 2009).
1.2 TARTARUGHE TRACHEMIS SCRIPTA SCRIPTA: CARATTERISTICHE E TRATTAMENTO IN LABORATORIO.
Le tartarughe Trachemis Scripta Scripta, dette anche tartarughe dalla pancia gialla (figura 9) appartengono alla famiglia Emydidae, ordine Chelonia, classe Rettilia, sono specie acquatiche, caratterizzate dall’avere pelle più sottile delle tartarughe terrestri e ricoperta da molte squame. La parte superiore del guscio (corazza) è costituita da 50 ossa piuttosto appiattite, mentre la parte ventrale (plastron) è più sottile della dorsale. Hanno arti adattati all’habitat in cui vivono, quindi zampe pinnate per agevolare il nuoto. La cassa toracica e la colonna vertebrale sono attaccate al guscio, così come tutti gli organi. Da un punto di vista anatomico e fisiologico, i loro sistemi visivo e uditivo hanno caratteristiche molto simili agli uccelli. Inoltre il sistema respiratorio ha meccanismi fisiologici da permetterli lunghi periodi di apnea. In allevamento le Trachemis Scripta Scripta vivono ad una temperatura di 25-35°C in acqua mantenuta sempre pulita da sistemi di filtrazione, poiché cibo non mangiato e feci possono essere fonte di microrganismi patogeni. Per quanto riguarda la dieta sono onnivore, per cui si cibano di piccoli pesci, alghe, vermi, crostacei. Per le tartarughe in cattività l’alimentazione è sufficiente 2-3 volte alla settimana perché sono
16
caratterizzate da un metabolismo molto lento e influenzato dalla temperatura corporea (minore è la temperatura corporea, più rallentato è il metabolismo).
Data la grande diffusione di queste tartarughe, è aumentato il numero di studi che possono essere condotti su questa specie, in particolare studi che prevedono il prelievo del sangue. Nelle tartarughe il sangue può essere raccolto dalla vena giugulare, dalla zampa o dai seni venosi della zona occipitale della testa. L’iniezione della vena giugulare è condotta facilmente se la testa della tartaruga è trattenuta in una posizione estesa all’esterno del carapace. Se la zona cervicale risulta difficoltosa, il prelievo è effettuato dalla zampa anteriore. Successivamente il sangue è raccolto in provette eparinizzate, poiché l’EDTA può causare lisi degli eritrociti (Mautino, Douglas, 1993).
17
1.2.1 RUOLO DELLE TARTARUGHE TRACHEMIS SCRIPTA SCRIPTA NELL’ECOSISTEMA
Nonostante sia diffusa in tutto il mondo, la Trachemis Scripta Scripta è originaria del sud degli Stati Uniti (Virginia e Florida). Nella cultura occidentale queste tartarughe, così come tutte le specie acquatiche (marine o palustri), sono specie protette, poiché il loro ruolo fondamentale è quello di essere considerate “pet animal”, ovvero animali da compagnia. Entrando sempre più a contatto con l’uomo, il trattamento con antibiotici per queste specie è richiesto per due motivi:
1) Mantenere la salute dell’animale
2) Evitare che tali animali siano fonte di batteri patogeni per l’uomo
Nella cultura orientale, invece la Trachemis Scripta Scripta è entrata a far parte della derrata alimentare, quindi nel caso che venga consumata una tartaruga trattata è fondamentale conoscere i tempi di sospensione e i valori di LMR, affinché il farmaco non abbia alcun effetto sull’organismo umano (Ertl, Winston, 1997).
18
L’obiettivo di questa sperimentazione è studiare la farmacocinetica dell’enrofloxacina e del suo metabolita primario ciprofloxacina in seguito ad una somministrazione di enrofloxacina per via intramuscolare nelle
19
3.1 TRATTAMENTO ANIMALE
In questo studio sono state usate 14 tartarughe della specie Trachemis Scripta Scripta, di sesso indeterminato, peso compreso tra 0,25 e 1,65 kg, provenienti dallo zoo di Aprilia (Roma). Le tartarughe sono state numerate con nastro adesivo posizionato sulla corazza per un riconoscimento veloce e marcate con pennarello sul piastrone (figura 10). Le tartarughe sono state determinate in buono stato di salute da osservazioni veterinarie generali e da analisi biochimico cliniche di base. Gli animali sono stati divisi in 3 gruppi in maniera random e collocati in 3 vasche interne, con uno strato d’acqua di 25 cm riscaldata, mantenuta tra i 25° C e i 30° C da termostati e tappeti riscaldanti. L’alimentazione è stata a base di pellet specifico per tartarughe (Biorept, Tropical) 3 volte a settimana. Tale acclimatazione è durata circa 7 giorni prima della sperimentazione vera e propria. Il progetto è stato approvato dal Comitato Etico dell’Università di Pisa, con protocollo n. 7920.
20
3.2 PRODOTTI CHIMICI E REAGENTI
Enrofloxacina, ciprofloxacina e sarafloxacina standard puri al 99,9 % sono stati acquistati da Sigma-Aldrich srl Milano. Il sodio cloruro, soluzione per infusione è fornito da Altaselect (San Giovanni Lupatoto, Verona). Acetonitrile, isopropanolo cloroformio e metanolo di grado HPLC isocratico sono ottenuti da HiPerSolv Chromanorm VWR International Bvba Prolabo (Leuven, Belgio). Trietilammina, potassio diidrogenofosfato, acido fosforico e sodio fosfato monobasico di grado analitico sono stati acquistati da Farmitalia Carlo Erba S.p.a (Milano). Disodiofosfato eptaidrato per la preparazione del tampone è stato acquistato da Baker Analyzed Reagent (Deventer, Olanda).
3.3 SOLUZIONI STANDARD E RETTE DI TARATURA
Soluzioni acquose delle sostanze madri sono state preparate e conservate in frigo a temperatura 4° C, avvolte in un foglio di alluminio al riparo dalla luce, per un tempo non superiore alle 2 settimane. In particolare sono stati disciolti e sonicati (Elmasonic Seac Sub) 5 mg di ciprofloxacina, 25 mg di enrofloxacina e 20 mg di sarafloxacina, ciascuna in un matraccio da 100 mL con acqua, al fine di ottenere concentrazioni di 50 ppm di ciprofloxacina, 250 ppm di enrofloxacina, 200 ppm di sarafloxacina. Successivamente le rispettive soluzioni madri sono state ulteriormente diluite in vials scure con tappo a pressione a concentrazioni 10 µg/mL, 1 µg/mL, 500 ng/mL, 100 ng/mL, 50 ng/mL, 10 ng/mL, 5 ng/mL, 1 ng/mL. Le concentrazioni a 1, 100, 500, 1000, 3500 ng/mL sono state testate (in ordine
21
crescente) con HPLC per ottenere le rette di taratura (e quindi il coefficiente angolare e l’intercetta sull’asse Y) grazie a GraphPad Prism 4 Project versione 4.0, 2003 (figura 11). Ogni campione è stato iniettato 3 volte.
Enrofloxacina Y=1303X+58650 Ciprofloxacina Y=791X+49390 Sarafloxacina Y=490X-270000
Curve Taratura
1000 2000 3000 4000 -1000000 0 1000000 2000000 3000000 4000000 5000000 Enro Cipro Sara conc ppb Ar e aFigura 11 Rette di taratura
Queste rette sono utili per calcolare le concentrazioni degli analiti nei campioni di sangue a partire dall’area dei picchi presenti nel cromatogramma.
22
3.4 FASE SPERIMENTALE
Prima della somministrazione del farmaco alle tartarughe, una soluzione di enrofloxacina 50 mg/mL (Valemas 5, soluzione iniettabile, ATI, Bologna) è stata diluita con fisiologica a 10 mg/mL, dopodiché si è proceduto con la somministrazione per via intramuscolare nella zampa posteriore, iniettando un volume in mL pari al peso corporeo degli animali. Successivamente i campioni di sangue (1 mL) sono stati raccolti in provette eparinizzate come mostrato in figura 12.
Figura 12 A sinistra la soluzione di Enrofloxacina e a destra un campione di sangue pronto per l’estrazione
I prelievi di sangue sono stati eseguiti dai seni venosi della zona cervicale di ogni tartaruga (figura 13), prima della somministrazione di enrofloxacina (T0) e a 0,5, 2, 4, 8, 12, 24, 48, 72, 96, 120, 144, 168, 192 ore dopo la somministrazione. I campioni, infine, sono stati conservati in congelatore a -20°C fino al momento dell’analisi (entro una settimana dal prelievo).
23
Figura 13 Prelievo del sangue dai seni venosi cervicali
3.5 PREPARAZIONE DEI CAMPIONI ED ESTRAZIONE
Un’aliquota di sangue intero (200 µL) è stato diluito con 800 µL di tampone fosfato 0,1 M a pH 7,4, precedentemente preparato diluendo in acqua deionizzata e filtrata 0,3117 g di sodiofosfato monobasico e 2,0747 g di disodiofosfato eptaidrato. Dopo aver vortexato (vortex VWR, VV3), ai campioni sono stati aggiunti 100 µL di standard sarafloxacina 10 µg/mL e nuovamente vortexato. Infine sono stati aggiunti 5 mL di solvente organico costituito da una miscela di cloroformio e isopropanolo in rapporto 4:1. I campioni sono stati agitati (agitatore DYNAL Sample Mixer) per 10 minuti, in modo tale che il solvente estraesse i farmaci dal sangue. Dopo l’agitazione i campioni sono stati centrifugati per 5/10 minuti a 3500*g (centrifuga UNIVERSAL 320 Hettich Zentrifugen) per separare le parti corpuscolate dal surnatante organico contenente gli analiti. Successivamente sono stati prelevati 4 ml di surnatante e concentrati, portandoli a secco con elio a 40°C. Al residuo secco sono stati aggiunti 200 µL di fase mobile.
24 + 200 µL sangue
Figura 14 Schema estrazione
200 µL di sangue intero
+ 800 µL tampone fosfato 0,1 M pH 7,4
+ 100 µL sarafloxacina + vortex + 5 mL solvente organico
agitatore per 10 minuti
centrifuga per 5-10 minuti
prelievo 4 mL di surnatante
25
3.6 SISTEMA HIGH-PERFORMANCE LIQUID CHROMATOGRAPHY (HPLC)
Nel presente studio è stata usata una pump HPLC Jasco PU-2089 Plus (figura 15) con rivelatore fluorimetrico Jasco FP-2020 Plus e la
separazione eseguita con colonna Phenomenex Gemini C18 (250*4,60 mm) con particelle di 5µm. La fase mobile è costituita da una miscela di
acetonitrile e soluzione acquosa di potassio diidrogeno fosfato 0,02 M a pH 3 (20:80 v:v). La soluzione acquosa è stata preparata sciogliendo in 1L di acqua deionizzata e filtrata, 2,72 g di potassio diidrogeno fosfato e
successivamente 860 µL di trietilammina; il pH poi è stato aggiustato con l’aggiunta di acido fosforico 0,006 M (phmetro HANNA INSTRUMENTS HI 9219). L’HPLC nel presente studio ha lavorato in condizioni isocratiche, con flusso 1 mL/min e loop 50 µL, mentre il detector è stato impostato per
lunghezze d’onda pari a λ eccitazione 338 nm, λ emissione 425 nm e gain 1000. Le aree dei picchi, le integrazioni e le visualizzazioni dei
cromatogrammi sono stati effettuati dal programma BORWIN JASCO. Il metodo usato è in accordo con Garcia et al. (1999), leggermente modificato.
26
3.7 VALIDAZIONE DEL METODO
Nel presente studio è risultato più vantaggioso ed affidabile il metodo dello standard interno. L’applicazione di questo metodo è consentita dal fatto che la sarafloxacina usata come standard ha simile fluorescenza e solubilità agli analiti, quindi la percentuale di sarafloxacina recuperata dal campione è uguale alla percentuale di enrofloxacina e ciprofloxacina. Il recupero si ricava mettendo in proporzione l’area dello standard interno ricavato dal campione con l’area ricavata dalla soluzione standard usata per costruire la retta di taratura:
Area IS sol. Pura : 100 = Area IS campione : X
X= percentuale di IS recuperato = percentuale di enrofloxacina recuperata.
Se la percentuale risulta inferiore al 100 % allora si calcola il valore di Real Area, cioè l’area del picco corrispondente al totale recupero di sarafloxacina e quindi di enrofloxacina:
Area enrofloxacina : %recuperata = X : 100
Una volta calcolata l’area corrispondente al totale recupero di sostanza (Real Area), si procede al calcolo della concentrazione. Aggiungendo 100 µL di sarafloxacina 10 µg/mL, nel campione è presente un valore assoluto di standard pari a 1 µg. Durante il procedimento di estrazione, però sono prelevati 4 mL di surnatante, quindi il 20 % di 1 µg di standard, quindi al valore di Real Area è opportuno addizionarci il 20% (Real Area + 20%). Infine per il calcolo della concentrazione (ng/mL) si usano le rette di taratura:
per l’enrofloxacina PPB= ( )
27
per la ciprofloxacina PPB= ( )
Anche se il metodo è stato validato precedentemente da Garcia et al. (1991), è stato rivalidato nelle tartarughe. Il limite di quantificazione nel presente studio è risultato 1 ng/mL, mentre il limite di determinazione di 0,3 ng/mL. Per la validazione del metodo HPLC-FL è stata utilizzata la linea guida dell’EMEA (“Guideline on validation of bioanalytical methods”).
L’accuratezza del metodo è stata dimostrata iniettando il sangue di tartaruga non soggetti a trattamento farmacologico (bianchi). La variazione intra-day ed inter-day è stata determinata effettuando analisi ripetute dei campioni di controllo qualità (CQ) nello stesso giorno e in giorni differenti. In particolare la ripetibilità del metodo è stata dimostrata confrontando i risultati derivanti dall’iniezione di tre campioni a tre concentrazioni diverse di enrofloxacina e ciprofloxacina per un numero totale di tre volte nello stesso giorno, nello stesso laboratorio, dallo stesso operatore, usando la stessa apparecchiatura e in intervalli di tempo brevi. Per valutare la precisione intermedia è stato eseguito lo stesso procedimento ma in intervalli di tempo lunghi (una volta al giorno per cinque giorni consecutivi). La stabilità a lungo termine è stata ottenuta confrontando le aree dei campioni CQ freschi con le aree dei campioni CQ aggiunti alla matrice organica e conservati a -20 °C per 14 giorni e per 2 mesi. La variabilità è stata inferiore al 5%. La riproducibilità del metodo è stata dimostrata confrontando i risultati ottenuti nel laboratorio di farmacologia e tossicologia di San Piero con quelli ottenuti dal laboratorio del dipartimento di Chimica e Chimica Industriale di Pisa, analizzando gli stessi campioni con lo stesso metodo, da operatori diversi, utilizzando
28
apparecchiature diverse e in intervalli di tempo diversi. Anche in questo caso la percentuale di variabilità è stata inferiore al limite richiesto dall’EMEA. La specificità del metodo è stata valutata confrontando i cromatogrammi ottenuti iniettando il bianco di sangue di tartaruga non soggetto ad alcun trattamento farmacologico con quelli ottenuti iniettando il sangue nel quale sono state aggiunte concentrazioni note degli analiti e tenute a 37° per 30 min (metodo delle aggiunte) e quelli ottenuti analizzando i campioni di sangue di tartaruga soggetti a trattamento farmacologico con Valemas 5®.
La più bassa concentrazione di analita che può essere rilevata ma non quantificata (LOD) e la più bassa concentrazione di analita che può essere rilevata e quantificata (LOQ) sono state calcolate determinando il rapporto segnale-rumore ottenuto confrontando i segnali misurati su campioni contenenti concentrazioni note di enrofloxacina e ciprofloxacina con quelle di campioni bianchi. In particolare il valore di concentrazione corrispondente al segnale più basso misurabile sul campione con la certezza che questo segnale non possa essere scambiato per il segnale del bianco dovuto al rumore di fondo (LOD) è stato calcolato nel modo seguente:
LOD (segnale) = valore medio dei bianchi + 3 volte la deviazione standard dei bianchi.
Il valore di concentrazione corrispondente al segnale misurabile sul campione a partire dal quale si può ragionevolmente cominciare a quantificare la concentrazione del campione stesso (LOQ) è stato calcolato nel modo seguente:
LOQ (segnale) = valore medio dei bianchi +10 volte la deviazione standard dei bianchi.
29
La linearità del metodo, ovvero l’abilità di dare risultati che sono direttamente proporzionali alla concentrazione degli analiti nei campioni all’interno di un determinato campo di validità, è stata dimostrata iniettando in HPLC-FL soluzioni dell’analita a cinque concentrazioni note. Dall’area dei picchi corrispondenti è stata costruita la curva di calibrazione. La linearità è stata verificata attraverso il calcolo del coefficiente di correlazione della curva di taratura eseguita (r2).
Il range lineare è stato valutato determinando l'intervallo di concentrazione nel quale il segnale varia linearmente con la concentrazione (area proporzionale alla concentrazione).
La robustezza è stata valutata evidenziando i parametri critici del metodo analitico come pH, temperatura, concentrazione, volatilità, stabilità in soluzione degli analiti, tempo di estrazione, composizione della miscela di estrazione, variazione della composizione di fase mobile, variazione della velocità del flusso e il tipo di colonna.
3.8 PARAMETRI FARMACOCINETICI
L’analisi farmacocinetica è stata eseguita dal programma WinNonlin 5.0. I parametri farmacocinetici di enrofloxacina e ciprofloxacina sono stati ricavati usando il modello noncompartimentale. Tale modello viene usato per determinare parametri farmacocinetici senza specificare modelli compartimentali, quindi i dati ricavati seguono una cinetica lineare. Tali parametri sono:
R²= coefficiente di determinazione di regressione lineare, indica la tendenza di due variabili a variare insieme. In particolare nella relazione lineare
30
all’aumentare di una variabile, si osserva l’aumento anche della seconda variabile. Il valore R² varia da 0 (nessuna correlazione tra le variabili) a 1 (massima correlazione tra le variabili).
λz= costante della velocità di eliminazione. Nel modello noncompartimentale è la misura della pendenza della parte finale della retta.
HL= tempo di emivita, cioè il tempo necessario affinché la concentrazione plasmatica del farmaco si riduca del 50 %. Si ricava dal rapporto 0,693/λ e si misura in ore (h).
Tmax= tempo necessario per raggiungere la concentrazione massima.
Cmax= concentrazione massima.
AUC 0-∞ = (Area Under Curve), area sotto la curva concentrazione-tempo,
che rappresenta la quantità di principio attivo presente nel sangue nell’intervallo di tempo 0-∞ in seguito alla somministrazione. Ha come unità di misura h*ng/mL
Vz= volume apparente di distribuzione, cioè la quantità di liquido che sarebbe necessario a contenere il farmaco alla stessa concentrazione alla quale esso si trova nel sangue. È un parametro importante per valutare la distribuzione ed è misurato in mL/kg.
Cl= clearance, cioè la quantità di sangue ripulita dal farmaco nell’unità di tempo. È un parametro che dà informazione sulla scomparsa dal compartimento ematico perché mette in relazione la velocità di scomparsa del farmaco con la sua concentrazione sanguigna.
31
AUMC 0-∞ = (Area Under the first Moment of the Curve). Mentre l’AUC è
l’area totale definita dalla curva concentrazione-tempo, l’AUMC è l’area definita dalla curva concentrazione-tempo e il tempo stesso. Ha come unità di misura h²* ng/mL
MRT= (Mean Residence Time), tempo durante il quale il farmaco permane nell’organismo in seguito alla somministrazione. È un valore indipendente dalla dose e dà informazioni riguardo l’eliminazione. Si calcola dal rapporto tra AUMC e AUC e si misura in ore (h).
32
4. RISULTATI
Nelle figure 16-19 sono riportati i cromatogrammi dei fluorochinoloni presi in considerazione nel presente studio. Ogni corsa è stata della durata di 12 minuti, all’interno dei quali la ciprofloxacina, l’enrofloxacina e la sarafloxacina sono stati ben separati. Nella figura 16 è riportato il cromatogramma ottenuto dall’iniezione di un campione contenente sia enrofloxacina, ciprofloxacina che sarafloxacina alla concentrazione di 3,3 µg/mL. Tale procedimento è stato eseguito prima della sperimentazione animale, al fine di valutare il tempo di ritenzione dei rispettivi farmaci. Dal grafico si può vedere che la ciprofloxacina ha un tempo di ritenzione di 5,7 ± 0,1 minuti, l’enrofloxacina 6,7 ± 0,3 minuti, mentre lo standard interno sarafloxacina ha un tempo di ritenzione di 9,7 ± 0,3 minuti.
Figura 16 Cromatogramma ottenuto dall’iniezione di un’estrazione contenente ciprofloxacina (C), enrofloxacina (E) e sarafloxacina (S) aggiunta al sangue della tartaruga di controllo alla concentrazione di 3,3 µg/mL.
Nelle figure 17 e 18 sono rappresentati i cromatogrammi ottenuti dai campioni estratti dal sangue delle tartarughe. In particolare nella figura 17 è
C
E
33
riportato un campione di bianco, cioè sangue di tartaruga non precedentemente trattata con enrofloxacina e al quale non è stato aggiunto lo standard interno. Non ci sono picchi interferenti ai tempi di ritenzione degli analiti. Nella figura 18, è riportato un campione di sangue di tartaruga trattata. In quest’ultimo si può notare che, oltre alla ciprofloxacina, enrofloxacina e sarafloxacina, compare un altro picco in corrispondenza degli 8 minuti. Questo picco è comparso in tutte le tartarughe trattate ed ha anche un andamento tempo dipendente. La sua area è spesso risultata maggiore dell’area della ciprofloxacina.
34
Figura 18 Campione di sangue trattato della tartaruga n.10 (prelievo delle 72 ore). Si possono osservare i picchi della ciprofloxacina (C), dell’enrofloxacina (E), della sarafloxacina (S) e del metabolita sconosciuto (?).
Infine il cromatogramma in figura 19 riporta l’andamento della ciprofloxacina e dell’enrofloxacina a 3 tempi differenti, in particolare dall’alto verso il basso sono riportate le 24, 48 e 72 ore. Da questi grafici si può vedere come, al passare del tempo il picco dell’enrofloxacina diminuisca, mentre quello della ciprofloxacina rimanga perlopiù invariato.
Figura 19 Andamento della ciprofloxacina (C), e dell’enrofloxacina (E) a 3 tempi differenti: a 24 ore (riquadro A), a 48 ore (riquadro B) e 72 ore (riquadro C).
C E ? S A B C C C C E E E
35
Nel presente studio tutte le tartarughe hanno percepito dolore dopo la somministrazione del farmaco, dimostrato dal movimento veloce e scoordinato degli arti in seguito all’iniezione. Tale effetto è stato transitorio e non si sono evidenziati altri effetti collaterali durante la sperimentazione. La tartaruga 2 è morta dopo 12 ore dalla somministrazione. Dall’autopsia veterinaria però le cause del decesso risultano sconosciute. Sebbene non ci sia certezza, è stato valutato improbabile che la causa del decesso sia dovuta alla somministrazione del farmaco, ma può essere attribuita al fatto che l’animale (che tra tutte era la tartaruga di peso inferiore) non ha sopportato i frequenti prelievi di sangue, quindi il decesso sia stato causato da un forte stress. Per quanto riguarda il metodo, l’uso dell’HPLC è stato vantaggioso per poter quantificare in maniera specifica sia l’enrofloxacina che il metabolita ciprofloxacina in ogni campione. Le figure 20, 21, 22, 23 e 24 rappresentano le curve semi logaritmiche concentrazione vs tempo di ogni tartaruga, mentre la figura 25 è una rappresentazione della curva semilogaritmica concentrazione vs tempo media. Dalla figura 25 si evince che il picco di massima concentrazione osservato dell’enrofloxacina è intorno alle 2,5 ore dalla somministrazione, mentre per la ciprofloxacina è di 8 ore, con singoli valori nel range di 8-24 ore. Le concentrazioni di enrofloxacina e ciprofloxacina sono state monitorate rispettivamente fino a 192 e 120 ore dopo la somministrazione. In questo intervallo di tempo la concentrazione dell’enrofloxacina è rimasta sempre superiore alla concentrazione di ciprofloxacina, infatti il rapporto tra l’AUC dell’enrofloxacina e AUC della ciprofloxacina è 17,5.
36
Figura 20 Curva Concentrazione-Tempo di enrofloxacina (▪) e ciprofloxacina () nel sangue delle tartarughe 1, 2 e 3 (dall’alto verso il basso).
1 10 100 1000 10000 100000 0 20 40 60 80 100 120 Log Co n c ( n g/ m L) Tempo (h)
Tartaruga 1
1 10 100 1000 10000 0 2 4 6 8 10 12 Log Co n c ( n g/ m L) Tempo (h)Tartaruga 2
1 10 100 1000 10000 100000 0 20 40 60 80 100 120 Log Co n c ( n g/ m L) Tempo (h)Tartaruga 3
37
Figura 21 Curva Concentrazione-Tempo di enrofloxacina (▪) e ciprofloxacina () nel sangue delle tartarughe 4, 5 e 6 (dall’alto verso il basso).
1 10 100 1000 10000 0 50 100 150 Log Co n c ( n g/ m L) Tempo (h)
Tartaruga 4
1 10 100 1000 10000 100000 0 50 100 150 Log Co n c ( n g/ m L) Tempo (h)Tartaruga 5
1 10 100 1000 10000 100000 0 50 100 150 Log Co n c ( n g/ m L) Tempo (h)Tartaruga 6
38
Figura 22 Curva Concentrazione-Tempo di enrofloxacina (▪) e ciprofloxacina () nel sangue delle tartarughe 7, 8 e 9 (dall’alto verso il basso).
1 10 100 1000 10000 100000 0 24 48 72 96 120 144 168 192 Log Co n c ( n g/ m L) Tempo (h)
Tartaruga 7
1 10 100 1000 10000 0 50 100 150 Log Co n c ( n g/ m L) Tempo (h)Tartaruga 8
1 10 100 1000 10000 0 50 100 150 Log Co n c ( n g/ m L) Tempo (h)Tartaruga 9
39
Figura 23 Curva Concentrazione-Tempo di enrofloxacina (▪) e ciprofloxacina () nel sangue delle tartarughe 10, 11 e 12 (dall’alto verso il basso).
1 10 100 1000 10000 0 50 100 150 Log Co n c ( n g/ m L) Tempo (h)
Tartaruga 10
1 10 100 1000 10000 0 24 48 72 96 120 144 168 192 Log Co n c ( n g/ m L) Tempo (h)Tartaruga 11
1 10 100 1000 10000 100000 0 24 48 72 96 120 144 168 Log Co n c ( n g/ m L) Tempo (h)Tartaruga 12
40
Figura 24 Curva Concentrazione-Tempo di enrofloxacina (▪) e ciprofloxacina () nel sangue delle tartarughe 13 e 14 (dall’alto verso il basso).
1 10 100 1000 10000 0 50 100 150 Log Co n c ( n g/ m L) Tempo (h)
Tartaruga 13
1 10 100 1000 10000 0 50 100 150 Log Co n c ( n g/ m L) Tempo (h)Tartaruga 14
41
Figura 25 Valori medi delle concentrazioni di enrofloxacina (▪) e ciprofloxacina () nel sangue di tutte le tartarughe in relazione al tempo.
1 10 100 1000 10000 100000 0 24 48 72 96 120 144 168 192 L o g Co n c (n g /mL ) Tempo (h) Media dei valori
42
Nella tabella 1 sono riportati i parametri farmacocinetici di ogni tartaruga per l’enrofloxacina, mentre nelle tabelle 2 e 3 sono riportati i valori medi e le relative deviazioni standard rispettivamente per l’enrofloxacina e per la ciprofloxacina. In seguito alla somministrazione intramuscolare, la concentrazione massima di enrofloxacina calcolata nel sangue delle tartarughe è 10,36 µg/mL, raggiunta dopo 2,6 ore, mentre per la ciprofloxacina è 0,3 µg/mL raggiunta dopo 8 ore. Inoltre l’enrofloxacina si distribuisce bene nell’organismo (volume di distribuzione pari a 2480 mL/kg), ha un’emivita alta (circa 47 ore) e tempo medio di permanenza nell’organismo di 56 ore. Anche la ciprofloxacina ha un’emivita alta (37,4 ore) e permane nell’organismo a lungo (MRT pari a 59 ore).
TABELLE PARAMETRI FARMACOCINETICI
Tabella 1 Parametri Farmacocinetici dell’enrofloxacina per ogni singola tartaruga.
Parametro Unità Tart. 1 Tart. 3 Tart. 4 Tart. 5 Tart. 6 Tart. 7 Tart. 8 Tart. 9 Tart. 10 Tart. 11 Tart. 12 Tart. 13 Tart. 14
R² 0,99 0,73 0,88 0,9 0,99 0,97 0,91 0,95 0,99 0,8 0,8 0,93 0,1 λz 1/h 0,025 0,016 0,02 0,012 0,0066 0,017 0,016 0,023 0,01 0,018 0,017 0,015 0,015 Hl h 27,5 41,95 33,5 59,16 104,26 41,13 43,03 29,92 68,07 38,5 39,7 46,11 46,02 Tmax h 4 2 4 4 2 2 2 4 2 2 2 2 2 Cmax ng/mL 13319,7 12968,9 8220,8 12572,7 15868,9 13973,1 9801,8 6717,5 8376,3 5794,7 10520,04 8464,2 8092,9 AUC 0-∞ h*ng/mL 342680 205961 159093 533114 534484 482272 233932 132578 248328 172217 302164 444572 222599 Vz mL/kg 1158,8 2938,3 3038,3 1600,9 2814,1 1230,3 2653,8 3255,8 3954,8 3225,1 1895,8 1496,5 2983,8 Cl mL/h/kg 29,2 48,55 62,86 18,76 18,71 20,73 42,75 75,43 40,27 58,07 33,09 22,49 44,94 AUMC 0-∞ h²*ng/mL 12649729 11771708 5506992 40402320 51372895 25825931 10918947 4987811 17550084 10600067 16039822 29236296 10190079 MRT h 37 57 35 76 96 53,55 46,7 37,6 70,7 61,5 53,1 65,8 45,8 4 . Risu ltati 43
44
TABELLE PARAMETRI FARMACOCINETICI
Parametro Unità Media DS
R² 0,84 0,23 Λz 1/h 0,016 0,005 Hl H 47,60 20,25 Tmax H 2,61 0,960 Cmax ng/mL 10361 3103 AUC 0-∞ h*ng/mL 308769 144441 Vz mL/kg 2480,5 896 Cl mL/h/kg 39,68 18,15 AUMC 0-∞ h²*ng/mL 19004052,4 14002254 MRT H 56,59 17,52
Tabella 2 Parametri farmacocinetici medi dell’enrofloxacina e relative deviazioni standard
Parametro Unità Media SD
R² 0,94 0,12 Λz 1/h 0,018 0,0009 Hl H 37,4 24,2 Tmax H 8 2,4 Cmax ng/mL 301,68 147,6 AUC 0-∞ h*ng/mL 17751 5463 AUMC 0-∞ h²*ng/mL 1047421 548756 MRT H 59 21,3
45
5. DISCUSSIONE
Nonostante le origini americane, da molti anni la tartaruga acquatica è considerata come animale domestico anche in Europa. Studiare la farmacodinamica e farmacocinetica di un antibiotico ampiamente commercializzato in medicina veterinaria come l’enrofloxacina è utile per salvaguardare la salute di questo animale e dell’ambiente circostante, visto che la tartaruga può infettarsi e contemporaneamente essere portatrice di agenti infettivi, per esempio la Salmonella (Nagano et al., 2006). Ogni anno la Salmonella causa 1,4 milioni di infezioni e 400 decessi. Circa il 6% di casi sono riconducibili al contatto diretto con rettili e spesso ad essere colpiti sono i bambini. Nelle tartarughe la Salmonella costituisce la flora intestinale e di conseguenza questo batterio viene riversato nelle feci, per cui l’uomo può entrare in contatto con esso. Le infezioni riguardano maggiormente i bambini perché la tartaruga è un animale lento, piccolo, pacifico e viene spesso trattato come giocattolo. È stato visto che un metodo efficace per ridurre le infezioni da Salmonella nelle tartarughe è quello di lavare la superficie delle uova con candeggina e successivamente, lavarle con antibiotici in una camera a vuoto; in particolare l’enrofloxacina svolge un ruolo fondamentale in questi trattamenti (Harris et al., 2010).
La farmacocinetica dell’enrofloxacina è stata studiata anche in altre specie di tartarughe come le Caretta Caretta alle quali sono stati somministrati 10 mg/kg di enrofloxacina per via orale e le Trachemis Scripta Elegans alle quali sono stati somministrati 5 mg/kg di farmaco per via intramuscolare. In questi studi le concentrazioni plasmatiche di enrofloxacina restano sopra il limite di quantificazione per 168 ore nelle Caretta Caretta e
46
per 48 ore per le Trachemis Scripta Elegans. Nel presente studio la concentrazione ematica di enrofloxacina permane sopra il limite di quantificazione per 192 ore. Il metodo analitico usato è risultato più sensibile dei metodi usati nei precedenti studi. Infatti, il limite di quantificazione calcolato è 0.05 µg/mL per le Trachemis Scripta Elegans e 0,03 µg/mL per le Caretta Caretta, valori molto maggiori rispetto a quello riscontrato nel presente studio (0,001 µg/mL). Questa maggiore sensibilità ha permesso di descrivere meglio la parte terminale della curva concentrazione vs tempo. La farmacocinetica ricavata dal presente studio è risultata differente da quella evidenziata in tartarughe simili (Trachemis Scritpta Elegans vs Trachemis Scripta Scripta), ma descrive in maniera più accurata l’andamento dell’enrofloxacina in seguito a somministrazione intramuscolare. Oltre ad usare una metodica più sensibile, sono state analizzate un numero di tartarughe notevolmente maggiori rispetto al precedente studio (6 vs 14), rendendo i presenti risultati statisticamente più forti. La cinetica mostrata in questo studio non sembra comunque discostarsi molto da quella in tartarughe più grandi come le Caretta Caretta (Jacobson et al., 2005).
Proprietà farmacocinetiche vantaggiose sia per l’enrofloxacina che per tutti i fluorochinoloni includono un rapido assorbimento, elevati volume di distribuzione ed emivita. Nelle specie Caretta Caretta, in seguito a somministrazione per via orale di enrofloxacina 10 mg/kg, il Tmax è di 5 ore, mentre nel presente studio è 2,5 ore, ciò suggerisce che la somministrazione per via intramuscolare permette un assorbimento più rapido rispetto alla somministrazione orale. Inoltre il tempo di emivita nelle Caretta Caretta risulta pari a 37,80 ore, nelle Trachemis Scripta Elegans di 17,64 ore, mentre in questa sperimentazione è stato trovato un valore di emivita molto
47
maggiore (47,60 ore). Un vantaggio dell’elevato tempo di emivita è che la frequenza di somministrazione di enrofloxacina nelle tartarughe è ridotta rispetto ai mammiferi.
In seguito al lancio sul mercato negli anni ’80 i fluorochinoloni sono diventati il gruppo di antibiotici di origine sintetica più usato in medicina veterinaria. Tra questi l’enrofloxacina è l’antibiotico più comunemente usato anche per il trattamento di infezioni batteriche nei rettili per la sua attività contro gram +, gram – e pochi effetti collaterali associati al suo uso (Jacobson, 1999). Nonostante abbia molti vantaggi clinici come ampio spettro d’azione ed indice terapeutico, in alcuni studi è stato riscontrato che la forma iniettabile può essere estremamente irritante. Ad esempio in uno studio con le Galapagos tortoise (Casares, Enders, 1996) trattate con una soluzione di enrofloxacina 100 mg/mL a dosaggi 5 mg/kg per via intramuscolare, sono stati riscontrati notevoli effetti collaterali come convulsioni, ipereccitazione, diarrea e ipersalivazione. In un altro studio (James et al., 2003) sono state trattate tartarughe Trachemis Scripta Elegans le quali hanno ricevuto enrofloxacina 22 mg/mL a dosaggi 10 mg/kg per via intramuscolare, quindi una soluzione meno concentrata, ma a dosaggio più alto rispetto al precedente. Gli animali, in questo caso, in seguito all’iniezione hanno evidenziato dolore e fastidio nella zampa, dimostrata dal ritiro di questa nel guscio e dalla difficoltà di deambulazione. Dati questi effetti collaterali, in entrambi gli studi è stato suggerito che la somministrazione per via orale è quella ottimale (Jacobson et al., 2005). Nel presente studio, le tartarughe sono state trattate per via intramuscolare 10 mg/kg con una soluzione 50 mg/mL diluita a 10 mg/mL ed è stato visto che gli animali provano dolore all’iniezione, reagendo con movimenti veloci e scoordinati
48
solo per alcuni secondi ma non evidenziano difficoltà natatorie o deambulatorie in seguito alla somministrazione. Inoltre, seppur le tartarughe siano state trattate con una somministrazione intramuscolare, non sono stati riscontrati fenomeni di necrosi e irritazione tissutale come riscontrato con soluzioni di enrofloxacina a concentrazioni elevate. È’ probabile che, diluendo maggiormente la soluzione, si arrivi ad una condizione in cui l’animale non avverta nessun tipo di dolore. La somministrazione orale non è quindi risultata la più vantaggiosa in questa razza di tartarughe, poiché per animali di piccola taglia come le tartarughe Trachemis Scripta Scripta richiederebbe una sonda orogastrica o strumenti per bloccare la testa ed assicurare così l’arrivo del farmaco al livello gastrico, ma sono metodiche rischiose per l’insorgenza della polmonite ab ingestis, difficoltà respiratorie, soffocamento e potrebbero recare stress all’animale fino alla morte se applicati anche per brevi periodi (Wimsatt et al. 2008).
Da sempre, la minima concentrazione inibente (MIC) di un farmaco è stata usata per valutare i dosaggi antimicrobici al fine di avere un effetto terapeutico evitando gli effetti collaterali. La MIC però è un parametro abbastanza generico perché non valuta efficacemente il dosaggio da somministrare. Infatti, per la specie Pseudomonas Aeruginosa, un gram negativo che ha betalattamasi in grado di inattivare penicilline e cefalosporine e altera la permeabilità dei canali di membrana, un picco di concentrazione sanguigna 4 volte superiore la MIC esercita sia un effetto soprainibitorio che postantibiotico, prolungando la sua attività per diverse ore anche quando la concentrazione sanguigna scende sotto i valori di MIC. Più recentemente sono stati proposti altri 3 parametri per prevedere con più precisione il risultato terapeutico: (1) il tempo durante il quale la
49
concentrazione sanguigna del farmaco rimane sopra i livelli di MIC ( t> MIC), (2) rapporto tra la massima concentrazione sanguigna e la MIC (Cmax/MIC) (3) rapporto tra AUC e MIC. Poiché i fluorochinoloni hanno un’attività antibatterica concentrazione dipendente, questi nuovi parametri sono stati identificati come possibili predittori farmacodinamici rispettivamente di risultati clinici e microbiologici per contrastare la resistenza batterica. In particolare sperimentazioni su modelli in vitro hanno evidenziato che alti valori di Cmax/MIC sono importanti nel prevenire la resistenza batterica, mentre AUC/MIC è un parametro importante per valutare l’effetto terapeutico e t>MIC è importante per sapere quanto tempo l’organismo è coperto dall’effetto terapeutico dell’antibiotico. È stato suggerito che valori Cmax/MIC > 10 sono richiesti per i chinoloni al fine di prevenire la resistenza batterica, mentre valori AUC/MIC nel range 100-125 sono consigliati al fine di avere un buon effetto terapeutico (Jacobson et al. 2005). Sebbene i valori di MIC isolati dalle tartarughe Trachemis Scripta Scripta non sono disponibili, sono stati riportati altri valori di MIC provenienti dalle tartarughe dalle orecchie rosse (Trachemis Scripta Elegans), come valori di riferimento. Uno studio con enrofloxacina (Jacobson et al.,2005) indica che nella maggior parte di batteri isolati da queste tartarughe il farmaco presenta una MIC < 0,5 µg/mL, mentre in alcuni batteri come la Pseudomonas, che sono più resistenti, ha una MIC intorno a 1,0 µg/mL. Nel presente studio, se prendiamo come valore di MIC 1,0 µg/mL per determinare la dose ottimale, vediamo che: (1) il tempo in cui la concentrazione sanguigna è maggiore della MIC è 72 ore di media, in particolare 96 h per la tartaruga 1, 48 h per la tartaruga 3,4, 9 e 11, 72 h per la tartaruga 8, 10, 12 e 14, 120 h per la tartaruga 6, 144 h per la tartaruga 7, 168 h per la tartaruga 13; (2) il rapporto Cmax/MIC è pari a 10,3 di media,