1
UNIVERSITA’ DI PISA
Dipartimento di Scienze Veterinarie
Corso di Laurea Magistrale in Medicina Veterinaria
Validazione e applicazione di tessuti Smart
per lo studio della variabilità della
frequenza cardiaca nel cavallo
Candidata Relatore
Michela Costigliola Dottor Paolo Baragli
Correlatore
Dottor Ingegnere Antonio Lanatà
2
Ai miei genitori, che mi hanno sempre
incoraggiata.
A mia nonna Diletta, la mia più grande sostenitrice.
3
INDICE
Pag.RIASSUNTO e ABSTRACT ...
5
INTRODUZIONE ...
6
PARTE PRIMA
PARTE
GENERALE
CAPITOLO 1 ...
7
1
CENNI DI FISIOLOGIA CARDIACA
1.1
Introduzione1.2
Elettrofisiologia cardiaca degli animali domestici e del cavallo1.3
Controllo della Frequenza CardiacaCAPITOLO 2 ...
17
2
ELETTROCARDIOGRAMMA
2.1
Introduzione2.2
Struttura dell’onda cardiaca2.3
DerivazioniCAPITOLO 3 ...
25
3
VARIABILITA’ DELLA FREQUENZA CARDIACA (HRV)
3.1
Introduzione alla variabilità della frequenza cardiaca3.2
Misurazione e metodi3.3
Artefatti e algoritmiCAPITOLO 4
... 37
4
STATO DELL’ARTE DELLA HRV
4.1
HRV nell’uomo4.2
HRV negli animali4.3
HRV nel cavallo4.4
Strumenti per il monitoraggio cardiaco e la valutazione della HRV a confronto4
CAPITOLO 5 ...
76
5
SCOPO DELLA TESI
PARTE SECONDA
LAVORO SPERIMENTALE
CAPITOLO 6 ...
78
6 MATERIALI E METODI
6.1 Animali
6.2 Design generale dell’esperimento
6.3 Materiali impiegati nel protocollo sperimentale
6.4 Design dell’esperimento
CAPITOLO 7 ...
89
7
RISULTATI
CAPITOLO 8 ...
96
8
DISCUSSIONE E CONCLUSIONI
ACRONIMI ... 99
BIBLIOGRAFIA ... 101
RINGRAZIAMENTI
5
RIASSUNTO
Nella presente tesi è stato effettuato un protocollo per la validazione e l’applicazione di tessuti Smart per l’analisi della variabilità della frequenza cardiaca nel cavallo. Sono state impiegate 12 cavalle trottatrici (di età compresa tra 10 e 14 anni), divise in due gruppi: 5 per la prima fase del protocollo per il confronto tra il sistema telemetrico e il nuovo sistema Smart, e 7 per la seconda fase, nella quale sono stati confrontati gli elettrodi in foam con gli elettrodi tessutali. I segnali ECG sono stati pre-filtrati per rimuovere la base e il rumore ad alta frequenza; in seguito sono stati suddivisi in finestre, in cui era presente almeno un complesso QRS completo.
Inoltre è stato sviluppato un innovativo algoritmo di elaborazione del segnale per la stima degli artefatti indotti dal movimento sulla base della Trasformata Stationary Wavelet con una soglia di multi-risoluzione. La percentuale di artefatti è stata analizzata con un T-test accoppiato. I risultati ottenuti indicano percentuali inferiori statisticamente significative di artefatti da movimento nei tracciati ECG acquisiti con gli e-textile, rispetto a quelli derivati dagli elettrodi in foam; maggiore accuratezza statisticamente significativa del nuovo algoritmo nel distinguere gli artefatti da movimento dai normali complessi QRS, rispetto all’analisi visiva e a quella automatica (correntemente in uso); maggiore accuratezza nell’analisi del segnale HRV. Oltre ai vantaggi di comfort e semplicità di utilizzo, gli elettrodi tessili hanno mostrato migliori prestazioni tecniche rispetto agli elettrodi standard, ponendo le basi per un loro impiego anche in condizioni di attività fisica più intensa.
Parole chiave: variabilità frequenza cardiaca; tessuti Smart; cavallo; validazione.
ABSTRACT
In this thesis was carried out a protocol for validation and application of the tissue Smart for the analysis of heart rate variability in the horse. 12 mares (aged between 10 to 14 years) have been employed, divided into two groups: 5 for the first phase of the protocol for the comparison between the telemetric system and the new system Smart, and 7 for the second phase, in which the foam electrodes were compared with e-textile. ECG signals were pre-filtered to remove the baseline and the high frequency noise; later were divided into windows, in which at least one complete QRS complex was present. It was also developed an innovative signal processing algorithm for the estimation of artifacts induced by the movement based on Stationary Wavelet Transform with a threshold of multi-resolution. The percentage of artifacts was analyzed with a paired t-test. The results show statistically significant lower rates of motion artifacts in the ECG acquired with e-textile, compared to those derived from the foam electrodes; greater accuracy of the new algorithm statistically significant in distinguishing motion artifacts from normal QRS complexes, with respect to the visual analysis and the automatic (currently in use); greater accuracy in the analysis of the HRV signal. Besides the advantages of comfort and ease of use, the textile electrodes showed better performance than the technical standard electrodes, setting the stage for their use even in the most intense physical activity.
6
INTRODUZIONE
In letteratura sono molti gli studi in cui si afferma quanto sia importante l’analisi della variabilità della frequenza cardiaca, sia nell’uomo che negli animali.
Per l’essere umano sono molti i sistemi di monitoraggio che permettono l’acquisizione dei tracciati Elettrocardiografici; tra i più impiegati troviamo la Telemetria e l’elettrocardiografia Holter, che da diverso tempo ormai sono entrati in uso anche nella Medicina Veterinaria.
L’utilizzo di tali sistemi in campo veterinario però, comporta alcune difficoltà legate alle peculiarità specifiche del cavallo e dovute principalmente a: 1) differenze anatomiche inter-specie, evidentemente presenti; 2) discrepanze esistenti nei tracciati ECG (specie-specifici); 3)maggior numero di artefatti da movimento presenti nel segnale ECG acquisito anche a riposo (non essendo possibile tenere immobili gli animali senza alterare i parametri fisiologici coinvolti nella regolazione dell’attività cardiaca).
Inoltre gli algoritmi applicati ai tracciati elettrocardiografici, sono stati sviluppati per essere usati nell’uomo e negli animali di piccola taglia, mentre non sono ancora stati studiati per i cavalli.
Infine, l’aumentato interesse per il benessere animale, e in particolare per il cavallo soprattutto durante l’attività sportiva, ha fatto emergere la volontà da parte dei ricercatori di affinare un nuovo metodo di monitoraggio dei parametri fisiologici che racchiuda tutte le caratteristiche dei sistemi “wearable” (già affermati in campo umano) calibrato per il cavallo.
Tutti questi motivi hanno portato alla realizzazione del seguente studio, effettuato per la validazione e l’applicazione di tessuti Smart textiles per l’analisi della variabilità della frequenza cardiaca nel cavallo.
Per comprendere l’importanza del lavoro svolto, la tesi è strutturata in modo da offrire una visione generale della fisiologia cardiaca e dei fattori coinvolti nella regolazione della variabilità dell’attività cardiaca, degli strumenti in uso e degli studi effettuati in merito (sia in ambito umano che veterinario), per poi giungere alla descrizione del sistema Smart textiles, alla dettagliata illustrazione del protocollo effettuato per la validazione, ed infine ai risultati ottenuti.
7
CAPITOLO 1
1 CENNI DI FISIOLOGIA CARDIACA
1.1 Introduzione
Per comprendere al meglio la fisiologia della variabilità della frequenza cardiaca e l’importanza della sua valutazione nella pratica clinica, è necessario porre l’attenzione sull’elettrofisiologia cardiaca e sulle componenti anatomiche coinvolte nell’origine e nella propagazione dell’impulso elettrico nel ciclo cardiaco.
Nel cuore sono presenti tre tipi di tessuto, muscolare, nodale e di conduzione, che hanno compiti funzionali diversi nello svolgimento dell’attività cardiaca: eccitabilità (refrattarietà), ritmicità, conducibilità e contrattilità.
Per eccitabilità si intende la proprietà di rispondere ad uno stimolo con un cambiamento di stato. Nelle cellule cardiache ciò avviene con una modifica del loro potenziale di riposo in potenziale d’azione, che si traduce in una contrazione.
Il tessuto muscolare, contraendosi ritmicamente, permette l’azione meccanica di pompa. Il tessuto nodale e quello di conduzione sono invece responsabili dell’insorgere periodico dell’eccitamento e della sua propagazione coordinata alla muscolatura atriale e ventricolare.
1.2 Elettrofisiologia cardiaca degli animali domestici e del cavallo
Il Tessuto Specifico di Conduzione del cuore crea e conduce un impulso elettrico dagli atri ai ventricoli, creando così la contrazione adatta a pompare il sangue in tutto l’organismo.Il cuore ha la capacità intrinseca di originare gli impulsi contrattili e ciò accade a livello del sistema di conduzione, costituito da fibre miocardiche specializzate. In condizioni fisiologiche le cellule del Nodo Seno-Atriale (NSA) danno l'avvio all'attività cardiaca (Cunningham, 2006).
La comunicazione elettrica nel cuore si diffonde rapidamente alle cellule adiacenti attraverso le gap junction (o giunzioni comunicanti) nei dischi intercalari.
8
Per tale motivo nel cuore le fibre nervose hanno la sola funzione di modulare gli impulsi originati nel sistema di conduzione.
Il Tessuto Specifico di Conduzione è costituito da diverse componenti (Immagine 1.1):
La depolarizzazione comincia a livello del Nodo Seno-Atriale (NSA), e le cellule autoritmiche da cui è composto rappresentano il pacemaker principale del cuore. È situato nella parte dell’atrio destro alla congiunzione con la Vena Cava superiore. Il nodo del seno è ellissoide negli esseri umani e in molte altre specie, mentre prende la forma di un ferro di cavallo negli equidi e negli ungulati in generale (Miller et al,
2002).
Dal NSA partono diramazioni di fibre autoritmiche non contrattili verso il basso, attraverso le quali si propaga velocemente l’onda di depolarizzazione in direzione del
Nodo Atrio-Ventricolare (NAV) (Aguggini et al, 2008),situato sul perimetro
dell’atrio destro alla sinistra dello sbocco del seno coronarico sopra l’inserzione della cuspide settale della Tricuspide. La parte superiore continua con le fibrocellule miocardiche atriali e con le fibre dei tratti internodali (Aguggini et al, 2008). Il NAV ha una bassa velocità di conduzione (7 V/s)rispetto al NSA e, come il NSA, negli animali è riccamente innervato da fibre adrenergiche e colinergiche. (Porciello
et al., 2010).
Dal Nodo Atrio-Ventricolare, la depolarizzazione si sposta ai ventricoli tramite il Fascio
comune di His, il
quale transita nel trigono fibroso destro lungo il bordo posteriore del setto membranoso. Il tronco
9
comune si divide quindi in branca destra e sinistra che decorrono in posizione sub-endocardica lungo il setto interventricolare (Aguggini et al, 2008), dove sono presenti le Fibre del Purkinje, cellule di conduzione specializzate che trasmettono segnali elettrici molto rapidamente (da 2 a 4 ms), circa tre volte più velocemente del miocardio (Porciello et al., 2010).
Branca destra: decorre, come unità anatomica ben distinta, sotto l’endocardio, lungo la superficie destra del setto interventricolare; in prossimità dell’apice cardiaco, attraversando il lume ventricolare mediante il fascio moderatore, essa si dirige verso la parete libera del Ventricolo destro, dove si apre a ventaglio.
Branca sinistra: è comunemente divisa, secondo una semplificazione elettrocardiografica, nei fascicoli anteriore e posteriore, anche se in realtà è costituita da innumerevoli fascicoli che si dirigono verso l’apice cardiaco, avvolgendo il Ventricolo sinistro (Porciello et al., 2010).
Le branche terminano il percorso inserendosi sulla rete sub-endocardica delle Fibre del Purkinje che si proiettano nello spessore della parte ventricolare, assumendo rapporti diretti con le fibrocellule miocardiche comuni (Aguggini et al, 2008). Nel cavallo, invece, le diramazioni terminali delle vie di conduzione specifiche penetrano più in profondità nelle pareti ventricolari e nel setto interventricolare. Questo impedisce la registrazione elettrocardiografica completa dei potenziali elettrici miocardici ventricolari dato che infiniti fronti di Depolarizzazione, con direzioni e orientamenti differenti, si propagano contemporaneamente nell’ambito del miocardio Ventricolare (Porciello et al., 2010).Tutto ciò si traduce in una particolare ritmicità cardiaca poiché il normale impulso, che come già detto si genera a livello del NSA, diffonde velocemente attraverso le cellule degli atri grazie alle giunzioni serrate, causa la simultanea contrazione di questi. Ma poiché le giunzioni serrate non sono presenti tra le cellule degli atri e quelle dei ventricoli, l’eccitamento non diffonde direttamente ai ventricoli e questi non si contraggono all’unisono con gli atri. La contrazione degli atri stimola il NAV, il quale, con un leggero ritardo, genera impulsi che vengono condotti ai ventricoli attraverso il fascio di His e le fibre
10
di Purkinje, che diffondono lo stimolo attraverso la massa muscolare dei ventricoli a partire dall’apice cardiaco, causandone la contrazione.
1.3 Controllo della Frequenza Cardiaca
1.3.1 Regolazione neuronale del Sistema Cardiovascolare
La Frequenza Cardiaca (FC) a riposo corrisponde ad un determinato valore che, pur rimanendo costante, è diverso da specie a specie. Inoltre nella stessa specie esistono delle differenze tra il giovane e l’adulto, come pure si riscontra una diminuzione della FC nel sonno o un aumento durante l’esercizio muscolare o in caso di eccitazione. L’inizio di ogni ciclo dell’attività cardiaca nei vertebrati, mammiferi inclusi, nasce nel cuore stesso dove si sono sviluppati e differenziati degli ammassi cellulari capaci di auto-eccitarsi e di trasmettere l’eccitamento originatosi in altre sedi.
Il primo controllo sulla FC viene esercitato dal NSA che, anche se dotato di una sua autonomia, soggiace agli interventi del Sistema Nervoso Autonomo (SNA) Simpatico e Parasimpatico (Aguggini et al, 2008). Il sistema cardiovascolare è infatti sotto il controllo di entrambi i componenti neuronali e umorali del SNA, agendo sia sul cuore che sul sistema vascolare periferico. Il cuore è innervato, quindi, dal Sistema Nervoso Simpatico (SNS) e dal Sistema Nervoso Parasimpatico (SNP). Le fibre parasimpatiche, che prendono origine dal Nucleo Motore dorsale del nervo Vago e dal Nucleo Ambiguo, e terminano nei gangli situati in prossimità del NSA e del NAV, determinano una depressione dell’automatismo (più lento battito cardiaco), diminuendo la velocità di conduzione e aumentando il periodo refrattario: l’azione complessiva del SNP è definita come tono Vagale. Questo effetto è mediato dal rilascio di Acetilcolina a livello delle terminazioni nervose, che attiva il potenziale di membrana delle cellule pacemaker, soprattutto nel NSA e, nei cavalli, nel NAV. Il SNS, le cui fibre efferenti del cuore hanno origine dai gangli cervicale craniale, medio e caudale, e dai primi quattro o cinque gangli toracici, agisce sul cuore attraverso il rilascio di Adrenalina e Noradrenalina. Ciò si traduce in una maggiore automaticità, una maggiore velocità di conduzione, un periodo refrattario accorciato (le cellule recuperano più rapidamente e consentono un più alto tasso di
11
stimolazione) e una maggiore contrattilità miocardica: l’azione complessiva del SNS è definita come tono Simpatico (Levy, 2009; Marr e Bowen, 2010).Inoltre, nei nervi del SNS sono presenti un contingente considerevole di fibre afferenti, probabili mediatori di sensazioni di dolore (Levy, 2009).
Gli atri sono ampiamente innervati da fibre noradrenergiche, colinergiche ed afferenti, e ci sono cellule gangliari colinergiche soprattutto sulla loro superficie posteriore. L'innervazione ventricolare, invece, con l'eccezione del fascio di His, è inferiore a quella atriale, e la maggior parte delle specie possiede solo una innervazione colinergica ridotta che segue sostanzialmente il corso delle arterie coronarie. Negli ungulati il Fascio di His è riccamente innervato e il miocardio riceve l'innervazione da piccoli plessi coronarici, principalmente noradrenergici, che seguono le arterie (Aguggini, 2008).
I due sistemi, Simpatico e Parasimpatico, non devono essere considerati indipendenti nel controllo della FC poiché esiste un certo sinergismo. Tuttavia, in determinate situazioni, la FC viene modificata per il prevalere di uno dei due sistemi con l’eventuale esclusione o riduzione dell’attività dell’altro (Aguggini et al, 2008).
Nel cavallo la frequenza cardiaca e lo stato inotropo del miocardio sono influenzati dal sistema nervoso autonomo e in particolare a riposo predomina il tono vagale che conferisce una frequenza cardiaca lenta, mentre il tono simpatico è estremamente basso. L'Acetilcolina agisce a livello dei recettori muscarinici M2-, localizzati solo sulle terminazioni nervose postgangliari Parasimpatiche del NSA e del NAV, dove inibiscono il rilascio di Acetilcolina, e su alcuni gangli del SNA, dove la loro attivazione determina l’iperpolarizzazione e riduce la velocità di trasmissione. L’innervazione diretta del muscolo ventricolare da parte del SNP è scarsa nella maggior parte delle altre specie.
Per contro, la distribuzione dei nervi simpatici cardiaci è molto più diffusa, permettendo a questo sistema di influenzare non solo la frequenza cardiaca, ma anche lo stato inotropo del muscolo cardiaco. Il concetto secondo il quale sia esclusivamente la noradrenalina ad agire sui recettori β1-adrenergici per mediare gli effetti della stimolazione simpatica, vale a dire aumento della frequenza cardiaca e della forza di contrazione, è troppo semplicistico. Anche se i recettori β1-adrenergici predominano in tutte le specie, tra cui il cavallo, nel tessuto nodale atriale si trovano
12
anche i recettori β2-adrenergici. In alcune specie, ma in modo poco evidente nel cavallo, ci sono prove che con una stimolazion cronica di alto livello, la percentuale di β2-adrenergici rispetto ai β1-adrenocettori aumenta, mentre il numero complessivo di β-adrenergici e la loro efficiente produzione di AMP ciclico diminuisce.
Nel muscolo cardiaco sono presenti anche i recettori α1-adrenergici la cui stimolazione contribuisce, in piccola parte, all'effetto inotropo positivo della stimolazione del SNS (senza alcun effetto sulla frequenza cardiaca), ma questa partecipazione è maggiore negli stati patologici, quando si verifica la down-regulation dei recettori β1- adrenergici, e può anche aumentare la tendenza a sviluppare aritmie dovute ad un elevato tono simpatico (Marr, Bowen, 2010).
In sentesi, il Nervo Vago a riposo esercita un freno continuo sull’attività cardiaca e di solito è più elevato in alcune specie (cavallo) rispetto ad altre (coniglio) (Detweiller,
2002).In condizioni di riposo il SNS, invece, non è in attività ma il suo meccanismo
di stimolazione è più o meno continuamente coinvolto nell'adattamento della frequenza cardiaca ai cambiamenti delle condizioni organiche (Detweiller, 2002).
Le branche Simpatica e Parasimpatica (Vagale) del SNA influenzano, quindi, la frequenza cardiaca attraverso un controllo antagonista. L’attività parasimpatica rallenta la FC, mentre quella simpatica l’aumenta per cui la prima ha un effetto cronotropo negativo mentre la seconda un effetto cronotropo positivo. Il neurotrasmettitore parasimpatico Acetilcolina rallenta la FC, attivando i recettori colinergici muscarinici, mentre le catecolamine noradrenalina e adrenalina, agendo sui recettori β1, localizzati sulle cellule autoritmiche, aumentano la velocità di depolarizzazione delle cellule stesse e quindi anche la FC.
1.3.2 Controllo centrale della frequenza
Sia nell’ uomo che negli animali la FC può dipendere anche da stimoli emozionali, comportamentali o di altra natura, che originano a livello della Corteccia Cerebrale, dove sono presenti degli agglomerati cellulari che regolano l’attività cardiaca.
Anche a livello Sottocorticale (Talamo ed Ipotalo) esistono zone che se stimolate danno luogo a variazioni della FC; l’Ipotalamo, ad esempio, interviene in rapporto
13
alle variazioni della temperatura corporea. Inoltre la stimolazione del Verme Cerebellare, che evoca inibizione su alcuni riflessi vegetativi e respiratori, inibisce anche l’attività riflessa barocettiva attraverso il Nucleo del tratto solitario, la scarica Simpatica renale ed i riflessi respiratori. Infine, anche a livello del Midollo Allungato esistono alcune aree capaci di modificare la FC.
1.3.3 Riflesso di bainbridge
Questo riflesso può essere facilmente riscontrato, negli animali e nell’uomo, infondendo per via venosa soluzioni fisiologiche o sangue poiché immediatamente si verifica un aumento della FC determinato dall’incremento della Pressione Venosa Centrale e dalla distensione a cui viene sottoposta la parete dell’Atrio destro. Secondo quanto ipotizzato da Bainbridge l’aumento della FC è il risultato della stimolazione delle afferenze vagali e del coinvolgimento delle efferenze Simpatiche. Tuttavia non va dimenticato che la variazione della FC non si riscontra solamente quando questa si aggira attorno a valori medi e bassi poiché nel caso di tachicardia, l’infusione di soluzioni induce bradicardia. Oltre alle variazioni della pressione e della distensione cardiaca, le variazioni della frequenza dipendono dai cambiamenti della volemia a cui è connessa la variazione della Gettata Cardiaca. L’aumento della volemia non induce solamente il Riflesso di Bainbridge ma, in certi casi, stimolando altri recettori, evoca altri riflessi che prendono decisamente il sopravvento sul riflesso della distensione Atriale e dell’aumento della Pressione Venosa Centrale. I barocettori capaci di modificare la FC sono variamente distribuiti, più precisamente, si ritrovano localizzati all’altezza dello sbocco della Vena Cava a livello dell’Atrio destro e all’altezza dello sbocco delle Vene Polmonari nell’Atrio sinistro. La via afferente di tale riflesso è rappresentata dalle fibre vagali, mentre le vie efferenti decorrono sia nel Vago che nel Simpatico che si portano a raggiungere il NSA. Poiché le vie efferenti decorrono nelle due componenti del Sistema Autonomo, è facile capire come la risposta possa presentarsi bifasica.
L’intervento dell’Atrio nella regolazione della FC è stato maggiormente chiarito a seguito dell’identificazione del fattore Natriuretico Atriale che induce sia l’aumento del volume urinario escreto che l’aumento della FC. Le variazioni del volume urinario dipendono probabilmente da una stimolazione Simpatica a livello renale, a
14
cui segue anche una inibizione nella secrezione di Vasopressina a livello dell’Ipofisi Posteriore (Aguggini, 2008).
1.3.4 Aritmia sinusale o respiratoria
Esiste inoltre una stretta interdipendenza tra Frequenza Respiratoria (FR) e FC, e tra contenuto di O2 e CO2 e FC (Aguggini, 2008).
Negli animali giovani e, in certe situazioni, nell’uomo e nell’animale adulto, si riscontra una variazione di FC connessa con le fasi della respirazione (Aguggini,
2008). Tale fenomeno può essere valutato facilmente controllando la FC in rapporto
alle fasi della respirazione, oppure controllando per via elettrocardiografica le suddette variazioni.
Questa aritmia trova giustificazione in diversi fenomeni coinvolti contemporaneamente: il primo, di sicuro significato riguarda il fatto che nell’inspirazione la diminuzione della pressione che si verifica a livello del mediastino facilita la distensione del cuore destro evocando il Riflesso di Bainbridge e favorendo nel contempo un maggior riempimento Atriale; in seconda istanza fa seguito un maggior riempimento del cuore sinistro, derivandone un Precarico maggiore che dà luogo ad un aumento della Pressione Arteriosa che riduce, in via reflessa, la FC per stimolazione dei barocettori. In questo riflesso intervengono direttamente il Vago ed i recettori polmonari che non solo regolano l’attività fasica respiratoria ma sono anche in grado di evocare risposte riflesse cardiocircolatorie. Tra questi vanno ricordati i recettori di stiramento del flusso inspiratorio e i recettori J sensibili alle variazioni dinamiche che coinvolgono i capillari polmonari.
Il Nervo Vago viene stimolato nella inspirazione e la risposta riflessa compare nella successiva espirazione, dove si riscontra a livello cardiaco un aumento della liberazione di Acetilcolina, che induce bradicardia nella inspirazione seguente. L’Acetilcolina viene immediatamente idrolizzata per cui, nella successiva inspirazione, il Vago risulta silente, venendo a prevalere l’attività Simpatica che evoca, di per se stessa, un aumento della FC.
In questa situazione alternandosi i sistemi simpatico e parasimpatico, si riscontrano a livello periferico delle variazioni di resistenza arteriolare che modificando a loro volta la pressione arteriosa, inducono variazioni cardiache.
15
Anche a livello di Midollo Allungato esistono i Centri Respiratori che influenzano i Centri Cardiaci e pertanto questi ultimi lavorano secondo oscillazioni costanti in rapporto alle varie fasi dell’attività respiratoria (Aguggini, 2008).
Normalmente, la Depolarizzazione inizia al centro o nella regione craniale del NSA, attivando per primo il tratto internodale craniale. La stimolazione vagale sposta il sito di attivazione iniziale alla regione sinusale caudale, determinando la Depolarizzazione del tratto internodale caudale, come prima via di conduzione Atrio-Ventricolare. Ciò è possibile nel cane in condizioni fisiologiche, grazie alla relativa grandezza del NSA, ed è responsabile dell’aritmia sinusale o respiratoria. In alcuni casi, l’influenza vagale può sopprimere l’attività del NSA, causando lo spostamento del “segnapassi” al tessuto automatico della regione del seno coronarico. Questo fenomeno è indicato come segnapassi errante o wandering pacemaker (Porciello et
al. 2010).
1.3.5 Ormoni e frequenza cardiaca
Tra gli ormoni aventi azione sulla FC dobbiamo considerare gli ormoni Surrenalici, i Tiroidei, gli ormoni dell’Ipofisi Anteriore, nonché l’Insulina ed il Glucagone.
L’azione degli steroidi secreti dalla Corteccia Surrenale sul miocardio è stata dimostrata in vitro, impiegando porzioni di muscolo cardiaco ottenuti da animali surrenectomizzati, riscontrando la comparsa di affaticamento in tempi più rapidi di quanto lo si verifichi negli animali normali.
In alcune specie gli ormoni secreti dalla Corteccia Surrenale favoriscono l’attività Inotropa e l’Idrocortisone sembra potenziare gli effetti delle Catecolamine.
Anche gli ormoni Tiroidei influenzano l’attività cardiaca, infatti nell’Ipotiroidismo la FC e la Gettata sono ridotte, mentre nell’Ipertiroidismo si verifica il fenomeno opposto, vale a dire tachicardia elevata, con aumentata Portata Cardiaca, extrasistolia ed aritmie, dovuta all’aumento dell’assorbimento del Ca2+ e all’idrolisi di ATP. Inoltre, la sintesi proteica indotta dagli ormoni Tiroidei favorisce la comparsa di ipertrofia cardiaca.
L’Insulina e Glucagone esercitano attività Inotropa positiva sul cuore di molti mammiferi. L’insulina probabilmente perché inibisce i legami del Ca2+ intracellulare rendendolo disponibile per l’interazione dei mio filamenti; mentre il Glucagone
16
perché ha un effetto iperglicemizzante sul sistema cardiovascolare e aumentando il livello di AMP ciclico, come le Catecolamine.
Sembra che anche gli ormoni dell’Ipofisi Anteriore esercitino una certa azione a livello cardiaco, ma questa deve essere considerata in funzione della presenza degli ormoni Tiroidei e Corticosurrenalici.
L’ormone dell’accrescimento, in combinazione con la Tiroxina svolge probabilmente una certa azione a livello cardiaco in quanto, negli animali carenti di Somatotropo, il cuore presenta bassa frequenza che viene ripristinata dalla somministrazione di Tiroxina, che da sola, in situazioni ipervolemiche, non è in grado di garantire una normale funzione cardiaca (Aguggini, 2008; Detweiller, 2002).
17
CAPITOLO 2
1 ELETTROCARDIOGRAMMA
2.1 Introduzione
Per diagnosticare lo stato di salute del cuore, i sistemi di monitoraggio cardiaco utilizzano i segnali prodotti durante ogni ciclo cardiaco. Molti tipi di segnali sono acquisiti per analizzare la funzionalità del cuore e, quindi, nella pratica clinica sono utilizzati diversi sistemi di monitoraggio cardiaco, come la fonocardiografia, l’elettrocardiografia, la fotopletismografia e la seismocardiografia (Puneet Kumar
Jainn, Anil Kumar Tiwari, 2014).
L’elettrocardiogramma, attraverso la registrazione di depolarizzazione (diffusione di uno stimolo elettrico attraverso le cellule) e ripolarizzazione (ritorno delle cellule allo stato di riposo) delle cellule eccitabili (Marr, Bowen, 2010), è la base per la comprensione delle proprietà elettrofisiologiche del cuore che sono richieste per la normale funzione cardiaca ed è lo strumento ideale per la diagnosi e la classificazione delle aritmie (Porciello et al., 2010), oltre che per lo studio della variabilità della frequenza cardiaca. Un elettrocardiogramma (ECG) può essere registrato per un periodo breve (ambulatoriale) o prolungato (ad esempio la registrazione 24 ore o "Holter"), a riposo o durante l'esercizio. La registrazione ECG durante l'esercizio fisico solitamente è riservata ai centri specializzati a causa del costo delle apparecchiature necessarie(Verheyen et al, 2010).
L’esame ECG routinario risulta però limitato nella valutazione delle aritmie sporadiche che, per la loro individuazione e analisi, richiedono monitoraggi ECG prolungati nel tempo, anche per 24-48h. Il monitoraggio Holter sopperisce a queste carenze, essendo particolarmente sensibile nel valutare l’evento aritmico, in virtù della sua lunga durata di registrazione.
Inoltre consente di valutare l’influenza del Sistema Nervoso Autonomo e dell’Ambiente (per esempio variazioni della temperatura, vari tipi di stress…) sull’attività cardiaca (Porciello et al., 2010).
18
1.2 Struttura dell’onda cardiaca
Il battito cardiaco è provocato da variazioni dello stato elettrico, depolarizzazione e ripolarizzazione, delle fibrocellule cardiache che passano dal riposo all’eccitazione. Queste variazioni di stato sono accompagnate da movimenti di cariche elettriche che possono essere derivate alla superficie del corpo divenendo quest’ultimo sede di un campo elettrico (Patteson,1996; Aguggini, 2008). L'ECG è la manifestazione grafica delle differenze di potenziale del campo elettrico intorno al cuore registrate tramite degli elettrodi, di solito collocati sulla superficie del corpo (Patteson,
1996;Aguggini,2008; Marr, Bowen,2010 ).
Si osserva quindi l’esistenza di una differenza di potenziale che è determinata da: 1) Struttura del corpo
2) Posizione del punto di rilevamento
3) Intensità e direzione delle correnti prodotte dalle variazioni di stato del cuore Posizionando gli elettrodi in punti diversi si rilevano le seguenti informazioni:
a) Nascita dell’eccitamento cardiaco e sua trasmissione
b) Propagazione dell’eccitamento nelle varie componenti cardiache e anomalie nella sua diffusione
c) Anomalie a livello delle pareti sia atriali che ventricolari d) Disturbi dell’irrorazione
e) Alterazioni di ritmo da cause patologiche, farmacologiche od elettrolitiche
(Aguggini, 2008; Marr, Bowen,2010 ).
La depolarizzazione di un piccolo gruppo di cellule, come il NSA e il NAV, non riescono a produrre sufficienti variazioni del campo elettrico cardiaco, quindi la generazione dell'impulso nel nodo del seno non è visibile sull'ECG.
La somma delle differenze di potenziale di tutte le singole cellule può essere rappresentato da un Asse Elettrico Medio (AEM), definito anche vettore cardiaco
(Marr, Bowen,2010), che indica la direzione media di attività elettrica nel cuore. La
differenza di potenziale registrata è grande quando gli elettrodi sono posti parallelamente al AEM, al contrario non può essere registrata alcuna differenza di potenziale se gli elettrodi sono posti perpendicolarmente all’asse. La combinazione di due elettrodi, uno negativo e uno positivo, tra i quali viene misurata una differenza
19
di potenziale, è chiamata derivazione. Se la direzione dell'attività complessiva elettrica depolarizzante è diretta verso l'elettrodo positivo, la deflessione all'ECG (onda) sarà positiva (verso l’alto), mentre se l'attività elettrica è rivolta nella direzione opposta all'elettrodo positivo, la deflessione sarà negativa (verso il basso). L'ampiezza della deflessione indica la grandezza del vettore ed è proporzionale alla massa di tessuto miocardico che viene depolarizzata e al voltaggio generato
(Patteson, 1996;Aguggini, 2008; Marr, Bowen,2010; Verheyenet al, 2010).
2.2.1 Descrizione delle componenti del tracciato ECG e loro significato
La rappresentazione grafica del tracciato ECG registrato può essere riportato su carta millimetrata che scorre alla velocità di 25 mm/sec, oppure su un display, a seconda del tipo di apparecchio elettrocardiografico impiegato.
La figura 2.1 mostra il tipico tracciato ECG e le sue componenti.
Quando l'impulso si diffonde attraverso gli atri, l'ECG mostra un'onda P.
Poco prima della fine della Depolarizzazione Atriale, inizia la Depolarizzazione del NAV, ma l’ampiezza di questo fenomeno è estremamente ridotta per cui il
20
complesso QRS inizia solo quando l’onda di attivazione invade il Setto Interventricolare (Aguggini, 2008).
Nel cavallo normale la posizione precisa di formazione degli impulsi nel NSA e il pattern di depolarizzazione attraverso gli atri può essere influenzata dalla frequenza cardiaca e dal sistema nervoso autonomo, che può risultare in una diversa configurazione di onde P (pacemaker vagante) anche se il NSA rimane la fonte dell'impulso (Marr, Bowen, 2010).
La morfologia dell’ onda P è variabile: può essere bifida, semplice positiva o bifasica. Quando ci sono variazioni della frequenza cardiaca, spesso cambia anche la morfologia dell'onda P, e anche le onde P successive non sono sempre identiche. Per esempio, in caso di rallentamento del battito cardiaco, l'onda P è spesso bifida: il primo picco rappresenta la depolarizzazione dell'atrio destro e il secondo quella dell'atrio sinistro. Nella sua morfologia bifasica, l'onda P è di solito del tipo positivo/negativo. Una normale onda P dovrebbe richiedere meno di 0,16 secondi
(Bonagura e Reef, 2004,).
Quando l'impulso raggiunge la giunzione atrio-ventricolare (AV) trova un ostacolo a diffondere ulteriormente poichè le cellule specializzate del NAV conducono l'impulso lentamente (Marr, Mark Bowen, 2010).
Dato che la conduzione stessa non comporta una deflessione sull'ECG, si presenta come segmento PR piatto (intenso come il tratto compreso tra la fine dell’onda P e l’inizio dell’onda Q). Nei cavalli, il normale intervallo PR può durare fino a 0,5 secondi, a causa del loro elevato tono vagale (Bonagura e Reef, 2004). Anche in animali normali, la conduzione è spesso sufficientemente rallentata o ridotta in ampiezza da provocare una marcata riduzione del tasso normale di conduzione (blocco AV di primo grado), o completa abolizione della ulteriore diffusione dell'impulso (blocco AV di secondo grado) (Marr, Bowen, 2010) .
La Ripolarizzazione Atriale non viene evidenziata in quanto viene coperta dal complesso QRS di voltaggio molto più alto, il quale rappresenta l'impulso che si diffonde molto rapidamente attraverso il fascio Hiss e le fibre del Purkinje per depolarizzare il miocardio ventricolare (Tilley, 1992; Aguggini,2008). La
21
Depolarizzazione Settale inizia sul lato sinistro del Setto e si dirige verso destra per la posizione che assume il Fascio di His, dando origine all’onda Q settale.
Segue la Depolarizzazione Apicale e immediatamente quella del Ventricolo destro, rappresentata elettrocardiograficamente dalla parte iniziale dell’onda R, la quale continua con la Depolarizzazione Ventricolare sinistra che la rende alta ed evidente. Dalla base del Ventricolo sinistro nasce un vettore istantaneo espresso dall’onda S che segna il termine della Depolarizzazione (Aguggini, 2008).
Nei cavalli anche se il complesso prende il nome "QRS", è più comune la morfologia RS o RSR e la sua durata non deve superare 0,14 secondi (Bonagura e
Reef, 2004; Marr, Mark Bowen, 2010).
Essendo completa la Depolarizzazione dei Ventricoli, non si riscontra alcun voltaggio sul tracciato e la linea non si modifica (isoelettrica, come il segmento PR) che sull’ECG si manifesta come tratto ST. A questo punto inizia l’onda di Ripolarizzaione ventricolare T, considerata come un vettore opposto alla Depolarizzazione (Aguggini, 2008), non sempre chiaramente identificabile. Poiché atri e ventricoli sono isolati tra loro da tessuto fibroso, a eccezione che a livello del NAV, la conduzione dell'impulso è molto lenta e profondamente dominata dal tono vagale (Patteson, 1996).
Nei cavalli, l'onda T è molto variabile in termini di dimensioni ed orientamento, e ciò dipende dalla frequenza cardiaca. Anche i cambiamenti “beat-to-beat” nell'intervallo RR spesso influenzano la morfologia dell'onda T che non risulta utile nella diagnosi di malattia cardiaca (Patteson, 1996), ma può esserlo per distinguere un battito ventricolare normale/anormale da artefatti (che non hanno onde T).
L'intervallo QT nei cavalli normali non dura più di 0,58 secondi (Bonagura e Reef,
2004).
E 'essenziale rendersi conto che il sistema delle fibre del Purkinje è molto più esteso nei cavalli che negli esseri umani e negli animali di piccola taglia, pertanto, il complesso QRS equino fornisce poca o nessuna informazione circa la dimensione del cuore o l'origine esatta di un battito ectopico, ma solo informazioni riguardanti la frequenza cardiaca e il ritmo (T. Verheyenet al, 2010) .
22
Si può affermare, quindi, che l’identificazione delle forme caratteristiche dell’onda permette al clinico di rilevare quando si verificano la depolarizzazione e ripolarizzazione degli atri e dei ventricoli, la tempistica delle onde, la relazione tra queste, la morfologia e la durata dei complessi e degli intervalli, consentendo la deduzione dell'origine e del percorso dell'impulso (Marr, Bowen, 2010).
2.3
Derivazioni
Come già accennato, l'ECG è la manifestazione grafica delle variazioni di voltaggio del campo elettrico intorno al cuore (differenza di potenziale) registrate tramite degli elettrodi, di solito collocati sulla superficie del corpo (Patteson,
1996;Aguggini,2008; Marr, Bowen,2010 ).
Nel corso degli anni sono stati sviluppati una serie di sistemi per registrare questo campo elettrico, in modo da poter valutare il processo di conduzione e per poter ottenere alcune informazioni circa la direzione e la grandezza del vettore cardiaco
(Marr, Bowen, 2010).
Le connessioni convenzionali usate per ottenere un tracciato elettrocardiografico, vengono definite derivazioni e si distinguono in: DERIVAZIONI DEGLI ARTI (periferiche bipolari standard o “di Einthoven”), DERIVAZIONI DEGLI ARTI AMPLIFICATE, e DERIVAZIONI PRECORDIALI (meno usate negli animali). Quest’ultime sono poste sul torace e permettono di esaminare il cuore sul piano orizzontale, avendo una precisa indicazione della parte destra e sinistra e del movimento dell’onda di Depolarizzazione (Aguggini, 2008).
2.3.1 Derivazioni periferiche bipolari (Standard o di Einthoven)
Questi tipi di derivazioni si ottengono posizionando 3 elettrodi: uno a livello dell’arto anteriore destro, uno sull’arto anteriore sinistro e il terzo sull’arto posteriore sinistro. Registrando con il galvanometro le variazioni di potenziale tra i tre punti (connettendoli a coppie) si osservano le deflessioni dell’onda elettrica che ne risultano. Unendo le tre linee di derivazione si ottiene un triangolo nel quale il cuore risulta situato al centro (Aguggini,2008).
23
Einthoven introdusse la convenzione di considerare il piano frontale come un cerchio, diviso in due metà, una superiore e una inferiore. Questa tecnica, comunemente usata nei piccoli animali e nell'uomo, può essere sfruttata anche nei cavalli. Ma per ovviare al fatto che, nei cavalli, il cuore non si colloca nel centro di un triangolo formato dagli arti, sono stati progettati dei sistemi che valutano il vettore cardiaco in tre dimensioni, misurando il campo elettrico in tre piani semiortogonali. Nei cavalli la derivazione usata più frequentemente è la “apice-base” che consiste nel posizionare l'elettrodo positivo all'apice cardiaco, l'elettrodo negativo nel terzo inferiore del solco giugulare destro o nella parte superiore destra della spina scapolare, mentre il terzo elettrodo (neutro) viene posto in qualsiasi sito lontano dal cuore.
Un altro tipo di derivazione usata nei cavalli è quella a Y, nella quale l'elettrodo negativo è fissato sopra il manubrio dello sterno, l'elettrodo positivo sul processo xifoideo dello sterno, mentre il terzo elettrodo viene posto in qualsiasi sito lontano dal cuore (Aguggini, 2008; Marr, Bowen, 2010).
Scheffer et al (1995) hanno valutato un ulteriore metodo per il monitoraggio continuo dell’elettrocardiogramma, sia in cavalli a riposo che durante l’esercizio fisico. Hanno registrato due derivazioni bipolari, la prima tra lo xifoide e il lato sinistro del garrese (più stabile durante l’esercizio fisico), la seconda tra il torace ventrale e il torace dorsale del lato sinistro (più efficace durante il riposo in box).
Inoltre, Marr e Bowen, in “Cardiologia del cavallo” nel 2010, affermano che per ottenere un tracciato ECG ambulatoriale diagnostico, sia frequente l’uso di una derivazione “toracica” dove gli elettrodi sono posizionati sotto un sottopancia o un fascione, garantendo un appropriato contatto tra gli elettrodi e la pelle, riducendo così gli artefatti da movimento, e fornendo anche un punto di attacco del dispositivo. La posizione della derivazione è tale che l’elettrodo positivo è posto nella parte superiore del torace sinistro a livello dei corpi vertebrali, mentre l’elettrodo negativo è posto sullo sterno, permettendo la registrazione di un QRS negativo, e onde P e T positive.
24
2.3.2 Derivazioni degli arti amplificate
Sono derivazione unipolari (5) che registrano le variazioni tra il potenziale esistente a livello di arto anteriore destro, anteriore sinistro e posteriore sinistro e un altro punto in cui l’attività elettrica non varia significativamente durante l’attività cardiaca. Si dicono amplificate poiché si ricorre a un particolare circuito elettrico inserito nell’elettrocardiografo che fa ottenere un tracciato di ampiezza aumentata nei confronti delle vecchie derivazioni unipolari (di Wilson).
Si cortocircuitano tutti e tre gli arti applicandovi una resistenza da 5000 Ohms per ognuno (Aguggini, 2008).
2.3.3 Derivazioni precordiali unipolari
Le derivazioni precedentemente descritte permettono di esaminare il cuore posto su un piano frontale. Wilson, considerando la posizione che il cuore assume nella cavità mediastinica, collocò un elettrodo indifferente a potenziale 0 al centro del cuore, e altri elettrodi esploranti posizionati a livello toracico in 6 punti, ottenendo così 6 derivazioni. Queste derivazioni, usate nell’uomo, permettono di registrare l’attività elettrica del cuore sul piano frontale ed orizzontale, e dedurre tutte le situazioni di normalità e patologiche esistenti a livello cardiaco (Aguggini, 2008).
25
CAPITOLO 3
3 VARIABILITA’ DELLA FREQUENZA CARDIACA (HRV)
3.1 Introduzione alla variabilità della frequenza cardiaca
La “Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology, nel 1996, analizzando il fenomeno oscillatorio nell’intervallo tra battiti cardiaci consecutivi e le oscillazioni tra frequenze cardiache istantanee consecutive, definì la Variabilità della Frequenza Cardiaca (Heart Rate Variability – HRV) come le variazioni che hanno luogo sia nella frequenza cardiaca istantanea che negli intervalli RR. Nei soggetti sani gli intervalli di tempo tra i battiti cardiaci non hanno la stessa durata, ma variano costantemente e sono alla base della variabilità della frequenza cardiaca, la quale, insieme alla frequenza cardiaca, riflette la regolazione dell’attività cardiaca da parte del Sistema Nervoso Parasimpatico, dei rami Simpatici del SNA e del sistema neuroendocrino (Marr, Bowen, 2010). Una diminuzione della HRV viene interpretata come un aumento dell’attività simpatica, riduzione dell’attività parasimpatica o una combinazione di entrambe (Sayers, 1973; von Borrel et al, 2007; Ille et al 2014), essendo considerata una misura indiretta dell’interazione simpato-vagale a livello del NSA.
Inoltre, è stato confermato che maggiore è la variabilità della frequenza cardiaca, più è sano il cuore, infatti sia l’aritmia sinusale respiratoria che il blocco atrioventricolare di secondo grado sono considerati normali aritmie fisiologiche, essendo il risultato del controllo autonomico del cuore (Marr, Bowen, 2010). È ben noto, infatti, che alterazioni nell’equilibrio autonomico caratterizzate da un incremento dell’attività simpatica possono influenzare l’elettrofisiologia cardiaca, aumentando così la suscettibilità ad aritmie ventricolari e morte cardiaca improvvisa. Nel cuore malato la presenza di un rimodellamento neuronale offre il back- ground fisiopatologico per lo squilibrio dell’attività autonomica. (Task Force of ESC & NASPE, 1996; La Rovere,
2007).
Gli effetti del sistema simpatico e parasimpatico influenzano in maniera predominante la FC intrinseca e determinano la FC istantanea, in quanto l’attivazione
26
parasimpatica riduce la FC, mentre l’attivazione simpatica la aumenta. Inoltre l’effetto di una componente è associato ad un aumento dell’attività della sua controparte, fenomeno che è stato definito come “antagonismo accentuato”, inteso come la condizione in cui l’aumento, ad esempio, dell’attivazione parasimpatica determina non solo una riduzione della frequenza cardiaca, ma anche la contemporanea attivazione della componente simpatica con aumento della frequenza cardiaca ( Lahiri et al, 2008).
Papaioannou et al (2013) hanno ricercato l’origine intracardiaca della variabilità della frequenza cardiaca. Nei loro studi sperimentali sono riusciti a trovare l’interrelazione tra le “funny current” (If) e la variabilità della frequenza cardiaca durante stati endotossiemici, suggerendo così l’associazione tra la ridotta variabilità cardiaca e le cellule pacemaker alterate durante la sepsi a causa delle modificate proprietà delle membrane cellulari e del conseguente rimodellamento della corrente ionica.
Molti studi su vasta scala hanno dimostrato che il monitoraggio della variabilità cardiaca può essere un buon metodo per diagnosticare patologie cardiache negli esseri umani (Task Force of ESC & NASPE, 1996). Pertanto, la comprensione di questo metodo può essere utile per migliorare ulteriormente la capacità del veterinario di valutare il rischio sia nei cavalli con malattie cardiache ( Marr,
Bowen,2010), ma anche in caso di sepsi e sindrome da disfunzione multi-organo
(MODS) ( Papaioannou et al, 2013).
3.2 Misurazione e metodi
3.2.1 Metodi di analisi lineare e non lineare
La variabilità del ritmo cardiaco può essere valutata in due modi: calcolando un indice mediante operazioni statistiche sull’intervallo RR, analisi nel dominio del tempo, oppure mediante l’analisi spettrale di insieme di intervalli RR, dominio della frequenza. Entrambi i metodi richiedono un’accurata tempificazione delle onde R, ma l’analisi può essere effettuata sia su brevi segmenti di elettrocardiogramma (da 0,5 a 5 minuti) che su registrazioni ECG 24-ore.
27
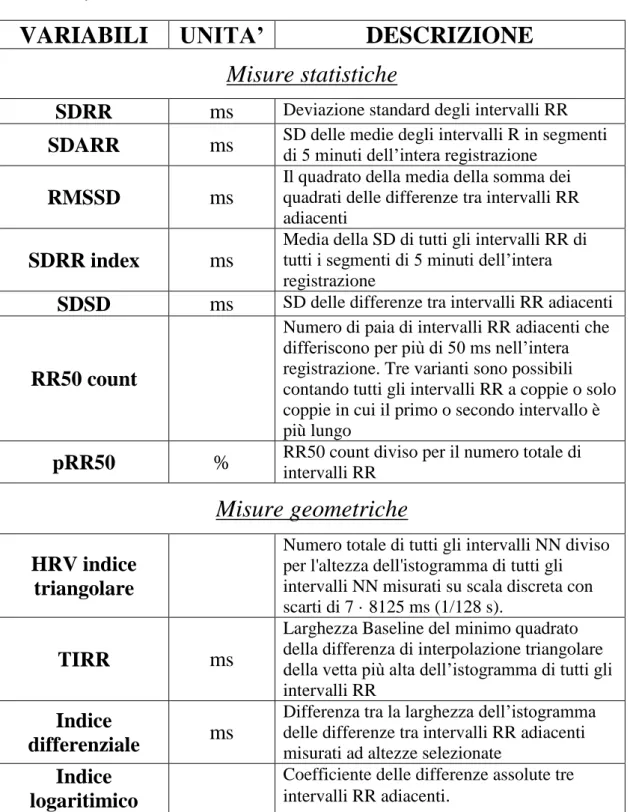
Utilizzando metodi statistici o metodi geometrici è possibile ricavare diverse misure della HRV nel dominio del tempo (Tabella 3.1). Le misure raccomandate sono: 1. SDRR (deviazione standard degli intervalli RR): è una stima complessiva della HRV
2. Indice triangolare della HRV (numero totale degli intervalli RR diviso per l’altezza dell’istogramma di tutti gli intervalli RR): è una stima complessiva della HRV
3. SDARR (SD della media degli intervalli RR in tutti i segmenti di 5 minuti dell’intera registrazione): è una stima delle componenti a lungo termine della HRV 4. RMSSD (radice quadrata della media dei quadrati delle differenze tra intervalli RR): è una stima delle componenti a breve termine della HRV
(Traina et al, 2010).
Questi parametri possono essere raggruppati in due tipi di indici della HRV: indici beat-to-beat o di variabilità a breve termine (STV), che rappresentano variazioni veloci del ritmo cardiaco (influenzati dall’aritmia sinusale), e indici di variabilità a lungo termine (LTV), fluttuazioni più lente (minori di 6 per minuto, influenzate dalla termoregolazione e dai barocettori).
L’analisi nel dominio della frequenza prevede vari metodi spettrali di analisi del tacogramma (il quale rappresenta graficamente gli intervalli RR o NN dei battiti consecutivi della registrazione analizzata), classificati come parametrici e non parametrici. L’analisi della densità della potenza spettrale (PSD) permette di ottenere le informazioni di come la potenza (variazione) si distribuisce in funzione della frequenza e, indipendentemente dal metodo utilizzato, si può ottenere solamente una stima della reale PSD del segnale, utilizzando un corretto algoritmo matematico. Il principale vantaggio che offre l’analisi spettrale è la possibilità di studiare le singole componenti oscillatorie (Traina et al,2010).
I vantaggi dei metodi non parametrici, che utilizzano per lo più la trasformata rapida di Fourier (FFT), sono la semplicità dell’algoritmo e l’elevata velocità di elaborazione, mentre i vantaggi dei metodi parametrici, con il modello auto
28
regressivo, sono la facilità di distinguere le diverse componenti spettrali il cui profilo è regolare, la facilità di elaborazione successiva dello spettro che permette il calcolo automatico della potenza delle componenti a bassa ed alta frequenza con una facile identificazione della frequenza centrale di ciascuna componente, e un’accurata stima della PSD anche in un piccolo numero di campioni in cui si suppone che il segnale ECG si sia mantenuto stabile. Nei metodi parametrici bisogna verificare l’adeguatezza del modello scelto e la sua complessità (l’ordine del modello matematico).
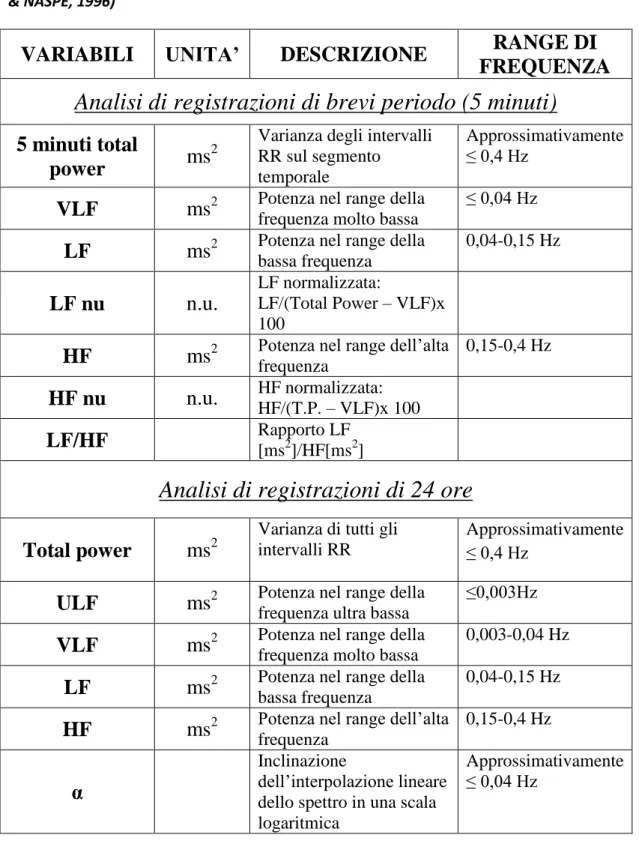
Le componenti spettrali vengono ricavate con registrazioni ECG di breve o lunga durata. Con le registrazioni ECG di breve durata (2-5 minuti) vengono individuate tre principali componenti spettrali:
1. Componenti a frequenza molto bassa “Very Low Frequency” (VLF): frequenze comprese fra 0.01 e 0.04 Hz; la banda VLF dipende in parte all'attività del sistema nervoso simpatico e si modifica con le variazioni nella termoregolazione, dei chemorecettori, del sistema renina-angiotensina (ChuDuc et al, 2013), ed è influenzata, in ambito psicologico, dalle preoccupazioni e dai pensieri ossessivi; tuttavia, l’interpretazione fisiologica della componente VLF non è ben definita 2. Componenti a frequenza bassa “Low Frequency” (LF): frequenze comprese fra 0.04 e 0.15 Hz; la banda LF dipende principalmente dall'attività del sistema nervoso simpatico e dall'attività di regolazione dei barocettori
3. Componenti ad alta frequenza “High Frequency” (HF): frequenze comprese fra 0.15 e 0.40 Hz; La banda HF è espressione dell'attività del sistema nervoso parasimpatico. Questa zona di frequenze subisce una elevata influenza da parte del ritmo e profondita’ della respirazione (Task Force of ESC & NASPE, 1996)
L’interpretazione finale dei dati si basa sui parametri "Deviazione Standard" del tacogramma o anche il parametro "Total Power" (che è proporzionale al quadrato della deviazione standard).
Entrambi questi parametri esprimono il grado complessivo della variabilità della frequenza cardiaca, quindi l’attività complessiva del sistema Simpatico sommata al Parasimpatico.
29
I valori della Power sono spesso espressi anche nella loro forma logaritmica e secondo una delle più avanzate ditte Americane nel settore della HRV, la Cardiologix, nel loro software HeartScanner sono i seguenti:
Frequenza Cardiaca = 59 - 96 b/m Dev. Standard = 40 - 110 ms Ln (Total Power) = 7.2 - 9.1 Ln (Power VLF) = 6.6 - 8.6 Ln (Power LF) = 5.9 - 8.0 Ln (Power HF) = 3.8 - 7.0 Rapporto LF/HF = 0.6 - 10
Il rapporto fra Simpatico e Parasimpatico viene ricavato dal rapporto LF/HF ed il bilanciamento deriva da una delle 9 combinazioni possibili del logaritmo della Power delle bande LF e HF:
Zona 1: LF = basso e HF = basso
Viene mantenuto un bilanciamento fra il simpatico e il parasimpatico con un basso livello di attività di regolazione di entrambi i sistemi.
Zona 2: LF = basso e HF = normale
Moderata dominanza del sistema parasimpatico con un basso livello del simpatico e normale livello di regolazione del parasimpatico.
Zona 3: LF = basso e HF = alto
Significa dominanza del sistema parasimpatico con un basso livello del simpatico ed alto livello di regolazione parasimatica
Zona 4: LF = normale e HF = basso
Moderata dominanza del sistema nervoso simpatico con un normale livello del simpatico e basso livello di regolazione del parasimpatico.
Zona 5: LF = normale e HF = normale
Viene mantenuto un bilanciamento fra il simpatico ed il parasimpatico con un normale livello della loro attività regolatrice.
Zona 6: LF = normale e HF = alto
Moderata dominanza del sistema parasimpatico con normale livello del simpatico ed alto livello di regolazione del parasimpatico.
30
Zona 7: LF = alto e HF = basso
Significativa dominanza del sistema simpatico con elevato livello del simpatico e basso livello di regolazione del parasimpatico.
Zona 8: LF = alto e HF = normale
Moderata dominanza del sistema simpatico con alto livello del simpatico e normale livello di regolazione del parasimpatico.
Zona 9: LF = alto e HF = alto
Viene mantenuto un bilanciamento fra il simpatico ed il parasimpatico con elevato livello di attività di regolazione di entrambi i sistemi.
Un incremento della LF si può osservare durante il tilt test a 90°, stress mentale, moderata attività fisica in soggetti sani, durante moderata ipotensione, attività fisica e occlusione di arterie coronarie o della arterie carotidi comuni in cani coscienti
(Malliani e al,1991;Rimoldi et al, 1990; Task Force of ESC & NASPE, 1996).
Al contrario, un aumento della HF è indotto dalla respirazione controllata, stimolazione fredda del viso e stimoli rotazionali (Malliani et al,1991;Kamath e
Fallen, 1993; Task Force of ESC & NASPE, 1996).
Per le difficoltà di interpretazione fisiologica la componente VLF, ricavata da registrazioni di durata inferiore a 5 minuti, non viene presa in considerazione nell’analisi della PSD di registrazioni ECG di breve durata. Le misurazioni della potenza (P) delle componenti VLF, LF e HF sono in genere eseguite in valori assoluti di P (ms2). Le componenti LF e HF possono anche essere misurate in unità normalizzate (nu) che rappresentano il valore relativo di ciascuna componente in proporzione alla potenza totale meno la componente VLF. La rappresentazione di LF e HF in nu mette maggiormente in evidenza il comportamento controllato e bilanciato delle due componenti del sistema nervoso autonomo; inoltre, la normalizzazione tende a ridurre gli effetti delle variazioni della potenza totale sui valori delle componenti LF e HF. Tuttavia, per descrivere completamente la distribuzione della potenza nelle componenti spettrali, le nu dovrebbero essere confrontate con i valori assoluti di P (Traina et al, 2010).
31
A riposo le due principali componenti hanno una potenza analoga e sono individuabili nelle frequenze basse ed alte. Durante il “tilt test” (“Head Up Tilt Test” o “test di stimolazione ortostatica passiva” impiegato per monitorare la FC e la pressione arteriosa sistemica durante il passaggio tra posizione sdraiata e posizione eretta), invece, la componente LF diviene dominante, ma poiché la variazione totale si riduce, la P di LF non è modificata rispetto alle condizioni di riposo; la normalizzazione però, permette di evidenziare la predominanza della componente LF e la riduzione di HF secondarie al tilt test.
Con le registrazioni ECG di lunga durata l’analisi spettrale può essere eseguita sulla sequenza degli intervalli RR di un intero periodo di 24 ore, e in questo caso il risultato comprende anche la componente a frequenza “ultra” bassa “Ultra Low Frequency” (ULF).
Dal punto di vista dei requisiti tecnici, per poter ottenere tutti i parametri sopra esposti, il segnale ECG deve essere stabile, per permettere una corretta individuazione del punto di riferimento dell’onda R e “pulito” da artefatti. Disturbi di conduzione intraventricolare, battiti ectopici, eventi aritmici, dati persi e altre interferenze influenzano la stima della PSD della HRV, ma, utilizzando un’appropriata interpolazione, si possono correggere gli intervalli RR anomali per permettere una corretta analisi della PSD. Le registrazioni ECG di breve durata sono preferite in quanto risultano prive di battiti ectopici, dati non rilevati o interferenze. La scelta dei modelli di analisi influenza l’analisi spettrale e, tra le diverse possibilità, il modello parametrico autoregressivo rende più immediata l’analisi e l’interpretazione dei risultati della HRV (Traina et al, 2010).
La HRV è influenzata dai valori assoluti della frequenza cardiaca: durante l’esercizio, e in generale ogni volta che la frequenza cardiaca aumenta, la HRV (e quindi anche la potenza delle oscillazioni) decresce. Alcuni ricercatori hanno tentato di risolvere questo problema esprimendo la potenza delle oscillazioni come percentuale della potenza totale (unità normalizzate: nu) oppure usando il rapporto LFRR/HFRR (Malliani et al,1991), considerano le LFnu come un indice del SNS, le HFnu come un indice del SNP e il rapporto LFRR/HFRR come un indice del cosiddetto “bilancio simpatovagale”. In questo modo, un aumento del rapporto indica la predominanza dell’attività simpatica, mentre una diminuzione indica la
32
predominanza dell’attività parasimpatica. In ogni modo, mentre è largamente accettata l’ipotesi che le HFRR sono di origine vagale (Eckberg, 1983), al contrario, l’origine delle LFRR è ancora oggetto di discussione (Grasso et al, 1997;Houle e
Billman, 1999). Durante l’esercizio, parallelamente all’aumento dell’intensità e
quindi alla riduzione della variabilità, l’aumento progressivo della percentuale delle HFRR è determinato da meccanismi non neurali (Casadei et al,1995). Per questo motivo il rapporto LFRR/HFRR aumenta durante stress ortostatico per poi diminuire durante l’esercizio (Grasso et al, 1994). Di conseguenza, l’analisi spettrale del periodo cardiaco durante l’esercizio presenta importanti limitazioni metodologiche, e nessuna variabile (LFRR HFRR e LFRR/HFRR) è caratterizzata da un rapporto diretto con l’intensità dell’esercizio (Terziotti et al, 2000).
Concludendo, i metodi di analisi nel dominio della frequenza sono più adatti dei metodi nel dominio del tempo per studiare le registrazioni di breve durata, poiché per valutare la componente HF è sufficiente circa 1 minuto di registrazione, e per la componente LF circa 2 minuti. Per standardizzare gli studi fisiologici o clinici si utilizzano registrazioni di 5 minuti eseguite in condizioni fisiologiche stabili e valutate con i metodi nel dominio della frequenza, mentre l’utilizzo della media di periodi successivi di registrazione di 5 minuti ha dei limiti, in quanto il dato può essere influenzato dalle variazioni fisiologiche del periodo cardiaco durante i diversi momenti di registrazione (Traina et al, 2010).
Nella Task Force del 1996 si affronta l’argomento dei metodi non lineari per l’analisi della HRV (Tabella 3.2). Gi autori affermano che anche i fenomeni di tipo non-lineare risultanti da interazioni complesse tra variabili emodinamiche, elettrofisiologiche e umorali probabilmente sono coinvolti nei meccanismi di regolazione autonomica e implicati nella genesi dell’HRV. I parametri che sono stati utilizzati per misurare le proprietà non-lineari di HRV includono la scala 1/f dello spettro di Fourier (Kobayashi e Musha, 1982; Saul et al,1988), la scala esponenziale H, e la Coarse Graining Spectral Analysis (CGSA) (Yamamoto e Hughson, 1991). La Rovere et al (2007), evidenziano che negli ultimi dieci anni, una schiera di metodi e algoritmi non-lineari applicata all’analisi delle serie RR ha mostrato che essi possono rilevare e misurare aspetti peculiari delle dinamiche del ritmo cardiaco che non sono presi in considerazione dalle tecniche lineari (Voss et al, 1996; Wessel et
33
al,2000; Yamada et al, 2000). Infatti, queste ultime valutano principalmente
l’ampiezza della variabilità, mentre l’oggetto dei metodi non-lineari sono le proprietà di correlazione e la complessità. A ogni modo, la relazione tra indici non lineari e lineari dell’HRV deve essere ancora chiarita, ma recentemente, un’analisi di tipo simbolico delle dinamiche non-lineari è risultata in grado di rilevare variazioni della modulazione vagale e simpatica indotte da condizioni sperimentali e farmacologiche
(Guzzetti et al, 2005).
ChuDuc et al (2013), sostengono che i metodi e gli indici tradizionali non hanno le capacità per individuare le sottili variazioni della frequenza cardiaca poiché non è stazionaria (Gusatv e Krastic, 2003) e il sistema cardiovascolare è molto complesso per essere di natura lineare, quindi l’unico modo per capire la HRV è utilizzare metodologie prevalentemente non lineari. Inoltre affermano che per l’analisi HRV di aritmia, bisognerebbe adottare un concetto basato su fluttuazioni rapide che possono mostrare i cambiamenti nell’attività simpatica e vagale (Denton et al, 1990).
3.3 Artefatti e Algoritmi
La valutazione della HRV richiede l’estrazione degli intervalli RR, di solito eseguita estrapolando il complesso QRS da dati ECG digitalizzati. Anche un singolo artefatto può causare risultati non attendibili della HRV (Kaufmann et al, 2011), ma filtri automatici che escludono alcuni intervalli della sequenza originale RR non devono sostituire la modifica manuale, dato che è noto che non sempre sono affidabili e possono portare a effetti indesiderati e potenziali errori (Task Force of ESC &
NASPE, 1996).
Sono stati sviluppati diversi approcci, dalla semplice correzione visiva ad algoritmi più sofisticati, per correggere i dati dagli artefatti che si verificano a causa dell’errata identificazione dei complessi QRS e dei battiti ectopici.
Gli artefatti possono verificarsi a seguito di scarsa conduttanza tra elettrodo e pelle, malfunzionamento delle attrezzature, rumori da potenziali d’azione muscolari ed interferenze elettromagnetiche ambientali (Kamath et al, 1995).L’importanza di individuare e correggere gli artefatti e i battiti ectopici nei dati registrati è stata dimostrata sia nell’uomo che negli animali (Von Borell et al, 2007), in quanto la
34
presenza anche di un solo errore può influire in modo significativo l’esito delle analisi nel dominio del tempo e della frequenza (Berntson e Stowell, 1998; Storck et
al, 2001). Gli effetti degli artefatti non sono correlati a un metodo analitico specifico,
infatti sono evidenti sia nell’analisi nel dominio del tempo che della frequenza, ma i risultati sottolineano l’importanza della rilevazione degli artefatti e la risoluzione per lo studio della HRV (Berntson e Stowell, 1998). Per eliminare quanto più possibile gli artefatti, sono stati realizzati degli algoritmi che filtrano il segnale ECG ad una frequenza di 50 Hz, come raccomandato dalla Task Force of ESC & NASPE nel 1996.
Purtroppo questi algoritmi sono studiati per essere usati sui segnali ECG umani e di animali di piccola taglia, mentre per il cavallo non sono ancora stati approvati algoritmi specie-specifici, così che la valutazione visiva resta fondamentale quando si effettua l’analisi dei tracciati ECG equini.