1. INTRODUZIONE
Le malattie cardiache e renali sono frequenti e, spesso, coesistono determinando un significativo aumento di mortalità e morbidità, della difficoltà di gestione dei pazienti e dei costi sanitari.
Il “cross-‐talk” che esiste tra cuore e rene ha suscitato negli ultimi anni un crescente interesse, tanto da far ipotizzare l’esistenza di una sindrome cardio-‐renale definita come “una disfunzione combinata di cuore e rene in cui l’alterazione acuta o cronica di uno dei due organi può indurre alterazioni acute o croniche anche nell’altro”.
Il tempestivo inquadramento di una concomitante disfunzione renale in un paziente con insufficienza cardiaca è di fondamentale importanza non solo per il suo impatto prognostico, ma anche perché l’uso di molti presidi terapeutici, comunemente usati per il trattamento dello scompenso, aumenta il rischio di eventi avversi.
La riduzione della funzione renale è un fattore prognostico negativo indipendente nei pazienti con scompenso cardiaco; tale fattore, però, è spesso mal valutabile poiché sotto-‐rappresentato. La maggior parte dei dati, infatti, derivano da studi che hanno incluso gruppi selezionati di pazienti, sia per quanto riguarda la patologia cardiaca, sia per quanto riguarda la malattia renale (esclusione dei soggetti con valori di creatinina > 2-‐2,5 mg/dL), oltre che per una netta prevalenza di soggetti di sesso maschile.
Nonostante gli evidenti limiti metodologici, da molti studi è emersa una correlazione significativa e inversamente proporzionale tra funzione emuntoria renale e mortalità per tutte le cause.
2. SCOMPENSO CARDIACO: “A CLINICAL SYNDROME”
2.1 Definizione
Lo scompenso cardiaco è una sindrome clinica molto complessa data dal risultato di anomalie funzionali o strutturali: può essere determinata da alterazioni nel riempimento cardiaco o nell’eiezione di sangue. Le manifestazioni cardine dello scompenso cardiaco sono la dispnea, l’astenia, la limitazione della tolleranza all’esercizio fisico, la ritenzione di fluidi: la risultate di questo corteo sintomatologico induce congestione (polmonare e/o splacnica) e/o edema periferico
1.
2.2 Epidemiologia
Si stima che l’incidenza dello scompenso cardiaco negli Stati Uniti, rimasta sostanzialmente stabile negli ultimi decenni, sia di 650000 nuovi casi diagnosticati ogni anno, per un totale di circa 5,1 milioni
di persone affette 2. L’incidenza varia con l’età: approssimativamente
il 2% della popolazione tra i 60-‐70 anni sviluppa tale patologia, questa percentuale sale drasticamente al 10% per i soggetti over 70 anni 3. Proiettandosi verso il futuro si calcola che, nel 2050, un
americano su cinque avrà più di 65 anni: poiché la prevalenza è maggiore in questa fascia di età, il numero dei pazienti con
insufficienza cardiaca è destinato ad aumentare drasticamente 4.
Lo studio ARIC è riuscito a dimostrare disparità nella prevalenza dello scompenso cardiaco: l’incidenza, calcolata per 1000 persone-‐
anno, è diminuita nelle donne bianche, mentre risulta aumentata nei maschi di razza nera, questi ultimi però hanno una migliore mortalità a 5 anni rispetto ai bianchi dello stesso sesso 5.
L’analisi dei casi ospedalieri, dimessi in Italia nel 2011, mostra che i ricoveri per scompenso cardiaco corrispondono al 2,6% (trend in aumento rispetto al 2003 dove si assestava a 1,6%) del totale dei ricoveri effettuati in tutte le discipline, con una degenza media di 9,1 giorni ed un numero di dimissioni pari a 199658 soggetti (per un totale di 1,8 mln di giorni di degenza) diventando quindi la seconda
patologia per numerosità di dimissioni 6. Questi numeri sono
imputabili alla tipologia di attività ospedaliera (ordinaria o per acuti), alla fragilità e gravi comorbilità che affliggono il paziente con scompenso cardiaco. I pazienti ospedalizzati inoltre sono ad alto rischio per tutte le cause di riospedalizzazione, con un tasso di riammissione pari al 45% entro 6 mesi dalla dimissione (studio TEMISTOCLE, hearT failurE epideMIological STudy FADOI-‐ANMCO in itaLian pEople) e una spesa annua per pazienti ospedalizzati, e non, di 400 milioni di euro, pari al 2% della spesa sanitaria globale 7.
2.3 Mortalità
Il tasso di mortalità assoluta per i pazienti con insufficienza cardiaca
rimane approssimativamente al 50% a 5 anni dalla diagnosi 8. Nello
studio ARIC la percentuale dei casi fatali di scompenso cardiaco a 30 giorni, 1 anno e 5 anni si attesta rispettivamente al 10,4%, 22% e 42,3% 5. Un altro studio ha analizzato la sopravvivenza a 5 anni
(classificazione dello scompenso in stadi dell’ACC/AHA) risultando
rispettivamente 97%, 96%, 75% e 20% 9.
2.4 Classificazione
2.4.1 Classificazione in base alla FE
La migliore classificazione utilizzata nell’insufficienza cardiaca si basa sulla misurazione della Frazione di Eiezione (FE) del ventricolo sinistro (matematicamente si tratta del rapporto tra stroke volume, che è il volume telediastolico meno il volume telesistolico, con il volume telediastolico). Possiamo dedurre quindi che più severa è la
disfunzione sistolica e maggiore sarà la riduzione della FE (Fig. 1) 10.
La Frazione di Eiezione è dunque estremamente importante nello scompenso, non solo perché si tratta di un parametro prognostico, ma perchè permette di distinguere due categorie di malattia: Scompenso Cardiaco con riduzione di FE (HFrEF, Scompenso Cardiaco Sistolico) definito quando questo parametro è ≤40% e Scompenso Cardiaco con FE preservata (HFpEF, Scompenso Cardiaco Diastolico) se > 40% 11.
Fig. 1 -‐ Riduzione della Frazione di Eiezione in base al tempo [Tratto da: Longo DL et al., Harrison’s Principles of Internal Medicine, 18th Ed., 2012;234:1406-‐1407].
2.4.2 Classificazione in base al tempo
I pazienti che hanno Scompenso Cardiaco da tempo sono definiti cronici. I pazienti che hanno segni e sintomi i quali, per una frazione di tempo, non variano vengono definiti stabili. Se il paziente, precedentemente definito come cronico e stabile, ha un deterioramento della funzionalità è definito come scompensato, questo può avvenire rapidamente (paziente con scompenso cardiaco acuto) e può spesso necessitare di ricovero ospedaliero. Scompenso cardiaco congestizio è un termine utilizzato, soprattutto negli USA, per descrivere un paziente acuto o cronico che presenta evidenti segni di congestione (ad esempio ritenzione di sodio e acqua).
2.4.3 Classificazione in base alla gravità della
sintomatologia
La classificazione stilata dalla New York Heart Association (NYHA) è utilizzata spesso in molti trials randomizzati ed è utile per descrivere quei pazienti che beneficiano realmente di quella determinata terapia.
Pazienti con NYHA di classe I non hanno sintomi attribuibili alla malattia cardiaca; invece i pazienti con NYHA II, III, IV vengono rispettivamente definiti come lievemente, moderatamente e gravemente sintomatici (Fig. 2) 12.
Tale classificazione è fortemente correlata con la severità dei sintomi e la prognosi dei pazienti: è infatti considerata un predittore
Fig. 2 -‐ Classi NYHA [Adattata da: NYHA, Diseases of the Heart and Blood Vessels: Nomenclature and Criteria for Diagnosis, 6th Ed. 1964].
Esiste inoltre una distinzione funzionale, creata da AHA e ACC, per definire la progressione dello scompenso cardiaco in base ai fattori di rischio e alle anomalie strutturali ad esso correlate: stadio A, B, C e D (Fig. 3). Questa suddivisione viene maggiormente utilizzata per distinguere l’azione terapeutica da attuare verso i pazienti.
Fig. 3 -‐ I quattro stadi dello scompenso cardiaco [Tratta da: Hunt SA et al., J Am Coll Cardiol. 2001;38:2101–2113].
2.4.4 Classificazione in base al quadro clinico
La patologie che causano scompenso cardiaco possono compromettere esclusivamente o prevalentemente una delle sezioni (destra o sinistra) del cuore. Se lo scompenso è dovuto alla compromissione del ventricolo e/o atrio sinistro l’aumento della pressione venosa e gli edemi si verificano nel circolo polmonare (Scompenso Cardiaco Sinistro). Se viceversa esso è dovuto alla compromissione del ventricolo e/o dell’atrio destro gli stessi processi patologici hanno luogo sulla circolazione venosa sistemica (Scompenso Cardiaco Destro).
Altra distinzione va fatta tra Scompenso Cardiaco Anterogrado e Scompenso Cardiaco Retrogrado: questi termini si riferiscono, rispettivamente, alla prevalenza dei sintomi e segni di scompenso dovuti alla ridotta perfusione periferica conseguente alla riduzione della gittata cardiaca (Anterogrado) o di sintomi e segni di scompenso indotti dall’ipertensione venosa a monte della camera ventricolare insufficiente (Retrogrado).
Per ultimo distinguiamo lo Scompenso Cardiaco a Bassa Gittata: la classica insufficienza cardiaca associata a riduzione della portata cardiaca dallo Scompenso Cardiaco ad Alta Gittata: il quale si manifesta perché l’organismo richiede un flusso ematico molto superiore al normale che il cuore, pur non avendo alterazioni patologiche, non riesce a garantire.
2.5 Eziologia
Qualsiasi alterazione che porta ad una anomalia strutturale o funzionale del ventricolo sinistro e/o destro può predisporre il paziente allo sviluppo dell’insufficienza cardiaca. Sebbene l’eziologia dei pazienti con HFpEF differisca da quella dei pazienti con HFrEF ci sono cause sovrapposte tra queste due malattie (Fig. 4).
Nei paesi industrializzati la malattia coronarica (CAD) è la causa più frequente, responsabile di due terzi delle insufficienze cardiache sistoliche sia negli uomini che nelle donne. L'ipertensione contribuisce allo sviluppo di HF nel 75% dei pazienti, compresa la
maggior parte dei pazienti con CAD 14. CAD e ipertensione
interagiscono per aumentare il rischio di insufficienza cardiaca, come fa il diabete mellito 15.
Ci sono molte altre cause di scompenso cardiaco sistolico, tra le più importanti possiamo ricordare: valvulopatie, infezioni virali (riconosciute e non riconosciute), abuso di alcol, chemioterapia (es. doxorubicina o trastuzumab) e la cardiomiopatia dilatativa idiopatica. Nel 20-‐30% dei casi di HFrEF la causa eziologica precisa
resta misconosciuta 16.
La cardite reumatica resta invece una delle principali cause nei paesi in via di sviluppo come Africa e Asia, soprattutto nei giovani. La malattia di Chagas è causa frequente soprattutto nel sud America.
Fig. 4 -‐ Eziologia dello scompenso cardiaco [Tratto da: Longo DL et al., Harrison’s Principles of Internal Medicine, 18th Ed., 2012;234:1406-‐1407].
2.6 Fisiopatologia
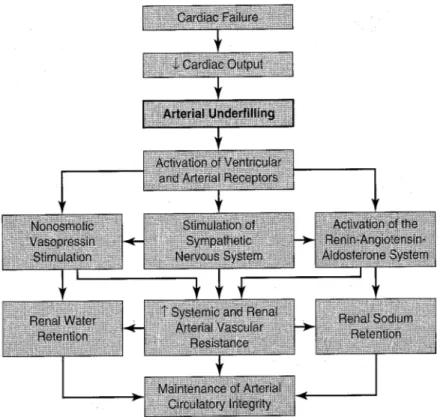
In presenza di una riduzione della contrattilità cardiaca o di un sovraccarico di lavoro cardiaco le conseguenze emodinamiche più immediate sono l’aumento della pressione venosa a monte e la riduzione della gittata sistolica a valle della camera cardiaca compromessa. L’organismo reagisce con una serie di meccanismi di compenso che hanno lo scopo di mantenere la portata cardiaca su valori normali.
Nei gradi più lievi di scompenso questi meccanismi riescono a garantire un adeguato flusso ematico in qualsiasi condizione. Procedendo con il danno a carico del cuore, quindi nello scompenso cardiaco moderato, essi potranno consentire il mantenimento di una normale portata cardiaca solo a riposo, ma non sotto sforzo. Nei casi ancora più gravi, infine, essi saranno incapaci di garantire una gittata cardiaca insufficiente anche per sforzi lievi o addirittura a riposo. Dobbiamo inoltre osservare come, tali meccanismi di compenso, soprattutto nella fase di loro massima attivazione riescono anch’essi a comportare effetti negativi sulla funzione circolatoria, e finiscono per contribuire al peggioramento dello scompenso cardiaco stesso. Tali meccanismi sono divisi in tre grandi capitoli: ipertrofia miocardica, rimodellamento cardiaco e meccanismi neuroendocrini.
2.6.1 Rimodellamento ventricolare e ipertrofia
ventricolare
L’ipertrofia miocardica costituisce un importante meccanismo di compenso che il cuore mette in atto per migliorare la sua efficienza contrattile in condizioni di insufficienza cardiaca persistente nel tempo: essa è pertanto una meccanismo di compenso cronico. Lo stimolo iniziale è l’aumento dello sforzo di parete che porta all’attivazione di canali ionici sensibili alle sue variazioni. Un secondo messaggero agisce poi all’interno del nucleo attivando geni normalmente latenti. Ne risulta quindi: una crescita quantitativa della cellula con aumento del numero di fibrille, dei sarcomeri e dei mitocondri (legato all’attivazione di proto-‐oncogeni quali c-‐fos e c-‐
myc), e una variazioni qualitativa delle proteine che vengono sintetizzate per tale crescita (vengono sintetizzate varianti di isoforme delle proteine contratti o di altre proteine cellulari, con particolare riattivazione delle isoforme fetali). La produzione di isoforme fetali riguarda soprattutto la miosina (provoca, rispetto alla forma normale, una contrazione più lenta ma con rendimento maggiore: cioè minor consumo di energia a parità di lavoro). La produzione di isoforme fetali nei cuori ipertrofici è stata dimostrata anche per altre proteine che costituiscono le fibre miocardiche e sembra finalizzata a garantire un maggior risparmio energetico, sebbene comportino una minor funzionalità: tipico esempio è pompa ATP-‐dipendete che accumula ioni calcio nel reticolo sarcoplasmatico durante la diastole, consentendo il rilascio dei miocardiociti: il rallentamento di questo processo aiuta a spiegare la significativa disfunzione diastolica che caratterizza il cuore ipertrofico 17.
Insieme alla modificazione dei miocardiociti coesistono alterazioni strutturali del ventricolo , vi è infatti una produzione di una maggiore quantità di collagene interstiziale, dovuta all’aumentata attività dei fibroblasti: l’ipertrofia è infatti accompagnata da un certo
grado di fibrosi che conferisce maggior distensibilità alle pareti 18.
Le variazioni geometriche del ventricolo variano a seconda del tipo di sovraccarico a qui è sottoposto. Se l’ipertrofia miocardica è causata da un sovraccarico di pressione del ventricolo, si avrà un ispessimento delle pareti, mentre i volumi non saranno modificati: ipertrofia concentrica. Se, viceversa, l’ipertrofia è causata da un sovraccarico di volume, si avrà una dilatazione della camera
ventricolare che consente di far fronte alla necessità di una maggiore gittata sistolica (ipertrofia ventricolare eccentrica).
Le modificazioni prodotte dall’ipertrofia permettono al cuore di sostenere, fino a un certo punto, il maggior carico di lavoro che viene richiesto. Se il grado di ipertrofia, però, diventa eccessivo esso finisce col determinare una notevole alterazione dell’equilibrio energetico cellulare e con il compromettere sia la funzione sistolica che quella diastolica. Con il persistere del sovraccarico inoltre si assiste ad una progressiva dilatazione delle cavità con assottigliamento e fibrosi delle pareti, che finisce per compromettere l’utilità della fibrosi stessa. Infine, agli effetti negativi, contribuisce anche la possibilità che si possa verificare un’ischemia miocardica, causata dal maggior lavoro e da un insufficiente sviluppo del circolo coronarico.
2.6.2 Meccanismi neuroendocrini
L’attivazione di questi meccanismi consente di ottenere un compenso rapido della funzione cardiaca. Essenzialmente il tutto si basa sulla stimolazione di due grandi meccanismi: il sistema nervoso
simpatico e il sistema renina-‐angiotensina-‐aldosterone 19.
Una delle prime e importanti conseguenze di una riduzione della gittata è l’attivazione del sistema nervoso simpatico, mediata da
riflessi nervosi a partenza dai barocettori e chemocettori periferici 20.
Questa determina un aumento sia della frequenza sia della contrattilità cardiaca. Essa inoltre induce una vasocostrizione
arteriolare nei distretti “sacrificabili” dell’organismo, favorendo la ridistribuzione del circolo verso organi vitali tra cui cuore e cervello. Ciò comporta una riduzione del flusso a livello renale: con riduzione della pressione arteriolare glomerulare. Ne consegue una ritenzione di acqua e sodio. A questo proposito svolge un ruolo fondamentale l’attivazione del sistema renina-‐angiotensina-‐aldosterone (SRA) che
contribuisce a mantenere la vasocostrizione arteriolare 21.
Tanto la stimolazione adrenergica, quanto l’attivazione del SRA promuovono il trasporto di sodio nei tubuli prossimali e causano ritenzione idrosalina, che è finalizzata ad aumentare il ritorno venoso al cuore. Il sodio e l’acqua trattenuti difatti espandono solo il
volume del compartimento extracellulare dell’organismo 22.
Il compartimento extracellulare comprende l’interstizio e il letto vascolare: quindi la ritenzione comporta espansione del volume ematico e del volume interstiziale. Il volume ematico, a sua volta, influenza il riempimento ventricolare (precarico) e pertanto il suo aumento tende a migliorare la funzione cardiaca.
Può contribuire a questi meccanismi anche una maggiore liberazione, da parte dell’ipofisi, di arginina-‐vasopressina (ormone antidiuretico) che pure induce vasocostrizione e ritenzione idrica. Tale liberazione è conseguenza di sollecitazioni osmotiche (aumento della pressione osmotica del liquido extracellulare conseguente alla ritenzione di sodio) e non osmotiche (la diminuzione della gittata cardiaca viene avvertita dai barocettori carotidei come un segnale di diminuzione del volume di fluido circolante): è difatti possibile che nello scompenso si abbia iponatremia, che peraltro è un fattore
Tra gli altri fattori che stimolano la vasocostrizione periferica vi è il rilascio di endotelina, come conseguenza dello stress a cui,
l’endotelio stesso è sottoposto 24.
Altri meccanismi si aggiungono alla fase finale dello scompenso cardiaco come l’elevata produzione di particolari citochine quali TNF (Tumor Necrosis Factor) che è probabilmente responsabile del
quadro di cachessia che caratterizza lo scompensato terminale 25.
Come già visto il precedenza, col tempo questi meccanismi tendono ad essere nocivi.
La vasocostrizione, utile inizialmente per ridistribuire il flusso ematico verso gli organi vitali, alla lunga porta ad un aggravio di lavoro per il cuore in quanto aumenta il postcarico e può istaurare un circolo vizioso che tende a far peggiorare lo scompenso. Nel caso di un cuore insufficiente, infatti, l’aumento delle resistenze periferiche finisce con il comportare un’ulteriore riduzione della portata cardiaca: questa, a sua volta, determina una ulteriore vasocostrizione per ridistribuire il flusso insufficiente.
Analogamente, anche la ritenzione di sodio e acqua ad opera del rene ipoperfuso, finalizzata a garantire un adeguato precarico, finisce per essere inappropriata. Essa infatti consente un miglioramento della gittata sino a quando la relazione precarico-‐ gittata non raggiunge il plateau della curva di Frank-‐Staring. Al di là di questo limite l’espansione del volume ematico finisce con l’essere associata a riduzione della gittata cardiaca.
Indipendentemente dalla terapia, anche l’organismo mette in atto meccanismi controregolatori.
Uno dei più importanti è rappresentato dai peptidi natriuretici, sostanze vasoattive prodotte dalle cellula muscolari di atri e ventricoli in risposta allo stiramento delle loro pareti che, come suggerito anche dal nome, favoriscono l’escrezione renale di sodio e acqua: tendono quindi a ridurre il volume ematico e il precarico. In aggiunta i peptidi natriuretici frenano l’attività del sistema simpatico, della vasopressina e del SRA 26.
A livello renale vengono prodotte sostanze con effetti vasodialatatori: le prostaglandine. Le quali contrastano in parte gli effetti dell’angiotensina sull’albero vascolare e contribuiscono a sostenere la filtrazione glomerulare quando il flusso renale si riduce a livelli critici 27.
Un ulteriore meccanismo di protezione dagli effetti negativi dei vari fattori neuroendocrini è rappresentato dalla ridotta espressione, sulle membrane cellulari, dei loro siti recettoriali specifici (down
regulation) 28. Questa down regulation dei recettori beta-‐adrenergici
cardiaci durante lo scompenso tende a preservare le cellula miocardiche dagli effetti negativi dell’eccessiva stimolazione simpatica (apoptosi e aritmogenicità). Tuttavia anch’essa, quando eccessiva e prolungata, determina una marcata riduzione della risposta inotropa, cronotropa e dromotropa adrenergica.
Un meccanismo puramente periferico di adattamento
dal sangue arterioso che perfonde i tessuti da parte delle cellule , che
determina una diminuzione della saturazione di O2 nel sangue
venoso misto a meno del 55%.
2.7 Sintomi
I classici segni e sintomi riferibili allo scompenso cardiaco vanno a formare i criteri maggiori e minori per la diagnosi clinica sulla base di quanto suggerito dai risultati dello studio Framingham (Criteri di
Framingham, Fig. 5) 29. La loro patogenesi è sempre riconducibile
alla congestione venosa o all’ipoperfusione periferica ed essi vanno a
combinarsi in modo da determinare quadri clinici diversi tra loro 30.
Sulla relazione tra sintomi e attività fisica si basa la classificazione funzionale di gravità dello scompenso cardiaco stilata dalla New York Heart Association (NYHA).
Fig. 5 -‐ Criteri di Framingham per la diagnosi di scompenso cardiaco [Tratta da Ho KL, Pinsky JL, Kannel WB, Levy D. The epidemiology of heart failure: The Framingham Study. J Am Coll Cardiol.1993;22(Suppl A):6A].
2.7.1 Funzione respiratoria
La dispnea è senza dubbio il sintomo principale dell’insufficienza cardiaca 31 ed è definita come la sensazione di fatica a respirare
associata a una sensazione di fame d’aria o mancanza di respiro. Essa è conseguenza della congestione polmonare, che provoca edema interstiziale e riduce perciò la distensibilità dei polmoni e l’ossigenazione del sangue. Ciò fa aumentare il lavoro dei muscoli respiratori che tentano di compensare, i quali a loro volta, però, possono essere malamente perfusi a causa della ipoperfusione periferica: tutto questo contribuisce alla sensazione di dispnea. Nei casi lievi la dispnea insorge esclusivamente per sforzi intensi o per condizioni che richiedono un aumento del lavoro e della portata cardiaca. Con il progredire della malattia la dispnea si rende più evidente anche per sforzi di lieve entità, fino ad arrivare alla dipnea a riposo.
Oltre che con gli sforzi la dispnea può comparire qualora il paziente assuma una posizione supina: il paziente stesso riferirà la necessità di assumere o mantenere la posizione eretta per poter respirare normalmente: condizione che viene definita ortopnea. Ciò è il risultato di una ridistribuzione dei fluidi dalla circolazione splancnica, e degli arti inferiori, alla circolazione centrale durante decubito, con un conseguente aumento della pressione capillare
polmonare 32.
Per motivi analoghi i pazienti con insufficienza cardiaca possono andare incontro a episodi parossistici notturni (dispnea parossistica notturna): i quali, oltre alla posizione supina, sono favoriti dalla
depressione del centro del respiro durante il sonno, che facilita l’ipossia, e la riduzione del tono del simpatico che priva il miocardio
di uno stimolo importante per la sua efficienza contrattile 33. In
questi casi il paziente si sveglia improvvisamente con sensazione di fame d’aria, con respiro affannoso, sibilante, talvolta accompagnato da tosse stizzosa. L’edema polmonare infatti può comprimere i bronchi, provocando un aumento delle resistenze delle vie aeree (asma cardiaca). Si arriva poi allo stadio terminale per cui, l’edema interstiziale, è tale da provocare uno stravaso di liquidi negli alveoli (edema polmonare acuto), grave conseguenza del paziente scompensato.
Il respiro di Cheyne-‐Stokes si riferisce ad un tipo di respiro periodico o ciclico che coinvolge il 40% dei pazienti con scompenso cardiaco terminale. L’apnea centrale notturna nello scompenso s’instaura con il seguente meccanismo: quando il paziente si sdraia, la ridistribuzione del volume circolante dagli arti inferiori al piccolo circolo favorisce la congestione polmonare. I recettori vagali polmonari sono stimolati e provocano iperventilazione. L’iperventilazione, a sua volta, determina una riduzione critica della
PaCO2. Esiste di norma un valore soglia di PaCO2 (mediamente
intorno ai 35 mmHg) al di sotto del quale cessa la stimolazione del centro bulbare e il respiro si interrompe. All’interruzione del respiro
segue un aumento della PaCO2, una riduzione della PaO2 e l’attività
respiratoria riprende. Questo meccanismo viene condizionato sia da
un innalzamento della soglia apnoica di PaCO2, per aumentata
chemosensibiltà recettoriale probabilmente causata dalla
un’iperventilazione cronica, come avviene nel soggiorno in alta quota dove l’iperventilazione favorisce un frequente abbassamento
della PaCO2 al di sotto della soglia, un conseguente respiro periodico
e una frammentazione del sonno. Alcuni autori ritengono che, nello scompenso congestizio, l’apnea notturna sia favorita anche da una
aumentata risposta ventilatoria alle variazioni di PaCO2. La ripresa
dell’attività respiratoria si accompagna spesso a un microrisveglio
registrato all’elettroencefalogramma (l’arousal) 34.
2.7.2 Attività muscolare
I sintomi relativi all’attività muscolare sono la conseguenza dell’ipoperfusione periferica. In genere sono sfumati e aspecifici e consistono nella rapida comparsa di astenia durante l’attività fisica.
2.7.3 Funzione renale
Nello scompenso cardiaco le alterazione della diuresi sono tipiche. La diuresi è spesso contratta di giorno, mentre, frequentemente, migliora di notte (nicturia) costringendo il paziente ad alzarsi più volte per la minzione. Questo comportamento deriva dal fatto che durante le ore diurne l’ipoperfusione del rene può essere importante (per la ridotta gittata cardiaca), per cui la diuresi è ridotta. Di notte, con la posizione clinostatica, la portata cardiaca aumenta come conseguenza dell’aumento del ritorno venoso; ne deriva un aumento della perfusione renale, la quale migliora anche per la riduzione
scompenso cardiaco l’ipoperfusione diventa costante e induce oliguria (<500-‐600 mL/24h) con aumento dell’azotemia e della creatininemia, fino ad arrivare poi ad anuria 35.
2.7.4 Attività cerebrale
Sintomi da alterata perfusione cerebrale compaiono solo nei casi di grave scompenso cardiaco, in particolare quando coesistono gravi
alterazioni vascolari cerebrali. Normalmente infatti
l’autoregolazione del flusso ematico cerebrale protegge l’encefalo dall’ipoperfusione. Quando si manifestano i sintomi sono: perdita di memoria, difficoltà ala concentrazione, insonnia e ansietà. Nei casi acuti si può osservare: confusione mentale, agitazione, sonnolenza e coma 36. 2.8 Segni 2.8.1 Esame generale
L’esame della cute nel paziente scompensato permette di evidenziare l’eventuale presenza di vasocostrizione o edemi.
L’edema periferico, come la dispnea, è una manifestazione tipica
dello scompenso cardiaco 37. Esso è il risultato dell’aumento di
pressione nelle vene e nei capillari sistemici e della ritenzione idrosalina operata dal rene per effetto dell’ipoperfusione.
L’edema compare prima nelle parti declivi, cioè ai piedi e alle caviglie, dove la pressione idrostatica è maggiore, ed è tipicamente
simmetrico. Nei casi meno gravi esso compare durante il giorno e viene riassorbito durante la notte. Nei pazienti costretti a letto l’edema compare prima in regione sacrale e poi nelle zone declivi. Nei casi più gravi di scompenso prolungato l’edema può divenire generalizzato (anasarca), coinvolgendo gli arti superiori, il torace, l’addome… Se l’edema non viene risolto e persiste nel tempo si può avere un indurimento della cute con formazioni di aree discromiche (macchie brune e rossastre) soprattutto sul dorso del piede e alle caviglie.
La costrizione dei vasi cutanei è un meccanismo di compenso messo in atto nei casi di scompenso cardiaco grave e mira a garantire un flusso adeguato agli organi più importanti. Essa diventa clinicamente evidente nello shock cardiogeno: in questi casi la cute appare pallida, fredda, sudata, con le estremità cianotiche. Nei casi estremi di vasocostrizione, aree cutanee cianotiche si aggiungono al pallore e all’ipotermia, rendendo al cute diffusamente marezzata, soprattutto agli arti 38.
Lo scompenso cardiaco in fase terminale può portare a cachessia cardiogena: sebbene il meccanismo di cachessia non sia del tutto chiarito ha, probabilmente, un’eziologia multifattoriale e comprende l’aumento del tasso metabolico a riposo, l’anoressia, la nausea, e il vomito (dovuti a epatomegalia congestizia e aumento della pressione addominale); vi è inoltre un innalzamento delle citochine come il TNF e un indebolimento dell’assorbimento a causa della congestione delle vene intestinali. Quando presente, la cachessia,
2.8.2 Esame cardiovascolare
I reperti tipici dell’esame obiettivo cardiaco sono la rilevazione di una frequenza cardiaca aumentata (conseguenza dell’ipertono simpatico), un cuore dilatato (spostamento dell’itto a sinistra e in basso) e ritmo di galoppo, dovuto alla presenza di un III tono cardiaco (galoppo protodiastolico). In alcuni pazienti è reperibile, in alternativa o in aggiunta al III tono, un IV tono (galoppo presistolico che si verifica quando la contrazione degli atri è molto forte o quando l'atrio si svuota in un ventricolo con elasticità ridotta) 35.
La pressione venosa centrale, tipicamente aumentata nei pazienti in condizioni di scompenso con insufficienza ventricolare destra, si valuta osservando il grado di turgore giugulare in posizione semiseduta (a 45°).
La pressione arteriosa è abitualmente normale o modestamente ridotta, soprattutto la pressione arteriosa sistolica e la pressione differenziale, a meno che non sussista una condizione di ipertensione arteriosa di base. Talvolta, nei casi di grave
insufficienza ventricolare, si può rilevare un polso alternante 40.
2.8.3 Esame del torace
L’obiettività dello scompenso a livello polmonare è caratterizzata da rumori umidi (rantoli) a livello dei campi basali. Essi sono indotti da un aumento della pressione nelle vene e nei capillari polmonari che provoca trasudazione di liquido nel tessuto polmonare.
Con il progredire del quadro clinico possono estendersi ai campi medi o essere diffusi a tutto l’ambito auscultatorio toracico per
livelli crescenti di gravità dello scompenso cardiaco 41.
Quando l’edema interstiziale e la congestione della mucosa bronchiale comprimono le vie aeree terminali si possono auscultare ronchi e sibili. In caso di edema polmonare acuto i rantoli divengono rapidamente grossolani e si diffondono rapidamente a tutto l’ambito polmonare (marea montante).
Nello scompenso cronico l’aumento della pressione nei capillari pleurici determina talvolta una versamento pleurico, più frequentemente a destra (idrotorace).
2.8.4 Esame dell’addome
Si può evidenziare un’epatomegalia (spesso accompagnata da splenomegalia): si verifica quando l’aumento della pressione venosa sistemica, da scompenso destro o globale, provoca congestione delle vene epatiche. In alcuni casi la compressione sostenuta sull’addome fa comparire una distensione delle vene giugulari prima assente:
reflusso epatogiugulare 42.
Nei casi gravi può comparire ascite, provocata da una prolungato aumento della pressione nelle vene epatiche e nei capillari peritoneali.
2.9 Diagnosi
La diagnosi di scompenso cardiaco è relativamente semplice quando il paziente si presenta con i classici segni e sintomi. Tuttavia, i segni ed i sintomi di insufficienza cardiaca non sono ne specifici ne sensibili, di conseguenza, la chiave per fare la diagnosi è di avere un alto indice di sospetto clinico, in particolare per i pazienti ad alto rischio. Quando questi pazienti presentano segni o sintomi di tipici, devono essere eseguiti ulteriori test.
2.9.1 Esami ematochimici
La valutazione laboratoristica iniziale e routinaria dei pazienti con scompenso cardiaco deve includere: emocromo completo, analisi delle urine, elettroliti, BUN, creatinina sierica e GFR, glucosio, profilo lipidico, funzionalità epatica e tiroidea: questo ci consente di impostare un adeguato schema terapeutico e di chiarire l’eventuale eziologia e/o comorbilità.
2.9.2 BNP e NT-‐proBNP
Il BNP o il suo equivalente di clivaggio amino terminale (NT-‐ proBNP) sono molecole prodotte dai cardiomiociti come conseguenza di numerosi triggers tra cui lo stretch miocardico. Nei pazienti con dispnea, in regime ambulatoriale, la misurazione di BNP e proBNP è utilizzata per supportare la diagnosi clinica di scompenso cardiaco e per stabilirne la prognosi e la severità 43, 44.
La misurazione seriale dei suddetti peptidi permette di ridurre
drasticamente l’ospedalizzazione e la mortalità di questi pazienti 45.
Vengono inoltre utilizzati per valutare il dosaggio ottimale dei farmaci ed effettuare quindi un trattamento “guidato” (BNP or proBNP guided HF therapy) 46, 47, 48.
Nei pazienti ospedalizzati il dosaggio di BNP e proBNP permette di
confermare la diagnosi e di monitorare l’efficacia della terapia 49.
Infine va ricordato che il dosaggio di questi peptidi, associato a troponina T e I, è fondamentale per stabilire l’eziologia, la prognosi e
la severità dei pazienti con scompenso cardiaco acuto 50.
Per i pazienti che si presentano acutamente il cut-‐off ottimale di esclusione è 300 pg/ml (per il proBNP) e di 100 pg/ml (per il BNP). Per i pazienti cronici il cut-‐off è di 125 pg/ml (pro-‐BNP) e 35 pg/ml (BNP) 51.
Va infine ricordato che la sensibilità e la specificità di questo esame nella diagnosi di insufficienza cardiaca è maggiore per il paziente acuto.
Ad oggi si sta valutando l’efficacia del mid-‐regional atrial natriuretic peptide (MR-‐proANP), cut-‐off di 120pmol/L, che sembra avere una
sensibilità uguale ai precedenti nel monitoraggio dei pazienti acuti 52.
2.9.3 Troponina T e I
E’ sovente riscontrare dosaggi elevati di Troponina T e I (indicatori di necrosi miocardica) nei pazienti con insufficienza cardiaca, anche in assenza di segni di CAD. Tale aumento suggerisce che ci sia, di
base, un danno a carico dei miocardiociti e successiva necrosi (da
imputare all’evento del rimodellamento cardiaco) 53.
Nel paziente cronicamente scompensato la misurazione della
troponina è associata ad alterazione dell’emodinamica 51, ad una
progressiva riduzione della funzione ventricolare sinistra 54 e a una
mortalità più elevata 55.
Nel paziente acuto, suddetto aumento, è associato ad un outcome e mortalità nettamente peggiori; viceversa, una diminuzione dei livelli di troponina nel tempo, come conseguenza di un buon trattamento,
sono associati a una migliore prognosi 56.
Pertanto risulta fondamentale la misurazione dei markers, troponina I e T, nei pazienti con scompenso cardiaco cronico e, ancor più, nei pazienti con scompenso cardiaco acuto.
2.9.4 Altri biomarkers
Altre molecole di fibrosi miocardica, come la ST-‐2 solubile 57, 58 e la
galectina-‐3 59, non sono solo predittrici di elevato rischio di
ospedalizzazione e di mortalità, ma svolgono, in aggiunta ai peptidi natriuretici, una valutazione prognostica.
I markers rilevanti il danno renale offrono una valutazione addizionale sulla funzionalità renale che, se compromessa, evolve modificando la patogenesi, la progressione, il compenso o le
complicazioni dello scompenso acuto e cronico 60.
2.10 Esami strumentali
La flowchart diagnostica, presentata dalle linee guida ESCardio 2012 (Fig. 6), prevede, per i pazienti con sospetta insufficienza cardiaca acuta che accedono al dipartimento di Emergenza e Accettazione, l’esecuzione rapida di un ECOcardiogramma (soprattuto per i pazienti in stato di shock ed emodinamicamente instabili) associato ad un ECG e dosaggio dei peptidi natriuretici. In questo modo, qualora ECG, BNP e proBNP fossero nella norma, si può arrivare ad escludere una riacutizzazione di scompenso cardiaco.
Viceversa, per i pazienti che si presentano senza riacutizzazioni, e che hanno segni e sintomi di scompenso cardiaco, è doveroso eseguire un ECG, ed eventualmente un RX del torace, associato a dosaggio di BNP e proBNP in modo da identificare quei pazienti che necessitano maggiormente di un ECOcardiogramma: in questi pazienti, infatti, bassi livelli di peptidi natriuretici, associati a ECG normale, permettono di prevenire una diagnosi errata di scompenso cardiaco.
Fig. 6 -‐ Flowchart per la diagnosi di scompenso cardiaco [Tratto da: McMurray JJV, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2012;33:1787-‐1847].
2.10.1 ECG
L’elettrocardiogramma a 12 derivazioni permette di diagnosticare
eventuali anomalie del ritmo o della conduzione cardiaca 61: ad
esempio patologie seno-‐atriali, blocchi atrio-‐ventricolari, anomalie nella conduzione ventricolare,… Inoltre permette di evidenziare
l’ipertrofia ventricolare o la presenza di onda Q (indicatore della perdita di miocardio vitale), possibile indizio sull’eziologia dello scompenso cardiaco .
Lo scompenso cardiaco è improbabile (<2%) se il paziente si
presenta in modo acuto e con ECG completamente normale 62. Nei
pazienti cronici il reperto di un ECG del tutto normale riduce la prognosi negativa 63.
2.10.2 Radiografia del torace
Questo esame ha un utilizzo limitato nell’iter diagnostico dei pazienti con insufficienza cardiaca: viene maggiormente utilizzato per valutare la presenza di congestione venosa polmonare, di edema (alveolare o interstiziale) o di cardiomegalia, nei pazienti con scompenso cardiaco acuto.
Escludendo la congestione, tutti reperti, causali e non, rilevabili alla radiografia del torace devono essere associati ai reperti clinici specifici dello scompenso cardiaco.
E’ importante sottolineare però che, a una grave disfunzione ventricolare sinistra, può essere associata una radiografia del torace normale con assenza di reperti di cardiomegalia.
2.10.3 Ecografia cardiaca
L’ecografia cardiaca è l’indagine di prima scelta nei pazienti con sospetta insufficienza cardiaca grazie alla accuratezza, disponibilità,
con altre tecniche diagnostiche per aumentare la sensibilità dell’esame. Va ricordato che, tra tutti gli esami, è quello che risente maggiormente della competenza e esperienza del tecnico esecutore
65.
Ci consente di avere importanti informazioni circa l’anatomia o la funzionalità cardiaca (Fig. 7).
La frazione di eiezione (parametro che deve essere sempre misurato nei pazienti con disfunzione sistolica del ventricolo sinistro) non è un indice di contrattilità, essa infatti dipende dal volume, precarico, postcarico, frequenza cardiaca, e funzione valvolare e non deve essere considerato sinonimo di gittata sistolica.
La gittata sistolica può essere infatti mantenuta normale da una dilatazione ventricolare (di compenso) nei pazienti con FE compromessa; altresì può essere ridotta nei pazienti con FE preservata e ipertrofia ventricolare concentrica.
La frazione di eiezione, inoltre, può essere normale (con gittata sistolica ridotta) nei pazienti con una grave insufficienza mitralica. In questo modo si comprende come la FE deve essere sempre interpretata in base al contesto clinico.
Il metodo raccomandato per la misurazione di suddetto parametro è “the apical biplane method of discs” (la regola di Simpson
modificata)66. Quando sussiste una riduzione della qualità delle
immagini (una finestra ecografica pessima: intesa come la visualizzazione di meno dell’80% del margine endocardico) e, poiché questa metodica dipende dal modo più o meno accurato di delineare il bordo dell’endocardio, è consigliata la somministrazione
di mezzo di contrasto che permette di delineare con più precisione i bordi.
Una ecografia tridimensionale di qualità elevata può ulteriormente incrementare l’accuratezza della valutazione del volume ventricolare e quindi della FE 67.
Fig. 7 -‐ Misurazioni ECOcardiografiche più frequenti nello scompenso cardiaco [Tratto da: McMurray JJV, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2012;33:1787-‐1847].
Altri parametri che possono essere valutati, in alternativa alla FE, sono: il punteggio associato al movimento di parete cardiaca (può essere un’alternativa accettabile, purtroppo viene poco utilizzato), l’escursione sistolica del piano atrioventricolare, la velocità tissutale sistolica (misurata in Doppler) e la misura della deformazione ventricolare (strain e strain-‐rate): questo parametro è più sensibile della FE nel determinare piccoli cambiamenti nella funzione del ventricolo sinistro.
La gittata cardiaca può essere inoltre calcolata misurando il tempo integrale di velocità nel punto di efflusso del ventricolo sinistro.
Oltre alla valutazione dei pazienti con scompenso cardiaco sistolico, l’ecografia cardiaca può essere utilizzata anche per i pazienti con scompenso cardiaco diastolico. E’ importante ricordare però che, i normali parametri usati per indicizzare la corretta funzionalità diastolica del ventricolo sinistro, possono essere ampiamente modificati con l’età, la frequenza cardiaca e il peso corporeo e che, la rilevazione di un solo parametro non è sufficiente a fare diagnosi di
scompenso diastolico 68.
E’ importante valutare la presenza di anomalie strutturali (ipertrofia ventricolare sinistra e dilatazione del rispettivo atrio) e anomalie funzionali associate.
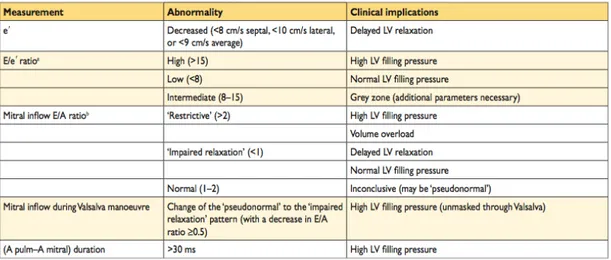
La velocità miocardica protodiastolica (e’) è un marker del grado di rilasciamento ventricolare diastolico e il rapporto che si ottiene tra la velocità transmitralica (o transtricuspidale per il ventricolo destro) protodiastolica (E) e la velocità (e’) anulare (rapporto E/e’) costituisce un indice accurato dell’entità delle pressioni di riempimento della camera ventricolare che si vuole studiare.
Un valore di e’ normale (v.n. >8cm/s settale, >10cm/s laterale, >9cm/s medio, misurato con metodica doppler tissutale pulsato TDI) è raro nei pazienti con insufficienza cardiaca.
Il rapporto E/e’ (v.n. <8) correla quindi con la pressione di
riempimento del ventricolo sinistro 69.
In questo modo possiamo affermare che le evidenze di disfunzione ventricolare diastolica sono: o un ridotto e’, o un incremento del rapporto E/e’ oppure la presenza di entrambi.
La presenza di due parametri aumentati, associati o meno alla fibrillazione atriale, incrementano la probabilità di diagnosi.

![Fig.
8
-‐
Terapia
in
base
agli
stadi
AHA/ACC
[Tratto
da:
Rugarli
C,
et
al.
Medicina
Interna
Sistematica.
6th
Ed.
2010].](https://thumb-eu.123doks.com/thumbv2/123dokorg/7617613.115866/40.892.161.754.128.508/fig-terapia-stadi-tratto-rugarli-medicina-interna-sistematica.webp)
![Fig.
9
-‐
Classificazione
dei
diuretici
in
base
al
sito
d’azione
sul
nefrone
[Tratto
da:
Schrier
RW,
Renal
and
Electrolyte
Disorders,
7th
Ed.,
2010].](https://thumb-eu.123doks.com/thumbv2/123dokorg/7617613.115866/54.892.232.685.127.537/classificazione-diuretici-nefrone-tratto-schrier-renal-electrolyte-disorders.webp)

![Fig.
13
-‐
Fattori
che
predispongono
alla
Sindrome
Cardio-‐Renale.
[Tratto
da:
Ronco
C,
et
al.
Cardiorenal
Syndrome
Type
1.
JACC.
2012;60(12):1031-‐1042].](https://thumb-eu.123doks.com/thumbv2/123dokorg/7617613.115866/78.892.163.760.385.940/fattori-predispongono-sindrome-cardio-renale-tratto-cardiorenal-syndrome.webp)