U
NIVERSITÀ
DI
P
ISA
F
ACOLTÀ
DI
F
ARMACIA
Corso di Laurea Specialistica in
FARMACIA
Tesi di Laurea
Studio degli effetti del salbutamolo sull’attivazione di
RhoA in cellule muscolaturi lisce umane
Relatore Prof.ssa Breschi Maria Cristina Candidato
Correlatore dott. Fogli Stefano Elena Lenzi
Indice
Capitolo 1. 1.Introduzione: Malattia asmatica 5
1.1 Caratteristiche della malattia 6
1.2 Fattori di rischio 7 1.2.1 Allergeni domestici 1.2.2 Allergeni ambientali 8 9 1.2.3 Fumo di tabacco 9 1.3 Terapie utilizzate 12
2. Ruolo della muscolatura liscia 17
2.1 Struttura della muscolatura liscia
bronchiale 17
2.2 Fisiologia della muscolatura liscia bronchiale
2.3 Recettore muscarinico
3.Meccanismi intracellulari della modulazione della contrazione
4.RhoA
5.Importanza di RhoA nei vari distretti
5.1 Ruolo di RhoA nel sistema gastrointestinale
5.2 Ruolo di RhoA nei disturbi
18 22 23 24 28 28
5.3 Ruolo di RhoA in gravidanza
5.4 Ruolo di RhoA Ruolo di RhoA e Rho-kinasi nella desensibilizzazione del recettore β2 adrenergico
5.5 Ruolo di RhoA nella disfunzione erettile maschile
6. Farmaci che interferiscono con l’attività di RhoA 6.1 RhoA e le statine 6.2 Fasudil 6.3 Epac 31 32 34 35 35 39 39
Capitolo 2. Scopo della tesi 43
Capitolo 3. Materiali e metodi 3.1 Sostanze chimiche 3.2 Linee cellulari 3.3 Immunocitochimica 3.4 Elisa
3.5 Analisi dei risultati e statistica
44 44 45 47 48 49 Capitolo 4. Risultati 50 Capitolo 5. Conclusioni 58 Bibliografia 59 Glossario 62 Ringraziamenti
INTRODUZIONE
1. Malattia asmatica
1.1 Caratteristiche della malattia
L’asma è una patologia infiammatoria cronica caratterizzata da
eccessiva costrizione delle vie aeree, da dispnea, respiro difficoltoso,
senso di costrizione toracica e di soffocamento [2].
Una delle caratteristiche della malattia asmatica è la dispnea, cioè
difficoltà a respirare accompagnata da senso di affanno, associata a
costrizione toracica e respiro sibilante.
I suoi aspetti patologici si manifestano con una severa costrizione della
trachea e dei bronchi, ispessimento della mucosa per infiltrazione
cellulare, in particolare eosinofili, edema e addensamenti di tappi di
Uno dei maggiori fattori di rischio individuale per lo sviluppo della
malattia sembra essere la atopia, cioè la predisposizione a sviluppare
una eccessiva risposta immunitaria IgE-mediata verso gli allergeni
esterni [1].
Altra caratteristica peculiare della malattia è l’iperresponsività delle
vie aeree che si può parzialmente spiegare con un aumento della
contrazione della muscolatura liscia, ed è seguita da cambiamenti fisici
delle vie aeree come danni all’epitelio, gonfiore delle mucose,
iperplasia delle cellule e rimodellamento delle pareti del sistema
respiratorio [4].
La tipica manifestazione della patologia asmatica è il così detto
“attacco asmatico”, ossia un episodio di crisi respiratoria dovuta a
contrazioni improvvise della muscolatura bronchiale che causano al
soggetto un respiro sibilante e una ventilazione difficile e molto
faticosa. La frequenza delle crisi varia da persona a persona [10].
Nell’asma l’infiltrazione degli eosinofili è indotta da chemiochine,
molecole di adesione e citochine come IL-5 e IL-13[8].
RhoA-kinasi aumenta la migrazione cellulare e questo potrebbe
che il complesso RhoA/RhoA-kinasi induce migrazione di eosinofili
mediata da eotassine e che questo effetto viene annullato usando un
inibitore RhoA (C3 esoenzima) o di RhoA-kinasi ( Y-27623) [8].
Studi effettuati sui topi [8]dimostrano che negli animali sensibilizzati
con ovalbumina ed esposti ad allergeni, le concentrazioni di IL-4, IL-5,
IL-13 e eotassina salgono vertiginosamente, si riscontra inoltre un
marcato aumento dell’infiltrazione degli eosinofili nelle vie aeree.
Invece nei topi pretrattati con un inibitore di RhoA-kinasi, come
Y-27632, si verifica una riduzione dell’incremento di eosinofili con un
andamento dose-dipendente, inoltre vengono abbassati i livelli di
interleuchine ed eotassina, e si assiste ad una attenuazione
dell’up-regulation delle molecole di adesione [8].
1.2 Fattori di rischio:
Tra i principali fattori di rischio per l’insorgenza dell’asma bronchiale
troviamo:
Fattori ambientali che possono causare l’insorgenza, la riacutizzazione o la persistenza dei sintomi della malattia;
Per diversi anni l’esposizione ad allergeni, cioè sostanze capaci di
sensibilizzare le vie aeree, o a sostanze presenti in ambito lavorativo, è
stata ritenuta la causa più probabile di insorgenza di asma ; secondo
altri studi il tenore di vita occidentale e il livello di igiene ottenuto con
il conseguente calo di malattie infettive potrebbe essere una delle
motivazioni che hanno portato ad un incremento delle malattie di
natura allergica nelle nuove generazioni [1].
1.2.1 Allergeni domestici
Tra gli allergeni domestici,o degli ambienti interni, si trovano
principalmente, polvere e acari, prodotti immunogeni di animali e
funghi.
Gli allergeni contenuti nella polvere sono costituiti da escrezioni e
In Italia e nel mondo occidentale si sta verificando un forte aumento di
patologie di natura allergica collegate all’aumento di questi
organismi,che trovano nelle nostre case un ambiente ideale per la loro
proliferazione per la presenza di sistemi di riscaldamento,
deumidificazione e climatizzazione.
1.2.2 Allergeni ambientali
Per quanto riguarda gli allergeni extradomestici al primo posto
troviamo i pollini seguiti dai funghi.
Nonostante sembri accertato che il polline causi un’acutizzarsi delle
crisi, non è ancora certo che la sensibilizzazione la polline aumenti il
rischio di insorgenza di nuovi casi di asma .
L’inquinamento ambientale gioca un ruolo che gli studi
epidemiologici non sono ancora riusciti a definire con chiarezza a
causa delle troppe variabili presenti, ma pare appurato, che i livelli di
anidride solforosa , ozono e ossidi d’azoto raggiungibili nelle città più
inquinate possano riacutizzare l’asma, aumentare temporaneamente
1.2.3 Fumo di Tabacco
Il fumo di tabacco, in quanto irritante, sembra velocizzare la perdita di
funzionalità respiratoria nei soggetti asmatici, causa inoltre un
inasprimento dei sintomi della malattia ma non esiste ancora la
certezza che costituisca un fattore di rischio scatenante per
l’insorgenza di nuovi casi.
Tuttavia pare aumentare l’insorgenza di asma in soggetti sottoposti ad
allergeni presenti in ambiente di lavoro[1].
Tabella riassuntiva[1]: 1. Fattori individuali: Atopia; Predisposizione genetica; Iperresponsività bronchiale; Sesso; Razza;
2. Fattori ambientali (influenzano l’insorgenza di asma in
soggetti predisposti) :
Allergeni domestici I. Acari;
II. Scarafaggi;
III. Funghi,muffe e lieviti;
IV. Allergeni animali;
Allergeni degli ambienti esterni; I. Pollini;
II. Funghi ,muffe e lieviti;
Sensibilizzanti presenti in ambito lavorativo;
Inquinamento ambientale;
Infezioni respiratorie;
Condizioni socio-economiche;
Alimentazione e farmaci;
Obesità;
3. Fattori che acutizzano la malattia o ne causano la
persistenza [1]:
Allergeni ambienti esterni/interni,
Inquinamento;
Infezioni respiratorie;
Sforzo fisico e iperventilazione;
Clima;
Anidride solforosa;
Alimenti,additivi alimentari e farmaci,
Emozioni intense;
Fumo di tabacco sia passivo che attivo;
Inquinanti aerei come spray ed esalazioni di vernici ;
In passato sono state utilizzate serie eterogenee di sostanze, la carenza
di conoscenze dei meccanismi cellulari implicati nella patologia
asmatica ha permesso che venissero utilizzate anche farmaci senza
una vera efficacia. Tra le prime terapie troviamo: tabacco, canapa
indiana, anestetici, (usando piccole dosi di cloroformio,oppio o etere),
ipecacuana (espettorante), caffè , tè , stramonio, lobelia e altre
sostanze meno efficaci [2].
Dopo che la ricerca ne ha dimostrato la validità, alcuni dei principi
attivi contenuti in questi rimedi, quali xantine, antagonisti colinergici
e anestetici, sono stati inseriti tra le terapie per curare l’asma
successivamente sono stati introdotti anche anticolinergici,
antistaminici, antileucotrieni, β-agonisti, inibitori delle
fosfodiesterasi e cortisonici [2].
Attualmente i farmaci antiasmatici si dividono in due grandi
categorie:farmaci per il trattamento sintomatico, a breve durata
d’azione e da assumere nel momento di insorgenza dell’attacco
asmatico vero e proprio; e farmaci per il trattamento cronico
somministrati per ridurre lo stato infiammatorio persistente nei
Altri farmaci utilizzati come broncodilatatori con ottimi risultati sono
la teofillina, e farmaci antimuscarinici [10].
La teofillina appartiene alla classe delle metilxantine e insieme ad
aminofillina, difillina, oxtrifillina ed emprofillina viene usata come
broncodilatatore con ottimi risultati [14].
Figura 1 Struttura aminofillina .
Figura 2 struttura di teofillina .
Il meccanismo d’azione di questi farmaci rimane non del tutto chiaro;
sono stati proposti vari meccanismi per spiegare la loro azione
broncodilatatoria, tra cui figurano l’inibizione della idrolisi di cAMP
da parte delle fosfodiesterasi, un’azione antagonista nei confronti del
recettore dell’adenosina, la stimolazione della secrezione di
catecolamine endogene, l’inibizione delle prostaglandine e la
riduzione della concentrazione intracellulare degli ioni calcio [14].
Tra le molecole somministrate per la terapia cronica dell’asma
troviamo soprattutto antiinfiammatori quali glucocorticoidi,
antagonisti dei leucotrieni o inibitori della degranulazione
mastocitaria [10].
Tra i primi farmaci simpatico mimetici più importanti utilizzati nel
trattamento della patologia asmatica troviamo adrenalina,
isoprenalina ed efedrina.
Per quanto concerne la terapia sintomatica, i farmaci risultati più
efficaci sono i broncodilatatori quali gli agonisti β-adrenergici, in
Questi farmaci oltre a contrastare la broncocostrizione causano
stimolazione cardiaca (in particolare adrenalina e isoprenalina), per
questo attualmente vengono preferiti composti selettivi β2 agonisti
come salbutamolo, terbutalina e metaproterenolo e salmeterolo [10].
Figura 3 Struttura di salbutamolo; Figura 4 Struttura di terbutalina;
Figura 5 Struttura del metaproterenolo ;Figura 6 Struttura del
I farmaci β2 agonisti sono attualmente tra i più impiegati nella cura
della patologia asmatica,possono essere somministrati sia per via orale
che inalatoria,presentano lunga durata d’azione e buona selettività per
il recettore β2, provocano una broncodilatazione massima dopo 30
minuti dalla somministrazione che persiste per 3-4 ore [10].
Nonostante la ricchezza di strumenti terapeutici e la precocità
d’intervento, non tutti i soggetti rispondono alla terapia; per questo è
importante la ricerca di nuovi bersagli terapeutici ma la loro
individuazione richiede una più attenta analisi.
2. Il ruolo della muscolatura liscia
2.1 Struttura della muscolatura liscia bronchiale umana
La muscolatura liscia è costituita da cellule fusate, intorno alle quali,
oltre al sarcolemma è presente una membrana basale di cui fa parte la
Il sarcoplasma contiene il nucleo, i mitocondri, l’apparato del Golgi,
granuli di glicogeno, gocce lipidiche, corpi densi citoplasmatici e mio
filamenti [6].
I miofilamenti, distinguibili in due tipi, spessi di miosina o sottili di
actina, sono disposti longitudinalmente in maniera disordinata e non
in vere miofibrille in cui siano identificabili i sarcomeri caratteristici
della muscolatura striata.[6]
2.2 Fisiologia della muscolatura liscia bronchiale
La cellula muscolare liscia si contrae quando la miosina viene
fosforilata, questo avviene ad opera della chinasi della catena leggera
della miosina Ca2+/Calmodulina dipendente (MLCK) che a sua volta
viene attivata da alti livelli intracellulari di calcio.
Quando un agonista si lega al recettore associato a proteina G questo
effettua uno scambio tra GDP con GTP nella subunità α, a questo
punto il complesso αβg si dissocia, si lega al complesso GTP-subunità
α e attiva la fosfolipasi C che a sua volta produce due secondi
IP3 si lega al suo recettore presente sul reticolo sarcoplasmatico e
determina il rilascio del calcio contenuto in esso.
A questo punto MLCK viene attivata dalla Calmodulina che si lega a 4
ioni calcio e può fosforilare la catena leggera della miosina dando così
inizio alla contrazione [5].
La meccanica della contrazione si attua tramite scivolamento dei
filamenti di miosina e actina l’uno sull’altra e con la formazione di
ponti trasversali.
La miosina è una grossa molecola in cui si riconoscono due porzioni
ben distinte. Le code delle molecole di miosina si raggruppano per
formare dei filamenti spessi, invece le regioni delle teste si orientano
lateralmente in direzione dei filamenti sottili che sono costituiti da
actina e tropomiosina. Ogni testa presenta due siti di legame per
l’actina e due siti deputati all’idrolisi di ATP e dopo l’interazione viene
definita ponte trasversale[12].
Il processo della contrazione richiede dispendio di energia chimica
sotto forma di ATP, la quale viene idrolizzata e utilizzata per
per interagire correttamente con i filamenti di actina per poter formare
i ponti trasversali.
La contrazione si verifica quando le teste di miosina vanno ad
interagire con i filamenti sottili di actina [9].
La contrazione è calcio-dipendente e alcuni agonisti in grado di
contrarre la muscolatura liscia, operano attraverso l’apertura dei canali
al calcio.
Oltre al meccanismo calcio-dipendente la regolazione della
fosforilazione della catena leggera della miosina è sottoposta anche al
controllo di un meccanismo indipendente dal calcio, la suddetta
molecola subisce infatti defosforilata dalla fosfatasi della catena
leggera della miosina(MLC fosfatasi) [5].
Poiché lo stato di fosforilazione della miosina dipende dall’equilibrio
tra la kinasi e la fosfatasi, una modulazione di tale equilibrio
condiziona lo stato contrattile.
Un’attivazione del processo è determinata anche dal mediatore
colinergico. Infatti le vie respiratorie sono innervate da terminazioni
colinergiche sembrano importanti nell’insorgenza della bronco
costrizione tipica dell’attacco acuto di asma.
Queste fibre motorie colinergiche innervano i recettori M3 sulla
muscolatura liscia e presentano recettori M2 delle terminazioni
nervose, l’inibizione di quest’ultimo tipo di recettori può incrementare
la broncocostrizione mentre antagonisti del recettore M3 svolgono
un’azione broncodilatatoria [10].
2.3 Recettore muscarinico:
Il recettore muscarinico è un recettore transmembranario accoppiato a
proteine G, ne sono stati scoperti 5 sottotipi (m1, m2, m3, m4, m5) dei
quali solo tre sembrano presenti nel sistema respiratorio:
- M1 determina broncocostrizione tramite stimolazione
parasimpatica;
- M2 è un autorecettore polmonare di nervi parasimpatici,inibisce
il rilascio da parte del nervo Vago di acetilcolina;
- M3 si trova sulla membrana di cellule della muscolatura liscia
3. Meccanismi intracellulari della modulazione della contrazione
La stimolazione da parte di alcuni agonisti induce la contrazione della
muscolatura liscia tramite sensibilizzazione al calcio.
Uno dei fattori coinvolti in questo processo sembra essere RhoA,una
proteina monometrica legante il GTP insieme al suo target di azione
Rho-kinasi .
Il ruolo di RhoA/Rho-kinasi è cruciale per la regolazione di MLC
fosfatasi , l’enzima deputato alla defosforilazione della catena leggera
della miosina attivata,intervenendo quindi sul rilasciamento della
muscolatura liscia.
Quando RhoA viene attivata causa fosforilazione del target subunità 1
della miosina fosfatasi(MYPT1) [4]che determina l’inattivazione della
MLC fosfatasi stessa ; quindi aumenta il livello di MLC fosforilata e si
Figura 7 Schema di attivazione di RhoA e suo ruolo nella
contrazione[21].
4. RhoA
RhoA è una proteina G monometrica appartenente alla famiglia di
proteine Ras, la quale nel suo stato inattivo si trova nel citosol ed è
legata a GDP, mentre, quando subisce l’attivazione, cede GDP per
Una volta attivata, RhoA esplica al sua azione tramite l’effettore
Rho-kinasi, il quale causa sensibilizzazione al calcio mediante inibizione
della fosfatasi della catena leggera della miosina.
Le principali funzioni fisiologiche di Rho-kinasi comprendono
contrazione, migrazione e proliferazione delle cellule.
RhoA si attiva attraverso il recettore associato a proteine G, con il
recettore tirosin kinasico o con alte concentrazioni di cloruro di
potassio (KCl).
In tutti questi casi si verifica l’attivazione di RhoA perché tutti e tre i
meccanismi citati portano alla trasformazione di GDP in GTP.
Generalmente il controllo dell’attività di RhoA viene esercitato da 3
gruppi di proteine: il fattore di scambio del nucleotide guanilico
(GEFs),la proteina attivante l’enzina GTPasi (GAPs) e l’inibitore della
dissociazione del nucleotide della guanina (GDIs)[8].
L’azione del fattore di scambio del nucleotide guanilico stimola lo
scambio tra GDP e GTP, al contrario la proteina attivante l’enzima
GTPasi e l’inibitore della dissociazione del nucleotide guanilico
L’inibizione dell’attivazione della proteina RhoA avviene, da parte di
GAPs, tramite un meccanismo di idrolisi del GTP e, ad opera di GDIs ,
attraverso l’inibizione sia della traslocazione della proteina verso la
membrana plasmatica sia dello scambio dei nucleotidi tramite
costituzione di un complesso citoplasmatico con GDP-RhoA [8].
Rho-kinasi è una kinasi serina-treonina che si lega alla forma attiva di
RhoA,esiste in due isoforme,la Rho-kinasiα o ROCK2 o ROKα e la
Rho-kinasi β o ROCK1 o ROKβ [8].
La regione dell’enzima deputata alla fosforilazione si trova sulla parte
N- terminale,la molecola presenta inoltre un dominio a spirale nella
regione C- terminale su cui si trova il sito di legame per GTP-RhoA e
un dominio pleckstrin homology [8].
RhoA e Rho-kinasi si trovano in molti tessuti incluse le cellule della
muscolatura liscia bronchiale umana, entrambe le proteine si trovano
nel citosol nello stato inattivo fino a che RhoA attivata con si lega alla
Rho-kinasi attivandola a sua volta e permettendone la traslocazione
verso la membrana citoplasmatica.
una sub unità della miosina chiamata MYPT1 (myosin phosphatase
targeting subunit 1) [8].
Rho-kinasi manifesta la sua azione fisiologica modulando la
contrazione della muscolatura liscia, intervenendo nella regolazione
del citoscheletro e nella migrazione cellulare.
Tali evidenze suggeriscono che RhoA e Rho-kinasi possano essere
implicate nella iperresponsività della muscolatura liscia
bronchiale,nella desensibilizzazione del recettore β,nel reclutamento di
eosinofili,nel rimodellamento delle vie aeree e nella limitazione del
passaggio d’aria,che sono caratteristiche peculiari della malattia
Figura 8 Rappresentazione schematica dei meccanismi di regolazione
5. Importanza di RhoA nei vari distretti
5.1 Ruolo di RhoA nel sistema gastrointestinale:
La muscolatura liscia può essere classificata in base alle caratteristiche
di contrazione in muscolatura tonica e fasica. La muscolatura liscia
tonica sviluppa e sostiene il tono basale miogenico in mancanza di
stimoli esterni, tipici esempi di questo tessuto nel sistema
gastrointestinale sono lo sfintere anale interno (IAS) e lo sfintere
esofageo inferiore (LES), che si occupano rispettivamente di consentire
il transito di materiale di scarto e di cibo e rispondono a
neurotrasmissione inibitoria nonadrenergica non colinergica.
Nel sistema cardiovascolare abbiamo come esempio le piccole arterie,
queste sono implicate in molte funzioni fisiologiche ad esempio il
mantenimento del tono basale dei vasi e la regolazione della pressione.
La muscolatura liscia fasica si contrae in maniera rapida e si rilascia in
seguito a stimolazione nervosa o di sostanze endogene come
Studi recenti indicano che l’azione di RhoA-kinasi come inibitore di
MLCP sia fondamentale per il mantenimento del tono basale sia per
quanto concerne lo sfintere inferiore esofageo umano e animale sia per
lo sfintere interno anale animale.
In seguito alla somministrazione di Y27632, inibitore di RhoA-kinasi,
sullo sfintere anale interno si registra un rilassamento
concentrazione-dipendente dello sfintere. Ulteriori sperimentazioni sull’uomo
confermano che l’utilizzo di inibitori di RhoA-kinasi determinano una
riduzione, concentrazione dipendente, del tono del LES .
Il cambiamento del tono muscolare di LES e IAS è associato con la
fisiopatologia di malattie debilitanti come incontinenza rettale, certe
forme di costipazione intestinale, acalasia, emorroidi e reflusso
gastroesofageo.
Sono stati documentati livelli di RhoA/ROCK II nella muscolatura di
IAS più alti in confronto alla muscolatura liscia rettale o del tratto
ano-coccigeo, inoltre l’azione di ROCK attiva nella muscolatura di IAS
risulta essere la causa di un aumento concentrazione-dipendente della
L’effetto contrario viene ottenuto con la somministrazione di
Y27632(inibitore di RhoA) [9].
5.2 Ruolo di RhoA nei disturbi cardiovascolari:
La contrazione delle cellule della muscolatura liscia vasale (VSMC)
dipende dai livelli di MLCP determinati dal bilancio delle attività di
Ca2+/Calmodulina/MLCK-dipendente e dall’attività di MLC
fosfatasi. L’inibizione di MLC fosfatasi da parte di
RhoA-Kinasi(ROCK) determina un aumento di MLCP e quindi l’inizio della
contrazione di VSMC. La regolazione di VSMC da parte di ROCK è
molto importante in quanto quest’enzima non solo determina il
mantenimento del tono muscolare di piccole arterie ma controlla
anche la contrazione di molti vasi di notevole rilevanza, come l’arteria
polmonare, l’arteria mesenterica e la vena porta.
L’implicazione del complesso RhoA/RhoA-kinasi nella regolazione
del tono vascolare lo rende di cruciale importanza nella cura
dell’ipertensione cardiovascolare dovuta all’incremento delle
resistenze periferiche ad opera di un aumento della contrazione della
In ratti con ipertensione spontanea è stato osservato un significativo
abbassamento della pressione sanguigna dopo trattamento con
Y27632, invece la somministrazione dello stesso farmaco in soggetti
normopressori non causa abbassamenti significativi, confermando il
ruolo di RhoA/RhoA-kinasi nella ipertensione cardiovascolare.
Ulteriori accertamenti in ratti con ipertensione spontanea dimostrano
che il trattamento con Y27632 causa un maggiore rilasciamento delle
arterie cerebrali e dell’arteria mesenterica rispetto ad animali di
controllo.
Questi dati inducono a ipotizzare una correlazione tra l’ipertensione
cronica e RhoA-kinasi [9].
5.3 Ruolo di RhoA in gravidanza:
Durante la gravidanza l’utero va incontro a molti cambiamenti
strutturali e funzionali.
Il miometrio rimane generalmente rilassato ma nel momento del parto
Studi pubblicati nel 2007 condotti su ratti [16] hanno dimostrato un
incremento di RhoA e RhoA-kinasi associata all’aumento della
contrattilità della muscolatura liscia del miometrio sui ratti e lo stesso
risultato è stato confermato da Cario. Toumanianz et al. in uno studio
pubblicato nel 2003 sul miometrio di conigli durante la gravidanza
[19;5].
Si può ipotizzare un coinvolgimento di RhoA e un suo erroneo
funzionamento in caso di parto prematuro [5].
5.4 Ruolo di RhoA e Rho-kinasi nella desensibilizzazione del recettore
β2 adrenergico:
Il recettore β2 agonista se stimolato provoca una massiccio
rilassamento della muscolatura delle vie aeree, sono considerati
bersagli di prima scelta nel controllo dell’attacco di asma.
Il recettore β2 è associato a proteine G,sviluppa dei sistemi di trasporto
che nell’ordine sono adenilato ciclasi, cAMP e proteina kinasi(PKA),
per arrivare a fosforilare i suoi bersagli molecolari ed esprimere le sue
La sua azione inibitoria nei confronti della contrazione della
muscolatura liscia bronchiale viene effettuata tramite una riduzione
della concentrazione di calcio intracellulare e un incremento
dell’azione della proteina kinasi (PKA).
Gli agonisti dei recettori β2 causano, tra l’altro, l’aumento della
apertura dei canali al potassio calcio dipendenti; di conseguenza una
ridotta capacità di uscita provoca un aumento della differenza di
depolarizzazione della cellula [8].
5.5 Ruolo di RhoA nella disfunzione erettile maschile
Anormalità nel segnale di RhoA/RhoA-kinasi sono state ipotizzate
anche nella disfunzione erettile maschile e molte ricerche sembrano
avvalorare questa tesi. L’erezione del pene è causata dall’aumento
dell’afflusso di sangue e della pressione a livello dei corpi cavernosi
che ne provocano il rigonfiamento, contestualmente si verifica un
rilassamento della muscolatura liscia delle arteriole di queste strutture.
Studi effettuati in vivo su ratti, utilizzando Y-27632 (inibitore di
calcio RhoA/RhoA-kinasi mediato a livello della muscolatura liscia
dei corpi cavernosi che mantenga il tono flaccido del pene.
È interessante notare come nei ratti l’applicazione topica di Y-27632
sulla tunica albuginea o sul glande o sulla pelle circostante causi
6. Farmaci che interferiscono con l’attività di RhoA.
6.1 RhoA e le statine:
Le statine sono farmaci ipocolesterolemizzanti, riducono i livelli di
colesterolo bloccandone la biosintesi tramite inibizione competitiva
della 3-idrossi-3-metilglutaril coenzima A (HMG-CoA) reduttasi che
Figura 9 Schema biosintesi del colesterolo [13].
Le statine presentano effetti pleiotropici, ad esempio agiscono come
antiinfiammatori e antiossidanti interferendo con effetti dovuti a vari
intermedi della sintesi del colesterolo, in particolare si tratta di
farnesilpirofosfato e geranilgeranilpirofosfato [7].
Queste molecole appartengono alla classe degli isoprenoidi pirofosfati
e sono implicati come precursori nella prenilazione post-trascrizionale
e nella attivazione di varie molecole, tra cui la RhoA.
La forma inattiva di RhoA legata a GDP si trova nel citosol insieme a
un inibitore della dissociazione dal GDP, chiamato RhoA-GDI che
scherma la coda idrofobica di RhoA costituita da geranilgeranile.
Tramite l’attivazione di recettori di membrana accoppiati a proteine
eterotrimeriche leganti il GTP, si attiva il fattore di scambio del
nucleotide della guanina (RhoGEFs), questo scambia GDP di RhoA
con GTP causando la dissociazione di RhoA-GDI e quindi l’attivazione
il legame di un agonista della contrazione al suo recettore, come
acetilcolina, causa la migrazione di RhoA e l’induzione della
contrazione della muscolatura liscia bronchiale. Possiamo affermare
quindi che tramite l’inibizione indiretta di RhoA, le statine riescono a
ridurre la sensibilizzazione al calcio della muscolatura liscia [7].
È stato dimostrato sui topi che in animali con asma indotto da
allergeni che presentano iperresponsività della muscolatura liscia
bronchiale, le statine svolgono un ruolo inibitore verso RhoA; al
contrario, negli animali sani non si verifica, la Lovastatina, non
6.2 Fasudil
Fasudil o HA-1077 è un farmaco inibitore di Rho-kinasi,è attualmente
l’unico inibitore di Rho-kinasi utilizzato in nella pratica clinica, in
Giappone viene somministrato per il trattamento del vasospasmo
cerebrale nei pazienti con emorragia subaracnoidea [4].Anche altre
molecole vengono usate per inibire l’attività di Rho-kinasi,ad esempio,
Y27632 è un derivato piridinico utilizzato come inibitore di Rho-kinasi,
agisce inibendo la contrazione della muscolatura liscia delle vie aeree
indotta da un agonista senza ridurre i livelli intracellulari di calcio.
Questa molecola è risultata attiva anche nella rilasciamento della
muscolatura liscia vascolare, per questo motivo è stata utilizzata in
alcuni studi per il trattamento dell’ipertensione dei ratti [8].
6.3 Epac
Epac è il fattore di scambio del nucleotide guanilico per piccole
proteine G Ras-like ed è dipendente da cAMP; la sua scoperta ha
modificato la convinzione secondo cui cAMP interagisse solo con la
Il fattore di scambio del nucleotide guanilico è stato individuato come
agente di collegamento tra l’attivazione di RhoA e cAMP.
Esistono due forme di Epac:Epac 1 (o cAMP-GEF-1 ) e Epac 2 (o
cAMP-GEF-2) ed entrambe sono implicate nella regolazione di molti
processi e sembra che siano in grado di agire sia in combinazione con
PKA che senza di essa [11].
Tra i processi in cui è interessato cAMP [18] abbiamo: la mobilità del
calcio, la contrazione della muscolatura liscia e cardiaca, la
memorizzazione e l’apprendimento, la differenziazione e la
proliferazione cellulare , l’apoptosi e l’infiammazione.
I recettori associati a proteine G controllano i livelli di cAMP
principalmente tramite sia adenilato ciclasi che cAMP fosfodiesterasi
Figura 11 Schema meccanismo di attivazione di Epac e
strutture delle sue forme Epac1 ed Epac2 [11].
Come illustrato nella figura 10[11], l’attivazione del recettore associato
a proteine Gs attiva l’AC che a sua volta aumenta i livelli di cAMP.
cAMP esercita un’azione di attivazione di Epac 1 e 2, questo porta a
sua volta ad attivazione di proteine Rap e R-Ras, le quali mediano
rispettivamente l’inibizione di RhoA, l’attivazione di fosfolipasi C
(PLC), l’attivazione della proteina kinasi B/AKT (PKB/AKT),
Questi meccanismi si traducono in attività di modulazione su
attivazione neuronale, sulla risposta immunitaria, sul processo
infiammatorio, sui processi di memoria e apprendimento, sulla
proliferazione e adesione cellulare, sull’ espressione di proteine, sui
flussi di calcio e sulle funzioni della membrana cellulare [11].
Nonostante la molteplicità dei processi in cui le proteine Epac sono
coinvolte, a volte con effetti contrastanti, in numerose sperimentazioni
sono stati impiegati analoghi dell’cAMP selettivi per questi fattori di
scambio per verificare se gli effetti regolati dall’cAMP fossero mediati
2. SCOPO DELLA TESI
Lo scopo di questa tesi di laurea era di verificare se la proteina RhoA,
la quale è implicata nel controllo dei meccanismi che regolano la
contrattilità della muscolatura liscia respiratoria, potesse
rappresentare un elemento-chiave del complesso network molecolare
correlato agli effetti del salbutamolo, un β2 agonista usato in clinica
per il trattamento sintomatico di malattie respiratorie croniche.
Il lavoro è stato fatto in collaborazione con il gruppo della Prof.ssa
Letizia Mattii del Dipartimento di Morfologia Umana e Biologia
3. MATERIALI E METODI
3.1 Sostanze chimiche
Il salbutamolo e un farmaco β2-agonista ad azione rilasciante sulla
muscolatura liscia bronchiale che appartiene alla categoria dei farmaci
β2-agonisti short acting, poiché produce un’azione rapida ma di breve
durata (circa tre ore). Il salbutamolo (Sigma Aldrich), è stato pesato e
disciolto in tampone fosfato (PBS; Sigma Aldrich) per formare una
soluzione madre 1 mM, che poi e stata successivamente diluita con
mezzo di coltura RPMI1640 senza fattori di crescita, per ottenere le
concentrazioni da saggiare (1 μM e 10μM).
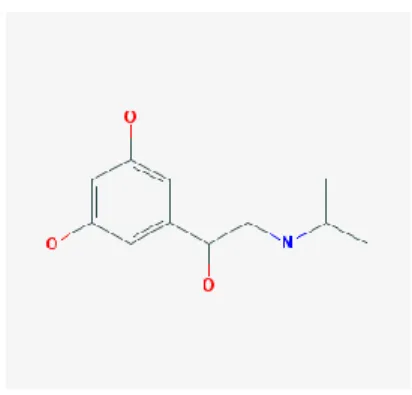
Il composto 8-pCPT-2′-O-Me-cAMP è un attivatore selettivo della
proteina Epac. La sostituzione con il gruppo metilico in posizione 2’
dello zucchero ribosio conferisce a questa molecola un’elevata
specificità nei confronti di Epac e la rende particolarmente utile come
tool farmacologico per lo studio dei meccanismi molecolari
cAMP-mediati, indipendenti dalla proteina PKA (Grandoch et al., 2010).
8-pCPT-2′-O-Me-cAMP è stato pesato e disciolto in tampone fosfato
(soluzione madre 10 mM). Le concentrazioni da saggiare (100 e 500
Figura 12 Struttura chimica del composto 8-pCPT-2′-O-Me-cAMP
3.2 Linea cellulare
Le cellule muscolari lisce bronchiali umane utilizzate in questa ricerca,
sono state acquistate da Lonza, (Walkersville, MD, USA). Il terreno di
coltura, ottimizzato per questa linea cellulare (SmGM™-2 BulletKit™),
era costituito da siero fetale bovino al 5% e fattori di crescita (es. FGF e
EGF), al quale veniva aggiunta una miscela 1:1 degli antibiotici
penicillina (5 UI/ml) e streptomicina (5 µg/ml) all’1%.
Questa linea cellulare è stata isolata dai bronchi principali di tessuti
normali e acquistate al secondo passaggio. È comunemente impiegata
per studi in vitro riguardanti malattie respiratorie croniche quali asma
micoplasmi, batteri o virus (HIV-1, epatite B e C). Le cellule crescono
in adesione hanno un tempo di duplicazione di circa 24 ore. Da un
punto di vista morfologico presentano forma irregolare affusolata.
Figura 13 Fotomicrografia della linea cellulare BSMC
Il mantenimento delle cellule è stato realizzato in fiasche T75 ad una
temperatura costante di 37 °C, in atmosfera controllata al 5% di CO2.
Le cellule sono state controllate quotidianamente e il mezzo di coltura
è stato sostituito quando necessario.
Per la conservazione della linea cellulare a lungo termine è stato
utilizzato un mezzo di congelamento ottenuto aggiungendo al mezzo
state poste per circa 24-48 ore a una temperatura di -80°C e in seguito
conservate in azoto liquido.
3.3 Immunocitochimica
La valutazione della RhoA è stata effettuata mediante
immunocitochimica, grazie alla peculiarità di questa proteina di
migrare da un compartimento cellulare ad un altro a seguito di una
stimolazione. In particolare, nello stato inattivo, Rho A è situata nel
citosol mentre, quando attivata, essa si localizza sulla membrana
citoplasmatica. Per l’analisi, Le cellule sono state raccolte, centrifugate
su vetrini e fissate in formalina all’1% per 1 minuti a 4°C. Allo scopo
di evidenziare i siti antigenici, i campioni sono stati successivamente
trattati per 10 minuti con Triton X-100 in tampone citrato e incubati
per 15 minuti con una soluzione di perossido di idrogeno allo 0,6% e
metanolo per bloccare l’attività delle perossidasi endogene. Dopo
trattamento per 20 minuti a 37°C in siero di suino (per saturare i siti
antigenici aspecifici), i campioni sono stati incubati overnight a 4°C con
l’anticorpo primario policlonale di coniglio diretto verso RhoA.
policlonale secondario biotinilato, un complesso
streptavidina-perossidasi e 3,3-diaminobenzidina tetraidrocloruro (DAB) contenente
H2O2, produceva una colorazione marrone. I campioni sono stati
sottoposti a controcolorazione con ematossilina e quindi disidratati in
etanolo e successivi passaggi in xilolo per il montaggio con balsamo
DPX Mountant.
3.4 ELISA
Per l’analisi quantitativa dell’attivazione della proteina RhoA è stato
impiegato il kit “G-LISA TM RhoA activation Assay” (Cytoskeleton).
Le cellule sono state lisate e il campione risultante è stato utilizzato, in
parte, per effettuare la quantificazione proteica con saggio Bradford.
La parte restante è stata congelata in azoto liquido e mantenuta in
frigo a -80°C fino al momento dell’analisi. I lisati sono stati scongelati e
diluiti con buffer di lisi, ad una concentrazione proteica nell’intervallo
0,4-2 mg/ml. Venticinque µl di tali lisati sono stati successivamente
incubati per 30 minuti a 4°C in una piastra da 96 pozzetti ad alta
affinità per RhoA attivo (RhoA-GTP). Per ogni esperimento sono stati
proteina in grado di legare RhoA nella sua forma attiva, ed un
controllo negativo, contenente soltanto buffer di lisi. Dopo 2 passaggi
in tampone di lavaggio i campioni sono stati incubati per 2 minuti con
uno smascherante antigenico e per 45 minuti a temperatura ambiente
con una soluzione contenente l’anticorpo primario anti-RhoA. Sono
stati poi effettuati 2 lavaggi consecutivi e i campioni sono stati incubati
per altri 45 minuti a temperatura ambiente con una soluzione
contenente l’anticorpo secondario marcato con perossidasi. Dopo altri
3 lavaggi, i campioni sono stati trattati per 15 minuti a 37°C con la
soluzione di rivelazione. Immediatamente dopo il blocco della
reazione con tampone specifico, il grado di reattività è stato valutato
misurando l’assorbanza a 490 nm con uno spettrofotometro per
micropiastre (VICTOR, Wallack).
3.5 Analisi dei risultati e statistica
I risultati sono stati espressi come valori medi ± errore standard della
media (S.E.M.) e graficati mediante GraphPad Software. L’analisi
statistica è stata realizzata mediante analisi della varianza (ANOVA)
4. RISULTATI
La finalità di questo lavoro di tesi era indagare il ruolo della proteina
RhoA nel meccanismo d’azione del farmaco salbutamolo in cellule
della muscolatura liscia bronchiale umana. A tale scopo sono stati
effettuati esperimenti utilizzando due diversi metodi di analisi,
immunocitochimica e immunoenzimatica, con i quali abbiamo
valutato il grado di attivazione della proteina RhoA, in presenza o
assenza di salbutamolo o dell’ attivatore selettivo Epac,
8-pCPT-2ˈ-O-Me-cAMP.
L’analisi immunocitochimica utilizza anticorpi anti-RhoA e
l’attivazione della proteina viene valutata in termini di traslocazione
dal citosol alla membrana cellulare. Infatti, RhoA, per essere attivata,
deve necessariamente ancorarsi al doppio strato fosfolipidico della
plasmacellula tramite gruppi isoprenoidi: in questa posizione, grazie
alla sua attività GTPasica, RhoA riesce ad attivare segnali a valle che
modulano i suoi effetti biologici sulla muscolatura liscia delle vie
respiratorie, che consistono nell’aumento della sensibilità a stimoli
Come possiamo osservare nella figura 14a, le cellule di controllo sono
caratterizzate da un’alta espressione della proteina RhoA, che si trova
localizzata quasi esclusivamente nel citoplasma (come evidenziato
meglio nel riquadro piccolo). L’abbondanza di RhoA nelle cellule
muscolari lisce bronchiali umane, sottolinea l’importanza funzionale
di questa proteina in questo tessuto e la necessità di capire meglio il
suo ruolo nel meccanismo d’azione di farmaci comunemente impiegati
nel trattamento delle malattie respiratorie croniche.
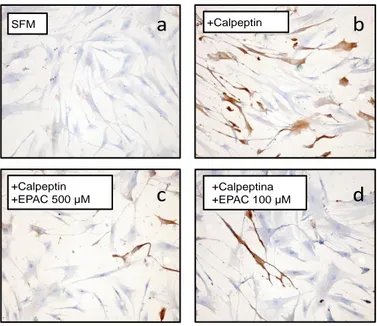
SFM +Calpeptina +Sal 1 µM for 24 h +Calpeptina +Calpeptina +Sal 10 µM for 15’ a b c d
La stimolazione delle cellule muscolari lisce umane da parte della
calpeptina, promuove la traslocazione di RhoA dal citosol alla
membrana cellulare: tale spostamento è evidenziato dalla più netta
demarcazione dei contorni cellulari rispetto alle cellule di controllo
(Figura 14b). Il trattamento acuto delle cellule muscolari lisce stimolate
con calpeptina, con salbutamolo alla concentrazione 10 µM per 15
minuti, bloccando la delocalizzazione di RhoA verso la membrana
cellulare, ne impedisce l’attivazione, come dimostra l’immagine della
Figura 14c (simile a quella osservata per le cellule di controllo).
Il trattamento cronico con salbutamolo 1 µM per 24 ore, invece ha un
effetto minore rispetto al trattamento acuto con lo stesso farmaco.
Questa differenza tra le due modalità di trattamento è verosimilmente
ascrivibile alla desensibilizzazione omologa del recettore β2
adrenergico indotta nelle cellule muscolari liscie dall’esposizione
prolungata al β2 agonista che attenua l’azione inibitoria del
salbutamolo sull’attivazione di RhoA (Figura 14d).
Dai risultati ottenuti, possiamo inoltre constatare che la
completamente l’effetto indotto dal trattamento acuto con
salbutamolo. Questo risultato, probabilmente si spiega considerando
che le cellule muscolari lisce umane delle vie respiratorie presentano
un’ampia riserva di recettori β2 adrenergici che le protegge, almeno in
parte, dall’azione desensibilizzante indotta dal farmaco [20].
Allo scopo di quantificare l’effetto del salbutamolo sull’attivazione
della proteina RhoA è stato eseguito un saggio ELISA. Come possiamo
vedere nella figura 15,la presenza di calpeptina determina un aumento
marcato dell’attivazione di RhoA ( circa 5 volte rispetto alle cellule di
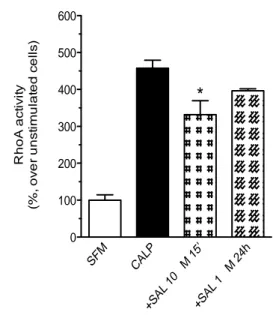
controllo). SFM CALP +SA L 10 mM 1 5' +SA L 1 mM 2 4h 0 100 200 300 400 500 600 *
Figura 2. Analisi ELISA dell'attivazione della proteina RhoA in presenza o in assenza di salbutamolo in cellule muscolari lisce bronchiali umane. SFM: serum-free medium; Sal: salbutamolo. *p<0,05.
R h o A a c ti v it y (% , o v e r u n s ti m u la te d c e ll s )
Figura 15 Analisi ELiSA dell’attivazione della proteina RhoA in presenza o in assenza di salbutamolo in cellule muscolari lisce bronchiali umane. SFM: serum free medium ; Sal: salbutamolo ;* p<0,05 .
Il trattamento acuto con salbutamolo 10 µM per 15 minuti determina
una riduzione significativa (p< , 5) dell’attivazione di RhoA indotta
dalla calpeptina, di circa il 30% (Figura 15).
Come precedentemente osservato in immunoistochimica, il
trattamento cronico con salbutamolo (1µM per 24 ore), riduce
parzialmente l’effetto inibitorio dello stesso farmaco sull’attivazione di
RhoA.
Per indagare meglio il meccanismo d’azione molecolare del
salbutamolo, sono stati effettuati esperimenti utilizzando un attivatore
selettivo della proteina Epac, una proteina coinvolta nei meccanismi di
trasduzione delle vie mediate dal cAMP. La figura 16 mostra i risultati
di esperimenti effettuati in immunocitochimica che evidenziano come
il composto 8-pCPT-2ˈ-O-Me-cAMP sia in grado di riprodurre gli
Anche in questo esperimento si evidenzia la delocalizzazione di RhoA
indotta dalla calpeptina (Figura 16b). Le cellule stesse sono state poi
incubate per 15 minuti con l’attivatore Epac alle concentrazioni 500 µM
e 100 µM, rispettivamente (figura 16c e 16d). Questo trattamento ha
prodotto una marcata inibizione dell’attivazione della proteina RhoA,
in modo indipendente dalla concentrazione saggiata.
SFM +Calpeptin
+Calpeptin
+EPAC 500 µM +Calpeptina +EPAC 100 µM
Figura 3. Analisi immunocitochimica dell’attivazione della proteina RhoA in presenza o in assenza di 8-pCPT-2'-O-Me-cAMP (attivatore Epac) in cellule muscolari lisce bronchiali umane. SFM: serum-free medium.
a b
c d
Figura 16 Analisi immunocitochimica dell'attivazione della proteina RhoA in presenza o in assenza del composto 8-pCPT-2'-O-Me-cAMP(attivatore Epac) in cellule muscolari liscie bronchiali umane. SFM:serum free medium.
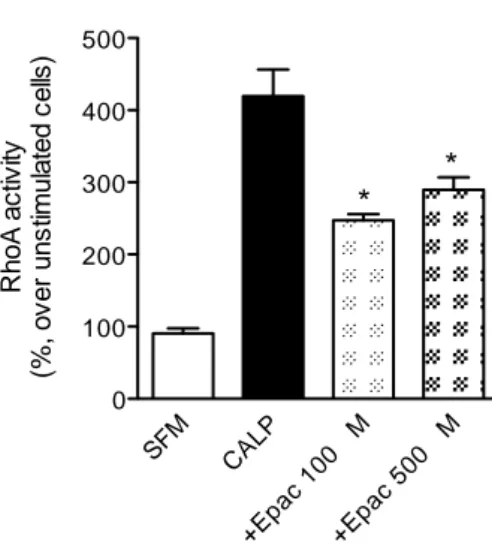
La valutazione quantitativa dell’effetto dell’attivatore Epac, effettuata
mediante saggio ELISA, ha confermato i dati prodotti in
immunocitochimica.
Il composto 8-pCPT-2ˈ-O-Me-cAMP è in grado, quindi, di inibire
l’attivazione di RhoA indotta dalla calpeptina, a livelli paragonabili a
quelli prodotti dal trattamento con salbutamolo.
SFM CALP +Epa c 10 0 m M +Epa c 50 0 m M 0 100 200 300 400 500 * *
Figura 4. Analisi ELISA dell'attivazione della proteina RhoA in presenza o in assenza del composto 8-pCPT-2'-O-Me-cAMP (attivatore Epac) in cellule muscolari lisce umane. SFM: serum-free medium. *p<0,05 R h o A a c tiv ity (% , o v e r u n s tim u la te d c e lls )
Figura 17 Analisi ELiSA dell’attivazione della proteina RhoA in presenza o in assenza del composto 8-pCPT-2’-O-Me-cAMP in cellule muscolari lisce bronchiali umane. SFM: serum free medium;* p<0,05 .
5. CONCLUSIONI
I risultati di questa tesi di laurea dimostrano che:
(i) il salbutamolo inibisce l’attivazione della proteina RhoA in
cellule muscolari lisce bronchiali umane mediante la via
β2-AR/Epac;
(ii) la desensibilizzazione omologa del recettore β2 adrenergico
può attenuare tale effetto.
Nonostante la natura preliminare di questi esperimenti, i risultati di
questo studio hanno importanti implicazioni farmacologiche
indicando il possibile ruolo di RhoA nel meccanismo molecolare
responsabile degli effetti del salbutamolo sul controllo della
6.
BIBLIOGRAFIA
1. Ministero della Salute ,direzione generale del sistema informativo:"Relazione sullo stato sanitario del Paese 2005-2006",www.salute.gov.it, 2008;
2. Janssen L. J. e Killian K. : "Airway smooth muscle as a target of asthma therapy : history and new directions", Respiratory Research 7:123-135, 2006;
3. Matsui T., Amano M., Yamamoto T., Chihara K., Nakafuku M., Nakano T., Okawa K., Iwamatsu A., Kaibuchi K. : "Rho-associated kinase, a novel serine/threonine kinase as a putative target for small GTP binding protein Rho". EMBO J. 15(9): 2208-16, 1996;
4. Schaafsma D. , Gosen R., Zaagsma J., Halayko A.J., Meurs H. :"Rho kinase inhibitors : A novel therapeutical intervention in asthma?" European Journal of Pharmacology 585, 398-406, 2008; 5. Chiba Y. e Misawa M. : "The role of RhoA-mediated Ca2+
sensitization of bronchial smooth muscle contraction in airway hyperresponsiveness". J. Smooth Muscle Res. 40, 155-167, 2004; 6. Pasqualino A., Panattoni G.L. "Anatomia
Umana,citologia,istologia,embriologia ,anatomia sistematica" UTET , Torino, 2002;
7. Chiba Y., Arima J., Sakai H., Misawa M. :"Lovastatin inhibits bronchial hyperresponsiveness by reducing RhoA signaling in rat allergic asthma". Am J Physiol Lung Cell Mol Physiol 294:705-713, 2008 ;
8. Kume H. : "RhoA/Rho-kinasi as a Therapeutic Target in Asthma". Current Medicinal Chemistry, 15: 2876-2885, 2008;
9. De Godoy M., Rattan S. : "Role of Rho-kinase in the functional and dysfunctional tonic smooth muscles" , Trends in Pharmacological Sciences 32, 384-392, 2011;
10. Katzung ;" Farmacologia generale e clinica " 6° edizione in lingua italiana sulla 9° in lingua inglese a cura di Paolo Preziosi, PICCIN Ed., Padova, 2006;
11. Grandoch M., Roscioni S.S., Schmidt M. : "The role of Epac proteins, novel cAMP mediators, in the regulation of immune, lung and neuronal function". British Journal of Pharmacology 159,265-284, 2010;
12. Berne R. M.,Levy M.N. :"Principi di fisiologia ". Terza edizione, Casa Editrice Ambrosiana,Milano,2002 ;
13. Sapientemente.blogspot.com "biosintesi del colesterolo: le Quattro tappe del processo e la sua regolazione";
14. Williams e Lemke "Foye’s principi di chimica farmaceutica", IV Edizione italiana condotta sulla V americana a cura di : Dall’Acqua ,Caffieri.,PICCIN Ed., Padova, 2 5;
15. Pontieri G.M.,Russo M.A., Frati L. : "Patologia generale "Tomo II , III edizione, PICCIN Ed., Padova,2005 ;
16. Niiro N., Nishimura j., Sakihara C., Nakano H., Kanaide H: "Up regulation of RhoA and Rho-kinase mRNAs in the rat myometrium during prenancy". Biochem. Biophys Res. Commun. 230:356-359, 1997;
17. Wjocialk-Stothard B. : "New drug targets for pulmonary hypertension : Rho GTPases in pulmonary vascular remodelling". Postgrad Med J. 84: 348-53, 2008;
18. Beavo J.A., Brunton LL., "Cyclic nucleotide research—still expanding after half a century". Nat. Rev. Mol. Cell. Biol. 3:710-8, 2002;
19. Cario-Toumaniantz C., Reillaudoux G., Sauzeau V., Heutte F., Vaillant N., Finet M., Chardin P., Loirand G., Pacaud P.: "Modulation of RhoA-Rho kinase-mediated Ca2+ sensitization of rabbit myometrium during pregnancy-role of Rnd3" . J.Physiol. (Lond.) 552:403-413, 2003;
20. Giembycz MA: "An estimation of beta 2-adrenoceptor reserve on human bronchial smooth muscle for some symphatomimetic bronchodilators". Br. J. Pharmacol. 159: 287-99, 2009;
Glossario
MLCK : kinasi della catena leggera della miosina Ca2+/Calmudulina dipendente;
IP3:inositolo trifosfato; DAG : diacilglicerolo;
GAPS:proteina attivante l’enzima GTPasi;
GEFs: fattore di scambio del nucleotide guanilico;
GDIs:inibitore della dissociazione del nucleotide della guanidina; MYPT1:myosin phosphatase targeting subunit 1;
IAS:sfintere anale interno;
LES: sfintere esofageo inferiore;
VSMC: cellule della muscolatura liscia vascolare; ROCK: Rho kinasi;
MLCP:fosfatasi della catena leggera della miosina; PKA:proteina kinasi A;
Epac:fattore di scambio del nucleotide guanilinico per piccole GTPasi Ras-like;
cAMP:adenosina monofosfato ciclica; PDEs: cAMP fosfodiesterasi;
AC: adenilato ciclasi; PLC: fosfolipasi C; PLD: fosfolipasi D;
Ringraziamenti
Ringrazio tutti coloro che mi hanno sostenuta e sopportata in questi anni.
Ringrazio la Prof.ssa Breschi e il dott. Fogli per avermi fatto da guida in questo ultimo passo finale.
Ringrazio la mia Famiglia per avermi permesso di studiare e per non avermi mai fatto mancare il suo sostegno.
Ringrazio Fabio e Barbara per i loro preziosi consigli e la loro amicizia,senza di loro non sarebbe stato lo stesso.
Ringrazio Alessia,Elena ,Francesca,Sara e Rosi ,splendide compagne di viaggio,per il meraviglioso tempo trascorso insieme .
Ringrazio tutti coloro che ruotano intorno al "nostro" laboratorio,per avermi aperto le porte di un mondo eccezionale : la ricerca.
Ringrazio Deborah,che mi sopporta da anni ed ha vissuto con me quest’avventura dall’inizio nei momenti belli e in quelli meno piacevoli.
Ringrazio Lucia che da Parigi non mi ha mai fatto mancare il suo supporto.
Ringrazio Serena per avermi sostenuta sempre.
Ringrazio tutti gli amici ,in particolare Sara e Rossella, che hanno condiviso con me le mie gioie e le mie preoccupazioni.
![Figura 8 Rappresentazione schematica dei meccanismi di regolazione intracellulari di RhoA/Rho-kinasi [4]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7565800.111036/27.892.138.784.106.669/figura-rappresentazione-schematica-meccanismi-regolazione-intracellulari-rhoa-kinasi.webp)