Riassunto 5
Abstract 7
INTRODUZIONE
9
Sviluppo precoce dei Vertebrati 10
Neurulazione 10
Differenziamento del tubo neurale 10
Struttura istologica del sistema nervoso centrale 11
Sviluppo dell’occhio 12
Formazione delle strutture dell’occhio 12
Tipi cellulari della retina 13
Retinogenesi 14
La zona del margine ciliare 15
Sviluppo del chiasma 17
Mappe topografiche 18
Geni coinvolti nello sviluppo delle strutture neurali 19
La metamorfosi 28
La metamorfosi degli Anfibi 28
Importanza dell’ormone tiroideo alla metamorfosi 29
Ruolo dell’ormone tiroideo e dei recettori 30
Xenopus laevis come sistema modello 31
Metamorfosi del sistema visivo di Xenopus laevis 32
Proliferazione asimmetrica della retina 33
• Ruolo dell’ormone tiroideo 33
• Deiodinasi di tipo III (D3) 34
Connessioni retinotalamiche ipsilaterali 35
• Ruolo delle efrine e dei recettori Eph 36
Scopo della tesi 38
MATERIALI E METODI
39
Soluzioni di uso comune 40
Trasformazione di cellule competenti 41
Ceppi batterici 41
Trasformazione batterica (cellule rese competenti con RbCl) 42 Trasformazione batterica (cellule elettrocompetenti) 43
Cloni 44
Estrazione di DNA plasmidico su piccola scala mediante lisi alcalina
(“mini-prep”) 45
Estrazione di DNA plasmidico su media scala mediante colonne
NUCLEOBOND AX-100 (“midi-prep”) 46
Digestione di plasmidi con enzimi di restrizione 48
Purificazione del DNA 49
Precipitazione in Fenolo-Cloroformio-alcool isoamilico 49 GenEluteTM Gel Extraction Kit (purificazione di plasmidi e frammenti di DNA da
gel di agarosio) 50
Elettroforesi su gel di agarosio 52
Stima della concentrazione di acidi nucleici in soluzione 53
Elettroforesi su gel di agarosio 53
Spettrofotometria UV 53
Trascrizione in vitro di RNA marcato con DIG-UTP 54
Estrazione di RNA con guanidina tiocianato 55
Estrazione di RNA con kit NucleoSpin RNA II (Machery-Nagel) 56
Estrazione di RNA con TRIzol® Reagent 57
Trattamento con DNasi sull’RNA estratto 58
RT-PCR (“Reverse Transcription Polymerase Chain Reaction”) 59
Embrioni di Xenopus laevis 62
Raccolta di embrioni 62
Embrioni metamorfici 63
Trattamento con ormone tiroideo (T3) 63
Istologia 64
Fissazione e disidratazione 64
Inclusione in resina OCT o “Tissue-Tek” 64
Inclusione in agarosio-LMP 4% in MBS 1X 65
Sezioni al criostato 65
“Whole mount in situ hybridization” 66
Ibridazione in situ su sezioni 68
Rivelazione immunoistochimica 70
Incorporazione di Bromodeossiuridina (BrdU) 71 Rivelazione della Bromodeossiuridina (BrdU) 71 Marcatura delle proiezioni retiniche con perossidasi HRP 72 Rivelazione della perossidasi HRP in “whole-mount” 73 Rivelazione della perossidasi HRP su sezione con diamminobenzidina (DAB)
74 Rivelazione della perossidasi HRP su sezione con Tiramide 75
Colorazione anterograda con DiI 76
Iniezioni di DiI 77
Lipofezione in vivo 78
Cellule eucariotiche 79
Piastratura 79
Conteggio delle cellule eucariotiche 80
Trasfezione 80
Prelievo e quantificazione della proteina ottenuta dalla trasfezione 81 Alkaline Phosphatase-tag staining (AP-tag staining) 82
Microfotografie 84
RISULTATI
86
Analisi dell’espressione di geni regolati dall’ormone tiroideo 87 Formazione delle connessioni retinotalamiche ipsilaterali alla metamorfosi
98
Lipofezione in vivo 99
Marcatura anterograda del nervo e del tratto ottico 101 Ibridazioni in situ per l’analisi dell’espressione dell’efrina-B2 103 Ibridazioni in situ per l’analisi dell’espressione dei geni candidati 104
DISCUSSIONE
109
Espressione di geni regolati dall’ormone tiroideo 110 Formazione delle connessioni retinotalamiche ipsilaterali alla metamorfosi114
Riassunto
La metamorfosi è un processo fondamentale nello sviluppo degli Anfibi, in cui assistiamo ad una serie di cambiamenti che coincidono con il passaggio alla vita adulta. Tali cambiamenti coinvolgono tutte le strutture dell’organismo, sia interne sia esterne. Nel girino, animale con abitudini di vita da preda, gli occhi sono disposti lateralmente all’encefalo; al contrario, durante la metamorfosi, assistiamo allo spostamento degli occhi in posizione dorso-frontale, locazione che verrà mantenuta nell’adulto e che coincide con un’abitudine di vita da predatore; ciò comporta l’acquisizione di una parziale binocularità dovuta al sovrapporsi dei due campi visivi, rendendo migliore la percezione della profondità. Tale spostamento degli occhi è accompagnato da un accrescimento asimmetrico della zona del margine ciliare (CMZ) che avviene durante la metamorfosi. In questo frangente, si assiste ad una maggiore proliferazione della CMZ ventrale rispetto a quella dorsale con l’effetto di compensare lo spostamento dell’occhio in senso dorso-frontale, in modo da mantenere inalterata la percezione dell’ambiente esterno. La proliferazione della CMZ dorsale è minore in quanto, in questa regione, permane espressa la deiodinasi di tipo III (D3) che è in grado di inattivare l’ormone tiroideo.
L’ormone tiroideo (TH) svolge un ruolo basilare durante la metamorfosi in quanto molti cambiamenti, sia morfologici sia fisiologici, sono dovuti alla sua azione. I recettori dell’ormone tiroideo sono intracellulari e, in seguito al legame con il TH stesso, sono capaci di traslocare all’interno del nucleo operando come fattori di trascrizione su vari geni, sia stimolandone la trascrizione sia inibendola; uno di questi geni è la deiodinasi di tipo III (D3) la cui trascrizione viene potenziata in risposta all’ormone tiroideo.
Durante lo sviluppo antecedente la metamorfosi, tutte le cellule gangliari della retina emettono assoni che entreranno in contatto sinaptico con il talamo controlaterale, incrociandosi sul pavimento del diencefalo a livello del chiasma ottico. Con la metamorfosi, nella regione del chiasma, si accende l’espressione dell’efrina-B2, proteina esposta sulla membrana citoplasmatica delle cellule del chiasma. Un’esigua percentuale di assoni provenienti dalla retina, e più precisamente dalla regione ventro-temporale, espone sulla membrana citoplasmatica il recettore EphB1, in grado di interagire con l’efrina-B2; al riconoscimento tra ligando e recettore seguono una serie di eventi intracellulari che portano alla repulsione dell’assone dal chiasma, indirizzandolo ad entrare in contatto sinaptico con il talamo ipsilaterale.
Un primo scopo della tesi è stato quello di caratterizzare geni della retina la cui espressione fosse sotto il controllo dell’ormone tiroideo; a tal fine, sono stati condotti alcuni trattamenti con l’ormone tiroideo su girini premetamorfici, controllando che la CMZ ventrale proliferasse maggiormente rispetto alla dorsale mediante esperimenti di incorporazione della bromodeossiuridina nelle cellule in proliferazione. Per saggiare la risposta dei diversi geni al TH, abbiamo proceduto tramite l’analisi di geni candidati, utilizzando le tecniche di ibridazione in situ su sezione, per valutare qualitativamente i cambiamenti nell’espressione genica a livello della retina, e di RT-PCR per un’analisi contemporanea su un numero maggiore di geni. Abbiamo osservato che, oltre a quella di D3, anche la trascrizione dei geni Xotch e XcycD1, inerenti il ciclo cellulare, è potenziata dall’ormone tiroideo: tale attivazione risulta maggiore nella CMZ ventrale che nella dorsale. Il passo successivo sarà quello di sfruttare la tecnica dei “microarray” per ampliare ulteriormente la nostra analisi.
Un secondo obiettivo è stato quello di individuare i fattori di trascrizione responsabili dell’attivazione dell’espressione dell’efrina-B2 a livello del chiasma al momento della metamorfosi, con la conseguente formazione delle connessioni retinotalamiche ipsilaterali. A questo scopo, abbiamo rivelato quali geni, codificanti per fattori di trascrizione, siano espressi a livello del chiasma al momento della metamorfosi, individuando i geni Xvax2, Xzic2, Xsix3, Xnkx2.1 e Xdll3. Utilizzando la tecnica della lipofezione, cercheremo di far esprimere precocemente questi fattori di trascrizione in modo da valutare se siano in grado di accendere l’espressione dell’efrina-B2 nel chiasma, con la possibile formazione precoce di connessioni retinotalamiche ipsilaterali. Abbiamo infine caratterizzato l’espressione della proteina dell’efrina-B2 a livello del chiasma a stadi metamorfici, mediante il saggio della “alkaline phosphatase-tag staining”.
Abstract
Metamorphosis is a fundamental process of amphibian development, in which many changes take place, and that coincides with the passage to adult life. These changes involve all the structures of the organism, including the eyes. In the tadpole, an animal with a prey lifestyle, the eyes are localized laterally to the brain; instead, during metamorphosis, we assist to the eyes’ movement to a dorso-frontal position, that is maintained in the adult and appropriated to a predatory lifestyle. This is accompanied by the acquisition of a partial binocularity due to overlap of two eye fields. The movement of the eyes is also accompanied by an asymmetric growth of the ciliary margin zone (CMZ) during metamorphosis. In fact, we assist to an increased proliferation of the ventral CMZ compared to the dorsal CMZ. This has the effect to compensate the dorso-frontal movement of the eyes, in order to maintain the same perception of the environment. The dorsal CMZ proliferation is reduced because this region expresses the type III deiodinase (D3), an enzyme which can inactivate thyroid hormone, thus rendering it inactive.
Thyroid hormone (TH) plays a key role during metamorphosis, in fact, most changes, both morphological and physiological, are due to its action. Thyroid hormone receptors are intracellular and, after binding to TH, can traslocate into the nucleus acting as transcription factors, up- or down-regulating the transcription of many different genes; one of these is D3, whose transcription is up-regulated by thyroid hormone.
During embryonic development, before metamorphosis, every retinal ganglion cell sends its axon to innervate the contralateral thalamus, crossing the floor of diencephalon at the level of the optic chiasm. During metamorphosis, in the chiasm region, expression of ephrin-B2, a transmembrane protein expressed by chiasm cells, starts being expressed. A low percentage of axons coming from the ventro-temporal region of the retina, express the receptor EphB1. EphB1 interacts with ephrin-B2 in the optic chiasm, this leads to repulsion of retinal axons, leading to the formation of ipsilateral projections to the thalamus.
The first aim of my thesis has been to characterize retinal genes whose expression is regulated by thyroid hormone. We treated premetamorfic tadpoles with thyroid hormone, in order to check the goodness of the treatment we analyzed the asymmetrical growth of the CMZ, using BrdU incorporation in proliferating cells. To assay the genes’ answer to TH, we proceeded to analysis of candidate genes, both by in situ hybridisation on sections, to estimate changes of gene expression in the retina qualitatively, and by RT-PCR for a
parallel analysis on a great number of genes. We observed that thyroid hormone treatments increase transcription of Xotch and XcycD1, involved in cell cycle, in addition to D3: this activation is stronger in ventral CMZ than in dorsal CMZ. Our next step will be to use microarray technique to broaden our analysis.
The second aim has been to identify some transcription factors responsible for activation of ephrin-B2 expression in the optic chiasm during metamorphosis, with consequent formation of ipsilateral retinothalamic projections. We searched for genes coding for transcription factors, expressed in the optic chiasm during metamorphosis, we identified Xvax2, Xzic2, Xsix3, Xnkx2.1, Xdll3. Using the lipofection technique, we will try to express these transcription factors precociously to analyse whether they can turn on ephrin-B2 expression in the optic chiasm, with possible formation of ipsilateral retinothalamic projections. Finally, we characterized the expression of the protein ephrin-B2 in the optic chiasm at metamorphosis, using the technique “alkaline phosphatase-tag staining”.
Sviluppo precoce dei Vertebrati
I Vertebrati presentano un aspetto molto simile al termine della gastrulazione; con il progredire dello sviluppo le singole specie divengono maggiormente distinguibili in quanto compaiono caratteristiche sempre più specifiche.
La gastrulazione è un processo caratterizzato da movimenti di cellule e tessuti ad alto grado di integrazione, durante il quale si assiste alla riorganizzazione delle cellule della blastula.
Queste assumono così una localizzazione diversa, entrando in contatto con nuove cellule; in questo modo prende forma il piano strutturale dell’organismo con tre foglietti embrionali: uno ectodermico esterno, uno endodermico interno e uno mesodermico intermedio.
La fase successiva dello sviluppo consiste nell’interazione tra il mesoderma dorsale e il soprastante ectoderma, evento che condurrà all’organogenesi.
Neurulazione
Nei Vertebrati, la neurulazione conduce alla formazione del tubo neurale, una struttura epiteliale di natura ectodermica, che darà origine al cervello e al midollo spinale; durante questa fase l’embrione assume il nome di neurula. Il tessuto del futuro tubo neurale forma inizialmente una lamina ispessita, detta piastra neurale, localizzata nella regione dorsale dell’embrione, grazie all’induzione operata dal mesoderma sottostante. In questo frangente, le cellule assumono una diversa conformazione a seconda del loro destino: quelle che andranno a far parte del futuro tubo neurale si allungano, mentre quelle destinate a formare l’epidermide si appiattiscono. Il cambiamento di forma porta al sollevamento dei bordi della piastra rispetto alla sua superficie: i bordi formano le pliche neurali che delimitano un solco neurale centrale. Quindi, le pliche neurali si fondono lungo la linea mediana dorsale dell’embrione dando origine al tubo neurale che, infine, si separa dall’ectoderma adiacente, sprofondando al di sotto di esso.
Differenziamento del tubo neurale
Le prime fasi dello sviluppo del cervello sono simili nella maggior parte dei Vertebrati; tra questi i Mammiferi presentano il grado di complessità maggiore. Il tubo neurale iniziale dei Mammiferi è una struttura rettilinea. Tuttavia, ancor prima che la parte posteriore del tubo neurale si sia definitivamente formata, la regione craniale subisce notevoli modifiche.
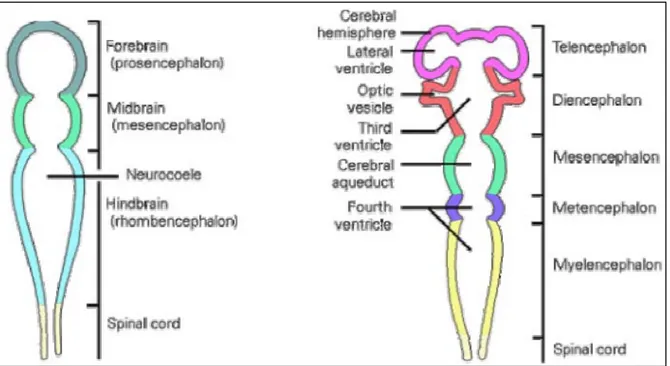
Figura 1. Differenziamento del tubo neurale.
Nella sua regione anteriore, il tubo neurale si rigonfia in tre vescicole primarie: prosencefalo, mesencefalo e rombencefalo (Figura 1). Mentre il tubo neurale completa la sua chiusura nella regione caudale, dal prosencefalo si estroflettono lateralmente due protuberanze secondarie, le vescicole ottiche.
In un momento successivo, il prosencefalo si divide in un telencefalo anteriore e in un diencefalo posteriore, con il primo che originerà gli emisferi cerebrali e il secondo le regioni del talamo e dell’ipotalamo, nonché il chiasma ottico. Il mesencefalo, invece, rimane indiviso e il suo lume formerà il dotto cerebrale. Il rombencefalo si divide in metencefalo anteriore, il futuro cervelletto, e in mielencefalo posteriore che diverrà il midollo allungato.
Struttura istologica del sistema nervoso centrale
Il tubo neurale è costituito inizialmente da un neuroepitelio germinativo pseudostratificato, infatti abbiamo un unico strato cellulare, ma la diversa disposizione dei nuclei gli conferisce un aspetto pluristratificato.
Con il progredire dello sviluppo, le cellule adiacenti al lume del tubo neurale continuano a dividersi mentre le cellule differenziate di nuova formazione si allontanano da questa regione, formando un nuovo strato denominato zona del mantello; l’epitelio germinativo assume quindi il nome di zona ventricolare.
I neuroni della zona del mantello inviano i loro assoni in direzione opposta al lume del tubo neurale; instaurano connessioni sinaptiche con la zona marginale esterna, ricca di fibre nervose, ma povera di cellule; quindi le cellule gliali formatesi nella zona del mantello rivestono gli assoni con una guaina mielinica.
Sviluppo dell’occhio
Formazione delle strutture dell’occhio
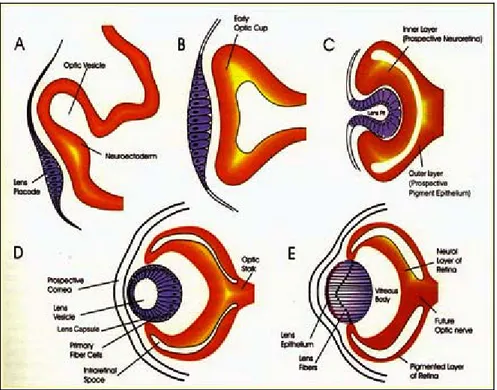
L’inizio dello sviluppo dell’occhio può esser fatto risalire agli eventi finali della gastrulazione, quando l’endoderma in involuzione ed il mesoderma interagiscono con il soprastante ectoderma prospettico cefalico. Questa interazione induce la formazione del cristallino da parte dell’ectoderma cefalico (Saha et al., 1989). L’attivazione della capacità potenziale di formare una lente e la posizione del cristallino rispetto alla retina dipendono, in ultima istanza, dalla vescicola ottica.
Le vescicole ottiche si formano come due estroflessioni delle pareti laterali del diencefalo; durante il loro sviluppo restano comunque collegate al diencefalo tramite i peduncoli ottici (Figura 2). In seguito al contatto tra le vescicole e l’ectoderma cefalico, quest’ultimo si ispessisce originando il placode del cristallino il quale si invaginerà formando la lente definitiva.
La vescicola della lente induce l’ectoderma soprastante a formare una cornea trasparente, i cui parametri fisici svolgono un ruolo importante nello sviluppo dell’occhio; la pressione del fluido intraoculare è essenziale per una corretta curvatura della cornea e questo fattore influisce sulla corretta focalizzazione della luce sulla retina (Coulombre, 1965).
Il placode del cristallino induce modifiche anche nella vescicola ottica che si invagina formando una coppa ottica a doppia parete. Le cellule dello strato esterno producono granuli di pigmento e danno origine all’epitelio pigmentato retinico (Retinal Pigmented Epitelium, RPE). Al contrario, le cellule dello strato interno proliferano velocemente generando cellule gliali, neuroni gangliari, interneuroni e neuroni fotorecettori sensibili alla luce: si è formata così la retina nervosa.
Gli assoni delle cellule gangliari uscenti dalla retina confluiscono nel peduncolo ottico, ormai ridotto ad una piccola fessura, che assume il nome di nervo ottico. Quando gli assoni entrano nel nervo ottico, crescono lungo le cellule gliali fino a raggiungere il chiasma ottico, posto sul pavimento del diencefalo. Da qui raggiungono i centri superiori, il tetto ottico mesencefalico nella maggior parte dei Vertebrati e il nucleo genicolato laterale nei Mammiferi.
Tipi cellulari della retina
La retina neurale si sviluppa in una struttura stratificata contenente differenti tipi cellulari neurali.
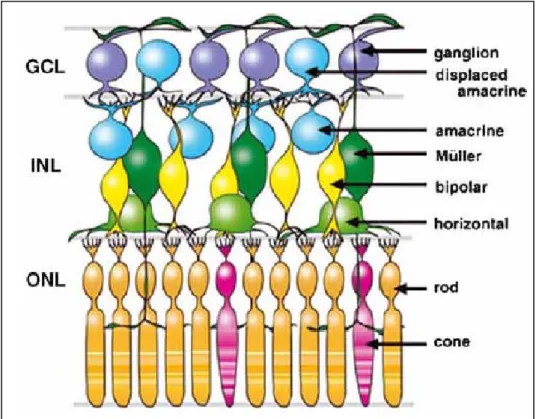
Questi includono fotorecettori sensibili al colore e alla luce (coni e bastoncelli), i corpi cellulari delle cellule gangliari e gli interneuroni bipolari che trasmettono gli stimoli elettrici dai coni e dai bastoncelli alle cellule gangliari (Figura 3). Nella retina sono presenti anche numerose cellule della glia di Müller che, altamente ramificate alle estremità, forniscono l’impalcatura strutturale della retina, e cellule neurali amacrine e orizzontali che trasmettono gli impulsi elettrici lungo il piano della retina (Turner and Cepko, 1987).
Le sezioni trasversali della retina mostrano l’alternanza di strati nucleari, costituiti dai corpi cellulari dei neuroni, e strati plessiformi, costituiti dai processi cellulari che garantiscono le connessioni sinaptiche.
Lo strato nucleare esterno (Outer Nuclear Layer, ONL), subito a ridosso del RPE, è costituito da coni e bastoncelli. Spostandosi in direzione della lente, oltrepassato lo strato plessiforme esterno, troviamo lo strato nucleare interno (Inner Nuclear Layer, INL) costituito dai corpi cellulari degli interneuroni bipolari, dalle cellule neurali amacrine e
orizzontali, e dai corpi cellulari delle cellule della glia di Müller. In posizione più superficiale troviamo lo strato plessiforme interno e, nelle vicinanze della lente, lo strato delle cellule gangliari (Ganglion Cell Layer, GCL) i cui assoni confluiscono nel nervo ottico.
Figura 3. Rappresentazione di una retina di Vertebrati. Nello strato nucleare esterno
(Outer Nuclear Layer, ONL) si distinguono i coni e i bastoncelli; nello strato nucleare interno (Inner Nuclear Layer, INL) si individuano gli interneuroni bipolari, le cellule orizzontali, le cellule amacrine e le cellule della glia di Müller; lo strato cellulare gangliare (Ganglion Cell Layer, GCL) presenta i neuroni gangliari (Hatakeyama and Kageyama, 2004).
Retinogenesi
La retina neurale dei Vertebrati è un complesso tessuto sensoriale la cui funzionalità è correlata alla formazione della sua citoarchitettura laminare che a sua volta dipende dalla produzione di un numero sufficiente di cellule di ciascun tipo. (Livesey e Cepko, 2001). Nei primi stadi di sviluppo, le divisioni cellulari a partire dagli strati germinativi, la migrazione e la morte differenziale delle cellule danno origine alla struttura laminare della retina nervosa.
Tutti i tipi cellulari neurali originano da comuni precursori, i progenitori cellulari retinici (Retinal Progenitor Cells, RPCs), e possiedono due importanti caratteristiche: ciascun tipo cellulare è generato durante un intervallo di tempo limitato e il numero di cellule che si formano varia a seconda del tipo cellulare. (Levine and Green, 2004).
I sette tipi cellulari vengono sempre generati in un preciso ordine: le cellule gangliari si differenziano per prime, assieme ai coni e alle cellule orizzontali, seguite dalle cellule amacrine, dai bastoncelli, dalle cellule bipolari e, infine, dalle cellule della glia di Müller (Young et al., 1985).
I progenitori cellulari retinici sono totipotenti, ossia sono in grado di differenziare in qualsiasi tipo cellulare della retina; con il passare del tempo ed il procedere delle divisioni mitotiche, questa potenzialità viene perduta e tali progenitori potranno generare soltanto tipi cellulari sempre più tardivi, non potendo riacquisire la potenzialità perduta. La retinogenesi è quindi un processo che può avvenire in una sola direzione.
La diminuzione continua della potenzialità dei progenitori cellulari retinici suggerisce che possano presentarsi fattori locali che influenzano le decisioni del destino cellulare da intraprendere per ciascuna cellula (Balsamo et al., 1995). Tra questi fattori possiamo annoverare regolatori interni alla cellula come fattori di trascrizione o recettori cellulari, e regolatori esterni come fattori di crescita (Yang, 2004; Levine and Green, 2004).
Un recente modello di sviluppo retinico propone che le RPCs passino attraverso degli “stati di competenza”; ciascuno di questi favorirebbe la specificazione di uno o più tipi cellulari. Lo “stato di competenza” è probabilmente definito da proprietà intrinseche alla cellula che determinano il suo grado di risposta a fattori estrinseci e il suo potenziale sviluppo (Livesey et al., 2001).
La zona del margine ciliare
La zona del margine ciliare (Ciliary Marginal Zone, CMZ) è un neuroepitelio proliferativo in continuo rinnovamento, situato alla periferia della retina di Anfibi e Pesci; grazie alla sua attività proliferativa, garantisce l’accrescimento durante la vita adulta, aggiungendo alla retina nuove cellule di ciascun tipo.
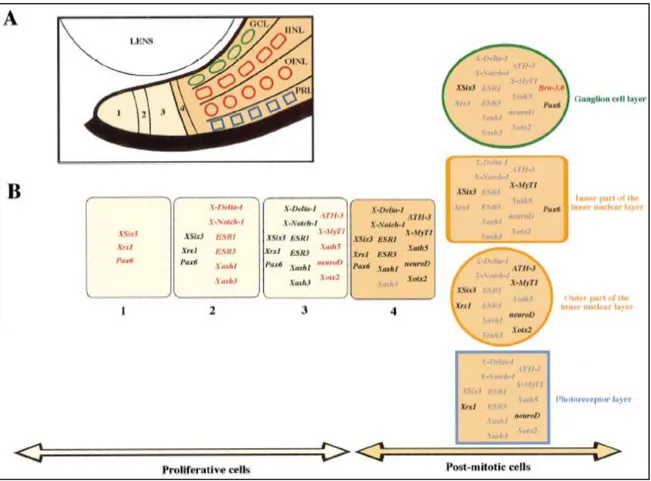
Nella CMZ, le cellule sono spazialmente ordinate secondo lo stadio di sviluppo cellulare: le cellule staminali indifferenziate sono disposte più perifericamente mentre i progenitori retinici differenziati sono localizzati in posizione più centrale. Ciò che avviene nella CMZ ricapitola la retinogenesi embrionale e fornisce un sistema potenziale per l’analisi dell’ordine di espressione dei geni durante questo processo (Figura 4). Nel caso in cui un gene sia espresso più perifericamente di un altro, significa che è anche espresso più precocemente nella cascata di attivazione genica della retinogenesi (Perron et al., 1998).
Figura 4. Ricostruzione della cascata di attivazione genica durante la retinogenesi. (A) è
mostrata la suddivisione della CMZ nelle zone 1, 2, 3 e 4. (B) sono mostrati i geni espressi in ciascuna zona della CMZ (Perron et al., 1998).
La struttura della CMZ è stata dettagliatamente studiata in girini di Xenopus allo stadio 40 di sviluppo. Dal momento che la CMZ continua a produrre neuroni retinici durante tutta la vita, è stato ipotizzato che l’ordine di espressione dei geni osservato a stradio 40 sia preservato anche a stadi tardivi (Perron et al., 1998). Sono state individuate quattro zone della CMZ che coincidono con quattro fasi dello sviluppo retinico:
Zona 1: è costituita da cellule staminali totipotenti in grado di originare sia cellule
dell’epitelio pigmentato sia della retina neurale; non esprimono nessuno dei geni neurogenici o proneurali, ma soltanto Xrx1, Xsix3 e un basso livello di Pax6, indice del fatto che questi geni sono importanti per conferire un’identità retinica alle cellule staminali. Le cellule staminali, avendo un ciclo cellulare molto lento, sono caratterizzate da un basso livello di incorporazione di bromodeossiuridina.
Zona 2: mantenendo l’espressione dei geni presenti nella zona 1, si accende l’espressione
di geni neurogenici come X-Notch-1 e X-Delta-1, e fattori di trascrizione come Xash1 e Xash3. Le cellule di questa zona sono retinoblasti precoci altamente proliferanti e presentano elevati livelli di incorporazione di bromodeossiuridina.
Zona 3: si assiste all’accensione di geni proneurali come ATH-3, Xath5, XneuroD e
X-MyT-1, pur mantenendo attivi anche i geni espressi nella zona 2. Siamo in presenza di retinoblasti indeterminati tardivi, sebbene comincino ad accendersi geni di strati specifici della retina come Xotx2; anche in questo caso, siamo in presenza di un ciclo cellulare molto veloce che porta ad un’alta incorporazione di bromodeossiuridina.
Zona 4: le cellule hanno terminato le divisioni mitotiche, ma il differenziamento dei
singoli neuroni avverrà solo dopo il silenziamento dei geni neurogenici e il mantenimento di alcuni geni proneurali che variano a seconda dello strato cellulare in cui le cellule differenzieranno. Ci troviamo in presenza di retinoblasti postmitotici non ancora completamente differenziati.
Sviluppo del chiasma
Formazione del chiasma ottico
Il chiasma ottico si forma al livello del diencefalo ventrale, il quale si origina dall’estremità più anteriore del tubo neurale (Williams et al., 2004).
Gli assoni in uscita dalla retina confluiscono nel nervo ottico e crescono lungo le cellule gliali fino a raggiungere il cervello. In tutti i Vertebrati, con l’esclusione dei Mammiferi, gli assoni retinici raggiungeranno il tetto ottico mesencefalico. Una volta raggiunto il cervello, gli assoni possono decussare al livello del chiasma ottico, oltrepassando la linea mediana per dirigersi al tetto ottico controlaterale, situato sul lato opposto dell’occhio dal quale si sono formati, o procedere sullo stesso lato in modo da raggiungere il tetto ottico ipsilaterale, posto invece sul medesimo lato dell’animale.
La percentuale di connessioni retinotalamiche ipsilaterali è molto variabile nei Vertebrati; maggiore è il numero di proiezioni ipsilaterali e migliore risulta l’interazione tra i due emisferi cerebrali.
Attraverso le varie classi dei Vertebrati si assiste ad un aumento della sovrapposizione dei due campi visivi; ciò permette l’acquisizione di un grado di binocularità sempre maggiore. Ad essa è associata la formazione delle proiezioni ipsilaterali, infatti, esse si presentano solamente in quelle specie dotate di una visione di tipo binoculare e la loro quantità aumenta all’aumentare del grado di binocularità.
Mappe topografiche
Il funzionamento del cervello dei Vertebrati non dipende soltanto dalla differenziazione e dalla posizione delle cellule nervose, ma anche dalle specifiche connessioni che queste cellule instaurano tra loro e con gli effettori periferici. Gli assoni provenienti da un organo sensoriale devono entrare in contatto sinaptico con specifici neuroni del cervello capaci di interpretare quei particolari stimoli.
La specificità delle connessioni assonali viene analizzata sotto tre aspetti (Goodman and Shatz, 1993):
Selezione del percorso: l’assone intraprende una via che lo conduce ad una particolare regione.
Selezione del bersaglio: l’assone, giunto a destinazione, instaura connessioni stabili con un gruppo di cellule.
Delimitazione del bersaglio: la selezione del bersaglio viene perfezionata in modo che ogni assone si connette con un piccolo sottogruppo dei suoi possibili bersagli.
Il cono di crescita coordina l’accrescimento dell’assone; essendo la porzione più distale dell’assone in accrescimento, risente per primo dei diversi fattori che ne condizionano la crescita e determina la giusta direzione da seguire. La matrice cellulare può offrire un gradiente di adesività al cono di accrescimento, oltre a fornire indicazioni sulla direzione da seguire grazie alla presenza di solchi e canali relativamente grandi.Allo stesso modo esistono classi di proteine situate sulle membrane cellulari che influenzano il comportamento del cono di crescita, comportando la sua adesione alla superficie extracellulare. La chemoattrazione e la chemorepulsione sfruttano, invece, proteine solubili come le netrine e le semaforine, rilasciate da apposite cellule solamente in particolari regioni dell’organismo.Le efrine mediano l’inibizione da contatto; tale meccanismo di guida assonica è evidente nelle connessioni che si instaurano tra la retina e il tetto ottico; nelle due regioni le cellule esprimono rispettivamente i recettori di tipo Eph o le efrine, secondo gradienti definiti (Van Horck et al., 2004).
Una caratteristica del cervello dei Vertebrati è l’esistenza di mappe topografiche: i neuroni delle varie regioni del sistema nervoso proiettano in maniera ordinata verso regioni definite dell’encefalo.
La proiezione topografica più studiata è quella del nervo ottico che proietta dalla retina al tetto ottico in Pesci e Anfibi, e al nucleo genicolato laterale nei Mammiferi. Il nervo ottico
uscente da ciascun occhio è composto da migliaia di assoni che formano connessioni con il tetto ottico controlaterale in maniera altamente ordinata: sussiste una corrispondenza punto a punto tra le diverse posizioni della retina e quelle del tetto ottico. I neuroni della porzione dorsale della retina inviano proiezioni alla regione ventrale del tetto ottico e le regioni della porzione nasale della retina proiettano alla regione posteriore del tetto ottico. L’inversione delle coordinate spaziali assume un’importanza fondamentale nella percezione dell’ambiente esterno; l’immagine reale viene proiettata già invertita sulla retina per la presenza della lente; la successiva inversione ristabilisce le giuste coordinate (Peters, 2002). Queste mappe topografiche sono tali che l’organizzazione spaziale delle cellule della retina si riflette nelle terminazioni dei rispettivi assoni formando una mappa continua in cui cellule contigue proiettano in regioni contigue del bersaglio (McLaughlin et al., 2003). Inizialmente, lo sviluppo delle proiezioni suddette non è molto accurato, ma successivamente queste vengono perfezionate grazie agli impulsi nervosi provenienti dalla cellule gangliari della retina stimolata, in quanto vengono utilizzate preferenzialmente alcune vie di trasmissione del segnale piuttosto che altre.
Geni coinvolti nello sviluppo delle strutture neurali
La proliferazione dei progenitori cellulari retinici è un processo fondamentale per la crescita e il differenziamento della retina durante lo sviluppo dei Vertebrati. In questo processo sono coinvolti attivatori e inibitori del ciclo cellulare, fattori di trascrizione e fattori di crescita.
Alcuni geni risultano coinvolti sia nello sviluppo della retina sia in quello del chiasma in quanto entrambe le strutture derivano dagli stessi territori embrionali e presentano notevoli somiglianze per quanto riguarda l’espressione genica.
Notch-1
In Xenopus, X-Notch-1 (Xotch) è uno dei geni neurogenici il cui compito è quello di opporsi al differenziamento di determinati tipi cellulari (Dorsky et al., 1995). La proteina Notch è un recettore estremamente importante nel sistema nervoso; sia in quello dei Vertebrati che in quello di Drosophila, il legame di Delta, altra proteina implicata nella medesima via di segnale, a Notch impedisce che le cellule intraprendano il destino neurale (Chitnis, 1995; Wang et al., 1998).
La trasfezione di una forma attiva di X-Notch-1 nelle cellule retiniche di Xenopus comporta che esse mantengano le caratteristiche neuroepiteliali indifferenziate (Dorsky et al., 1995).
L’mRNA di X-Notch-1 è espresso nella CMZ (Dorsky et al., 1997), ma il suo dominio è ristretto solamente alle regioni centrali di questa zona, infatti, la regione più periferica, contenente cellule staminali, e quella più centrale, contenente cellule differenziate, non lo esprimono (Perron et al., 1998).
In Xenopus, all’inizio della metamorfosi a stadio 54, l’mRNA di X-Notch-1 è espresso in ugual misura nelle cellule proliferanti nelle CMZ dorsale e ventrale; è stato dimostrato che nella CMZ dorsale, a questo stadio, l’espressione di X-Notch-1 coincide perfettamente con quella della deiodinasi di tipo III (D3). Nelle fasi finali della metamorfosi (stadio 63), la CMZ ventrale prolifera in modo più marcato rispetto alla CMZ dorsale e ciò coincide con un’espansione dell’espressione di X-Notch-1 nella regione ventrale rispetto alla dorsale (Marsh-Armstrong et al., 1999).
Ciclina-D1
La ciclina-D1 (CycD1) è la principale ciclina di tipo D espressa nei progenitori cellulari retinici. La sua presenza è estremamente importante in quanto topi mutanti CycD1-/- hanno una retina con poche cellule, a causa di una ridotta proliferazione (Fantl et al., 1995; Levine and Green, 2004). Il gene ciclina-D1 codifica per una proteina in grado di legarsi e attivare le chinasi ciclina-dipendenti cdk4 e cdk6, svolgendo così un ruolo fondamentale nella progressione della fase G1 e nell’entrata in fase S del ciclo mitotico (Matsushime et al., 1992; Meyerson e Harlow, 1994; Motokura et al., 1991).
In Xenopus, l’espressione della ciclina-D1 non è riscontrabile prima di midblastula-transition (MBT) (Hartley et al., 1996); compare nell’embrione a stadio 10 in posizione dorsale e a stadio 13 si localizza nella piastra precordale. Allo stadio di piastra neurale l’espressione è localizzata all’estremità anteriore dell’embrione. Con il progredire dello sviluppo, l’espressione della ciclina-D1 si localizza nell’occhio, nell’encefalo, nel tubo neurale e nelle creste neurali in migrazione (Vernon and Philpott, 2003). Negli embrioni di Xenopus, la proliferazione è abbastanza uniforme prima della gastrulazione, ma subito dopo il ciclo cellulare assume un pattern tessuto-specifico che, almeno in parte, riflette la distribuzione delle singole cicline (Saka and Smith, 1999).
Cdk2
Cdk2 è una chinasi ciclina-dipendente che può essere riconosciuta dalle cicline di tipo A e di tipo E. In Xenopus, già da stadio 17, la sua espressione è confinata al campo dell’occhio e alla porzione anteriore del tubo neurale e, a stadio 33/34, permane espressa solamente nell’occhio e negli archi branchiali (Vernon and Philpott, 2003).
p27
Xic1p27Xic1 è un inibitore delle chinasi ciclina-dipendenti e svolge un ruolo importante nel coordinare l’uscita dal ciclo cellulare e il differenziamento durante la retinogenesi precoce (Vernon et al., 2003).
L’iniezione di un costrutto morpholino contro p27Xic1 (p27Xic1Mo) allo stadio di due cellule impedisce l’accumulo della proteina di p27Xic1 che normalmente avviene dopo midblastula-transition (MBT) (Shou and Dunphy, 1996; Vernon et al., 2003). L’ablazione di p27Xic1 fa aumentare la proliferazione cellulare in quanto viene eliminato un importante inibitore (Vernon et al., 2003).
Gadd45-γ
Gadd45-γ codifica per un inibitore del ciclo cellulare ed è espresso in territori le cui cellule stanno terminando gli eventi mitotici, come nel caso della formazione dei neuroni primari. Inoltre, la perdita di funzione di XGadd45-γ comporta l’arresto del ciclo cellulare. Durante la formazione dei neuroni primari in Xenopus, XGadd45-γ blocca le divisioni cellulari e induce il differenziamento verso un destino neurale (de la Calle-Mustienes et al., 2002). L’espressione di XGadd45-γ è preceduta da quella del gene proneurale Xngnr-1 (Ma et al., 1996); ciò suggerisce che questo gene possa attivare XGadd45-γ, infatti, la sua espressione ectopica è promossa dall’iniezione dell’mRNA dello stesso Xngnr-1 (de la Calle-Mustienes et al., 2002).
Sussiste anche un certo antagonismo con X-Notch-1 in quanto la sovraespressione del suo dominio intracellulare comporta una riduzione dell’espressione di XGadd45-γ; al contrario, l’espressione aumenta quando la via di segnale di X-Notch-1 viene bloccata sovraesprimendo una forma dominante negativa del suo ligando X-Delta-1 (de la Calle-Mustienes et al., 2002).
Xrx1
Il gene Xrx1 appartiene alla classe paired-like dei geni “homeobox”. E’ espresso nella piastra neurale anteriore e, successivamente, nelle strutture neurali dell’occhio in sviluppo (retina neurale ed epitelio pigmentato) e in altre strutture del prosencefalo derivanti dalla piastra neurale anteriore. L’espressione di Xrx1 nell’occhio inizia a diminuire a partire da stadio 42 e raggiunge bassi livelli allo stadio di larva natante (stadio 45) (Casarosa et al., 1997).
L’espressione di Xrx1 è individuabile anche al livello dell’encefalo, inizialmente nella regione di connessione tra le due vescicole ottiche in evaginazione; successivamente, a stadio 34, l’espressione di Xrx1 si restringe arrivando a comprendere il pavimento del diencefalo, dalla regione del chiasma all’ipotalamo disposto posteriormente (Casarosa et al., 1997).
Allo stadio di neurula precoce, l’espressione di Xrx1 e quella di Xotx2 risultano complementari, definendo così per la prima volta i territori della retina e del diencefalo nella piastra neurale anteriore; inoltre, la sovraespressione di Xrx1 comporta una riduzione dell’espressione di Xotx2 (Andreazzoli et al., 1999).
Xrx1 è essenziale per la proliferazione della piastra neurale anteriore in quanto, se sovraespresso, induce la proliferazione e inibisce X-ngnr-1, X-Delta-1 e N-tubulina, inducendo repressori trascrizionali antineurogenici come Zic2 e Xhairy2 e reprimendo p27Xic1. Inoltre, i suddetti effetti di Xrx1 sono ristretti alla porzione più rostrale dell’embrione, definendo così questo gene come un regolatore anteriore della neurogenesi (Andreazzoli et al., 2003).
Pax2
Pax2 è un membro della famiglia di fattori di trascrizione Pax, di cui Pax6 è l’omologo del gene eyeless di Drosophila.
Nel topo, Pax2 è espresso nella metà ventrale della vescicola ottica durante la morfogenesi precoce dell’occhio. Subito dopo l’invaginazione della coppa ottica, la sua espressione è confinata al peduncolo ottico e alla fessura ottica (Nornes et al., 1990; Torres et al., 1996). Topi mutanti per Pax2 (Pax2-/-) hanno un differenziamento alterato del peduncolo ottico (Torres et al., 1996); l’effetto più evidente è che le cellule retiniche, sia appartenenti al RPE che agli strati della retina neurale, e quelle gliali che sorreggono il nervo ottico, si estendono lungo lo stesso nervo ottico fino a raggiungere la zona mediale del diencefalo (Schwarz et al., 2000).
Pax6
Pax6 appartiene alla famiglia di fattori di trascrizione Pax, omologo del gene eyeless di Drosophila; contiene due motivi di legame al DNA, un dominio “paired” e un omeodominio “paired-type” (Walther et al., 1991).
Pax6 è espresso precocemente nell’occhio in sviluppo al momento della formazione delle vescicole ottiche mentre, in una fase tardiva, la sua espressione si ritrova nelle cellule gangliari e amacrine della retina (Hirsch and Harris, 1997b; Perron et al., 1998). Cellule progenitrici retiniche deficienti per Pax6 mostrano una ridotta capacità proliferativa e differenziano solo in interneuroni amacrini (Marquardt et al., 2001).
Pax6 è un regolatore chiave dello sviluppo dell’occhio; è necessario per la sua formazione in diversi organismi e, nella rana, è sufficiente per indurre occhi ectopici (Chow et al., 1999).
L’espressione di Pax6 nello strato delle cellule gangliari e nella parte interna dello strato nucleare interno è limitata alle cellule postmitotiche; al contrario, il basso livello di espressione che si registra al livello della CMZ coincide con cellule in proliferazione marcate con bromodeossiuridina (Perron et al., 1998).
Otx2
Otx2 è stato clonato come un omologo murino del gene orthodenticle (otd) di Drosophila, un gene regolatorio che controlla la determinazione dei segmenti specifici della testa. Le proteine di Otx2 ed Otd contengono entrambe un omeodominio simile, appartenente alla classe bicoid (Simeone et al., 1992; Finkelstein and Perrimon, 1990).
Topi eterozigoti mutanti per Otx2 mostrano seri difetti nello sviluppo dell’occhio, supportando l’idea che Otx2 sia un gene homeobox coinvolto nel controllo dello sviluppo dell’occhio (Matsuo et al., 1995; Perron et al., 1998).
In Xenopus, Xotx2 è un gene implicato nella formazione dell’occhio e nella determinazione cellulare; è espresso nella CMZ, ma non nelle cellule più periferiche; ciò suggerisce che non sia coinvolto nel passaggio iniziale della retinogenesi che ha luogo in questa regione (Perron et al., 1998). Durante lo sviluppo, Xotx2 continua ad essere espresso anche nella parte esterna dello strato nucleare interno (INL) nella retina centrale, marcando espressamente i neuroni bipolari (Viczian et al., 2003). La sovraespressione di Xotx2 nei retinoblasti proliferanti mediante lipofezione in vivo a stadio 18 aumenta il numero di cellule bipolari, facendo diminuire i fotorecettori e le cellule della glia di Müller (Viczian et al., 2003).
Xotx5b
Xotx5b è un membro della famiglia otd/Otx dei fattori di trascrizione omeodominio di tipo paired-like (Vignali et al., 2000).
Al livello della retina, Xotx5b è espresso nei fotorecettori, sia nei coni che nei bastoncelli, e nelle cellule bipolari (Viczian et al., 2003).
La lipofezione di Xotx5b nei precursori retinici induce l’assunzione del destino di fotorecettori; inoltre, è stato dimostrato che tale sovraespressione di Xotx5b comporta un aumento sia del numero dei coni che di quello dei bastoncelli, senza significative differenze (Viczian et al., 2003).
Xoptx2
Six6 e il suo ortologo in Xenopus Optx2 sono strettamente correlati nella struttura della sequenza con il gene Optix di Drosophila.
Negli embrioni di Xenopus, l’espressione di Xoptx2 è individuabile nella cresta neurale anteriore agli stadi 14-15 e, da stadio 17, nel diencefalo ventrale, nel peduncolo ottico e nella porzione ventrale del campo dell’occhio (Zuber et al., 1999). Xoptx2 è espresso più tardivamente rispetto a Xpax6 e Xrx1 nel territorio presuntivo della retina (Li et al., 1997; Mathers et al., 1997) e mostra un pattern di espressione simile a Six6 (Optx2) nel pollo e nel topo (Jean et al., 1999; Lopez-Rios et al., 1999).
Le iniezioni dell’RNA di Xoptx2 in embrioni di Xenopus suggerisce che esso sia coinvolto nel controllo della proliferazione della retina e nella regolazione della dimensione dell’occhio piuttosto che nella determinazione del destino delle cellule della retina (Zuber et al., 1999).
Le iniezioni di dosi elevate (75-200 pg) di Xoptx2 possono indurre la formazione di strutture retiniche ectopiche nel mesencefalo maturo; inoltre, sempre in seguito ad esperimenti di microiniezione, l’analisi con marcatori molecolari mostra che le cellule del mesencefalo e del rombencefalo anteriore perdono la loro identità e sono riprogrammate in cellule della retina (Bernier et al., 2000).
Zic2
Zic2 è un fattore di trascrizione zinc-finger, omologo nei Vertebrati del gene odd-paired (opa) di Drosophila; è espresso nelle cellule gangliari retiniche (RGCs) che proiettano al tetto ottico ipsilaterale durante il periodo in cui questa sottopopolazione viene generata ed estende i suoi assoni dalla retina ventrotemporale fino al chiasma (Herrera et al., 2003).
In topo, è stato dimostrato che Zic2 si esprime nelle RGCs postmitotiche nella retina neurale ventrotemporale; la sua espressione è assente nelle cellule in piena attività mitotica, marcate con BrdU mentre si presenta nelle RGC postmitotiche appena uscite dal ciclo cellulare, marcate con Isl2 (Rachel et al., 2002b; Herrera et al., 2003). Successivamente, sempre in topo, è stato dimostrato che le RGCs della retina ventrotemporale, più precisamente situate nella regione di sovrapposizione binoculare e quindi strettamente correlate anche con la decussazione degli assoni al chiasma ottico, positive per Zic2 non esprimono il gene Isl2, facendo ipotizzare una regolazione tra i due geni nel definire le caratteristiche delle singole cellule gangliari (Pak et al., 2004).
Nel topo, a stadio E14-E17, Zic2 è sovraregolato nelle cellule gangliari differenziate nella retina ventrotemporale quando si formano le proiezioni ipsilaterali. Topi geneticamente modificati che esprimono un basso livello di Zic2 (Zic2kd/kd) presentano anche una riduzione nelle proiezioni ipsilaterali (Nagai et al., 2000).
Nei girini di Xenopus, l’mRNA di Xzic2 è espresso nella CMZ, ma non nella retina ventrotemporale. Alla metamorfosi, quando si sviluppano le connessioni retinotalamiche ipsilaterali, Xzic2 si esprime anche nella retina neurale. Nell’adulto, l’espressione dell’mRNA di Xzic2 permane nella retina ventrotemporale, ma in maniera ridotta rispetto alla metamorfosi; ciò corrisponde alla continua, ma minore produzione di cellule gangliari i cui assoni non decusseranno al livello del chiasma ottico (Herrera et al., 2003).
Un’ulteriore convalida della importanza di Zic2 nella formazione di connessioni retinotalamiche ipsilaterali risiede nel fatto che è stata dimostrata la sua colocalizzazione spaziotemporale nella retina con i recettori EphB1 che, quindi, potrebbero risentire di una sua regolazione (Herrera et al., 2003).
Inoltre, la quantità di cellule gangliari retiniche che esprimono Zic2 è proporzionale al grado di binocularità attraverso le specie, attribuendo un ruolo importantissimo a questo gene (Herrera et al., 2003).
Nel topo, oltre che al livello della retina, Zic2 è anche espresso nelle regioni ventrali dell’encefalo come il pavimento del diencefalo da cui si svilupperà il chiasma ottico (Brown et al., 2003). Topi mutanti per Zic2 (Zic2kd/kd) mostrano un’alterazione nell’espressione di molecole importanti per la guida assonica al livello del chiasma, come l’efrinaB2 (Nakagawa et al., 2000; Williams et al., 2003).
Vsx1
Il gene Vsx1 di Xenopus è l’ortologo dei geni Vsx1 isolati in precedenza in altri Vertebrati; la sua espressione si localizza al livello dei progenitori cellulari retinici (RPCs) e nelle cellule bipolari differenziate (D’Autilia et al., 2006).
Nella retina di topi mutanti per Vsx1, l’espressione di marcatori delle cellule bipolari innervate dai coni (recoverina, NK3R e Neto1) risulta fortemente ridotta; tale espressione persiste comunque in alcune cellule bipolari facendo presumere che nella maggior parte di esse, Vsx1 sia responsabile della attivazione, direttamente o indirettamente, dei geni suddetti; al contrario, in un piccolo sottogruppo, l’espressione sembra essere regolata solo parzialmente (Chow et al., 2003).
Vax2
Vax2 è un gene “homeobox” che svolge un ruolo importante nel controllo del pattern dorsoventrale della retina; mostra un dominio di espressione ristretto alla porzione ventrale della retina neurale prospettica nel topo, nell’uomo e in Xenopus.
La sovraespressione di Xvax2 in embrioni di Xenopus determina un effetto ventralizzante sull’occhio in sviluppo; parimenti induce anche un’espansione del peduncolo ottico, struttura derivante dalla porzione più ventrale della vescicola ottica (Barbieri et al., 1999). I domini di espressione di Xvax2 sono stati studiati durante tutto lo sviluppo di Xenopus. A neurula precoce (stadio 13/14), è espresso nel tubo neurale in posizione più anteriore di Xrx1, un marcatore del campo dell’occhio (Casarosa et al., 1997). A stadio 30 si esprime nel telencefalo ventrale, nella porzione ventrale della vescicola ottica e nel peduncolo ottico; da questo stadio, l’espressione è visibile anche nel chiasma ottico prospettico. A stadi metamorfici (stadio 59/60), la sua espressione permane nella retina ventrale, nel telencefalo ventrale e nel diencefalo, dove però si restringe alla sola regione del chiasma (Liu et al., 2001).
Esperimenti di silenziamento genico di Vax2 in topo mostrano come l’efrinaB1 e l’efrinaB2 espandano il loro dominio di espressione anche nella retina ventrale, a scapito di geni come EphB2 ed EphB3 (Mui et al., 2002).
Sempre in topi mutanti Vax2-/- non si presentano proiezioni retinotettali ipsilaterali, effetto forse dovuto alla riduzione dell’espressione di EphB2 nella retina ventrale (Barbieri et al., 2002; Mui et al., 2002).
Six3
Nei vertebrati, il gene Six3 fa parte della famiglia genica so/Six; il gene “homeobox” sine oculis (so) è essenziale per la formazione del sistema visivo in Drosophila.
Six3 è inizialmente espresso nel neuroectoderma anteriore; successivamente la sua espressione si ritrova nell’occhio in sviluppo e nel prosencefalo ventrale (Kawakami et al., 2000).
In Xenopus, il territorio di espressione di Xsix3 è abbastanza continuo e, già dallo stadio 20 di sviluppo, comprende le vescicole ottiche in formazione, la regione ventrale del diencefalo compresa tra esse e si spinge anche in direzione più rostrale, nel telencefalo (Zhou et al., 2000).
Esperimenti di sovraespressione di Six3 in medaka (Loosli et al., 1999), zebrafish (Kobayashi et al., 1998), Xenopus (Bernier et al., 2000) e topo (Lagutin et al., 2001) mostrano che tale gene è in grado di indurre la formazione di vescicole ottiche ectopiche nelle regioni del tubo neurale che danno origine al mesencefalo e al rombencefalo. Il suddetto effetto è reso possibile dalla capacità di questo gene di reprimere contemporaneamente sia l’espressione dei geni Wnt (Lagutin et al., 2001) sia quella di BMP4 (Gestri et al., 2005).
Nkx2.1
Nkx2.1 è un fattore di trascrizione con omeodominio; assieme a Nkx2.4, è un membro della famiglia genica NK-2 che svolge un ruolo essenziale nel differenziamento tissutale e nell’organogenesi (Harvey, 1996; Bingle, 1997).
Topi mutanti per il gene Nkx2.1 non formano il prosencefalo, i polmoni e la ghiandola tiroidea (Kimura, 1996). In Xenopus, la trascrizione di Xnkx2.1 viene osservata per la prima volta allo stadio di neurula come un dominio di espressione all’estremità anteriore del tubo neurale. Allo stadio di bottone caudale, l’espressione si estende andando a comprendere la regione ventrale del diencefalo; a stadio 25, l’espressione compare nella regione prosencefalica posteriore agli occhi, il futuro diencefalo ventrale (Small et al., 2000; Gonzalez et al., 2002).
Dll3
Nello Xenopus, X-dll3 è un fattore di trascrizione omologo al gene Distal-less (Dll) di Drosophila. Una caratteristica importante che lo diversifica dagli altri geni della famiglia X-dll è che la sua espressione compare già allo stadio di piastra neurale aperta.
X-dll3 si esprime nella parte più rostrale della piastra neurale, regione che originerà il telencefalo ventrale, le strutture diencefaliche e i placodi olfattivi. Questo suggerisce che X-dll3 sia un marker precoce per queste strutture (Papalopulu and Kintner, 1993).
La metamorfosi
In molte specie animali, lo sviluppo embrionale conduce ad uno stadio larvale con caratteristiche molto diverse da quelle dell’organismo adulto. Molto spesso le forme larvali sono specializzate per certe funzioni come la crescita e la migrazione.
Durante la metamorfosi, i processi dello sviluppo vengono riattivati da specifici ormoni e l’intero organismo si modifica preparandosi al suo nuovo tipo di esistenza. La metamorfosi è un periodo di drammatici cambiamenti dello sviluppo che riguardano l’intero organismo.
La metamorfosi degli Anfibi
Negli Anfibi, la metamorfosi è associata a quei cambiamenti che preparano un organismo acquatico alla vita terrestre. Il genere Xenopus rappresenta un’eccezione, conducendo una vita acquatica anche da adulto. Negli Urodeli, come le salamandre, i cambiamenti comprendono il riassorbimento della pinna caudale, la distruzione delle branchie esterne e il cambiamento della struttura della pelle. Negli Anuri, rane e rospi, i cambiamenti alla metamorfosi sono molto più vistosi e quasi tutti gli organi sono soggetti a modifiche. I cambiamenti regressivi includono la perdita dei denti cornei, l’eliminazione della coda e delle branchie interne del girino, sostituite da un apparato respiratorio provvisto di polmoni. Contemporaneamente si hanno anche processi costruttivi come lo sviluppo degli arti e delle ghiandole dermoidi. Il lungo intestino, caratteristico degli erbivori, si accorcia per adattarsi alla dieta prevalentemente carnivora della rana adulta. Anche l’apparato sensoriale si modifica: degenera il sistema della linea laterale del girino, l’occhio e l’orecchio vanno incontro ad un’ulteriore differenziazione. Cambia anche il pigmento retinico passando dalla porfiropsina dei girini alla rodopsina, fotopigmento caratteristico dei vertebrati terrestri e marini, negli adulti (Wald, 1945; Wald, 1981; Smith-Gill and Carver, 1981).
Alla metamorfosi si associano anche alcuni cambiamenti di tipo biochimico; l’emoglobina del girino lega l’ossigeno più velocemente e lo rilascia più lentamente rispetto all’emoglobina dell’adulto (McCutcheon, 1936).
Inoltre, alla metamorfosi, vengono indotti enzimi necessari alla produzione di urea. I girini, così come la maggior parte dei pesci d’acqua dolce, eliminano ammonio, cioè sono ammoniotelici. Al contrario, le rane adulte (non quelle del genere Xenopus) sono uroteliche, eliminando urea come la maggior parte dei Vertebrati terrestri.
Importanza dell’ormone tiroideo alla metamorfosi
Il controllo della metamorfosi degli Anfibi da parte degli ormoni tiroidei fu dimostrato agli inizi del ‘900 da Gudernatsch il quale scoprì che i girini metamorfosavano prematuramente quando erano nutriti con estratti di ghiandola tiroidea di pecora (Gudernatsch, 1912).
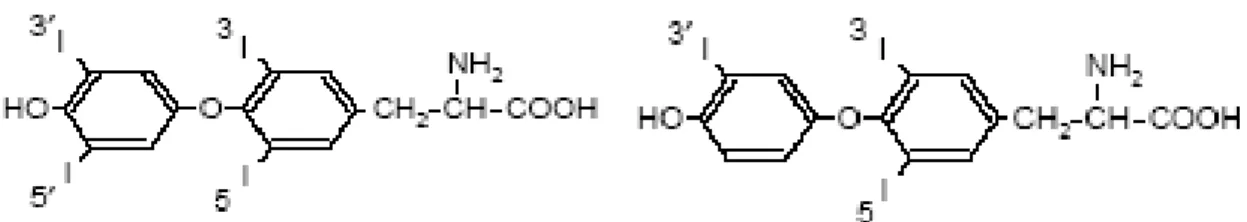
Tutti i diversi cambiamenti che avvengono durante la metamorfosi sono causati dalla secrezione di tiroxina (T4) e triiodotironina (T3) da parte della tiroide (Figura 5 e 6). La forma T3 presenta una maggiore attività rispetto all’altra in quanto sono necessarie concentrazioni minori per indurre i cambiamenti metamorfici in girini tiroidectomizzati (Kistler et al, 1977; Robinson et al., 1977).
Figura 5. Tiroxina (T4) Figura 6. 3,5,3’-triiodotironina (T3)
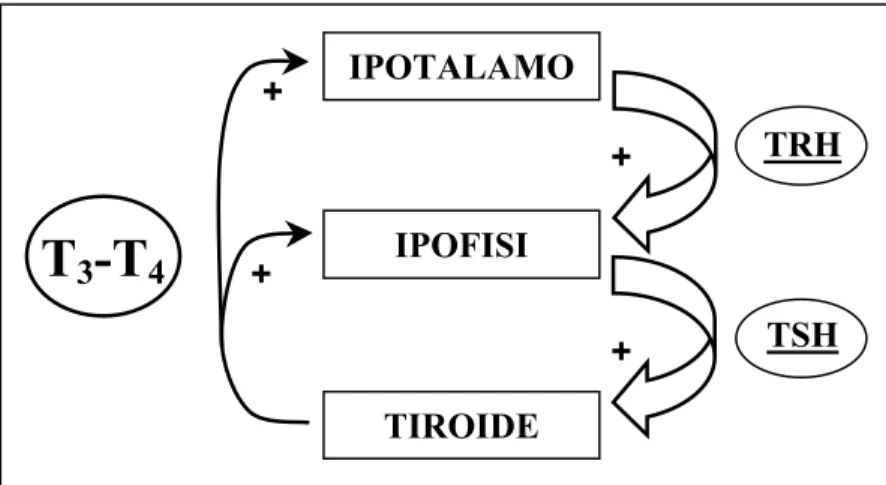
In risposta allo stato nutrizionale e a fattori ambientali come la temperatura e la luce, le cellule neurosecretici dell’ipotalamo rilasciano l’ormone di rilascio della tireotropina (TRH) il quale agisce sull’ipofisi inducendo il rilascio dell’ormone tireotropo (TSH). Questo stimola a sua volta la tiroide a secernere gli ormoni tiroidei che promuovono la metamorfosi (Figura 7).
T
3-T
4 IPOTALAMO + + + + TIROIDE IPOFISI TRH TSHFigura 7. Regolazione della sintesi e del rilascio dell’ormone tiroideo
Ruolo dell’ormone tiroideo e dei recettori
Gli effetti dell’ormone tiroideo (TH) sono mediati dall’azione di specifici recettori nucleari che funzionano come fattori di trascrizione inducibili (Evans, 1988; Leng et al., 1994). La prima risposta all’aumentato livello di ormone tiroideo in circolo è l’attivazione della trascrizione dei geni che codificano i recettori per gli ormoni tiroidei stessi (Thyroid hormone Receptor, TR) (Yaoita et al., 1990; Kawahara et al., 1991). Geni distinti codificano per le due forme (α e β) dei recettori per il TH; esiste comunque un elevato grado di omologia sia nel dominio legante il DNA sia in quello legante l’ormone (Carlson et al., 1996a). Questi recettori sono membri della superfamiglia dei recettori degli ormoni steroidei che agiscono come fattori di trascrizione ligando-dipendenti (Ranjan et al., 1994; Wong et al., 1995; Puzianowska-Kuznicka et al., 1997; Yen, 2001). Come la maggior parte dei recettori di questa famiglia, i TR hanno un dominio di legame al DNA all’estremità N-terminale e un dominio di legame al TH all’estremità C-N-terminale (Figura 8).
Figura 8. Trasmissione del segnale di T3. Abbreviazioni: TR, Thyroid hormone
Receptor (recettore dell’ormone tiroideo); RXR, Retinoid-X Receptor (recettore dell’acido retinoico); T3RE, T3 Response Element (sequenza sensibile al T3) (Forrest et
I recettori per il TH sono in grado di legarsi a specifiche sequenze del DNA, le Thyroid hormone Response Elements (TREs), localizzate nelle vicinanze di specifici geni bersaglio (Koenig, 1998; Xu et al., 1999).
I TR si legano alle sequenze TREs non solo come omodimeri, ma anche come eterodimeri con altri membri della superfamiglia dei recettori degli ormoni steroidei come il recettore della vitamina D (Vitamin-D Receptor, VDR) e tutti i sottotipi dei recettori dell’acido retinoico (Retinoid-X Receptors, RXRs). L’eterodimerizzazione con RXR aumenta notevolmente il legame dei TRs sulle sequenze TREs, la risposta dei TR al T3 e l’attivazione trascrizionale (Lehmann et al., 1993).
Il legame del TH al complesso TR-RXR permette il rilascio di un corepressore consentendo il reclutamento di un coattivatore che favorisce la trascrizione. Al contrario, in assenza di TH, il corepressore rimane legato reprimendo la trascrizione. Alcuni complessi di cofattori mediano l’acetilazione degli istoni e ciò suggerisce che la transattivazione mediata dai TRs coinvolga modifiche strutturali della cromatina (Lemon and Freedman, 1999).
Xenopus laevis come sistema modello
L’utilizzo della rana Xenopus laevis, un anfibio anuro di origine sudafricana, presenta notevoli vantaggi come modello animale per gli studi da noi condotti. Innanzitutto, in qualsiasi periodo dell’anno la femmina può essere artificialmente indotta a deporre uova mediante stimolazione ormonale e la fecondazione può essere effettuata in vitro con l’aggiunta di spermi prelevati dal maschio.
Un altro grande vantaggio è la quantità di uova deposte (1000-1500) per ogni stimolazione. Le grandi dimensioni delle uova degli Anfibi, da 1 a 1,2 millimetri di diametro, le rendono particolarmente adatte alla manipolazione sperimentale sia in termini di microiniezione che di microchirurgia; inoltre, essendo estremamente resistenti, le uova contraggono infezioni molto difficilmente.
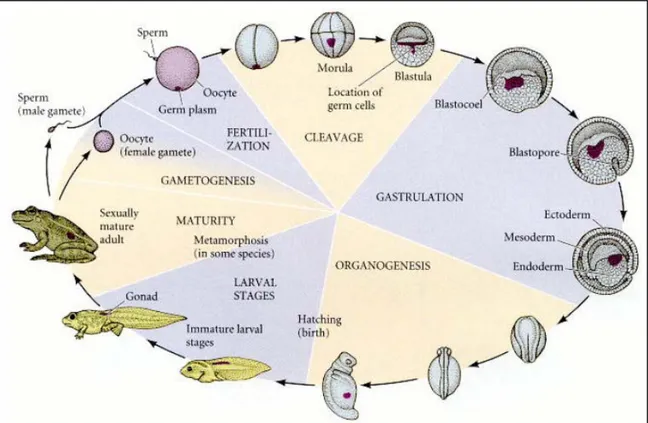
Sebbene lo Xenopus impieghi uno o due anni per raggiungere la maturità sessuale, le fasi iniziali dello sviluppo avvengono molto velocemente. Una volta fecondato, l’uovo di Xenopus laevis si divide in due blastomeri in circa novanta minuti e le divisioni successive si ripetono ogni 20 minuti fino allo stadio di blastula. Affinché un embrione raggiunga lo stadio di larva natante, terminando l’organogenesi, occorrono due giorni. In condizioni ottimali di crescita, la metamorfosi, il passaggio allo stadio adulto, viene raggiunta in circa due mesi (Figura 9).
Figura 9. Ciclo vitale di un Anfibio.
Metamorfosi del sistema visivo di Xenopus laevis
Una conseguenza facilmente osservabile nella metamorfosi degli Anuri è lo spostamento in avanti degli occhi dalla loro posizione laterale originaria. Gli occhi laterali del girino sono tipici delle prede mentre gli occhi posti frontalmente nella rana si adattano al suo stile di vita da predatore. Per la predazione, la rana deve assumere una visione tridimensionale. Ciò significa che essa deve acquisire un campo visivo binoculare in cui le immagini percepite da entrambi gli occhi convergono al cervello, integrandosi tra loro.
Inoltre, nel girino, l’occhio destro innerva solo l’emisfero sinistro del cervello e l’occhio sinistro innerva solamente quello destro: non vi sono proiezioni ipsilaterali dei neuroni retinici.
Con la metamorfosi, si assiste ad una parziale sovrapposizione dei campi visivi dei due occhi e si formano delle connessioni retinotalamiche ipsilaterali aggiuntive che consentono agli impulsi provenienti da entrambi gli occhi di raggiungere la medesima area del cervello (Currie and Cowan, 1974; Hoskins and Grobstein, 1985a).
Proliferazione asimmetrica della retina
Al contrario della retina di Mammiferi e Uccelli, la retina di Xenopus continua a crescere durante la vita in seguito all’aggiunta di nuove cellule da parte della zona del margine ciliare (CMZ) disposta alla periferia della retina (Perron et al., 1998; Harris and Perron, 1998).
D
V
D
V
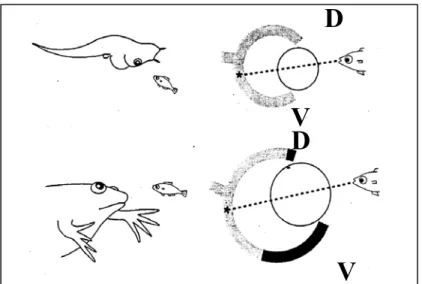
Figura 10. Spostamento degli occhi in posizione dorsofrontale alla metamorfosi e
proliferazione asimmetrica della retina (Nakagawa and Harris, 1999).
Al momento della metamorfosi, la proliferazione cellulare della CMZ ventrale diviene maggiore rispetto a quella della CMZ dorsale (Hollyfield, 1971; Straznicky and Tay, 1977; Beach and Jacobson, 1979a). Questa crescita asimmetrica della retina è essenziale per bilanciare lo spostamento dell’occhio in posizione dorsofrontale; durante questo processo, infatti, cambiano le relazioni spaziali tra l’ambiente esterno e come questo viene percepito dall’animale (Figura 10). La proliferazione asimmetrica delle CMZ ventrale e dorsale è in grado di mantenere invariato l’asse cervello-corpo-ambiente.
Ruolo dell’ormone tiroideo
L’ormone tiroideo (TH) è una molecola chiave durante la metamorfosi ed è coinvolta in innumerevoli processi. Già all’inizio della metamorfosi, a stadio 55, la retina ventrale comincia ad accrescersi più rapidamente della retina dorsale e tale comportamento persiste fino a sei mesi dopo che si è completata la metamorfosi (Hollyfield, 1971).
Il TH può indurre precocemente il pattern di crescita asimmetrico in girini premetamorfici mentre inibitori della sua sintesi impediscono il formarsi di questo pattern di crescita differenziale; è il caso del propiltiouracile (PTU) che, somministrato, blocca la sintesi di
TH impedendo la iodinazione delle tirosine (Green, 1978). L’applicazione locale di tiroxina nell’occhio di girini trattati con PTU ricrea la crescita asimmetrica della retina. Questo suggerisce che l’ormone tiroideo sia necessario e sufficiente per indurre i cambiamenti che avvengono nella crescita retinica alla metamorfosi (Hoskins, 1986). Questa risposta differenziale all’ormone tiroideo da parte del margine ciliare dorsale e ventrale non sembra essere legata ai recettori del TH (TR) in quanto è stato dimostrato che questi sono espressi ubiquitariamente sia nel sistema nervoso sia nelle diverse regioni della retina (Kawahara et al., 1991).
Deiodinasi di tipo III (D3)
Le iodotironina deiodinasi sono essenziali nella regolazione dell’azione dell’ormone tiroideo sia nelle forme adulte che in quelle larvali. La iodotironina 5-deiodinasi di tipo III (D3) è un enzima in grado di catalizzare la rimozione di un residuo di iodio dall’anello interno della tiroxina (T4) e dalla 3,5,3’-triiodotironina (T3) dando rispettivamente la 3,3’,5’-triiodotironina (rT3) e la 3,3’-diiodotironina (T2), entrambe forme inattive dell’ormone tiroideo (St. Germain et al., 1994).
L’espressione di D3 è sovraregolata nei tessuti in accrescimento al momento degli eventi metamorfici e ciò suggerisce un ruolo nella modulazione della risposta al TH da parte di questi tessuti (Berry et al., 1998b). Essendo in grado di processare le forme attive del TH a forme inattive, è stato ipotizzato che D3 svolga un ruolo protettivo affinché certi tessuti non siano esposti a dosi troppo elevate di TH (Berry et al., 1998a). Il gene codificante per D3 è stato isolato inizialmente dalla coda di girini premetamorfici; un livello basale di espressione del gene della deiodinasi è mantenuto in questo tessuto e tale livello comincia a salire fino a raggiungere un picco a stadio 60, coincidente con il picco di rilascio del TH endogeno (Wang and Brown, 1993). L’ipotesi è che D3 degradi parte dell’ormone tiroideo in circolo, rallentando il processo di riassorbimento della coda che avviene alla metamorfosi (Berry et al., 1998a). Inoltre, girini che sovraesprimono D3 sono resistenti al trattamento con TH esogeno (Huang et al., 1999). Il gene D3 presenta un’espressione asimmetrica nella retina a stadio 54, momento in cui la proliferazione delle due CMZ diviene asimmetrica. Col procedere della metamorfosi, il dominio di espressione nel margine dorsale si espande verso la retina centrale (Marsh-Armstrong et al., 1999).
Sebbene D3 sia stato identificato come gene indotto dall’ormone tiroideo (Wang and Brown, 1993), la sua espressione nella CMZ dorsale dovrebbe essere indipendente dal TH
in quanto compare già a stadio 36, molto prima che si sia formata una ghiandola tiroidea funzionante (Marsh-Armstrong et al., 1999).
La CMZ dorsale è capace di rispondere alla somministrazione di T3, ma richiede alte concentrazioni dell’ormone; nel caso in cui sia trattata contemporaneamente con acido iopanoico (IOPA), un inibitore delle deiodinasi, si assiste ad un aumento della proliferazione anche con basse concentrazioni di ormone tiroideo (Galton, 1989; Marsh-Armstrong et al., 1999). Al contrario, utilizzando un transgene di D3 posto sotto il controllo di un promotore ubiquitario o neuro-specifico, si assiste all’inibizione della proliferazione nella retina ventrale durante la metamorfosi (Nakagawa and Harris, 1999).
Connessioni retinotalamiche ipsilaterali
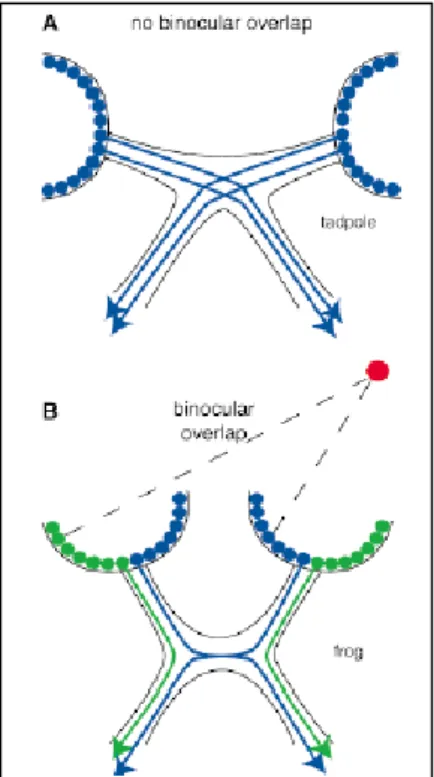
In Xenopus, le proiezioni della retina al talamo controlaterale cominciano a formarsi precocemente durante l’embriogenesi e sono ben sviluppate nel girino. Al contrario, le proiezioni al talamo ipsilaterale si formano solamente in un momento successivo, quando ci si avvicina alla metamorfosi (Figura 11) (Hoskins and Grobstein, 1985a).
Figura 11. Posizione degli occhi e proiezioni retiniche negli Anfibi premetamorfici e
postmetamorfici. (A) nel girino sono presenti solamente proiezioni controlaterali (in blu) mentre (B) nella rana postmetamorfica, sono presenti anche proiezioni ipsilaterali (in verde).
Queste proiezioni retinotalamiche non decussanti al livello del chiasma sono essenziali nell’acquisizione di una visione binoculare appropriata allo stile di vita predatorio della rana adulta (Jacobson, 1976).
Inoltre, le cellule che danno origine a queste proiezioni ipsilaterali si localizzano esclusivamente nella porzione ventrotemporale della retina e nessuna cellula della porzione dorsale vi partecipa (Hoskins and Grobstein, 1985a). Questo modello di sviluppo coincide con gli eventi proliferativi della retina al momento della metamorfosi: le proiezioni ipsilaterali hanno origine da cellule gangliari retiniche di nuova formazione, che differenziano principalmente nella regione ventrale della retina (Hoskins and Grobstein, 1985b). Una dimostrazione di ciò risiede nel fatto che girini trattati con propiltiouracile (PTU), un inibitore della produzione di tiroxina nella ghiandola tiroidea, non presentano connessioni retinotalamiche ipsilaterali; la somministrazione di TH ad uno solo degli occhi trattati recupera la formazione delle proiezioni ipsilaterali da quell’occhio (Hoskins and Grobstein, 1985a).
Inizialmente, fu tratta la conclusione che l’ormone tiroideo fosse effettivamente in grado di indurre la formazione di nuove cellule nella retina ventrotemporale; da queste si dipartivano poi proiezioni assonali che raggiungevano il talamo ipsilaterale (Hoskins, 1990). Trapiantando tali cellule da una retina metamorfica (stadio 58-64) in una retina premetamorfica (stadio 33/34), si assiste alla formazione di sole connessioni retinotalamiche controlaterali, non ipsilaterali. Gli assoni del trapianto decussano al livello del chiasma a stadi precoci a causa della mancanza di molecole che li guidino in direzione ipsilaterale (Nakagawa et al., 2000).
Ruolo delle efrine e dei recettori Eph
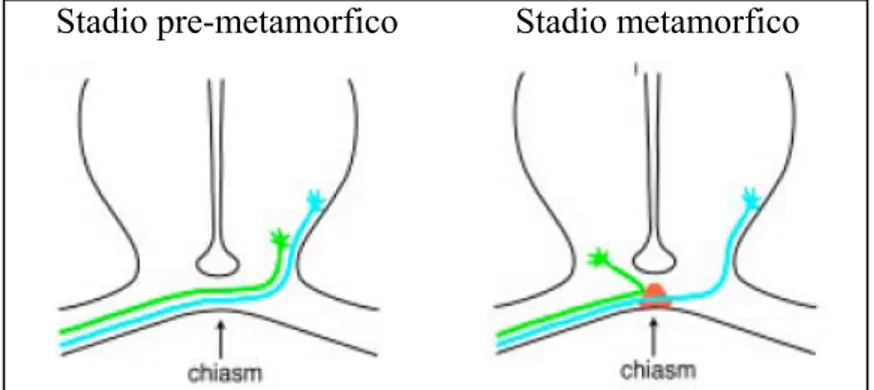
Negli animali con una visione di tipo binoculare, gli assoni delle cellule gangliari retiniche (RGCs) decussano o meno al livello del chiasma. La diversa direzione che le proiezioni seguono durante il loro cammino verso il talamo dipende da fattori che gli assoni incontrano durante il loro accrescimento. L’approccio è stato quindi quello di identificare molecole di guida assonica che non sono espresse nel chiasma di girini a stadi precoci, ma sono sovraregolate durante la metamorfosi.
L’espressione stadio-specifica spiegherebbe così che l’accensione di determinati geni in un momento particolare dello sviluppo dello Xenopus, la metamorfosi, è responsabile della formazione delle connessioni retinotalamiche ipsilaterali.