UNIVERSITA’ DELLA CALABRIA
DIPARTIMENTO DI CHIMICA CHIM/03-Chimica Generale ed Inorganica
Tesi di Dottorato di Ricerca in ICM “Inorganic Chemistry Methods”
XIV Ciclo
Sintesi e caratterizzazione di complessi di Zn(II):
un nuovo approccio per ottenere biomateriali
Supervisore Candidato Prof. Daniela Pucci Sante Pirillo
Coordinatore Ch.mo Prof. Nino Russo
INDICE
SOMMARIO 1
CAPITOLO I 14
I.1“Drug discovery” e design di complessi metallici antitumorali 14
I.2 Metallo-intercalazione del DNA 17
I.3 Lo zinco come metallo innovativo 25
I.4 Complessi di zinco biologicamente attivi 31
I.5 G-quadruplex 46
CAPITOLO II 58
II.1 Curcumina-storia e tradizione 59
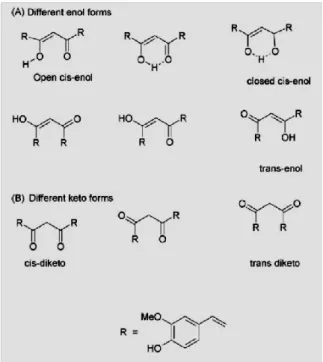
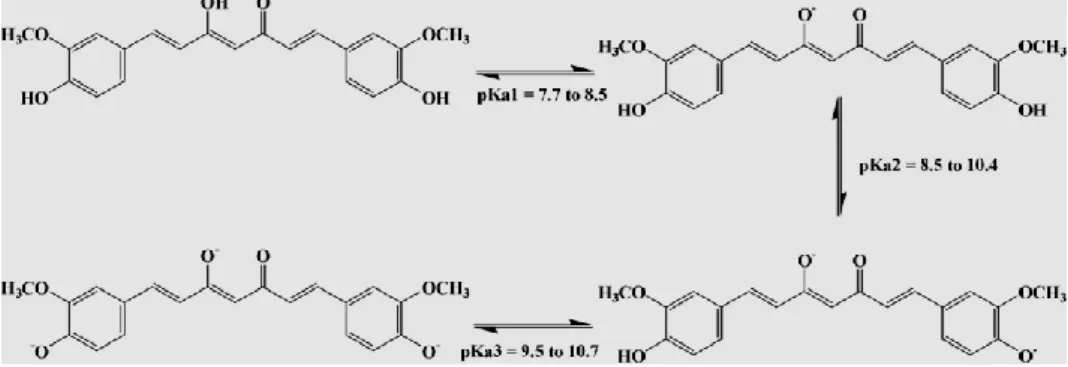
II.2 Curcumina-chimica 62
II.3 Curcumina-farmacologia 67
II.3.1 Attività antinfiammatoria 68
II.3.2Attività antiossidante 69
II.3.3 Attivita antiaggregante 72
II.3.4Attività ipoglicemizzante 73
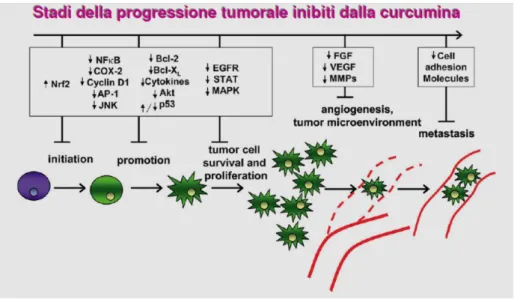
II.3.5 Attività antitumorale 74
II.3.6 Curcumina-effetti indesiderati tossicità 81
II.4 Le formulazioni della curcumina 82
II.5 Complessi metallici di cucumioidi 89
II.5.1 Complessi metallici omolettici della curcumina 90 II.5.2. Compessi metallici eterolettici della curcumina 96
CAPITOLO III 102 III.1 Sintesi e caratterizzazione di complessi di Zn (II) della
curcumina con derivanti 1,10 fenantrolinici 103 III.1.1 Sintesi e caratterizzazione dei complessi precursori
[(Ln)ZnCl2], 1-3 105
III.1.1.1 Sintesi e caratterizzazione del complesso precursore 1 106 III.1.1.2 Sintesi e caratterizzazione del compesso precursore 2 108 III.1.1.3 Sintesi e caratterizzazione del compesso precursore 3 111 III.1.2 Sintesi e caratterizzazione dei complessi curcuminici
[(Ln)Zn(curc)(Cl)], 4-6 113
III.1.1.1 Sintesi e caratterizzazione del complesso 4 114 III.1.1.2 Sintesi e caratterizzazione del complesso 5 120 III.1.1.2 Sintesi e caratterizzazione del complesso 6 123
III.2 Sintesi e caratterizzazione del complesso di Zn(II) della
curcumina con un derivato 2,2’ bichinolinico 127 III.2.1 Sintesi e caratterizzazione del legante bichinolinico L4 130
III.2.2 Sintesi e caratterizzazione del complesso precursore 7 133 III.2.3 Sintesi e caratterizzazione del complesso 8 134
III.3 Sintesi e caratterizzazione di complessi di Zn(II) della
curcumina con derivati 2,2’ bipiridinici 140
III.3.1. Sintesi e caratterizzazione dei leganti 2,2’ bipiridinici 142 III.3.1.1 Sintesi e caratterizzazione del legante bipiridinico L6 143 III.3.1.2 Sintesi e caratterizzazione del legante bipiridinico L7 146 III.3.1.3 Sintesi e caratterizzazione del legante bipiridinico L8 148 III.3.2 Sintesi e caratterizzazione dei complessi precursori
[(Ln)ZnCl2], 9-12 149
III.3.2.2 Sintesi e caratterizzazione del complesso precursore
10 152
III.3.2.3 Sintesi e caratterizzazione del complesso precursore
11 154
III.3.2.4 Sintesi e caratterizzazione del complesso precursore
12 156
III.3.3 Sintesi e caratterizzazione dei complessi curcuminici
[(Ln)Zn(curc)(Cl)], 13-16 158
III.3.3.1 Sintesi e caratterizzazione del complesso 13 159 III.3.3.1.1 Caratterizzazione biologica del complesso 13 169 III.3.3.1.2 Caratterizzazione spettroscopica dell’interazione
del complesso 13 con l’HSA 171
III.3.3.1.3 Studio di incapsulazione nei nanotubi di carbonio
del complesso 13 174
III.3.3.2 Sintesi e caratterizzazione del complesso 14 178 III.3.3.2.1 Caratterizzazione biologica del complesso 14 182 III.3.3.3 Studio di interazione dei complessi 13 e 14 con
oligomeri di DNA tramite fluorescenza a microscopia polarizzata
184
III.3.3.4 Sintesi e caratterizzazione del complesso 15 186 III.3.3.5 Sintesi e caratterizzazione del complesso 16 190
III.4 Sintesi e caratterizzazione di complessi omolettici di Zn(II)
con derivati 2,2’ bipiridinici 195
III.4.1 Sintesi e caratterizzazione del complesso 17 195 III.4.2 Sintesi e caratterizzazione del complesso 18 200 III.4.3 Caratterizzazione fotofisica dei complessi 17 e 18 202
CAPITOLO IV 205
IV.1 Materiali e metodi 205
IV.1.1 Informazioni generali 205
IV.1.2 Fotofisica 205
IV.1.3 Cristallografia a raggi X 206
IV.1.4 Microscopia a forza atomica “AFM” 207
IV.1.5 Microscopia a fluorescenza polarizzata 208
IV.1.6 Citotossicità e inibizione della crescita cellulare 210
IV.1.7 Nanotubi di carbonio “CNTs” 212
IV.2 Sintesi di complessi curcuminici di Zn(II) 214
IV.2.1 Sintesi di [(L1)ZnCl2], 1 214
IV.2.2 Sintesi di [(L2)ZnCl2], 2 215
IV.2.3 Sintesi di [(L3)ZnCl2], 3 217
IV.2.4 Sintesi di [(L1)Zn(curc)(Cl)], 4 218
IV.2.5 Sintesi di [(L2)Zn(curc)(Cl)], 5 220
IV.2.6 Sintesi di [(L3)Zn(curc)(Cl)], 6 221
IV.2.7 Sintesi del legante L4 223
IV.2.8 Sintesi di [(L4)ZnCl2], 7 225
IV.2.9 Sintesi di [(L4)Zn(curc)(Cl)], 8 227
IV.2.10 Sintesi del legante L6 228
IV.2.11 Sintesi del legante L7 232
IV.2.12 Sintesi del legante L8 233
IV.2.13 Sintesi di [(L5)ZnCl2], 9 234
IV.2.15 Sintesi di [(L7)ZnCl2], 11 236
IV.2.16 Sintesi di [(L8)ZnCl2], 12 237
IV.2.17 Sintesi di [(L5)Zn(curc)(Cl)], 13 238
IV.2.18 Sintesi di [(L6)Zn(curc)(Cl)]·(Acetone), 14 240
IV.2.19 Sintesi di [(L7)Zn(curc)(Cl)], 15 242
IV.2.20 [(L8)Zn(curc)(Cl)], 16 243
IV.3. Sintesi di complessi omolettici di Zn(II) 245
IV.3.1 Sintesi di {[Zn(L6)3](PF6)2}2·L6·4H2O, 17 245
1
SOMMARIO
La chemioterapia è una delle principali modalità di trattamento dei tumori, nonostante i noti effetti collaterali e l'instaurarsi di resistenza farmacologica dopo la prima esposizione all' agente chemioterapico. Pertanto sarebbe auspicabile lo sviluppo di nuovi composti con minor tossicità ma maggiore efficacia. L'applicazione della chimica inorganica alla medicina è un campo di ricerca in grande crescita; in particolare, molti sforzi sono rivolti a sviluppare nuovi farmaci antitumorali basati sulla chimica dei metalli di transizione. I complessi di coordinazione, infatti, offrono nuovi meccanismi di azione rispetto ai composti organici, poiché la natura dello ione metallico, il suo stato di ossidazione ed il tipo e numero di leganti coordinati possono tutti esercitare una influenza decisiva sull'attività biologica del complesso metallico. Il cis-platino (cis-DDP) è entrato nell'uso clinico del trattamento del cancro da più di 30 anni ma esso presenta alcuni problemi, come l'elevata tossicità, lo sviluppo di resistenza al trattamento farmacologico e la ridotta efficacia nei confronti di alcuni tipi di cancro. Negli ultimi anni, quindi, la ricerca si è spostata verso lo sviluppo di una nuova generazione di complessi metallici che si discostano dalle classiche regole struttura-attività, ed un’ottima alternativa al Pt(II) sembra essere lo Zn(II). Lo Zn(II) è uno dei metalli biologicamente più importanti ed apparentemente indispensabile a tutte le forme di vita: è considerato un microelemento ma con un grande ruolo. E’ un metallo a basso costo, con vasta chimica di coordinazione e con interessanti proprietà fotofisiche, grande protagonista nella chimica bioinorganica ma ancora poco esplorato per le sue potenzialità antitumorali.
Sono stati, infatti, recentemente sintetizzati alcuni complessi di Zn(II) basati su leganti O,O chelanti, appartenenti alla famiglia dei troponoidi e
2
degli acilpirazoloni, e leganti N,N chelanti bipiridinici, di cui sono state studiate le proprietà antitumorali in vitro su linee cellulari prostatiche. I risultati sono stati promettenti, ma i limiti di solubilità nei solventi biologicamente compatibili e la loro scarsa affinità strutturale per un meccanismo di intercalazione hanno spinto verso la ricerca di complessi simili ma più adatti agli scopi prefissati.
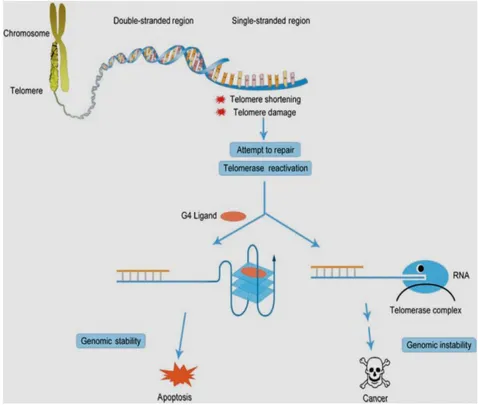
Un’ulteriore tendenza nella ricerca dei farmaci anticancro, è quella di individuare tratti particolari e caratteristiche uniche delle cellule cancerose. Fino ad oggi, i maggiori sforzi sono stati ampiamente indirizzati alla progettazione di molecole che interagiscono con la doppia elica del DNA o DNA duplex. I moltissimi studi sulla trasformazione delle cellule umane normali in cellule tumorali hanno consentito di caratterizzare meglio le differenze tra i due tipi di cellule e di individuare target esclusivi delle cellule tumorali: tra questi ha avuto ampio risalto l’intimo legame tra l’immortalità del tumore e l’attività dell’enzima telomerasi, una nucleoproteina che ha il compito di conservare la lunghezza dei cromosomi. Le quadruple eliche, o G-quadruplex, sono strutture secondarie del DNA caratteristiche di oligonucleotidi con sequenze ricche di guanine, le quali hanno una naturale tendenza ad associarsi in quartetti complanari di basi, tenute insieme da legami idrogeno di tipo Hoogsteen. L'interesse scientifico verso strutture del DNA a quadrupla elica è giustificato dalla presenza di sequenze ricche di guanine, potenzialmente in grado di strutturarsi in quadruplex, in regioni importanti del genoma umano quali telomeri eucarioti. La mancata azione della telomerasi è alla base del meccanismo dell’apoptosi. Al contrario, un'intensa attività telomerasica, tipica di diverse forme tumorali, causa il fallimento dell'apoptosi. Pertanto, la telomerasi è considerata un target molecolare promettente in varie terapie anticancro, proprio perché
3
espressa nell'80-90% delle cellule tumorali ed assente nella maggior parte dei tessuti somatici. La strutturazione dei telomeri in forme a quadrupla elica non consente il riconoscimento da parte della telomerasi e, pertanto, blocca l'allungamento del telomero. Un approccio farmacologico estremamente promettente è basato, quindi, sulla possibilità di inibire l'attività della telomerasi in cellule tumorali e promuoverne, conseguentemente, l'apoptosi mediante somministrazione di sostanze in grado di indurre e/o stabilizzare strutture quadruplex nei telomeri. Fino ad ora pochi sono gli esempi di complessi metallici in grado di stabilizzare strutture quadruplex telomeriche, ma grazie alla versatilità della chimica di coordinazione dei metalli di transizione, i complessi metallici si configurano come ottimi potenziali leganti G-quadruplex.
In questo lavoro di ricerca sono state progettate due famiglie di complessi di Zn(II), in modo che la struttura e le proprietà abbiano i requisiti per soddisfare le attività biologiche precedentemente menzionate.
Complessi eterolettici
E’ stata messa a punto di sintesi per la realizzazione di nuovi complessi metallici eterolettici multifunzionali, capaci cioè di raggruppare in una singola molecola diverse proprietà: esibire effetti antitumorali attraverso meccanismi addizionali o alternativi rispetto a quelli covalenti classici, come l’intercalazione, ed essere nello stesso tempo dotati di una fluorescenza intrinseca, per seguirne per via spettroscopica sia la localizzazione che il meccanismo stesso di citotossicit.
Per ottenere tale scopo è stato utilizzato lo ione Zn(II) come metallo centrale ed a lui sono state coordinate due diverse tipologie di leganti, uno N,N ed uno O,O chelante, entrambi potenzialmente intercalanti. A completare la sfera di coordinazione dello Zn(II) è stato utilizzato un
4
legante monodentato labile per dare origine a complessi pentacoordinati con una geometria piramidale quadrata, quindi molto innovativi rispetto ai classici metallointercalatori a geometria quadrato-planare o ottaedrica presenti in letteratura. La struttura generale di tali complessi è la seguente:
HO OCH3 O N N X X Zn Cl O OCH3 OH X'
Come leganti N,N chelanti sono stati utilizzati 1,10-fenantroline, 2,2ˈ-bichinoline e 2,2ˈ-bipiridine, leganti che presentano elevata capacità
di coordinazione. In particolare sono stati usati la 1,10-fenantrolina (L1), la 4,7-difenil-1,10-fenantrolina (L2), e la 5-nitro-1,10-fenantrolina (L3), in modo da sondare se la presenza si sostituenti più o meno ingombranti potesse modificare le proprietà e la reattività dei complessi finali.
N N N N N N
NO2
L1 L2 L3
A differenza dei leganti fenantrolinici che sono commerciali, è stato necessario mettere a punto una strategia sintetica opportuna che prevede numerosi step, il legante 2,2’ bichinolinico e quelli 2,2’ bipiridinici
5
funzionalizzati opportunamente in posizione para rispetto agli atomi di azoto, in modo da studiarne e migliorarne il ruolo dei vari gruppi sulle proprietà di solubilità nonché sulla citotossicità.
2,2’-bichinoline 2,2’-bipiridine N N HOH2C CH2OH L4 N N X L5: X = C9H19; L6: X = CH2OH; L7: X = CH2Br; L8: X = CH2N+(Et)3Br -X
Tali leganti N,N chelanti sono stati coordinati allo ione Zn(II) dando luogo alla formazione di complessi di Zn(II) tetracoordinati [(Ln)ZnCl2].
N N X X ZnCl2 N N X X Zn Cl Cl + Y Y L1: X=H, Y=H L2: X=Ph, Y=H L3: X=H, Y=NO2 L4: X=CH2OH, Y=H L5: X=C9H19, Y=H L6: X=CH 2OH, Y=H L7: X=CH2Br, Y=H L8: X=CH2N+(Et)3Br-, Y=H [(L1)ZnCl2], 1 [(L2)ZnCl 2], 2 [(L3)ZnCl 2], 3 [(L4)ZnCl2], 7 [(L5)ZnCl2],9 [(L6)ZnCl2],10 [(L7)ZnCl2],11 [(L8)ZnCl2],12
I complessi [(Ln)ZnCl2] rappresentano i precursori dei complessi
eterolettici finali [(Ln)Zn(curc)Cl] in cui è stata utilizzata, come legante O,O, la curcumina (curc).
6
La curcumina, infatti, come legante libero presenta una buona attività in diversi campi della medicina essendo un potente antiossidante con numerose proprietà biologiche, recentemente noto anche per la sua efficacia terapeutica nei confronti di varie forme tumorali. Sfortunatamente però la curcumina soffre dello svantaggio di essere relativamente poco biodisponibile, facilmente ossidabile e fotodegradabile, tutti fenomeni alla base dell’uso limitato che di questa specie organica si può fare in campo farmaceutico. La coordinazione di tale legante ad uno ione metallico però induce delle variazioni strutturali consistenti che possono stabilizzare il farmaco, impedendone la degradazione e migliorandone le proprietà farmacologiche.
O O HO OCH3 OCH3 OH N N Zn Cl O O HO OCH3 OCH3 OH + Trietilammina X X N N X X Zn Cl Cl Y Y [(L1)ZnCl 2], 1 [(L2)ZnCl2], 2 [(L3)ZnCl2], 3 [(L4)ZnCl 2], 7 [(L5)ZnCl 2], 9 [(L6)ZnCl 2], 10 [(L7)ZnCl 2], 11 [(L8)ZnCl2], 12 [(L1)Zn(curc)Cl], 4 [(L2)Zn(curc)Cl], 5 [(L3)Zn(curc)Cl], 6 [(L4)Zn(curc)Cl], 48 [(L5)Zn(curc)Cl], 13 [(L6)Zn(curc)Cl], 14 [(L7)Zn(curc)Cl], 15 [(L8)Zn(curc)Cl], 16
7
La presenza contemporanea del frammento curcuminoide e dello ione Zn(II), permette di combinare in una singola molecola le proprietà antitumorali con una intrinseca fluorescenza, ottimo strumento per poter seguire il percorso farmacocinetico ed i target specifici in modo da esaminare il meccanismo d’azione del farmaco senza bisogno di ulteriori agenti esterni.
Tutti i complessi sintetizzati sono stati ottenuti con buone rese e sono stati caratterizzati mediante spettroscopie IR, 1H-NMR, UV-vis ed analisi elementare e, laddove possibile, mediante analisi diffrattometrica a raggi X e microscopia AFM in modo da studiarne la morfologia in nanoscala e testare l’effetto di differenti substrati e solventi sulla forma ed aggregazione delle molecole stesse.
Tutti i leganti ed i complessi sono stati caratterizzati anche da un punto di vista fotofisico per verificare il loro possibile carattere emissivo e la loro stabilità in soluzione. La curcumina assorbe nel blu-violetto ed emette nella regione giallo-verde con una resa quantica del 5%. I leganti fenantrolinici, bipiridinici e bichinolinici assorbono nell’ UV e risultano essere privi di proprietà emissive, eccezion fatta per i leganti L1, L2 e L8 che presentano proprietà emissive nella regione UV, ma con basse rese quantiche di emissione. Anche i complessi precursori [LnZnCl2]
assorbono nella regione UV dello spettro elettromagnetico ed emettono nella regione UV con basse rese quantiche di emissioni, eccezion fatta per i complessi precursori bipiridinici 9 e 10, che mostrano elevate rese quantiche di emissione, rispettivamente pari al 6% ed al 43%. Un comportamento completamente diverso, rispetto ai leganti N,N chelanti ed ai loro precursori dicloro, mostrano i complessi curcuminici [(Ln)Zn(curc)Cl], che assorbono nel blu-violetto ed emettono conseguentemente nella regione giallo-verde, in un range che va da 531 a
8
545 nm, con buone rese quantiche di emissione (dal 2% al 20.4%). Questo comportamento si origina dalla presenza del legante curcumina nei complessi sintetizzati.
Sulla maggior parte dei complessi sono stati effettuati studi biologici, ma prima di fare i test biologici sono state eseguite le misure di spettroscopia UV-vis dei complessi, dopo 24 e 48h, in soluzione acquosa tamponata con tampone fosfato a pH fisiologico (pH=7.4). Tali misure hanno confermato la stabilità nel tempo dei complessi rispetto alla curcumina libera che, invece va incontro, già dopo 24 ore, a fotodegradazione.
250 300 350 400 450 500 550 600 0,0 0,2 0,4 0,6 t0 24h 48h A bs nm 300 400 500 600 700 0,05 0,10 0,15 0,20 0,25 0,30 0,35 Ab s nm t0 24h 48h Curcumina Complesso 13
Quindi, i complessi sono stati testati in vitro su linee cellulari tumorali prostatiche umane (DU145, LnCaP e PC-3) e su linee cellulari di neuroblastomi umani (LAN-5 e SHSY-5Y). I complessi testati, a differenza dei leganti liberi e dei complessi precursori dicloro, mostrano un’ ottima attività antitumorale dell’ ordine micromolare. Si può affermare che questa coordinazione non solo stabilizza la curcumina, ma ne modifica anche l’ attività biologica.
In modo particolare il complesso bipiridinico 13 [(L5)Zn(curc)Cl] è quello che presenta la migliore solubilità in vari solventi (clorurati, alcoli,
9
DMSO e parzialmente acqua), quindi è stato scelto per effettuare studi più approfonditi.
E’ stata studiata l’ attività antiproliferativa in vitro, nei confronti di linee cellulari tumorali prostatiche umane (DU145, LNCaP e PC-3) e di neuroblastomi (SHSY-5Y e LAN-5). In particolare, nella seguente tabella sono riportati i suoi valori di IC50 (concentrazione di farmaco necessaria
per inibire il 50% della proliferazione cellulare). Si può notare che, a differenza del legante bipiridinico L5 e del complesso precursore 9 che non mostrano una particolare attività antiproliferativa, il compleso 13 ha un’ ottima attività citotossica dell’ ordine micro molare, in particolare sulla linea cellulare prostatica DU145 (12,5 µM) con un’ attività nettamente superiore allo stesso cis-platino (33µM).
DU145 Pc-3 LNCaP SH5Y-SY LAN-5 Curcumina 2.3±0.7 2.0±2.2 7.8±1.5 13.6±5.6 24±2.2
(bipy-9), L5 > 100 > 100 > 100 > 100 > 100
[(L5)ZnCl2], 9 32.3±2.5 28.3±2.2 45.3±2.1 19.1±3 36±2.2
[(L5)Zn(curc)Cl],13 12.5±2.6 21.5±8 34±1.3 16±8.1 13.2±9
Validata l’attività citotossica del complesso 13 nei confronti di cellule neoplastiche e dunque, una sua potenziale applicazione come farmaco antitumorale, è stato effettuato lo studio dell’interazione dello stesso complesso con l’HSA (human serum albumin), mediante tecniche spettroscopiche di fluorescenza UV/VIS, con l’obiettivo di giungere ad una comprensione del meccanismo di binding complesso-proteina. E’ stato deciso di condurre questo studio in quanto la farmacocinetica e la farmacodinamica di molti farmaci dipendono, ampiamente, dall’interazione che gli stessi hanno con l’albumina sierica umana, che è la più abbondante proteina presente a livello del plasma sanguigno. Lo
10
studio è stato realizzato monitorando il cambiamento delle proprietà fotofisiche del complesso 13 e dell’albumina, in seguito alla loro interazione. I risultati ottenuti convergono alla conclusione che il sito di legame del complesso all’albumina è localizzato in una tasca idrofobica del subdominio IIA della stessa.
E’ stata studiata, inoltre, la possibile incapsulazione del complesso 13 nei nanotubi di carbonio (CNTs). I nanotubi di carbonio sono materiali innovativi che presentano svariati campi di applicazione, tra cui quello biomedicale e farmaceutico è senz’altro quello in più rapida espansione. Questo complesso è stato incapsulato all’interno dei CNTs e la sua effettiva incapsulazione all’interno dei CNTs è stata confermata mediante microscopia TEM come si può osservare dalla seguente immagine
Inoltre, è stata determinata l’efficienza di caricamneto del farmaco che è risultata essere del 29 ± 2 %. Questo risulta essere un buon dato che darà la possibilità di passare allo step successivo, che sarà quello di valutare i profili di rilascio del potenziale farmaco prima in vitro al fine di valutare le cinetiche di rilascio, e successivamente in coltura cellulare per valutare l’efficacia del sistema di rilascio proposto.
Infine, è stata studiata la potenziale capacità intercalante a livello del DNA. Questo è stato studiato utilizzando tecniche ottiche come la microscopia a trasmissione polarizzata e la microscopia a fluorescenza
11
polarizzata, così da caratterizzare ulteriormente il complesso 13 in presenza di oligomeri di DNA a doppio filamento grazie alla fluorescenza che presentano nel range del visibile. In particolare, è stato mescolato con gli oligomeri di DNA liquido-cristallini che provvedono anche a rendere l’ambiente più idrofobico, quindi molto più adatto per molecole che presentano una bassa solubilità in acqua. L’emissione della miscela è stata fotografata in varie direzioni della polarizzazione incidente (orizzontale e verticale) ed è stata osservata nel dominio liquido-cristallino, come mostrato nella seguenti immagini
Tutto ciò sta ad indicare la presenza di interazioni tra le doppie eliche di DNA e le molecole ospiti. Inoltre per i complessi 13 il pattern di fluorescenza, lungo i domini liquido-cristallini, è simile a quello del bromuro di etidinio (paradigma di molecola intercalante), infatti la loro intensità di fluorescenza indica, che le molecole sono perpendicolari all’ asse del DNA, parallele alle basi e quindi intercalate.
Complessi omolettici
E’ stata messa a punto anche la sintesi di complessi tris omolettici di
Zn(II), in cui sono stati utilizzati come leganti esclusivamente le 2,2’ bipiridine, in modo da avere una estesa superficie aromatica e quindi
12
svolgere sia una potenziale attività intercalante che una potenziale
stabilizzazione delle strutture G-quadruplex. Sono state utilizzate 2,2’-bipridine che presentano differenti sostituenti in posizione para
rispetto agli atomi di azoto, in modo da poter verificare gli effetti dei gruppi terminali sulla solubilità dei complessi e nello stesso tempo in modo che la solubilità in mezzi polari venga in questo modo favorita da interazioni elettrostatiche.
In particolare, sono stati utilizzati i leganti L6 ed L8, in quanto presentano come sostituenti in posizione para rispetto agli atomi di azoto, rispettivamente un gruppo idrossilico ed un gruppo ionico. Sono stati scelti con la possibilità che la solubilità nei mezzi polari venga favorita da possibili interazioni elettrostatiche.
N N X X 3 + Zn(AcO)2 2+ 2PF6 -Zn N N N N N N X X X X X X L6: X=CH 2OH, Y=H L8: X=CH 2N+(Et)3Br -{[Zn(L6) 3](PF6)2}2·L6·4H2O, 17 [Zn(L8) 3](PF6)2, 18
I complessi sintetizzati sono stati ottenuti con buone rese e sono stati caratterizzati mediante spettroscopie IR, 1H-NMR, UV-vis, analisi elementare e mediante analisi diffrattometrica a raggi X.
In generale l’obiettivo che ci si era proposti, cioè di mettere a punto una strategia sintetica per ottenere da un lato, nuovi complessi di Zn(II)
13
eterolettici e dall’ altro, nuovi complessi tris omolettici sempre di Zn(II), è stato raggiunto.
I complessi di Zn(II) con la curcumina mostrano una buona stabilità in soluzione ha permesso di superare svantaggi come poca biodisponibilità e fotodegradazione che limitano l’efficacia del legante curcumina da solo. La struttura molecolare complessiva e la presenza dei leganti aromatici planari coordinati allo Zn(II) ha suggerito che tali complessi possano agire come metallointercalanti. Inoltre la presenza contemporanea del frammento curcuminoide e dello ione Zn(II), ha permesso di combinare in una singola molecola le proprietà antitumorali con una intrinseca fluorescenza, ottimo strumento per poter seguire il percorso farmacocinetico ed i target specifici in modo da esaminare il meccanismo d’azione del farmaco senza bisogno di ulteriori agenti esterni.
Inoltre, tutti i complessi tris bipiridinici di Zn(II), vista la loro stabilità nel tempo in soluzione acquosa tamponata a pH 7.4, saranno testati per studiare se sono anch’ essi citotossici e nello stesso tempo, vista la loro solubilità in acqua e l’ estesa superficie aromatica, se sono capaci di stabilizzare le strutture G-quadruplex.
14
Capitolo I
I.1 “Drug discovery” e design di complessi metallici antitumorali
Il cancro rappresenta una tra le maggiori cause di morte per l'uomo. La principale strategia di trattamento antitumorale è la chemioterapia, nonostante i ben noti effetti collaterali. 1 A livello clinico, molti tumori rispondono in modo soddisfacente al primo trattamento con chemioterapici, sebbene la maggior parte di essi sviluppi una farmaco resistenza secondaria che determina un progressivo peggioramento clinico del paziente. E' stato ampiamente dimostrato che il fenotipo “multi drug resistant” espresso dalle cellule tumorali sia la maggior causa di insuccesso della chemioterapia antitumorale. 2 Pertanto è necessario ricercare e sviluppare nuovi composti in grado di ridurre la sopravvivenza delle cellule tumorali al trattamento.
Negli ultimi decenni la chimica inorganica si è occupata, con sempre maggiore interesse, della sintesi di complessi metallici che possano risultare utili in campo biologico, lavoro che risulta essere molto stimolante e proficuo come testimoniano i numerosi nuovi complessi sintetizzati che sono entrati a far parte dell’uso medico come innovativi agenti terapeutici. 3,4,5,6 I complessi di coordinazione, infatti, offrono nuovi meccanismi di azione rispetto ai composti organici, poiché la natura dello ione metallico, il suo stato di ossidazione ed il tipo e numero di
leganti coordinati possono tutti esercitare una influenza decisiva
1 V. T. Devita, E. Chu, Cancer Res. 2008, 68, 8643.
2 M. D. Hall, M. D. Handley, M.M. Jottesman, Trends Pharmacol. Sci., 2009, 30, 546. 3
C. X. Zhang, S. J. Lippard, Curr. Op. Chem. Biol., 2003, 7, 481.
4 G. Gasser, I. Ott, N. Metzler-Nolte, J. Med. Chem., 2011, 54, 3. 5 Z. Guo, P. J. Sadler, Angew. Chem. Int. Ed., 1999, 38, 1512. 6 I. Ott, R. Gust, Arch. Pharm. Chem. Life Sci., 2007, 340, 117.
15
sull' attività biologica del complesso metallico. 7,8,9 L’uso di complessi inorganici in medicina non è una novità: per migliaia di anni i complessi di rame sono stati utilizzati per le loro proprietà antisettiche mentre i complessi di oro hanno trovato largo impiego nella medicina araba e cinese. L’applicazione sicuramente più nota nella medicina moderna riguarda l’ uso del cis-platino (cis-DDP) come agente antitumorale. Il cis-platino è entrato nell'uso clinico del trattamento del cancro da più di 30 anni ma esso presenta alcuni problemi, come l'elevata tossicità, lo sviluppo di resistenza al trattamento farmacologico 10 e la ridotta efficacia nei confronti di alcuni tipi di cancro. 11 Recentemente quindi la ricerca si è spostata verso la sintesi di nuovi complessi a base di Pt(II), che esplicano la loro azione citotossica formando sempre addotti covalenti con le molecole responsabili della trasmissione dei caratteri ereditari; ma tuttavia presentano un grosso limite, che deriva dall’elevata tossicità dovuta alla scarsa selettività d’azione, in quanto agiscono nella larga matrice organica dei sistemi biologici. 7,12,13,14 Di recente, comunque, la ricerca si è spostata verso la sintesi di nuovi complessi metallici la cui attività antiproliferativa sia legata a nuovi modi di interazione con il DNA. 8,11,15,16,17 Infatti, dalla scoperta del cis-DDP ad oggi, molti progressi sono stati fatti per quanto riguarda lo studio delle interazioni tra biomolecole e complessi metallici a potenziale attività farmacologica e
7
P. CA Bruijnincx, P. J. Sadler, Curr. Op. Chem. Biol., 2008, 12, 197.
8
G. Sava, A. Bergamo, P. J. Dyson, Dalton Trans., 2011, 40, 9069.
9 T. W. Hambley, Dalton Trans., 2007, 4929.
10 M. Galanski, M. A. Jakupec, B. K. Keppler, Curr. Med. Chem., 2005,12, 2075. 11
J. Reedijk, Eur. J. Inorg. Chem., 2009, 1303.
12 Y.-P. Ho, S. C. F. Au-Yeung, K. K. W. To, Med. Res. Rev., 2003, 5, 633. 13 R. Bakhtiar, E.-I. Ochiai, General Pharmacol., 1999, 32, 525.
14 L. M. Pasetto, M. R. D’ Andrea, A. A. Brandes, E. Rossi, S. Monfardini, Crit. Rev.
Oncol. Hematol., 2006, 60, 59.
15 T. Storr, K. H. Thompson, C. Orvig, Chem. Soc. Rev., 2006, 35, 534. 16 S. P. Fricker, Dalton Trans., 2007, 4903.
16
molte tecniche provenienti dalla biologia molecolare sono in grado di studiare questi aspetti. Oggi possiamo affermare che i complessi metallici possono legarsi al DNA reversibilmente o irreversibilmente. Sono legami irreversibili il legame covalente, che può essere bifunzionale (intrastand o interstand) o monofunzionale. Tra gli agenti più noti che legano il DNA in modo covalente possiamo ricordare potenti cancerogeni come il benzo[α]pirene e lo stesso cis-platino. Mentre legami reversibili sono il legame al solco minore, l’intercalazione e l’inserzione (Figura I.1 e I.2).
Questi ultimi implicano interazioni elettrostatiche e/o legame a idrogeno. 18
Fig. I.1. Legame al solco (A), metallointercalazione (B) e metalloinserzione (C)
Fig. I.2. Legante al solco (A), metallointercalatore (B) e metalloinsertore (C)
17 I.2 Metallo-intercalazione del DNA
La novità nella ricerca di specie antitumorali è rappresentata dall’interazione con il DNA mediante intercalazione che è una delle modalità più studiate perché produce alta affinità di legame e selettività specifica nei confronti del target. 18
Il concetto d’intercalazione fu proposto per primo da Lerman nel 1961 per spiegare il reversibile e non covalente legame delle acridine al DNA. 19 Queste, come altre strutture aromatiche o eteroaromatiche planari, sono in grado di inserirsi all’interno dello spazio esistente tra due coppie di basi consecutive del DNA, provocando un gran numero di effetti biologici. Da qui il crescente interesse verso lo studio dei processi d’ intercalazione, come si vede dal continuo aumento delle pubblicazioni scientifiche relative a questo argomento.
Ma per capire come avviene l’ interazione tra il DNA e gli agenti intercalanti bisogna conoscere la complessità chimica della macromolecola responsabile della trasmissione dei caratteri ereditari. Il modello di Watson e Crick del DNA propone una struttura costituita da due catene polinucleotidiche avvolte a spirale a formare una doppia elica destrogira. Lungo le due catene o filamenti antiparalleli, si alternano una molecola di acido fosforico e una di pentosio a cui sono legate lateralmente le basi puriniche e pirimidiniche. Nel DNA gli accoppiamenti dell’adenina con la timina, AT e della guanina con la citosina, GC (Figura I.3) rendono massima la stabilizzazione della doppia elica attraverso legami a idrogeno. 20
19 L. S. Lerman, J. Mol. Biol., 1961, 3, 18.
18
Fig. I.3. Coppie di legame AT e GC
Con tali interazioni ogni coppia di basi forma un piano che dista 3.4 Å uno dall’altro, e questi piani si sovrappongono parzialmente con interazioni di tipo idrofobico che vengono chiamate interazioni di stacking.
Alcuni studi dimostrano che gli agenti intercalanti tendono ad aggregarsi tra di loro in soluzione acquosa, come dimeri o polimeri, e queste strutture sono dovute ad interazioni idrofobiche o forze di Van der Waals, le stesse responsabili dello stacking degli acidi nucleici. Ne deriva che le stesse interazioni di stacking tra le molecole intercalate e i nucleotidi, non solo non disturbano i pattern di stacking del DNA ma l’intercalato risultante ne risulta stabilizzato. L’interazione dell’intercalante poi, determina cambiamenti di parametri strutturali, quali il grado di rotazione con le successive coppie di basi (angolo di twist), distorsione del legame zucchero-fosfato e una separazione tra i piani formati dalle coppie di basi. L’allungamento risultante della doppia elica, conseguente all’intercalazione (Figura I.4), si traduce a sua volta in una serie di cambiamenti di proprietà fisiche, quali aumento dell’intrinseca viscosità ed un irrigidimento totale che determina una diminuzione del coefficiente di sedimentazione. 21
19
Fig. I.4. Modello semplificato di un tratto del DNA prima e dopo intercalazione
Secondo questo modello semplificato del DNA e del corrispondente
complesso intercalato, proposto da Lerman, si esclude la possibilità d’inserzione di una seconda molecola d’intercalante nei siti
immediatamente vicini, per cui quando il polinucleotide è saturato, si ottiene un’alternanza di siti vuoti ed occupati. A livello più macroscopico possiamo dire che l’intercalazione è un’interazione di tipo host-guest, cioè le sequenze del polinucleotide a cui si legano gli intercalatori vengono viste come siti accettori piuttosto che come dei veri recettori, dato che i loro effetti biologici sono esercitati solo attraverso l’interferenza con il riconoscimento e quindi con la funzione di proteine che legano il DNA (es. polimerasi, topoisomerasi). Così molecole in grado di inibire la sintesi degli acidi nucleici in vivo sono mutageni, antibiotici, antibatterici, antiparassitari e agenti antitumorali.
I complessi metallici, ovvero complessi formati da ioni metallici di transizione legati a strutture contenenti un’estesa parte aromatica, vengono detti metallointercalatori in quanto producono una forte interazione al DNA mediante intercalazione. La planarità di questi leganti
20
infatti, promuove il processo d’intercalazione, ovvero grazie alla capacità che ha il residuo aromatico planare di inserirsi all’interno dello spazio esistente tra due coppie di basi consecutive, il metallo viene avvicinato alle basi azotate dell’acido nucleico, facilitandone l’attacco ai siti selezionati.
Un complesso progenitore che si lega in modo non covalente al DNA fu sintetizzato e studiato da Lippard e suoi collaboratori nel 1970, un complesso monocationico del Pt(II), planare-quadrato, il [Pt(terpy)Cl]+ che viene attirato, grazie alla carica positiva, dallo scheletro esterno dei fosfati del DNA e si intercala con una costante di legame di 105 M-1. 21
[Pt(terpy)Cl]+ [Pt(terpy)(HET)]+
Analogamente, con una costante di associazione dell’ordine 105
-106 M-1 il complesso [Pt(terpy)(HET)]+, lega in modo molto forte, ma del tutto
reversibile il DNA. Questo complesso dimerizza sia in soluzione
(Kdimer= 7(5)x103) che allo stato solido. L’inserzione di questo cromoforo
planare al sito adiacente ad una coppia di guanina-citosina determina un aumento della temperatura di fusione e della viscosità specifica del DNA.
Questi complessi vengono definiti progenitori, in quanto contengono un sito di legame al metallo labile, a differenza di un complesso di Cu(II)
21
sintetizzato poco più tardi nel laboratorio di D. S. Sigman, il complesso [Cu(phen)2]2+. 22
[Cu(phen)2]2+
Questo complesso, che segna l’introduzione della fenantrolina in complessi che legano il DNA reversibilmente, ha infatti la proprietà di funzionare come una nucleasi sintetica del DNA, ovvero legandosi al solco minore è in grado di degradare non solo la doppia elica della forma B-DNA ma anche della forma A del DNA e del RNA.
Sulla base degli studi d’ interazione con il DNA dei primi complessi sintetizzati si può affermare che i complessi che legano il DNA non-covalentemente sono complessi cineticamente inerti, principalmente complessi ottaedrici d6 o complessi quadrato-planari d8, in generale complessi con una struttura tridimensionale rigida o quasi del tutto rigida e in cui la stereochimica è importante per la specificità di legame.
Alla stereochimica si aggiunge il fatto che il tipo di legame è influenzato anche dal grado di saturazione del DNA con il complesso metallico, come avviene nel caso di un complesso ionico del rutenio(II), [Ru (phen)3]2+,
complesso ottaedrico della fenantrolina che interagisce con il DNA attraverso tre tipi di legame non-covalente: elettrostaticamente, legame
22
idrofobico al solco minore e parziale intercalazione di una fenantrolina (Figura I.5). 22
Fig. I.5. Isomeri di [Ru (phen)3]2+
Infatti, a tutte le concentrazioni l’isomero Λ-3 si lega nel solco maggiore con una sola fenantrolina, in modo approssimativamente parallelo al piano delle basi, mentre il legame dell’ isomero Δ-3 è più complesso. Quest’ultimo, infatti, a basse concentrazioni si inserisce con due unità
fenantroliniche nel solco minore, mentre ad alte concentrazioni l’ inserzione di una singola fenantrolina sia nel solco minore che in quello
maggiore risulta essere più favorito.
Affinchè un intercalante possa trovare posto tra due basi del DNA è necessario che la doppia elica perda la sua conformazione standard. I metallo-intercalanti sono complessi metallici con al massimo un legante che funge da intercalante. Questi leganti, detti ancillari, sono orientati parallelemente rispetto alle coppie di basi, sporgono al di fuori del centro metallico e possono prontamente impilarsi nell’area π del DNA-duplex. Due noti esempi di leganti intercalanti sono phi (9,10-fenantrenechinone diimmina) e dppz (dipirido[3,2-a:2’,3’-c]fenazina). 23
23
I metallo-intercalanti entrano dunque nella doppia elica attraverso il major groove. Con l’intercalazione, in effetti, il legante agisce come una nuova coppia di basi. Nessuna base è però espulsa dal DNA-duplex. I metallo-intercalanti sono stati studiati in modo da essere saturi da un punto di vista della coordinazione e inerti alla sostituzione così che non ci sia coordinazione diretta con le basi del DNA. Le caratteristiche fotochimiche e fotofisiche che spesso mostrano sono vantaggiosamente esplorate sia per investigare la loro intercalazione che per capire ulteriori vari aspetti della chimica degli acidi nucleici.
Da quanto emerso finora, l’intercalazione rappresenta uno dei modi di legame al DNA più importante attraverso cui complessi metallici, che assomigliano strutturalmente poco al cis-DDP, esercitano la loro attività antiproliferativa, ed è assodato che l’abilità intercalante aumenta all’aumentare della planarità dei leganti. Tuttavia, la geometria di coordinazione gioca un ruolo essenziale nel tipo e forza di legame al DNA e dipende, oltre che dalla struttura dei leganti, dal tipo di ione metallico. Esso infatti, sfruttando differenti numeri di coordinazione può dare luogo a differenti geometrie che possono influenzare il tipo di legame al DNA.
24
Un’esaustiva letteratura su metallointercalatori di Ru(II) e Rh(III) descrive l’interazione di questi complessi con il DNA, i quali, anche se hanno una geometria differente dalla classica quadrato-planare, sono complessi relativamente semplici. 24,25 Quello che invece sorprende è che metalli “nuovi” nell’ambito della ricerca sul farmaco antitumorale, manifestino attività antiproliferativa che è dovuta oltre che alla planarità del sistema, alla particolare geometria dei loro complessi.
Un esempio di questi nuovi complessi metallici è rappresentato da due complessi di Cu(II) e Zn(II), [Cu(L)3](ClO4)2 e [Zn(L)3](ClO4)2(H2O)2,
dove L è l’1-[3-(2-piridil)pirazol-1-metil]naftalene. 26
1-[3-(2-piridil)pirazol-1-metil]naftalene
Questi due complessi sono stati testati contro tre linee cellulari tumorali e la riscontrata attività è dovuta all’ interazione con il DNA attraverso intercalazione grazie alla planarità del sistema metallo-legante. Inoltre, la maggiore attività del Cu(II) è dovuta alla geometria distorta del complesso (Figura I.6) derivante dalle proprietà elettroniche del sistema.
24 J. D. Higgins III, L. Neely, S. Fricker, J. Inorg. Biochem., 1993, 49, 149. 25 A. Bergamo, G. Sava, Dalton Trans., 2007,1267.
25
Fig. I.6. Struttura del complesso di Cu(II) contenente il legante 1-[3-(2-piridil)pirazol-1-metil]naftalene
Una descrizione delle relazioni struttura-attività di alcuni dei più significativi contributi provenienti dalla chimica di coordinazione, allo scopo di migliorare l’attività antitumorale dei complessi metallici, vuole essere non una mera digressione sullo stato dell’arte di nuovi sistemi con un potenziale valore terapeutico, ma piuttosto si vuole mettere in risalto l’importanza del drug design in questo settore della ricerca. In effetti si vuole evidenziare il fatto che, alterando la natura del metallo e i leganti cineticamente inerti (L), o cineticamente labili (X), la cinetica, la proprietà strutturali ed elettroniche della molecola possono massimizzare o minimizzare l’attività biologica. In molti casi anche la semplice sostituzione di differenti gruppi funzionali sui leganti può ribaltare l’attività dell’intero complesso metallico.
I.3. Lo zinco come metallo innovativo
Un metallo alternativo al Pt(II) ma poco utilizzato per la sintesi di complessi potenzialmente citotossici e nello stesso tempo intercalanti potrebbe essere lo Zn(II). Lo zinco è un metallo bivalente che, data la sua
26
posizione nella tavola periodica, presenta poche delle proprietà caratteristiche dei metalli di transizione. É considerato un metallo molto versatile grazie alla sua elevata capacità di coordinazione nei confronti di leganti N2-donatori e N,O-donatori formando complessi con interessanti
proprietà. Lo zinco è uno dei metalli biologicamente più importanti ed apparentemente indispensabile a tutte le forme di vita: è considerato un microelemento ma con un grande ruolo. É il secondo metallo di transizione, dopo il ferro, più abbondante nel corpo umano, in più è un elemento essenziale per la vita degli organismi in quanto è coinvolto in diversi processi biologici. 27,28 A differenza di altri metalli, l’accumulo dello ione Zn(II) non comporta effetti tossici, mentre una carenza potrebbe comportare gravi effetti sul sistema immunitario e soprattutto problemi di tipo metabolico. 29
Lo zinco ha importanti ruoli strutturali in quanto è coinvolto nel mantenimento dell’integrità delle membrane biologiche. Fa parte di moltissimi sistemi enzimatici, è catalizzatore di 300 enzimi diversi coinvolti nel metabolismo proteico, nella produzione di energia, nella divisione cellulare e nella sintesi di acidi nucleici. Le sue funzioni catalitiche derivano dalle sue proprietà di acido di Lewis. E’ nota da tempo l’esistenza di zinco proteine che riconoscono sequenze specifiche di basi del DNA e partecipano a processi di regolazione e trascrizione. Sono dette anche fattori di trascrizione e alcune di esse contengono motivi strutturali chiamati zinco “finger” (dita contenenti zinco) per il fatto che possono inserirsi nel solco della doppia elica del DNA e ripiegarsi come fossero delle dita. Ciò è dovuto alla possibilità che hanno gli ioni metallici di formare legami trasversali all’interno di una stessa proteina. Molti sono
27 N. P. Farrell, Uses of Inorganic Chemistry in Medicine, 1999. 28 S. Aoki, E. Kimura, Chem. Rev., 2004, 104, 769.
27
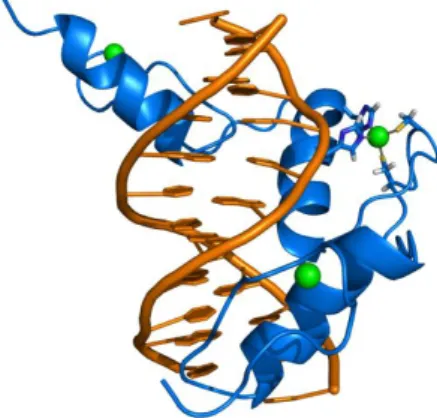
i fattori di trascrizione che contengono zinco, il più importante è l’ RNA. L’esistenza dei domini zinco “finger” fu proposta in base alle ricerche del fattore di trascrizione III A. 30 La caratteristica fondamentale delle proteine zinco “finger” è che esse contengono unità adiacenti (finger) costituite da un atomo di zinco centrale coordinato a due cisteine e a due istidine (Figura I.7).
Fig. I.7. Struttura del dominio di zinco “finger”
Gli zinco “finger” interagendo con il DNA formano un’elica destrorsa avvolgendo esternamente la doppia elica (Figura I.8).
Fig. I.8. Interazioni di una proteina “zinc finger” con frammenti di DNA
28
Lo zinco “finger” che riconosce particolari siti del DNA ha numerose potenziali applicazioni in medicina, prima tra tutte la generazione di fattori di trascrizione biomimetici per controllare l’espressione del DNA e per inibire alcuni geni specifici. 28
Inoltre, l’interesse per lo Zn(II) e gli studi in vitro ed in vivo hanno permesso di capire un altro particolare aspetto di questo metallo. Infatti, recentemente è emerso che lo Zn(II) ha un ruolo fondamentale nei
processi di cancerogenesi ed in particolare è un importante regolatore dell’ apoptosi cellulare. 31
Per capire il ruolo dello zinco nello sviluppo e progressione del cancro dobbiamo soffermare la nostra attenzione sul processo che caratterizza la trasformazione di una normale cellula in una
cellula tumorale (Figura I.9).
Fig. I.9. Trasformazione genetica/metabolica di cellule tumorali
Infatti, da come possiamo vedere in figura I.9, in assenza di una trasformazione metabolica, la cellula neoplastica potrebbe rimanere in una condizione di stabilità oppure potrebbe essere eliminata; se invece, la trasformazione metabolica si verifica, la cellula va incontro alla manifestazione tumorale. Questo importante processo di trasformazione patologica, da studi effettuati recentemente, interessa anche lo zinco ed in
29
particolare è la variazione di concentrazione di quest’ ultimo a livello cellulare che assume una certa importanza in tale processo. L’ accumulo
di zinco nelle cellule dipende dai trasportatori dello zinco: 32 gli “Zip-transporter”, che sono presenti sulle membrane plasmatiche e
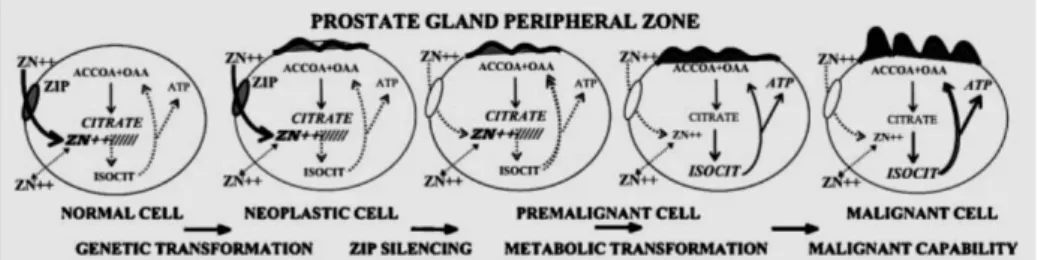
trasportano lo zinco dall’ ambiente extracellulare a quello intracellulare e gli “ZnT-transporter”, che sequestrano lo zinco dagli organelli citoplasmatici. Quindi, l’espressione e la disponibilità degli zinco trasportatori ed in particolare degli “Zip-transporter” costituisce un fattore critico della trasformazione genetica e metabolica che è essenziale per il processo tumorale nella maggior parte, se non in tutti, i tumori come mostrato in figura I.10 per le cellule prostatiche.
Fig. I.10. Il ruolo di Zip-1 e dello zinco nella trasformazione genetica/metabolica delle normali cellule prostatiche a cellule tumorali
Infatti, le normali cellule epiteliali secretorie sono cellule altamente specializzate che sintetizzano, accumulano e secernono alti livelli di citrato nel fluido prostatico e ciò avviene grazie alla capacità che queste cellule hanno di accumulare alti livelli di Zn(II) cellulare e mitocondriale. Nei mitocondri lo Zn(II) inibisce l’attività enzimatica dell’m-aconitasi prevenendo così l’ossidazione del citrato attraverso il ciclo di Krebs. Di conseguenza il ciclo di Krebs si arresta al primo step ossidativo ed il citrato risulta essere un prodotto finale del metabolismo intermedio nelle
30
cellule prostatiche. La produzione del citrato come prodotto finale ha delle implicazioni bioenergetiche: l’ossidazione del glucosio, fermata al citrato, porta alla formazione di 14 molecole di ATP mentre dalla sua completa ossidazione se ne ottengono 38 per ogni molecola di glucosio. Nelle cellule tumorali prostatiche viene a mancare la capacità di accumulare Zn(II) che quindi non esplica la funzione inibitoria rispetto all’attività dell’m-aconitasi: il citrato è dunque completamente ossidato attraverso il ciclo di Krebs. Il meccanismo responsabile della capacità di accumulare Zn(II) è la down-regulation di Zip-1, che è il maggiore trasportatore responsabile dell’ uptake dello zinco. 33
In questo modo, le cellule tumorali della prostata evitano gli effetti soppressori dello zinco, compreso l’effetto apoptogenetico ed è per questa ragione che si può definire lo Zip-1 e quindi lo zinco un agente soppressore nel cancro alla prostata.
Ulteriori studi hanno rivelato effetti diretti dello zinco sul meccanismo apoptogenico come mostrato in figura I.11:
Fig. I.11. Induzione del processo apoptotico nelle cellule prostatiche da parte dello zinco
31
Infatti, si è avuta conferma che l’effetto apoptotico nelle cellule della prostata è dovuto all’ apoptogenesi mitocondriale indotta dallo zinco. Più significativamente, questa azione è dovuta all’effetto dello zinco citoplasmatico sui mitocondri, in particolare quest’ultimo ha la capacità di aumentare l’inserzione di Bax (proteina pro-apoptotica) citosolico a livello della membrana mitocondriale, facilitare la formazione del poro a livello del mitocondrio, con successiva attivazione della caspasi-3 che da
luogo alla cascata apoptotica. 34,35 Conseguentemente, l’induzione dell’apoptosi, da parte dello zinco, è soppressa nelle normali cellule in situ grazie alla presenza di attività antiapoptotiche. Le normali cellule
epiteliali prostatiche, infatti, presentano una up-regulation della proteina antiapoptotica Bcl-2 che ha il ruolo di prevenire gli effetti apoptogeni dello zinco. L’effetto apoptotico individuato nelle cellule prostatiche è un importante risultato che bisogna approfondire e studiare maggiormente per cercare di capire meglio il ruolo ed i meccanismi che lo zinco esplica anche in altre forme tumorali. Nello stesso tempo, si può affermare che la presenza dello zinco in queste cellule ha una notevole importanza dandoci la possibilità di poter individuare nuovi approcci per il trattamento e la possibile prevenzione del cancro alla prostata.
I.4 Complessi di zinco biologicamente attivi
La fondamentale importanza dello Zn(II) nel corpo umano ha fatto sì che nascesse e si espandesse la sintesi di nuovi complessi basati su tale centro metallico così da ottenere nuovi composti con migliori proprietà
34 P. Feng, T.-L. Li, Z.-X. Guan, R. B. Franklin, L. C. Costello, Prostate, 2002, 52, 311. 35 P. Feng, T. Li, Z. Guan, R. B. Franklin, L.C. Costello, Mol. Cancer, 2008, 7, 1.
32
biologiche e nello stesso tempo minore tossicità rispetto a complessi di metalli differenti. 36
Possiamo constatare come, nella passata decade, ci sia stato un maggiore interesse nell’applicazione di complessi di Zn(II) nell’ambito della chimica biologica, specificatamente come potenti biosensori e nello stesso tempo come potenziali ed emergenti farmaci per il diabete mellito, i tumori e l’ HIV.
Un campo notevolmente in crescita è lo sviluppo di biosensori: i complessi di Zn(II) hanno ottime caratteristiche da questo punto di vista, sono in grado di indagare selettivamente macromolecole biologiche e fornire informazioni su parametri quali la concentrazione o la conformazione del target. Un esempio è rappresentato dai complessi fluorescenti di Zn(II), come Zn(II)-dipicolilammideantracene (DPA) e Zn(II)2-bisdipicolilammideantracene (BDPA), che sono capaci di legare
selettivamente, in condizioni fisiologiche, fosfopeptidi polianionici rispetto a peptidi non fosforilati. 37
N Zn N N N Zn N N 4NO3- N Zn N N 2 NO3 Zn(II)-DPA Zn(II)-BDPA
Altri studi hanno dimostrato che i complessi di Zn(II) possono essere usati per inibire targets biologici in una serie di meccanismi non classici:
36J. A. Drewry, P. T. Gunning, Coord. Chem. Rev., 2011, 255, 459.
33
sono infatti in grado di denaturare la struttura proteica stabilizzando un ripiegamento non-funzionale. Lo Zn(II)-cyclen ad esempio agisce sulla proteina RAS, una proteina oncogenica attiva nel 30% di tutti i tumori umani. La proteina RAS legata ad una guanosina trifosfato esiste in due conformazioni: una delle conformazioni lega proteine e svolge il suo ruolo nello sviluppo della malattia (stato on), mentre l’altra conformazione non lega le proteine e quindi non dà origine alla patologia
(stato off), quindi lo Zn(II)-cyclen è in grado di stabilizzare la forma off.38
Lo zinco, tra le sue notevoli proprietà biologiche, ha mostrato di esibire attività insulinomimetica e quindi avere effetto antidiabetico, infatti è stata largamente studiata la correlazione tra la deficienza di Zn(II) e il diabete mellito. Tali studi hanno dimostrato che lo zinco esplica un ruolo importante nel diabete mellito e quindi la ricerca si è spinta verso la sintesi di complessi metallici basati sullo ione Zn(II) con promettenti proprietà antidiabetiche. Sono stati sintetizzati due complessi omolettici di zinco contenenti due leganti: la N-metil-tioallixina nello [Zn(tanm)2],o
N-ditiocarbammato-pirrolidina nel [Zn(pdc)2]. 39
38 M. Spoerner, T. Graf, B. Koning, H. R. Kalbitzer, Biochem. Biophys. Res. Commun.,
2005, 334, 709.
34
Tali complessi sono stati testati in vivo su topi ammalati di diabete mellito ed hanno dimostrato, dopo somministrazione orale, un’alta attività ipoglicemica che sembra essere dovuta alla loro capacità di bloccare l’attivazione del fattore trascrizionale NF-kB nel pancreas.
Molto interesse ha destato, come detto in precedenza, la sintesi di complessi con attività antitumorale. E’ stata presa in considerazione la streptonigrina, antibiotico con struttura amminochinolinica, che presenta importanti effetti su diversi tipi di tumore umano.
Alcuni metalli di transizione, tra cui lo ione zinco, sono stati coordinati alla streptonigrina, e sembrano essere coinvolti nella frammentazione del DNA attraverso o complessazione diretta con il farmaco o formazione di radicali ossidrilici vicino al DNA, anche se, il ruolo esatto del metallo, nel meccanismo d’azione, non è del tutto chiaro. 40
Diversi studi su complessi modello, che hanno in comune con la streptonigrina alcuni siti di coordinazione, hanno messo in evidenza che la struttura e la stabilità sono solvente-dipendenti. 41
E’ stato, inoltre, utilizzato un legante analogo alla streptonigrina,
40 X. Wei, L.-J. Ming, Dalton Trans., 1998, 2793.
41 G. V. Long, M. M. Harding, M. C. L. Xie, I. E. Buys, T. W. Hambley, Dalton Trans.,
35
Analogo della Streptonigrina
il quale è stato complessato con lo zinco. E’ stata ottenuta la struttura allo stato solido (Figura I.12) che fornisce utili informazioni sul sito di legame del metallo e che può essere usata come base per studiare complessi metallici della streptonigrina.
Fig. I.12. Struttura del complesso di Zn(II) contenente l’ analogo della streptonigrina
Possiamo, anche, affermare che una delle caratteristiche principali delle cellule cancerogene è l’anormale divisione cellulare dovuta ad una iperattivazione del CDKs o per via di mutazioni e delezioni degli inibitori naturali CDK. Per questo motivo, parecchi inibitori farmacologici di CDKs sono stati sviluppati e valutati come nuova generazione di chemioterapici antitumorali, incluse le 2,6,9-purine trisostituite (che hanno come nucleo base l’adenina), quali l’olomucina, la bohemina ed la R-roscovitina, quest’ ultima è stata approvata come farmaco antitumorale nella fase II dei trias clinici.
36
Olomicina R-Roscovitina Bohemina
Sono stati effettuati diversi studi che riportano l’interazione tra la base purinica adenina e lo ione Zn(II) ed a partire da ciò che sono stati sintetizzati i primi complessi di zinco con bohemina ed olomucina.
[Zn(BohH+)Cl3] H2O
Questi complessi mostrano attività citotossica, sulle linee cellulari tumorali quali G-361, HOS, K-562e MCF7, addirittura maggiore rispetto a quella dei rispettivi leganti. 42
Comunque, pochi sono gli esempi di complessi di Zn(II) con attività antitumorale ed, oltre a quelli già menzionati, possiamo prenderne in considerazione pochi altri, che sono, per la maggior parte, rappresentati da derivati omolettici di formula generale [Zn(L2)] in cui al metallo si
trovano coordinati due unità dello stesso legante, L, che è costituito da
37
tiosemicarbazoni, 43 quercitina, 44 acilpirazoloni, 45 benzimidazoli, 46 e terpiridine 47.
I tiosemicarbazoni (TSC) sono molecole versatili non solo per le loro ben note attività farmacologiche (attività antibatterica, antivirale e antitumorale), ma anche perché possono agire come leganti con differenti modi di coordinazione. I TSC hanno mostrato di legare una grande varietà di composti mostrando differenti attività. 48 Il meccanismo d’ azione dei TSC è dovuto alla loro abilità di inibire la biosintesi del DNA, di legarsi agli atomi di azoto delle basi del DNA e del RNA e di creare delle
lesioni a livello dei filamenti del DNA grazie a rotture ossidative. 49 Inoltre, la loro attività antitumorale è esaltata dalla
coordinazione con metalli di transizione ed in particolar modo con lo zinco. Sono stati, recentemente, sintetizzati due nuovi complessi di Zn(II) con
2-acetilpiridinaN(4)-(4-fluorofenile)-piperazina tiosemicarbazone (HAcPipPhF), che presentano una configurazione ottaedrica distorta [Zn(HAcPipPhF)2] (A) ed
una configurazione piramidale quadrata distorta [Zn(OAc)(HAcPipPheF)]2 (B), come si può vedere in figura I.13.
43
T. P. Stanojkovic, D. Kovala-Demertzi, A. Primikyri, I. Garca-Santos, A. Castineiras, Z. Juranic, M. A. Demertzis, J. Inorg. Biochem., 2010, 104, 467.
44 J. Tan, B. Wang, L. Zhu, Bioorg. Med. Chem., 2009, 17, 614. 45
F. Caruso, C. Pettinari, F. Marchetti, M. Rossi, C. Opazo, S. Kumar, S. Balwani, B. Ghosh, Bioorg. Med. Chem., 2009, 17, 6166.
46 O. Sanchez-Guadarrama, H. Lopez-Sandoval, F. Sanchez-Bartez, I. Gracia-Mora, H.
Hopfl, N. Barba-Behrens, J. Inorg. Biochem., 2009, 103, 1204.
47
O. Jiang, J. Zhu, Y. Zhang, N. Xiao, Z. Guo, Biometals, 2009, 22, 297.
48 J. S. Casas, M. S. Garcia-Tasende, J. Sordo, Coord. Chem. Rev., 2000, 209, 197. 49 R. A. Finch, M.-C. Liu, S. P. Grill, W. C. Rose, R. Loomis, K. M. Vasquez, Y.-C.
38
a
b
Fig. I.13. Strutture dei complessi [Zn(HAcPipPheF)2] (a)
e [Zn(OAc)(HAcPipPheF)]2 (b)
Studi biomedici rivelano che, sia il legante che i complessi
ottenuti, mostrano una potente attività antitumorale. Infatti l’ attività antiproliferativa è stata trovata essere considerevolmente
migliore rispetto al cis-Pt: il valore di IC50 per i complessi va da
26 a 90 nM nei confonri delle linee cellulari testate (HeLa, K562, MDA-MB-361 e MDA-MB-453), mentre abbiamo un valore di IC50 per il cis-Pt che va da 2 a 17 µM. Il complesso B mostra la
più alta attività nei confronti di tutte le linee cellulari tesatate ed inoltre, entrambe i complessi, inibiscono la proliferazione per arresto del ciclo cellulare nella fase S. 44
39
La quercitina (3,5,7,3’,4’-pentaidrossiflavone), è un bioflavonoide distribuito in frutta e vegetali, che presenta vari effetti biologici e
mostra principalmente attività antitumorale ed antiossidante. 50 La quercitina è in grado di chelare ioni metallici e quindi formare
complessi che hanno un’ attività antitumorale ed antiossidante migliore rispetto alla quercitina stessa. 51 E’ stato sintetizzato il seguente complesso di Zn(II) della quercitina [Zn(Que)2(H2O)2],
che presenta significativa attività citotossica nei confronti delle tre linee cellulari (HepG2, SMMC7721 e A549) testate in vitro.
[Zn(Que)2(H2O)2]
Inoltre ha la capacità di legare il DNA, intercalandosi tra le basi dello stesso e competendo con il forte intercalatore etidinio bromuro. Infatti ha un valore di Ksq (costante di quenching di
Stern-Volmer) pari a 1.24, valore che suggerisce un’ interazione forte del complesso con il DNA; in aggiunta a ciò, studi di “molecular modeling” hanno permesso di constatare che il complesso potrebbe essere legato al DNA specificatamente nella
50 H.-B. Shao, L.-Y. Chu, Z.-H. Lu, C.-M. Kang, Int. J. Biol. Sci., 2008, 4, 8. 51 J. Zhou, L. Wang, J. Wang, N. Tang, Trans. Met. Chem., 2001, 26, 57.
40
regione GC. Questi risultati ottenuti, infatti, confermano che l’ attività del compesso di Zn(II) della quercitina potrebbe essere
correlata alla sua intercalazione a livello del DNA. 45
Recenti lavori hanno mostrato che il β-dichetone naturale curcumina, gioca un ruolo molto importante nell’ inibire ICAM-1 (molecola di adesione intercellulare 1), che ha un ruolo fondamentale nei processi infiammatori. 52 Questa attività della curcumina ha destato l’attenzione di ricercatori che hanno studiato
l’attività inibitoria nei confonti di ICAM-1 di altri composti β-dichetonici, per esempio i 4-acil-5-pirazoloni.
4-acil-5-pirazoloni
I 4-acil-5-pirazoloni sono adatti per vari cationi metallici ed alcuni studi hanno permesso di affermare che i loro complessi mostrano una marcata attività citotossica. 53
I 4-acil-5-pirazoloni sono una classe di asimettrici β-dichetoni che differiscono dalla curcumina per la mancanza di sostituenti idrossi e metossi aromatici, infatti, la loro attività biologica sembrerebbe essere dovuta solo al gruppo dichetonico e ciò ci permette di avere informazioni indirette sul meccanismo d’azione della curcumina.
52 Y. S. Kim, Y. Ahn, M. H. Hong, S. Y. Joo, K. H. Kim, H. W. Park, Y. J. Hong, J. H.
Kim, W. Kim, M. H. Jeong, J. G. Cho, J. C. Park, J. C. Kang, Cardiovasc Phrmacol.,
2007, 50, 41.
53 C. Pettinari, F. Caruso, N. Zaffaroni, R. Villa, F. Marchetti, R. Pettinari, C. Phillips, J.
41
In questo lavoro, si è investigata l’inibizione di ICAM-1 da parte dei β-dichetoni e dei relativi complessi di sodio e dei complessi
omolettici di zinco e calcio e si è potuto constatare che i β-dichetoni sono sistematicamente più attivi dei complessi
metallici e la migliore inibizione ottenuta è pari al 75%. I migliori inibitori sono il 4-benzoil-3-metil-1-fenil-pirazolo-5-one (HQPh) per i leganti ed il sodio benzoilacetonato per i derivati metallici, risultati in linea con le riportate attività antitumorali delle relative specie. Dato che i 4-acil-5-pirazoloni possiedono quattro forme tautomeriche (Figura I.14), le rispettive forme tautomeriche di HQPh sono state studiate usando la teoria del funzionale della densità.
Fig. I.14. Forme tautomeriche dei 4-acil-5-pirazoloni. I) N-H dicheto; 2) Cheto-enolica (pirazolone); 3) Cheto-enolica (acil); 4) C-H dicheto
In aggiunta, sono stati effettuati studi di docking per tutti i tautomeri del legante HQPh sulla proteina ICAM-1 suggerendo che la forma cheto-enolica (II) è quella più favorita di agire in ambiente biologico. 46
I benzimidazoli sono stati usati come agenti antivirali ed antitumorali 54,55 ed i loro composti di metalli di transizione
54 J. R. Hwu, R. Singha, S. C. Hong, Y. H. Cang, A. R. Das, I. Vliegen, E. De Clercq, J.