POLITECNICO DI MILANO
Scuola di Ingegneria Industriale e dell'Informazione
Corso di Laurea Magistrale in Ingegneria Biomedica
BANCO PROVA PER LA SIMULAZIONE
DELLA CIRCOLAZIONE PEDIATRICA
PATOLOGICA, MODIFICATA SECONDO
GLENN
Relatore: Prof. Maria Laura Costantino
Correlatore: Dott. Ing. Francesco De Gaetano
Tesi di laurea di:
Alessandro Avis
842014
Stefania Lacché
842074
Indice dei contenuti
Sommario ... I Summary ... XI
1 Fisiopatologia del sistema cardio-circolatorio ... 1
Sistema circolatorio ... 2
1.1.1 Il cuore ... 2
1.1.2 I vasi sanguigni ... 7
1.1.3 Il sangue ... 10
Malattie cardiache congenite ... 16
2 Dispositivi di supporto meccanico alla circolazione cardiaca ... 33
Classificazione dei dispositivi di assistenza ventricolare ... 34
Dispositivi di assistenza ventricolare ad uso pediatrico ... 38
3 Stato dell’arte dei simulatori del sistema circolatorio ... 47
Stato dell’arte dei modelli a parametri concentrati ... 48
Stato dell’arte dei banchi prova ... 57
4 Progettazione del banco prova attraverso un modello a parametri concentrati ... 64
Scelta del modello ... 65
Calcolo BSA ... 67
Calcolo dei parametri del circuito ... 68
Simulazione dei modello in Simulink ... 78
5 Realizzazione del banco prova ... 88
Strumentazione utilizzata ... 89
Resistenza idraulica ... 93
5.2.1 Stato dell’arte delle resistenze idrauliche ... 93
5.2.3 Progettazione dell’alloggiamento per gli elementi resistivi ... 112
Compliance ... 117
5.3.1 Stato dell’arte delle compliance ... 117
5.3.2 Dimensionamento e progettazione degli elementi complianti ... 122
5.3.3 Caratterizzazione casse d’aria ... 125
Inertanza ... 130
Sistema di attuazione ... 131
5.5.1 Sistema di controllo ... 132
5.5.2 Verifica di funzionamento ... 139
Assemblaggio circuito ... 142
6 Analisi e discussione dei risultati ... 148
Pressione di comando ... 149
Portata in mandata al VAD (Swanson e Clark) ... 151
Pressione aortica ... 153
Confronto delle portate tra distretti superiori e vena polmonare ... 155
7 Conclusioni e sviluppi futuri ... 160
Bibliografia ... 165
APPENDICE A ... 171
I
Sommario
IntroduzioneQuesto lavoro di tesi si inserisce nell'ambito della ricerca sui difetti cardiaci a ventricolo unico e si pone come obiettivo la realizzazione di un banco prova atto a simulare il sistema cardiocircolatorio pediatrico, a seguito dell’intervento di Glenn, per pazienti di 2, 4 e 5 anni. I difetti cosiddetti a ventricolo unico fanno parte delle malattie congenite cardiache in cui il cuore si presenta alla nascita come sottosviluppato e incompleto. Ciò è dovuto all’ipoplasia dei suoi tessuti, che può essere del cuore destro, più raramente, o del cuore sinistro, più comunemente. In questo lavoro di tesi viene trattata quella sinistra.
A causa della mancanza del ventricolo sinistro, il sangue, di ritorno dalla vena polmonare, deve attraversare un difetto inter-atriale (forame ovale) ed essere spinto dal ventricolo destro fuori dal cuore attraverso il dotto di Botallo. Il solo ventricolo destro si prende così carico di entrambe le circolazioni, e grazie alla pervietà del suddetto dotto, il sangue è in grado arrivare sia ai polmoni che agli altri gli organi.
Al momento della nascita il dotto di Botallo e il forame ovale si chiudono spontaneamente ed è quindi necessario intervenire chirurgicamente per garantire il completo circolo del sangue. Ad oggi vi sono due tipi di trattamento possibili: il trapianto di cuore che si presenta come “gold standard” o una serie di interventi palliativi che precedono il trapianto. La procedura palliativa, nota anche come procedura di Norwood, può essere suddivisa in tre stadi chirurgici:
- intervento di Norwood, nei primi giorni di vita;
- intervento di Glenn, tra il quinto e il sesto mese di vita; - intervento di Fontan tra il quarto e il quinto anno di vita.
Negli ultimi anni sono in corso diversi studi atti a migliorare le condizioni del paziente in seguito all’intervento di Glenn per evitare il terzo intervento prima del trapianto. L’effetto di tale operazione è quello di convogliare il sangue venoso, proveniente dai distretti superiori del corpo, nel circolo polmonare che è collegato all’atrio comune tramite vena polmonare. La vena cava inferiore, invece, viene lasciata in posizione fisiologica, quindi parte del sangue non ossigenato è ancora in grado di entrare nel circolo sistemico e ciò causa una leggera cianosi del paziente.
II Il banco prova realizzato in questo progetto di tesi è in grado di simulare correttamente le pressioni e le portate nei diversi distretti del circuito. Nella configurazione realizzata si ricorre all’utilizzo di un dispositivo di assistenza ventricolare pulsatile (VAD) per simulare la funzione dell’unico ventricolo.
Materiali e metodi
Il processo di realizzazione del banco prova è stato diviso in due parti: una di progettazione e una di realizzazione dei componenti. Durante la prima parte del lavoro è stato implementato un modello computazionale a parametri concentrati. Successivamente, utilizzando i valori degli elementi presenti nel modello, sono stati progettati, dimensionati e realizzati tutti i componenti da inserire nel circuito.
Implementazione di un modello a parametri concentrati
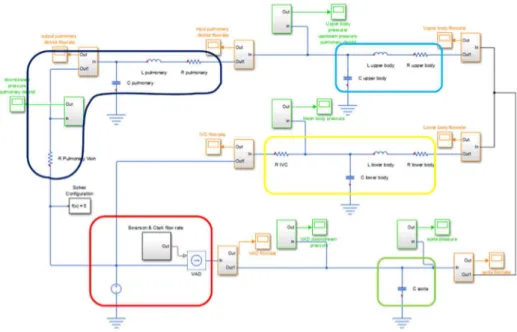
Per la progettazione del banco prova si è ricorso all’utilizzo di un modello a parametri concentrati. La rappresentazione elettrica è indicata per il sistema cardiocircolatorio, in quanto è semplice da realizzare e presenta analogie con i sistemi idraulici. Il modello scelto è stato implementato utilizzando la libreria Electrical della Foundation library di Simscape presente in Simulink, un toolbox di Matlab®, che permette la simulazione di circuiti elettrici. I risultati di tale simulazione forniscono i valori di pressione e portata nei diversi punti del circuito.
Il modello utilizzato è rappresentato in Figura I.1 e può essere diviso in tre distretti distinti che simulano rispettivamente distretti superiori, distretti inferiori e distretto polmonare. Ogni distretto è stato rappresentato attraverso un modello Windkessel a 3 o 4 elementi.
III
Figura I.1 Equivalente elettrico del sistema cardiocircolatorio in seguito all'operazione di Glenn.
I valori di tutti gli elementi sono stati ottenuti rielaborando il modello a parametri concentrati utilizzato da Baretta et al [1]. Il modello in questione presenta un numero superiore di elementi rispetto a quello adottato ed è associato ad una superficie corporea (BSA) pari a 0.66 m2. Per prima cosa è stato necessario associare questo modello alle BSA di interesse
(0.56, 0.67 e 0.74 m2) attraverso l’uso di equazioni allometriche e, in secondo luogo è stato
necessario ridurlo attraverso un metodo semplificativo. La validità di questo metodo è stata infine provata confrontando la funzione di trasferimento del circuito adottato con quella associata al circuito di partenza. È stata inoltre effettuata una simulazione in Simulink, per ottenere i valori di portata e pressione in tutti i distretti, impostando una portata di 1.2 l/min e una frequenza cardiaca pari a 100 bpm. La curva di portata impostata come sorgente per il ventricolo è quella proposta da Swanson e Clark.
Progettazione e realizzazione del banco prova
Una volta costruito il modello a parametri concentrati, da esso sono stati estrapolati i valori di resistenze, compliance e inertanze necessari a progettare gli elementi del banco prova. Quest’ultimo infatti mantiene la struttura e il numero di componenti proprio del modello realizzato in silico.
I primi pezzi ad essere realizzati sono stati gli elementi resistivi. Per la loro realizzazione si è scelto di utilizzare un sistema bicomponente formato da un cilindro cavo di materiale poroso e da una barra piena con diametro pari a quello della cavità interna del cilindro. La resistenza offerta dal campione poroso, nell’alloggiamento appropriato, varia al variare della posizione della barra al suo interno. Si ottiene infatti la resistenza massima inserendo
IV la barra per tutta la lunghezza del provino, e la resistenza minima occludendo il mezzo solo per un centimetro.
Al fine di ottenere campioni con porosità controllata, essi sono stati realizzati tramite l’utilizzo della stampante 3D (Prusa i3, RepRap),. Il gcode di ogni stampa è stato realizzato con il software Cura (ver. 2.6.2, Ultimaker).
La porosità di ogni campione è stata ottenuta impostando nel software di comando diverse percentuali di riempimento (Infill Density) e diverse trame di riempimento (Infill Pattern). Sono stati stampati 8 mezzi porosi con caratteristiche differenti.
Ognuno di essi è stato caratterizzato sia con barra inserita per tutta la sua lunghezza sia con barra inserita per un solo centimetro, per conoscere l’intervallo di resistenza che lo stesso poteva offrire. Dalle prove è stata inoltre ricavata la resistività propria di ogni campione. Con questo dato è stato possibile calcolare la lunghezza che ogni elemento resistivo del circuito avrebbe dovuto avere, se stampato con le stesse caratteristiche del campione esaminato. Sono state scelte le porosità che permettevano di ottenere elementi resistivi tra i 3 e i 9 cm di lunghezza, quindi si è proceduto con la stampa. Grazie alla loro capacità di regolazione, ognuno di questi elementi è in grado di simulare il valore di resistenza offerto nel distretto in cui è stato posto, per tutte tre le BSA di interesse.
Dopo aver realizzato gli elementi resistivi è stato necessario progettare un alloggiamento che garantisse il movimento assiale della barra e allo stesso tempo avesse una struttura lineare per evitare eccessive perdite di carico.
La soluzione tecnica scelta è mostrata in Figura I.2.
Figura I.2 Rappresentazione CAD dell'elemento resistente con soluzione traslante. Connettore da ½“(1); Tubo interno (2); Mezzo poroso (3); Tubo esterno (4);barra (5); Vite (6).
V Come rappresentato in Figura I.2 la barra è retta da una vite vincolata ad un tubo esterno tramite due fori diametralmente opposti. L’inserimento della barra all’interno del mezzo poroso è ottenuto traslando il tubo esterno su quello interno, il che è permesso dalla presenza di due scanalature su quest’ultimo. La tenuta idraulica è stata garantita dal posizionamento di due o ring alle estremità delle scanalature del tubo interno e dalla presenza di due guarnizioni poste all’altezza in cui la barra trasversale fuoriesce dal tubo esterno.
Per la costruzione del banco prova, oltre agli elementi resistivi sono stati progettati elementi complianti in grado di rappresentare la variazione di volume subita dai condotti al variare delle pressioni interne. Per la loro realizzazione si è scelto di utilizzare casse d’aria chiuse in quanto facilmente regolabili e semplici da utilizzare.
I volumi di aria e acqua da inserire nelle casse sono stati ottenuti utilizzando le equazioni che regolano i gas perfetti, assumendo per ipotesi che l’aria si comporti come tale e subisca due diverse trasformazioni: quella isoterma e quella adiabatica.
Per poter dimensionare le casse d’aria, sono stati considerati i valori di compliance dei distretti, provenienti dal modello a parametri concentrati.
Dopo aver valutato i volumi necessari ad ottenere questi valori, tali casse sono state costruite per i distretti associati alla BSA da 0.56 m2. Ad esse è stato possibile collegare i volumi
aggiuntivi necessari ad aumentare la loro capacità e ad ottenere i volumi necessari per simulare le compliance associate alle BSA di 0.67 e 0.74 m2.
Nel modello a parametri concentrati gli ultimi elementi rappresentati sono le inertanze. Per riprodurle nel banco, non sono stati progettati elementi appositi ma è stata appositamente scelta la dimensione dei tubi di collegamento del circuito.
Essi infatti, incorporano, l’inerzia del fluido nell’attraversarli.
Sistema di attuazione e sistema di controllo.
Come accennato nell’introduzione, per rappresentare la funzione del ventricolo unico, nel banco prova, è stato utilizzato un dispositivo di assistenza ventricolare.
Non disponendo di nessuna delle stazioni apposite per il suo funzionamento, è stato creato un circuito pneumatico comandato da scheda Arduino, progettato e assemblato ad hoc.
VI
Figura I.3 Rappresentazione della linea pneumatica per il controllo del ventricolo. (1) Linea dell’aria compressa. (2) Filtro regolatore. (3) Valvola ad azionamento meccanico. (4) Regolatore di pressione. (5) Elettrovalvola a 2 vie. (6) Eiettore di vuoto. (7)
Elettrovalvola a 3 vie. (8) Sistema di controllo. (9) ventricolo.
Come si vede dalla Figura I.3 il circuito comprende due elettrovalvole necessarie per intervallare la fase di diastole con quella di sistole. Per il loro funzionamento è stato necessario progettare il sistema di controllo. È stato utilizzato Arduino (ARDUINO MEGA 2560, Arduino LLC, Ivrea), un controllore facilmente disponibile in commercio, programmabile e con costi contenuti.
Il codice implementato permette all’utente l’inserimento della frequenza cardiaca e della percentuale di durata della sistole rispetto alla durata totale di un singolo battito. Questi valori regolano l’apertura delle valvole.
Assemblaggio del circuito
Il banco prova assemblato è rappresentato in Figura I.4. Il ventricolo, aspirando da un atrio comune, pompa verso la compliance aortica, a valle della quale si ha la diramazione tra distretto superiore e inferiore. I distretti inferiori, come nel modello in Simulink vengono rappresentati con una resistenza e una compliance, seguite dalla resistenza della vena cava inferiore. I distretti superiori, invece, sono formati da un elemento resistivo e da una compliance e precedono il distretto polmonare. Quest’ultimo è composto da due elementi resistivi che permettono di simulare un paziente in fase post operatoria precoce o tardiva. A
VII seconda della condizione che si vuole simulare, si esclude uno dei due rami dal circuito tramite l’uso di clamp. Il circuito prosegue con la compliance polmonare, la resistenza della vena polmonare e, infine, converge in un atrio comune simulato tramite l’utilizzo di due casse aperte.
Durante le prove per rappresentare la resistenza aortica e ritrovare le pressioni corrette è stato utilizzato uno stringi vena, posto a valle della compliance aortica.
Figura I.4 Banco prova configurato per pazienti pediatrici con BSA di 0.56 m2. (1) Ventricolo da 25 ml (EXCOR VAD, Berlin
Heart GmbH, Berlin), dispositivo usato per simulare il singolo ventricolo; (2) Compliance aortica; (3) Resistenza distretti inferiori; (4) Compliance distretti inferiori; (5) Resistenza IVC; (6) Resistenza distretti superiori; (7) Compliance distretti superiori; (8)
Resistenza polmonare regolabile; (9) Resistenza polmonare fissa; (10) Compliance polmonare; (11) Resistenza della vena polmonare; (12) Prima cassa dell’atrio comune; (13) Seconda cassa dell’atrio comune.
VIII
Analisi e discussione dei risultati
Una volta assemblato il circuito sono stati effettuati i test nelle tre diverse configurazioni di progetto (BSA pari a 0.56, 0.67e 0.74 m2).
Al fine di permettere il confronto tra le acquisizioni ottenute sperimentalmente e i risultati delle simulazioni effettuate in Simulink, è stata imposta una frequenza cardiaca pari a 100 bpm e una portata media di 1.2 l/min. Inoltre è stata regolata la pressione di comando tramite i regolatori presenti sulla linea pneumatica. Attraverso l’utilizzo di trasduttori di pressione è stata rilevato il segnale pressorio a valle di ogni distretto, mentre, utilizzando un flussimetro con apposite sonde, è stata misurata la portata a monte di ogni resistenza.
In Figura I.5 è mostrato l’andamento della pressione di comando per il circuito associato alla BSA di 0.56 m2.
Figura I.5 Andamento della pressione di comando e andamento della portata in uscita dal VAD, usato per simulare il singolo ventricolo, per BSA di 0.56 m2.
I valori della pressione della linea d’aria variano a seconda della BSA che si sta simulando. È da notare che, per garantire una portata di 1.2 l/min con una frequenza di 100 bpm, lo stroke volume nominale è di 12 ml e il ventricolo utilizzato, avendo capacità pari a 25 ml, non deve riempirsi e svuotarsi completamente. Per questo motivo la pressione misurata lato aria della membrana mostra un andamento anomalo.
Per quanto riguarda il confronto tra risultati sperimentali e computazionali, in Figura I.6 e Figura I.7 vengono riportati i grafici relativi alla portata di mandata per la BSA di 0.56 m2.
-40 -20 0 20 40 60 80 100 120 140 160 180 200 -1 0 1 2 3 4 5 0 0,5 1 1,5 2 P re ss io n e [ m m H g ] P o rt a ta [ l/ m in ] Tempo [s]
Portata e Pressione in uscita dal VAD
BSA 0.56 m
2Portata Pressione
IX
Figura I.6 Confronto tra la portata misurata sperimentalmente in uscita dal VAD, usato per simulare il singolo ventricolo, e quella ottenuta dal modello Simulink. Valori sperimentali per BSA di 0.56 m2: = 1.35 l/min, Q
max = 4.49 l/min.
Si evince che la curva sperimentale segue lo stesso andamento proposto dalla Swanson e Clark, benché il picco massimo risulti minore di quello teorico. Questo andamento si ripete per tutte e tre le BSA.
Figura I.7 Confronto tra la pressione nel distretto aortico misurata sperimentalmente e ottenuta dal modello Simulink per BSA 0.56 m2. I valori di pressione media, massima e minima per il banco prova sono: = 55.88 mmHg, P
max = 74.04 mmHg, Pmin = 38.25 mmHg. I valori di pressione media, massima e minima per il modello Simulink sono: = 56.77
mmHg, Pmax = 71.95 mmHg, Pmin = 40.33 mmHg.
Come per le portate anche i segnali relativi alla pressione arteriosa sperimentale e computazionale sono confrontabili, sia come andamento che come valori. Ciò si ripete anche
-1 0 1 2 3 4 5 6 7 8 0 0,5 1 1,5 2 2,5 3 3,5 4 P o rt a ta [ l/ m in ] Tempo [s]
Confronto portate in uscita dal VAD - BSA 0.56 m2
Sperimentale Simulink 0 10 20 30 40 50 60 70 80 0 0,5 1 1,5 2 2,5 3 3,5 4 P re ss io n e [ m m H g ] Tempo [s]
Confronto pressione aortica - BSA 0.56 m2
Simulink Sperimentale
X per le curve di pressione e portata ottenute dalle misurazioni nei distretti superiori, inferiori e polmonare.
Come ultima analisi è stato confrontato l’andamento delle pressioni e delle portate rilevate nei singoli distretti del circuito. Confrontando la portata registrata a monte della resistenza della vena polmonare, essa risulta smorzata rispetto a quella acquisita nel distretto polmonare e a monte dei distretti superiori. Questo andamento si ripete anche per le pressioni e si riscontra nei tracciati rilevati in tutti e tre i circuiti. L’utilizzo di due casse a pelo libero per simulare l’unico atrio permette quindi di evitare che le oscillazioni dovute alla pulsatilità del VAD usato per rappresentare il cuore, influenzino i tracciati di portata e pressione rilevati nella vena polmonare e nella vena cava inferiore.
Conclusioni e sviluppi futuri
Il banco prova realizzato risulta versatile in quanto permette di simulare i circuiti associati a tre diverse BSA (0.56, 0.67 e 0.74 m2) regolando la resistenza offerta dagli elementi resistivi
e variando, tramite l’utilizzo di volumi aggiuntivi, il valore di compliance offerto dalle casse. Tra i possibili sviluppi futuri si può pensare di utilizzare il banco prova per valutare le condizioni di un paziente dopo l’intevento di Glenn sia in condizioni stabili che in seguito allo sviluppo di determinate patologie. La possibilità di regolare singolarmente ogni parametro permette infatti di simulare disfunzioni come l’insufficienza sistolica, l’insufficienza diastolica, l’ipertensione polmonare e di analizzare le pressioni e le portate a cavallo dei distretti del circuito.
Mediante l’utilizzo di questo strumento è inoltre possibile indagare come variano i parametri di interesse (pressioni e portate) nel caso di circolazione assistita. È possibile analizzare il comportamento del dispositivo a seconda della frequenza imposta, della portata, e del tipo di incannulazione effettuata (atriale o ventricolare).
Infine, poiché i collegamenti tra tubi ed elementi avvengono attraverso connettori, è possibile collegare il tubo posto a valle della resistenza della vena cava inferiore a monte del distretto polmonare, ottenendo così il circuito corrispondente all’operazione di Fontan. Tale configurazione risulta utile per confrontare, per una stessa BSA o per una stessa patologia, l’andamento di pressione e portate a seguito dei due diversi interventi.
XI
Summary
BackgroundThe work done in this thesis is relative to the research on congenital heart defects, focusing on single ventricle defects. The objective of this thesis was to design and develop a hydraulic test bench, capable of simulating the pediatric cardio circulatory system in 2, 4 and 5-year-old patients that had undergone the Glenn palliative surgery.
Single ventricle defects represent a rare disorder in which the newborn baby has an incomplete or under developed heart. This is mainly due to hypoplasia of the tissue and can affect both the left and the right side of the heart, even though the latter is a much rarer condition. Therefore, the focus of this work is to study patients with a left hypoplastic ventricle.
The absence of the left ventricle means that the right one must guarantee both the systemic and pulmonary circulation. Before birth an inter-atrial defect named foramen ovale and the ductus Botalli allow blood to flow, but because at birth these two passages spontaneously close, surgery is required.
At present there are two ways of treating patients with this condition: heart transplant that still represents the “gold standard” or a series of palliative procedures as a bridge to transplant. The first option is a three-stage surgery also called Norwood procedure, that can be divided as the follows:
- stage 1 or Norwood procedure, is carried out within the first days after birth;
- stage 2 or Glenn procedure, is carried out between the fith and sixth month after birth; - stage 3 or Fontan procedure, is carried out between between the fourth and fith year
after birth.
Recently, research has focused on improving the patient’s conditions after stage 2 surgery to avoid the Fontan procedure before transplant. The objective of the stage 2 procedure is to redirect the blood coming from the upper body directly to pulmonary circulation, with the pulmonary vein still attached to single atrium. The lower body, instead, still sends its venous blood through the inferior vena cava and in to the atrium.
XII
Materials and methods
The first part of this work consisted in developing a computational lumped parameter model (LPM), while the second in constructing the physical model. Dimensions and design were decided based on the parameters found in the LPM.
Implementation of the lumped parameter model
Electrical modeling is an appropriate tool for modeling hydraulic systems because of the analogies it shares with it and because of its simplicity. The LPM was developed in Simulink (Matlab, Mathworks) using the electrical library in Simscape. From this model, the data of interest were the pressure and flow curves measured in key points.
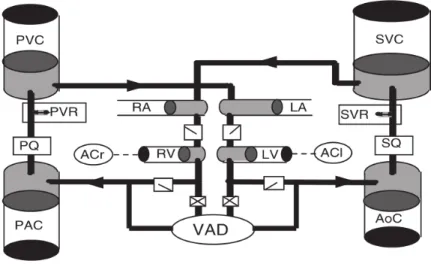
The scheme that was used is shown in Picture I.1 and can be divided in three main districts that simulate the upper body, the lower body and the pulmonary district respectively. Each district was implemented with a 3 or 4 Windkessel element.
Picture I.1 Electrical equivalent of the cardiocirculatory system after Glenn surgery.
The values of each element in the circuit were obtained by reducing the model of Baretta et al [1]. Apart from simulating a single patient with a BSA of 0.66 m2, their model is more
complex, with a greater amount of detail and number of elements.
Using allometric equations and starting from the model described above, it was possible to find the equivalent model for the patients of interest (BSA of 0.56, 0.67 and 0.74 m2). Once
XIII shown in the picture above. The method used was proven to be suitable by comparing the transfer functions of the starting model with the reduced equivalent.
With the resulting LPMs, it was possible to simulate in Simulink the desired conditions of the circulatory system with the single ventricle beating at 100 bpm, generating an average blood flow of 1.2 l/min.
Design and development of the test bench
The value of the resistances, capacitances and inductances found with the LPM, were used to design the elements of the mock loop. The latter, in fact, maintains the same number of elements in it.
Starting from the resistances, the chosen element consisted in a two component system. A cylindrical rod with the same internal diameter of a hollow porous cylinder. This element, in the proper housing, can offer a variable resistance based on the length of the rod that is in it. If the rod is completely inserted the resistance is maximum, while when the rod is inserted for only one cm, the resistance is minimum. This allows the test bench to simulate the circulation of the patients with different BSA.
The hollow cylinders were obtained with a 3D printer (Prusa i3, RepRap), available in the laboratory, using Cura (Ultimaker, ver 2.6.2) as the slicer software. By setting different infill densities and different infill patterns it was possible to obtain 8 samples with different porosity.
Each one of these elements was tested with the rod both inserted completely and inserted just one cm. The values that were obtained gave us the range of resistances that each element was able of offering. Another parameter that was measured is the resistivity, that allowed us to dimension the definitive cylinders for the test bench.
The housing of the porous element was designed to guarantee axial movement of the rod in the hollow cylinder, at the same time minimizing little pressure drops and maintaining a linear shape. The solution designed is shown in Picture I.2.
XIV
Picture I.2 CAD drawing of the resistance element. ½“ connector (1); Internal tube (2); Porous element (3); External tube (4); Main rod (5); Support rod (6).
The main rod is held in place by a support rod that is fixed, through two diametrically opposite holes, to the external tube. The main rod can shift through the hollow porous cylinder by moving the external tube. This is also possible because two diametrically opposite grooves were cut in the internal tube to allow the support rod to shift along. The complete element was set up to be watertight with two O-rings put at opposite sides of the grooves and two pieces of rubber on the external side of the support rod.
Compliant elements were designed to simulate the elastic properties of the circulatory system. These elements were created by using closed air chambers (Windkessel chambers), since the solution allows for regulation and they occupy reduced amounts of space.
To define the amount of air that had to be left in the chamber, assuming that the air within behaved like a perfect gas, their related equations were used. It is also assumed that two different polytrophic processes occur during use: isothermic and adiabatic.
Starting from the values obtained with the LPM, the chambers to be inserted in the circuit were designed to simulate compliance values for patients with BSA of 0.56 m2. When
needed additional volumes (chambers) were connected to them, thus allowing to simulate patients with BSA of 0.67 and 0.74 m2 as well.
Inertance elements, instead, are represented with connection tubing cut to the appropriate length, thus allowing to simulate the fluid’s inertia.
Actuation and control system
As previously pointed out, the function of the heart has been achieved by using a ventricular assist device (VAD) in place of the single ventricle.
This device needs a control system capable of regulating the air pressure in its chamber, therefor controlling the stroke volume and output flow.
XV In this project, a preexisting pneumatic circuit was used and a control system, managed by Arduino, was designed and assembled (Picture I.3).
Picture I.3 Pneumatic air line to control the ventricle. (1) compressed air line; (2) regulator filter; (3) Mechanical valve; (4) Pressure regulator; (5) 2-way solenoid valve; (6) vacuum generator; (7) 3-way solenoid valve; (8) control system; (9)
Ventricle.
As shown in Picture I.3, the circuit contains two solenoid valves that alternate systole and diastole in the device that replicates the heart. The control system was designed with at the heart an Arduino controller (ARDUINO MEGA 2560, Arduino LLC, Ivrea), because of its ease of use and low price. The code that was implemented prompts the user to insert the cardiac frequency and the relative systole duration. All is done through a display and numeric keyboard fixed. The inputs given directly regulate the opening and closure of the solenoid valves.
Circuit assembly
The test bench was assembled by connecting all the components with ½ “ tubes, as shown in Picture I.4
XVI
Picture I.4 Mock loop of the pediatric cardiovascular circulation after Glenn surgery in patients with BSA of 0.56 m2. (1) Simulated ventricle (25 ml EXCOR VAD, Berlin heart Gmbh, Berlin); (2) Aortic compliance; (3) Lower body resistance; (4) Lower body compliance; (5) IVC resistance; (6) Upper body resistance; (7) Upper body resistance; (8) Adjustable pulmonary resistance; (9) Fixed pulmonary resistance; (10) Pulmonary compliance; (11) Pulmonary vein resistance;
(12) First atriber; (13) Second atrium chamber.
Result analysis and discussion
With the circuit completely assembled, a different simulation was done for each BSA of interest (0.56, 0.67 and 0.74 m2). Every simulation was executed with a heart rate of 100
bpm and with an average flow rate of 1.2 l/min, thus using the same parameters used in Simulink. The pressure of each district was measured at the exit of every district, using pressure sensors, while the flow rate was measured at the start of each district, using a flowmeter sensor.
XVII Picture I.5 shows the command pressure trend and the output flow rate from the ventricle.
Picture I.5 Command pressure and flow rate at the exit of the ventricle for a BSA of 0.56 m2.
Command pressure in air line vary for each BSA that is simulated. It must be pointed out that the ventricle used for this project had a stroke volume of 25 ml, therefore to give the correct output flow rate, it wasn’t used at its optimal conditions. This caused the anomalies in the trend of the command pressure.
Picture I.6 and Picture I.7 show the comparison between the experimental and computational data of the output flow rate from the ventricle for BSA of 0.56 m2.
-40 -20 0 20 40 60 80 100 120 140 160 180 200 -1 0 1 2 3 4 5 0 0,5 1 1,5 2 P re ss io n e [ m m H g ] F lo w r a te [ l/ m in ] Time [s]
Comand pressure and flow rate at the exit of
the ventricle - BSA 0.56 m
2Flow rate Pressure
XVIII
Picture I.6 Comparison between the output flow rate of the ventricle measured on the test bench and the LPM in Simulink. Experimental values for a BSA of 0.56 m2: = 1.35 l/min, Q
max = 4.49 l/min.
As can be seen from the graph, the experimental curve is similar to the computational one proposed by Swanson and Clark, even though the maximum value measured on the test bench is higher.
Picture I.7 Comparison between the aortic pressure measured on the test bench and the LPM in Simulink for a BSA of 0.56 m2. Maximum, minimum and medium pressure for the test bench: = 55.88 mmHg, P
max = 74.04 mmHg, Pmin = 38.25 mmHg. Maximum, minimum and medium pressure for the LPM: = 56.77 mmHg, Pmax = 71.95 mmHg, Pmin =
40.33 mmHg. -1 0 1 2 3 4 5 6 7 8 0 0,5 1 1,5 2 2,5 3 3,5 4 F lo w r a te [ l/ m in ] Time [s]
Comparison between output flows - BSA 0.56 m
2Experimental Simulink 0 10 20 30 40 50 60 70 80 0 0,5 1 1,5 2 2,5 3 3,5 4 F lo w r a te [ m m H g ] Time [s]
Comparison between aortic pressures - BSA 0.56
m
2Simulink Experimental
XIX As for the flow rate, even the pressure curves are similar, both as general trend and values. This is also valid for the upper, lower and pulmonary districts.
The last analysis that was done, was to verify that pressure and flow rate curves had a dampened trend as the signal measuring got closer to the atrium. This was obtained by using a dual chamber atrium, that allowed to dampen the input oscillations to ventricle. Pressure and flow rate readings were taken on both the entrance tubes to the first atrium chamber.
Conclusions and future outcomes
In the present work, a test bench to mock the circulatory system of pediatric patients with hypoplastic left heart syndrome after the Glenn procedure, was designed and constructed. The design phase started with the development of the LPM, that assumed the important role of giving the necessary values to design the physical elements of the circuit. Furthermore, simulations with the LPM gave the pressure and flow rate curves that were used to analyze the experimental data. A comparison between the computational and experimental data was done to verify the precision of the test bench.
Both the pressure and flow rate curves follow the trend of the computational ones and have comparable mean values. The test bench is therefore a versatile tool, that allows to simulate three different types of patients (BSA of 0.56, 0.67 and 0.74 m2) by adjusting the resistances
and connecting additional volumes to the compliant chambers. All of which can be done without dismantling the existing circuit. The control system also allows for great flexibility, giving the user the opportunity of setting the desired heart rate and relative systole duration. As a future outcome, this test bench can be used to evaluate the conditions of a patient, both in the early phases after the Glenn surgery and in the late phases. This can be done by blocking one of the two branches of the pulmonary resistances.
Since every element can be regulated to simulate different conditions, this mock loop could be used to study the effects of certain cardiac pathologies, such as systolic insufficiency, diastolic insufficiency and pulmonary hypertension. Another possible use could be to use the circuit to study the effects of assisted circulation by using a second VAD to aid the single ventricle. Analyzing pressure and flow rate curves, the mock loop could also be used to study the effect of different types of incannulation.
As a final possible outcome, the tool developed in this thesis could be used to study the effect of the Glenn and Fontan procedure on patients with different BSA. This can be easily
XX achieved by reconnecting the proximal tube of the after the IVC before the pulmonary distric, thus obtaining the Fontan circuit.
1
1
Fisiopatologia del sistema cardio-circolatorio
La progettazione e la costruzione di un banco prova, adibito allo studio della circolazione patologica pediatrica, presuppone la conoscenza del sistema cardio-circolatorio. In questo capitolo viene illustrata la fisiologia di questo sistema, soffermandosi sulla costituzione e sulle proprietà dei vasi sanguigni che dovranno essere replicate nel banco prova. Vengono inoltre illustrate le patologie cardiache, in particolare, quelle che rendono necessario l’utilizzo di dispositivi di assistenza ventricolare. Si focalizza quindi l’attenzione sulle patologie congenite e vengono presentate le tecniche chirurgiche al momento utilizzate per sopperire alla mancanza di una corretta circolazione. Il banco prova infatti, dovrà replicare la circolazione ottenuta dopo l’intervento di Glenn che rappresenta il secondo passo dell’iter seguito per ripristinare una corretta circolazione, in caso il paziente presenti uno dei cosiddetti difetti a “ventricolo unico”. In queste malformazioni, infatti, uno dei due ventricoli risulta poco sviluppato e l’altro, da solo, provvede ad entrambe le circolazioni sistemica e polmonare.
2
Sistema circolatorio
Il sistema circolatorio è formato dal cuore, dai vasi sanguigni e dal sangue e può essere assimilato ad un circuito idraulico chiuso in cui una pompa (il cuore) imprime su di un fluido (il sangue) la forza necessaria per permettere il suo movimento all’interno dei condotti (i vasi).
Le funzioni principali di questo sistema sono:
• la distribuzione di sostanze nutritive e di ossigeno a tutte le cellule dell’organismo;
• la rimozione dei prodotti di scarto provenienti dal metabolismo cellulare, che vengono convogliati agli organi deputati alla loro eliminazione;
• la termoregolazione dell’organismo;
• la protezione del sistema attraverso l’emostasi che consiste nella capacità delle piastrine di creare dei coaguli, che impediscono emorragie in caso di danneggiamento di vasi;
• la difesa immunitaria che viene attuata dai globuli bianchi e dagli anticorpi in grado di captare ed eliminare le sostanze nocive per l’intero organismo;
• il controllo omeostatico ossia la contribuzione del sistema circolatorio al mantenimento dell’equilibrio dei parametri interni all’organismo.
Nei successivi paragrafi vengono riportate le caratteristiche principali degli elementi costituenti il sistema circolatorio.
1.1.1 Il cuore
Il cuore è un organo muscolare cavo posto al centro della cavità toracica avvolto in una sottile sacca membranosa chiamata pericardio. La cavità pericardica è composta da due foglietti: l’epicardio che aderisce al cuore e il pericardio propriamente detto, che, circondando l’epicardio, forma una cavità virtuale in cui il cuore può muoversi liberamente durante la contrazione cardiaca.
Le sue dimensioni sono pari a quelle di un pugno chiuso e il suo peso varia tra i 250-300 grammi nella donna e tra i 300-350 grammi nell’uomo [2].
Il cuore è strutturato in quattro camere cardiache, due atri e due ventricoli e può essere suddiviso in due parti: cuore destro e cuore sinistro. Tra di esse non persiste alcuna
3 comunicazione per la presenza del setto interatriale e interventricolare. Nell’atrio destro tuttavia si nota una cicatrice corrispondente alla chiusura del foro ovale di Botallo che durante la vita intrauterina consente la comunicazione tra le due metà.
Tra ogni atrio e ogni ventricolo è presente una valvola detta di aspirazione o atrioventricolare che, durante la diastole risulta aperta per permettere il riempimento ventricolare mentre, in fase di sistole, è chiusa per evitare che il sangue torni nell’atrio invece di andare in circolo. Esistono poi altre due valvole poste tra i ventricoli e le grandi arterie (aorta e arteria polmonare) chiamate valvole di mandata o semilunari. Queste, in fase di diastole sono chiuse per evitare il reflusso di sangue nel cuore mentre, durante la sistole si aprono per permettere l’eiezione del sangue verso il circolo sistemico.
Tutte le valvole si aprono e si chiudono passivamente secondo gradiente pressorio, assicurando in questo modo il flusso unidirezionale del sangue (Figura 1.1).
Figura 1.1 Anatomia del cuore.
Il cuore è in grado di contrarsi spontaneamente e ritmicamente grazie alla presenza di particolari cellule all’interno dei tessuti che lo compongono, dette cellule pacemaker. Le cellule Pacemaker sono in grado di stimolare la contrazione del cuore perché riescono ad eccitarsi autonomamente senza essere innervate. Esse dunque controllano la frequenza cardiaca producendo dai 60 ai 100 segnali al minuto.
I tessuti che compongono il cuore sono:
• il tessuto nodale in cui risiedono le cellule pacemaker capaci di autoeccitarsi;
• il tessuto di conduzione che trasmette gli impulsi nati nel tessuto nodale al tessuto contrattile;
4
• il tessuto contrattile che risponde con effetti meccanici agli stimoli che riceve. In Figura 1.2 è rappresentato il percorso seguito dall’onda di depolarizzazione.
Figura 1.2 Percorso seguito dall'onda di depolarizzazione nel cuore.
Lo stimolo elettrico nasce a livello del nodo senoatriale e tramite le vie internodali raggiunge rapidamente il nodo atrioventricolare. A questo punto la depolarizzazione si propaga più lentamente verso gli atri. La conduzione si sposta, poi, verso l’apice cardiaco attraverso il sistema di conduzione ventricolare. Infine lo stimolo viene propagato dall’apice verso la base del cuore.
Il ciclo cardiaco rappresenta la risposta meccanica associata alla propagazione dello stimolo elettrico; esso viene rappresentato in Figura 1.3.
5
Figura 1.3 Rappresentazione del ciclo cardiaco. 1.Fase tardiva della diastole: atri e ventricoli sono rilassati, il 70 % del riempimento ventricolare avviene per gravità; 2. Sistole atriale: la contrazione degli atri spinge la restante quantità di sangue nei ventricoli; 3. Contrazione ventricolare isovolumica: la prima fase della contrazione ventricolare determina la
chiusura delle valvole atrioventricolari ma non crea una pressione sufficiente ad aprire le valvole semilunari. 4.Eiezione ventricolare: la pressione ventricolare aumenta progressivamente e, una volta superata quella delle arterie, permette alle valvole semilunari di aprirsi e al sangue di fuoriuscire dal cuore. 5.Rilasciamento ventricolare isovolumico: quando i ventricoli si rilasciano la pressione al loro interno diminuisce, il sangue refluisce verso i lembi delle valvole semilunari
e ne determina la chiusura.
Il ciclo cardiaco può anche essere rappresentato attraverso un diagramma pressione-volume (PV-loop) come riportato in Figura 1.4.
6
Figura 1.4 Diagramma pressione-volume per un ciclo cardiaco.
L’area compresa nel PV-loop rappresenta il lavoro compiuto dal cuore durante il ciclo ed è calcolabile tramite la relazione:
= ∗ 1.
Si può stimare un lavoro del cuore a riposo di circa 0.8 W.
Per studiare la funzionalità del cuore è necessario prendere in considerazione alcune variabili tra cui il volume sistolico VS (stroke volume) e la gittata cardiaca GC (cardiac output). Il volume sistolico rappresenta la quantità di sangue pompata da ciascun ventricolo ad ogni sistole mentre, la gittata cardiaca corrisponde alla quantità di sangue eiettata al minuto. Questi due parametri sono direttamente proporzionali tra di loro, a meno di una costante che corrisponde alla frequenza cardiaca (f).
= ∗ 2.
La gittata cardiaca in un adulto è circa 5 l/min, ma può aumentare in alcune situazioni come per esempio durante l’esercizio fisico. Questo parametro risulta fondamentale per lo studio della funzione cardiaca in quanto il cuore può essere assimilato ad una pompa e il suo compito principale è quello di assicurare un adeguato flusso di sangue al fine di irrorare tutti gli organi.
7 La variazione della gittata cardiaca è governata da meccanismi intrinseci ed estrinseci. Durante l’esercizio fisico, per esempio, si chiudono le arteriole di alcuni distretti, mentre si dilatano quelle del distretto cardiaco e del muscolo scheletrico interessato. Esistono due meccanismi intrinseci in grado di consentire al miocardio l’adattamento a questa variazione di richiesta di ossigeno: il meccanismo di Frank-Starling e la modulazione della contrattilità indotta dalla frequenza.
La legge di Frank Starling afferma che la tensione attiva sviluppata nel passaggio dalla fase di rilasciamento a quella di contrazione dipende dalla lunghezza iniziale delle fibre del miocardio. È possibile, dunque, osservare come ad un aumento del riempimento diastolico corrisponda un maggior stiramento delle fibre miocardiche e quindi una contrazione più efficace, che si traduce in una maggior quantità di sangue pompata nelle arterie. Si può quindi affermare che, entro i limiti fisiologici, il cuore pompa tutto il sangue che gli perviene evitando un suo eccessivo ristagno nelle vene.
Per quanto riguarda i meccanismi estrinseci in grado di modulare il valore della gittata cardiaca bisogna considerare che il cuore è riccamente innervato da fibre simpatiche e parasimpatiche, in grado di controllare la frequenza e la sua
forza di contrazione.
Infine, oltre all’azione del sistema nervoso anche il controllo ormonale può variare i parametri associati alla funzionalità cardiaca.
1.1.2 I vasi sanguigni
I vasi sanguigni formano un sistema chiuso di tubi e la loro funzione principale è quella di convogliare il sangue verso tutti i tessuti del corpo per distribuire le sostanze nutritive e raccogliere i cataboliti [3].
La parete vascolare è costituita da un tessuto dalla struttura particolarmente complessa e diversificata da zona a zona in relazione alla specifica funzione richiesta. In termini generali la parete di ogni segmento vascolare è costituita da tre strati concentrici che dall’interno verso l’esterno sono la tonaca intima, la media e l’avventizia (Figura 1.5).
8
Figura 1.5 Struttura interna dei vasi sanguigni.
L’intima è costituita da un singolo strato di cellule endoteliali che sono direttamente in contatto con il sangue che scorre nel vaso. Fra l’intima e la media è interposta la lamina elastica interna costituita da lamine di elastina.
La media costituisce generalmente lo strato più spesso della parete ed ha strutture differenti nelle diverse parti del sistema vascolare.
La tonaca avventizia, infine, è separata dalla tonaca media da una ulteriore lamina elastica, che può avere lo stesso spessore della media ed è composta prevalentemente da fasci di fibre di collagene non compatti in direzione longitudinale.
La tonaca avventizia è inoltre attraversata da fibre nervose e vasi linfatici. Nel caso di vasi di grandi dimensioni la tonaca avventizia è perfusa da un sistema di piccoli vasi detti “vasa vasorum”, deputati al trasporto di O2 e sostanze nutrienti ai tessuti della parete del vaso. I vasa vasorum sono presenti quando le dimensioni del vaso sono tali che la distanza tra le cellule della parete e il sangue che scorre all’interno del vaso risulti superiore a circa 25 μm. I vasi sanguigni si dividono in arterie, vene e capillari, diversi per composizione e dimensione come mostrato in Figura 1.6.
9
Figura 1.6 Rappresentazione schematica delle caratteristiche di ciascun tipo di vaso.
Le arterie sono preposte alla distribuzione del sangue nei tessuti periferici. In base alle loro dimensioni si possono distinguere tre principali tipi di arterie. Le grandi arterie elastiche (avente diametro maggiore di 7-8 mm) sono essenzialmente l’aorta e i suoi rami principali e sono caratterizzate da una parete molto spessa. Nella tonaca media sono presenti quasi esclusivamente lamine elastiche. In virtù della propria elasticità, queste arterie svolgono l’azione di secondo cuore: durante la sistole cardiaca sequestrano, dilatandosi per effetto della pressione arteriosa, parte del sangue eiettato dal ventricolo e lo restituiscono in fase di diastole quando tornano al loro calibro iniziale. In questo modo smorzano la natura pulsatile del flusso sanguigno generato dalla pompa ventricolare. Il risultato netto dal punto di vista energetico è l’abbassamento delle resistenze all’efflusso sistolico in quanto le arterie accolgono parte rilevante (30-40 %) della gittata cardiaca e quindi il sistema vascolare a valle è soggetto a un flusso continuo, situazione che comporta nella media del ciclo cardiaco perdite di carico minori rispetto ad una situazione pulsatile.
Le arterie muscolari distribuiscono il sangue ai vari organi. Esse svolgono un’importante funzione di vasoregolazione attiva, mentre hanno un’estensibilità passiva modesta se confrontata con quella delle grandi arterie. Queste arterie hanno in proporzione la tonaca media più spessa rispetto alle arterie di grande calibro, ed essa è costituita prevalentemente da cellule muscolari lisce. Le cellule muscolari lisce hanno il compito di ridurre il lume del
10 vaso e quindi aumentare la resistenza al flusso nel caso si renda necessaria una minore perfusione del distretto servito dall’arteria.
Le piccole arterie o arteriole hanno un calibro che varia tra i 20 e i 100 μm. La tonaca media è formata da uno o due strati di muscolo liscio con poche fibre elastiche. Il muscolo liscio è organizzato a spirale intorno ad uno strato interno di cellule endoteliali.
A differenza delle arterie le vene sono i vasi che conducono il sangue dalle reti capillari dei diversi organi al cuore, hanno forma cilindrica, parete relativamente sottile e lume ampio. Il loro calibro è sempre maggiore di quello delle arterie nel medesimo distretto ma la loro struttura è simile nonostante lo spessore della parete sia minore e la tonaca media contenga molta meno elastina. Le vene accolgono il 65% del sangue totale che scorre nel nostro corpo e, a differenza delle arterie, possono facilmente collassare per effetto di un’elevata pressione esterna.
Per evitare il reflusso del sangue questi vasi presentano al loro interno delle valvole che garantiscono l’unidirezionalità del fluido, dette “valvole a nido di rondine”.
Le vene possono avere decorso superficiale o profondo; le prime sono disposte nel sottocutaneo, non corrono in contiguità delle arterie corrispondenti e sono più sviluppate a livello degli arti e del collo; le seconde si accompagnano ad arterie e decorrono negli spazi intermuscolari e nei visceri.
Si distinguono in funzione delle dimensioni tre tipi di vene: vene di piccolo medio e grosso calibro.
Infine i capillari sono i vasi più piccoli della circolazione, hanno un calibro compreso tra 5 e 20 μm e una lunghezza media di 1 mm. Essi costituiscono il sito di scambio di gas e nutrienti tra i tessuti e il sangue. Sono costituiti da endotelio e lamina basale. In alcuni casi è sufficiente una sola cellula endoteliale per rivestire l’intera circonferenza della loro parete. Non sono presenti negli epiteli di rivestimento, nella cornea, nel cristallino e nelle cartilagini. I capillari formano reti tridimensionali dette letti capillari che hanno origine da una arteriola e terminano in una venula.
1.1.3 Il sangue
Il sangue è un tessuto connettivo fluido che, scorrendo nei vasi sanguigni, svolge la funzione di trasporto. In esso si evidenzia una parte liquida, il plasma (55%) e una componente corpuscolata formata da globuli rossi, globuli bianchi e piastrine.
11 Il plasma è costituito prevalentemente da acqua (90%), sali minerali e proteine a basso peso molecolare.
Per quanto riguarda la parte corpuscolata i globuli rossi, detti anche eritrociti, sono le cellule anucleate più numerose del sangue. Essi vengono prodotti nel midollo osseo e hanno la forma di un disco biconcavo, con diametro di 7-8 μm. Al loro interno si trova l’emoglobina (Hb), una proteina globulare specializzata nel legare molecole di ossigeno e anidride carbonica. La concentrazione fisiologica di Hb nel sangue è compresa tra 13-15 g/dl di sangue. Al di sotto di questo valore si ha la condizione di anemia, mentre al di sopra di poliglobulia.
I globuli bianchi, detti anche leucociti, sono invece cellule contenenti un nucleo, più grandi ma meno numerose dei globuli rossi. Sono anch’essi prodotti dal midollo osseo emopoietico, e la loro funzione è quella di difendere l’organismo dalla presenza di agenti patogeni quali batteri e virus.
Le piastrine, infine, svolgono un ruolo essenziale nella coagulazione del sangue. Quando un vaso sanguigno viene danneggiato esse vengono richiamate nella zona interessata e si aggregano aderendo alla parete del vaso. Liberando enzimi, tra cui la trombina che trasforma il fibrinogeno in fibrina, esse modulano la formazione di tessuto temporaneo. Aggregati di fibrina formano un coagulo, ossia matrice temporanea che funge da impalcatura per le cellule che nelle fasi successive alla risposta immunitaria porteranno alla riparazione del tessuto. La circolazione di tale tessuto può essere descritta seguendo il percorso del sangue eiettato dal ventricolo destro.
Il ventricolo destro pompa il sangue nei polmoni attraverso l’arteria polmonare, la quale si dirama in due appena dopo l’uscita dal cuore. Mentre scorre attraverso i capillari polmonari, il sangue libera CO2 e assorbe O2. Il sangue ricco di ossigeno torna al cuore mediante le vene polmonari ed entra in esso attraverso l’atrio sinistro. Dopo essere passato dall’atrio al ventricolo sinistro attraverso la valvola mitrale, il sangue scorre nell’aorta che, ramificandosi in numerose arterie, lo distribuisce tra i vari distretti corporei. Le arterie immettono il sangue nelle arteriole che a loro volta si diramano nei capillari. I capillari irrorano i tessuti liberando le sostanze nutritive e convogliano il sangue nelle venule, dalle quali esso affluisce alle vene. Il sangue venoso proveniente dalla parte superiore del corpo confluisce nella vena cava superiore, mentre la vena cava inferiore (IVC) raccoglie il sangue proveniente dalla parte inferiore del corpo. Queste due vene confluiscono nell’atrio destro. Infine, passando
12 dall’atrio al ventricolo destro attraverso la valvola tricuspide, il sangue può ricominciare il suo percorso (Figura 1.7).
Figura 1.7 Sistema cardiocircolatorio.
La rete di vasi percorsa dal sangue può essere divisa in due circolazioni: quella sistemica, detta anche grande circolazione, e quella polmonare chiamata piccola circolazione.
La circolazione sistemica comprende il tratto del circuito che inizia dal ventricolo sinistro e termina nell’atrio destro. Può essere divisa in circolazione sistemica inferiore e superiore. La prima porta le sostanze nutritive agli organi del tronco, reni, visceri, pelvi e arti inferiori. La seconda invece raggiunge gli arti superiori e la testa.
La circolazione polmonare rappresenta il tratto del sistema che parte dal ventricolo destro e termina nell’atrio sinistro. La funzione principale di questo tratto è quella di ossigenare il sangue e rimuovere C02.
In condizioni fisiologiche il volume totale di sangue è distribuito tra circolazione sistemica e polmonare in rapporto 2:1. Questo rapporto è mantenuto costante, ma se la regolazione non è operante, per esempio in caso di insufficienza cardiaca, la ripartizione può essere alterata e la quota nel circolo polmonare può aumentare.
13 È importante sottolineare come il cuore possa essere assimilato a due pompe in serie, sincrone con un’azione intermittente: durante la fase di compressione (sistole) il sangue viene spinto da ciascuna camera verso il rispettivo sistema arterioso, mentre nella fase di dilatazione (diastole) nuovo sangue viene aspirato dal letto venoso.
Ciò che spinge il sangue nel sistema circolatorio è il gradiente di pressione. Il sangue infatti si muove da regioni a pressione maggiore verso regioni a pressione inferiore. La pressione media aortica è di circa 90 mmHg, mentre quella in vena cava, in corrispondenza della sua congiunzione con il cuore è prossima a zero.
La pressione media arteriosa è proporzionale alla gittata cardiaca e varia a seconda delle resistenze periferiche (Figura 1.8).
Figura 1.8 Relazione tra pressione arteriosa, gittata e resistenza.
La legge con cui si può descrivere il moto del sangue nei vasi è la legge di Poiseuille. Essa si riferisce ad un modello semplificato dove vigono le seguenti ipotesi:
• il condotto è cilindrico, rigido, ha lunghezza l e raggio R;
• il fluido che scorre all’interno del condotto è spinto dal gradiente pressorio;
• la viscosità del fluido è costante (fluido Newtoniano);
• la velocità del fluido è nulla alle pareti del condotto, mentre raggiunge il suo massimo al centro, assumendo dunque un profilo di tipo parabolico;
• si è regime stazionario;
• il fluido scorre all’interno del condotto con flusso laminare.
Sotto queste ipotesi la legge di Poiseuille stabilisce una proporzionalità tra il gradiente pressorio ΔP e la portata Q e può essere espressa tramite la seguente formula:
14
= 8μ 3.
La portata di un fluido rappresenta il volume di liquido che attraversa la sezione del condotto nell’unità di tempo e può essere calcolata moltiplicando il valore dell’area trasversale dello stesso condotto per la velocità del fluido.
= ∙ 4.
In caso di moto stazionario la portata è costante nel tempo, mentre in presenza di moto pulsatile essa varia in modo periodico. In caso di moto stazionario si può dunque affermare che al diminuire della sezione di scorrimento la velocità del flusso aumenti.
In condizioni fisiologiche il flusso pulsatile proprio della gittata cardiaca viene trasformato in un flusso continuo che garantisce una portata costante anche in assenza di pompaggio ventricolare.
Questo fenomeno è dovuto alla distensibilità delle grandi arterie che durante la diastole, a seguito del recupero elastico, tornano nella configurazione di riposo restituendo l’energia al sangue sotto forma di pressione. L’effetto della distensibilità arteriosa è chiamato anche effetto Windkessel. Ciò, permette dunque di affermare che all’aumentare della sezione trasversale, la velocità del sangue diminuisce. Di conseguenza la velocità è minore a livello dei capillari e ciò favorisce gli scambi di nutrienti con i tessuti circostanti (Figura 1.9).
15
Figura 1.9 Andamento dell'area della sezione trasversale e della velocità del flusso sanguigno nei diversi vasi del sistema circolatorio.
Una condizione da rispettare affinché la legge di Poiseuille possa essere applicata per il sangue è la laminarità del flusso.
Sperimentalmente si osserva che, se la velocità del fluido aumenta sopra una certa soglia, la formula di Poiseuille cessa di descrivere adeguatamente il moto. Questa velocità, chiamata velocità critica rappresenta il punto di passaggio tra moto laminare e turbolento e dipende dalla viscosità del fluido (µ), dal raggio del condotto (r), dalla densità del fluido (ρ) nonché da una costante adimensionale detta numero di Reynolds (Re).
= μ 5.
Per i fluidi molto viscosi la velocità critica è piuttosto elevata: nell’aorta assume il valore di 40 cm/s.
Considerando una portata di 5 l/min si ottiene una velocità media di 26.5 cm/s, inferiore dunque alla velocità critica.
Per i rimanenti vasi il raggio è minore rispetto all’aorta e da ciò segue che la velocità critica è maggiore di 40 cm/s, quindi il moto può essere considerato laminare anche in tutto il resto del sistema. La turbolenza del flusso si verifica solo in prossimità delle valvole.
Infine per quanto riguarda l’ipotesi di fluido Newtoniano è importante sottolineare come essa sia verificata per il sangue solo nei condotti di grosso calibro.
16 Inoltre, considerando la circolazione nel suo insieme, come illustrato in Figura 1.10, si può svolgere un’ulteriore considerazione [4].
Figura 1.10 Schema del sistema circolatorio.
In un circuito idraulico chiuso, alimentato da una pompa intermittente, il flusso si mantiene a patto che il volume emesso ad ogni pulsazione sia immediatamente restituito alla pompa, caricandola così per la pulsazione successiva. Affinchè ciò avvenga, è necessario che il circuito sia colmo di liquido. Un circuito parzialmente vuoto può infatti accogliere il volume pulsatorio senza restituirlo. In conclusione, un prerequisito indispensabile per mantenere la circolazione è che il volume di sangue riempia l’albero circolatorio.
Per soddisfare questa necessità, se ne impone però una seconda. Dato che ad ogni sistole il cuore immette il suo contenuto nei vasi, è necessario che questi, pur essendo pieni, siano in grado di accogliere temporaneamente il volume pulsatorio, in attesa di restituirlo al cuore durante la dilatazione diastolica. Poiché i liquidi sono incomprimibili, l’eccesso di volume può essere accolto dal circuito idraulico solo se le pareti dei suoi condotti sono elastiche e dilatabili. Un secondo prerequisito al mantenimento del circolo è dunque la cedevolezza elastica delle pareti dei condotti.
Malattie cardiache congenite
Le principali patologie cardiache possono essere divise in tre categorie: le cardiomiopatie, le malattie infiammatorie e le malattie cardiache congenite.
Le cardiomiopatie rappresentano un gruppo eterogeneo di patologie del miocardio associate a disfunzioni meccaniche e/o elettriche che tipicamente portano a ipertrofia o dilatazione [5]. Le malattie infiammatorie che riguardano il cuore sono principalmente tre: miocardite, pericardite, endocardite [6]. La prima è anche nota come cardiomiopatia infiammatoria ed è
17 tipicamente dovuta ad infezione virale [7] o batterica. La seconda, invece, è una patologia che riguarda l’infiammazione del pericardio, ossia della sacca che circonda il cuore e ne permette una lubrificazione ottimale. Infine, la terza è una patologia infiammatoria che colpisce lo strato più interno del tessuto cardiaco detto endocardio.
Le patologie congenite, a cui viene rivolta l’attenzione in questo lavoro di tesi, colpiscono la struttura del cuore e sono presenti sin dalla nascita; esse possono interessare le pareti, le valvole o i vasi direttamente connessi all’organo [8]. Queste malattie possono essere asintomatiche, ma nel caso portino ad alterazione della normale circolazione, le conseguenze possono essere anche mortali e rendere necessari interventi chirurgici o terapie mediche. L’incidenza di tali patologie è stata valutata tra 12 e 14 casi ogni 1000 nati vivi. Per quanto riguarda le patologie congenite che richiedono trattamenti cardiologici specializzati, l’incidenza si abbassa a 2.5 - 3 ogni 1000 nati vivi come riportato nello studio di Julien I. E. Hoffman et al. [9] . Bisogna infatti tenere conto che alcuni difetti congeniti riescono a chiudersi spontaneamente come per esempio i difetti intra-ventricolari e intra-atriali.
I neonati affetti da patologie congenite mostrano un cuore non formato correttamente al momento della nascita, e possono presentare difetti semplici come fori passanti nel setto o il restringimento di una valvola che rallenta il passaggio di sangue. Esistono però anche difetti complessi che vedono la combinazione di diversi difetti come ad esempio la tetralogia di Fallot. Solitamente queste malformazioni non causano dolore al petto, ma hanno come principali sintomi l’iperventilazione, la cianosi o stanchezza [8].
Le cause di tali anomalie non sono ancora state comprese a fondo, ma si crede che esse vadano ricercate nel codice genetico. È infatti crescente l’importanza che viene data ad alterazioni geniche nel causare patologie congenite cardiache [10]. Mutamenti del DNA spontanei, come delezione o traslocazione, sono le alterazioni più comuni ritenute cause scatenanti di difetti come la tetralogia di Fallot. Inoltre, come mostrato nello studio di J.W. Roos-Hesselink [11], la trisomia del cromosoma 21, 13 o 18 sono le sindromi che più frequentemente vedono anche una concomitante malattia cardiaca congenita.
Nei paragrafi successivi verranno analizzate singolarmente le diverse patologie cardiache congenite al momento conosciute.
18
Difetti del setto
Il setto è la parete che separa il cuore sinistro dal cuore destro, ed è distinto in due sezioni: setto interatriale e setto interventricolare. Il setto ventricolare è diviso a sua volta in setto interventricolare muscolare che corrisponde alla parte inferiore più spessa, e in setto ventricolare membranoso che corrisponde alla parte superiore che appare più sottile e fibrosa (Figura 1.11).
Figura 1.11 Sezione del cuore con enfasi su ventricoli e setto ventricolare.
Il setto interatriale si forma durante il primo e il secondo mese di sviluppo fetale. La sua funzione nel neonato sarà quella di separare i due atri ed impedire che il sangue ossigenato si mescoli con quello venoso. Durante il periodo di formazione si creano due fori (difetti) fisiologici che permettono il passaggio di sangue tra gli atri. Con il crescere del feto e del setto si forma una continuazione del difetto che prende il nome di Forame ovale. Alla nascita, nel 75% dei casi, questo difetto si sigilla autonomamente, ma può rimanere pervio portando all’omonima patologia cardiaca (Forame ovale pervio) [12].
Difetto del setto interatriale
Il difetto del setto inter-atriale è un foro che rimane pervio tra i due atri, permettendo il passaggio di una parte di sangue, ricco d’ossigeno, dall’atrio sinistro all’atrio destro (Figura 1.12).
19
Figura 1.12 Flusso sanguigno in un cuore normale e in uno affetto da difetto interatriale.
In base alla dimensione del difetto possono essere effettuati differenti interventi. Nel caso di difetti di piccole dimensioni, il cuore è in grado di rigenerare sufficiente tessuto per occludere il foro altrimenti, se il difetto è di dimensioni notevoli, il paziente deve essere operato. La conseguenza principale a questa malformazione è la minor concentrazione di ossigeno nel sangue arterioso che risulta inferiore ai valori fisiologici. Il principale sintomo di questa patologia è la mancanza di fiato dopo esercizio lieve, ma in età adulta si può anche verificare ictus. Una seconda conseguenza di tale difetto è che, formandosi un atrio comune, si annulla la differenza di pressione tra i due atri.
È da notare che se le dimensioni del difetto sono ridotte non si hanno sintomi evidenti.
Difetto del setto intraventricolare
Se tra le camere ventricolari vi è un foro passante, si ha un difetto interventricolare. Il sangue ossigenato che proviene dai polmoni può quindi ritornare al ventricolo destro e di conseguenza essere rimandato verso i polmoni (Figura 1.13). Tale anomalia spesso può modificare notevolmente l’emodinamica cardiaca. Quando le sue dimensioni diventano importanti vi è una grossa quantità di sangue ossigenato che entra nel ventricolo destro. Ciò porta ad un aumento del lavoro complessivo del cuore, necessario per poter soddisfare la richiesta di nutrienti e di ossigeno da parte di tutti i distretti corporei.
20
Figura 1.13 Struttura e flusso sanguigno in cuore normale rispetto ad un cuore affetto da difetto intra-ventricolare.
Nell’80% dei casi il difetto è nella parte membranosa del setto e richiede un intervento chirurgico per la sua chiusura. Questa anomalia è la più comune tra le patologie congenite del cuore e ha un’incidenza tra i 2 e i 4 casi ogni 1000 nati vivi [9].
Canale atrioventricolare completo
Il difetto del setto atrioventricolare è caratterizzato da un difetto nel setto atriale, una sola valvola atrioventricolare comune e un difetto interventricolare (Figura 1.14). È una patologia congenita rara che riguarda circa il 3% delle malformazioni cardiache e ha un’incidenza di 2 casi su 10000 nati vivi [13]. Le conseguenze principali legate a questa anomalia sono l’aumento di pressione e di volume del ventricolo destro e l’ipertensione polmonare. L’intervento chirurgico deve essere effettuato entro i primi anni di vita in quanto l’ipertensione polmonare diventa irreversibile con il progredire del tempo.
21
Figura 1.14 Flusso sanguigno in un cuore che presenta un canale atrioventricolare.
Ostruzione del tratto di uscita ventricolare
Le patologie ostruttive del tratto di uscita ventricolare sono anomalie cardiache in cui l’uscita del ventricolo destro o sinistro è ostruita e impedisce quindi al sangue di fuoriuscire. Possono essere divise in anomalie del lato destro o sinistro. Le prime comprendono l’atresia polmonare, la stenosi della valvola polmonare, la sindrome del cuore ipoplastico destro e la tetralogia di Fallot. Le seconde comprendono la stenosi della valvola aortica, la stenosi aortica supravalvolare, la coartazione dell’aorta e la sindrome del cuore ipoplasico sinistro.
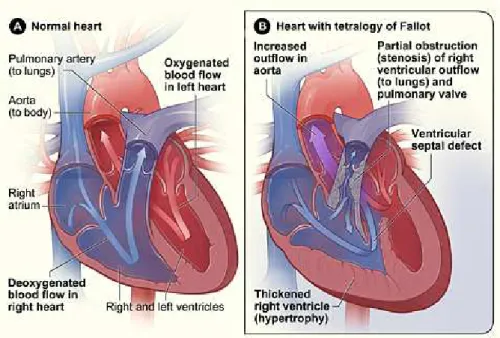
Tetralogia di Fallot
La tetralogia di Fallot è la malformazione cianotica congenita del cuore più comune, ha un’incidenza di circa 3 casi ogni 10000 nati vivi, e ammonta a circa il 7-10% di tutte le malformazioni congenite del cuore. La diagnosi è pressoché immediata, i neonati infatti presentano una diversa gradazione di cianosi a seconda del livello di ostruzione al flusso [14].
Essendo una patologia complessa necessita obbligatoriamente di un intervento chirurgico per poterne arginare le conseguenze.
Tale condizione vede l’effetto combinato di quattro difetti: stenosi della valvola polmonare; difetto inter-ventricolare esteso; posizionamento dell’aorta direttamente sopra il difetto intra-ventricolare, che causa il flusso diretto del sangue non ossigenato verso il circolo sistemico; ipertrofia del ventricolo destro, dovuta al maggior lavoro richiesto dal lato destro del cuore (Figura 1.15).