Scuola di Ingegneria
Corso di laurea magistrale in Ingegneria Biomedica
Tesi di laurea
Progettazione di una capsula
ingeribile per il trattamento delle
infezioni da Helicobacter pylori
Relatori:
Prof. Arianna Menciassi
Dr. Giuseppe Tortora
Candidato:
Prof. Franco Fusi
Federico Cubeddu
1
Indice
Introduzione ... 4
Capitolo 1: Lo stomaco: habitat dell‘Helicobacter pylori ... 8
1.1 Generalità ... 8
1.1.2 Parete dello stomaco ... 11
1.1.3 Funzione motoria dello stomaco ... 11
1.1.4 Svuotamento gastrico ... 13
1. 2 Helicobacter pylori ... 14
1.2.1 Vie di trasmissione ed epidemiologia ... 16
1.2.2 Trattamento farmacologico... 17
Capitolo 2: Principi e metodi ... 19
2.1 Fototerapia ... 19
2.1.2 Fototerapia mediata con farmaci esterni ... 23
2.1.3 Fototerapia non mediata da molecole esogene ... 24
2.2 Capsule endoscopiche ... 24
2.2.1 Capsule endoscopiche terapeutiche ... 30
2.3 Capsula terapeutica per l‘eradicazione dell‘Helicobacter pylori attraverso terapia fotodinamica ... 31
2
2.3.1 Specifiche mediche ... 32
2.3.2 Specifiche tecniche... 33
Capitolo 3: Materiali e componenti ... 36
3.1 Sorgente di luce ... 36
3.1.1 Principio di funzionamento ... 36
3.1.1.2 LED die ... 42
3.1.1.3 LED SMD (Surface Mounted Device) ... 43
3.1.2 Scelta sorgente luce ... 45
3.1.3 Test sperimentali ... 48
3.1.3.1 Verifica dello spettro di emissione dei LED ... 50
3.1.3.2 Verifica della potenza totale emessa dal LED ... 50
3.1.3.3 Verifica dell’ uniformità della luce e dell’irradianza sulla Petri ... 52
3.1.3.4 Verifica dell’efficienza battericida... 53
3.1.3.5 Test dell’efficienza battericida ... 58
3.2 Sorgente di energia ... 59
3.2.1.1 Principi di funzionamento... 59
3.2.1.1 Tipologie di batterie analizzate ... 61
3.2.1.2 Pila Zn-Aria... 61
3.2.1.2 Batterie all’ossido d’argento ... 63
3.2.1.3 Batterie agli ioni di litio ... 64
3.2.1.4 Batterie ai polimeri di litio ... 66
3.2.2 Scelta della sorgente di energia ... 67
3
3.3.1 metodi di controllo capsula/ ritardo accensione ... 70
3.4 Involucro esterno ... 70
Capitolo 4: Progettazione dei prototipi della capsula per fototerapia ... 73
4.1 Progettazione di un prototipo preliminare ... 74
4.2 Progettazione prototipo di ricerca ... 76
4.2.1 Progettazione della scheda elettronica ... 80
4.2.2 Valutazione integrazione di un microcontrollore ... 81
4.3 Progettazione del prototipo pre-industriale ... 82
Capitolo 5: Conclusioni ... 85
Appendice 1: Piani anatomici ... 88
Appendice 2: software utilizzati durante la tesi ... 89
Solidworks ... 89
Eagle ... 89
Keil µvision ... 89
Appendice 2.2 Tabella dei simboli utilizzate nella tesi ... 90
Appendice 3: Cenni di fotometria ... 91
Bibliografia ... 94
4
Introduzione
Lo scopo della presente tesi è la progettazione di una capsula per il trattamento delle infezioni da Helicobacter pylori (H.pylori). L‘idea nasce dall‘intuizione dell‘Università di Firenze di utilizzare una capsula ingeribile per effettuare la fototerapia del batterio H.pylori. Il lavoro di analisi della fattibilità, di progettazione e di realizzazione dei prototipi preliminari è stato svolto nell‘ambito di questo lavoro di tesi presso l‘Istituto di BioRobotica della Scuola Superiore Sant‘Anna di Pisa.
L‘H.pylori è un batterio gram-negativo, microaerofilo, che generalmente colonizza la parete dello stomaco spingendosi nel piloro e nel duodeno. La prevalenza dell‘infezione è circa il 50% nella popolazione mondiale con picchi di oltre il 90% nei paesi in via di sviluppo[1]. E‘ associato alla gastrite cronica e a patologie più importanti come la gastrite atrofica, l‘ulcera gastrica e duodenale, il linfoma MALT (tessuto linfoide associato alle mucose) e l‘adenocarcinoma gastrico. E‘ considerato un agente cancerogeno di 1° grado dal World Health Organization (WHO).
Attualmente la cura dell‘infezione da H.pylori viene effettuata mediante l‘impiego della terapia farmacologica eradicante, che consiste nell‘associazione di due o tre antibiotici insieme ad un farmaco inibitore della secrezione gastrica (in genere un inibitore di pompa protonica) per 10-15 giorni. Tale trattamento risulta sempre meno efficace: si osserva un‘efficacia ridotta al 60-70 %, soprattutto recentemente, a causa dell‘aumentata resistenza dei batteri agli antibiotici. Inoltre, questo trattamento presenta molti effetti collaterali quali nausea, vomito, diarrea e vertigini [2]-[3].
Emerge quindi la necessità di esplorare strategie alternative non farmacologiche per limitare questo fenomeno. Un‘alternativa promettente è rappresentata dalla terapia fotodinamica (Photo-dynamic Therapy, PDT).
La terapia fotodinamica è stata scoperta all‘inizio del ‗900 ed è applicabile sia in campo oncologico sia per il trattamento di ferite infette, infezioni batteriche (ad esempio l‘acne) e fungine, ed in campo odontologico [4-5]. La terapia
5 fotodinamica in genere prevede l‘utilizzo di un fotosensibilizzante esterno, tipicamente una porfirina, da somministrare al paziente. Dopo un adeguato periodo di tempo, necessario affinché il fotosensibilizzante si accumuli in modo selettivo nel target, quest‘ultimo (cellule tumorali, batteri, virus) viene irraggiato da luce visibile. L‘interazione della luce con il fotosensibilizzante produce varie specie reattive (ROS) che distruggono il bersaglio.
L‘H.pylori accumula in maniera naturale agenti fotosensibilizzanti endogeni come da esempio la coproporfirina III e la protoporfirina IX, sia al suo interno che nell‘ambiente immediatamente circostante. Può essere quindi trattato con luce ad un‘appropriata lunghezza d‘onda. Tale lunghezza d‘onda dipende, infatti, dalla lunghezza d‘onda principale di assorbimento del fotosensibilizzante. Il trattamento dell‘H.pylori con terapia fotodinamica è stato dimostrato in vitro su colture batteriche ed in vivo illuminando la cavità gastrica per mezzo di un gastroscopio [6-7]. L‘utilizzo di un gastroscopio ha però lo svantaggio di essere mal tollerato dal paziente, in quanto praticato mediante un esame invasivo che può provocare forte disagio. Il trattamento richiede la presenza di medici specializzati ed esiste il rischio di perforazione della parete correlato alla metodica stessa. Infine, difficilmente la terapia fotodinamica può essere ultimata in un‘unica seduta di gastroscopia.
Negli ultimi anni sono state sviluppate per l‘esplorazione del tubo digerente le capsule endoscopiche. Esse costituiscono un metodo minimamente invasivo e perciò ben tollerato dal paziente.
Le capsule endoscopiche sono state sviluppate inizialmente per la diagnosi di patologie dell‘intestino tenue, un tratto del sistema gastrointestinale non esplorabile per via endoscopica, e, in seguito, hanno preso campo in vari distretti del tratto gastrointestinale come l‘esofago, lo stomaco ed il colon, oltre ad essere state proposte anche per un uso terapeutico [8].
Il presente lavoro di tesi nasce con lo scopo di progettare una capsula ingeribile che, una volta deglutita, sia capace di illuminare le pareti dello stomaco ad un‘appropriata lunghezza d‘onda al fine di distruggere l‘H.pylori presente, grazie
6 all‘interazione fra la luce e le porfirine prodotte dal batterio. Per la sua applicazione clinica e l‘accettabilità sanitaria, la capsula deve rispettare alcuni requisiti fondamentali. Anzitutto deve avere dimensioni di circa 11-14 mm di diametro e 26-32 mm di lunghezza per essere facilmente ingeribile. Tali dimensioni corrispondono a quelle attualmente utilizzate in capsule endoscopiche commerciali.
Inoltre deve essere biocompatibile per evitare di innescare reazioni infiammatorie nei tessuti che attraversa, trasparente alla lunghezza d‘onda desiderabile, non biodegradabile, non danneggiare la parete del sistema gastrointestinale durante il transito e avere al suo interno tutti i dispositivi utili per applicare la terapia fotodinamica.
Il dispositivo è ovviamente monouso, quindi i costi di produzione devono essere ridotti e complessivamente minori dei costi diretti e indiretti della terapia farmacologica. Il sistema, nel suo complesso, deve essere sicuro, affidabile e deve assicurare l‘espulsione in ogni caso.
Per progettare la capsula è stato necessario analizzare stato dell‘arte dei LED, delle batterie e delle capsule commerciali, studiare il batterio e lo stomaco, utilizzare diversi software di CAD meccanico ed elettronico. Questo ha consentito di giungere alla realizzazione di un dispositivo meccatronico integrato, composto da una scheda elettronica che integra i LED per il trattamento fotodinamico, driver per i LED e relativa resistenza, dalla batteria e dagli interruttori per l‘accensione e lo spegnimento del dispositivo. I componenti sono integrati in un guscio polimerico che racchiude delle finestre trasparenti alla luce emessa dai LED. La tesi è suddivisa in 5 capitoli:
1. Nel primo capitolo si descrive lo stomaco inteso come habitat del batterio H.pylori, delle patologie associate alla sua infezione e delle attuali terapie eradicanti;
2. Nel secondo capitolo sono illustrati i principi e i metodi (terapia fotodinamica e capsule endoscopiche);
7 3. Nel terzo vengono affrontate la progettazione del sistema (analisi delle sorgenti di luce, batterie commerciali, interruttori), la validazione dei componenti e i risultati ottenuti;
4. Nel quarto capitolo sono illustrati i prototipi progettati e infine, nel quinto capitolo, vengono riportate le conclusioni e le prospettive future.
8
Capitolo 1. Lo stomaco: habitat dell’Helicobacter pylori
1.1 Generalità
Lo stomaco è un organo impari che si presenta come un tratto dilatato del canale alimentare, interposto tra esofago e intestino tenue. È situato nella cavità addominale, subito al di sotto del diaframma, e occupa l‘ipocondrio sinistro e una parte dell‘epigastrio (Fig. 1).
Fig. 1: Regioni addominali
Svolge importanti funzioni tra cui quella di fungere da deposito temporale del cibo, dove sosta per essere digerito grazie all‘azione dei succhi gastrici (1-2 pH). Esso ha dimensioni variabili e, di norma, è maggiore nell‘individuo maschile raggiungendo una capacità di circa 1200 ml nell‘adulto, ed è suscettibile di variazioni in base alle abitudini alimentari dell‘individuo. In condizioni di media distensione ha un diametro trasverso di 5-10 cm che decresce nelle porzioni distali (piloro e cardias) [9].
La forma dello stomaco dipende dalla tonicità delle sue pareti, quindi si ha una sostanziale differenza nella conformazione tra il vivente e il cadavere; si presenta come una sacca allungata con l‘estremo prossimale espanso a cupola e posto in alto e a sinistra del piano sagittale mediano, e l‘estremo distale (Fig.2) situato in basso e a destra.
9
Fig. 2: Regioni dello stomaco
L‘asse principale è circa verticale ma, inferiormente, s‘inflette verso destra facendosi dapprima orizzontale e successivamente ascende obliquamente in alto e indietro. L‘organo si presenta dunque complessivamente incurvato con la concavità rivolta a destra, in alto e posteriormente. E‘ lievemente appiattito sul piano sagittale1, mentre su quello frontale si possono notare due pareti (anteriore e posteriore) evidenziate da due margini, destro (o concavo) detto anche piccola curvatura e sinistro (o convesso), detto anche grande curvatura; inoltre, dispone di due orifizi, superiore (cardias o orifizio esofageo) e inferiore (piloro o orifizio duodenale).
Il cardias è segnato sulla superficie esterna dall‘incisura cardiale. Il piloro è segnato sulla superficie esterna da un solco anulare, il solco pilorico, cui corrisponde internamente la sporgenza dello sfintere pilorico. Si distinguono nello stomaco quattro porzioni principali: fondo, corpo, antro e piloro (Fig.3)
1
10
Fig. 3: Porzioni dello stomaco
Il fondo dello stomaco (o grande tuberosità) è la parte più alta dello stomaco che, a forma di cupola, si adatta alla concavità del diaframma; si considera come limite convenzionale tra fondo e corpo un piano orizzontale passante per il cardias. Il corpo dello stomaco rappresenta la porzione più estesa dell‘organo e fa seguito direttamente al fondo; ha forma cilindro-conica e si dirige in basso quasi verticalmente, restringendosi. Il limite convenzionale con la parete pilorica è segnato da una linea obliqua che dalla piega angolare raggiunge la grande curvatura. L‘antro gastrico è una porzione di forma cilindrica, che si dirige lateralmente e superiormente rispetto al corpo. È compresa tra l'incisura angolare e il solco intermedio. La sua mucosa interna è per la maggior parte liscia, ma in stato di contrazione si possono notare pieghe rilevanti al confine con il canale pilorico; si tratta di pieghe longitudinali, più simili a quelle della via gastrica breve che non a quelle della grande curvatura. La parte pilorica dello stomaco, di aspetto irregolarmente conico, è diretta obliquamente in alto e a destra e forma con il corpo un angolo di circa 90° che determina sulla piccola curvatura un‘incisura, la piega angolare.
11
1.1.2 Parete dello stomaco
La superficie interna si presenta, a riposo, di colore grigio roseo; diviene rossa e tumida durante la digestione gastrica per il maggiore afflusso di sangue.
A digiuno lo stomaco è retratto, e la superficie interna si mostra sollevata in pieghe grossolane, dette pieghe gastriche (Fig.4), dirette prevalentemente secondo l‘asse longitudinale dell‘organo e anastomizzate fra loro in modo da formare un reticolo a maglie allungate. Solo in corrispondenza della piccola curvatura si osservano pieghe longitudinali ben individualizzate, molto sporgenti, non unite da anastomosi trasversali. Queste delimitano un solco che collega direttamente l‘esofago al piloro chiamato via gastrica breve. Le pieghe gastriche, sono determinate dal sollevamento della sottomucosa e non sono formazioni permanenti, infatti, scompaiono con la dilatazione dell‘organo.
A stomaco disteso sono visibili sottili solchi della mucosa anastomizzati a rete, i solchi permanenti, che delimitano su tutto l‘ambito della superficie gastrica piccole aree rilevate di forma variabile, di diametro da 2 a 4 mm, dette areole gastriche. La superficie di tali aree presenta tanti piccoli infossamenti, le fossette gastriche, nel cui fondo si aprono le ghiandole dello stomaco. La mucosa che separa le fossette gastriche si solleva, specialmente nella parte pilorica, in sottili sporgenze laminari denominate creste gastriche.
In corrispondenza del cardias si osserva un orlo anulare dentellato che segna il limite fra mucosa esofagea e mucosa gastrica. L‘orifizio ha forma ovalare, a grande asse verticale, ed è rivolto a destra e un poco in alto. A livello del piloro la superficie interna dello stomaco si solleva a formare una piega circolare, sporgente in cavità, detta impropriamente valvola pilorica, che circoscrive l‘orifizio pilorico. Questo ha forma circolare ed è disposto su un piano quasi frontale [10].
1.1.3 Funzione motoria dello stomaco
Il sistema gastrointestinale, al fine di garantire una corretta e completa modificazione degli alimenti ingeriti, svolge diverse funzioni motorie.
12
Fig. 4: Cavità interna dello stomaco
Per quanto riguarda lo stomaco, esso si trova raramente in uno stato di distensione, infatti, poco dopo essersi completamente svuotato, comincia a essere percorso da contrazioni ritmiche, le quali, a mano a mano che il periodo di digiuno aumenta, possono diventare sempre più frequenti provocando crampi allo stomaco associati alla sensazione di fame. Con l'ingestione di cibo e l'arrivo di questo nello stomaco, le contrazioni da fame hanno termine.
Le funzioni motorie dello stomaco sono essenzialmente due:
1. Rimescolamento: garantisce che il materiale alimentare sia efficacemente mescolato con i succhi gastrici e che tutti i prodotti della digestione vengano a contatto con la superficie della mucosa assorbente.
2. Serbatoio: il corpo dello stomaco è in grado di accumulare velocemente una notevole quantità di materiale ingerito ed esercita notevoli forze meccaniche per un regolare svuotamento gastrico.
13 Tutto il sistema gastrointestinale esercita, inoltre, vari tipi di attività motorie le cui più importanti sono la peristalsi, le segmentazioni ritmiche e le contrazioni toniche.
Le contrazioni peristaltiche (proprie della muscolatura liscia dell'apparato digerente) prendono inizio nella parte mediana dello stomaco e si propagano come un'onda verso la valvola pilorica. Esse, dapprima deboli, si fanno poi sempre più frequenti e più profonde a mano a mano che si avvicinano al piloro.
I movimenti di segmentazione (o movimenti di rimescolamento) sono contrazioni ritmiche dello strato muscolare circolare con lo scopo di rimescolare e dividere il contenuto luminale;
Le contrazioni toniche sono contrazioni prolungate presenti essenzialmente nella parte prossimale dello stomaco dello sfintere esofageo e nel piloro.
Entrando più nel dettaglio della motilità gastrica, lo stomaco viene diviso in due regioni: prossimale e distale.
La regione prossimale ha funzione di serbatoio e corrisponde al fondo e al terzo prossimale del corpo gastrico mentre la distale è costituita dalla pompa antrale e corrisponde ai restanti due terzi del corpo gastrico, all‘antro e al piloro.
La diversa attività motoria è dovuta alle funzioni peculiari delle due regioni. Nello stomaco prossimale, la muscolatura mantiene un tono continuo mentre la pompa antrale presenta delle contrazioni fasiche che hanno lo scopo di spingere il contenuto gastrico nel duodeno attraverso lo sfintere pilorico.
1.1.4 Svuotamento gastrico
Lo stomaco, attraverso la sua funzione motoria, deve assicurare il passaggio nel duodeno del chimo gastrico alla velocità ottimale per una completa digestione e
14 assorbimento dei principi nutritivi. Inoltre, essendo l‘ambiente intestinale completamente diverso rispetto a quello gastrico, il controllo dello svuotamento gastrico è finalizzato a garantire che il passaggio nel duodeno avvenga ad una velocità tale che permetta all‘intestino tenue la neutralizzazione del pH, l‘equilibrio osmotico fino all‘isomolalità e la digestione enzimatica seguita dall‘assorbimento dei prodotti di digestione.
La velocità di svuotamento dipende da vari fattori, essa deve compensare, infatti, variazioni di volume, composizione e stato fisico del contenuto gastrico.
Nel caso della presenza di materiale solido e liquido nel serbatoio gastrico, lo svuotamento del materiale liquido è più rapido di quello solido.
Si osserva inoltre che sfere di plastica con diametro maggiore di 7 mm non passano nel duodeno nel corso dello svuotamento gastrico del pasto ma solo in un momento successivo [11].
1. 2 Helicobacter pylori
L‘Helicobacter pylori (H.pylori) è un batterio gram-negativo2
spiraliforme, acidofilo, microaerofilo (Fig.5), appartenente insieme ad oltre venti altre specie al genere Helicobacter; che colonizza le pareti dello stomaco e del duodeno.
L‘infezione da Helicobacter pylori è molto diffusa ed è riconosciuta come un fattore importante di morbilità e mortalità. Essa è associata fino al 95% delle ulcere duodenali e gastriche, ed allo sviluppo del carcinoma gastrico e del linfoma gastrico di tipo MALT (tessuto linfoide associato alle mucose) (Fig. 5).
L‘H.pylori è stato classificato dal World Health Organization nel 1994 come carcinogeno di tipo I [12].
L'interno dello stomaco è immerso in circa mezzo litro di succo gastrico ogni
2
Si definiscono Gram-negativi quei batteri che rimangono colorati di rosa dopo aver subito la colorazione di Gram. Si contrappongono ai batteri Gram-positivi, che invece rimangono colorati in blu - violetto all'inizio del procedimento di Gram.
15 giorno. Quest‘ultimo è composto da enzimi digestivi e acido cloridrico concentrato, che può facilmente lacerare il cibo o microrganismo più duro.
Fig. 5: Helicobacter pylori
In passato, ciò portò la comunità scientifica a pensare che lo stomaco non contenesse batteri e fosse in realtà sterile ma, con la scoperta dell‘H.pylori nel 1982 (da parte dei dott. Robin Warren e Barry Marshall, per il quale ricevettero il premio Nobel), tale concezione è cambiata.
Lo spesso strato di muco che copre il rivestimento dello stomaco, lo protegge dal suo stesso succo gastrico e l‘Helicobacter pylori si avvale di questa protezione, annidandosi nel rivestimento del muco. Inoltre il batterio si difende dall‘acido grazie all‘azione enzimatica dell‘ureasi che converte l‘urea (abbondante nello stomaco) in biossido di carbonio e ammonio. L‘H.pylori viene riconosciuto dal sistema immunitario dell‘ospite ma non viene eliminato. Il sistema immunitario risponde all‘infezione da H.pylori con il reclutamento di globuli bianchi, linfociti B e T e altre cellule infiammatorie (macrofagi) con produzione di mediatori chimici antiinfiammatori. Tuttavia, questi potenziali uccisori dell‘H.Pylori non possono raggiungere l'infezione, perché non riescono a passare facilmente attraverso il rivestimento dello stomaco.
16
Fig. 6: Patologie associata all’infezione da H.pylori.
La mancata eliminazione del batterio porta ad un‘esaltazione di questa risposta infiammatoria che conduce con il tempo ad una gastrite cronica ed in certi casi a patologie più importanti come la gastrite atrofica, l‘ulcera peptica ed il cancro gastrico.
1.2.1 Vie di trasmissione ed epidemiologia
Attualmente le vie di trasmissione del batterio sono: Orale
Oro-fecale Oro-orale
Altre possibili vie di contagio sono il contatto con acque o con strumenti endoscopici infetti, ma non esistono ancora delle prove a riguardo.
Per quanto riguarda l‘incidenza delle infezioni, H.pylori è un patogeno molto diffuso che colpisce prevalentemente gli adulti con una prevalenza dell‘infezione di circa l‘80% nei paesi in via di sviluppo e del 20-50% nelle nazioni
17 industrializzate. Si stima che, a livello mondiale, ci siano circa 2 miliardi di persone positive al batterio[13].
1.2.2 Trattamento farmacologico
Dall‘anno della sua scoperta, nel 1982, sono state varate varie linee guida per l‘eradicazione del batterio. Attualmente si fa riferimento alle linee guida riportate nel Consenso Europeo tenuto a Firenze nel 2010 (Maastricht IV/Florence Consensi Report), che propone vari schemi di terapia eradicante farmacologica consistenti nella somministrazione di un inibitore di pompa protonica più due o tre antibiotici per vari tempi (Tabella 1) [14].
Tuttavia la terapia farmacologica risulta sempre più spesso non efficace per la scarsa compliance del paziente che si trova costretto a prendere molte pillole al giorno per lunghi periodi (10-14 gg), per gli effetti collaterali legati all‘assunzione
Tipologia Durata (giorni)
Medicinali usati
Triplice terapia
10-14 Claritromicina + amoxicillina o metronidazolo + Inibitore di pompa protonica
Quadruplice Terapia
10-14 Bismuto + Tetraciclina + Metronidazolo + Inibitore di pompa o Ranitidina
Terapia sequenziale
10 Amoxicillina+ Inibitore di pompa (1-5 gg) + Claritromicina o Levofloxacina + metronidazolo + Inibitore di pompa (6-10 gg)
Terapia concomittante
7-10 Claritromicina + amoxicillina + metronidazolo + Inibitore di pompa protonica
Terapia Ibrida 14 Amoxicillina+ Inibitore di pompa (1-7 gg) + Claritromicina + amoxicillina + metronidazolo + Inibitore di pompa protonica
(8-14 gg)
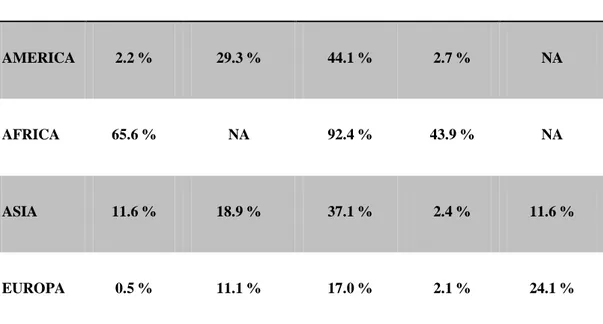
18 dei farmaci (nausea, diarrea, vertigini) e soprattutto per l‘aumentato fenomeno della resistenza all‘antibiotico che il batterio tende a sviluppare ormai a livello mondiale (Tabella 2) [15].
Area Amoxicillina Claritromicina Metronidazolo Tetraciclina Levofloxacina
AMERICA 2.2 % 29.3 % 44.1 % 2.7 % NA
AFRICA 65.6 % NA 92.4 % 43.9 % NA
ASIA 11.6 % 18.9 % 37.1 % 2.4 % 11.6 %
EUROPA 0.5 % 11.1 % 17.0 % 2.1 % 24.1 %
19
Capitolo 2: Principi e metodi
In questo capitolo viene presentata la terapia fotodinamica e, successivamente viene fatta una panoramica sulle capsule endoscopiche sia commerciali che di ricerca.
2.1 Fototerapia
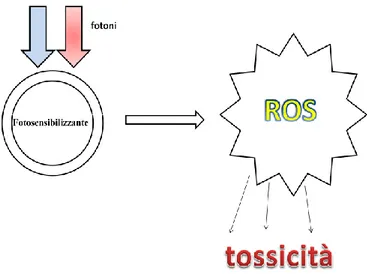
La terapia fotodinamica (PDT, Photo-Dynamic Therapy) o fototerapia è un metodo mininvasivo per il trattamento di varie patologie, caratterizzato dall‘interazione tra un elemento fotosensibilizzante e la luce visibile con spettro di emissione adeguato allo spettro di assorbimento del foto sensibilizzante usato, in presenza di ossigeno. Tale interazione ha l‘effetto di innescare la reazione fotodinamica. Quest‘ultima è un processo chimico mediato dalla luce (processo fotochimico) che prevede l‘assorbimento della luce da parte di una sostanza fotosensibile e la successiva formazione di specie reattive dell‘ossigeno o ROS (tali specie sono: l‘ossigeno singoletto, l‘anione superossido e il perossido d‘ossigeno) che, essendo tossiche, provocano la distruzione della cellula nella quale si sono formate (Fig. 7).
Sebbene le proprietà della luce nel trattamento di vari disturbi, come ad esempio la psoriasi, fosse nota già nell'antichità, solamente nei primi del ‗900 la sua importanza viene riconosciuta per il trattamento delle malattie cutanee e Nils Finsen ricevette il Nobel per la sua ricerca in questo campo [16]. Nel 1975 Dougherty condusse i primi esperimenti con l‘utilizzo dell‘Ematoporfirina, per il trattamento di tumori e, l‘anno dopo, iniziò il primo esperimento in pazienti affetti da tumori alla vescica o alla pelle.
20
Fig. 7: Processi fotodinamici con la PDT
1. Elemento fotosensibilizzante, che si localizza nel tessuto o cellula target. 2. Sorgente luminosa con lunghezza d‘onda tale da attivare il foto
sensibilizzante.
3. Ossigeno molecolare necessario per la formazione delle specie reattive (ROS)
In particolare, si sfruttano le proprietà della protoporfirina IX (PpIX), molecola fotosensibilizzante endogena facente parte della via biosintetica dell‘emoglobina (Fig.8) [4].
21 Tale molecola è sintetizzata da tutte le cellule nucleate del nostro organismo a livelli troppo bassi per causare fotosensibilità. Pertanto, al fine di incrementare la sintesi endogena di PpIX a livelli tali da indurre fotosensibilizzazione, è necessario somministrare topicamente un pro-farmaco (in grado di essere convertito dalle cellule captanti in PpIX).
I due principali pro-farmaci in uso attualmente in Italia sono l‘acido 5-aminolevulinico (5-ALA) ma soprattutto il suo derivato lipofilico esterificato, il metil-aminolevulinato (MAL). Sia nel caso di utilizzo di 5-ALA che di MAL, il passaggio finale delle reazioni che avvengono nelle cellule che hanno captato il pro-farmaco, consiste sempre nella formazione di protoporfirina IX a livello mitocondriale. Successivamente si somministra la luce che deve essere in grado di innescare la reazione fotochimica e di attivare la PpIX.
Per ottenere ciò, è fondamentale che l‘emissione luminosa sia stabile e che il campo d‘irradiazione sia omogeneo. A tale scopo possono essere utilizzate varie fonti di luce, ma le tre principali includono le lampade ad ampio spettro, quelle a diodi (LED) ed i laser [17].
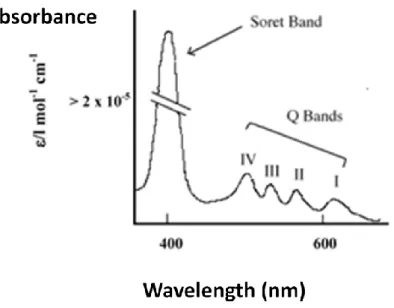
Il massimo assorbimento della luce da parte della PpIX è vicino a 410 nm (luce blu). Altri picchi più bassi di assorbimento si trovano intorno a 460 nm, 510 nm, 545 nm (luce verde) e a 580nm e 635 nm (luce rossa) (Fig. 9). Luci con lunghezze d‘onda di 635 nm, sono in grado di penetrare la pelle ad una profondità di circa 6 mm, circa il triplo rispetto ai 2 mm raggiunti con una lunghezza d‘onda di 400-500 nm.
Per questo motivo nella PDT si privilegia la luce rossa, che ha una profondità di penetrazione maggiore rispetto le altre (basta verificare che un la luce rossa riesce a oltrepassare lao spessore di un dito). Per quanto appena detto, dalla fine degli anni ‘90 la PDT è divenuta una valida opzione terapeutica per il dermatologo, e dopo il 2000 è entrata a far parte delle linee guida internazionali per il trattamento dei tumori cutanei non melanocitari (NMSC, Non Melanoma SkinCancer) di spessore non superiore ai 2 mm. La cheratosi attinica (AK), il carcinoma basocellulare superficiale (BCC), e recentemente anche il morbo di Bowen (BD),
22 rappresentano le indicazioni terapeutiche per la PDT con livello di evidenza A1, in accordo con le più recenti linee guida.
Fig. 9: spettro di assorbimento delle porfirine dell’H.Pylori
La PDT viene usata in vari ambiti: dal trattamento delle infezioni, al campo oncologico, a quello estetico e odontoiatrico (Fig.10). La PDT si divide in mediata e non mediata
23
2.1.2 Fototerapia mediata con farmaci esterni
Per aumentare la produzione di protoporfirina IX, nella pratica clinica, si usa somministrare delle molecole esogene di ALA/MAL.
Ciò avviene in vari campi:
Oncologia Dermatologia
Decontaminazione ferite Lesioni superficiali Odontoiatria
In generale si utilizza l‘agente esterno quando il livello di porfirina è troppo basso perché inneschi la reazione fotodinamica (Fig.11). E‘ questo il caso di varie patologie, come ad esempio tumori della pelle, sterilizzazione del sangue [18] e del plasma [19], trattamento di patologia parodontale e vari altri disturbi di origine batterica, virale o fungina [5].
24
2.1.3 Fototerapia non mediata da molecole esogene
In letteratura viene presentata anche la fototerapia non mediata da molecole esogene, essa è infatti possibile, se abbiamo un organismo che produce di per sé delle grandi quantità di porfirina. Ciò si verifica ad esempio nell‘acne, dove è stato testato l‘utilizzo di PDT senza porfirine esogene e con luce sia blu sia rossa [20]-[21], come anche nel trattamento dell‘eritrasma [22].
E‘ stato dimostrato che anche l‘H.Pylori produce delle porfirine endogene, chiamate coproporfirinaIII e Protoporfirina IX. Inoltre è stato dimostrato che le porfirine di tale batterio sono sensibili a varie lunghezze d‘onda (Fig.12) [6-7, 23].
Fig. 12: lunghezze d'onda efficaci per il trattamento dell'H.Pylori
2.2 Capsule endoscopiche
Nel 1966, fu presentato al pubblico cinematografico un film destinato a far discutere: "Viaggio Allucinante" (titolo originale Fantastic Voyage). Nel film,
25 come nel libro da cui venne tratto, viene descritta una fantascientifica tecnologia che permette di miniaturizzare un sommergibile e il suo equipaggio, fino a portarlo alla grandezza dei microbi, per essere immesso all‘interno del corpo umano ed effettuare un‘operazione al cervello dall‘interno del corpo, quindi in maniera minimamente invasiva. L‘autore stesso, Asimov, aveva sottolineato che l'insieme narrativo era pura fantasia: un espediente letterario per descrivere le meraviglie e le possibilità che si sarebbero manifestate disponendo di una simile tecnologia. Ciononostante, il libro ha sicuramente ispirato tantissimi scienziati per la portata che una simile tecnologia avrebbe a livello mondiale. Probabilmente non arriveremmo mai a miniaturizzare un sommergibile e il relativo equipaggio ciononostante, a distanza di circa 20 anni dall‘uscita del film, venne progettato un dispositivo che permetteva di essere inghiottito da un essere umano e che poteva inviare all‘esterno delle immagini fatte durante il suo percorso nel sistema gastrointestinale (GI).
Era il 1981 e nasceva la prima capsula endoscopica. Tale dispositivo deve la sua nascita ad un ingegnere israeliano, Gavriel Iddan. Tuttavia, a causa della tecnologia limitata in quegli anni, per la sua applicazione negli animali si è dovuto attendere fino al 1994 (nel corso degli anni infatti vi è stata una spinta verso la miniaturizzazione dell‘elettronica). L‘applicazione si è poi estesa all'uomo e, nel 2001, ha ottenuto l‘approvazione FDA (Food and Drug Administration) per l'uso in diagnostica clinica. Il principio è semplice: tale capsula, dalle dimensioni di un antibiotico (circa 11 mm di diametro x 26 mm di lunghezza), contiene all'interno, miniaturizzati, una videocamera a colori, una fonte di luce e due batterie, un trasmettitore ed un'antenna (Fig.13). La capsula viene inghiottita e, durante il suo tragitto nel tratto gastro-intestinale, trasmette delle immagini alla frequenza di una al secondo. Queste immagini vengono registrate da particolari sensori applicati sulla parete addominale e poi trasmesse ad un registratore incorporato in una cintura portata dal paziente stesso.
Successivamente le immagini registrate vengono rielaborate da un software e possono essere visionate dal medico su un monitor. Il tragitto intestinale viene
26 completato dalla capsula in un tempo di 8-10 ore e non impedisce al paziente di svolgere le sue normali occupazioni.
Fig. 13: PillCam®
Dalla nascita e successiva commercializzazione della capsula appena descritta sono passati diversi anni, densi di ricerca per migliorare il dispositivo o crearne altri, sempre ispirandosi al ―viaggio allucinante‖. Ciò è dovuto al fatto che la capsula è un dispositivo minimamente invasivo ed è pertanto ben tollerato dal paziente.
In ambito diagnostico tale ricerca è sfociata nella produzione di capsule per ispezionare vari tratti del sistema gastrointestinale, dall‘esofago fino al colon. Come mostrato in Fig. 14 in commercio si trovano varie capsule ingeribili, ognuna specializzata per diversi distretti.
Fig. 14: Capsule commerciali.
Tali capsule ispezionano il tratto gastrointestinale tramite delle telecamere integrate al loro interno. Molti dei dispositivi di Fig. 14 sono state progettati per l‘intestino tenue, e differiscono fra loro per il modo di trasmettere le immagini e
27 per il modulo di potenza integrato a bordo. Fanno eccezione la PillCam Eso che è una capsula per l‘esofago e la PillCam Colon che è per le diagnosi dell‘intestino crasso. Tutte le capsule hanno dimensioni di 11 mm di diametro e 26 mm di lunghezza, ad eccezione della OMOM che ha 13 mm di diametro e 27,9 mm di lunghezza e della PillCam Colon che ha diametro di 11 mm e lunghezza di 31 mm. Tali capsule sono tutte di tipo diagnostico [24].
In ambito terapeutico, la Philips ha prodotto la ―ePill‖ ( commercializzata dalla sua spin-off, la Medimetrics), una capsula terapeutica passiva per il rilascio controllato di farmaco (Fig. 15). Tale capsula, che i pazienti devono deglutire con acqua, ha dimensioni di 11 mm di diametro x 26 mm di lunghezza.
Il concetto di poter investigare il corpo umano dal suo interno e, se necessario, eseguire su di esso delle operazioni senza creare disagio al paziente è il motore che muove la ricerca sulle capsule.
Fig. 15: ePill
Vale la pena notare come, commercialmente, siano disponibili solo capsule passive per lo più diagnostiche e che non riescono a fare una diagnosi dello stomaco, a causa delle sue dimensioni molto più ampie di quest‘ultimo rispetto ai restanti distretti del tratto gastrointestinale. Per superare tale ostacolo, è stata progettata la swimming capsule [25], essa ha dimensioni di 40.8mm di lunghezza e 15 di diametro. Rientra nella categoria delle capsule attive, in quanto si muove grazie a 4 eliche comandate in modo wireless dall‘esterno utilizzando un ricevitore e il protocollo Zigbee.
Tale capsula è stata in seguito modificata per permettere la visione dell‘interno dello stomaco (Fig.16) [26]. Un‘altra sfida nel campo diagnostico è sicuramente
28 riuscire a svincolare la diagnosi dai movimenti peristaltici (cui sono sottoposte le capsule passive), poiché delle volte sono troppo veloci per diagnosticare alcune parti del tratto intestinale, quali l‘intestino tenue e il colon.
Fig. 16: swimming capsule;
In tal senso, vari autori mostrano dei sistemi per rendere attiva la capsula mediante campi magnetici esterni [27-28], fra cui anche note aziende come ad esempio l‘Olympus (Giappone), il cui sistema è mostrato in Fig.17.
Fig. 17: Concetto della capsula magnetica dell’Olympus
L‘interazione della capsula con un campo magnetico rotante, ne causa un movimento elicoidale che le permette di avanzare lungo l‘intestino tenue. Nella letteratura è mostrata inoltre una capsula magnetica per la diagnosi dello stomaco in fase di sperimentazione clinica [29]. Sono state proposte anche capsule autonome dotate di zampe (Fig.18a) [30] per la colonscopia, o altre bio-ispirate (ad esempio riproducendo il movimento dei vermi) [31] (Fig 18b). Una difficoltà
29 che si incontra nella progettazione delle capsule attive è relativa alla sorgente di energia. Infatti, le batterie commerciali ad oggi approvate per uso medicale, erogano poca potenza, insufficiente per alimentare ad esempio motori e LED contemporaneamente.
Fig. 18: a) Capsula autonoma con zampe per il colon, b) capsula bio-ispirata
Per cercare di superare tale ostacolo, vi sono varie vie. L‘utilizzo di batterie ai polimeri di litio (LiPo) è sicuramente promettente. Tali batterie hanno la più alta densità di carica di tutte le batterie (circa 200 Wh/kg) presenti sul mercato, sono capaci di fornire picchi di corrente fino a 10 volte la loro corrente nominale [32] e possono essere costruite in maniera custom. Un'altra strada seguita è quella di fornire energia in modo wireless dall‘esterno come proposto da alcuni autori [33] che hanno integrato sulla capsula tre bobine che generano fino a 150mW di potenza (Fig.19).
Altri autori, hanno ripreso tale concetto per fornire potenza alle capsule e, contemporaneamente permetterne il movimento [34-35].
Un‘ultima promettente fonte di energia, comparsa ultimamente è la tecnologia presentata dall‘Università dell‘Illinois [36] da applicare, in futuro, nella produzione di nuove batterie.
30
2.2.1 Capsule endoscopiche terapeutiche
Per quanto riguarda l‘utilizzo di capsule wireless per uso terapeutico, sul mercato, la Medimetrics (spin-off della Philips) ha commercializzato come già accennato la ―ePill‖, nella sua evoluzione IntelliCap [37] . Questo dispositivo è costituito da un microprocessore, batteria, sensore termico e di pH, collegamento radio senza fili (che permette il monitoraggio dei dati), pompa e serbatoio per il farmaco. Il sensore di pH permette alla capsula di individuare la propria posizione misurando l'acidità dell'ambiente in cui è immersa (giacché varia a seconda del tratto intestinale) e rilascia il farmaco dove è necessario in una sola volta oppure in modo graduale [38].
Nel campo della chirurgia bariatrica la Obalon produce una capsula che, una volta nello stomaco rilascia dei palloncini per ridurre il volume dello stomaco [39] che vengono poi, dopo tre mesi, rimossi con l‘uso di gastroscopi tradizionali.
E‘ stato progettato anche un prototipo di capsula per la coagulazione che impiega una reazione chimica esotermica per generare calore dall‘interazione dell‘ossido di calcio e dell‘acqua. Questo prototipo potrebbe essere usato anche per altre terapie termali [32]. LLC (Raleigh, U.S.A) ha prodotto la capsula IntelliSite una capsula per il rilascio di farmaco basato su SMA (metallo a memoria di forma) e attivato da radio frequenza, capace di somministrare il farmaco nel luogo desiderato grazie all‘ausilio della localizzazione fornito da una gamma camera. Anche Phaeton Research (Nottingham U.K.) ha proposto una capsula per il rilascio di farmaco chiamata Enterior capsule. Essa utilizza, per il rilascio del farmaco, un meccanismo di attuazione molla-pistone [40].
E‘ stata anche proposta una capsula terapeutica che usa delle clip chirurgiche per suturare lesioni interne [41] , guidata tramite magneti esterni fino alla zona da trattare.
Recentemente è stata proposta una capsula molto versatile [42]. Essa è in grado di ―sparare‖ un film bioadesivo che può essere utilizzato per svariati scopi: dall‘ ancoraggio dalla capsula al trattamento delle lesioni. Vieni guidata e posizionata
31 da un sistema magnetico esterno ed ha dimensioni di 19 mm di diametro e 51 di lunghezza (Fig. 20).
Fig. 20: Capsula per il rilascio di un film bioadesivi
Come si vede da questa breve sintassi sullo stato dell‘arte delle capsule, la maggior parte delle capsule terapeutiche esistenti sono ideate per il rilascio di farmaci o per fermare il sanguinamento nel caso di lesioni della membrana intestinale. Non vi sono, ad oggi, capsule che utilizzano la terapia fotodinamica per il trattamento di patologie interne al sistema gastrointestinale.
2.3 Capsula terapeutica per l’eradicazione dell’Helicobacter pylori attraverso terapia fotodinamica
Lo stato dell‘arte descritto nei precedenti paragrafi è alla base dell‘intuizione che ha portato allo sviluppo di questa tesi: progettare e realizzare una capsula terapeutica per l‘eradicazione dell‘ H.pylori attraverso terapia fotodinamica. La terapia fotodinamica è stata dimostrata in vitro su colture batteriche ed in vivo illuminando la cavità gastrica per mezzo di un gastroscopio. L‘utilizzo di un gastroscopio ha però lo svantaggio di essere mal tollerato dal paziente in quanto praticato mediante un esame altamente invasivo che può provocare dolori. Esiste il rischio di perforazione correlato alla metodica stessa e per il trattamento è comunque richiesta la presenza del medico. Inoltre, difficilmente la terapia fotodinamica può essere ultimata in un‘unica seduta di gastroscopia.
32 Un‘alternativa al gastroscopio è rappresentata dall‘utilizzo di una capsule terapeutica ingeribile in grado di effettuare la fototerapia.
Per consentirne l‘applicazione clinica e l‘accettabilità, tale capsula deve rispettare alcuni requisiti fondamentali, ai quali bisogna riferirsi durante la progettazione. Anzitutto dovrebbe avere dimensioni tali da essere facilmente deglutibile e quindi in linea con le capsule commerciali già utilizzate nella pratica clinica, di circa 11-14 mm di diametro e 26-30 mm di lunghezza. Inoltre deve essere biocompatibile per evitare di innescare reazioni infiammatorie dei tessuti che attraversa, trasparente alla lunghezza d‘onda desiderabile, non biodegradabile, non danneggiare la parete del sistema gastrointestinale durante il transito e avere al suo interno tutti i dispositivi utili per poter applicare la terapia fotodinamica. Il sistema, nel suo complesso deve essere sicuro e affidabile e deve assicurare l‘espulsione in ogni caso. Il dispositivo è monouso, quindi i costi di produzione devono essere ridotti e inferiori dei costi diretti e indiretti dell‘attuale terapia farmacologica. La realizzazione di tale capsula è un obiettivo molto importante sia dal punto di vista ingegneristico che medico, ed è un punto di partenza per investigare la possibilità dell‘applicazione della terapia fotodinamica in varie parti del tratto GI, per il trattamento di vari tipi di disturbi.
Per progettare la capsula sono state analizzate le specifiche mediche e tecniche che il dispositivo richiede e riportate nei paragrafi seguenti.
2.3.1 Specifiche mediche
Uno dei primi aspetti da considerare sono sicuramente l‘ingombro e le dimensioni della capsula, che deve essere ingerita per arrivare dalla bocca allo stomaco passando attraverso l‘esofago, qui agire ed infine transitare tramite lo sfintere pilorico nel duodeno fino all‘ileo e da qui fino al retto per la sua espulsione. Le dimensioni massime per l‘ attraversamento di tutto il tratto gastrointestinale sono 20 mm di diametro e 40-50 mm di lunghezza. Tuttavia l‘obiettivo è quello di progettare il dispositivo con dimensioni comparabili alle capsule endoscopiche commerciali già in uso nella pratica clinica. Tali dimensioni sono tipicamente
11-33 14 mm di diametro per 26-27 mm di lunghezza e per permettere una deglutizione relativamente agevole.
Per facilitare l‘ingestione, potrebbero essere utilizzate delle particolari soluzioni come uno strato sul guscio esterno di un materiale scivoloso biocompatibile e che venga eliminato facilmente dallo stomaco (ad esempio uno strato di sostanze oleose biocompatibili). In ogni caso, la somministrazione della capsula va‘ valutata dopo un‘attenta diagnosi preventiva in quanto la capsula potrebbe essere trattenuta nel caso di pazienti che presentano stenosi nel tratto intestinale, e richiedere quindi un‘asportazione chirurgica. E‘ necessario che il dispositivo abbia forma accettabile anche dal punto di vista medico e tali da contenere i componenti di cui necessita per il funzionamento.
La capsula terapeutica per il rilascio di terapia fotodinamica è una capsula di tipo passivo e, pur non necessitando del grande quantitativo di energia di capsule dotate di un sistema di attuazione, ha bisogno di un‘autonomia energetica compatibile per il tempo di permanenza nello stomaco in cui dovrà emettere luce ad alta intensità. La luce dovrà essere emessa completamente al massimo entro il tempo di svuotamento gastrico (circa 30 minuti), con una fluenza tale da poter distruggere il batterio (10-20 J/cm2 a seconda della lunghezza d‘onda considerata [6]). Queste specifiche sono state considerate nella scelta della sorgente di energia. Nel complesso la capsula deve essere sicura, di semplice e intuitivo utilizzo, e avere un costo economico conveniente sia dal punto di vista dei costi diretti che indiretti (50-109 €) [43].
2.3.2 Specifiche tecniche
Come già accennato, il lavoro di tesi nasce da un brevetto dell‘Università di Firenze [44] da cui sono state ricavate le specifiche tecniche che la capsula deve soddisfare.
La capsula ha lo scopo di fornire luce ad alta intensità in modo il più uniforme possibile a fini foto-terapeutici. In accordo con quanto mostrato in letteratura [6]
34 deve emettere, durante la sua permanenza nello stomaco (circa 30 minuti) una fluenza pari a 20 J/cm2 (a 635 nm)per ottenere un‘efficacia del 100%.
Tuttavia, sempre dalla letteratura, si nota come, per fluenze minori, in base alla lunghezza d‘onda utilizzata, si ha comunque una buona efficacia, ad esempio per una fluenza di 5 J/cm2 e lunghezze d‘onda di 405 nm e 625 nm si ha, rispettivamente, una mortalità del 99,9% e del 90% (è sufficiente ripetere il trattamento prima che il batterio riesca a riprodursi) [6].
La capsula comprende un involucro esterno, una sorgente di energia, una sorgente di luce puntiforme, un circuito di alimentazione sorgente di energia-sorgente di luce, un modulo di attivazione (on/off). L‘involucro esterno deve essere trasparente alla radiazione luminosa, non degradabile e facilmente deglutibile (ad esempio ricoprendolo con materiale biodegradabile scivoloso) e può essere scelto tra i materiali con comportamento diffusivo nei confronti delle lunghezze d‘onda scelte, in funzione di un‘emissione il più possibile distribuita su tutto l‘angolo solido. La sorgente di luce deve emettere a bande di lunghezza d‘onda opportune, preferibilmente 405 nm e 625 nm. Il dispositivo deve essere attivo per almeno 20-30 minuti ossia per il tempo medio di permanenza nello stomaco o comunque deve restare attivo il tempo sufficiente a raggiungere la fluenza desiderata (tale tempo dipende dall‘irradianza che la sorgente di luce andrà ad emettere). Il lobo di emissione della luce deve essere esteso su un angolo solido il più ampio possibile. La capsula deve essere inattiva nel momento del suo ingresso nell‘intestino. E‘ possibile assumere più pillole nel tempo oppure prolungare il trattamento nel tempo. Riassumendo, la capsula deve integrare i seguenti moduli:
Sorgente di luce a 405 nm e 625 nm di lunghezza d‘onda con almeno 5 mW/cm2 (a 405nm) e11,1 (a 605 nm) di irradianza (questo dato è stato calcolato considerando il tempo medio di permanenza nello stomaco di 30 minuti) o comunque in grado di fornire la fluenza desiderata. La scelta della sorgente di luce e l‘analisi dei componenti della capsule sono descritti nel paragrafo 3.1.2;
35 Sorgente di energia che garantisca l‘autonomia necessaria a raggiungere la fluenza desiderata di 20 J/cm2 e alimenti la sorgente di luce. La scelta della sorgente di energia è riportata nel paragrafo 3.2.2
Modulo di attivazione/spegnimento capsula;
Involucro esterno trasparente alla luce e biocompatibile, che sigilli i componenti interni.
Per soddisfare tali specifiche sono state considerate varie possibilità, analizzando le sorgenti di luce, le sorgenti di energia, i moduli di attivazione spegnimento del dispositivo e scegliendo quelli più adatti allo scopo. Tali componenti sono stati testati su banco per verificare le performance dichiarate e, dopo la valutazione dei test effettuati, si è proceduto con la progettazione della capsula terapeutica che ha visto la nascita di due diversi tipi di prototipo: uno di ricerca per favorire l‘implementazione di soluzioni meccatroniche avanzate al prototipo di ricerca fra le quali l‘integrazione di un microcontrollore e di sensori dedicati, l‘altro preindustriale per favorire la futura possibile industrializzazione del dispositivo e il trasferimento tecnologico del prototipo preindustriale. Per realizzare tali prototipi sono stati utilizzati software di CAD meccanico ed elettronico, mentre per valutare la futura integrazione del microcontrollore è stato utilizzato il programma di sviluppo keil µvision, illustrati brevemente in appendice
36
Capitolo 3: Materiali e componenti
In questo capitolo sono descritte le fasi di analisi e validazione dei componenti elettronici e meccanici che saranno utilizzati per la progettazione della capsula terapeutica per l‘eradicazione dell‘H.pylori mediante terapia fotodinamica. La capsula deve avere caratteristiche idonee sia dal punto di vista ingegneristico che medico, che sono state attentamente analizzate prima di procedere alla fase di realizzazione dei prototipi.
3.1 Sorgente di luce
Come sorgente di luce sono stati scelti i LED (Light Emitting Diode), poiché sul mercato si trovano LED con un‘apertura di 60°, meno direzionali rispetto ad altre fonti, quali ad esempio laser, che comunque sarebbero più complicati da integrare a bordo di una capsula. Questi devono avere un‘irradianza (E) di 11,1 mW/cm2
(a 625 nm) per essere certi di avere una frazione di sopravvivenza del batterio di 10-6. Infatti, considerando un tempo di permanenza nello stomaco di 30 minuti e volendo una fluenza (H) di 20 J/cm2 dalla seguente formula
con t = tempo di irraggiamento [s], si ottiene un‘irradianza (E) di 11,1 mW/cm2. Tale valore varia, come mostrato in precedenza, in funzione della lunghezza d‘onda.
3.1.1 Principio di funzionamento
Per sua definizione il LED è un diodo emettitore di luce. Un diodo è un dispositivo elettronico a due terminali che consente il passaggio di corrente elettrica in una sola direzione, con l‘entità della corrente che dipende dalla differenza di potenziale ai capi del dispositivo come si nota dalla caratteristica tensione-corrente riportata in Fig. 21.
37
Fig. 21: caratteristica diodo
La caratteristica tensione corrente è data dalla seguente equazione:
1 th d V V s d I e I
con Vd tensione di soglia, Vth tensione termica e Is corrente di saturazione. Fisicamente, un LED, è un chip di materiale semiconduttore, drogato con impurità per formare una giunzione positivo-negativo (P-N). Quest‘ultima viene realizzata drogando la struttura cristallina del wafer semiconduttore di partenza (ossia aggiungendo delle impurità). Ricordiamo che si ottiene un semiconduttore di tipo P, drogando con elementi trivalenti (alluminio, boro, gallio) mentre otteniamo un semiconduttore di tipo N drogando il semiconduttore con elementi pentavalenti (fosforo, antimonio, arsenico).
Unendo un semiconduttore di tipo P con uno di tipo N si forma la giunzione P-N. A temperatura ambiente, ciò fa diffondere gli elettroni dalla zona N alla zona P e viceversa per le lacune.
Ciò produce una zona di svuotamento, mentre le cariche fisse generano un campo elettrico che induce un potenziale intrinseco.
Quest‘ultimo confina gli elettroni e le lacune fuori dalla zona di svuotamento, ed è chiamato tensione di diffusione o di soglia Vd. Esso è descritto dalla seguente equazione: 2 ln ni N N e KT Vd A D
38 Dove NA , NB sono rispettivamente le concentrazioni degli atomi accettori e donori, ni è la concentrazione intrinseca del semiconduttore, K è la costante di Boltzamm( per vedere le grandezze utilizzate vedere la Tabella dei simboli utilizzate nella tesi in appendice 2.2), T la temperatura ed e la carica dell‘elettrone. Nel dispositivo si distinguono due poli: il positivo (chiamato anodo) e il negativo (chiamato catodo).
I LED hanno la caratteristica di lasciarsi attraversare dalla corrente in un solo verso (proprio come gli altri diodi) ed emettere luce di intensità proporzionale alla corrente che li attraversa. Il simbolo circuitale del LED è riportato in Fig.22. la punta del triangolo indica la direzione della corrente mentre le frecce rappresentano l‘emissione di luce.
Il LED funziona in polarizzazione diretta. In pratica ciò avviene collegando il polo positivo di un‘ alimentatore all‘anodo e il polo negativo al catodo. Le connessioni in polarizzazione diretta hanno l‘effetto di spostare gli elettroni e le lacune attraverso la giunzione P-N, riducendo in questo modo la regione di svuotamento e permettendo alle cariche negative l‘attraversamento della barriera stessa.
Fig. 22: simbolo circuitale LED
Gli elettroni entrano quindi nella zona P e vanno di lacuna in lacuna. Quando un elettrone attraversa la barriera e incontra una lacuna rilascia energia sottoforma di fotoni e quindi di luce. La lunghezza d‘onda della luce emessa, e quindi il suo colore, corrisponde al divario tra i livelli energetici dei materiali utilizzati per la formazione (Fig. 23 e Tabella 3)
39
Fig. 23: Tensione di soglia di alcuni semiconduttori drogati
L‘energia del fotone emesso è legata quindi al materiale con cui è realizzato il semiconduttore e, idealmente, è pari al salto effettuato dall‘elettrone (ossia l‘ampiezza della banda proibita del semiconduttore):
c h hv Ef
Con h costante di Plank, λ lunghezza d‘onda della radiazione e c velocità della luce. Da quanto finora detto si capisce come il LED funzioni in tensione continua, secondo la caratteristica tensione corrente che varia in base al LED utilizzato. Nei datasheet vengono riportati la tensione e la corrente massima che il LED può sopportare senza danneggiare la giunzione.
Tabella 3: principali materiali utilizzati per i LED e colori di emissione
Materiali semiconduttori Colore emissione LED
AlGaInP Arancione-rosso brillante,arancione, giallo
AlgaN Lontano e vicino UV
C (diamante) UV
GaAsP Rosso, rosso-arancio,arancio, giallo
GaP Rosso,giallo,Verde
GAn Verde, blu
SiC Blu
40 Il pilotaggio tramite resistenza è descritto dal seguente circuito:
In cui Vo è la tensione di alimentazione, Vd è la tensione di soglia a cui il LED si accende e ILED è la corrente che scorre nel LED. Di solito sappiamo quale corrente
scorre nel diodo per una certa intensità luminosa quindi possiamo calcolare il valore di resistenza mediante la seguente formula:
LED
I Vd Vo R
Ad esempio per un LED con Vd=2,8V, una tensione di alimentazione di 4V e una corrente di 20 mA avrò R= 60Ω. Esistono varie tipologie di LED che si possono riassumere nelle seguenti:
THT (Through Hole Technology) SMD (Surface Mounted Device) Die o chip-LED
Durante il lavoro di tesi sono state prese in considerazione le ultime due tipologie di LED , ossia i LED die (o chip-LED) e i LED SMD. Le lunghezze d‘onda considerate sono state dettate dallo spettro di assorbimento delle porfirine del batterio (Fig.12 e Fig.24)
41
Fig. 24: spettro di assorbimento delle porfirine dell’ H.pylori
Come si vede dallo spettro, si ha un picco intorno ai 405 nm poi dei picchi più bassi a lunghezze d‘onda maggiori. Sono stati, per tale motivo, ricercati LED intorno alle seguenti lunghezze d‘onda:
375 nm (ultravioletto) 405-410 nm (violetto-blu) 460 nm (blu)
630-640 nm (rosso)
I LED a 405 nm hanno proprietà battericida maggiore rispetto a quelli con lunghezza d‘onda maggiore che, però, hanno una maggiore profondità di penetrazione in accordo con il seguente grafico:
42 In cui la profondità di penetrazione della luce è stata calcolata secondo la relazione seguente: s a a ' 3 1
Con µa coefficiente di assorbimento e µ’s coefficiente di scattering ridotto. Inoltre
è dimostrato che l‘acqua ha banda di assorbimento a 980 nm, 1189 nm, 1450 nm, 1787 nm, 1940 nm [45].
3.1.1.2 LED die
Il LED die è semplicemente il wafer di semiconduttore su cui è stata ricavata la giunzione. La sua struttura varia in base ai materiali utilizzati e all‘applicazione per cui è progettato il LED. La zona in cui avviene l‘emissione luminosa è chiamata zona attiva. I substrati più utilizzati per la realizzazione sono zaffiro e carburo di silicio. Tipicamente hanno le dimensioni di 250 µm2 e hanno la caratteristica di emettere luce in modo omnidirezionale (Fig.25) attraverso le sei facce.
.
Fig. 25: emissione die
Durante il lavoro di tesi sono state contattate varie aziende per i LED die, in particolare la Roitnher laser [46] , la Marubeni [47] e la Semileds [48], le cui caratteristiche sono riportate in Tabella 4. Come si vede dalla tabella, le dimensioni di tali LED sono molto ridotte e potrebbero quindi essere usati come stringa di die con unico package. Per poterli utilizzare occorre però realizzare un package custom su commissione poiché, l‘omnidirezionalità dei die limita fortemente l‘energia emessa per unità di area. Infatti, irraggiando una superficie
43 molto ampia, ossia quella di una sfera, forniscono un‘irradianza minore rispetto ai LED SMD con la stesso flusso radiante. Ciò è molto importante per la nostra applicazione, in quanto, come già detto, si è visto che gli effetti sul batterio sono correlati ad un‘energia totale irraggiata di 20 . Stimando un tempo di permanenza nello stomaco di 30 minuti(correlato anche alla durata della batteria) si ricava che il LED deve poter erogare un irradianza di ed irraggiare la maggior area possibile. L‘alternativa è trovare dei LED die con potenza di emissione più elevata oppure degli SMD con massimo angolo di emissione e potenza elevata.
Tabella 4: caratteristiche dei LED die analizzati
Per quanto detto, oltre il costo del LED die, bisogna aggiungere i costi relativi alla messa in opera di un package che permetta il flusso radiante desiderato. Questo motivo e il loro difficile montaggio in laboratorio, ha portato la scelta verso gli SMD.
3.1.1.3 LED SMD (Surface Mounted Device)
I LED di questo tipo si istallano in circuiti montati su una base isolante. Questi circuiti sono forati per consentire il passaggio degli elettrodi, le cui saldature sono
Colore Marca e modello Lunghezza d’onda (nm) Vd (V) Id (mA) Dimensioni (µm) Luminosità (mcd) Rosso MarubeniC630-30U 630 1,9-2,4 20 300x300 90 Blu-viola Roitnherelc410-34-2 410 3,5- 3,8 20 331x331 n.d rosso Elc630-13-1 630 2-2,3 20 265x265 90-180 UV Semileds Evu15A 375-425 3,2 20 400x400 nd
44 effettuate sulla faccia inferiore della base. Si tratta di componenti in cui gli elettrodi non sporgono verso il basso, ma escono dai lati del chip. Si contraddistinguono per la forma piatta: la parte inferiore può essere appoggiata su una base, mentre i collegamenti elettrici sono laterali. In questo modo è possibile utilizzare circuiti stampati su base isolante di ridotto spessore ed effettuare le microsaldature con macchinari automatizzati. Questo tipo di LED si presenta come un minuscolo box con una faccia da cui viene emessa la luce, la faccia opposta o laterale che funge da base d‘appoggio, mentre le rimanenti facce laterali sono munite di anodo e catodo (Fig. 26).
Nel lavoro di tesi sono stati controllati vari tipi di LED SMD, in base alle dimensioni e al flusso luminoso dichiarata. Conoscendo il flusso radiante e l‘irradianza necessaria per ogni LED, si può calcolare a quale distanza si ha l‘irradianza desiderata. Essendo quest‘ultima pari a 11,1 si può risalire alla superficie che si deve irraggiare semplicemente moltiplicando l‘inverso di tale irradianza per il flusso radiante.
Fig. 26: LED SMD
In questo modo si ottiene la base del cono di luce ideale emesso dal LED. Possiamo quindi trovare il raggio (r) di tale area ( r = ). Sfruttando infine le relazioni trigonometriche, ricavabili dalla Fig. 27 , otteniamo che la distanza a cui si ha l‘irradianza desiderata è
45 Tali formule sono valide per piccoli poiché al crescere di tale angolo non si ha più un cono (quindi non irraggio solo la sua base) ma una calotta sferica con conseguente dissipazione di energia su un‘area molto più vasta.
Fig. 27: emissione ideale del LED
I LED SMD, avendo un‘apertura di max 60°, possono essere descritti utilizzando tali approssimazioni , utili anche per calcolare in vie teorica la fluenza (J/cm2) a distanze determinate.
3.1.2 Scelta sorgente luce
Dopo un‘attenta analisi dei pregi e dei difetti delle varie tipologie descritte in precedenza, delle dimensioni e della potenza richiesta, sono stati scelti i LED SMD della Nichia [49] e della Vishay [50], le cui caratteristiche, ottiche e dimensionali, principali sono riportate in Tabella 5.
Come si nota dalla tabella, i LED hanno dimensioni tali per poter essere integrati nella capsula, e un flusso luminoso che è correlato alla lunghezza d‘onda. Si può notare come il flusso luminoso sia inferiore per lunghezze d‘onda basse, ciò è dovuto ai limiti tecnologici e alla curva di sensibilità dell‘occhio umano essendo il flusso luminoso un grandezza fotometrica (vedi appendice2 per una descrizione delle grandezze fotometriche). Le caratteristiche elettriche e ottiche di alcuni dei LED scelti sono riportate in Fig.28-29.
46
Tabella 5: caratteristiche ottiche e dimensionali dei LED SMD scelti
Fig. 28: caratteristiche LED rosso (Vlmx333)
LED Angolo di emissione (°) Intensità luminosa (mcd) λ (nm) Flusso radiante (mW) Dimensioni ( mm) LED blu – violetto (Vishay, VLME3100) 120 11 405 2,80x3,20x1,90 LED UV (Nichia, NSSU100) 120 375 13.6 3x2x1,2 LED blu ( Nichia, NHSB064T) 120 155 460 3,5x2,8x 2 LED rosso ( Vishay VLMX333) 120 750 625 3x2,8x1,75
47
Fig. 29: caratteristiche Vlmu 3100
I LED scelti hanno inoltre le seguenti caratteristiche elettriche: LED blu – violetto
(Vishay, VLME3100-GS08)
3,6 20
LED Vd (V) Id tipica (mA)
LED UV (Nichia, NSSU100) 3,2 20
LED blu ( nichia, NHSB064T) 3,1 10
LED rosso( Vishay VLMR333-Red) 2 20
48
3.1.3 Test sperimentali
In una prima fase di progettazione, sono stati valutati lo spettro effettivo dei LED, il flusso radiante e l‘uniformità della luce. Queste misure sono state effettuate in modo da verificare l‘effettiva utilità dei LED scelti in termini quantitativi, prima degli esperimenti in vitro sul batterio e per la progettazione dei prototipi.
L‘esperimento è concepito per essere effettuato su colture batteriche coltivate su supporti dette capsule Petri (successivamente indicate semplicemente con Petri) per verificare le ipotesi nel caso più semplice ossia con i batteri completamente esposti/irradiati alla luce e non nascosti/schermati dalle pliche dello stomaco. La verifica dell‘efficacia dei singoli componenti per la terapia è stata necessaria per procedere al progetto della capsula.
Per poter effettuare gli esperimenti preliminari e i successivi esperimenti di irraggiamento sul batterio è stato organizzato un setup sperimentale. Questo prevede il posizionamento di un singolo LED sulla coltura ad una distanza di 20 mm, per tale motivo sono stati disegnati e stampati, con processo litografico mediante 3D-printer, dei supporti distanziatori.
I LED sono stati alimentati con celle LiPo da 50 mAh e resistenza dimensionata per avere una corrente costante di 20 mA (Fig. 30). Tale circuito è stato poi montato su un supporto circolare e sigillato con l‘ausilio di uno stampo e successiva colata con resina epossidica bi-componente (Prochima Plexifluid elemento A, elemento B in proporzione 4:1 ) in modo da evitare contaminazione con l‘esterno (Fig. 31).
49
Fig. 30: circuito di alimentazione LED e dimensionamento della resistenza
Fig. 31: disegno dei supporti del circuito e sua realizzazione con colata di resina
Il supporto distanziatore è stato disegnato in modo da essere vincolato alla Petri e realizzato in resina poliuretanica con la stampante 3D.
Gli esperimenti sono stati organizzati nelle seguenti sessioni: Sessione 1: verifica spettro di emissione dei LED Sessione 2: verifica della potenza emessa dai LED Sessione 3: uniformità luce e irradianza su Petri Sessione 4: Prove battericida



![Fig. 10 Possibili infezioni da trattare con PDT[5]](https://thumb-eu.123doks.com/thumbv2/123dokorg/8009287.121462/24.892.260.683.778.1005/fig-possibili-infezioni-trattare-pdt.webp)