INDICE
1. Introduzione……… 2
2. Stenosi aortica………. 4
2.1 Eziologia………. 4 2.2 Fisiopatologia………. 5 2.3 Classificazione……… 11 2.4 Sintomatologia……….... 11 2.5 BNP……… 13 2.6 Indicazioni chirurgiche………... 14
2.7 Indicazioni alla sostituzione percutanea…………. 18
3. Trattamento chirurgico della stenosi aortica…22
4. Trattamento percutaneo della stenosi aortica.. 29
5. Gestione anestesiologica………..33
6. Studio clinico………...38
6.1 Obiettivi………...38 6.2 Materiali e metodi………....39 6.3 Risultati………42 6.4 Discussione………. 45 6.5 Conclusioni………..487. Bibliografia………..49
1. INTRODUZIONE
L’invecchiamento medio della popolazione, con un’aspettativa di vita ormai superiore agli ottant’anni, parallelamente al miglioramento delle opzioni terapeutiche mediche e chirurgiche, ha aumentato notevolmente il numero di pazienti anziani con patologie valvolari degenerative che necessiterebbero di un intervento valvolare riparativo o sostitutivo, ma il cui rischio operatorio è considerato troppo elevato per le patologie associate (1).
Nel registro Euro Heart Survey, che ha raccolto dati relativi a 5001 pazienti con valvulopatia in 92 centri europei, globalmente il 32% dei pazienti con stenosi valvolare aortica severa sintomatica (NYHA III-IV o angina) non è stato sottoposto ad intervento chirurgico per la presenza di importanti comorbidità che ne controindicavano l’esecuzione (2).
Ad oggi il trattamento di prima scelta per la stenosi aortica (SA) è rappresentato dalla sostituzione valvolare chirurgica con impianto di una protesi meccanica o biologica. Tale intervento si è dimostrato in grado di migliorare sia la sopravvivenza a distanza che i sintomi, con buoni risultati anche nella popolazione anziana ed in presenza di disfunzione ventricolare sinistra; la mortalità intraoperatoria è stimata tra 1 e 4% (1), tuttavia circa un terzo dei pazienti con valvulopatia aortica severa non viene operato a causa dell’età proibitiva o delle severe comorbidità, con riduzione dell’aspettativa di vita (2-3). Questo gruppo di pazienti sarà destinato ad aumentare negli anni sia per
l’aumento dell’aspettativa di vita sia per il miglioramento delle opzioni terapeutiche in pazienti con pluripatologie (1).
Specialmente per i pazienti ad alto rischio, quindi, la chirurgia convenzionale non è la soluzione migliore; la ricerca di una soluzione alternativa è iniziata nel 1985 con l’introduzione della valvuloplastica percutanea, tecnica però abbandonata a causa degli scarsi risultati clinici dovuti soprattutto alle frequentissime recidive. Negli anni novanta sono iniziati degli studi per l’impianto percutaneo di valvole espandibili che hanno portato Cribier e il suo team a praticare, il 16 aprile 2002, la prima sostituzione valvolare aortica totalmente percutanea con approccio anterogrado transattale; l’approccio transettale presentava però delle limitazioni come l’insufficienza mitralica ed il possibile danneggiamento della valvola stessa; è stato nel 2005 che Grube e il suo team hanno sviluppato una tecnica alternativa, utilizzando vavole autoespandibili e l’approccio retrogrado hanno ridotto l’incidenza, sia di complicanze sulla mitrale che di insufficienza aortica paravalvolare.
La tecnica di Grube è quella che ha riscosso maggiori successi ed è quella che viene eseguita nel nostro centro, sulla quale ho svolto il mio lavoro andando a confrontare l’impatto sul decorso perioperatorio della stessa e dell’intervento chirurgico tradizionale in pazienti di età superiore a 75 anni.
2. STENOSI AORTICA
La stenosi aortica è un’ostruzione all’eiezione di sangue dal ventricolo sinistro (4).
Questa è più frequentemente localizzata al livello della valvola aortica, ma può anche verificarsi al di sopra della valvola (stenosi sopravalvolare) o al di sotto (stenosi sottovalvolare) (5).
La stenosi sopravalvolare è generalmente una malattia congenita, la sottovalvolare è più frequentemente dovuta a miocardiopatia ipertrofica (ostruzione muscolare) (6).
2.1 EZIOLOGIA
Le stenosi aortiche più frequenti sono quelle congenite, quelle dovute a malattia reumatica e quelle dovute a calcificazione degenerativa della valvola (4).
Per pazienti di età inferiore a 70 anni la calcificazione di valvole congenitamente bicuspidi è responsabile della metà dei casi chirurgici; mentre per pazienti con età superiore a 70 anni è la calcificazione degenerativa ad essere responsabile della metà dei casi (7).
La stenosi aortica calcifica degenerativa e correlata all’età (in passato detta senile) è attualmente la causa più comune di stenosi aortica e attualmente il motivo più frequente di sostituzione della valvola (8). L’eziologia della stenosi aortica degenerativa si pensa sia dovuta alle turbolenze che causano fibrosi e modificazioni infiammatorie con
infiltrazione di macrofagi e linfociti T. La degenerazione delle cuspidi valvolari ha caratteristiche biochimiche e istologiche simili all’aterosclerosi, nonchè gli stessi fattori di rischio: ipertensione, dislipidemia, obesità, fumo, diabete mellito.
Il processo di calcificazione probabilmente non è degenerativo ma attivo e regolato attraverso modificazioni della risposta infiammatoria o modificazioni della sintesi di proteine regolatrici; infatti usando tecniche di immunoistochimica si è visto che l’osteopontina, una proteina coinvolta nella regolazione dei processi di calcificazione sia normale che distrofica, è associata al grado di calcificazione e all’accumulo di macrofagi nelle valvole aortiche stenotiche (9).
2.2 FISIOPATOLOGIA
L’ostacolo all’efflusso del ventricolo sinistro causa un aumento della pressione sistolica, un aumento del tempo di eiezione, un aumento della pressione diastolica e una diminuzione della pressione aortica; si instaura così un gradiente transvalvolare quando l’area valvolare si riduce di almeno il 50%. L’aumento della pressione sistolica del ventricolo sinistro con sovraccarico di volume aumenta la massa del ventricolo e ciò può portare a disfunzione e insufficienza del ventricolo sinistro. L’aumento della pressione sistolica della massa e del tempo di eiezione portano ad aumento del consumo di ossigeno da parte del miocardio: l’ aumento del tempo di efflusso causa la diminuzione del tempo diastolico, l’ aumento della pressione diastolica e la diminuzione della pressione aortica causano una
diminuita perfusione coronarica, così consegue un diminuito apporto di ossigeno al miocardio.
L’aumento del consumo di ossigeno e il suo diminuito apporto causano ischemia miocardica con ulteriore peggioramento della funzione ventricolare sinistra (10).
FUNZIONE MIOCARDICA. Quando si determina un gradiente tra ventricolo sinistro e aorta la pressione ventricolare aumenta e quindi aumenta anche lo stress di parete. L’aumento dello stress parietale sistolico indotto dalla stenosi porta a ipertrofia concentrica. L’aumento dello spessore della parete ventricolare sinistra è spesso sufficiente a controbilanciare l’aumento pressorio così che il picco della tensione parietale ritorna normale o rimane nella norma se l’ostruzione si sviluppa lentamente. Quindi l’ipertrofia ventricolare rappresenta il principale meccanismo compensatorio del cuore per far fronte all’ostruzione dell’efflusso (5).
PROPRIETA DIASTOLICHE. Prima di parlare delle alterazioni fisiopatologiche della diastole in caso di stenosi aortica è opportuno introdurre la fisiologia diastolica, concetto comunemente trascurato nella cultura intensivologica ed anestesiologica.
La diastole di un ciclo cardiaco normale dura in media 0,5 sec., cioè una volta e mezza la durata della sistole ed divisibile in quattro fasi fisiologiche.
La diastole non è sinonimo di riempimento ventricolare, infatti la chiusura della valvola aortica, delineando, la fine della fase elettiva,
rappresenta contemporaneamente l’inizio della diastole. Quindi l’inizio della diastole è quel periodo in cui si ha il rilasciamento ventricolare a valvole aortica e mitrale chiuse, quindi senza variazione di volume: prima fase diastolica. Solo dopo l’apertura della mitrale avviene la prima fase di riempimento: fase di riempimento rapido, che incamera l’80% del volume diastolico ventricolare. Tale riempimento realizza rapidamente un’equalizzazione delle pressioni in atrio sinistro e ventricolo sinistro; la fase seguente è la diastasi, nella quale il passaggio di sangue tra atrio e ventricolo è praticamente nullo. Alla diastasi segue la contrazione atriale che contribuisce per circa il 20% al riempimento ventricolare.
Quindi le fasi della diastole sono:
-
Rilasciamento isovolumetrico-
Riempimento rapido-
Diastasi-
Contrazione atrialeLa corretta durata di ciascuna fase è determinante per una normale diastole e dalla normalità di queste deriva la capacità del ventricolo sinistro a riempirsi del volume refluo ad un livello di pressione intracavitaria normale. L’alterazione di ciascuna fase può interferire con il normale svolgimento della fare diastolica e determinare la disfunzione diastolica.
Questa è definita come l’incapacità del ventricolo a riempirsi senza un aumento della pressione intracavitaria (11).
I concetti appena esposti ci fanno capire come l’ipertrofia, benchè sia un meccanismo adattativo fondamentale, ha una conseguenza fisiopatologica sfavorevole: aumenta la rigidità diastolica. Di conseguenza per il riempimento ventricolare è necessaria una pressione intracavitaria maggiore. Nei pazienti con stenosi aortica spesso compaiono ampie onde a al polso pressorio atriale sinistro a causa della contrazione atriale che deve superare la ridotta compliance ventricolare. La contrazione atriale è quindi fondamentale per superare l’aumento di pressione telediastolica causato dalla stenosi senza che ci sia un aumento della pressione atriale media, così da impedire l’aumento delle pressioni venose polmonari e capillari a livelli tali da causare congestione polmonare. La contrazione atriale garantisce inoltre un adeguato riempimento del ventricolo scarsamente compliante, e di conseguenza la funzione sistolica.
La perdita della vigorosa contrazione ariale come accade nella fibrillazione atriale o nella dissociazione atrioventricolare, può provocare un rapido peggioramento clinico nei pazienti con stenosi aortica.
ISCHEMIA. Nei pazienti con stenosi aortica vi può essere una inadeguata ossigenazione del miocardio anche in assenza di malattia coronaria. La massa muscolare ventricolare sinistra ipertrofica, l’aumento della pressione sistolica e anche il prolungamento dell’eiezione aumentano il consumo di ossigeno; inoltre l’anomalo aumento pressorio che comprime le arterie coronarie può superare la pressione di perfusione, portando ad uno squilibrio tra richiesta e
apporto di ossigeno al miocardio. Questa ipoperfusione può essere responsabile dello sviluppo di ischemia subendocardica, specialmente durante la tachicardia (5).
FUNZIONE SISTOLICA. La funzione sistolica del ventricolo sinistro dipende dal miocardio e dalla combinazione tra pre- e postcarico. Quindi un alterata funzione sistolica (misurata con la frazione d’eiezione) può dipendere da un’alterazione del pre- e postcarico, da un’alterata funzione miocardia o da entrambe. Nella maggior parte dei pazienti con stenosi aortica grave la funzione sistolica è normale; quando l’ipertrofia del ventricolo sinistro non riesce a compensare da sola l’ostruzione all’efflusso il ventricolo utilizza il meccanismo di Frank-Starling (riserva di precarico) per mantenere la funzione sistolica, quando anche questo meccanismo non è più sufficiente si ha la riduzione della funzione sistolica.
L’insufficienza cardiaca diviena clinicamente manifesta quando vengono superati questi meccanismi di compenso, ciò può avvenire in seguito ad un’alterazione della funzione diastolica che in seguito ad un peggioramento della funzione meccanica miocardia oppure ci può essere un associazione delle due cause.
Nella maggior parte dei pazienti inizialmente la gittata cardiaca è normale e aumenta con lo sforzo, quando la stenosi aortica diventa progressivamente più grave la gittata cardiaca rimane normale a riposo, ma non aumenta in proporzioni adeguate durante lo sforzo; quando compare la disfunzione sistolica la gittata cardiaca è ridotta anche a riposo (6).
FISIOPATOLOGIA DELLA STENOSI AORTICA NELL’ANZIANO. Negli anziani ci sono dei cambiamenti nell’aorta e nel ventricolo sinistro che accelerano il processo fisiopatogenetico. Con l’età c’è una progressiva perdita di elastina, associata ad un aumento di collagene nella tonaca media dell’aorta, c’è in oltre una perdita di cellule muscolari lisce che rendono l’arteria più rigida e meno compliante. Con questi cambiamenti aumenta la velocità del polso aortico che si riflette più rapidamente, così da tornare in anticipo, alla fine della sistole ventricolare, alla radice dell’aorta. Questo evento aumenta il postcarico e tutto ciò riflette una più precoce iprtrofia ventricolare.
Negli anziani quindi c’è una minor riserva funzionale dovuta all’ipertrofia precoce e alla fibrosi miocardica che ne consegue, nonché alla diminuzione della compliance diastolica.
Per ogni grado di stenosi aortica l’ipertrofia e la diminuzione della compliance sono maggiori in pazienti con età superiore a 65 anni rispetto ai più giovani; ciò causa un maggiore aumento della pressione atriale sinistra e della pressione capillare polmonare, quindi si ha un aumento dell’incidenza di congestione polmonare.
Con l’aumentare dell’età aumenta anche l’incidenza della malattia coronarica, si ha quindi un aumentata frequenza di sintomatologia anginosa associata alla stenosi aortica, in ragione dell’alterato rapporto tra richiesta e disponibilità di ossigeno.
Concludo dicendo che l’ipossia completa un circolo vizioso poiché l’ischemia subendocardica che si instaura aggrava la fibrosi e quindi la compliance e la contrattilità, portando ad insufficienza miocardica (9).
2.3 CLASSIFICAZIONE SECONDO IL GRADO
DI STENOSI
L’area valvolare normale è 2,5-3,5 cm2.
-
Stenosi aortica lieve: area >1,5 cm2; gradiente medio <30 mmHg-
Stenosi aortica moderata: area compresa tra 1 e 1,5 cm2; gradiente medio tra 30 e 50 mmHg-
Stenosi aortica grave: area compresa tra 0,7 e 1 cm2; gradiente medio >50 mmHg (12).2.4 SINTOMATOLOGIA
I sintomi cardinali della stenosi aortica sono l’angina pectoris, la sincope,la dispnea da sforzo ed infine lo scompenso cardiaco.
L’angina si verifica in circa due terzo dei pazienti, la metà dei quali ha un’associata ostruzione coronarica significativa. Essa ricorda l’angina osservata nei pazienti con malattia coronarica, essendo generalmente precipitata dallo sforzo ed eliminata dal riposo.
Nei pazienti senza coronaropatia l’angina deriva dalla combinazione dell’aumento delle richieste di ossigeno del miocardio ipertrofico e
dalla riduzione dell’apporto di ossigeno secondaria a eccessiva compressione dei vasi coronarici, nei pazienti con coronaropatia è causata dalla combinazione tra ostruzione e squilibrio di ossigeno caratteristico della stenosi aortica.
La sincope è più spesso dovuta a riduzione della perfusione cerebrale che si verifica durante lo sforzo quando la pressione arteriosa diminuisce in conseguenza della vasodilatazione sistemica in presenza di una portata cardiaca fissa. La sincope è stata anche attribuita ad un malfunzionamento del meccanismo barorecettoriale nella stenosi aortica severa (13), come pure ad una risposta vasodepressiva e a uno spiccato innalzamento della pressione sistolica ventricolare sinistra durante lo sforzo (14).
Sono frequenti i sintomi premonitori della sincope: l’ipotensione da sforzo si può manifestare con brevi episodi di obnubilamento visivo o vertigini da sforzo. La sincope a riposo può anche essere dovuta ad una fibrillazione ventricolare transitoria, dalla quale il paziente si riprende spontaneamente, ad una fibrillazione atriale transitoria con perdita del contributo atriale al riempimento diastolico che causa un’improvvisa diminuzione della gittata cardiaca; oppure a un blocco atrioventricolare dovuto all’estendersi della calcificazione al sistema di conduzione.
La dispnea da sforzo con ortopnea, la dispnea parossistica notturna e l’edema polmonare rispecchiano diversi gradi di ipertensione venosa polmonare, conseguenza della scarsa efficienza dei sistemi di compenso.
La portata cardiaca è generalmente ben conservata per molti anni, una marcata affaticabilità, la debilitazione, la cianosi periferica e altre manifestazioni cliniche di bassa portata di solito non sono evidenti fino alle fasi più avanzate della malattia.
Altri segni presenti tardivamente nei pazienti con stenosi aortica isolata comprendono la fibrillazione atriale, l’ipertensione polmonare e l’ipertensione sistemica (5).
2.5 BNP
BNP (Brain natriuretic peptide). Il BNP è un neurormone che viene
rilasciato quasi esclusivamente dai miociti ventricolari in risposta al sovraccarico pressorio cardiaco (15). Il rilascio del BNP porta a cambiamenti fisiologici che antagonizzano meccanismi compensatori come: vasocostrizione, tachicardia ed espansione volemica. Il BNP è un controregolatore che si lega selettivamente a livello di recettori renali, surrenali ed endoteliali per promuovere la diuresi, la natriuresi, la vasodilatazione e la soppressione del sistema renina-angiotensina-aldosterone (16).
I livelli plasmatici di BNP sono quindi aumentati in caso di aumento della pressione di riempimento ventricolare ed in caso di aumentato stress parietale, proprio per questo viene considerato marker di funzionalità cardiaca e di ipertrofia (17,18). In pazienti con presunta o certa insufficienza cardiaca ed in pazienti con infarto miocardico acuto, i livelli di BNP sono correlati con il grado di scompenso
cardiaco e con il grado di disfunzione ventricolare, inoltre in questi casi è un attendibile indice prognostico (19, 20).
Diversi studi si sono concentrati sui livelli plasmatici del BNP in pazienti con stenosi valvolare aortica, il risultato è stato che il BNP può essere utilizzato come indicatore non invasivo di progressione della malattia (21) e come precoce segno di disfunzione ventricolare (22, 23).
Questa premessa dimostra come il BNP, essendo un marker prognostico, è attendibile per la valutazione dell’impatto di una procedura invasiva sull’outcome di un paziente; posso inoltre precisare che in uno studio pubblicato nel 2004 da Georges A, Forestier F, Valli N, Plogin A, Janvier G e Bordenave L sull’European Journal of Cardio-thoracic Surgery, è stato dimostrato che i livelli plasmatici di BNP aumentano in seguito agli interventi cardiochirurgici anche se c’è stata la correzione della patologia.
2.6 INDICAZIONI CHIRURGICHE
Gli adulti sintomatici con stenosi aortica severa richiedono la sostituzione valvolare. In caso di sintomi e stenosi severa infatti la prognosi è infausta con elevato rischio di scompenso cardiaco e morte improvvisa. Il rischio chirurgico è più basso rispetto alla mortalità senza chirurgia. Tale rischio viene valutato calcolando l’EuroSCORE
L’EuroSCORE è un metodo per calcolare il rischio di morte predittivo per i pazienti che devono essere sottoposti a cardiochirurgia.
Il sistema è stato elaborato studiando 20000 pazienti di 128 ospedali in 8 paesi europei, su ogni paziente è stata valutata la presenza di vari fattori di rischio; l’outcome operatorio dei pazienti (sopravvivenza o morte) è stato associato ai suddetti fattori di rischio. Da un insieme di 97 fattori di rischio sono poi stati selezionati i più indicativi per la creazione dello score system.
L’EuroSCORE è stato presentato nel 1998 a Brussels al meeting dell’European Association for Cardio-Thoracic Surgery.
L’EuroSCORE valuta:
-
Fattori correlati al paziente: età, sesso, malattie polmonari croniche, arteriopatie, malattie neurologiche, precedenti interventi cardiochirurgici, creatinina plasmatica, endocarditi attive, stato preoperatorio critico.-
Fattori cardiaci: angina instabile, disfunzione ventricolare sinistra, infarto miocardico recente, ipertensione polmonare.-
Fattori correlati all’intervento: emergenza, altro intervento chirurgico rispetto a CABG isolata, chirurgia sull’aorta toracica rottura del setto postinfartuale.Ad ognuno di questi fattori di rischio viene assegnato un punteggio, così il sistema riesce ad elaborare la percentuale di rischio operatorio.
STENOSI AORTICA SINTOMATICA. Ci sono due criteri per ottimizzare la scelta dell’epoca dell’intervento:
-
Cosa significa sintomatico.-
I sintomi sono realmente causati dalla stenosi aortica.Spesso i sintomi sono subdoli, all’inizio la classica sintomatologia caratterizzata da angina, sincope e scompenso non si presenta e la maggior parte dei pazienti riferiscono intolleranza allo sforzo e dispnea da sforzo; questi sintomi indicano un deficit nei meccanismi di compenso cardiaco e l’approccio chirurgico se la stenosi severa è indicato.
Se la sintomatologia non è chiara si consiglia l’esecuzione di test da sforzo; l’esercizio precipita la sintomatologia in un terzo dei pazienti apparentemente asintomatici e dimostra una caduta della pressione arteriosa sistemica in circa il 10% dei casi.
Anche il dosaggio del BNP potrebbe essere utile, elevati livelli dello stesso sono correlati con una rapida insorgenza di sintomatologia. In caso di associazione della malattia coronarica con una stenosi aortica severa è appropriato associare la rivascolarizzazione coronarica alla sostituzione valvolare.
Se i sintomi sono associati ad una stenosi moderata non possiamo dare per scontato che la patologia valvolare sia la primitiva causa della sintomatologia, in questa situazione dobbiamo fare degli approfondimenti diagnostici per escludere che eventuali comorbidità siano la principale causa della sintomatologia; per esempio sarà
importante la valutazione della funzione polmonare e cardiaca per escludere eventuali aritmie e coronaropatia. Se dopo l’esclusione di tutte le altre cause ci troviamo di fronte ad una stenosi moderata sintomatica, la decisione è difficile, comunque si prende in considerazione la chirurgia se la valvola è fortemente calcifica e se i sintomi persistono in uno stretto follow-up.
STENOSI AORTICA SEVERA ASINTOMATICA. Studi recenti indicano che il rischio di morte improvvisa cardiaca in caso di stenosi severa asintomatica è inferiore all’ 1% annuo, in questa situazione il rischio operatorio 2-9% è superiore, quindi la sostituzione valvolare non è raccomandata.
Ci sono comunque delle eccezioni: adulti con stenosi estremamente severa (area < 0.6 cm2) in cui la progressione della malattia verso i sintomi entro l’anno è quasi la regola e pazienti che risiedono lontano dai centri di assistenza medica.
STENOSI AORTICA E DISFUNZIONE VENTRICOLARE. Se la stenosi è accompagnata a disfunzione ventricolare ( frazione di eiezione < 50% ) la sostituzione valvolare è indicata; infatti anche nel caso ci sia un concomitante processo degenerativo a carico del miocardio, ci sarebbe un miglioramento della condizione dopo la sostituzione valvolare in ragione della diminuzione del postcarico.
INDICAZIONI NELL’ANZIANO. L’età, di per se, non è una controindicazione all’intervento, infatti ne sono stati dimostrati i
benefici; bisogna comunque considerare i rischi chirurgici (mortalità 5-15%) e tutte le comorbidità. L’intervento è comunque raccomandato, dopo aver valutato l’intera storia clinica del paziente accuratamente e aver discusso ampiamente con paziente e familiari, in quasi tutti i casi di stenosi aortica severa (24).
2.7 INDICAZIONI ALLA SOSTITUZIONE
PERCUTANEA DELLA VALVOLA AORTICA
Mi sembra opportuno premettere che le indicazioni precedentemente esposte sono imprescindibili per l’esecuzione dell’intervento percutaneo, quindi si possono selezionare i candidati alla sostituzione valvolare aortica percutanea solo dopo aver accertato la presenza delle suddette caratteristiche cliniche del paziente.
La sostituzione percutanea è indicata in caso di stenosi aortica calcifica.
I passaggi per la selezione di un candidato sono quattro: - Conferma della severità della stenosi
- Valutazione dei sintomi
- Analisi del rischio chirurgico, valutazione dell’aspettativa e della qualità di vita
- Accertamento dell’ eseguibilità della procedura ed esclusione delle controindicazioni (25).
CONFERMA DELLA SEVERITA DELLA STENOSI. L’ ecocardiografia è la metodica di scelta visto che può combinare la misurazione dell’area valvolare con quella degli indici di flusso; l’area valvolare deve essere inferiore ad 1 cm2 (26). Piccole dosi di dobutamina possono essere utili per differenziare stenosi severe dalle rare stenosi “ pseudo-severe” nei pazienti con bassa frazione di eiezione e basso gradiente medio (27, 28).
VALUTAZIONE DEI SINTOMI. Per l’esecuzione della sostituzione percutanea i sintomi devono essere severi e dipendenti dalla stenosi aortica.
ANALISI DEL RISCHIO CHIRURGICO E VALUTAZIONE DELLA QUALITA E DELL’ASPETTATIVA DI VITA. La valutazione del rischio chirurgico si basa su fattori cardiaci ed extra cardiaci (29). Si utilizzano degli scores che stratificano il rischio come l’ EuroSCORE, l’ STP Predicted Risk of Mortality score, o l’Ambler score; questi comunque hanno una limitazione data dal fatto che è difficile prevedere l’ outcome di pazienti anziani come questi, che sono solo una piccola parte dei pazienti su cui sono stati impostati i criteri di stratificazione. Il valore individuale degli scores, in pazienti ad alto rischio come quelli che sono selezionati per la sostituzione percutanea deve ancora essere stabilito in maniera specifica e non ci sono ancora metodi standard per farlo (30).
In ragione di queste considerazioni gli elementi chiave per stabilire quali pazienti abbiano un elevato rischio chirurgico sono: il giudizio clinico associato ad accertamenti quantitativi.
L’euroSCORE deve essere maggiore o uguale al 20%, in più dobbiamo considerare fattori di rischio che non sono presi in considerazione dagli scores come: cirrosi epatica, insufficienza respiratoria, pregressa chirurgia cardiaca, ipertensione polmonare grave (PAP > 60 mmHg), embolie polmonari recidivanti, insufficienza ventricolare destra, torace ostile (radioterapia, ustioni), collagenopatia grave e cachessia; possiamo aggiungere infine che anche l’età del paziente è molto importante poiché si selezionano pazienti maggiori di 75 anni o maggiori di 65 in caso della presenza dei suddetti fattori di rischio non presi in considerazione dagli scores (31).
ACCERTAMENTO DELL’ESEGUIBILITA E DI EVENTUALI CONTROINDICAZIONI ALLA SOSTITUZIONE VALVOLARE AORTICA PERCUTANEA. Per l’eseguibilità è necessario valutare l’anatomia delle coronarie, delle arterie periferiche e misurare l’anulus aortico.
Accertamento dell’anatomia coronaria. A questo scopo si esegue la
coronarografia ed in caso di malattia coronaria si procede alla rivascolarizzazione se necessario, prima di eseguire la sostituzione valvolare. Possiamo però affermare che la sostituzione percutanea non è eseguibile in caso di grave stenosi prossimale delle coronarie non trattabile con PTCA (25).
Accertamento dell’anatomia delle arterie periferiche. Premesso che
l’accesso per la procedura si può effettuare a livello femorale, radiale nonché attraverso l’arteria succlavia; dobbiamo valutare la presenza di tortuosità, diametri ristretti e stenosi per selezionare l’accesso più idoneo, la metodica di prima scelta è l’angiografia.
Misurazione dell’anulus aortico. La corretta scelta misura del
dispositivo valvolare è fondamentale per minimizzare il leakage paravalvolare e per evitare l’eventuale migrazione della protesi dopo il posizionamento. La metodica gold standard non è ancora stata stabilita, comunque si ritiene adeguato l’utilizzo dell’ecocardiografia transesofagea, soprattutto in caso di valori raccolti con l’ecocadiografia transtoracica, che rendono dubbiosa l’eseguibilità della procedura (32).
Controindicazioni generali:
-
Anulus aortico minore di 18 o maggiore di 25mm per il posizionamento di dispositivi balloon-expandable; anulus minore di 20 o maggiore di 27mm per dispositivi self-expandable (25).-
Presenza di grosse calcificazioni valvolari che potrebbero comprimere le coronarie durante la procedura (33). Comunque il rischio può essere diminuito dall’esecuzione della valvuloplastica con pallone espandibile (25).-
Diametro dell’aorta ascendente 3cm sopra l’anulus maggiore di 45mm (31).3. TRATTAMENTO CHIRURGICO
DELLA STENOSI AORTICA
La sostituzione valvolare aortica chirurgica è un intervento molto invasivo eseguito in sternotomia mediana che necessita di by-pass cardiopolmonare e protezione miocardica con cardioplegia per evitare danni da ischemia riperfusione sul muscolo cardiaco.
CIRCOLAZIONE EXTRACORPOREA. Durante questa procedura il sangue è drenato dalla gravità nel venous reservoir, infatti questo è posto 40-70 cm sotto il livello del cuore, attraverso due cannule, una in vena cava superiore e una nella vena cava inferiore, oppure si può utilizzare una sola cannula posizionata nell’atrio destro. Dal reservoir il sangue è pompato attraverso una membrana ossigenatrice e quindi può tornare nel sistema arterioso, generalmente con una cannula posta alla radice aortica.
Fondamentale per la prevenzione di microembolie che possono mettere in pericolo la vita del paziente, la macchina cuore polmone ha un microfiltro che intrappola le bolle (microfilter bubbole-trap) al livello della fuoriuscita del sangue ossigenato dalla macchina.
Incannulazione venosa e drenaggio. Il primo passo è la scelta dei
cateteri, questa si fa in base alle dimensioni del paziente, al flusso precedentemente determinato e alle caratteristiche di resistenza e di flusso dello strumento che sono determinate dai fabbricanti. I
principali approcci per l’incannulazione venosa sono: bicavale, atriale e cavo-atriale (two-stage).
Il drenaggio è determinato dalla pressione venosa centrale, dalla resistenza delle cannule e dall’assenza di aria nel sistema. La pressione venosa centrale è determinata dal volume intravasale e dalla compliance venosa, ciò è influenzato dai farmaci, dal tono simpatico e dall’anestesia.
Ci possono essere svariate complicazioni in seguito alla incannulazione: aritmie atriali, perdite ematiche sia a livello cavale che atriale, malposizionamento , decannulazione, lacerazione di un bronco durante la sutura cavale; il posizionamento delle cannule può anche compromettere il ritorno venoso (34).
Incannulazione arteriosa. I siti anatomici disponibili per la
reimmissione di sangue ossigenato sono: l’aorta ascendente, l’arteria anonima, la porzione più distale dell’arco aortico, l’arteria iliaca esterna, l’arteria femorale e l’arteria succlavia; la scelta è influenzata dal tipo di intervento (35) e dalla distribuzione delle placche aterosclerotiche (36).
Nella chirurgia della valvola aortica comunque il sito di scelta è la parte prossimale dell’arco aortico; questa regione è preferita sia per la minor incidenza di complicanze che per la maggior semplicità. Le complicanze includono: difficoltà nell’inserzione, emorragia, lacerazione della parete aortica, formazione di emboli ateromasici, inadeguata o eccessiva perfusione cerebrale (37), dissezione aortica (38) e decannulazione accidentale (34).
Interruzione della circolazione extracorporea. Prima dell’interruzione
della procedura il paziente è riscaldato, defibrillato, i polmoni vengono riespansi con una pressione di 40 cm H2O ed è ripresa la ventilazione. Necessitano di un attento monitoraggio: ematocrito, elettroliti, equilibrio acido base; prima che inizi l’attività cardiaca è importantissimo verificare con TEE se è stata rimossa tutta l’aria dalle porzioni cardiache precedentemente aperte, fondamentale è inoltre il monitoraggio attento del ritmo e della contrattilità cardiaca per l’eventuale scelta di infondere farmaci inotropi che possono prevenire danni dovuti alla bassa portata in uscita dalla macchina cuore polmone (34).
Danni dovuti alla circolazione extracorporea. Organi e tessuti
possono soffrire a causa della scarsa perfusione che si può avere in alcune regioni e che è indipendente dal controllo fisiologico in corso di CEC, essa è spesso causata da microemboli che si formano nella macchina; si verificano anche danni da ischemia-riperfusione che aumentano il danneggiamento a livello cardiaco e di altri organi; quindi in seguito alla circolazione extracorporea si possono avere danni cellulari reversibili ma anche irreversibili, questi sono dovuti oltre che alla scarsa perfusione, dovuta anche al basso ematocrito, all’attivazione della risposta infiammatoria (39).
PROTEZIONE DEL MIOCARDIO. Questa procedura si esegue utilizzando soluzioni cardioplegiche contenenti agenti chimici che provocano l’arresto del cuore in diastole garantendo una protezione
dai danni causati dall’ischemia e dalla riperfusione , garantendo allo stesso tempo la possibilità di eseguire l’intervento con il cuore fermo. Ci sono due tipi di soluzioni cardioplegiche: cristalloidi ed ematiche, che si possono utilizzare in condizioni di ipotermia, normotermia ma anche a temperatura intermedia.
Cardioplegia con cristalloidi ipotermici. Ci sono due tipi di soluzioni,
una intracellulare ed una extracellulare; la soluzione intacellulare contiene basse concentrazioni di sodio e calcio al contrario di quella extracellulare che contiene maggiori concentrazioni sia di sodio che calcio, nonché di magnesio; entrambe le soluzioni contengono comunque concentrazioni di potassio comprese tra 10 e 40 mmol/l e sono osmoticamente bilanciate. La temperatura di queste soluzioni varia tra i 4 e i 12 gradi centigradi.
Cardioplegia con soluzione ematica ipotermica. La soluzione è
generalmente preparata con sangue autologo ottenuto dal circuito extracorporeo combinato con una soluzione cristalloide contenente citrato-fosfato-destrosio (CPD), tre idrossimetil-aminometano o bicarbonato e cloruro di potassio ad una concentrazione di circa 30mmol/l. Il rapporto tra sangue e cristalloide è variabile 8:1, 4:1 o 2:1 a seconda dei centri. La temperatura della soluzione è tra 4 e 12 gradi centigradi.
Sono stati eseguiti studi che hanno dimostrato l’efficacia anche di soluzioni normotermiche a 37 gradi e tiepide, che si producono mescolando la soluzione fredda (4-12 gradi) con quella normotermica ottenendo una soluzione attorno ai 29 gradi; queste metodiche sono però di uso meno frequente rispetto alle soluzioni ipotermiche.
Metodi di somministrazione. La somministrazione delle soluzioni
cardioplegiche può avvenire in modi diversi: infusione anterograda, continua o intermittente, infusione retrograda continua o intermittente, infusione anterograda seguita da retrograda ed infusione simultanea anterograda e retrograda. L’approccio anterogrado si esegue attraverso l’aorta ascendente, mentre l’approccio retrogrado attraverso il seno coronario (40).
TECNICA CHIRURGICA. Dopo aver eseguito il by-pass cardiopolmonare e la protezione miocardica, quando il cuore è arrestato, si esegue un’aortotomia trasversa o obliqua. L’aortotomia inizia al di sopra dell’origine della coronaria destra e si estende sia anteriormente che posteriormente. Aperta la radice dell’aorta si ispeziona la valvola e quindi si inizia l’escissione delle cuspidi valvolari: si incide la cuspide destra tra l’ostio della coronaria destra e la commissura che è tra al coronaria destra e la cuspide non coronarica, dopo l’asportazione della cuspide destra, si passa alla cuspide non coronarica ed infine alla cuspide sinistra. Durante l’asportazione delle cuspidi è importante valutare anche la presenza di depositi di calcio ed eventualmente asportarli dalla parete aortica. A questo punto viene posta nel cono di efflusso una spugna umidificata che serve per raccogliere i detriti, la completa asportazione di tutti i frammenti di calcio migliora l’adesione parietale della protesi e diminuisce l’incidenza sia del leak paravalvolare che della deiscenza della protesi. Si deve prestare attenzione alla perforazione dell’aorta durante l’asportazione del materiale calcico soprattutto alla
commissura tra la cuspide sinistra e la non coronarica, dove la perforazione è più frequente. Il fascio di His è al di sotto della giunzione tra la cuspide destra e la noncoronarica, nel setto membranoso, quindi bisogna tenere conto che un suo danneggiamento può portare ad un blocco cardiaco permanente. Dopo la decalcificazione la radice aortica viene lavata con soluzione salina, mentre viene chiuso il foro che da accesso al ventricolo sinistro.
Dopo l’asportazione della valvola nativa si procede alla misurazione dell’anulus e dunque viene selezionato il dispositivo anatomicamente più adatto, che viene suturato a livello dell’anulus.
La chiusura dell’aorta inizia a destra, nella parte posteriore dell’aortotomia, la chiusura deve essere accurata e bisogna assicurarsi che non sia presente alcun leak.
Durante la procedura entra aria nell’aorta, nel ventricolo e nell’atrio sinistro; questa deve essere eliminata per evitare l’embolizzazione. Prima di stringere la sutura dell’aortotomia il cuore è pronto per essere riempito; già il riempimento, vista la solo parziale chiusura dell’aortotomia, promuove l’espulsione di gran parte dell’aria da queste cavità; si completa dunque la sutura a livello dell’aortotomia. Le cannule per la cardioplegia che sono posizionate nell’aorta ascendente e nel ventricolo sinistro iniziano ad aspirare per eliminare completamente l’aria, con un’agocannula da 21 gauge si aspira l’apice del ventricolo sinistro e la cupola dell’atrio sinistro; la completa asportazione dell’aria dalle camere e dall’aorta viene verificata con l’ecocardiografia transesofagea.
L’intervento si conclude staccando il paziente dalla macchina cuore polmone e togliendo le cannule necessarie al funzionamento della stessa (41).
4. TRATTAMENTO PERCUTANEO
DELLA STENOSI AORTICA
Vista la complessità e l’invasività del trattamento chirurgico per la sostituzione valvolare aortica è stata studiata una procedura di gran lunga meno invasiva che consente la riuscita dell’intervento anche in quei pazienti che non potrebbero tollerare, a causa di condizioni cliniche precarie, il suddetto.
LA VALVOLA: CoreValve. La CoreValve è costituita da una valvola in pericardio bovino montata su un dispositivo autoespandibile in nitinolo costituito da tre parti:
-
Una porzione superiore (livello aortico) permette il fissaggio della protesi alla parete aortica e facilita l’allineamento del sistema al flusso sanguigno.-
Una porzione mediana (livello commissurale) contiene la valvola, la forma convessa del dispositivo a questo livello è opposta alla concavità dei seni coronarici e mantiene una fisiologica idrodinamica.-
Una porzione inferiore (livello dell’anulus) ancora la protesi all’anulus aortico, prevenendo l’embolizzazione e l’insufficienza paravalvolare, grazie alla sua elevata forza radiale.L’autoespandibilità del dispositivo consente l’adattamento ad anatomie non circolari e impedisce il recoil. Il primo impianto è stato eseguito nel 2004 con la prima generazione della valvola, la seconda generazione ha ridotto le dimensioni dell’introduttore a 21F, oggi è disponibile anche la terza generazione con introduttore di 18F (42).
LA PROCEDURA. Sono stati sperimentati due approcci per la sostituzione percutanea della valvola aortica: un approccio anterogrado eseguito incannulando una vena e che necessita di puntura transattale, questa metodica ha il vantaggio poter essere eseguita anche in pazienti con un’importante vasculopatia periferica; il secondo approccio è retrogrado eseguito mediante puntura arteriosa, quest’ultimo è quello che sta riscuotendo maggior successo in campo clinico,ed è quello che andrò a descrivere.
Approccio retrogrado. L’accesso vascolare si può ottenere con o
senza esposizione chirurgica del vaso interessato, può essere incannulata l’arteria iliaca, la femorale o la succlavia.
La procedura si svolge in anestesia generale e l’ecocardiografia transesofagea (TEE) è necessaria durante l’intervento per valutare il posizionamento del dispositivo ma anche per individuare rapidamente eventuali complicanze.
Dopo l’incannulazione il catetere viene fatto scorrere fino al livello della valvola nativa dove viene eseguita una valvuloplastica con pallone espandibile (balloon aortic valvuloplasty, BAV), simultaneamente, per diminuire la gittata cardiaca, viene effettuato un pacing ad alta frequenza ( > 180 bpm); a questo punto con tecniche di
imaging (fluoroscopia, aortografia ed ecocardiografia) si stabilisce il corretto posizionamento della protesi e le eventuali calcificazioni che possono essere la causa della successiva insufficienza paravalvolare. Quando si considera correttala posizione la protesi viene rilasciata, la CoreValve è un dispositivo selfexpandable che ha una memoria di espansione di 24ore, quindi dopo il rilascio la valvola si adatta anatomicamente al paziente.
Immediatamente dopo la procedura, con TEE e aortografia si verificano: il corretto posizionamento, il grado di insufficienza paravalvolare (leak paravalvolare), la perfusione delle coronarie ed eventuali complicanze acute come emopericardio e dissezione aortica nonché il risultato emodinamico (25).
COMPLICANZE. Oltre alle complicanze sul sito d’accesso ci possono essere: embolizzazione della protesi, ostruzione degli osti coronarici e insufficienza aortica periprotesica (43).
L’embolizzazione è una complicanza che insorge generalmente nelle procedure che utilizzano valvole balloon expandable, inoltre devo aggiungere che il pacing ad alta frequenza riduce molto l’insorgenza della complicanza.
L’insufficienza aortica paraprotesica, che è presente in forma lieve in quasi la totalità dei pazienti, può essere causa di scompenso cardiaco quando si verifica in forma acuta in ventricoli poco complianti; la causa più frequente è la non completa apposizione del dispositivo valvolare a causa delle estese calcificazioni anulari, dobbiamo
precisare che il dispositivo CoreValve riduce l’entità del leak grazie alla memoria di espansione.
L’ostruzione degli osti coronarici può essere causata sia dalla posizione della protesi che dal dislocamento dei lembi della valvola nativa.
Dobbiamo considerare altre complicanze benchè molto più rare, queste sono: l’emolisi, un’accelerata distruzione dei lembi della protesi e la trombosi delle maglie dello stent (42).
5. GESTIONE ANESTESIOLOGICA
Le problematiche e gli interventi anestesiologici nel paziente con stenosi valvolare aortica sono gli stessi sia in caso di sostituzione valvolare chirurgica che percutanea, infatti nonostante la sostanziale differenza nei due interventi, sono le caratteristiche fisiopatologiche della malattia a determinare le procedure da eseguire per una corretta gestione del caso clinico.
PROFILO EMODINAMICO.
Precarico. A causa della diminuita compliance del ventricolo sinistro
e dell’ aumento, sia della pressione ventricolare sinistra di fine diastole (LVEDP) che del volume ventricolare sinistro di fine diastole (LVEDV) è necessario l’aumento del precarico per mantenere una normale gittata cardiaca.
Frequenza cardiaca. La tachicardia non è ben tollerata, essa può
diminuire la perfusione coronarica, allo stesso modo sono mal tollerate anche basse frequenze, soprattutto in quei pazienti che hanno gittata cardiaca fissa. Si preferisce comunque mantenere il paziente su frequenze attorno ai 50-70 battiti al minuto rispetto a frequenze elevate, sopra i 90 battiti per esempio, per consentire una buona gittata attraverso la valvola stenotica. Il mantenimento del ritmo sinusale è fondamentale, vista l’importanza che la contrazione atriale riveste nel riempimento ventricolare.
Contrattilità. Per il mantenimento di un’adeguata gittata sistolica è
necessaria un’elevata contrattilità, i β-bloccanti quindi non sono ben tollerati, perché possono causare un aumento del volume ventricolare sinistro di fine diastole (LVEDV) e una significativa diminuzione della capacità eiettiva che può condurre ad un deterioramento clinico.
Resistenze sistemiche. La maggior parte del postcarico è a carico della
valvola stenotica, di conseguenza la diminuzione della pressione sistemica e quindi delle resistenze periferiche non crea alcun tipo di giovamento al profilo emodinamico, anzi si deve prestare attenzione alla pressione diastolica poiché una sua caduta può compromettere la perfusione coronarica (44). Il paziente con stenosi valvolare aortica è a rischio di ischemia subendocardica, proprio per questo trova giovamento in seguito alla somministrazione precoce di farmaci α-adrenergici che prevengono bruschi cali pressori possibile causa di morte improvvisa (45).
Possiamo concludere che l’aumento delle resistenze causato dalla somministrazione di farmaci non diminuisce l’output cardiaco perché le resistenze sono a carico soprattutto della stenosi.
Resistenze polmonari. Queste sono normali fino alle fasi terminali
della malattia, quindi non è necessario nessun tipo di trattamento.
TECNICHE ANESTESIOLOGICHE.
-
Una premedicazione leggera è necessaria a mantenere il paziente calmo senza tachicardia; una premedicazione aggressiva è sconsigliata perché può causare una diminuzione significativa sia del pre che delpostcarico. Si possono usare senza significativi effetti emodinamici: 0,2-0,3mg di scopolamina in associazione a 0,05-0,1mg/Kg di morfina per via intramuscolare; 1-2mg di lorazepam per via orale; 1-3mg di midazolam per via orale o intramuscolare. I dosaggi della premeditazione sono diversi da paziente a paziente in base all’età, alla costituzione fisica e alle eventuali comorbidità (35).
-
All’ingresso in sala operatoria il paziente viene sottoposto ad incannulazione di un’arteria periferica, per la valutazione invasiva della pressione arteriosa, di una vena periferica e di una vena centrale.-
Il paziente viene monitorato tramite: ECG, sO2, PA invasiva, PVC,Et (End tidal) CO2.
-
L’anestesia totalmente endovenosa (TIVA) viene indotta con propofol in TCI (target controlled infusion) a 2 ng/ml e remifentanil a 0,3 γ/Kg/min.-
L’intubazione orotracheale viene praticata, dopo il raggiungimento della mio risoluzione, con un bolo di cistracuronio 0,14 mg/Kg.-
Il paziente viene mantenuto in ventilazione meccanica con aria e ossigeno a volume controllato, per garantire il mantenimento della normocapnia e di una adeguata saturazione di ossigeno.-
Al termine dell’anestesia il paziente sottoposto all’intervento percutaneo viene decurarizzato farmacologicamente, il paziente sottoposto all’intervento chirurgico viene trasferito in regime di sedazione e ventilazione meccanica in terapia intensiva.-
I farmaci anestetici che causano depressione miocardica, riduzione della pressione sistemica, tachicardia o altre aritmie devono essere usati con cautela, in quanto ognuno di questi cambiamenti può influenzare negativamente l’assetto emodinamico del paziente portando ad un deterioramento clinico.-
Durante l’induzione e il mantenimento dell’anestesia un farmaco α-adrenergico deve essere pronto per il trattamento precoce ed aggressivo di un’eventuale riduzione della pressione sistemica sistolica o diastolica.-
In caso di segni o sintomi di ischemia la nitroglicerina deve essere usata con cautela a causa dei suoi effetti sul precarico che possono peggiorare le condizioni cliniche del paziente.-
Devono essere trattate aggressivamente le aritmie sopraventricolari poichè sia la tachicardia che la perdita della contrazione atriale possono portare ad una rapida diminuzione della gittata cardiaca e al deterioramento dello stato emodinamico; con la stessa aggressività vanno trattati a battiti ectopici, questi possono esitare in fibrillazione ventricolare e i pazienti che vanno incontro a questa evenienza sono difficilmente rianimabili.-
In assenza di disfunzione ventricolare preoperatoria o associazione a coronaropatia il supporto inotropo non è generalmente necessario dopo il by-pass cardiopolmonare, visto che la sostituzione della valvola aortica riduce il postcarico e quindi facilità la capacità contrattile cardiaca.-
L’ecocardiografia transesofagea è suggerita per il monitoraggio intraoperatorio della funzione ventricolare, per la valutazione del de-aring post by-pass cardiopolmonare, nonché per valutare la funzionalità, il corretto posizionamento e il leak paravalvolare del nuovo apparato valvolare (44).6. STUDIO CLINICO
L’invecchiamento della popolazione ha provocato un aumento dell’incidenza della stenosi aortica in pazienti anziani, buona parte di questi essendo clinicamente compromessi non vengono sottoposti all’intervento di sostituzione valvolare; la prognosi di questi pazienti è infausta infatti la loro prospettiva di vita è di circa un anno.
Nel 2002 Cribier et al hanno eseguito la prima sostituzione valvolare aortica percutanea utilizzando un accesso anterogrado. Nel 2005 Grube et al hanno introdotto l’utilizzo della CoreValve, un dispositivo con memoria di espansione di 24 ore che viene introdotto tramite accesso retrogrado.
La sostituzione valvolare aortica percutanea sta entrando nella pratica clinica per quei pazienti che hanno un rischio operatorio troppo elevato (32% secondo il registro Euro Heart Survey) e non possono essere sottoposti alla chirurgia tradizionale.
6.1 OBIETTIVI
Questo studio preliminare si propone di confrontare il decorso perioperatorio di 40 pazienti, con età compresa tra 68 e 92 anni, 20 dei quali (Gruppo A) sono stati sottoposti a sostituzione valvolare aortica chirurgica e 20 che (Gruppo B) sono stati sottoposti a sostituzione percutanea.
Lo scopo del confronto è valutare le differenze di outcome postoperatorio delle due procedure.
6.2 MATERIALI E METODI
Pazienti.
Sono stati selezionati 40 pazienti, di età compresa tra 68 e 92 anni, affetti da stenosi aortica sintomatica per la quale è stata riconosciuta l’indicazione chirurgica. I pazienti sono stati sottoposti a sostituzione della valvola aortica, su 20 di questi che avevano un EuroSCORE inferiore al 20% è stata praticata la sostituzione valvolare chirurgica (Gruppo A: 9 maschi, 11 femmine), sugli altri 20 (Gruppo B: 12 maschi, 8 femmine), che presentavano controindicazione alla chirurgia tradizionale poiché avevano un EuroSCORE maggiore del 20%, è stato praticato l’intervento percutaneo utilizzando la tecnica di Grube et al, cioè è stata impiantata la CoreValve con accesso retrogrado.
BNP (Brain natriuretic peptide).
Il dosaggio del BNP ha richiesto due prelievi di sangue da CVC, uno prima e uno dopo la sostituzione valvolare aortica, sia essa chirurgica o percutanea. Il sangue è stato trasportato al laboratorio in provette contenenti EDTA ed è stato dosato con tecnica immunoenzimatica. La significatività dei risultati è stata valutata con il test-t di Student, con un intervallo di confidenza del 95%.
Inotropi.
L’ipertrofia ventricolare sinistra, condizione costante nei pazienti con stenosi aortica, è associata ad un’aumentata rigidità diastolica della
camera ventricolare dopo la sostituzione della valvola aortica; farmaci ino-dilatatori come levosimendan ed enoximone migliorano la contrattilità ed il rilasciamento del ventricolo sinistro (46).
L’alterazione della funzione diastolica del ventricolo sinistro nella stenosi aortica è un importante fattore di rischio per la mortalità precoce e tardiva dopo la sostituzione valvolare (47), l’uso di ino-dilatatori è associato al miglioramento della funzione diastolica dopo la cardiochirurgia (48, 49).
La scelta di somministrare o meno farmaci inotropi dopo la sostituzione valvolare spetta all’anestesista che dunque dovrà valutare oltre la funzione sistolica anche quella diastolica del paziente sottoposto a sostituzione valvolare aortica.
In questo lavoro si è valutato l’utilizzo o meno di farmaci inotropi dopo la sostituzione valvolare aortica chirurgica e percutanea perchè si ritiene il parametro un utile indice per la valutazione dell’impatto che l’intervento ha sulla funzione cardiaca nel periodo perioperatorio.
Trasfusioni.
La necessità di essere trasfusi dopo un intervento cardiochirurgico dipende dalle condizioni cliniche del paziente, ma anche dal sanguinamento durante l’intervento chirurgico, nonché dalla perdita ematica dovuta alla circolazione extracorporea, se l’intervento la necessita. Per questo motivo si è ritenuto il conteggio delle sacche di sangue, contenenti globuli rossi, un utile indice per valutare l’invasività della tecnica chirurgica. Dunque nel decorso perioperatorio dei pazienti selezionati per questo lavoro si è contato il
numero di sacche di sangue che ogni paziente ha ricevuto come trattamento postoperatorio.
Ventilazione meccanica.
Non sono stati pubblicati studi sull’ estubazione precoce negli
interventi di sostituzione valvolare aortica (50). Possiamo comunque sostenere che l’estubazione, o meglio lo svezzamento dal ventilatore, indica il raggiungimento di una certa autonomia da parte del paziente. Questo è certamente un punto di partenza per iniziare a pensare alla dimissione del paziente dall’unità di terapia intensiva; è questa la ragione per cui abbiamo ritenuto il tempo necessario allo svezzamento, quindi la durata della ventilazione meccanica, un parametro ideale per valutare l’outcome postoperatorio nei pazienti sottoposti alle due diverse procedure.
Tempo trascorso in terapia intensiva.
In seguito alla sostituzione valvolare aortica chirurgica il passaggio del paziente dall’unità di terapia intensiva è la regola, i pazienti oltre alla ventilazione meccanica e ad un attento monitoraggio spesso necessitano di cure intensive che non possono essere attuate in altre sedi. Per la sostituzione percutanea della valvola aortica il passaggio all’unità di terapia intensiva, almeno nel nostro centro non è la regola visto che spesso i pazienti hanno dimostrato una certa autonomia dopo la procedura; essendo questo un lavoro preliminare che va a valutare l’impatto perioperatorio dell’intervento percutaneo confrontandolo con l’intervento chirurgico, l’analisi del tempo trascorso in terapia
intensiva in seguito all’esecuzione delle due procedure è stato considerato un valido indice di valutazione dell’outcome, è un valido indice anche per stimare l’eventuale riduzione dei costi di gestione dei pazienti sottoposti all’intervento percutaneo.
6.3 RISULTATI
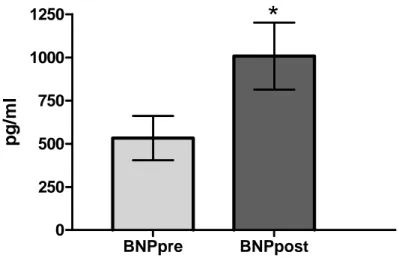
Nei pazienti del Gruppo A, che sono stati sottoposti a sostituzione chirurgica della valvola aortica, sono stati riscontrati valori medi di BNP preoperatorio pari a 533 pg/ml, il valore medio di BNP postoperatorio è risultato 1007 pg/ml; dopo l’analisi con test-t di Student, intervello di confidenza del 95%, l’innalzamento è risultato statisticamente significativo con p < 0,05 (Figura 1).
Nei pazienti del Gruppo B, sottoposti a sostituzione percutanea, sono stati riscontrati valori medi preoperatori di BNP pari a 388 pg/ml, il valore medi postoperatorio è risultato 397 pg/ml; l’analisi con test-t ha mostrato un innalzamento non significativo con p > 0,05 (Figura 2).
sAVR
BNPpre BNPpost 0 250 500 750 1000 1250*
pg/ m lFigura 1: Valori medi di BNP nella sAVR
pAVR BNPpre BNPpost 0 150 300 450 pg/ m l
L’ utilizzo di inotropi durante il decorso postoperatorio è stato necessario per 6 pazienti del Gruppo A e per nessuno del gruppo B. I pazienti che hanno richiesto trasfusioni sono stati 12 per il Gruppo A e 2 per il Gruppo B.
Il tempo di ventilazione meccanica necessario per i pazienti del Gruppo A è stato in media di 16 ore, per i pazienti del Gruppo B la ventilazione meccanica durante il decorso postoperatorio non è stata necessaria.
Il tempo trascorso in terapia intensiva è stato in media di 57 ore per i pazienti del Gruppo A, per i pazienti del Gruppo B la media è risultata 13 ore.
I risultati sono riassunti nella tabella 1.
Ventilazione Degenza UTI Inotropi Trasfusioni
pAVR 0 13 0 2
sAVR 16 57 6 12
Tabella1:
Media delle ore di ventilazione; media delle ore di degenza in terapia intensiva; numero di pazienti che hanno necessitato di inotropi durante il decorso postoperatorio; numero di pazienti trasfusi con GRC durante il decorso postoperatorio.6.4
DISCUSSIONE
Il BNP è un indice importante per la valutazione della malattia cardiaca. Generalmente pazienti in classe III-IV NYHA, con elevati livelli di BNP, presentano una disfunzione sistolica severa; comunque se la frazione di eiezione è > 50% la dispnea può essere giustificata da alterazioni diastoliche che causano una diminuzione del rilasciamento e della compliance, ciò spiega l’incremento delle pressioni di riempimento.
In accordo con molti studi elevati livelli di BNP (> 100 pg/ml) portano alla diagnosi di disfunzione diastolica e sono correlati con la severità della malattia tanto da determinare la prognosi (51, 52, 53).
I livelli preoperatori di BNP sono anche correlati con la gravità delle alterazioni cardiache indotte dalla stenosi aortica (54, 55); eventi cardiaci acuti perioperatori come infarto miocardico, scompenso cardiaco acuto e morte (56, 57); complicazioni postoperatorie.
Nei pazienti del Gruppo B, sottoposti a sostituzione percutanea, l’innalzamento del BNP dopo la procedura è risultato non significativo, a differenza della sostituzione chirurgica, Gruppo A, che ha provocato un innalzamento significativo dei valori dello stesso peptide.
Questo risultato ci suggerisce che la sostituzione percutanea ha un impatto trascurabile sulla funzione cardiaca ed in particolare sulla funzione diastolica. L’intervento chirurgico, invece, necessitando anche di circolazione extracorporea che altera la funzione diastolica e la compliance ventricolare (58, 59), incide ampiamente sulla funzione
cardiaca nell’immediato postoperatorio nonostante la risoluzione della patologia.
Il miglior impatto sulla funzione cardiaca della tecnica percutanea, dimostrato dalla non significatività dell’innalzamento dei livelli di BNP, è avvalorato dal fatto che nessun paziente del Gruppo B ha presentato alterazioni della contrattilità tali da richiedere la somministrazione di farmaci inotropi; al contrario 6 pazienti del Gruppo A hanno richiesto l’impiego di inotropi per il mantenimento di un’adeguata contrattilità.
Gli effetti favorevoli sulla funzione cardiaca sono correlati con una minor incidenza di complicazioni postoperatorie; dobbiamo però precisare che le complicazioni postoperatorie sono a loro volta associate alla durata della ventilazione meccanica e della degenza in terapia intensiva, dopo la procedura, le quali non sono influenzate solamente dalla funzionalità cardiaca.
La circolazione extracorporea è una procedura che causa alterazioni a livello soprattutto di polmone, rene e SNC, i danni sono dovuti a microemboli, che provocano alterazioni a livello del microcircolo, e all’attivazione dell’infiammazione; queste alterazioni influenzano negativamente il decorso dei pazienti, nei quali si riscontrano scambi gassosi alterati, contrazione della diuresi e difficoltà alla ripresa di coscienza, in relazione alla durata della circolazione extracorporea. Alterazioni a livello polmonare, influenzano negativamente lo svezzamento. Lo svezzamento dalla ventilazione meccanica è associato ad un incremento della richiesta di ossigeno, connessa sia all’aumento del lavoro respiratorio sia all’increzione delle
catecolamine endogene. L’aumento del consumo di ossigeno che ne deriva impone un aumento dello Stroke Volume, che può rappresentare uno stress cardiaco importante, in grado di esacerbare, in pazienti ad alto rischio, sia la sofferenza ischemica miocardica che un disfunzione ventricolare sinistra e/o destra (60).
La sostituzione valvolare aortica percutanea è una procedura che non necessita di circolazione extracorporea; i pazienti del Gruppo B non hanno richiesto assistenza ventilatoria dopo la procedura, al contrario i pazienti trattati chirurgicamente Gruppo A in media sono stati ventilati meccanicamente per 16 ore. Lo svezzamento del paziente dal ventilatore è necessario alla dimissione dal reparto di terapia intensiva, per pazienti che non hanno sequele neurologiche.
La dipendenza dal ventilatore e la permanenza in terapia intensiva espongono il paziente a complicazioni di tipo infettivo, anche molto gravi come la polmonite da ventilatore e la sepsi, che oltre a prolungare la degenza mettono in pericolo la vita dello stesso paziente.
Detto questo possiamo capire come i pazienti del Gruppo B abbiano trascorso in media solo 13 ore in terapia intensiva, mentre i pazienti del Gruppo A ne hanno trascorse 57.
Il sanguinamento è un’altra condizione che influenza l’outcome, il trattamento chirurgico della stenosi aortica prevede, oltre alla circolazione extracorporea che causa anche perdite ematiche, la sternotomia che implica un abbondante sanguinamento; la richiesta di trasfusioni ematiche proprio per queste ragioni è stata molto inferiore
per i pazienti del Gruppo B; solo due pazienti di questo gruppo sono stati trasfusi contro 12 del Gruppo A.
6.5 CONCLUSIONI
Questo studio conferma che la sostituzione aortica percutanea è una procedura idonea al trattamento di pazienti con stenosi aortica non trattabili chirurgicamente; in ragione della scarsa invasività della procedura la durata della ventilazione meccanica, la degenza in terapia intensiva e la richiesta di trasfusioni risultano inferiori rispetto alla sostituzione chirurgica. Anche la funzione cardiaca, sia sistolica che diastolica, risulta migliore dopo la sostituzione percutanea, infatti la procedura influenza meno i livelli plasmatici di BNP e nessun paziente ha necessitato di inotropi.
La sostituzione valvolare chirurgica rimane però il gold standard per la terapia della stenosi aortica, non ci sono infatti studi che dimostrino l’adeguatezza della procedura percutanea a lungo termine; non sappiamo se la CoreValve è un dispositivo che garantisce a lungo termine l’efficacia delle protesi chirurgiche, siano esse meccaniche o biologiche.
Ammesse queste considerazioni possiamo affermare che in un futuro prossimo, se il dispositivo CoreValve si dimostrerà tanto efficace quanto le protesi chirurgiche, la sostituzione percutanea potrà sostituire nella pratica clinica l’intervento chirurgico.
7. BIBLIOGRAFIA
1. Colombo P, Bruschi G, Bossi I, Pirola R, Klugmann S. Trattamento percutaneo delle valvulopatie: ruolo nella realtà clinica. G Ital Cardiol. 2008; 9:155-159.
2. Iung B, Baron G, Butchart EG, et al. A prospective survey of patients with valvular heart disease in Europe: the Euro Heart Survey on valvular heart disease. Eur Heart J. 2003; 24:1231-34. 3. Kividal P, Bergstrom R, Hate LG, Stahle E. Observed and relative
survival after aortic valve replacement. J Am Coll Cardiol. 2000; 35:747-756.
4. Rahimtoola SH. Aortic valve disease. In: Fuster V, Alexander RW, O’Rourke RA, eds. Hurst’s The Heart. 10th ed. New York, Mc Graw Hill; 2005:1667-95
5. Braunwald E. Cardiopatie valvolari. In: Braunwald, Zipes, Libby. Malattie del cuore, 6th ed. San Donato Milanese, Elsevier; 2004:1742-46.
6. Rahimtoola SH. Aortic valve disease. In: Fuster V, Alexander RW, O’Rourke RA, eds. Hurst’s The Heart. 11th ed. New York, Mc Graw Hill; 2005:1987-90.
7. Passik CS, et al. Temporal changes in the causes of aortic stenosis: a surgical pathologic study of 646 cases. Mayo Clin Proc. 1987; 62:119-123.
8. Otto CM, Lind BK, Kitzman DW, et al. Association of aortic valve stenosis with cardiovascular mortality and morbidity in the elderly. N Eng J Med. 1998; 341:142.
9. Melvin D, Cheitlin MD. Pathophysiology of valvular aortic stenosis in the elderly. The American Journal of Geriatric Cardiology. 2003; 12:173-176.
10. Boudoulas H, Gravanis MB: Valvular heart disease. In: Gravanis MB, eds. Cardiovascular disorders: pathogenesis and pathophysiology. St. Louis, CV Mosbby CO; 1993:64.
11. Guarracino F. L’ecocardiografia transesofagea in area critica. Elsevier Masson 2008 in press.
12. Rahimtoola SH. Perspective on valvular heart disease: Update II. In: Kuoebel S, ed. An Era in Cardiovascular Medicine. New York: Elsevier; 1991:45-70.
13. Carabello BA. Aortic stenosis. Cardiol Rev. 1993; 1:64.
14. Schwartz LS, Goldfischer J, Sprague GJ, Schwartz SP. Syncope and sudden death in aortic stenosis. Am J Cardiol. 1969; 23:647. 15. Cowie MR, Struthers AD, Wood DA, Coats AJS, Thompson SG,
et al. Value of natriuretic peptides in assessment of patients with possible new heart failure in primary care. Lancet. 1997; 350:1349-53.
16. Prahash A, Lynch T. B-type natriuretic peptide: a diagnostic, prognostic and therapeutic tool in heart failure. American Journal of Critical Care. 2004; 13:46-55.
17. de Lemos JA, Mc Guire DK, Drazner MH. B-type natriuretic peptide in cardiovascular disease. Lancet. 2003; 362:316-322.
18. Qi W, Mathiesen P, Kjekhus J, et al. Natriuretic peptides in patients with aortic stenosis. Am Heart J. 2001; 142:725-732. 19. Maisel AS, Krishnaswamy P, Nowak RM, et al. Rapid
measurement of B-type natriuretic peptide in the emergency of heart failure. N Eng J Med. 2002; 347:161-167.
20. Gerber IL, Stewart RA, Legget ME, et al. Increased plasma natriuretic peptide levels reflect symptom onset in aortic stenosis. Circulation. 2004; 107:1884-90.
21. Talwar S, Downie PF, Squire IB, Davies JE, Barnett DB, Ng LL. Plasma N-terminal pro BNP and cardiotrophin-I are elevated in aortic stenosis. Eur J Heart Fail. 2001; 3:15-19.
22. Qi W, Mathiesen P, KjeKshus J, Simonsen S, Bjornerheim R, Endersen K, Hall C. Natriureti peptides in patients with aortic stenosis. Am Heart J. 2001; 142:725-732.
23. Brookes CI, Kemp MW, Hooper J, Oldershaw PJ, Moat NE. Plasma brain natriuretic peptide concentration in patients with chronic mitral regurgitation. J Heart Valve Disease. 1997; 6:608- 612. Karen K Stout, Catherine M Otto. Indications for aortic valve replacement in aortic stenosis. Journal of Intensive Care Medicine. 2007; 22:18-22.
24. Karen K Stout, Catherine M Otto. Indication for aortic valve replacement in aortic stenosis. Journal of Intensive Care Medicine. 2007; 22:18-22.
25. Vahanian A, Alfieri O, et al. Transcatheter valve implantation for patients with aortic stenosis: a position statement from the European Association of Cardio-Thoracic Surgery (EACTS) and
the European Society of Cardiology (ESC), in collaboration with the European Association of Percutaneous Cardiovascular Interventions (EAPCI). European Heart Journal. 2008; 29:1463-70.
26. Grube E, et al. Percutaneous aortic valve replacement for severe aortic stenosis in high risk patients using the second-and current third-generation self expanding CoreValve prosthesis. JACC. 2007; Vol. 50, No. 1:69-76.
27. Bonow RO, Carabello BA, Kanu C, et al. ACC/AHA 2006 guidelines for the menagement of patient with valvular hear disease: a report of the American College of Cardiology/American Heart Association task force on pratice guidelines: developed in collaboration with the Society of Cardiovascular Anaesthesiologists: endorsed by the Society of Thoracic Surgeons. Circulation. 2006; 114:84-231.
28. Vahanian A, et al. Task force on the management of valvular heart disease of the European Society of Cardiology. European Heart Journal. 2007; 28:230-268.
29. Edwards FH, Petersen ED, et al. Predication of operative mortality after valve replacement surgery. J Am Coll Cardiol. 2001; 37:885-892.
30. Dewey TM, Brown D, Ryan WH, et al. Reliability of risk algorithms in high risk patients undergoing aortic valve replacement. J Torac Cardiovasc Surg. 2008; 135:180-187.
31. Grube E, et al. Protocollo per la selezione dei pazienti candidate a sostituzione valvolari aortica percutanea mediante protesi CoreValve. Circulation; 114:1616-24.
32. Moss RR, Ivens E, Pasupati S, Humphires K, Thompson CR, Munt B, Sinhal A, Webb JG. Role of echocardiography in Percutaneous aortic valve implantation. J Am Coll Cardiol Imaging. 2008; 1:15-24.
33. Webb JG, et al. Percutaneous aortic valve implantation retrograde from the femoral artery. Circulation. 2006; 113:842-850.
34. Hammon JWi. Extracorporeal circulation: perfusion system. In: Cohn LH, eds. Cardiac Surgery in the Adult. New York, Mc Graw Hill. 2008:350-370.
35. Banbury MK, Cosgrave DM 3rd. Arterial cannulation of the innominate artery. Ann Thorac Surg. 2000; 69:957.
36. Mills NL, Everson CT. Atherosclerosis of the ascending aorta and coronary artery by-pass: pathology, clinical correlates, and management. J Thorac Cardiovasc Surg. 1991; 102:546.
37. Watson BG. Unilateral cold neck. Anaesthesia. 1983; 38:659. 38. Salama FD, Blesovsky A. Complication of cannulation of the
ascending aorta for open heart surgery. Thorax. 1970; 25 604. 39. Hammon JWi. Extracorporeal circulation: organ damage. In: Cohn
LH, eds. Cardiac Surgery in the Adult. New York, Mc Graw Hill. 2008:389-414.
40. Mentzer R Mi Jr., Jahania M Si, Lasley R Di. Myocardial protection. In: Cohn LH, eds. Cardiac Surgery in the Adult. New York, Mc Graw Hill. 2008:443-464.