Indice
Indice ...1
Riassunto ...3
Introduzione...6
1 Generalità sui tumori della testa e del collo...10
1.1 Eziopatogenesi ed istologia ...10
1.2 Descrizione clinica...12
1.3 Stadiazione...13
1.4 Fattori prognostici...14
2 Problematiche del trattamento ...16
2.1 Problematiche legate alla biologia della malattia ...16
2.2 Problematiche legate al paziente ...17
2.3 Problematiche legate alla scelta terapeutica ...18
3 Trattamento...19
4 Nuove prospettive terapeutiche ...23
4.1 Recettore del fattore di crescita epidermico ...24
4.1.2 Attivazione della via del segnale ...26
4.1.3 Inibizione del segnale ...29
4.2 Ruolo fisiologico del fattore di crescita epidermico...29
4.3 EGFR e neoplasie ...30 4.4 Cetuximab...34 4.4.1 Proprietà farmacodinamiche...34 4.4.2 Proprietà farmacocinetiche ...36 4.4.3 Studi clinici...36 4.5 Tossicità...40
4.5.1 Tossicità cutanea e degli annessi ...40
4.5.2 Reazioni di ipersensibilità ...43
4.5.3 Altre manifestazioni ...44
5 La nostra esperienza ...45
5.1.1 Cetuximab...45 5.1.2 Radioterapia...46 5.2 I nostri pazienti ...48 5.3 Risultati...70 5.4 Discussione ...73 6 Conclusioni ...77 BIBLIOGRAFIA ...78
Riassunto
Le neoplasie del distretto cervico-facciale rappresentano un gruppo di lesioni tumorali piuttosto eterogeneo, che in base alla sede di insorgenza possono diversificarsi per istotipo, storia naturale e responsività ai trattamenti, pertanto vengono suddivise in vari sottogruppi che si differenziano per caratteristiche biologiche, incidenza, prognosi e terapia.
L’istototipo squamoso è il più frequente, e rappresenta circa l’80-90% di tutte le neoplasie di questo distretto anatomico.
Per queste neoplasie non è ancora stato messo a punto un trattamento ottimale, anche se l’atteggiamento terapeutico più diffuso prevede nelle forme diagnosticate in uno stadio precoce un trattamento chirurgico o radioterapico esclusivo, mentre nelle forme localmente avanzate, che sono le più frequenti, può trovare indicazioni la chirurgia seguita da radioterapia se la malattia è operabile, oppure un trattamento radiochemioterapico concomitante.
Negli ultimi anni i risultati terapeutici sono migliorati, ma rimangono ancora insoddisfacenti; infatti, se nei casi di malattia in stadio I o II le probabilità di guarigione sono buone con sopravvivenze a 5 anni comprese rispettivamente tra 80-90% e 65-80% [1,2,3], per stadi III e IV la sopravvivenza globale a 5 anni è del 30-40% [4,5].
Attualmente nei pazienti non elegibili per chirurgia a causa di età e condizioni generali, il trattamento più utilizzato è la radioterapia esclusiva per gli stadi intermedi, e la radiochemioterapia concomitante con cisplatino per le forme localmente avanzate. L’associazione radiochemioterapica ha sicuramente migliorato i risultati clinici [6], ma nel contempo ha provocato un incremento di tossicità locale e sistemica che ne limita l’applicazione in pazienti con scadenti condizioni generali, e talvolta impone l’interruzione del programma. Risulta infatti che circa 1/3 dei pazienti elegibili per RT + CT con lo schema Cisplatino 100 mg/m2 ogni 3 settimane, abbiano una scarsa compliance al trattamento [7,8].
Le recenti acquisizioni di biologia molecolare hanno portato a sviluppare il concetto di modulazione selettiva della risposta del tumore mediante “target therapy”, ovvero terapia con farmaci a bersaglio molecolare in grado di colpire in modo più selettivo le cellule
neoplastiche, spesso caratterizzate da iperespressione di alcune molecole deputate al controllo della proliferazione.
Tra le molecole più studiate come bersaglio molecolare ci sono i recettori per i fattori di crescita; in particolare il recettore per il fattore di crescita epidermico (EGFR) ha dimostrato un importante ruolo non solo nella patogenesi del carcinoma squamoso della testa e del collo, dove è iperespresso nella quasi totalità delle neoplasie [9], ma anche nella sua responsività a radio e chemioterapia. L’utilizzo di un anticorpo monoclonale (Cetuximab) diretto contro EGFR permette di bloccare il segnale di trasduzione per la crescita tumorale [10] aumentando inoltre la radiosensibilità delle cellule neoplastiche, come dimostrato da studi condotti su xenotrapianti murini di tumori umani [11].
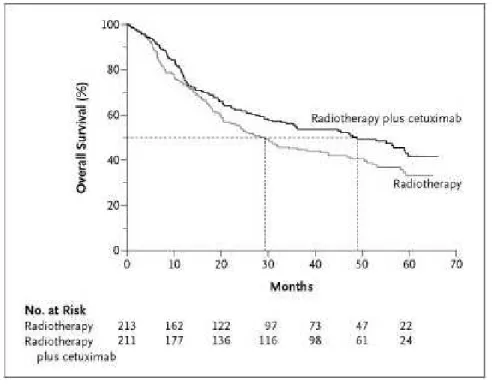
In ambito clinico l’efficacia di Cetuximab è stata dimostrata da uno studio di fase III condotto da Bonner e pubblicato nel 2006 [12], nel quale 424 pazienti con neoplasie squamose localmente avanzate della regione testa-collo sono stati randomizzati in due gruppi, uno trattato con RT esclusiva ed uno con RT + Cetuximab; da questo confronto è emerso che l’associazione migliora in modo statisticamente significativo sia la sopravvivenza sia il controllo loco-regionale. La sopravvivenza globale mediana a 3 anni nel braccio con l’associazione è aumentata di 20 mesi, così come risulta incrementata dal 45% al 55% la percentuale di sopravvivenza a 3 anni. Il trattamento con Cetuximab e RT sembra associato ad una riduzione del 26% del rischio di morte rispetto alla RT esclusiva e ad una durata mediana del controllo loco-regionale più lunga di 9,5 mesi (24,4 vs 14,9). Nel braccio con l’associazione, a fronte di tali migliori risultati non è stato osservato un incremento della tossicità, contrariamente a quanto si verifica con radiochemioterapia concomitante a base di CDDP.
Visti questi risultati preliminari, presso la Divisione di Radioterapia dell’Università di Pisa dal Febbraio 2007 è iniziata un’esperienza con l’associazione Cetuximab-RT per il trattamento di pazienti affetti da carcinoma squamoso localmente avanzato della regione testa-collo.
Nel periodo compreso tra Febbraio 2007 ed Agosto 2008 sono stati selezionati 6 pazienti con buon “performance status”, alcuni dei quali non erano elegibili per il trattamento standard radiochemioterapico a base di CDDP o per l’intervento chirurgico.
In questi pazienti abbiamo valutato innanzitutto la tolleranza dell’associazione e la risposta terapeutica ottenuta al termine del trattamento.
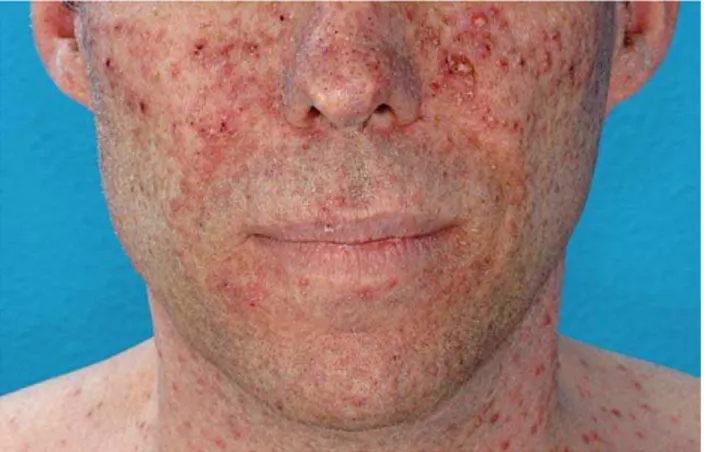
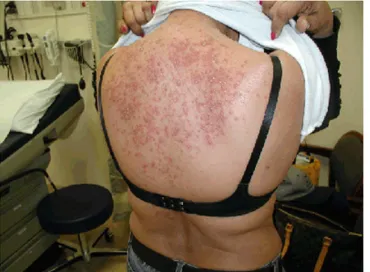
Il programma RT e Cetuximab è stato completato in 4 pazienti, che lo hanno ben tollerato, manifestando tossicità di media entità, alla RT ed al farmaco. La RT ha causato mucositi con disfagia ed eritemi cutanei, talvolta accompagnati da epiteliolisi; l’anticorpo ha provocato la comparsa di rash acneiforme, ipotensione, cefalea ed un episodio febbrile che non hanno richiesto terapia specifica, ma esclusivamente farmaci sintomatici, e non hanno modificato il programma radioterapico.
In 2 pazienti le reazioni a Cetuximab sono state più importanti: nel primo caso è stato interrotto alla VI somministrazione per comparsa di manifestazioni di ipersensibilità, in particolare laringospasmo, malgrado la premedicazione con steroidi già introdotta per insorgenza di brivido ed ipotensione; nel secondo paziente, la reazione a Cetuximab è stata più grave, e si è manifestata durante l’infusione della dose di induzione con una sintomatologia di shock anafilattico, risoltosi con adrenalina, steroidi e sostituti plasmatici e conseguente sospensione definitiva del farmaco.
I pazienti che hanno portato a termine il programma terapeutico hanno avuta buona risposta, ed a conclusione del trattamento non presentavano segni clinici di malattia, come confermato anche da indagini strumentali. Due di loro sono deceduti dopo 4 e 5 mesi, ma la causa del decesso non è imputabile né a ripresa di malattia né a complicanze delle terapie, bensì a complicanze post-chirurgiche, ed a compromissione delle condizioni generali. Il follow-up di questa piccola casistica è ancora troppo breve, e non ci permette di fare valutazioni sul controllo loco-regionale e sulla sopravvivenza globale, che costituiscono un obiettivo futuro; tuttavia nei primi due pazienti trattati, a distanza di 12 e 13 mesi non si osservano né ripresa loco-regionale di malattia, né ripetizioni a distanza.
La nostra limitata esperienza conferma che la combinazione Cetuximab + RT può essere considerata un’efficace e ben tollerata alternativa alla CRT in pazienti con neoplasie squamose della regione testa-collo ad alto rischio non elegibili per chemioterapia, ma potrebbe rappresentare il trattamento di scelta in pazienti con malattie a rischio intermedio per i quali il raggiungimento di un soddisfacente controllo loco-regionale non giustifica la tossicità da CRT. Rimane la necessità di confrontare i risultati terapeutici di Cetuxmab + RT con quelli della CRT in studi randomizzati su ampia casistica.
Introduzione
I tumori squamosi del distretto cervico-facciale sono un’importante causa di morte per neoplasia, e sebbene negli ultimi decenni le nuove opzioni terapeutiche nell’ambito della cura dei tumori abbiano consentito notevoli miglioramenti dei risultati, la prognosi di queste neoplasie rimane scadente, soprattutto per le forme localmente avanzate [13,14], che sono presenti in circa il 50% dei pazienti alla diagnosi [15].
Il trattamento di questi tumori è reso complesso da vari aspetti, in primo luogo la natura stessa delle neoplasie, in genere scarsamente responsive ai trattamenti chemioterapici e radioterapici sia per caratteristiche cellulari intrinseche, sia perché spesso si tratta di masse di grosse dimensioni non ben vascolarizzate e talvolta necrotiche, in cui la diffusione dei farmaci risulta scarsa e l’efficacia delle radiazioni ionizzanti è ridotta per la bassa tensione di ossigeno che rappresenta il principale radiosensibilizzante.
Un’altra problematica da affrontare nel trattamento di queste neoplasie è legata alla tipologia dei pazienti, che per l’abuso di alcol e fumo possono presentarsi in condizioni generali scadenti, oltre ad avere quadri di comorbilità importanti, quali malattie metaboliche, cardiovascolari, respiratorie, che contribuiscono a peggiorare la prognosi per le loro caratteristiche evolutive, e perché possono condizionare la scelta del programma terapeutico o comprometterne il completamento.
D’altro canto la necessità di utilizzare schemi terapeutici aggressivi, aumenta il rischio di tossicità acuta e tardiva, in maggior misura in pazienti già debilitati.
Il trattamento delle neoplasie testa-collo localmente avanzate crea i maggiori problemi, infatti se nella malattia in stadio iniziale la chirurgia o la radioterapia esclusive in genere ottengono buoni risultati, negli stadi III o IV la sopravvivenza globale a 5 anni è del 15-25% [16] ed il controllo loco-regionale di malattia è ottenuto soltanto nel 30% dei pazienti [7,17].
In presenza di malattia resecabile lo standard terapeutico è considerato la chirurgia seguita da RT adiuvante, mentre per le forme non resecabili è indicato un trattamento radiochemioterapico concomitante con cisplatino (CDDP), alla dose di 100 mg/m2 ogni 3 settimane o di 40 mg/m2 settimanale [7,8]. L’associazione del chemioterapico tende ad
tossicità ematologiche e renali, che in pazienti con un “performance status” non buono possono peggiorare notevolmente il quadro generale, impedendo talvolta di portare a termine il programma.
Negli ultimi anni in questa patologia si è cercato di mettere a punto trattamenti più efficaci utilizzando modalità di frazionamento non convenzionale della RT, ad esempio l’iperfrazionamento od il frazionamento accelerato che hanno dato buoni risultati in termini di efficacia, ma purtroppo anche un aumento significativo delle tossicità [18], mentre sul versante farmacologico i maggiori sforzi sono stati focalizzati alla ricerca di chemioterapici con maggior efficacia terapeutica e minor tossicità, da associare alla radioterapia prevalentemente con modalità concomitante o neoadiuvante.
Se CDDP e 5-FU sono le molecole più utilizzate nelle neoplasie testa-collo, di recente ad esse si sono aggiunti i Taxani [19,20], che hanno dimostrato una buona attività terapeutica e ridotta tossicità sulle mucose. Gli effetti collaterali provocati a tale livello da radio e chemioterapia sono di particolare rilievo clinico, e possono rappresentare un importante fattore limitante la prosecuzione del trattamento, per cui la possibilità di ridurne l’entità consentirebbe maggior aggressività terapeutica nell’ottica di migliorare i risultati. La disponibilità di queste nuove molecole ha portato a valutare la combinazione di chemioterapia neoadiuvante [21] seguita da CT concomitante a RT per consentire di sfruttare i vantaggi di entrambe le modalità, ovvero migliorare il controllo loco-regionale con la CRT, e ridurre le ripetizioni a distanza per effetto della CT di induzione su eventuali micrometastasi, migliorando la sopravvivenza globale [22].
La ricerca farmacologica negli ultimi anni ha subito un’importante evoluzione, ed anche per i tumori della regione testa-collo le recenti acquisizioni in ambito molecolare sulla biologia delle neoplasie, e la messa a punto di farmaci a bersaglio molecolare, che caratterizzano la “target therapy”, sembrano aver aperto la strada ad altre possibilità di trattamento. Questi nuovi farmaci sono in grado di legare selettivamente alcune molecole, ed identificando quelle iperespresse sulle cellule tumorali possono colpirle in modo abbastanza selettivo risparmiando i tessuti sani e riducendo quindi notevolmente la tossicità del trattamento. Tra i bersagli più studiati troviamo EGFR, cioè il recettore per il fattore di crescita epiteliale, molecola che è iperespressa in varie neoplasie ed in particolare nella quasi totalità di quelle squamose del distretto cervico-facciale [9]. Aumentati livelli di questo
recettore sono responsabili di proliferazione incontrollata delle cellule, aumentata sopravvivenza, neoangiogenesi e maggior resistenza alle radiazioni [23]; di conseguenza un’iperespressione nelle neoplasie correla con un aumento dell’aggressività di malattia, minor sopravvivenza globale e sopravvivenza libera da malattia, e maggior rischio di recidive loco-regionali [24].
I farmaci diretti verso tali recettori possono bloccare la sequenza di eventi che attivano la proliferazione tumorale. Tra questi, Cetuximab è un anticorpo monoclonale di classe IgG in grado di legare EGFR, impedendone la dimerizzazione e la conseguente attivazione della via del segnale; recentemente è stato introdotto nel trattamento dei tumori metastatici del colon-retto in associazione ad Irinotecano e nel trattamento dei tumori squamosi localmente avanzati di testa e collo in asssociazione a RT [23].
Le prime acquisizioni relative all’efficacia di questo farmaco in associazione alla RT sono state ottenute da esperimenti in vitro che hanno dimostrato come il legame tra anticorpo e recettore aumenti la radiosensibilità delle cellule, riducendo la riparazione del danno indotto dalle radiazioni [25]. Studi su xenotrapianti murini di tumori umani hanno dimostrato che l’anticorpo migliora il controllo delle neoplasie rispetto alla sola RT e riduce la dose di radiazione necessaria al controllo tumorale [11].
Bonner ha condotto il più ampio studio randomizzato di fase III [12] confrontando l’associazione RT + Cetuximab rispetto alla RT esclusiva in 424 pazienti affetti da carcinoma squamoso localmente avanzato della regione testa-collo ed ha riportato miglioramenti statisticamente significativi della sopravvivenza e del controllo locoregionale a 3 anni, senza rilevare incremento di tossicità.
Studi successivi hanno valutato la tollerabilità di Cetuximab che è risultata buona [26], con tossicità prevalentemente caratterizzata da effetti lievi-moderati a livello cutaneo, o da reazioni di ipersensibilità anch’esse prevalentemente di gravità lieve o moderata; raramente è stata documentata l’interruzione temporanea o definitiva della somministrazione del farmaco, contrariamente a quanto può accadere in corso di trattamenti con chemioterapici. Visti questi risultati preliminari, presso il reparto di Radioterapia dell’Università di Pisa è stata realizzata un’esperienza con Cetuximab + RT in 6 pazienti affetti da carcinoma squamoso localmente avanzato del testa-collo, trattati nel periodo Febbraio 2007-Agosto
Il limitato numero della nostra casistica è motivato dall’esigenza di selezionare adeguatamente i pazienti in base a P.S., non elegibilità per il trattamento RT + CT convenzionale, accettazione da parte del paziente di uno schema in fase di validazione. L’obiettivo di questa esperienza è valutare la tolleranza al trattamento ed il controllo locale di malattia, ed in seguito, con un adeguato follow-up, sarà possibile anche valutare l’intervallo libero da malattia e la sopravvivenza globale.
1 Generalità sui tumori della testa e del collo
1.1 Eziopatogenesi ed istologia
L’incidenza dei tumori squamosi di testa e collo è molto variabile a seconda delle aree geografiche, anche se si calcola che in Europa come negli Stati Uniti rappresentino circa il 5% di tutte le neoplasie maligne con un rapporto M/F di 3 a 1.
L’età dei soggetti colpiti è in genere compresa tra i 50 e i 70 anni, e la familiarità come per altre neoplasie sembra rilevante e si riscontra in circa il 10% dei pazienti [13].
Il principale fattore di rischio per questi tumori è l’esposizione al tabacco, in particolare al fumo di sigaretta, seguito in ordine di importanza dall’abuso di alcol che ha effetto sinergico col fumo; la presenza di entrambi i carcinogeni aumenta il rischio di circa 2,5 volte rispetto alla somma dei rischi associati ai singoli fattori. Sebbene non sia stato ancora provato, si ritiene che l’alcol agisca come solvente dei cancerogeni contenuti nel fumo; è possibile anche ipotizzare un effetto sulla loro metabolizzazione epatica ed un’attività lesiva sulle mucose, che determinando un effetto flogistico cronico agirebbe da cocancerogeno. Non è da escludere infine un’azione indiretta legata ai deficit nutrizionali che sono frequenti nei soggetti che abusano di alcol, infatti risultano più esposti al rischio neoplastico soggetti con una dieta poco variata, soprattutto povera di frutta e verdura e quindi di vitamine, che hanno un importante ruolo protettivo [27].
In alcuni casi sono state chiamate in causa anche infezioni da papilloma virus, in particolare le tipologie 16 e 18, ad alto potere oncogeno, come pure il virus di Epstein Barr, che sembrerebbe coinvolto nell’eziologia del tumore del rinofaringe [28].
Fenomeno frequente di cui occorre tener conto nella valutazione di questi pazienti è l’insorgenza di carcinomi multipli, sincroni o metacroni che si osservano rispettivamente nel 5-10% e nel 10-20% dei casi e che si sviluppano non solo a livello cervico-facciale, ma anche a livello polmonare o esofageo a causa di un comune fattore di rischio, rappresentato essenzialmente dal fumo di sigaretta, che agisce a livello di ampie aree degli epiteli delle alte vie digerenti e del tratto respiratorio.
recidive sono piuttosto precoci e si osservano entro i primi 2-3 anni; superato questo periodo il rischio maggiore è costituito dai secondi tumori che compaiono in circa il 2-3 % dei pazienti.
A livello del distretto cervico-facciale possiamo riscontrare diverse forme neoplastiche che riflettono l’eterogeneità dei tessuti presenti, e sono rappresentate principalmente dai seguenti istotipi:
• Carcinoma squamocellulare, caratterizzato da spiccata tendenza all’invasione locoregionale, precoci metastasi linfonodali, ripetizioni a distanza più rare e tardive. • Carcinoma indifferenziato, con minore tendenza all’invasione locale, ma spiccata
tendenza a formare secondarismi in tempi relativamente brevi.
• Carcinoma adenoideo-cistico, a lento accrescimento locale, tendenza alla progressione lungo le guaine perineurali, elevata percentuale di recidive loco-regionali, frequenti ripetizioni polmonari.
• Adenocarcinoma, con atteggiamento biologico analogo al carcinoma adenoideo-cistico ma con evoluzione locale più rapida.
Circa il 90% dei tumori maligni di testa e collo sono rappresentati da carcinomi squamocellulari, distinti in diversi gradi di differenziazione in base alla quantità di cheratina prodotta, all’atipia degli elementi cellulari ed al numero di mitosi. Tali gradi vengono usualmente indicati come G1 o ben differenziato, G2 o moderatamente differenziato, G3 o scarsamente differenziato. L’utilizzo del grado G4 proposto in passato non sembra adeguato poiché indicherebbe un quadro indifferenziato e molti tumori definiti come tali ad esami più accurati sono risultati non appartenere al tipo squamoso.
Come accade per neoplasie di origine epiteliale di altre sedi anatomiche, lo sviluppo del carcinoma squamocellulare di testa e collo è frequentemente preceduto da lesioni intraepiteliali precancerose, talvolta riconoscibili sia clinicamente sia dal punto di vista istopatologico, ed a cui corrispondono spesso a livello genetico e molecolare alterazioni che sono state almeno in parte identificate. Si considerano lesioni precancerose, con un crescendo di alterazioni morfologiche e di potenzialità evolutiva la cheratosi, l’iperplasia squamosa benigna e la displasia da lieve a severa.
Queste neoplasie, indipendentemente dalla sede di origine hanno in comune non solo l’eziopatogenesi, ma anche la tendenza spiccata all’invasione locale, infiltrando i piani sottomucoso e muscolare in tempi più o meno brevi, e la metastatizzazione per lo più per via linfatica, anche se con frequenza diversa a seconda della sede di insorgenza della malattia iniziale. Infatti la maggiore o minore ricchezza di rete linfatica a livello di una regione anatomica condiziona la diversa incidenza di metastasi linfonodali, che nel distretto cervico-cefalico sono più frequenti ad esempio nelle neoplasie di rinofaringe ed ipofaringe, e praticamente assenti nei tumori glottici.
In generale, fatta eccezione per quest’ultima sede, il distretto testa-collo è molto ricco di vasi linfatici e linfonodi, che si calcola siano in numero variabile tra 150 e 300, cioè circa 1/3 di tutti i linfonodi presenti nell’organismo, e spesso precocemente interessati dalla neoplasia con conseguenti implicazioni prognostiche.
Rare invece sono le metastasi a distanza; la loro frequenza oscilla tra il 3% e il 18%, e l’organo più frequentemente colpito è il polmone, seguito dal fegato.
1.2 Descrizione clinica
Dal punto di vista macroscopico le neoplasie della regione testa-collo possono presentarsi con quadri molto diversi: lesioni ulcerate, infiltranti, sessili, peduncolate o vegetanti.
Possono essere diagnosticate del tutto casualmente o in corso di visite odontoiatriche o otorinolaringoiatriche per comparsa di sintomatologia o per riscontro di linfoadenopatie, che non di rado sono il primo segno di malattia.
I sintomi d’esordio sono variabili e dipendono soprattutto dalla sede anatomica coinvolta. Il paziente può riferire la presenza di una lesione visibile che non guarisce, può lamentare difficoltà nella masticazione o nella fonazione quando sono infiltrati i muscoli della lingua, oppure disfagia, odinofagia, senso di corpo estraneo, raucedine persistente e dolore localizzato o diffuso. Neoplasie in fase avanzata possono provocare più di uno di questi sintomi, indipendentemente dalla sede di insorgenza della lesione iniziale. Possibile riscontrare “foetor ex ore” in assenza di lesioni visibili, oltre a sintomi neurologici e linfoadenopatie.
Le stazioni linfonodali coinvolte variano in base alla localizzazione del tumore primitivo, ma in genere l’interessamento dei linfonodi avviene per livelli anatomici contigui, anche se occasionalmente può esserci un salto di stazione.
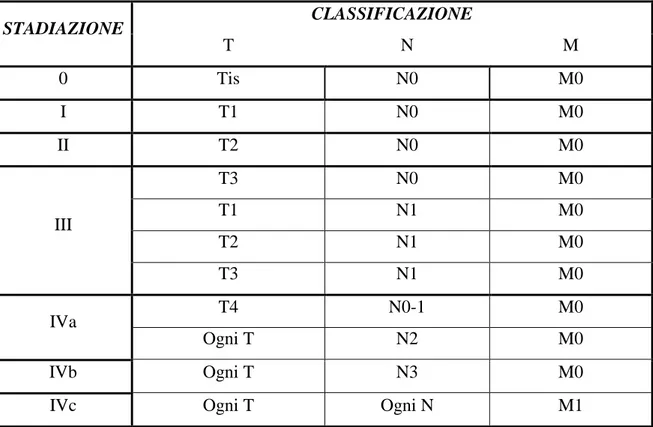
1.3 Stadiazione
La stadiazione di queste neoplasie è effettuata con il sistema TNM, che è stato più volte modificato negli anni per consentire una classificazione più accurata possibile, in quanto da essa deriverà la scelta terapeutica che assicuri il migliore risultato oncologico con minor sacrificio della funzione d’organo e dell’estetica.
Il parametro T viene definito in modo variabile per le diverse sedi, basandosi sulle dimensioni del tumore quando esso si sviluppa in sedi dove è possibile misurarlo quali il labbro, la cavità orale e l’orofaringe, mentre in altri casi si definisce in base al coinvolgimento di sottosedi, quali ad esempio i seni pririformi o l’area postcricoidea per l’ipofaringe oppure le aree glottica, sopraglottica o sottoglottica per la laringe.
La definizione dell’interessamento linfonodale indicata con N si basa per lo più su dimensioni, livello e lateralità dei linfonodi coinvolti.
La presenza o meno di metastasi a distanza è indicata dal parametro M.
Nell´edizione TNM del 2004 per questi tumori è stata introdotta la suddivisione in T4a e T4b, a seconda dell´estensione loco-regionale di malattia, con l´intento di definire i tumori resecabili (T4a) e quelli non resecabili (T4b) con raggruppamento in tre stadi IV (a, b, c) in relazione alla resecabilità del T, all’estensione di N ed alla presenza di metastasi a distanza [29].
Probabilmente la classificazione subirà ulteriori modifiche nei prossimi anni, poiché in quella attuale non viene dato particolare rilievo ad alcuni parametri che risultano invece molto importanti nella pratica clinica; fra questi vengono segnalate la morfologia esofitica o infiltrante del tumore, alcune caratteristiche istopatologiche come l´infiltrazione perineurale o linfo-ematica e caratteristiche biologico-molecolari, che condizionano la prognosi.
Per stadiare la malattia attualmente si utilizzano i criteri definiti dall’American Joint Committee on Cancer come di seguito riportato (tab. 1.1).
CLASSIFICAZIONE STADIAZIONE T N M 0 Tis N0 M0 I T1 N0 M0 II T2 N0 M0 T3 N0 M0 T1 N1 M0 T2 N1 M0 III T3 N1 M0 T4 N0-1 M0 IVa Ogni T N2 M0 IVb Ogni T N3 M0
IVc Ogni T Ogni N M1
Tabella 1.1: criteri di stadiazione dell’AJCC
1.4 Fattori prognostici
Lo stadio di malattia ed il “performance status” del paziente sono i principali fattori prognostici per le neoplasie del distretto testa-collo.
L’importanza rivestita dall’estensione loco-regionale è documentata dalla sopravvivenza globale a 5 anni, compresa tra l’80% e il 90% per malattia in stadio I, tra il 65% e l’80% per malattia in stadio II [1,2,3], riducendosi notevolmente per gli stadi successivi; nel caso di malattia localmente avanzata e non resecabile trattata con chemioradioterapia la sopravvivenza a 5 anni oscilla tra il 30% e il 50% [4,5].
Anche il “performance status” (P.S.), che definisce le condizioni generali del paziente gioca un ruolo primario sulla prognosi di questa patologia, in particolare sono importanti lo stato di nutrizione e le comorbilità, tra cui le malattie cardiocircolatorie, epatiche o cerebrovascolari che riducono notevolmente la probabilità di sopravvivenza, sia per la loro evoluzione clinica, sia per le difficoltà ad effettuare trattamenti aggressivi per il controllo di malattia.
La prognosi scadente di queste neoplasie ha motivazioni diverse, tra cui lo stadio localmente avanzato alla diagnosi di buona parte dei pazienti [13], anche se i casi con metastasi a distanza sono infrequenti [30]; la radio-chemioresistenza della malattia legata alle caratteristiche di ripopolamento cellulare, all’ipossia, alle capacità di recupero del danno e le pesanti tossicità che limitano il dosaggio dei trattamenti radio e chemioterapici.
2 Problematiche del trattamento
Il trattamento delle neoplasie testa-collo localmente avanzate è molto complesso e nonostante i progressi nelle conoscenze oncologiche e nelle procedure terapeutiche, rimangono ancora aperte numerose problematiche, correlate alla biologia della malattia, al paziente ed al trattamento.
2.1 Problematiche legate alla biologia della malattia
Benchè le neoplasie squamose della regione cervico-facciale siano comunemente considerate un’entità patologica unica, il comportamento biologico nell´ambito delle diverse sottosedi anatomiche può variare in misura sensibile, come del resto la risposta terapeutica. Due esempi estremi sono rappresentati dal tumore del rinofaringe e dell’ipofaringe. Nel primo caso si tratta di un tumore che risponde molto bene all’associazione radio-chemioterapica, tanto da non essere preso in considerazione negli studi focalizzati alla valutazione di nuovi schemi terapeutici come la target therapy. Il tumore dell’ipofaringe invece è un tumore a prognosi peggiore sia perché spesso a diagnosi tardiva, per la scarsa accessibilità di questa zona ad una valutazione clinica rispetto ad altre sedi del distretto testa-collo, sia perché meno responsivo ai trattamenti attuati, inoltre in questa sede è maggiore che in altre la probabilità di riscontrare forme a minor grado di differenziazione, però non è stato ancora definito se ciò è dovuto a caratteristiche biologiche intrinseche della neoplasia presenti “ab initio” o sviluppatesi nel tempo e dipendenti dal ritardo diagnostico [13].
Le neoplasie squamose della testa e del collo non sono considerate particolarmente responsive a radio e chemioterapia, pertanto la mortalità per malattia rimane piuttosto elevata e questo spiega l’ulteriore ricerca di nuove soluzioni terapeutiche.
La scarsa radio-chemiosensibilità può essere legata non solo a caratteristiche cellulari intrinseche, ma anche ad una insufficiente vascolarizzazione delle lesioni, soprattutto nelle zone centrali, dove la compressione dei piccoli vasi neoformati impedisce una buona diffusione dei farmaci e dell’ossigeno.
danno cellulare attraverso la produzione di radicali liberi; viene stimato infatti che in condizioni di ipossia si può rendere necessario incrementare di 3 volte la dose per ottenere lo stesso danno sulle cellule neoplastiche.
2.2 Problematiche legate al paziente
Il paziente affetto da tumore squamoso del distretto cervico-facciale ha spesso uno stile di vita che lo espone anche ad altre patologie di tipo metabolico, cardiovascolare e respiratorio.
Dato che alcol e tabacco risultano i principali fattori di rischio per questo tipo di tumore, non è infrequente il riscontro di quadri di etilismo conclamato, nei quali i danni diretti dell’alcol si sommano a danni indiretti, con situazioni patologiche complesse.
L’alcol non solo ha un grave effetto tossico sul fegato, dove causa cirrosi con conseguente ipertensione portale ed insufficienza d’organo, ma aumenta anche il rischio di cardiomiopatia dilatativa per un danno diretto sulle cellule miocardiche. Può provocare ipertensione per aumentato rilascio di catecolamine, gastriti ripetute e pancreatiti croniche con insufficienza pancreatica e conseguente ridotto assorbimento di nutrienti.
Effetti indiretti dell’alcol sono la malnutrizione ed i deficit vitaminici correlati; tra questi va ricordato in particolare il deficit di tiamina che può causare gravi conseguenze a livello del sistema nervoso periferico e centrale come nella sindrome di Wernicke e Korsakoff, caratterizzata da deficit cognitivi.
Per quanto riguarda il tabagismo è sicuramente un fattore di rischio di patologia cardiovascolare poiché aumenta il rischio di aterosclerosi, ipertensione e di gravi danni che ne possono derivare, quali coronaropatie e ischemie cardiache, arteriopatie periferiche, patologie cerebrovascolari. I danni del fumo a livello respiratorio quali bronchiti croniche ed enfisema rappresentano motivo di ulteriore aggravamento del quadro clinico.
La malnutrizione è una problematica di frequente riscontro nel paziente con tumore squamoso della regione cervico-facciale e nel 25% dei casi può essere di grave entità; può derivare da condizioni preesistenti allo sviluppo del tumore e correlate all’abuso di alcol o a problemi di dentizione, oppure da un alterato metabolismo legato alla presenza della malattia o dalla ridotta assunzione di cibo dovuta alla disfagia che tipicamente accompagna queste neoplasie.
2.3 Problematiche legate alla scelta terapeutica
Le numerose strutture di grande rilievo funzionale presenti nel distretto cervico-cefalico, oltre che il non trascurabile ruolo estetico che questa regione anatomica svolge, possono condizionare talvolta in modo importante le scelte terapeutiche. Infatti, non solo la neoplasia spesso comporta modificazioni anche gravi dell’aspetto esteriore del paziente, ma gli stessi trattamenti oncologici, radioterapici e chirurgici possono essere causa di deficit funzionali ed estetici importanti.
Il problema maggiore in tal senso è posto dal trattamento dei tumori localmente avanzati, nei quali si preferiscono spesso soluzioni più conservative quali CT ed RT rispetto alla chirurgia, che a fronte di un grave danno estetico e funzionale, non sempre garantisce la radicalità oncologica. L’associazione CT + RT non è però esente da tossicità acuta che risulta di tipo prevalentemente sistemico per la chemioterapia, e loco-regionale per la radioterapia. Le manifestazioni cliniche derivanti possono comportare un peggioramento significativo della qualità di vita del paziente, soprattutto se il suo P.S. non è buono, e talvolta rendono difficile portare a termine il trattamento secondo lo schema inizialmente stabilito; infatti è stato osservato che circa 1/3 dei pazienti trattati con RT concomitante a CDDP, a dose di 100 mg/m2 ogni 3 settimane, deve interrompere il trattamento per tossicità acuta [7,8], con conseguenti implicazioni prognostiche.
3 Trattamento
Il trattamento ottimale per le neoplasie della regione testa-collo in stadio avanzato non è ancora definitivamente standardizzato e anche se negli ultimi anni i risultati clinici sono migliorati integrando in vario modo chirurgia, radioterapia e chemioterapia, questa malattia continua ad avere una prognosi non buona.
Di fronte a neoplasie localmente avanzate ma resecabili, la chirurgia seguita dalla RT rappresenta la principale scelta terapeutica; gli attuali progressi delle tecniche chirurgiche e ricostruttive consentono una maggior aggressività con minori danni estetici o funzionali rispetto al passato quando a causa di interventi chirurgici molto demolitivi i pazienti presentavano un significativo peggioramento della qualità di vita, anche se in controllo di malattia.
Spesso però le neoplasie localmente avanzate della regione testa-collo non sono operabili per estensione loco-regionale, o perché la perdita di funzione d’organo potrebbe non essere accettata dal paziente, ed in questi casi la radioterapia ha da sempre rivestito un ruolo di primo piano in quanto rende possibile il mantenimento delle funzioni d’organo, anche se i risultati non sono eccellenti, con sopravvivenza mediana di 12 mesi [31,32], controllo locoregionale raggiunto soltanto nel 30% dei pazienti [7,17] e sopravvivenza globale a 5 anni del 15-25% [16].
In ambito radioterapico per migliorare i risultati sono state fatte esperienze con frazionamento non convenzionale della dose e sia l’iperfrazionamento che il frazionamento accelerato con boost concomitante hanno dimostrato di essere più efficaci in termini di controllo locoregionale rispetto al frazionamento standard [18]. Un gruppo di studio che ha trattato pazienti con neoplasie dell’orofaringe T2-3 N0-2 ha osservato una sopravvivenza libera da malattia a 5 anni del 59% nel gruppo di pazienti trattati con l’iperfrazionamento contro il 40% del frazionamento convenzionale; questi migliori risultati però sono stati osservati soltanto in pazienti con neoplasie T2 e non in forme più avanzate [33]. Oltre a questa valutazione, uno dei principali limiti nell’applicazione routinaria dei frazionamenti non convenzionali è rappresentato dal maggior impegno richiesto ai centri di RT nel trattare un unico paziente 2-3 volte al dì, considerate le lunghe liste d’attesa.
In parallelo sono state studiate anche associazioni di farmaci chemioterapici da somministrare con la RT in modo da potenziare l’effetto “killing” sul tumore, sfruttando l’azione radiosensibilizzante ed agendo nel contempo anche su eventuali micrometastasi responsabili di ripetizioni a distanza [7,8].
La CRT si è dimostrata la migliore scelta terapeutica per quanto riguarda sia la sopravvivenza globale a 3 anni sia il controllo locoregionale, e per questo attualmente è considerata lo standard terapeutico delle neoplasie localmente avanzate del testa-collo non aggredibili chirurgicamente [34,35].
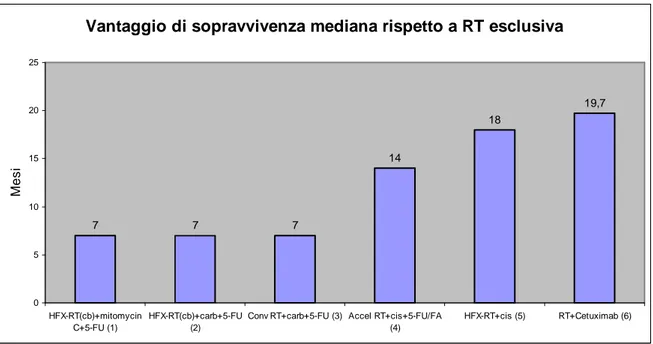
Uno degli studi randomizzati di fase III più significativi al riguardo è stato condotto da Aldestein e colleghi [21], confrontando in 3 bracci di trattamento 295 pazienti con malattia non resecabile. Un gruppo è stato trattato con sola RT, uno con RT e CDDP in bolo e uno con RT “split-course” e 5FU in infusione + bolo di CDDP. I risultati dello studio hanno mostrato la superiorità dell’associazione chemioradioterapica con CDDP rispetto alla RT esclusiva (sopravvivenza a 3 anni del 37% vs 23%), mentre l’altra associazione CRT con CDDP e 5-FU ha mostrato un’efficacia sovrapponibile a quella della RT esclusiva, ma con un aumento di tossicità, causa di interruzione del trattamento nel 27% dei pazienti, percentuale più elevata rispetto a quella registrata negli altri due gruppi (15% nel gruppo con CRT a base di CDDP e 7% nel gruppo trattato con RT esclusiva).
Un altro ampio studio randomizzato di fase III [17] ha confrontato pazienti trattati con CDDP/5FU/Acido Folinico e RT con un gruppo di pazienti trattati con RT esclusiva. Anche in questo caso i risultati ottenuti hanno mostrato una maggiore efficacia della CRT, con significativo aumento della sopravvivenza globale a 3 anni (49% vs 24%) e del controllo locoregionale sempre a 3 anni (35% vs 17%), mentre la probabilità di metastasi a distanza (9%) è risultata sovrapponibile nei 2 bracci.
La superiorità dell’associazione CRT rispetto a RT esclusiva è emersa anche da altri studi, tra cui quello pubblicato da Lefebvre nel 1999 [36] in cui sono stati valutati 226 pazienti con neoplasie dell’orofaringe in stadio III e IV distribuiti in 2 gruppi, uno trattato con RT esclusiva e uno con RT con frazionamento convenzionale e 3 cicli di 4 giorni con carboplatino e 5FU. La sopravvivenza globale a 3 anni e la sopravvivenza libera da malattia a 3 anni sono state rispettivamente del 31% e del 20% nel primo gruppo contro il 51% e
equivalente, ma le tossicità nel caso di CRT sono risultate più frequenti, sia per quanto riguarda le mucositi gravi sia la tossicità ematologica, mentre non sembrano esistere differenze per quanto riguarda la tossicità cutanea.
Un altro studio condotto su 171 pazienti con neoplasie non resecabili di oro e ipofaringe ha mostrato che i pazienti trattati con 3 cicli di CDDP e 5FU concomitanti a RT hanno presentato sopravvivenza globale a 18 mesi del 48% rispetto al 36% di quelli trattati con sola RT [37]. Tale beneficio è risultato maggiore nei pazienti con tumore dell’orofaringe, in cui la sopravvivenza mediana è stata di 17 mesi dopo CRT, rispetto ai 10 mesi del trattamento radioterapico esclusivo.
Miglior sopravvivenza globale a 2 anni (80% vs 43%), è stata riportata anche con l’associazione CDDP + 5-FU + RT iperfrazionata, rispetto alla sola RT, pur con un aumento della tossicità [38].
Studi di metanalisi hanno confermato che il miglior regime terapeutico per il trattamento di neoplasie squamose localmente avanzate di testa e collo è basato sull’utilizzo di chemioterapia a base di CDDP concomitante a RT, e che contrariamente a quanto si possa immaginare, la monoterapia è più efficace di una polichemioterapia [39]. Conferma di ciò si è avuta anche da uno studio in cui sono stati confrontati 18 trials per un totale di oltre 3000 pazienti, i cui risultati dimostrano una riduzione dell’11% del rischio di morte dopo trattamento con CRT rispetto alla sola RT, percentuale che nel gruppo di pazienti trattati con monochemioterapia a base di CDDP sale al 12% [8].
Sono state valutate anche altre associazioni farmacologiche, ad esempio è stato condotto un ampio studio su 384 pazienti con malattia non resecabile, randomizzati in due gruppi, uno trattato con Mitomicina C associata a 5FU e RT con iperfrazionamento ed uno trattato con sola RT con iperfrazionamento, ed anche in questo caso il gruppo sottoposto a radio-chemioterapia presentava a 5 anni migliori risultati con incremento del 5% in sopravvivenza e del 13% in controllo loco-regionale [40].
Stabilito che l’associazione radio-chemioterapica migliora la risposta terapeutica, rimane da definire quale sia il miglior regime chemioterapico e la migliore modalità di somministrazione dei farmaci (bolo o infusione protratta), valutando inoltre la possibilità di associare la CT ad una RT a frazionamento non convenzionale, dato che esistono studi retrospettivi in cui un frazionamento non convenzionale sembra migliorare la
sopravvivenza, anche se non sembra incidere sul rischio di recidive locoregionali. Uno di tali studi confronta 4 gruppi di pazienti trattati con RT esclusiva con frazionamento convenzionale, RT con frazionamento convenzionale associata a CDDP o carboplatino, RT esclusiva con iperfrazionamento e RT con iperfrazionamento associata a CDDP. Da tale confronto risulta che la miglior sopravvivenza, pur senza significatività, si ha con RT iperfrazionata + CDDP; l’associazione radio-chemioterapica riduce anche l’incidenza di metastasi, mentre non vi sono differenze tra i 4 gruppi per quanto riguarda le recidive locoregionali.
A fronte di migliori risultati sul controllo di malattia, il gruppo trattato con RT iperfrazionata e CDDP ha presentato tossicità maggiori [41].
Un’altra modalità di associazione CT - RT è la CT neoadiuvante o di induzione (CI). Già in passato ci sono stati tentativi di utilizzo della chemioterapia neoadiuvante a RT, ma tale approccio è stato abbandonato in quanto ad un aumento della durata dei trattamenti e delle tossicità registrate non corrispondeva miglioramento significativo dei risultati [21].
Anche se lo schema terapeutico più utilizzato nei carcinomi squamosi localmente avanzati della regione testa-collo rimane la chemioradioterapia concomitante, alla luce dei buoni risultati in termini di efficacia e tossicità ottenuti in alcuni studi associando Taxani al regime chemioterapico classico con CDDP e 5-FU [19,20], la possibilità di effettuare una CT di induzione seguita da CRT sembra essere sempre più utilizzabile.
Questa sequenzialità permette di sfruttare i vantaggi di entrambe le modalità, ovvero migliorare la sopravvivenza con la CI riducendo l’incidenza di metastasi, ed aumentare il controllo loco-regionale con la CRT [42].
4 Nuove prospettive terapeutiche
I risultati ottenuti in campo oncologico nel corso dell’ultimo decennio, basati sull’utilizzo dei chemioterapici, sono stati certamente molto rilevanti anche se associati ad importanti effetti collaterali, dato che l’azione biologica di tali molecole non si esplica soltanto sulle cellule neoplastiche, ma anche sulle cellule sane in proliferazione.
La recente acquisizione che alla base dei tumori vi sono spesso mutazioni genetiche, ha rappresentato una svolta nella cura delle neoplasie, poiché ha portato allo sviluppo di farmaci “a bersaglio molecolare”, che sono alla base della “target therapy”, definizione che sta ad indicare la selettività di azione di queste molecole dirette verso bersagli presenti in misura rilevante sulle cellule neoplastiche e direttamente implicati nei meccanismi che ne regolano la proliferazione.
Rispetto alla chemioterapia, la target therapy ha due vantaggi essenziali: la selettività d’azione con risparmio dei tessuti sani, con conseguenti minori effetti collaterali e l’“individualizzazione” della terapia, che viene effettuata nelle neoplasie potenzialmente responsive, in quanto esprimono specifiche alterazioni molecolari.
I fattori di crescita e i loro recettori giocano un ruolo importante nell’indurre la trasformazione neoplastica e la successiva proliferazione e sono da diversi anni oggetto di studio. Tra questi il recettore per il fattore di crescita epidermico (EGFR) è una delle molecole di maggiore interesse oncologico, in quanto espressa a livelli elevati in molti tumori solidi. La deregolazione del segnale di EGFR svolge un ruolo importante sia nella trasformazione neoplastica delle cellule, sia nella loro capacità di proliferare anche in condizioni avverse, di invadere i tessuti circostanti e gli organi a distanza.
4.1 Recettore del fattore di crescita epidermico
Il recettore per il fattore di crescita epidermico è un recettore transmembrana tirosin-chinasico di170 kDa espresso anche sulle cellule normali, codificato dal gene c-erbB1 costituito da 28 esoni, presente sul cromosoma 7 [43].
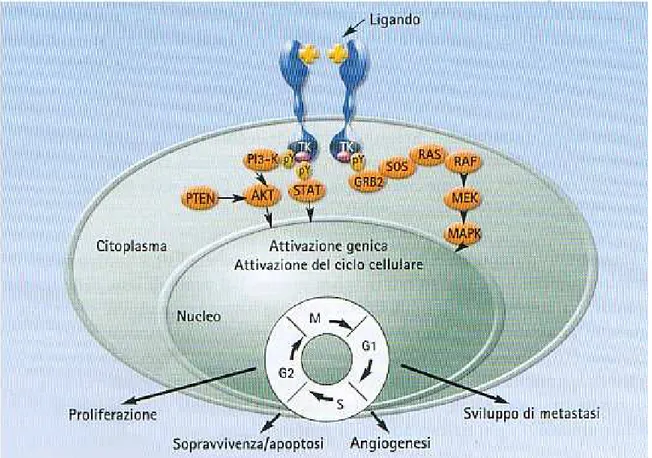
Il recettore ed i suoi ligandi rivestono un ruolo fondamentale nel normale sviluppo degli organi; EGFR è coinvolto in particolare nello sviluppo di nuovi vasi e nella differenziazione, proliferazione e sopravvivenza cellulare (fig.4.1) [23].
Figura 4.1: vie di trasduzione del segnale di EGFR
EGFR appartiene alla famiglia ERBB, che include quattro recettori noti come EGFR/Her1, Her2/neu/ErbB2, Her3/ErbB3 e Her4/ErbB4.
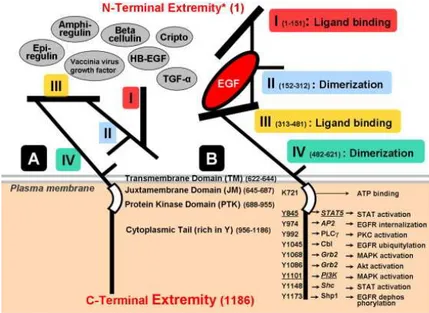
Dal punto di vista strutturale EGFR è composto da 4 domini extracellulari nel complesso definiti ectodomini, di cui quelli indicati come I e III o L1 e L2 sono coinvolti nel legame
con il ligando mentre i domini II e IV, noti anche come CR1 e CR2 o domini ricchi in cisteina, hanno ruolo fondamentale nella dimerizzazione.
La porzione restante è formata da una regione idrofobica transmembrana (TM), un dominio juxta-membrana (JM), un dominio intracellulare costituito dalla porzione tirosin chinasica (PTK) e contenente il sito di legame per l’ATP e una porzione regolatoria carbossi-terminale [10].
Figura 4.2: struttura di EGFr in forma libera (A) e legata (B), e suoi ligandi.
Da Thariat J, Milas L, Ang K [10]
In condizioni basali il recettore è in forma monomerica e l’interazione con il ligando comporta una modificazione strutturale che ne favorisce la dimerizzazione, cioè la formazione di coppie di recettori detti omodimeri quando sono formati da due recettori uguali oppure eterodimeri quando si uniscono due recettori diversi. Alla dimerizzazione segue l’autofosforilazione delle porzioni intracellulari del recettore con notevole incremento dell’attività enzimatica e del segnale intracellulare. L’autofosforilazione non è prerequisito fondamentale per generare il segnale, ma aumenta notevolmente l’attività, come se eliminasse un freno; infatti da esperimenti con mutanti del recettore è stato osservato che il segnale si genera anche se la porzione C-terminale è troncata [44].
In presenza del ligando si formano legami crociati tra i residui di cisteina del dominio extracellulare in prossimità della membrana, che determinano un riorientamento della
molecola coinvolgente anche la sua porzione intracellulare e la successiva attivazione della chinasi.
4.1.2 Attivazione della via del segnale
EGFR può essere attivato da almeno 8 diversi ligandi, che possono essere distinti in tre diversi gruppi in base all’affinità per i vari recettori: EGF, TGF-alfa e anfiregulina che legano esclusivamente EGFR; heparin binding epidermal growth factor, betacellulina, epiregulina che possono legare sia EGFR sia ErbB4 e tomoregulina e eregulina che legano ErbB4 e occasionalmente ErbB3. Non sono noti invece i ligandi specifici per Her2 che è il partner con cui più spesso EGFR forma eterodimeri.
L’eterodimerizzazione è facilitata dalla co-localizzazione di “rafts”, microdomini di membrana ricchi in sfingolipidi e colesterolo che agiscono come piattaforme che organizzano spazialmente i recettori sulla membrana e che da studi recenti sembrano aver un ruolo importante in alcune neoplasie, specialmente in quelle di testa e collo, e sembra che esista un diverso assortimento di queste molecole nelle cellule neoplastiche rispondenti a RT rispetto a quelle resistenti [45].
La fosforilazione dell’estremità C-terminale di EGFR dà luogo alla formazione di specifici siti d’attacco per trasduttori del segnale o proteine adattatrici, cioè proteine il cui ruolo è proprio quello di guidare la disposizone e l’assemblamento di altre molecole coinvolte nella genesi del segnale. EGFR come tutti i recettori tirosin chinasici non fosforila tutte le tirosine presenti in un substrato proteico, ma solo quelle contenute all’interno di certe sequenze aminoacidiche, che hanno poca o nessuna affinità per una proteina in cui i residui non siano fosforilati. In questo modo l’attivazione di un recettore tirosinchinasico può portare alla fosforilazione di vari substrati proteici purchè presentino tali domini indicati come domini SH2, acronimo che deriva da “Src homology 2”, poiché è stato identificato per la prima volta nella proteina codificata dall’oncogene src, o domini PTB, cioè “PhosphoTyrosin Binding” [44].
Ognuno dei substrati che viene attivato può dare inizio ad una via separata di segnalazione. Alcune proteine di segnale si associano direttamente ad EGFR mediante i domini SH2, è il caso per esempio della fosfolipasi C (PLC-y) o della tirosin-chinasi Src, altre indirettamente
sono associate al recettore nel suo stato di riposo e vengono attivate o traslocate dopo l’attivazione come nel caso della Zinc Binding Protein1 e delle molecole STAT che vengono traslocate nel nucleo.
Un’altra modalità di interazione è attraverso i siti C-terminali fosforilati dei partner di EGFR che formano l’eterodimero; le differenze nelle sequenze terminali di questi recettori spiegano la specificità dei diversi complessi nell’attivare preferibilmente una via piuttosto che un’altra, e la molteplicità dei segnali attivati [44].
In seguito al legame di uno dei ligandi con EGFR, si ha un’attivazione simultanea di più vie che sono generalmente correlate, anche se ogni specifico ligando innesca una via di segnale preferenziale; infatti EGF preferibilmente attiva la fosfolipasi C, mentre TGF-alfa porta all’attivazione della via della Janus-chinasi e della trascrizione mediante STAT.
Da un punto di vista funzionale le varie vie del segnale sono interconnesse, ma per semplicità se ne possono individuare almeno 4:
1. La cascata tirosinchinasica che porta all’attivazione del protoncogene Ras, detta “cascata MAP chinasica”.
Il segnale ha inizio quando il dominio SH2 dell’adaptor Grb2 lega direttamente EGFR dopo che questo è stato attivato, oppure indirettamente mediante l’adaptor Shc attraverso domini PTB e questa è forse quella più frequentemente utilizzata tra le due possibili modalità. Grb2 è normalmente legato alla proteina Sos e si trova nel citosol; la rilocalizzazione a livello di membrana facilita l’interazione tra Sos e la proteina Ras e come conseguenza del legame, Ras viene attivata perché si realizza uno scambio tra GDP e GTP. Ras è una proteinchinasi che dà inizio alla catena ordinata di reazioni nota come “cascata MAP chinasica” che porta a fosforilazione, attivazione e traslocazione nucleare di ERK1 e ERK2. Questi catalizzano la fosforilazione di fattori di trascrizione, che aumenta la loro affinità per i siti regolatori sul DNA e di conseguenza promuove la sintesi del DNA e la divisione cellulare, ed incrementa la trascrizione di geni specifici, molti dei quali coinvolti nella regolazione del ciclo cellulare.
Uno dei geni di cui viene stimolata la trascrizione codifica per una MAPK fosfatasi che inattiva una protein chinasi della cascata e interrompe il segnale.
La cascata MAP chinasica probabilmente gioca un ruolo fondamentale anche nella traduzione poiché la MAP chinasi aggiunge un fosfato a PHAS-I, molecola che lega il fattore d’inizio IF4E determinandone un cambiamento conformazionale che fa perdere l’ancoraggio tra il ribosoma e la catena di mRNA, passaggio fondamentale per l’inizio della traduzione.
2. La via iniziata dall’attivazione della Fosfatidilinositolo3chinasi (PI3K) che stimola un’enzima chiamato AKT chinasi o protein chinasi B che controlla crescita, proliferazione, sopravvivenza e mobilità cellulare. Questa via sembra quella maggiormente coinvolta nella mediazione dell’attività antiapoptotica di EGFR.
3. La via Jak/STAT che è una via diretta che controlla la trascrizione. Nei mammiferi sono state identificate 7 forme di proteine STAT, ma soltanto STAT 1, 3 e 5 sono coinvolte nella cascata del segnale originata da EGFR. STAT nel nucleo induce la trascrizione di geni e media la divisione cellulare, la vitalità, la motilità, l’invasione, l’adesione cellulare e la riparazione del DNA. Geni targets sono quelli che codificano per ciclina D1, COX2, iNOS coinvolti rispettivamente nella progressione del ciclo cellulare e nella produzione di prostaglandine e acido nitrico.
4. Una via che coinvolge la fosfolipasi C (PLC) che scinde il fosfatidil-inositolo-difosfato in inositolo-trifosfato (IP3) e diacilglicerolo (DAG). Il primo fa rilasciare calcio dalle riserve intracellulari portando ad attivazione di enzimi calcio-dipendenti ed entra in gioco anche nella via che porta ad attivazione di Akt. Il diacilglicerolo invece è cofattore per l’attivazione di una serina-treonina chinasi (PKC) che regola la progressione del ciclo cellulare e la motilità cellulare.
Recentemente sono state identificate le vie intranucleari di EGFR sia ligando dipendenti sia indipendenti. Nel dominio juxta-membrana di EGFR si trova una sequenza per la trasclocazione intranucleare del recettore attraverso pori della membrana nucleare o trasportatori quali importina alfa/beta1 o esportina. Sebbene EGFR manchi di un dominio
riparazione della catena del DNA qualora vada incontro a rottura per effetto delle radiazioni [10].
4.1.3 Inibizione del segnale
L’inibizione del segnale di EGFR avviene mediante defosforilazione di residui chiave e rimozione per endocitosi.
L’attenuazione del segnale mediante endocitosi è stata ampiamente studiata per EGFR; risulta essere un processo molto complesso e regolato, che inizia con la formazione di vescicole ricoperte da clatrina mediante le quali EGFR è trasportato agli endosomi e da qui è veicolato verso la degradazione o il riciclaggio [46].
Una via alternativa che coinvolge le caveole, invaginazioni di membrana non rivestite da clatrina, è selettivamente attivata quando si hanno più alti livelli di EGFR [46].
L’internalizzazione del recettore sembra essere finemente regolata, come risulta da studi effettuati con lo scopo di comprendere i meccanismi coinvolti in tale processo, molto utile ai fini terapeutici. Al momento non esistono dati sicuri in merito, ma sembra sia coinvolta soprattutto l’attivazione della tirosina chinasi [47], che non è però l’unico meccanismo poiché l’internalizzazione si realizza anche in caso di recettori mutati privi di questa componente [48].
I meccanismi di inattivazione del segnale non sono uguali per tutti i recettori della famiglia, per esempio ErbB2 dopo l’internalizzazione è prevalentemente diretto verso la degradazione, mentre ErbB3 verso il riciclaggio, questo è importante poiché la dimerizzazione di EGFR con l’uno o l’altro membro della famiglia può influenzare la durata del segnale a partenza dal recettore [46].
4.2 Ruolo fisiologico del fattore di crescita epidermico
Il fattore di crescita epidermico ha un ruolo fondamentale nella proliferazione delle cellule epiteliali in vari organi e tessuti ed in momenti diversi dello sviluppo. Studiando topi mutati privi del recettore è stata osservata innanzitutto difficoltà nell’impianto dell’embrione e un aumento dei casi di morte gestazionale; nei casi in cui le gravidanze sono state portate a termine si sono osservate anomalie a livello di cute, polmone, tratto gastrointestinale, cervello e fegato [44]. Inoltre, anche se non esistono ancora dati precisi, sappiamo che EGF
riveste sicuramente un ruolo importante sulla mobilità cellulare agendo su vie del segnale diverse ma integrate tra loro.
È stato dimostrato che a seguito del legame EGF-recettore, l’attivazione della fosfolipasi C comporta modificazioni dei filamenti di actina e forse di altre proteine, processo richiesto per l’estensione e la retrazione delle cellule mobili [49]. L’attivazione della cascata delle MAP chinasi, pur non essendo da sola sufficiente a determinare la mobilità cellulare, sembra possa modulare le funzioni adesive dell’integrina riducendo l’adesione al substrato [50].
L’attivazione della chinasi deputata alla fosforilazione della catena leggera della miosina, favorendo l’attività ATP-asica e la polimerizzazione dell’actina gioca un ruolo importante nella contrazione cellulare e nella traslocazione del corpo cellulare delle cellule in movimento [51].
EGF inoltre porta all’attivazione delle calpaine, una famiglia di proteasi calcio-dipendenti che nei fibroblasti esaltano la mobilità [52].
Il ruolo della via di segnale a partenza dall’inositolo 3 fosfato è meno chiaro; al momento ci sono dati contrastanti che fanno presupporre un’azione diversa di EGF nei vari tipi cellulari, tuttavia un dato certo sembra essere la regolazione dell’attività sia della beta-catenina sia di APC e anche se non è chiaro come queste cooperino, quello che è certo è che nel topo stimolano la migrazione delle cellule epiteliali del colon [44].
L’attivazione del segnale a partenza dal fattore di crescita epidermico sembra comportare anche un aumento dell’espressione del fattore di crescita endoteliale, noto con l’acronimo VEGF; dati significativi a sostegno di quest’ipotesi sono stati ottenuti da studi su cellule di glioblastoma [53].
4.3 EGFR e neoplasie
Le cellule dei tessuti sani normalmente esprimono il recettore per EGF, i cui livelli possono variare tra 40.000 e 100.000 molecole per cellula [9].
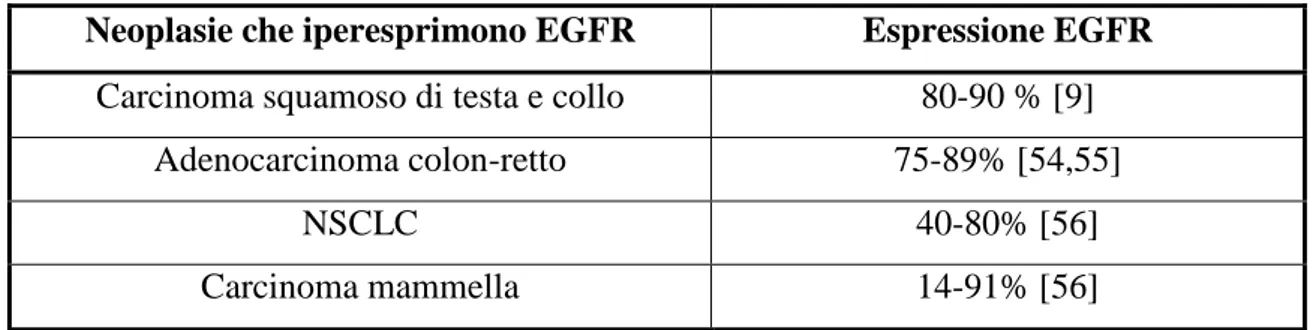
In molte neoplasie EGFR ed i suoi ligandi EGF e TGF-alfa sono espressi in misura più rilevante, con percentuali variabili a seconda dell’istotipo; sono iperespressi soprattutto negli adenocarcinomi del colon-retto, nelle neoplasie del polmone non a piccole cellule
(NSCLC) e nelle neoplasie squamose della regione testa-collo, dove elevati livelli di mRNA e proteine di EGFR sono riscontrabili nell’80-90% delle lesioni (vedi tab. 4.1).
Neoplasie che iperesprimono EGFR Espressione EGFR Carcinoma squamoso di testa e collo 80-90 % [9]
Adenocarcinoma colon-retto 75-89% [54,55]
NSCLC 40-80% [56]
Carcinoma mammella 14-91% [56]
Tabella 4.1: tumori che iperesprimono EGFR
Il meccanismo di up-regulation di EGFR nelle diverse neoplasie non è sempre lo stesso; nei tumori della regione cervico-facciale prevale l’attivazione della trascrizione di EGFR secondaria alla produzione autocrina di TGF-alfa, che può essere secreto anche da macrofagi, cellule T e cheratinociti in risposta al danno tissutale [57]; non sembrano coinvolti né cambiamenti nella stabilità dell’mRNA né amplificazioni di geni.
Un’altra modalità, ma di riscontro meno frequente, è rappresentata da un’alterazione della funzione del dominio chinasico derivata da una sua mutazione, che provoca un aumento dell’attività di Akt, come si è osservato in tumori a piccole cellule del polmone.
La delezione di un esone nella porzione del gene che codifica per il dominio extracellulare dà luogo ad una variante troncata di EGFR, chiamata EGFRvIII tipica del glioblastoma, ma occasionalmente riscontrabile anche nei tumori della regione testa-collo; come risultato della mutazione il recettore non è attivato dal ligando, ma è costitutivamente attivo e non viene internalizzato, determinando soprattutto una up-regulation di BcL con inibizione dell’apoptosi.
Un’attivazione alterata della via del segnale di EGFR si può avere anche per legami alterati con altri recettori della famiglia [58].
Un’aumentata espressione di EGFR è stata osservata anche nelle lesioni displastiche, come pure nella mucosa sana di pazienti con neoplasie, anche se a livelli intermedi tra quelli delle cellule normali di soggetti sani e delle cellule neoplastiche; sembra infatti che l’espressione
del recettore sia un evento precoce nelle carcinogenesi, ed aumenti in parallelo alla trasformazione da tessuto normale a lesioni altamente aggressive [9,59].
Elevati livelli di EGFR sono spesso associati a prognosi peggiore ed a maggior resistenza ai trattamenti, in particolare alla RT, con aumentato rischio di recidiva loco-regionale.
Una conferma in tal senso è stata fornita da un primo studio condotto nel 1996 da Maurizi, Almadori e colleghi su 140 pazienti con carcinoma a cellule squamose della laringe, che ha mostrato una sopravvivenza a 5 anni dell’81% nei pazienti che non esprimevano EGFR, contro il 25% in quelli positivi per il recettore [60].
Vari studi preclinici e clinici successivi hanno dimostrato un minor controllo locoregionale di malattia dopo radioterapia nei tumori con iperespressione di EGFR.
Akimoto nel 1999 ha condotto uno studio che mirava a ricercare un’eventuale relazione tra i livelli di EGFR e radiocurabilità in neoplasie murine; sono stati utilizzati 9 campioni di neoplasie con diversa radiosensibilità, in essi è stata misurata l’espressione di EGFR e valutata la dose di radiazioni necessaria per ottenere il controllo di malattia in almeno il 50% dei topi. È stata osservata una correlazione tra livello di espressione del recettore e dose di radiazione necessaria per il controllo tumorale [11].
Uno studio in vitro completato nel 2003 ha confermato la relazione tra livelli di EGFR e radioresistenza, osservando che mediante la trasfezione di un vettore contenente la sequenza completa di EGFR in linee cellulari con bassi livelli del recettore, e pertanto radiosensibili, si otteneva un aumento significativo della radioresistenza [11].
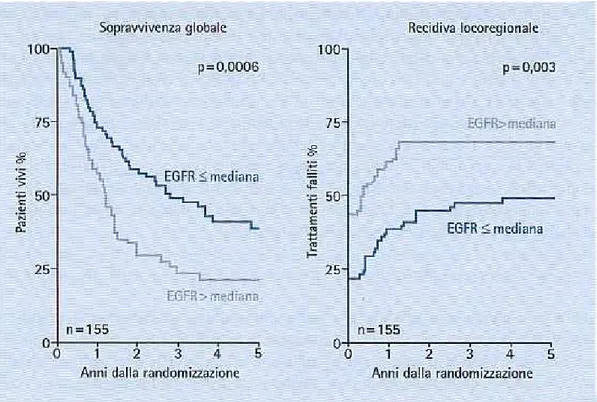
L’espressione di EGFR è una caratteristica del tumore indipendente dallo stadio di malattia o dall’iniziale coinvolgimento linfonodale, ed analisi statistiche hanno evidenziato che è un fattore prognostico indipendente di sopravvivenza globale e di sopravvivenza libera da malattia (Fig. 4.3 ) [24], ma se una maggior espressione del recettore correla con un aumentato rischio di recidiva locoregionale, non sembra avere alcun ruolo sul rischio di metastasi a distanza [24].
Figura 4.3: i livelli di espressione di EGFR sono fattori predittivi di risposta alla RT.
Da Ang KK, Berkey BA, Tu X, Zhang HZ, Katz R [24]
Da esperimenti condotti in vitro su linee cellulari di tumori squamosi della regione cervico-facciale è emerso che le cellule che sopravvivono all’irradiazione vanno incontro a ripopolamento rapido e sono caratterizzate da up-regulation di EGFR e TGF-alfa [61]. Le radiazioni aumentano la fosforilazione della tirosina di EGFR [62], e studiando modelli murini è stato osservato che in vitro una singola dose di radiazioni induce l’autofosforilazione del recettore e l’attivazione del segnale solo nei tumori con elevata espressione di EGFR, fenomeno responsabile della relativa radioresistenza [11]. L’esposizione alle radiazioni inoltre induce una traslocazione nucleare di EGFR, e questo processo è accompagnato dalla formazione di complessi tra il DNA e le protein chinasi DNA dipendenti, che hanno un ruolo fondamentale nella riparazione del danno indotto dalle radiazioni sui filamenti del DNA [25, 63].
La conoscenza dettagliata di tutti i meccanismi biologici alla base della crescita tumorale e del ruolo rivestito dai recettori cellulari, in particolare da EGFR, ha portato allo sviluppo di molecole in grado di bloccare la trasduzione del segnale, e di interferire con la crescita tumorale.
4.4 Cetuximab
Cetuximab è un anticorpo monoclonale chimerico umano-murino di tipo IgG1 diretto contro il dominio extracellulare del recettore per il fattore di crescita epidermico, al quale si lega con un’affinità 5-10 volte più alta di quella dei ligandi endogeni [64].
4.4.1 Proprietà farmacodinamiche
Il legame col recettore antagonizza il legame coi ligandi fisiologici, impedisce la dimerizzazione favorendo l’internalizzazione del recettore ed induce una tossicità cellulo-mediata anticorpo dipendente sulle cellule tumorali [26]. Coerentemente con la complessità delle vie intracellulari di trasduzione del segnale a partenza da EGFR, gli effetti di Cetuximab si realizzano a diversi livelli [65].
Cetuximab lega il dominio III del recettore per il fattore di crescita occludendo parzialmente il sito di legame per i ligandi endogeni e blocca stericamente il dominio I, quindi previene il legame col ligando e l’attivazione ligando dipendente [66] ed indipendente come quella indotta dalle radiazioni [67]. Oltre a questo meccanismo, che è considerato il principale, sembra che Cetuximab possa indurre una tossicità cellulare anticorpo dipendente, come osservato in esperimenti su topi con deficit del sistema immunitario, nei quali l’anticorpo è in grado di impedire la metastatizzazione di xenotrapianti di melanoma [68]. Infine il complesso formato dal recettore e Cetuximab sembra essere più resistente all’azione degli enzimi endosomiali che dovrebbero scindere il legame tra le 2 molecole, quindi il complesso viene veicolato preferibilmente verso i lisosomi, con conseguente degradazione e riduzione dell’espressione del recettore sulla superficie cellulare [66].
Cetuximab è in grado di potenziare gli effetti antineoplastici sia dei farmaci chemioterapici [69,70,71], sia della radioterapia.
Per quanto riguarda gli effetti di questo anticorpo sulle cellule tumorali in associazione alla RT, inizialmente è stato definito che l’anticorpo potenzia l’apoptosi indotta dalle radiazioni aumentando l’espressione di Bax, una proteina pro-apoptotica, e riducendo l’espressione di Bcl-2 che ha effetto opposto. In un secondo tempo alcuni studi hanno dimostrato che la
![Figura 4.4: Cetuximab + RT vs RT: controllo loco-regionale. Da Bonner, Harari, Giralt [12]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7330983.90814/37.892.222.714.602.976/figura-cetuximab-controllo-loco-regionale-bonner-harari-giralt.webp)