Indice
INDICE
1. Riassunto 4
2. Introduzione 9
2.1 Il neonato piccolo per l’età gestazionale (SGA) 9
2.1.1 Definizione 9
2.1.2 Epidemiologia 14
2.1.3 Fattori prenatali associati 15
2.1.4 Implicazioni della nascita SGA 16
2.1.5 La crescita del bambino nato SGA 17
2.1.6 La composizione corporea del bambino nato SGA 20
2.1.7 Conseguenze neurologiche ed intellettive della nascita SGA 21
2.1.8 Programmazione endocrina intrauterina 22
2.1.9 Conseguenze endocrine della nascita SGA 26
2.1.10 Conseguenze metaboliche della nascita SGA 30
2.1.11 Management endocrino del bambino nato SGA: crescita e pubertà 32
2.2 Il neonato con restrizione di crescita extrauterina 38
2.2.1 Definizione 38
2.2.2 Epidemiologia 41
Indice
2.2.5 L’alimentazione del neonato pretermine di alto grado 45
2.2.6 Conseguenze della restrizione di crescita extrauterina 48
2.2.7 Parallelismo tra la crescita del neonato SGA e quella del pretermine nato AGA con EUGR: possibilità terapeutiche 50
3. Obiettivi dello studio 52
4. Pazienti e metodi 53
4.1 Popolazione di pazienti, valutazione clinica e follow-up auxologico 53
4.2 Analisi statistica 56
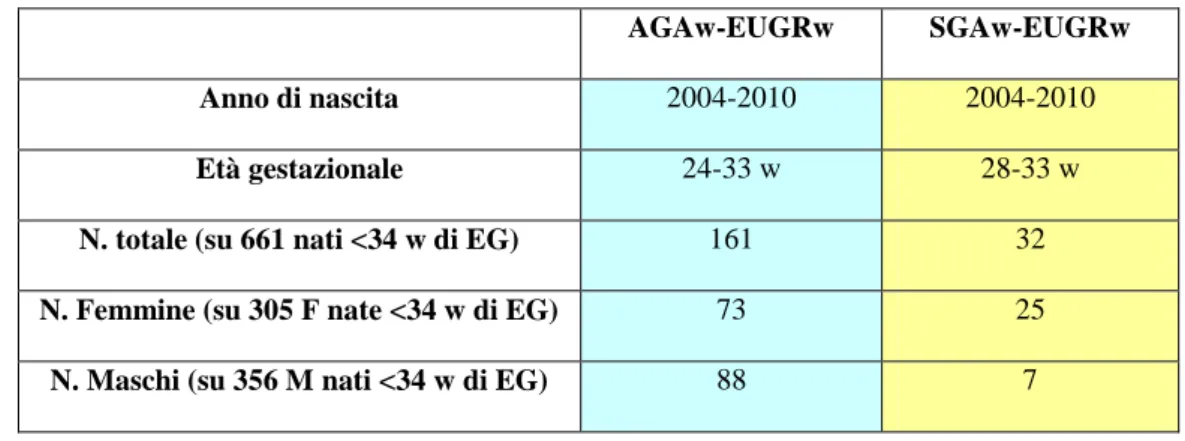
5. Risultati 57
5.1 Il neonato piccolo per l’età gestazionale 57
5.1.1 Prevalenza 57
5.1.2 Principali fattori di rischio associati alla nascita SGA 62
5.1.3 Follow-up auxologico dei bambini nati SGA 63
5.2 Il neonato con restrizione di crescita extrauterina 70
5.2.1 Prevalenza 70
5.2.2 Variazione negli apporti nutrizionali con alimentazione parenterale e con latti speciali nei pretermine nelle prime settimane di vita 75
5.2.3 Principali fattori di rischio pre e post-natali associati a EUGR 77
Indice
6. Discussione 83
6.1 Il neonato piccolo per l’età gestazionale 83
6.2 Il neonato con restrizione di crescita extrauterina 87
7. Conclusioni 91
Riassunto
1. Riassunto
Mentre in neonatologia è generalmente definito piccolo per l’età gestazionale (Small for Gestational Age) il neonato con peso e/o lunghezza alla nascita <10° percentile per EG e sesso, in endocrinologia pediatrica si raccomanda di considerare SGA il neonato con tali parametri inferiori a –2 DS o al 3° percentile perché questo permette di identificare la maggior parte dei soggetti che richiedono un follow-up auxologico.
La restrizione di crescita extrauterina (EUGR) è una problematica legata alla crescente sopravvivenza di neonati di età gestazionale molto bassa ed è definita dal riscontro di parametri di crescita extrauterina (peso, lunghezza, circonferenza cranica) <10° percentile rispetto alla crescita intrauterina attesa, prendendo in considerazione, come età alla dimissione (generalmente un’età corretta uguale o di poco inferiore al termine), l’età post-concezionale.
Gli obiettivi principali di questo studio sono: l’analisi della prevalenza della nascita SGA con peso <3° percentile (SGAw) in neonati a termine e pretermine; la valutazione della prevalenza di EUGRw severo (peso <3° percentile per sesso ad un’età gestazionale pari al termine) in pretermine con EG alla nascita <34 settimane; l’analisi dei principali fattori di rischio per nascita SGAw e per EUGRw severo; il follow-up auxologico, principalmente staturale, a 1, 2 e 4 anni di vita nei nati SGAw e nei pretermine con EUGRw severo.
Per lo studio di prevalenza abbiamo arruolato i bambini nati presso la U.O Neonatologia dell’Azienda Ospedaliero-Universitaria Pisana e presso la Neonatologia dell’Ospedale di Massa tra il 1° Gennaio 2004 e il 31 Dicembre 2010. Per la classificazione dei neonati alla nascita sono state utilizzate le carte antropometriche di Bertino E. et al. (JPGN 2010); per il calcolo dei percentili di lunghezza/statura abbiamo
Riassunto
utilizzato le carte dell’Organizzazione Mondiale della Sanità per il primo anno di vita e le curve di Cacciari E. et al. (JEI 2006) a partire dal secondo anno di età.
Per lo studio di follow-up abbiamo contattato tutti i bambini SGAw o pretermine <34w di EG con EUGRw severo nati a Pisa che avessero compiuto i 2 anni di vita entro il 31 Dicembre 2011.
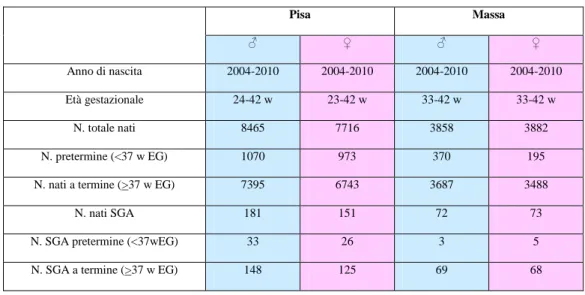
Su 16.181 nati a Pisa (centro di III livello) tra il 2004 e il 2010, la prevalenza di SGAw è stata del 2,1% (n. 332), con una percentuale maggiore (p=0.001) nel gruppo dei pretermine (2,9%) rispetto ai nati a termine (1,9%). Non abbiamo riscontrato differenze significative tra i maschi e le femmine all’interno di ogni singolo gruppo. Pur con un lieve incremento nel corso degli anni, il trend annuale della prevalenza della nascita SGAw non ha subito variazioni statisticamente significative tra il 2004 e il 2010. I dati di prevalenza ottenuti dalla Neonatologia dell’Ospedale di Massa (centro di II livello) sono sovrapponibili a quelli pisani nella popolazione generale e tra i nati a termine. Nel gruppo dei pretermine, invece, la prevalenza di SGAw è inferiore a Massa, con una differenza statisticamente significativa nel gruppo dei maschi (rispettivamente 0,8% a Massa contro 3,1% a Pisa, p=0.02).
I principali fattori di rischio prenatali associati a nascita SGAw nel gruppo dei nati a Pisa sono risultati essere IUGR, importanti alterazioni placentari, infezioni durante la gravidanza, fumo, diabete gestazionale.
Per il follow-up auxologico sono stati reclutati 137 bambini, 78 maschi e 59 femmine. Entro il primo anno di vita circa il 90% dei bambini nati SGAw presentava una lunghezza >3° percentile, a 2 anni di età solo il 7% degli SGAw aveva una statura <3° percentile. Non abbiamo osservato un significativo recupero staturale tra i 2 e i 4 anni di vita.
Riassunto
Nel nostro gruppo di SGAw la nascita pretermine aumentava di circa 5 volte il rischio di avere una lunghezza <3° percentile a 1 anno di età. Infatti tra gli SGAw pretermine circa il 20-21% presentava una lunghezza ad 1 anno di vita <3° percentile e il 16-17% non avevano una statura >3° percentile neppure a 2 e a 4 anni di età. Dal nostro studio emerge dunque come non sia ancora ben chiaro il timing del catch-up growth negli SGAw pretermine.
La presenza di SGAwL aumentava di circa 4,5 volte il rischio di statura <3° percentile a 2 anni di età. In letteratura è noto come tra coloro che non hanno catch-up growth nei primi 2 anni di vita, il rischio relativo di bassa statura a 18 anni sia più elevato per gli SGAL che per gli SGAW.
La prevalenza di EUGRw severo è stata di circa il 29%, con percentuali maggiori alle età gestazionali più basse.
Circa la metà dei nostri pretermine con EUGRw severo presentava una restrizione severa non solo del peso ma anche della lunghezza (EUGRwL severo).
I nati AGAw presentavano EUGRw severo con una prevalenza intorno al 24,3%. Il fatto che la nostra popolazione di neonati pretermine con EUGRw severo fosse caratterizzata principalmente (p<0.001) da neonati nati AGAw potrebbe essere legato all’elevata percentuale di mortalità associata ad un peso alla nascita <3°percentile nei pretermine di alto grado.
La riduzione del trend annuale della prevalenza di EUGRw severo è sicuramente legata all’ottimizzazione degli apporti nutrizionali tramite latti speciali ed alimentazione parenterale all’interno della nostra terapia intensiva e subintensiva neonatale, con una riduzione significativa (p<0.05) del timing di introduzione delle proteine e dei lipidi e un netto aumento (p<0.05) degli apporti quantitativi/kg/die di proteine, lipidi e carboidrati.
Riassunto
I principali fattori prenatali associati allo sviluppo di EUGRw sono risultati essere lo IUGR, la preclampsia e il diabete gestazionale mentre quelli post-natali erano una severa anemia, infezioni, displasia broncopolmonare, retinopatia del pretermine, persistenza di pervietà del Dotto di Botallo e ittero. Il sesso maschile risultava essere associato con un rischio più elevato di sviluppo di EUGRw severo.
Per quanto riguarda il follow-up auxologico l’aderenza allo studio è stata di circa il 53%. Nel nostro gruppo di pazienti la percentuale di soggetti con lunghezza <3° percentile all’età di 1 anno era complessivamente di circa il 16%, con una prevalenza maggiore nel gruppo SGAw-EUGRw severo (33%-40%) rispetto al gruppo AGAw-EUGRw severo (circa 13%) e nei maschi rispetto alle femmine. Tali differenze non sono risultate però statisticamente significative. Non vi è stata alcuna percentuale di guadagno nel percentile della statura tra 1 e 2 anni di vita.
Tra i 2 e i 4 anni di età invece vi è stato un leggero recupero staturale, non statisticamente significativo, nel gruppo degli AGAw-EUGRw severo di sesso maschile. Ciò ha determinato una riduzione complessiva della prevalenza di bambini con statura <3° percentile dal 15,9% a 2 anni al 12,7% a 4 anni di età. I bambini nati pretermine con EUGRw severo possono dunque presentare tempi di recupero della statura superiori rispetto ai soggetti nati a termine. A parità di EUGRw severo, i nati SGAw presentano una prognosi staturale a 4 anni di vita peggiore rispetto ai nati AGAw, evidenziando come la condizione di SGAw e di EUGRw severo, se associate, possano contribuire ad un peggior outcome staturale.
In conclusione possiamo affermare che non vi è ancora chiarezza sul timing del catch-up growth negli SGAw pretermine. Sono necessari ulteriori studi per verificare la possibilità di un catch-up growth in questi bambini anche dopo i 4 anni di età.
Riassunto
La condizione di SGAwL è associata ad un peggior outcome staturale rispetto alla condizione di SGAw. Questo potrebbe indicare la necessità di considerare anche i neonati SGA soltanto per la lunghezza alla nascita ai fini di un eventuale possibilità terapeutica con GH a 4 anni di età.
I neonati pretermine con EUGRw severo, equivalente extrauterino della nascita SGA a termine, sembrano avere un outcome auxologico intermedio tra i neonati SGA a termine e pretermine. Tuttavia, anche in questi neonati, come nei neonati SGA pretermine, il follow-up auxologico dovrebbe valutare anche un’eventuale crescita di recupero oltre i 4 anni di vita. Anche se ad oggi i criteri di inclusione della terapia con GH non prendono in considerazione il possibile fenomeno EUGRw severo nei pretermine nati AGAw, tale situazione dovrebbe essere sottoposta ad un’attenta valutazione da parte delle società scientifiche e dei comitati etici al fine di un’eventuale estensione della nota AIFA 39 anche a questi bambini, magari posticipando l’inizio della terapia a 5-6 anni di età.
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Definizione
2. Introduzione
2.1 Il neonato piccolo per l’età gestazionale (SGA)
2.1.1 Definizione
Viene comunemente definito piccolo per l’età gestazionale (Small for Gestational Age-SGA) il neonato con un peso e/o una lunghezza alla nascita inferiori a quelli attesi in base all’età gestazionale e al sesso, sulla base di curve di riferimento specifiche per la popolazione cui appartiene (1,2).
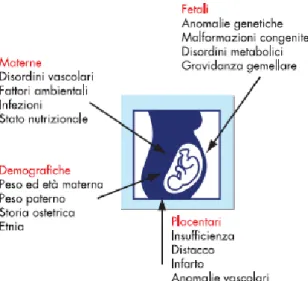
E’ opportuno precisare che il termine SGA non fa riferimento alla crescita fetale ma solo ai dati auxologici alla nascita. La crescita intrauterina, infatti, è un processo biologico complesso che inizia al momento del concepimento e prosegue fino al termine della gravidanza (3). Fattori fetali, placentari e materni (figura 1) possono interferire in questo processo di sviluppo portando ad un mancato raggiungimento del potenziale di crescita del feto. Questa condizione viene definita ritardo di crescita intrauterino (Intrauterine Growth Restriction-IUGR) (4).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Definizione
A parte le infezioni, che sono nello stesso tempo cause sia materne che fetali e possono manifestarsi in ogni momento della gravidanza, le cause fetali (anomalie genetiche, cromosomiche, malformazioni congenite) si manifestano precocemente e determinano generalmente una riduzione di tutte le dimensioni corporee (peso, lunghezza e circonferenza cranica) del feto e del neonato (neonati IUGR proporzionati, simmetrici) e ridotta crescita di recupero post-natale (catch-up growth) (5). Le cause placentari si presentano generalmente in fasi più tardive della gravidanza e determinano più frequentemente una riduzione soprattutto del peso del neonato, con lunghezza e circonferenza cranica normali o poco ridotte (neonati IUGR sproporzionati, asimmetrici) (6) e un buon catch-up growth.
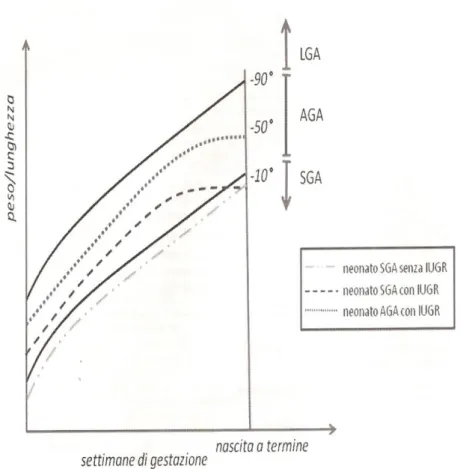
Purtroppo in letteratura il termine IUGR è stato e, talvolta, è ancora erroneamente utilizzato come sinonimo di SGA. Queste due parole esprimono invece una condizione clinica diversa dato che la situazione di IUGR riguarda solo feti che presentano una deviazione verso il basso della curva di crescita intrauterina, riconosciuta con almeno due consecutive valutazioni ecografiche prenatali (7). Una situazione in cui si verifichi IUGR può portare alla nascita di un neonato sia SGA che adeguato all’età gestazionale (8). Inoltre un neonato SGA può non aver mai presentato IUGR (9) (figura 2).
Mentre in Neonatologia è generalmente definito SGA il neonato con peso alla nascita <10° percentile per età gestazionale e sesso, in Endocrinologia Pediatrica si raccomanda di considerare SGA il neonato con peso e/o lunghezza alla nascita inferiore a –2 deviazioni standard (DS), corrispondenti al 2.3° percentile, per l’età gestazionale (2), in base a curve sesso e popolazione specifiche (8). Questa definizione permette infatti di identificare la maggior parte dei soggetti a rischio di bassa statura in età adulta, cioè coloro che richiedono un accurato follow-up auxologico durante l’infanzia e l’adolescenza (10). E’ necessario precisare che la classificazione di un neonato come
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Definizione
SGA non deve essere preclusa dalla contemporanea presenza di bassa statura familiare, sindrome di Turner o altre sindromi associate a bassa statura, deficit di GH o displasia scheletrica (8).
Figura 2: Il neonato SGA e la restrizione di crescita intrauterina (IUGR).
In base ai parametri auxologici alla nascita, i neonati SGA possono essere ulteriormente classificati in sottogruppi: SGA per il peso (SGAW-low birth weight), SGA per la lunghezza (SGAL-low birth lenght) e SGA sia per il peso che per la lunghezza (SGAWL-low birth weight and lenght) (7,11). Questa sottoclassificazione è molto importante dal momento che questi tre gruppi di neonati SGA possono avere uno sviluppo auxologico diverso con differenti risposte ad eventuali terapie (8).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Definizione
La definizione di SGA non tiene conto di fattori che possono influenzare la crescita intrauterina, come ad esempio la statura e il peso materni, l’etnia e la parità. Questi fattori potrebbero comunque essere utilizzati per creare un peso alla nascita “corretto”, in modo tale da identificare i neonati con una crescita fetale anormale (12) distinguendoli da quelli “fisiologicamente piccoli” (13). L’applicazione di questo metodo potrebbe essere utile soprattutto nei bambini con parametri antropometrici alla nascita ai limiti bassi della curva di normalità (3°-10° percentile) per consentire l’identificazione di quelli che, seppur nati adeguati all’età gestazionale, hanno presentato comunque una crescita fetale patologica (8). Questi soggetti costituiscono un gruppo a rischio perché sfuggono alla definizione puramente antropometrica dei neonati SGA ma possono presentarne la stessa morbilità (8).
Sono considerati adeguati per l’età gestazionale (Appropriate for Gestational Age-AGA) i neonati con peso e/o lunghezza alla nascita entro +2 DS per età gestazionale e sesso; infine sono definiti grandi per l’età gestazionale (Large for Gestational Age-LGA) quelli con tali parametri >+2DS, sempre per età gestazionale e sesso (8).
Dato che la definizione di SGA si basa su valori biometrici, appare evidente l’importanza di una precisione estrema nella determinazione delle misure antropometriche alla nascita e di una accurata valutazione dell’età gestazionale, associate all’utilizzo di curve di riferimento adeguate (3).
Per una corretta determinazione dei valori auxologici alla nascita è necessario un sistema accurato e standardizzato di misurazione; in particolare la lunghezza dovrebbe essere misurata più di una volta nelle prime ore di vita, con uno strumento adeguato e con una metodica riproducibile (8).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Definizione
L’età gestazionale deve essere valutata non solo in base alla data dell’ultima mestruazione ma anche sulla base delle ecografie fetali nel primo trimestre (14). Gli indici ultrasonografici più accurati per la determinazione della corretta età gestazionale sono il diametro biparietale e la lunghezza cranio-caudale (intesa come misurazione della distanza tra la parte più distale del capo e la regione glutea del feto) nel primo trimestre (15). Tale indice, però, perde di accuratezza quando si verifica un difetto di crescita nel primo trimestre; in tal caso la data dell’ultima mestruazione diventa il dato più importante per la datazione corretta della gravidanza (6).
Per quanto riguarda le curve di riferimento è necessario l’utilizzo di carte specifiche derivate da un campione numericamente rilevante e fortemente rappresentativo della popolazione cui tali curve si riferiscono (3).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Epidemiologia
2.1.2 Epidemiologia
Secondo stime recenti negli Stati Uniti sono nati 4.115.590 bambini nel 2004 (16). In base alla definizione che abbiamo appena dato di SGA possiamo approssimativamente dire che circa 95.000 bambini erano piccoli per l’età gestazionale (incidenza di circa 1/43). Nello stesso anno il numero di nati con deficit di GH (1/3.500) (17) corrispondeva a circa 1.200, quello dei nati con acondroplasia (la più comune forma di displasia scheletrica con un’incidenza compresa tra 1/10.000 e 1/25.000) (18-20) dovrebbe essere intorno a 160-400. Dunque l’incidenza di neonati SGA è molto elevata se paragonata a quella di altre patologie associate a bassa statura in età adulta ed è per questo motivo che il problema della nascita SGA è fortemente sentito in tutto il mondo scientifico.
Dati Europei che fanno riferimento alla popolazione svedese di neonati sani a termine nati tra il 1973 e il 1975 mostrano come il 5.5% di questi neonati fossero nati SGA, l’1.5% sia per peso che per lunghezza, il 2.4% solo per lunghezza, l’1.6% solo per peso (7).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Fattori prenatali associati
2.1.3 Fattori prenatali associati
Le cause responsabili della nascita SGA dovrebbero sempre essere identificate perché sono indicative di differenti meccanismi patogenetici, con diversi outcome a breve e a lungo termine e con differenti pattern di anomalie metaboliche associate. Ciò influenza chiaramente anche l’approccio terapeutico (8).
Le cause di una ridotta crescita fetale possono essere molteplici ed includono fattori fetali, materni, utero-placentari e demografici, oltre ad altre cause più generiche (21-24).
I principali fattori materni includono l’età, la parità, la gestosi, le infezioni (in particolar modo Toxoplasmosi, Rosolia e infezioni da Citomegalovirus e virus Herpetici), malnutrizione, abuso di alcol e fumo di sigaretta (H). Per quanto riguarda l’ultimo punto, totalmente evitabile con campagne informative adeguate, alcuni studi mostrano come ogni sigaretta fumata in una giornata riduca di 13 grammi il peso del neonato alla nascita (25). I nati da madre fumatrice hanno generalmente un peso, una lunghezza e una circonferenza cranica inferiori, a parità di sesso ed età gestazionale, rispetto ai nati da madri non fumatrici (25-29). Non va dimenticato che anche il fumo passivo può comportare rischi sovrapponibili (30).
I fattori placentari più importanti riguardano tutto ciò che va ad interferire con la perfusione placentare e l’ossigenazione fetale (21). L’esame macroscopico e microscopico della placenta risultano essere molto utili nella definizione delle cause morfologiche, vascolari ed infettive, di insufficienza placentare.
I fattori fetali più frequentemente associati includono anomalie cromosomiche e difetti genetici (l’accrescimento fetale è in genere inibito da disomie materne).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Implicazioni della nascita SGA
2.1.4 Implicazioni della nascita SGA
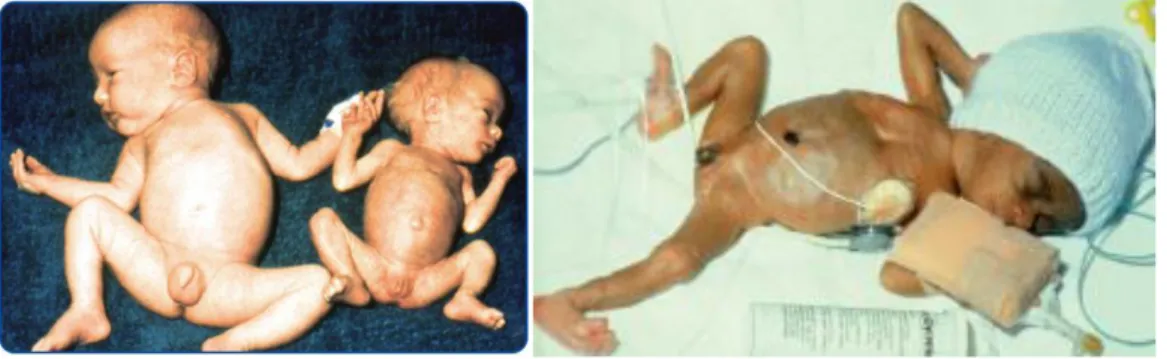
Essere nato SGA comporta un aumentato rischio di morbilità e mortalità sia nel periodo perinatale che nelle fasi successive della vita (6). Nel periodo perinatale vi è un maggior rischio di complicanze respiratorie, ipotensione, ipoglicemia, enterocolite necrotizzante e morte (31,32) (figura 3).
Figura 3: esempi di neonati a termine e pretermine piccoli per l’età gestazionale (3).
Un mancato catch-up growth nei bambini SGA si traduce in bassa statura in età adulta, con tutte le conseguenze fisiche e psicologiche che ciò può comportare (33-36).
Inoltre i bambini nati SGA possono presentare un alterato sviluppo neurologico, con ritardo cognitivo e raggiungimento di inferiori traguardi scolastici rispetto ai coetanei nati AGA (37-40).
Gli adolescenti e gli adulti nati SGA hanno anche un aumentato rischio di sviluppare complicanze cardiovascolari, malattie polmonari ostruttive, diabete mellito tipo 2, insufficienza renale, alterata funzione riproduttiva (41-45), tumori testicolari e, con un’incidenza leggermente inferiore, anche renali (46,47). Donne nate SGA hanno un rischio aumentato di partorire figli SGA (48), suggerendo una potenziale influenza del genoma mitocondriale, trasmesso esclusivamente per via materna (49,50), sul peso alla nascita, e di soffrire di preclampsia e diabete gestazionale (48).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) La crescita del bambino nato SGA
2.1.5 La crescita del bambino nato SGA
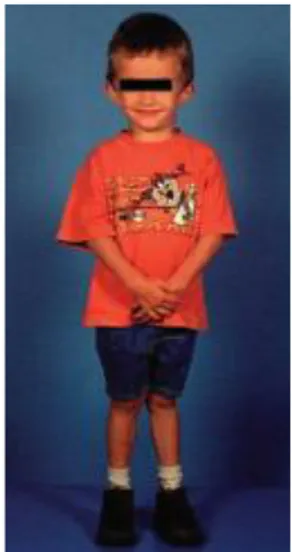
I bambini nati SGA possono presentare una statura inferiore rispetto ai coetanei non SGA sin dalla prima infanzia e raggiungono in media una statura in età adulta pari a -1DS rispetto alla media dei soggetti dello stesso sesso e della stessa razza (33,51) (figura 4).
Figura 4: aspetto tipico del bambino nato SGA che non ha avuto catch-up growth all’età di 5 aa (gentile concessione della Dott.ssa Hokken-Koelega) (3).
Tipicamente questi bambini mostrano un periodo di accelerazione della crescita lineare nei primi 12 mesi di vita che si traduce, in una percentuale che arriva fino al 90% dei casi, in una statura ad 1 anno >-2DS. In circa l’80% dei casi tale recupero avviene addirittura nei primi 6 mesi di vita (6). Il catch-up growth (definito come velocità di crescita espressa in centimetri per anno significativamente più elevata rispetto alla media attesa in base al sesso e all’età cronologica, (6) avviene in genere nel primo anno di vita e si conclude intorno ai 2 anni di età (51,52) e risulta essere una
Introduzione Il neonato piccolo per l’età gestazionale (SGA) La crescita del bambino nato SGA
raggiungimento del potenziale genetico di accrescimento (6). I bambini con grave ritardo di crescita, soprattutto quelli in cui la lunghezza alla nascita è fortemente compromessa, raggiungono più difficilmente una statura nel range di normalità, anche se quelli con un potenziale genetico favorevole (coloro cioè che hanno genitori con statura ai limiti alti della norma) possono raggiungerla in una percentuale rilevante di casi (53). I bambini con sindromi associate a bassa statura, come ad esempio la Sindrome di Silver Russel, presentano in genere un catch-up growth incompleto. La Consensus Statement della International Society of Pediatric Endocrinology e della Growth Hormone Research Society del 2007 sul Management del bambino nato SGA dall’infanzia all’età adulta raccomanda di seguire un protocollo di valutazione specifico per i bambini nati SGA, con un follow-up trimestrale per il primo anno di vita e semestrale negli anni successivi. Ad ogni visita è opportuno eseguire un’accurata misurazione di peso, lunghezza e circonferenza cranica. La Consensus suggerisce inoltre di seguire attentamente quei bambini che non presentano un significativo catch-up growth nei primi sei mesi di vita o che presentano una statura al di sotto dei limiti di normalità all’età di 2 anni (che corrispondono circa al 10% dei nati SGA); questo sottogruppo potrebbe infatti presentare condizioni cliniche specifiche responsabili di scarso accrescimento o, comunque, potrebbe beneficiare di un rapido intervento terapeutico, nell’ottica del raggiungimento di una statura all’interno del range di normalità in età adulta (10).
Un importante studio a lungo termine effettuato su 213 individui nati SGA e 272 soggetti nati AGA ha evidenziato come il 13.6% degli SGA avesse una statura finale a 20-21 anni di età <-2 DS, mentre tra gli AGA questa prevalenza era dell’1.8% (54).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) La crescita del bambino nato SGA
I bambini nati prematuri rappresentano un gruppo a parte dal momento che i pretermine SGA possono impiegare anche fino a quattro anni per raggiungere una statura nei limiti della norma (55).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) La composizione corporea del bambino nato SGA
2.1.6 La composizione corporea del bambino nato SGA
I neonati SGA presentano una ridotta massa grassa rispetto agli AGA (56,57) perché durante la restrizione di crescita fetale lo sviluppo del tessuto adiposo è alterato (56).
Numerosi studi hanno però dimostrato che i bambini nati SGA con adeguato catch-up growth presentano una ridotta massa magra ed una aumentata massa grassa, che si traduce soprattutto in un aumento dell’adiposità viscerale (58-60), rispetto ai coetanei nati AGA (10). Questo si osserva sia in età pediatrica (61) che in età adulta (62). Il fatto che il catch-up growth ponderale dei nati SGA interessi soprattutto il tessuto grasso, rispetto a quello muscolare, è un fenomeno tipico di tutte le condizioni di recupero ponderale dopo malattie che determinano digiuno o malnutrizione proteica (63), come è quello che avviene molto spesso in utero in un neonato SGA.
Un rapido recupero ponderale nell’infanzia è associato ad un’aumentata incidenza di obesità sia in età pediatrica che in età adulta (64,65). Alcuni studi hanno mostrato che l’allattamento materno può rivelarsi protettivo nei confronti del rischio di sviluppare obesità (66,67). Anche se nessuno di questi studi riguarda soggetti nati SGA, la Consensus del 2007 ritiene non adeguata un’alimentazione molto calorica nei nati piccoli per età gestazionale.
Dunque negli SGA la determinazione della composizione corporea in età giovane-adulta non dipende tanto dal peso alla nascita (68) o dal rapido recupero ponderale nell’immediato periodo post-natale quanto piuttosto dall’entità di tale recupero durante l’infanzia, caratterizzato prevalentemente da accumulo di massa grassa (69,70).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Conseguenze neurologiche ed intellettive della nascita SGA
2.1.7 Conseguenze neurologiche ed intellettive della nascita SGA
Molti studi osservazionali hanno evidenziato l’esistenza di un’associazione tra la nascita SGA e lo sviluppo cognitivo, con un peggior outcome in coloro che non presentano catch-up della statura o della circonferenza cranica (71,72). La condizione di SGA sembra essere associata soprattutto a scarse abilità cognitive nel campo della matematica e nella comprensione della lettura, a deficit di attenzione e a disturbi da iperattività (10).
Uno studio post-mortem, eseguito su un piccolo gruppo di bambini nati SGA con IUGR documentato, ha evidenziato un ridotto peso del cervello, associato ad un minor numero di cellule cerebrali, in questi soggetti rispetto a coetanei AGA (73). Lavori sperimentali in vivo hanno studiato il cervello di feti umani comparando le immagini ottenute con risonanza magnetica a quelle ecografiche ed evidenziando come la condizione di IUGR possa portare ad una riduzione del volume cerebrale (74). Studi su bambini nati SGA hanno mostrato una riduzione, in tali pazienti, dello sviluppo della sostanza grigia della corteccia cerebrale (75,76), strettamente correlato con la misura della circonferenza cranica e con il deficit di attenzione in età successive (77).
In molti studi il quoziente intellettivo (QI) dei bambini SGA è risultato essere significativamente più basso dei coetanei AGA (78). Un buon catch-up growth è associato ad un miglior outcome cognitivo e ad un miglior quoziente intellettivo (72, 79,80). Va comunque indubbiamente tenuta in considerazione l’influenza, sull’outcome neurologico, dell’ambiente domestico e scolastico, dello status socioeconomico familiare e dell’intelligenza dei genitori (81-83).
Alcuni studi hanno anche trovato un’associazione tra bassa statura e disturbi psicosociali (84-87).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Programmazione endocrina intrauterina
2.1.8 Programmazione endocrina intrauterina
Esistono evidenze sperimentali su modelli animali di una “programmazione endocrina intrauterina” della crescita staturale, dell’incremento ponderale, della pubertà, delle funzioni endocrine e metaboliche (88). Ad oggi vi sono pochi studi che confermino questa ipotesi sull’uomo (88).
Dato che la malnutrizione intrauterina è il determinante principale delle anomalie endocrine e metaboliche a lungo termine, gli SGA con IUGR sono quelli più a rischio di complicanze post-natali (3).
Per spiegare questo fenomeno sono state proposte varie ipotesi. Secondo la “thrifty genotype” theory, proposta da Neel nel 1962, la sopravvivenza fetale in condizioni di scarso apporto di nutrienti viene garantita dalla presenza di geni che sono gli stessi responsabili dello sviluppo di insulino resistenza in condizioni post-natali favorevoli (89).
Nel 1992 Hales e Barker proposero la “Thrifty Phenotype Hypothesis” (90), secondo cui la deprivazione nutrizionale in epoca fetale portava il feto a sviluppare strategie volte alla sopravvivenza. In una prima fase si assisteva ad uno shift dei nutrienti disponibili verso i tessuti nobili, primo fra tutti il cervello, a scapito della crescita corporea e di altri organi meno fondamentali per la vita, come il pancreas, il fegato e i muscoli, con una conseguente riduzione delle β cellule pancreatiche e variazioni nell’insulino sensibilità. In una seconda fase avveniva una riprogrammazione metabolica fetale volta a garantire la sopravvivenza, anche in condizioni di scarso nutrimento (91). Dopo la nascita l’abbondanza di nutrienti in un neonato che aveva subito una riprogrammazione metabolica fetale poteva favorire l’insorgenza di insulino resistenza e diabete tipo 2 (92). Studi più recenti hanno però dimostrato come feti nati SGA abbiano una identica morfologia delle β cellule pancreatiche, una uguale densità di
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Programmazione endocrina intrauterina
isole pancreatiche e una uguale percentuale di area pancreatica occupata da β cellule rispetto ai feti nati AGA (93); inoltre giovani adulti nati SGA non hanno un difetto di secrezione insulinica e la funzione delle loro β cellule appare normale (94,95).
Secondo il “fetal salvage” model, proposto da Hofman et al. nel 1997 (96), i feti malnutriti garantivano un costante apporto di nutrienti ad organi vitali sviluppando insulino resistenza, con un conseguente shift di glucosio dal tessuto muscolare e da quello adiposo verso organi più nobili, come il cervello, mantenendo una certa quota di secrezione insulina.
La “fetal insulin” hypothesis (977), proposta da Hattersley nel 1999, sottolinea come il basso peso alla nascita, indice di insulino resistenza fetale, e lo sviluppo di intolleranza glucidica, diabete ed ipertensione in età giovane adulta potrebbero essere tutti fenotipi di uno stesso genotipo insulino resistente.
La “catch-up growth” hypothesis, proposta da Cianfarani nel 1999 (92), suggerisce che il ritardo di crescita in utero, seguito da un immediato catch-up growth post-natale, sia legato ad una riprogrammazione fetale verso elevate concentrazioni di IGF1, che predispone all’insorgenza di insulino resistenza e diabete mellito tipo 2 in età giovane adulta. Il catch-up growth che avviene nel primo anno di vita nella maggioranza degli SGA potrebbe rappresentare il momento cruciale per lo sviluppo di complicanze a lungo termine perché il recupero in lunghezza si associa spesso ad un recupero in peso, caratterizzato prevalentemente dall’accumulo di massa grassa (98,99).
Nel 2003 lo stesso Cianfarani ha proposto la “Stem Cell” hypothesis (100) basata sul concetto che, dopo la nascita, i vari organi contengono alcune cellule staminali che rimangono quiescenti ma mantengono la capacità di riattivarsi e rigenerare i tessuti in caso di necessità. La malnutrizione intrauterina riduce il numero
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Programmazione endocrina intrauterina
dei vari organi, specie se sottoposti ad un lavoro eccessivo. Ciò favorisce l’insorgenza di insulino resistenza, diabete mellito non insulino dipendente e malattie cardiovascolari in età adulta.
Ultimamente si è fatta strada una nuova teoria, quella del thrifty “Catch-up fat Phenothype” (63). Secondo questa ipotesi, proposta nel 2006 da Dulloo, in periodi di scarso apporto nutrizionale, come ad esempio in condizioni di ridotto nutrimento durante la vita fetale, si attiva un meccanismo di conservazione energetica che porta alla soppressione della termogenesi (101). Questo meccanismo sembra rispondere esclusivamente a segnali che provengono dal tessuto adiposo. In pratica si instaura un sistema di autofeedback tale che la deplezione dei depositi di grasso sopprime la termogenesi mentre un accumulo la favorisce. (102). Durante i periodi di scarso apporto nutrizionale il muscolo scheletrico è un importante sito di conservazione di energia. Il controllo del tessuto adiposo sulla termogenesi potrebbe creare un feedback loop tra i depositi di trigliceridi nel tessuto adiposo e il metabolismo del muscolo scheletrico. Poiché il muscolo scheletrico è il maggior sito di smaltimento del glucosio insulino mediato, una riduzione della quantità di tessuto scheletrico metabolicamente attivo si traduce in una ridotta utilizzazione di glucosio, con un conseguente iperinsulinismo. Inoltre il glucosio inutilizzato diventerebbe disponibile per la lipogenesi e l’accumulo di massa grassa. La soppressione della termogenesi nel muscolo scheletrico è dunque fondamentale per la conservazione di energia e il reclutamento di glucosio per la sintesi di massa grassa durante il catch-up growth. Inoltre la soppressione della termogenesi nel muscolo scheletrico durante la fase di cacth-up growth indirizza il glucosio verso la creazione di massa grassa. Questo è un vero Thrifty Phenothype, con una tendenza verso l’iperinsulinismo e l’insulino rsistenza e una predisposizione, in caso di condizioni
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Programmazione endocrina intrauterina
ambientali non più sfavorevoli, alla comparsa di altre complicanze metaboliche, come obesità addominale, diabete tipo 2 e malattie cardiovascolari (63).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Conseguenze endocrine della nascita SGA
2.1.9 Conseguenze endocrine della nascita SGA
L’asse GH-IGF1 è stato ampiamente studiato nei bambini SGA.
I neonati piccoli per l’età gestazionale hanno frequentemente elevati livelli di ormone della crescita (Growth Hormone-GH) e bassi livelli di Insulin like Growth Factor 1 (IGF-1), di Insulin like Growth Factor 2 (IGF-2) e di Insulin like Growth Factor binding protein 3 (IGFBP-3), con un aumento dei livelli di Insulin like Growth Factor binding protein 1 1) e di Insulin like Growth Factor binding protein 2 (IGFBP-2) (103), suggerendo una loro insensibilità al GH (104-106). Alcuni studi hanno però ipotizzato che l’alterata secrezione di GH in questi neonati possa essere una conseguenza della sofferenza avvenuta in utero (107). Infatti durante la vita intrauterina l’accrescimento dipende prevalentemente dall’apporto di nutrienti, con l’intervento regolatorio ormonale di insulina e IGF-1; il GH, invece, non esercita un ruolo particolare sulla crescita fino a dopo la nascita (108). Con il procedere dell’età gestazionale i livelli di IGF-1 aumentano e sono correlati con le dimensioni fetali; ecco perché nei feti SGA le concentrazioni di insulina e IGF-1 sono inferiori alla norma mentre il GH è elevato. Il livelli di IGF-1 aumentano solo dopo il parto quando si attiva l’asse GH-IGF-1. Il differente meccanismo di controllo della produzione di IGF-1 è una delle spiegazioni del catch-up growth (109). Il mancato catch-up growth che si verifica nel 10% degli SGA può essere dovuto ad un deficit di GH, ad una parziale resistenza al GH (normali livelli di GH e bassi livelli di IGF-1), ad una parziale resistenza all’IGF-1 (con livelli normali o elevati sia di GH che di IGF-1), al sommarsi di più fattori interferenti con una normale funzionalità dell’asse GH-IGF-1, ad una possibile riprogrammazione intrauterina dell’accrescimento (109). Inoltre alcuni polimorfismi dell’IGF-1, in particolare la delezione parziale in omozigosi del gene codificante per
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Conseguenze endocrine della nascita SGA
l’IGF-1 (110) e mutazioni dell’IGF-IR gene (111), sono stati associati nell’uomo con una ridotta crescita sia prenatale che post-natale (112,113).
Comunque, nell’immediato periodo post-natale, si assiste generalmente ad una normalizzazione dell’asse GH-IGF-1 (114), con adeguata risposta ai test di stimolo per GH e normali livelli circolanti di IGF-1 e IGFBP-3 (115).
La concentrazione di ormone della crescita, IGF-1 e IGFBP-3, non sono predittivi della futura crescita (104), anche se alcuni studi dimostrano come negli SGA con IUGR i livelli di IGF-1 rimangano significativamente più bassi nei bambini che falliscono il catch-up growth a 2 anni di età (116). Inoltre i bambini nati SGA che hanno presentato IUGR mostrano, indipendentemente dal recupero staturale, valori medi di IGF-1 inferiori rispetto ai coetanei AGA e ciò sembra essere correlato con la maggior predisposizione, in questi soggetti, all’insorgenza di malattie cardiovascolari (6).
Per quanto riguarda l’asse ipotalamo-ipofisi-surrene (HPA) alcuni studi hanno evidenziato come gli SGA che non hanno catch-up growth abbiano, a digiuno, livelli significativamente più elevati di cortisolo rispetto agli SGA che hanno mostrato catch-up growth (117). Anche se modelli animali hanno evidenziato come lo stress fetale, la malnutrizione materna e la terapia con corticosteroidi in gravidanza portino alla nascita di neonati di basso peso con iperattività, sia basale che dopo stimolo, dell’asse HPA, con successivo sviluppo di ipertensione e intolleranza glucidica (118,119), studi effettuati sull’uomo non confermano questi dati (un ruolo cruciale sembra essere svolto dalla 11 β idrossi-steroidodeidrogenasi tipo 2 placentare che trasforma il cortisolo nel suo composto inattivo cortisone, proteggendo così il feto da una eccessiva esposizione a glucocorticoidi di origine materna).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Conseguenze endocrine della nascita SGA
La maggior parte dei bambini nati SGA presentano un timing di sviluppo puberale nella norma (120). Tuttavia alcuni studi mostrano come lo spurt di accrescimento puberale sia modestamente ridotto negli SGA e come nelle bambine il menarca sia anticipato di 5-10 mesi (121,122). Chiaramente in coloro che presentano una pubertà precoce, in mancanza di terapie adeguate, vi è una compromissione della statura in età adulta (123,124). D’altra parte, la variabilità del timing e della progressione della pubertà negli SGA è influenzata da diversi fattori, come ad esempio l’etnia e la nutrizione (10). La condizione di SGA è stata associata a elevati livelli di FSH (“Folliculing Stimulating Hormone”) e a una minore dimensione degli organi genitali durante l’adolescenza (125). Queste alterazioni possono persistere anche nell’età riproduttiva. Le bambine SGA che presentano un rapido recupero ponderale durante la prima infanzia sono più a rischio di adrenarca prematuro (126-129). Nelle bambine SGA con adrenarca prematuro la pubertà e il menarca sono anticipate rispetto alle coetanee AGA con solo adrenarca prematuro (130). Negli SGA che non presentano catch-up staturale e ponderale l’epoca di insorgenza dell’adrenarca è sovrapponibile a quella dei coetanei non AGA (10). L’età ossea è una scarso predittore del timing puberale e della statura in età adulta (131).
Nei maschi SGA l’incidenza di ipospadia e criptorchidismo è maggiore rispetto a quella osservata nei maschi AGA (132).
Per quanto riguarda la funzione ovarica alcuni studi hanno evidenziato che le adolescenti nate SGA possono avere un ridotto numero di cicli ovulatori, un’aumentata secrezione di androgeni ovarici e surrenalici, un eccesso di adiposità addominale (anche in assenza di obesità) e iperinsulinismo (41, 133). Tuttavia ad oggi non esistono dati significativi a supporto di una disfunzione ovarica, di una ridotta fertilità o di menopausa precoce in donne nate SGA (41,125)
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Conseguenze endocrine della nascita SGA
Gli ormoni tiroidei hanno una funzione essenziale sulla crescita fetale e importanti effetti metabolici dopo la nascita (3). Tuttavia, ad oggi, in letteratura non vi sono dati attendibili che dimostrino alterazioni significative dell’asse tiroideo nei nati SGA (134).
Studi recenti hanno invece evidenziato come la nascita SGA sia associata ad un ridotto sviluppo di mineralizzazione e densità ossea (135) ma questa associazione si riduce in maniera importante se corretta per la statura in età adulta (135). Pertanto negli SGA non è documentata una significativa aumentata incidenza di fratture (136).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Conseguenze metaboliche della nascita SGA
2.1.10 Conseguenze metaboliche della nascita SGA
La sindrome metabolica può essere definita come un cluster di alterazioni metaboliche caratterizzato da insulino resistenza (iperinsulinismo), alterazione del metabolismo glucidico, dislipidemia, ipertensione ed obesità, che predispongono all’insorgenza di malattia cardiovascolare (137).
E’ noto ormai da tempo come un basso peso alla nascita sia associato allo sviluppo di malattia cardiovascolare in età giovane adulta.
Negli SGA l’insulino resistenza è stata evidenziata addirittura all’età di 1 anno (138) e nei bambini in età prepubere ha un’incidenza maggiore in presenza di un rapido catch-up ponderale e di un body mass index (BMI) >17 kg/m2 (139,140). I bambini SGA con elevato BMI hanno un aumentato rischio di sviluppare, in età adulta, un alterato metabolismo glucidico (141). Studi condotti su adolescenti e giovani adulti hanno evidenziato che la captazione glucidica insulino mediata sia inferiore negli SGA a quella osservata in coetanei AGA (33,94) In questi soggetti l’insulino resistenza era indipendente da fattori confondenti come BMI, età, storia familiare di diabete o dislipidemia, uso di contraccettivi orali e fumo (33).
La “Thrifty Genotype” hypothesis, la “Thrifty Phenotype” hypothesis, la “Fetal Salvage” hypothesis, la “Fetal Insulin” hypothesis, la “Catch-up growth” hypothesis e la teoria del thrifty “Catch-up fat Phenothype” hanno proposto una spiegazione scientifica dell’insulino resistenza negli SGA (6).
Alcuni studi hanno sottolineato come anche il tessuto adiposo possa giocare un ruolo importante nell’insulino resistenza riscontrata negli SGA dal momento che esso non presenta solo un’alterazione quantitativa (come illustrato precedentemente) ma anche qualitativa. In individui SGA con normale tolleranza glucidica è stata infatti trovata una precoce insulino resistenza nel tessuto adiposo (94). L’insulino resistenza
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Conseguenze metaboliche della nascita SGA
potrebbe essere influenzata da polimorfismi genetici di componenti fondamentali del tessuto adiposo, come il β3-adrenoceptors e il peroxisome proliferator-activated receptor γ (142). Il tessuto adiposo, in passato ritenuto un inerte deposito di energia, è in realtà un organo endocrino molto attivo e secerne numerose sostanze bioattive, come ad esempio l’adiponectina, che esercita un importante effetto insulino sensibilizzante (143-145). E’ stata trovata una correlazione negativa tra insulino resistenza e livelli di adiponectina circolante negli AGA, associata ad una riduzione significativa dei livelli di adiponectina nei nati SGA (146).
Anche se le percentuali sono molto basse, giovani adulti nati SGA hanno una più elevata incidenza di fattori di rischio metabolico (2.3%) rispetto ai coetanei AGA (0.4%) (147).
Comunque non vi è evidenza significativa che il diabete mellito tipo 2, la ridotta tolleranza glucidica o la dislipidemia abbiamo un’incidenza maggiore tra gli SGA rispetto alla popolazione generale (148).
Gli SGA hanno livelli leggermente più elevati di pressione sistolica ma questo non è correlato con un aumentato rischio in questi soggetti di sviluppare ipertensione in età pediatrica o adolescenziale (149).
Sicuramente alcuni fattori di rischio metabolico associati alla nascita SGA possono essere amplificati dalla predisposizione genetica e da fattori di rischio ambiente-correlati (3); l’alterato sviluppo fetale dovrebbe essere considerato un fattore di rischio contribuente (10). La gestione più corretta consiste in un precoce intervento sullo stile di vita, volto a prevenire un’iperalimentazione nell’immediato periodo post-natale e, conseguentemente, lo sviluppo di obesità, a promuovere l’attività fisica e ad abolire il fumo (3).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Management endocrino del bambino nato SGA: crescita e pubertà
2.1.11 Management endocrino del bambino nato SGA: crescita e pubertà
Come già esposto in precedenza, dalla letteratura risulta chiaro che circa il 10% dei bambini nati SGA siano destinati ad avere una statura in età adulta <-2DS.Tra coloro che non hanno catch-up growth nei primi 2 anni di vita, il rischio relativo di bassa statura a 18 anni è 5.2 per gli SGAW e 7.1 per gli SGAL (7).
L’uso del GH nei bambini con bassa statura nati SGA è stato studiato negli ultimi 50 anni (150-152), con lo scopo di consentire in questi soggetti un adeguato catch-up growth, con un mantenimento del recupero staturale in età pediatrica e il raggiungimento di una statura in età adulta più vicina possibile al target genetico staturale (153-155). La statura dei genitori e la lunghezza alla nascita sono le sole variabili che sembrano essere predittive della statura in età adulta dei bambini SGA che non vengono trattati (54).
Gli importanti effetti di tale terapia in questi soggetti (156) hanno portato all’approvazione nel 2001 da parte della Food and Drug Administration (FDA) e nel 2003 da parte dell’European Agency for the Evaluation of Medicinal Products (EMEA) della terapia con GH nei bambini con bassa statura nati SGA.
La tabella 1 mostra le indicazioni e le modalità di trattamento con GH in bambini SGA approvate dall’FDA e dall’EMEA.
Tabella 1: indicazioni e modalità di trattamento con GH nei bambini nati SGA approvate dall’FDA e dall’EMEA
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Management endocrino del bambino nato SGA: crescita e pubertà
In Italia la nota AIFA (Agenzia Italiana del FArmaco) 39 prevede che bambini nati SGA che all’età di 4 anni hanno una statura <-2.5 DS, con una velocità di crescita <50° percentile e un’altezza almeno 1DS al di sotto dell’SDS (Standard Deviation Score) del target genetico possano essere sottoposti a trattamento con GH (tabella 2).
Tabella 2: indicazioni al trattamento con GH nei bambini nati SGA (nota AIFA 39).
Peso alla nascita nei nati singoli uguale o inferiore a -2DS (<3°percentile) per l’età gestazionale e comunque inferiore ai 2500 grammi
Età al momento della proposta di somministrazione del GH uguale o superiore a 4 anni
Statura inferiore o uguale a -2,5 DS e velocità di crescita inferiore al 50° percentile
Peso alla nascita nei nati singoli uguale o inferiore a -2DS (<3°percentile) per l’età gestazionale e comunque inferiore ai 2500 grammi
Età al momento della proposta di somministrazione del GH uguale o superiore a 4 anni
Statura inferiore o uguale a -2,5 DS e velocità di crescita inferiore al 50° percentile
Chiaramente il trattamento con GH è consentito solo dopo l’esclusione di altre cause di bassa statura (terapie farmacologiche che inibiscono la crescita, alcune malattie croniche, disordini endocrini come l’ipotiroidismo, deprivazione affettiva o altre sindromi associate a bassa statura) che non rientrino di per sé tra le patologie in cui è approvato il trattamento con ormone della crescita (8). I bambini SGA con una sindrome associata rispondono peggio alla terapia di quelli che non hanno una sindrome (152) anche se nei bambini con sindrome di Silver Russel la terapia con GH sembra migliorare non solo la crescita staturale ma anche il BMI e il profilo lipidico (157).
Il dosaggio dei livelli di IGF-1 prima di iniziare il trattamento può avere un ruolo non solo nell’individuare i pazienti con vero deficit di GH (6), ma anche nella previsione della risposta alla terapia (158); il suo monitoraggio in corso di terapia è utile per ottimizzare la dose di GH (10).
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Management endocrino del bambino nato SGA: crescita e pubertà
Gli studi presenti in letteratura mostrano come la risposta al GH nei primi 2-3 anni di trattamento dipenda da diversi fattori, quali l’età e l’altezza all’inizio della terapia, l’altezza media dei genitori e la dose di ormone utilizzata. Il recupero staturale correla positivamente con la precocità di inizio del trattamento e con la dose utilizzata (159). E’ consigliato un dosaggio iniziale compreso tra 35 e 70 μg/kg/die, con l’utilizzo della dose più alta nei bambini con compromissione staturale maggiore (10). In media dopo 3 anni di trattamento si verifica un recupero staturale pari a 1,2-2 DS con dosi di GH comprese tra 35 e 70 μg/kg/die. Dopo l’iniziale catch-up growth la maggior parte del recupero staturale si mantiene fino all’età adulta. La fase di mantenimento sembra essere meno dose-dipendente. In presenza di alcune sindromi (come la S.me di Bloom o quella di Fanconi) il trattamento con GH è controindicato per il rischio elevato di importanti effetti collaterali (10).
In coloro che rispondono alla terapia con GH la sospensione improvvisa del trattamento in età preadolescenziale non è raccomandata perché determina, dopo 2-3 anni, un catch-down growth (152).
Si raccomanda la sospensione della terapia in età adolescenziale solo quando la velocità di crescita risulti inferiore a 2 cm/anno (10).
Recentemente è stato osservato come varianti geniche, come la delezione dell’esone 3 del recettore per il GH, possano essere coinvolte in una migliore risposta alla terapia con ormone della crescita nei bambini SGA (160). In futuro potranno essere molto utili test genetici per individualizzare e rendere più efficace la terapia con ormone della crescita (6).
Nella maggior parte dei bambini in trattamento lo sviluppo puberale segue un decorso regolare (161). Ad oggi non vi sono dunque indicazioni che l’associazione della
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Management endocrino del bambino nato SGA: crescita e pubertà
terapia con analoghi agonisti del Gonadotropin Releasing Hormone (GnRH), volto a ritardare lo sviluppo puberale, determini un ulteriore guadagno staturale (162).
La terapia con GH sembra migliorare anche la composizione corporea dei soggetti SGA portando ad un incremento della massa muscolare (163,164).
I bambini SGA che non hanno avuto catch-up growth hanno un basso intake calorico, soprattutto di lipidi e di glucidi, rispetto ai valori raccomandati per l’età ed il sesso e questo è associato a ridotti livelli circolanti di leptina, ormone implicato nella regolazione dell’appetito e del peso corporeo (165,166). Durante la terapia con GH si assiste ad un incremento dell’appetito, con un conseguente aumentato apporto nutrizionale, e ad un aumento dei livelli di leptina (167).
Per quanto riguarda gli effetti neurologici della terapia con GH nei bambini SGA la letteratura mostra ad oggi dati contrastanti. In alcuni studi infatti il GH sembra migliorare il quoziente intellettivo (168-170) mentre in altri tali risultati non sono stati osservati (171).
Se non c’è risposta alla terapia con GH è necessaria una valutazione della compliance al trattamento, della dose di ormone, una rivalutazione della diagnosi e deve essere presa in considerazione la possibilità di interrompere la terapia (10).
L’incidenza degli effetti collaterali nei bambini SGA è simile a quella riscontrata in pazienti affetti da altre patologie che richiedono trattamento con GH (172). In particolare non è stata osservata né una differenza significativa nella maturazione ossea (173, 153) né un significativo aumento di intolleranza glucidica (172) rispetto agli SGA non trattati o ai bambini con deficit di GH sottoposti a terapia. Livelli più elevati di insulina basale, con una relativa insulino resistenza, sono stati osservati in bambini SGA in terapia con GH (174) ma sono risultati completamente reversibili dopo la
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Management endocrino del bambino nato SGA: crescita e pubertà
per la parziale resistenza insulinica degli SGA trattati con GH e contribuisce a mantenere nella norma il metabolismo glucidico (172,177). Allo stesso modo giovani adulti nati SGA e trattati durante l’infanzia con GH non hanno mostrato un aumentato rischio di sindrome metabolica o diabete mellito tipo 2 rispetto a coetanei SGA che non avevano ricevuto il trattamento con GH (178). In letteratura è ben noto che gli SGA, anche se non vengono trattati con GH, possono avere un aumentato rischio di sviluppare insulino resistenza e diabete mellito tipo 2 in età giovane adulta (33,96). Il rischio di sviluppare queste patologie, tuttavia, appare maggiore negli SGA con spontaneo catch-up growth rispetto a quelli che non lo hanno avuto e sono stati dunque sottoposti a terapia con GH (70,179-181).
La terapia con ormone della crescita non aumenta il rischio di ipertensione (163) né di dislipidemia (182).
Non vi è evidenza di aumentato rischio di insorgenza di patologia tumorale dopo terapia con GH (172).
Come in ogni bambino trattato con ormone della crescita, anche negli SGA può insorgere ipertensione endocranica benigna con una incidenza di 1/1000 (6): in tal caso è indicata la sospensione, almeno per un breve periodo di tempo, della cura ormonale.
Tuttavia, dato che ad oggi non esistono ancora dati assoluti in grado di chiarire se la terapia con GH nei bambini SGA sia associata a benefici a lungo termine oppure se i rischi metabolici in età adulta possano essere aumentati dal trattamento (10,3), è consigliata una attenta valutazione, prima di iniziare terapia con GH, in soggetti che presentino altri fattori di rischio (tra i quali non va mai dimenticata la familiarità) per lo sviluppo di complicanze metaboliche o malattie cardiovascolari (8). Allo stesso modo è consigliato un adeguato e periodico monitoraggio dello stato metabolico dei bambini in
Introduzione Il neonato piccolo per l’età gestazionale (SGA) Management endocrino del bambino nato SGA: crescita e pubertà
terapia con ormone della crescita al fine di poter garantire loro una diagnosi precoce delle possibili complicanze (8,10).
Introduzione Il neonato con restrizione di crescita extrauterina Definizione
2.2 Il neonato con restrizione di crescita extrauterina
2.2.1 Definizione
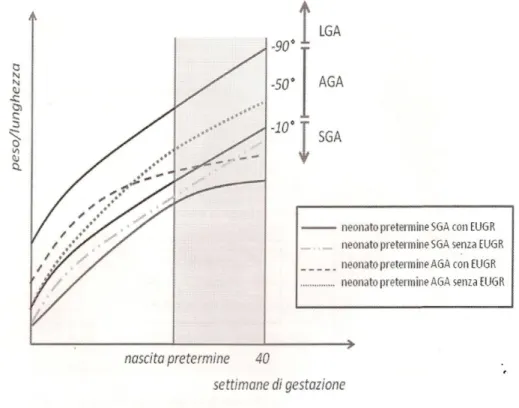
Per restrizione di crescita extrauterina (Extra Uterine Growth Restriction-EUGR) si intende il riscontro di parametri di crescita (peso, lunghezza, circonferenza cranica) <10° percentile rispetto alla crescita intrauterina attesa, prendendo in considerazione, come età alla dimissione (generalmente un’età corretta uguale o di poco inferiore al termine), l’età post-concezionale (183) (figura 5).
Figura 5: il neonato pretermine e la restrizione di crescita Extrauterina (EUGR)
Il fenomeno EUGR è una problematica relativamente recente; è infatti legato al miglioramento dell’assistenza all’interno delle terapie intensive neonatali, che ha determinato la sopravvivenza di pretermine di età gestazionale sempre più bassa e/o con importanti patologie (184).
Introduzione Il neonato con restrizione di crescita extrauterina Definizione
La maggior parte dei neonati Very Low Birth Weight (VLBW) vive nella terapia intensiva neonatale una quantità di tempo equivalente al terzo trimestre di gestazione, con la inevitabile esposizione alla vita extrauterina in un momento fisiologicamente caratterizzato da una rapida crescita intrauterina. L’unico modo per non soccombere in questa condizione sfavorevole è lo shift dell’energia, normalmente destinata esclusivamente all’accrescimento, verso inaspettate strategie di sopravvivenza (185). In questo periodo estremamente delicato è necessario garantire a questi piccoli pazienti un apporto nutritivo adeguato al mantenimento di una velocità di crescita, in ambiente extrauterino, simile a quella che avrebbero avuto all’interno dell’utero materno (186). Spesso però il raggiungimento di un adeguato apporto di nutrienti è limitato dalla ridotta capacità di questi delicatissimi individui di metabolizzare le sostanze ricevute (187-189) e dalla contemporanea necessità, da parte dei neonatologi, di limitare l’apporto giornaliero di liquidi per ridurre le complicanze legate alla persistenza della pervietà del dotto di Botallo o alla Chronic Lung Disease (190-192). E’ per questo motivo che la restrizione di crescita extrauterina è sicuramente una delle morbilità più frequentemente osservata nei neonati VLBW e la sua incidenza aumenta con la riduzione dell’età gestazionale e/o del peso alla nascita (183,194-197), anche perché il difetto nell’apporto di nutrienti durante le prime settimane di vita, in genere, non viene corretto durante il restante periodo di ospedalizzazione (198,199) (figura 6).
Le conseguenze di un deficit di crescita post-natale non sono state ancora completamente identificate ma includono sicuramente deficit di crescita e di sviluppo non solo nella prima infanzia (200-202) ma anche nelle epoche successive della vita (203-207), con un associato rischio di insorgenza malattie metaboliche e cardiovascolari in età giovane adulta (208,209).
Introduzione Il neonato con restrizione di crescita extrauterina Definizione
Introduzione Il neonato con restrizione di crescita extrauterina Epidemiologia
2.2.2 Epidemiologia
Studi recenti hanno mostrato come l’incidenza di EUGR sia relativamente alta all’interno della popolazione dei nati pretermine.
Uno studio su oltre 20.000 neonati, di età gestazionale alla nascita compresa tra 23 e 34 settimane, ha evidenziato come l’incidenza di EUGR fosse, in questa popolazione, circa il 28% facendo riferimento al peso, il 34% se il parametro considerato era la lunghezza e il 16% prendendo in esame la circonferenza cranica (183).
Da un lavoro giapponese su circa 416 neonati di età gestazionale <32 settimane è emerso inoltre come tra i VLBW l’incidenza di EUGR fosse intorno al 57%, 49% e 6% prendendo rispettivamente in considerazione il peso, la lunghezza e la circonferenza cranica alla dimissione (210).
Un ulteriore dato emerge da uno studio olandese su circa 400 neonati, sempre di età gestazionale <32 settimane. In questo lavoro gli autori hanno diviso i nati in SGA e AGA, mostrando come i nati AGA presentassero EUGR con una incidenza intorno al 21%. Andando a scorporare i parametri auxologici alla dimissione, all’interno di questo 21% di neonati, il 28% aveva presentato una restrizione del peso, il 26,5% della lunghezza e il 45,5% di entrambi (211).
I pretermine nati AGA, infatti, spesso crescono lentamente nelle prime settimane di vita e questo rischio è fortemente ed inversamente correlato con l’età gestazionale alla nascita (185).
Introduzione Il neonato con restrizione di crescita extrauterina Fattori post-natali associati alla condizione di EUGR
2.2.3 Fattori post-natali associati alla condizione di EUGR
Data l’importante entità del fenomeno della restrizione di crescita extrauterina, il mondo scientifico si è entusiasmato nella ricerca dei fattori post-natali responsabili di questa condizione.
Oltre alla forte correlazione positiva tra EUGR e bassa età gestazionale e/o basso peso alla nascita (183,212,213), è apparso sin da subito chiaro a tutti che il principale determinante dell’EUGR fosse l’inappropriato apporto di nutrienti fornito ai pretermine di alto grado nelle prime fasi della loro vita post-natale (183). E’ stato infatti stimato come più della metà della variazione della crescita post-natale nei VLBW sia correlata al deficit energetico e proteico nelle prime settimane di vita (199).
Altri fattori indirettamente correlati ad EUGR sono risultati il sesso maschile, la necessità di ventilazione assistita a 1 giorno di vita e/o di supporto respiratorio a 28 giorni di vita, una diagnosi di enterocolite necrotizzante e l’esposizione post-natale a steroidi (l’esposizione prenatale agli steroidi mostrava invece un effetto protettivo) (183).
Per quanto riguarda i potenziali effetti degli steroidi post-natali è necessaria una precisazione. Molti studi hanno sottolineato l’importante influenza sulla crescita corporea, polmonare e cerebrale di tale terapia (214-218). Va però evidenziato come la broncodisplasia, principale indicazione all’utilizzo post-natale di steroidi, sia una condizione molto grave che è di per sé responsabile di scarso accrescimento; ciò non consente dunque di scindere se in questi pazienti il ritardo di crescita sia legato alla malattia polmonare di per sé o alla terapia con steroidi (183).