pag. 1
Capitolo 1. Il carcinoma dell’endometrio1.1 Epidemiologia
Il carcinoma dell‟endometrio costituisce la più frequente neoplasia del tratto genitale femminile, sia in Europa che nel Nord America, e rappresenta il 4° tumore più frequente dopo quelli della mammella, del polmone e del colon. In Europa, circa 81500 donne ne sono affette ogni anno e l‟incidenza è in aumento, sebbene essa costituisca solo la settima causa di morte in Europa e l‟ottava nel Nord America.
In Italia, ogni anno si registrano circa 5000 nuovi casi di carcinoma dell‟endometrio, corrispondenti al 15% di tutte le neoplasie. Pur essendo una malattia prevalentemente post-menopausale, nel 25% dei casi insorge in età pre-menopausale (1).
1.2 Eziopatogenesi e fattori di rischio
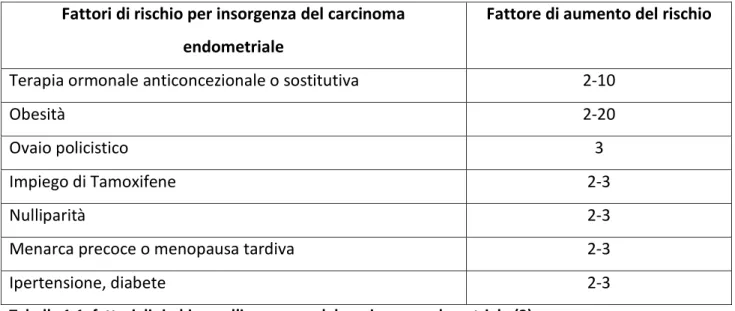
La presenza di una attività estrogenica non opposta ai progestinici sembrerebbe essere la principale causa delle neoplasie endometriali. Tra le situazioni cliniche associate a rischio di insorgenza si considerano il menarca precoce, la menopausa tardiva, la policistosi ovarica e la nulliparità. L‟obesità, il diabete, l‟ipertensione e alcune epatopatie croniche sono spesso comorbidità riscontrate in queste pazienti (vedi tabella 1.1). La terapia sostitutiva con soli estrogeni, aumenterebbe il rischio relativo da 2 a 10 volte in relazione alla dose e al tempo di assunzione; la somministrazione di progesterone, invece, sembra ridurre significativamente tale rischio, grazie alla sua azione protettiva svolta nei confronti
pag. 2
dell‟iperplasia adenomatosa, considerata come precursore dell‟adenocarcinoma endometriale.
Tabella 1.1: fattori di rischio per l’insorgenza del carcinoma endometriale (2).
La terapia con Tamoxifene, somministrata alle pazienti affette da carcinoma mammario, è stata identificata come un fattore di rischio di insorgenza per la neoplasia endometriale (2).
1.3 Anatomia
La storia evolutiva del carcinoma endometriale è fortemente condizionata dalla localizzazione dell‟organo e dal relativo drenaggio linfo-vascolare. Da un punto di vista anatomico, l‟utero è posto nella piccola pelvi, tra la vescica, dalla quale è separato tramite il cavo vescico-uterino, e il retto, con l‟interposizione del cavo del Douglas.
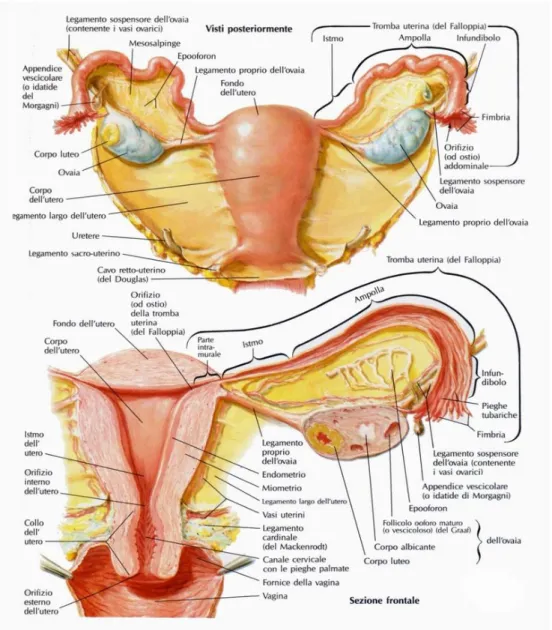
L'utero (figura 1.1) è composto da una porzione globosa superiore, denominata fondo, che si continua con il corpo,di forma conica avente l'apice rivolto posteriormente verso il basso; un piano immaginario passante attraverso l'inserzione delle tube divide il corpo dal fondo.
Fattori di rischio per insorgenza del carcinoma endometriale
Fattore di aumento del rischio
Terapia ormonale anticoncezionale o sostitutiva 2-10
Obesità 2-20
Ovaio policistico 3
Impiego di Tamoxifene 2-3
Nulliparità 2-3
Menarca precoce o menopausa tardiva 2-3
pag. 3
Figura 1.1: anatomia normale di utero e annessi.La porzione che connette il corpo dell'utero alla vagina è denominata cervice. Il fondo, il corpo e la porzione superiore della cervice uterina sono ricoperti dal peritoneo parietale, che rappresenta il perimetrio. I piani muscolari che costituiscono lo spessore della parete formano il miometrio.
Il miometrio circoscrive una cavità interna a forma di ampolla denominata cavità uterina; nella cervice uterina tale cavità assume un aspetto fusiforme, formando il canale cervicale. La cavità uterina e il canale cervicale sono tappezzate da un epitelio cilindrico
pag. 4
monostratificato, dove si localizzano cellule ciliate e cellule mucipare ancorate al tessuto connettivo che costituisce la lamina propria; questo strato epiteliale è chiamato endometrio. Sulla superficie della parte di cervice uterina che protrude in vagina, l‟endometrio lascia il posto ad un epitelio squamoso pluristratificato che continua in vagina. Il limite tra i due tipi di tessuto forma la giunzione squamo-colonnare.
L‟albero vascolare arterioso dell‟utero è costituito dall‟arteria uterina che origina dal tronco anteriore dell‟arteria ipogastrica. Essa si divide nei suoi rami terminali, che sono le arterie del fondo dell‟utero, il ramo ovarico, quello tubarico e l‟arteria per il legamento rotondo. Le vene, che originano dalla parete uterina, formano una ricca rete a livello dello strato vascolare del miometrio; qui presentano una parete molto sottile e sono denominate “seni uterini”. Le vene si raccolgono poi lungo il margine laterale dell‟utero, al di sotto del peritoneo, formando, insieme alle vene provenienti dalla vagina, il plesso utero-vaginale. Questo si scarica principalmente nelle vene uterine che, dopo aver raccolto anche alcune vene provenienti dal plesso vescico-vaginale, formano un unico tronco afferente alla vena ipogastrica.
Nel loro decorso alla base del legamento largo, in direzione della parete della pelvi, le vene sono contenute in un tessuto connettivo che concorre, assieme al connettivo che circonda l‟arteria e i vasi linfatici, a formare il cosiddetto “legamento cardinale” (o “di Mackenrodt”). Altre vene del plesso utero-vaginale si uniscono alle vene ovariche e assieme a queste afferiscono nel plesso pampiniforme, tributario a destra della vena cava
pag. 5
inferiore e a sinistra della vena renale. Il plesso utero-vaginale e le vene uterine sono in ampia comunicazione con gli altri plessi venosi del piccolo bacino.
I vasi linfatici dell‟utero formano reti tra loro comunicanti nei diversi strati della parete e fanno capo, infine, a una rete superficiale sottosierosa. I linfatici del corpo comunicano ampiamente con quelli del collo.
L‟utero ha una ricca rete linfatica che drena principalmente nei linfonodi paracervicali e successivamente negli iliaci esterni ed ipogastrici. I linfonodi pelvici drenano quindi verso gli iliaci comuni e i para-aortici I vasi linfatici del fondo uterino passano lateralmente seguendo i vasi ovarici, e fanno capo direttamente ai linfonodi para-aortici omolaterali e ai pre-aortici. Dai linfonodi ipogastrici, alcuni vasi linfatici decorrono lungo il legamento rotondo e raggiungono i linfonodi inguinali superficiali del gruppo supero-mediale, considerati già stazioni metastatiche nel carcinoma uterino (3).
1.4 istologia
Il carcinoma dell‟endometrio presenta numerosi sottotipi istologici, il più frequente dei quali è l‟adenocarcinoma endometrioide (75%); seguono l‟adenocarcinoma sieroso papillare (5%-10%), l‟adenocarcinoma a cellule chiare (1%-5%), l‟adenocarcinoma mucinoso (1%), il carcinoma squamoso (< 1%) e il carcinoma indifferenziato (2).
Dal punto di vista clinico le varianti endometrioide e quella sieroso papillare sono le più frequenti. L‟adenocarcinoma endometrioide si manifesta più frequentemente in menopausa o in perimenopausa, presentando una prognosi più favorevole. Usualmente si
pag. 6
sviluppa da una iperplasia, e spesso esprime recettori per estrogeni e progesterone. Generalmente viene diagnosticato in uno stadio iniziale e presenta un basso grado di differenziazione.
1.5 Sintomi
La metrorragia rappresenta il segno clinico più frequente; dolore e leucoxantorrea sono in genere dovuti a fenomeni necrotico-colliquativi, tipici comunque della neoplasia in fase più avanzata. Un interessamento linfonodale importante può determinare edema agli arti inferiori, al pube o alla vulva.
1.6 Storia naturale e fattori prognostici
La prognosi dei tumori endometriali è direttamente correlata all‟età di insorgenza, allo stadio, al tipo istologico ed in particolar modo nel carcinoma endometriale rivestono un ruolo di notevole importanza anche la profondità d‟invasione miometriale, il grado di differenziazione e la presenza di invasione vasculo-linfatica (4). L‟invasione del miometrio ed il grado istologico sono entrambi fattori prognostici indipendenti.
Yonei e al. (5) in uno studio retrospettivo hanno dimostrato che a parità di trattamento le pazienti con età superiore a 60 anni hanno una prognosi peggiore rispetto a quelle con età inferiore, indipendentemente da altri fattori.
Lo stadio è un importante indicatore di prognosi: infatti, la sopravvivenza a 5 anni è dell‟80% al I stadio FIGO e cade drasticamente nel IV stadio al 5%. In caso di
pag. 7
interessamento dello stroma della cervice uterina (stadio FIGO 2009 - II), la prognosi peggiora poiché la sopravvivenza libera da malattia diminuisce dall‟80% al 47% (6); il significato prognostico della presenza di cellule neoplastiche a livello del liquido di lavaggio peritoneale e in assenza di altri fattori sfavorevoli non è dirimente (7).
Per quanto riguarda l‟istotipo, il carcinoma endometrioide ha una sopravvivenza a 5 anni dell‟ 87,5%, il sieroso papillifero del 34%, il carcinoma a cellule chiare del 42%.
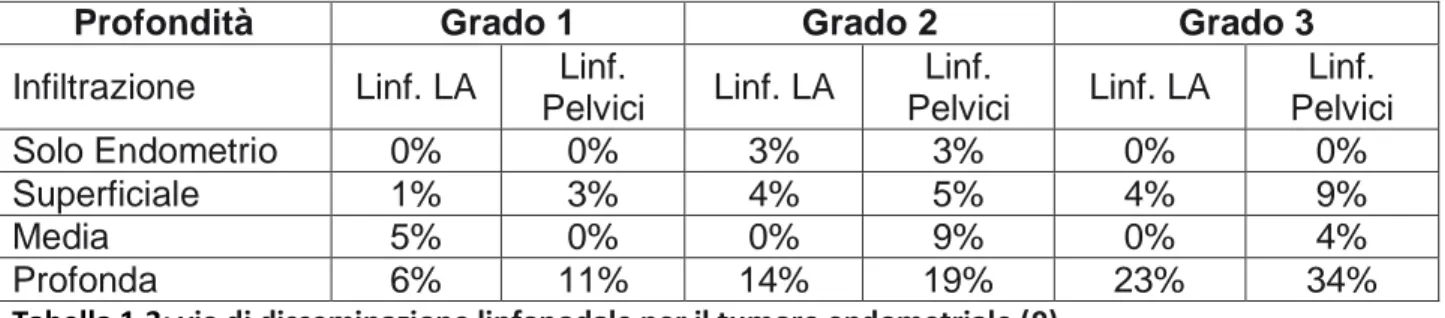
L‟invasione profonda del miometrio è associata ad un alto rischio di recidive (8) ed un aumentato rischio di coinvolgimento linfonodale come riportato in tabella 1.3 (9).
La presenza di metastasi linfonodali pelviche e para-aortiche è probabilmente il fattore con la più alta predittività di fallimento della terapia primaria del carcinoma endometriale e per questo le metastasi linfonodali sono considerate come fattore predittivo di diffusione sistemica.
Metastasi linfonodali si riscontrano nel 5%-15% delle pazienti con tumore limitato al corpo e nel 20%-30% delle pazienti con tumore esteso alla cervice. Le stazioni pelviche sono le più colpite. Metastasi linfonodali lombo aortiche isolate non sono frequenti (0.5%-36%), ma il rischio aumenta in caso di positività dei linfonodi pelvici.
I tumori G1 tendono a rimanere confinati nell‟endometrio mentre i G3 presentano una maggiore invasività locale, come illustrato in tabella 1.4 (10).
L‟infiltrazione linfovascolare è correlata con l‟interessamento linfonodale, e nelle donne con linfonodi negativi essa rappresenta un fattore prognostico significativo di recidiva. Il tasso di incidenza a 5 anni di metastasi per lo stadio I-III con o senza invasione cambia
pag. 8
rispettivamente da 40 al 20% (11). Le metastasi sistemiche tendono a presentarsi piuttosto tardivamente e si possono localizzare al polmone, al peritoneo, all‟omento, al fegato e all‟osso; sono considerate metastasi a distanza anche i linfonodi sovraclaveari e inguinali.
Tabella 1.3: vie di disseminazione linfonodale per il tumore endometriale (9).
Tabella 1.4: vie di disseminazione patologica locale per il tumore endometriale, in relazione al grado di differenziazione (10)
La ploidia del DNA rappresenta un altro fattore indipendente di prognosi per la sopravvivenza libera da malattia e risulta significativamente correlata con il grado, lo stadio e la profondità di invasione miometriale. La sopravvivenza è superiore se il tumore presenta un DNA diploide rispetto ad un DNA aneuploide (12).
Profondità Grado 1 Grado 2 Grado 3
Infiltrazione Linf. LA Linf.
Pelvici Linf. LA Linf. Pelvici Linf. LA Linf. Pelvici Solo Endometrio 0% 0% 3% 3% 0% 0% Superficiale 1% 3% 4% 5% 4% 9% Media 5% 0% 0% 9% 0% 4% Profonda 6% 11% 14% 19% 23% 34%
Profondità GRADO I GRADO 2 GRADE 3 TOTALE
Solo Endometrio 24% 11% 7% 14%
Superficiale 53% 46% 35% 45%
Medio 12% 24% 16% 19%
Profondo 10% 20% 42% 22%
pag. 9
1.7 DiagnosiDurante l‟esame fisico, oltre ad un accurata visita ginecologica dovrebbe essere analizzato attentamente l‟intero addome, con palpazione dei linfonodi inguinali.
Inizialmente dovrebbero essere richiesti tutti i principali test emato-chimici (emocromo completo, test di funzionalità renale ed epatica).
L‟ecografia trans-vaginale è un esame diagnostico fondamentale, poiché consente di valutare il grado di infiltrazione miometriale con una sensibilità del 97% (13); l‟ecografia è inoltre in grado di valutare l‟eventuale invasione in profondità del canale cervicale e lo spessore endometriale. L‟isteroscopia è utile per identificare le lesioni di piccolo volume, spesso non individuabili con il semplice raschiamento; inoltre consente di valutare la diffusione della neoplasia al canale cervicale. La diagnosi di carcinoma endometriale è confermata dall‟esame istologico di tessuto endometriale ottenuto tramite biopsia L‟esame bioptico ha dimostrato di possedere una capacità diagnostica elevata, con sensibilità del 78% e specificità del 95.8%. Sebbene un lavoro retrospettivo abbia dimostrato una buona correlazione tra citologia cervicale e presenza di neoplasia endometriale ad alto rischio, il PAP test non ha dimostrato di essere una procedura attendibile (14). La RMN effettuata con mezzo di contrasto trova indicazione con l‟ecografia trans vaginale per una corretta stadiazione e per una valutare l‟estensione della neoplasia (15). La TC presenta poca sensibilità nel valutare l‟estensione della neoplasia ma è molto utile per valutare il coinvolgimento linfonodale. Più recentemente viene utilizzata la Tomografia ad emissione di positroni con fluorodesossiglucosio radio marcato (FDG-PET) co-registrata con uno
pag. 10
studio TC, utile per l‟identificazione di distretti caratterizzati da un‟attività metabolica anormalmente elevata (malattia locale, malattia a distanza e interessamento linfonodale in sede para-aortica): il ruolo di questa metodica è estremamente importante nella individuazione di disseminazione a distanza con un‟elevata sensibilità (16).
1.8 Stadiazione
In relazione al periodo storico a cui si riferisce il presente lavoro, le neoplasie uterine sono state classificate secondo la stadiazione definita dal gruppo di studio della Fédération
Internationale de Gynécologie Obstétrique (F.I.G.O) che stratifica il rischio legato alla
malattia in funzione della sua diffusione (17) (tabella 1.5).
In base ad alcune evidenze si è resa necessaria una revisione della classificazione FIGO 1988 che ha portato alla stesura di una nuova classificazione nel 2009 (18) (tabella 1.6).
Le classi prognostiche, ad esempio, potevano essere semplificate negli stadi iniziali poiché la sopravvivenza tra pazienti con invasione solo dello stroma endometriale o della prima metà del miometrio era sovrapponibile.
Nelle pazienti affette da neoplasia al secondo stadio l‟evento prognostico sfavorevole non è l‟estensione superficiale alle pseudoghiandole endocervicali (questo tipo di estensione non comporta una prognosi diversa dallo stadio I) ma l‟infiltrazione dello stroma della cervice (recidive 5.1% nel caso di estensione solo mucosale, del 10.8% in caso di infiltrazione dello stroma).
pag. 11
Tabella 1.5: Classificazione FIGO 1988 relativa ai tumori dell’endometrio (17).Tabella 1.6: Classificazione FIGO 2009 dei tumori endometriali (18). Classificazione FIGO (1988) IA Tumore limitato all‟endometrio
IB Tumore con invasione del miometrio= ½
IC Tumore con invasione del miometrio >½
IIA Tumore con interessamento ghiandolare endocervicale
IIB Tumore con interessamento dello stroma cervicale
IIIA Tumore con interessamento della sierosa, e/o degli annessi e/o con citologia
peritoneale positiva per cellule tumorali maligne
IIIB Metastasi vaginali
IIIC Metastasi ai linfonodi pelvici e/o paraaortici IVA Tumore con invasione della vescica e/o del retto
IVB Metastasi a distanza, inclusive delle metastasi endo-addominali e/o dei linfonodi
inguinali
Classificazione FIGO (2009) IA Nessuna infiltrazione o< ½ del miometrio
IB Tumore con invasione del miometrio> ½
II Tumore esteso allo stroma cervicale
IIIA Tumore con estensione alla sierosa e/o alle ovaie
IIIB Tumore con estensione alla vagina o ai parametri
IIIC Metastasi ai linfonodi pelvici e/o para-aortici
IIIC1 Metastasi ai linfonodi pelvici
IIIC2 Linfonodi lombo-aortici positivi, indipendentemente dai pelvici
IVA Tumore con invasione mucosa vescicale o rettale
pag. 12
Si è resa necessaria anche una revisione del III stadio, in quanto è apparso come la presenza isolata di washing positivo in assenza di interessamento extrauterino della malattia non fosse di per sé un indice di peggioramento della prognosi, inoltre per stratificare meglio il rischio rappresentato dalle metastasi linfonodali regionali è stato deciso di differenziare la stadiazione in funzione della positività dei linfonodi pelvici o dei linfonodi lombo aortici.Sia nella stadiazione FIGO 1988 che in quella 2009 il primo ed il secondo stadio sono definiti “early”, mentre gli stadi III e IV sono considerati come avanzati. La stadiazione FIGO non tiene in considerazione il grado di differenziazione cellulare (G1-2-3), l‟istotipo e l‟infiltrazione degli spazi linfo-vascolari.
1.9 Il trattamento chirurgico
La chirurgia è il trattamento elettivo del carcinoma endometriale; l‟intervento standard attuale prevede l‟isterectomia totale extra-fasciale, l‟annessiectomia bilaterale, l‟esplorazione della cavità addominale, il washing peritoneale ed eventualmente l‟exeresi dei linfonodi pelvici e/o lombo-aortici (19-23).
L‟isterectomia radicale modificata può essere utilizzata in presenza di interessamento macroscopico della cervice; la colpoisterectomia può essere presa in considerazione in situazioni cliniche specifiche ed infine la laparoscopia rappresenta un approccio innovativo per questa neoplasia (24-31).
pag. 13
Non è ancora emersa una chiara evidenza del fatto che la linfoadenectomia di per sé sia un beneficio clinico in tutte le pazienti, sicuramente questa procedura comporta un maggior rischio di complicanze, da qui la necessità di selezionare le pazienti da sottoporre a tale procedura. Differenti approcci chirurgici possono essere utilizzati per valutare il retro peritoneo, che vanno dalla biopsia sui linfonodi bulky, al sampling selettivo di molteplici stazioni, fino alla linfoadenectomia sistematica pelvica o paraortica. Recenti studi randomizzati non hanno mostrato un significativo vantaggio per quanto riguarda la sopravvivenza libera da malattia e la sopravvivenza globale nelle pazienti sottoposte a linfoadenectomia pelvica rispetto a quelle che non l‟hanno eseguita: la recente metanalisi di May et al (32) ha evidenziato a tale riguardo l‟importanza degli studi di Benedetti Panici (33) e di Kitchener (34) recentemente conclusi.
Lo studio di Benedetti-Panici et al (33) del 2008, ha valutato se l‟aggiunta della linfoadenectomia pelvica abbia incrementato la sopravvivenza globale e la sopravvivenza libera da malattia: lo studio ha previsto la randomizzazione di 514 pazienti in stadio I la metà delle quali sottoposta anche a linfoadenectomia pelvica con un numero medio di linfonodi asportati uguale a 30 (range 22-42).
L‟analisi dei dati ha dimostrato che sebbene la linfoadenectomia statisticamente migliori la stadiazione chirurgica, non modifica la sopravvivenza libera da malattia e la sopravvivenza globale a 5 anni che sono risultate simili nei 2 gruppi (81% e 85,8% per le pazienti sottoposte a linfoadenectomia e 81,7% e 90% per il braccio non sottoposto a linfoadenectomia). Una maggior rilevanza di complicanze si è rinvenuta nel gruppo
pag. 14
sottoposto a linfoadenectomia come linfocisti, linfedema, trombosi venosa profonda ed embolia polmonare.Lo studio ASTEC di Kitchener et al. (34) del 2009 ha randomizzato 1408 pazienti in stadio I sottoposte a chirurgia standard o a chirurgia standard con linfoadenectomia. Le complicazione post-chirurgiche si sono dimostrate basse in entrambi i gruppi, ma le donne sottoposte a linfoadenectomia hanno sviluppato una maggiore percentuale di complicanze quali trombosi venosa (1% vs 0,1%), linfocele (1% vs 0,3%), deiscenza chirurgica (1% vs 0,3%) e linfedema agli arti inferiori (3%vs 0.5%). La sopravvivenza libera da malattia e la sopravvivenza globale a 5 anni non si sono dimostrate statisticamente differenti nei 2 gruppi (rispettivamente 73% e 80% per le pazienti sottoposte a linfadenectomia vs 79% e 81% per il braccio di controllo).
I risultati di quest‟ ultimo studio sono stati ampliamente criticati a causa di alcuni bias nella selezione delle pazienti: per esempio il numero di linfonodi rimossi era spesso modesto (≤9) e molte pazienti arruolate avevano un basso rischio di coinvolgimento linfonodale. In entrambi gli studi si concludeva che non c‟era differenza significativa di sopravvivenza complessiva (Overall Survival, OS) o di sopravvivenza libera da malattia (Disease-Free Survival, DFS).
La metanalisi di May et al (32) ha confermato che non esiste differenza significativa di sopravvivenza tra donne con malattia al primo stadio sottoposte o meno a linfoadenectomia pelvica e/o lomboaotica, anche dopo aggiustamento per età e per grado istologico del tumore. La sopravvivenza libera da malattia si è dimostrata non
pag. 15
significativamente diversa nei 2 gruppi. Gli autori non hanno evidenziato che la linfoadenectomia diminuisca il rischio di morte o comparsa di recidiva rispetto alla non linfoadenectomia in donne con carcinoma dell‟endometrio in stadio I. L‟incidenza relativamente elevata di importanti eventi avversi suggerisce che le donne sottoposte a linfoadenectomia abbiano un più alto rischio di comorbidità sistemiche.Certamente la linfoadenectomia pelvica e/o lombo-aortica trova indicazione nelle pazienti con malattia confinata all‟utero di grading G3, con invasione miometriale profonda o con istologia non endometrioide.
Come possiamo dedurre vi è ancora dibattito sulle indicazioni della linfoadenectomia e per tale ragione vi è un crescente interesse per le tecniche non invasive utili a determinare lo stato linfonodale: la valutazione del linfonodo sentinella potrebbe essere una soluzione praticabile.
I risultati del trial multicentrico prospettico SENTI-ENDO di Ballester et al. (35) ha dimostrato che la biopsia del linfonodo sentinella potrebbe dare informazioni fondamentali in modo tale da personalizzare la terapia adiuvante: questo studio è stato condotto per vagliare l‟utilità della biopsia del linfonodo sentinella come elemento predittivo in pazienti con carcinoma dell‟endometrio in stadio I-II; 133 pazienti sono state sottoposte ad iniezione di tecnezio colloidale,a seguire è stata praticata la biopsia del linfonodo sentinella. Almeno 1 linfonodo sentinella è stato marcato in 111 pazienti e 19 di queste sono risultate positive per metastasi pelviche. Non sono stai rilevati falsi negativi e pertanto la procedura ha avuto una sensibilità e una specificità del 100%.
pag. 16
Kitchener,in un commento al lavoro di Ballester, ha suggerito che questa procedura potrebbe essere considerata uno standard nel carcinoma endometriale in stadio I-II, come criterio di scelta per decide di effettuare la linfoadenectomia.1.10 La radioterapia
La radioterapia esterna associata di regola ad una brachiterapia utero-vaginale è utilizzabile in circa il 5-10% delle pazienti che non possono essere sottoposte a chirurgia per controindicazioni di ordine medico (36-41): con questo trattamento vengono riportate in letteratura sopravvivenze globali a 5 anni tra il 47% e il 76%.
Per quanto concerne il ruolo adiuvante della radioterapia, le indicazioni ad un trattamento esterno da solo o associato a brachiterapia come boost è stato a lungo argomento di discussione; fino a circa due decadi fa le indicazioni erano molto semplicistiche in quanto la maggior parte delle pazienti con carcinoma endometriale in stadio I con invasione miometriale < 50% e grado di differenziazione 1 o 2 venivano sottoposte a brachiterapia endovaginale esclusiva postoperatoria, mentre le pazienti con invasione miometriale superiore al 50% e grado 3 venivano sottoposte a radioterapia esterna pelvica, mentre le pazienti in stadio IA G1-2 infine non avevano indicazione ad nessun trattamento adiuvante.
Tuttavia nelle ultime due decadi si sono succeduti alcuni studi prospettici che dimostravano come la radioterapia e brachiterapia da sola o in combinazione alla radioterapia garantissero un vantaggio nel controllo locale di malattia, esclusivamente
pag. 17
negli stadi a rischio intermedio-alto, mentre non riportavano vantaggi nella sopravvivenza globale.Nello studio di Alders (42) sono state arruolate 540 pazienti con neoplasia uterina in stadio I per valutare gli effetti della radioterapia esterna pelvica: dopo l‟intervento chirurgico tutte
le pazienti sono state sottoposte a trattamento brachiterapico, a seguire una parte di esse è stata candidata a ricevere anche radioterapia esterna pelvica. Durante un periodo osservazionale da 3 a 10 anni gli studiosi hanno osservato una sostanziale riduzione di recidive vaginali e pelviche nel gruppo che aveva ricevuto radioterapia esterna (1,9 vs 5,4% p<0.1); mentre le metastasi a distanza si sono sviluppate nel 9.9% delle prime e nel 5.4% delle seconde e la sopravvivenza a 5 anni era simile nei 2 bracci. Una più dettagliata analisi aveva concluso che solo le pazienti con grado 3 e con infiltrazione >50% del miometrio potesse beneficiare dell‟aggiunta della radioterapia, inoltre era stato osservato che nel 20% delle pazienti era presente anche invasione degli spazi linfovascolari. Le morti per malattia e le recidive erano state maggiori in questo gruppo (26,7 vs 9,1% p< .01).
Nello studio randomizzato PORTEC 1 (43) sono state arruolate 715 pazienti a rischio intermedio (grado I con invasione < 50%, grado 2 con ogni invasione o grado 3 con invasione < 50%), per confrontare chirurgia seguita da radioterapia adiuvante con la stessa chirurgia esclusiva. A 5 anni la sopravvivenza globale era dell‟85% nel braccio di controllo e dell„81% nel braccio con radioterapia, la proporzione delle pazienti decedute per cause correlate al tumore sono risultate maggiori nel gruppo della radioterapia (9 %vs
pag. 18
6% p=037). Le complicanze collegate al trattamento si sono verificate nel 25% delle pazienti irradiate vs un 6% delle pazienti del braccio di controllo (p<0,0001). A 5 anni il rapporto di recidive vaginali e pelviche è stato statisticamente minore nel gruppo trattato con radioterapia (14%vs4% p<0,0001) la sopravvivenza globale non era risultata statisticamente significativa tra i due gruppi (81% con RTE vs 85% con la sola chirurgia p=0,31). Il maggior numero di recidive erano state vaginali (73%) e un trattamento di salvataggio (radioterapia) aveva portato un controllo locale a 2 anni nel 79%, facendo intendere che la radioterapia potesse essere impiegata come terapia di salvataggio. Lo studio concludeva che la radioterapia nel I stadio diminuiva le recidive loco regionali, ma non impattava sulla sopravvivenza globale aumentando la morbidità legata al trattamento. Inoltre per le recidive loco regionali l‟analisi multivariata mostrava che il trattamento radioterapico effettuato per la recidiva ed un‟età inferiore ai 60 anni erano fattori prognostici favorevoli. Gli autori a tale riguardo avevano concluso che le pazienti in stadio I a rischio intermedio, sotto i 60 anni e pazienti con grading 2 e tumore infiltrante il miometrio superficialmente non necessitavano di trattamento radioterapico.
Il trial prospettico GOG 99 (44), comprendente 392 pazienti in stadio IB-IC e II che confrontava chirurgia più radioterapia pelvica con chirurgia esclusiva, concludeva che la radioterapia riduceva le recidive locoregionali (1.7% vs 12%) particolarmente nel sottogruppo a rischio intermedio alto (neoplasie G2-G3, età avanzata, infiltrazione profonda del miometrio e interessamento degli spazi linfovascolari). La sopravvivenza non era differente nei due gruppi. Questo studio si prestava però ad alcune critiche: la popolazione era prevalentemente composta da pazienti a basso rischio e circa il 50% delle
pag. 19
morti erano dovute a malattia intercorrente. Quindi lo studio non aveva la potenza sufficiente per dimostrare una differenza statisticamente significativa di sopravvivenza.
Nello studio PORTEC 2 (45,46) 427 pazienti (carcinoma endometriale a rischio intermedio alto: età > 60 e stadio 1C grado 1-2 o stadio 1B grado 3; ogni età e stadio 2A grado 1-2 o grado 3 con < 50% infiltrazione) erano state arruolate in due bracci: uno a ricevere radioterapia esterna pelvica l‟altro trattato con la sola brachiterapia vaginale. Nonostante un modesto ma significativo aumento del tasso di recidiva pelvica nel braccio VBT (3.6% vs 0.37%), le percentuali di metastasi a distanza, la sopravvivenza globale e quella libera da recidiva erano simili, ma la qualità di vita dopo brachiterapia era migliore in quanto le pazienti riportavano meno sequele rispetto al trattamento radiante esterno.
Dopo un tempo medio di follow-up di 45 mesi 3 recidive vaginali vennero diagnosticate dopo brachiterapia e 4 dopo radioterapia; dopo 5 anni il tasso di recidiva vaginale era risultato del 1.8% per la brachiterapia e 1.6% per al radioterapia esterna. A 5 anni il tasso di recidive loco regionali era del 5.1% per la brachiterapia e del 2.1 % per la radioterapia, L‟ 1.5% vs 0.5% delle pazienti presentava recidive pelviche isolate e il tasso di recidive a distanza era simile 8.3% vs 5.7%; non furono registrate differenze per quanto riguardava la sopravvivenza globale (84.8% vs 79.6% p=0,57) e libera da malattia (82.7% vs 78.1% p=0.74) il tasso di tossicità gastrointestinale fu minore nella pazienti trattate con brachiterapia rispetto a quelle trattate con radioterapia esterna 12.6% vs 53.8%; in conclusione la brachiterapia vaginale offre un buon controllo di malattia locale con minor tossicità rispetto alla RTE quindi dovrebbe essere considerata come trattamento di scelta nelle pazienti con intermedio e d alto rischio.
pag. 20
Nel trial MRC ASTEC e NCIC CTG EN.5 (47), 905 donne in stadio I-B G3, IC-IIA, con rischio intermedio-alto erano state randomizzate in due bracci: uno a ricevere radioterapia esterna, l‟altro di sola osservazione. Dopo un follow-up mediano di 58 mesi 135 donne equamente ripartire tra braccio di controllo e sperimentale morirono. Non c‟ era evidenza che la sopravvivenza globale migliorasse con l‟ausilio della radioterapia rispetto al braccio di controllo, a 5 anni la sopravvivenza globale fu dell‟ 84% in entrambi i gruppi. Nel 51% delle pazienti nel braccio di controllo e nel 52% di quello della radioterapia era stata praticata brachiterapia, e questo costituiva un aspetto critico dello studio. Il controllo locale è stato del 96% nelle pazienti trattate con radioterapia esterna e del 93% in quello di controllo. La sopravvivenza globale e causa-specifica sono state dell‟84% e 89% per entrambi i bracci. Non è stato dimostrato che la radioterapia migliori la sopravvivenza globale o quella libera da malattia. Le complicanze significative sono state del 3% nel gruppo osservazione contro l‟8% in quello trattato con radioterapia. Gli autori concludono che la radioterapia adiuvante non gioca un importante ruolo nell‟aumentare il controllo locale in pazienti con carcinoma endometriale a rischio intermedio alto. Negli stadi ad alto rischio (IC-G3, IIA/B-G3, III, IV), tre trials randomizzati hanno confrontato la radioterapia con differenti trattamenti (48-50). Nello studio Italiano CNR (48) in 345 pazienti con carcinoma endometriale ad alto-rischio (stadio ICG3, IIG3 con infiltrazione del miometrio >50%, e III) trattati con LIAB +/- linfadenectomia selettiva pelvica e paraaortica, il trattamento adiuvante standard era confrontato con chemioterapia (cinque cicli di cisplatino, doxorubicina e ciclofosfamide): con un follow up di 95.5 mesi lo studio non ha
pag. 21
dimostrato alcuna differenza significativa tra le due metodiche in termini di DFS (56% vs 60%) e OS (62%). La radioterapia ritarda la comparsa di recidive locali e la chemioterapia quella delle metastasi ma queste tendenze non sono significative.
Il trial JGOG (49) che ha arruolato 385 pazienti, confrontava la radioterapia adiuvante con chemioterapia: tre o più cicli di cisplatino, doxorubicina e ciclofosfamide (CAP); la progressione libera da malattia e la sopravvivenza globale non erano statisticamente differenti. La DFS a 5 anni nei gruppi RT e CAP era rispettivamente dell‟83.5% e 81.8%, mentre la OS a 5 anni era dell‟85.3% per il gruppo RT e 86.7% per il CAP. L‟outcome per le pazienti ad alto rischio era significativamente migliore nelle pazienti sottoposte a CAP. La tossicità ere simile in entrambi i bracci.
Nel trial NSGO-EC-9501/EORTC 55991 (59 Gy +/- brachiterapia) o RT (44 Gy +/- brachiterapia), erogata prima o dopo quattro cicli di CT (basata su cisplatino-doxorubicina). Con una mediana di follow-up di 3.5 anni si dimostrava una differenza assoluta di PFS a 5 anni in favore della chemoradioterapia (82% vs 75 %), nonostante il 27% delle pazienti del braccio sperimentale non avesse effettuato una chemioterapia ottimale (50)
La radioterapia associata a chemioterapia è più efficace della sola radioterapia come terapia adiuvante nelle pazienti con carcinoma endometriale ad alto rischio per metastasi, la chemioterapia sembra essere più efficace della radioterapia per pazienti con carcinoma endometrialeavanzato, specialmente con diffusione addominale.
pag. 22
Il trattamento standard per la recidiva vaginale è la radioterapia (esterna più brachiterapia intravaginale). La radioterapia consente un eccellente controllo locale di recidive vaginali isolate di carcinoma endometriale (circa il 75%), particolarmente quando sono somministrate alte dosi usando una combinazione di radioterapia esterna e brachiterapia, con sopravvivenza globale a cinque anni nell‟ordine del 50%. Nelle pazienti non irradiate il trattamento delle recidive pelviche con radioterapia dimostra una buona efficacia mentre se la paziente è già stata irradiata occorre considerare un terapia di salvataggio chirurgica. Una recidiva non resecabile in paziente già irradiata può costituire una indicazione a chemioterapia citoriduttiva finalizzata ad una possibile chirurgia di recupero o ad una radioterapia di salvataggio con tecniche di precisione (51-54).
1.11 La chemioterapia
Numerosi studi randomizzati hanno dimostrato l‟efficacia della combinazione cisplatino [CDDP] - doxorubicina [DOX], che attualmente è il regime di chemioterapia più diffuso per il carcinoma endometriale avanzato o recidivante (55-60).
Uno studio randomizzato del Gynecology and Oncology Group (61) condotto su 422 pazienti affette da carcinoma endometriale in stadio III-IV e malattia residua < 2 cm ha confrontato l‟efficacia della radioterapia sull‟intero addome (30 Gy + boost di 15 Gy sulla pelvi e/o sui linfonodi lombo-aortici) con quella della chemioterapia a base di DOX + CDDP ogni 3 settimane per sette cicli, seguita da un ulteriore ciclo di CDDP. Dopo un follow-up mediano di 74 mesi è stato osservato un ridotto rischio di progressione (HR,
pag. 23
0.71; IC 95%, 0.55-0.91; p= 0.007) e di morte (HR, 0.68; IC 95%, 0.52-0.89; p= 0.004) nel braccio con chemioterapia.
Lo studio randomizzato di fase III del GOG comprendente 273 pazienti con malattia avanzata o recidivante, la combinazione DOX + CDDP + TAX con il supporto del fattore stimolante per le colonie granulocitarie (il G-CSF), ha ottenuto un miglioramento delle percentuali di risposta completa (57% versus 34%, p<0.01) in termini di sopravvivenza libera da progressione (mediana pari a 8.3 versus 5.3 mesi, p, 0.01), e di sopravvivenza globale (mediana, 15.3 versus 12.3 mesi, p, 0.037) rispetto alla combinazione DOX + CDDP. Tuttavia la tossicità neurologica periferica di grado 2-3 era nettamente più frequente nelle pazienti trattate con il regime a tre farmaci (12% and 27%, rispettivamente versus 1% and 4%, rispettivamente) (62).
Nel tentativo di ridurre la tossicità del trattamento, molti autori hanno cominciato ad utilizzare l‟associazione TAX + CBDCA nel carcinoma endometriale avanzato o recidivante (63-67), ed il GOG sta attualmente conducendo uno studio randomizzato di fase III che confronta questa combinazione con il regime DOX + CDDP+TAX (68).
1.12 Follow up
Nel follow-up delle pazienti trattate per neoplasie uterine pesano le modificazioni anatomiche e funzionali causate dai trattamenti chirurgici e/o radianti, che rendono meno immediato il riconoscimento di eventuali riprese di malattia o di complicanze iatrogene.
pag. 24
I controlli prevedono l‟esame clinico generale con visita ginecologica ed esplorazione rettale, PAP test dopo 4 mesi dal termine della radioterapia ed esami di laboratorio di routine.
È consigliabile per i primi 2 anni effettuare una visita di controllo ogni 4 mesi e poi fino al 5° anno ogni 6 mesi: questo stretto follow-up è giustificato dal fatto che il 75% delle recidive può insorgere entro 2 anni in relazione allo stadio della malattia, ai fattori di rischio presenti e alla terapia effettuata.
Nelle pazienti operate, la TC è spesso l‟indagine di prima scelta consentendo di riconoscere la presenza di tessuto neoplastico residuo o recidivo con buona sensibilità (90%). La TC non è in grado di distinguere tra tessuto solido da riferire a recidiva neoplastica e tessuto fibrotico cicatriziale, negli esiti chirurgici e/o attinici.
All‟opposto la RMN, benché con minore accuratezza diagnostica nei primi 6 mesi post-radioterapia a causa della presenza di fenomeni flogistici o edematosi, è in grado di definire con maggiore precisione l‟anatomia pelvica post trattamento. Molteplici studi dimostrano la superiorità della risonanza magnetica nel riconoscere l‟eventuale tessuto neoplastico residuo o l‟insorgenza di recidiva; la RMN è quindi la tecnica di elezione nel follow-up delle neoplasie trattate con radioterapia, in cui la eventuale recidiva si manifesta con le stessi caratteri della lesione primitiva (15).
Più recentemente è stato valutato il ruolo della PET utile nell‟individuare precocemente la presenza di eventuali recidive (16).
pag. 25
Capitolo 2. Materiali e Metodi2.1. Presentazione del gruppo di studio
Nel presente studio sono stati revisionati i dati clinici relativi alle pazienti seguite dal Gruppo Interdisciplinare di Oncologia Ginecologica dell‟Università di Pisa, reclutate dal gennaio 1987 fino al dicembre 2009 e con un follow-up fino a luglio 2010. Sono state escluse dall‟analisi le pazienti con follow-up incompleto o con istotipo non endometrioide.
2.2. Caratteristiche delle pazienti
La nostra analisi retrospettiva monocentrica ha selezionato un campione abbastanza omogeneo di pazienti e si è focalizzata in modo particolare sull‟istotipo endometrioide; sono stati registrati la storia clinica e tutti gli eventuali fattori prognostici quali l‟età di insorgenza, lo stadio di malattia, la profondità d‟invasione del miometrio, il grado di differenziazione, l‟invasione degli spazi linfo-vascolari e ogni altra informazione di carattere clinico. Tutte le pazienti considerate nella presente analisi hanno ricevuto un trattamento radioterapico adiuvante a fasci esterni ma non un trattamento chemioterapico. Hanno costituito criteri d‟esclusione l‟evidenza di linfonodi positivi, precedenti trattamenti radioterapici per pregresse patologie pelviche maligne o aver effettuato un corso di sola brachiterapia adiuvante.
pag. 26
L‟intervallo di osservazione si è esteso su oltre due decadi, e dunque è naturale osservare in questo periodo un‟evoluzione nei criteri di diagnosi e stadiazione e nelle tecnologie di indagine; tuttavia tutte le pazienti sono state stadiate clinicamente mediante esami ematochimici di routine, visita ginecologica, isteroscopia con biopsia e scansione tomografica computerizzata (TC); nel tempo, questi esami sono stati affiancati dall‟ecografia trans-vaginale, dall‟ecografia addominale e occasionalmente dalla risonanza magnetica nucleare (RM) e, in casi particolari dalla tomografia a emissione di positroni (PET).
Il numero di casi selezionati per la presente analisi retrospettiva è stato pari a 177. Le pazienti sono state sottoposte tutte a isterectomia totale ed annessiectomia bilaterale per carcinoma dell‟endometrio con o senza linfoadenectomia pelvica o para-aotica, e successivamente a radioterapia esterna pelvica.
Le pazienti sono state stadiate storicamente secondo i criteri della Fédération
Internationale de Gynécologie et Obstétrique (FIGO) 1988 (17) e successivamente gli
stadi di malattia sono stati revisionati secondo i criteri FIGO 2009 (18).
La classificazione istologica è stata effettuata secondo i criteri del World Health Organization ; il grado architetturale è stato definito nel seguente modo:
Grado I (G1): < 5% o meno di aspetti solidi non squamosi
Grado II (G2): 6-50% di aspetti solidi non squamosi
pag. 27
Utilizzando l‟analisi morfologica e, quando disponibile, immunoistochimica, l‟invasione linfo-vascolare è stata definita in base alla presenza di cellule tumorali all‟interno o alla superficie dell‟epitelio esterno dei vasi sanguigni o entro gli spazi linfatici.
Gli obiettivi di questa analisi sono stati molteplici:
1. determinare l‟intervallo libero da malattia e la sopravvivenza causa-specifica globale; 2. determinare i fattori predittivi per il controllo della malattia;
3. analizzare l‟impatto dell‟intervallo di tempo intercorso tra l‟intervento chirurgico e la radioterapia sul controllo della malattia;
4. determinare l‟impatto del ritardo nel completamento del trattamento radioterapico sul controllo di malattia;
5. determinare il tasso di incidenza di recidive locali e a distanza in relazione alle variabili osservate.
2.3. Procedura chirurgica
L‟intervento chirurgico è stato il primo approccio terapeutico effettuato in queste pazienti: 152 (86%) pazienti sono state sottoposte ad intervento chirurgico di isterectomia totale extra fasciale effettuato in laparotomia o laparoscopia, con washing peritoneale, annessiectomia bilaterale; 25 (14%) pazienti sono state operate per via vaginale.
La dissezione linfonodale è stata effettuata in tutte le pazienti con linfonodi sospetti alla stadiazione o alla valutazione intraoperatoria; complessivamente la linfoadenectomia è
pag. 28
stata eseguita in 81 (46%) pazienti con un numero medio di linfonodi asportati pari a 16 (range, 6-46).Sul pezzo operatorio sono stati valutati il grading, l‟interessamento cervicale, lo spessore dell‟infiltrazione miometriale, la presenza di interessamento degli spazi linfovascolari, dei parametri o dell‟ovaio e ogni altra possibile diffusione extrauterina.
2.4. Radioterapia
In assenza di complicazioni post-operatorie, la radioterapia è stata programmata entro 6 settimane dall‟intervento chirurgico, sebbene in una percentuale significativa di casi questo limite temporale non sia stato rispettato per ragioni organizzative del reparto o della paziente.
Prima del trattamento radiante, ogni paziente è stata sottoposta a simulazione con apparecchio dedicato e/o a TC di centraggio per definire i volumi di interesse. Gli studi radiologici erano eseguiti con la paziente in posizione supina. Su tutte le scansioni TC assiali sono stati delineati gli organi a rischio di sequele iatrogene e i volumi bersaglio. Il trattamento è stato successivamente pianificato al computer mediante un sistema di calcolo dedicato 3D.
Le scansioni assiali sono state di norma acquisite con passo non inferiore a 10 mm e in modo da comprendere superiormente i linfonodi iliaci comuni e inferiormente il terzo superiore della vagina, i linfonodi otturatori, iliaci interni e iliaci esterni; in caso di estensione extra-uterina della malattia, lo studio TC è stato esteso in modo da includere
pag. 29
tutte le sedi interessate con un margine di 40-50 mm. Sulle immagini TC sono stati individuati e delineati i volumi di interesse, definiti dalle raccomandazioni, inizialmente, della ICRU 29, ICRU 50 ed infine ICRU 62 (69-71), e cioè:1. Clinical Target Volume (CTV), rappresentato dalle aree di eventuale estensione locale o regionale (linfonodi) della malattia;
2. Planning Target Volume (PTV), definito sulla base dei dati anatomopatologici e degli esami di diagnostica, disegnato in modo da garantire un adeguato margine (indicativamente 15–20 mm) rispetto al CTV in funzione dell‟apparecchiatura usata, del posizionamento della paziente, dell‟impiego di sistemi di immobilizzazione e della tecnica di irradiazione.
I margini da aggiungere al CTV per l‟ottenimento del PTV sono definiti dall„ICRU 62:
Internal Margin (IM): margine per compensare i movimenti fisiologici della paziente;
Setup Margin (SM): margine per compensare gli errori di posizionamento.
In particolare sono stati identificati il CTV, l‟eventuale BOOST (definito come il volume del CTV ad alto rischio) e tutti gli organi a rischio.
Nell‟arco del periodo di tempo abbracciato dalla presente analisi le tecniche di irradiazione si sono evolute. La tecnica usata nella grande maggioranza dei casi è quella conformazionale a quattro campi (box), con porte di ingresso antero-posteriore, postero-anteriore e latero-laterali (gantry rispettivamente a 0°, 180°, 90° e 270°). I limiti dei campi di irradiazione sono definibili indicativamente come segue;
pag. 30
limite craniale sul profilo inferiore di L4; limite caudale sul profilo inferiore della branca ischio pubica; nello stadio IIIB il limite deve includere l‟introito vaginale, identificato con marcatore radiopaco;
limiti laterali fino a 15 - 20 mm lateralmente al perimetro della piccola pelvi (tranne nello stadio IIIB dove vengono irradiati anche i linfonodi inguinali, con limite laterale tangente il profilo laterale della testa femorale).
Campi laterali:
limite craniale coincidente con quello dei campi AP-PA;
limite caudale coincidente con quello dei campi AP-PA;
limite ventrale sul piano passante per il profilo ventrale della sinfisi pubica;
limite dorsale sul piano passante per il margine dorsale di S2-S3.
Il trattamento radioterapico prevedeva di impiegare campi di fotoni di energia pari a 15 MV. La radioterapia è stata programmata prevedendo la somministrazione di una dose totale pari a 45-50.4 Gy, 1.8-2 Gy/frazione, con 5 sedute settimanali, per una durata complessiva (salvo presenza di effetti collaterali) di circa 5-6 settimane. In caso in cui si sia verificata tossicità inaccettabile o la paziente abbia opposto un rifiuto, la radioterapia è stata temporaneamente sospesa o interrotta. Il piano di trattamento è stato effettuato mediante calcolo in 2 o 3 dimensioni sulle scansioni TC, in relazione all‟evoluzione del sistema di calcolo di dose adottato. Il peso relativo dei campi è stato ottimizzato in modo
pag. 31
da rispettare i vincoli di dose per gli organi a rischio, e in particolar modo il retto e la vescica.Al momento dell‟inizio della radioterapia, la paziente è stata riposizionata su tavolo di trattamento dell‟acceleratore lineare come nella simulazione, e il corretto posizionamento è stato verificato utilizzando le immagini portali ottenute con il gantry a 0° e a 90° per il confronto con le radiografie di centraggio o sulle radiografie digitali ricostruite (DRR), ottenute a partire dallo studio TC. Negli ultimi anni il corretto posizionamento è stato verificato mediante l‟esecuzione di una cone beam CT, e dunque le immagini cosi ottenute in fase di esecuzione del trattamento sono state confrontate con quelle della TC di centraggio.
Dal Dicembre 2009 presso il nostro Centro è stata introdotta la tecnica di irradiazione a intensità modulata (IMRT) grazie alla quale abbiamo ottenuto una migliore conformazione nella distribuzione di dose che permette la possibilità di effettuare boost concomitanti con al contempo un maggior risparmio degli organi critici. L‟adozione di queste nuove tecniche, insieme all‟impiego di tecniche diagnostiche inedite e di dispositivi di contenzione di concezione più avanzata, hanno imposto una revisione dei criteri per l‟individuazione del volume bersaglio.
I criteri di contornamento adottati nel nostro Centro (72) prevedono che il CTV debba includere i linfonodi iliaci comuni esterni ed interni, il terzo superiore della vagina e i tessuti para-vaginali; qualora vi sia invasione dello stroma cervicale, sono inclusi i linfonodi
pre-pag. 32
sacrali. il bordo superiore del CTV è posizionato 7 mm sotto lo spazio intersomatico di L4-L5.L‟ espansione che diamo al CTV è pari a 7 mm, il bordo inferiore si estende al terzo superiore della vagina, o 10 mm sopra i forami otturatori. La porzione superiore del CTV è definita aggiungendo 7 mm di margine intorno ai vasi iliaci comuni ed include i linfonodi sospetti. Il CTV deve comprendere 15 mm di tessuto lasso posto anteriormente ai corpi vertebrali escludendo il soma, il muscolo psoas e l‟intestino. Se i linfonodi pre-sacrali non sono inclusi nel volume, il CTV si bipartisce seguendo il percorso dei vasi iliaci comuni, partendo da 15-20 mm sotto la biforcazione aortica. Nella porzione inferiore del CTV si include il terzo superiore della cupola vaginale e i vasi iliaci interni ed esterni con un margine di 7 mm, escludendo l‟osso, l‟intestino ed i muscoli.
In caso di irradiazione dei pre-sacrali, il CTV esclude il muscolo piriforme (approssimativamente in corrispondenza del limite inferiore di S2) dividendosi dunque in due volumi separati.
In corrispondenza del bordo superiore delle teste femorali, il CTV deve comprendere la vagina e i parametri con un margine di 5 mm. Solitamente il retto, la vescica il muscolo e l‟osso sono esclusi dal CTV.
L‟utilizzo della brachiterapia è stato valutato in base ai vari fattori di rischio, in particolare la localizzazione di malattia, il grading, l‟infiltrazione del miometrio, l‟infiltrazione dello stroma cervicale, per effettuare un sovradosaggio alla fine della radioterapia a fasci esterni.
pag. 33
Nella nostra analisi la brachiterapia è stata somministrata dopo la radioterapia esterna pelvica mediante applicatore cilindrico o colpostato, in funzione dell‟anatomia della paziente. Il piano di trattamento è stato effettuato su scansioni assiali CT con il Nucletron Brachiteraphy planning system (Nucletron BV, Veenendal, The Netherlands). Nella brachiterapia endovaginale, il target è rappresentato dalla parete della cupola vaginale e dal terzo superiore della vagina.
La dose prescritta come boost è stata di 10-15 Gy in 2-3 frazioni. La dose alla vescica e al retto è stata valutata dall‟istogramma dose-volume ottenuto con il calcolo di dose: per tutte le pazienti sono stati registrati i valori di dose nei punti di riferimento per la prescrizione e per gli organi a rischio.
Allo scopo di studiare l‟efficacia del trattamento integrato di chirurgia e radioterapia, per tutte le pazienti è stato registrato l‟intervallo temporale tra l‟intervento chirurgico e l‟inizio della radioterapia e la durata del corso di radioterapia; successivamente è stato analizzato l‟impatto dell‟intervallo temporale tra chirurgia e radioterapia sulla probabilità di controllo della malattia. Inoltre è stato calcolato il tempo complessivo di trattamento, definito come il numero di giorni compresi tra l‟inizio e la fine del trattamento radiante e ne è stato analizzato l‟impatto sulla probabilità di controllo della malattia.
2.4. Analisi statistica dei risultati
L‟ età delle pazienti, il grading, l‟ infiltrazione miometriale, l‟invasione vasculo-linfatica, il coinvolgimento cervicale, lo stadio FIGO e lo stato linfonodale sono stati analizzati in funzione al rischio di recidiva locale e della sopravvivenza globale.
pag. 34
Le recidive peritoneali, quelle ematogene, e le recidive linfonodali fuori dall‟area retro-peritoneale (linfonodi inguinali) sono state considerate come fallimenti a distanza.
Tutte le complicanze riconducibili al trattamento sono state sistematicamente studiate e registrate; al momento dell‟analisi, le tossicità sono state attentamente riviste e classificate secondo la scala NCI CTCAE V4.02 (73).
Il tempo dalla chirurgia alla comparsa di recidive è stato definito come sopravvivenza libera da malattia. Il tempo intercorso dalla chirurgia alla morte per malattia specifica o all‟ ultima osservazione è stato definito come sopravvivenza globale specifica.
La sopravvivenza è stata calcolata a partire dalla data di intervento fino al momento della morte o fino al‟ultimo follow-up. Il metodo del prodotto limite di Kaplan-Meier è stato impiegato per l‟analisi della sopravvivenza globale e dell‟intervallo libero da malattia.
L‟analisi di regressione multifattoriale basata sul modello di rischio proporzionale di Cox è stato effettuata mediante il programma SPSS v10.4, per individuare i fattori di rischio indipendenti. I fattori analizzati sono stati l‟età delle pazienti, il grading, l‟invasione miometriale, l‟invasione linfo-vascolare, lo stadio FIGO, il tempo di trattamento, l‟intervallo tra chirurgia e radioterapia.
pag. 35
Capitolo 3. Risultati3.1 Caratteristiche generali del campione di pazienti analizzato
Le pazienti analizzate sono state 177 con età mediana di 62 anni (range, 34-80). Le caratteristiche delle pazienti sono mostrate nella tabella 3.1.
n. pazienti 177
Età mediana, anni (range) 62 (34-80)
Follow-up mediano, mesi (range) 65 (8-273)
Follow-up mediano delle viventi 72 mesi
TIPO ISTOLOGICO Endometrioide 177 GRADO Ben differenziato 38 Moderatamente differenziato 85 Scarsamente differenziato 54 INFILTRAZONE MIOMETRIO < 50% 42 >= 50% 135
INVASIONE VASCULO LINFATICA
Presente 40 Assente 45 Sconosciuta 92 STATO LINFONODALE Negativi 81 Positivi 0 Non rimozione linfonodale 96
Tab 3.1: Caratteristiche delle pazienti
Il follow-up mediano di tutto il campione è stato pari a 65 mesi, con un range compreso tra 8 e 273 mesi. Il follow-up mediano delle pazienti viventi fino alla conclusione del tempo di osservazione è stato pari a 72 mesi; 38 pazienti (21%) avevano tumore ben differenziato (G1), 85 (49%) moderatamente differenziato (G2) e 54 (30%) pazienti scarsamente differenziato (G3).
pag. 36
L‟infiltrazione del miometrio è risultata essere inferiore al 50% in 42 (24%) pazienti e superiore o uguale al 50% nelle restanti 135 (76%) pazienti analizzate.
Per quanto concerne l‟invasione linfo-vascolare, questa era presente in 44 (25%) pazienti analizzate, assente in 41 (23%) pazienti e sconosciuta in 92 (52%) pazienti.
Per quanto concerne lo stato linfonodale, 81(46%) pazienti avevano linfonodi pelvici e/o para-aortici negativi, mentre 96 (54%) pazienti non sono state sottoposte ad esplorazione linfonodale (NX). Il numero mediano di linfonodi analizzati nelle 81 pazienti sottoposte a linfoadenectomia è stato pari a 16 (range, 6-52).
Tutte le pazienti hanno effettuato trattamento chirurgico con intento radicale: in 25 (14%) di esse è stato eseguito per via vaginale, in 2 (1%) con approccio laparoscopico, in 5 (2%) è stata effettuata chirurgia laparoscopica robot-assistita e in 145 (81%) con accesso laparotomico.
In tabella 3.2 è stata riportata la ripartizione delle pazienti in base allo stadio clinico secondo la classificazione FIGO 1988, insieme alla revisione dello stadio effettuata alla luce delle indicazioni FIGO 2009. Si osserva che i 2/3 circa delle pazienti erano in stadio chirurgico IC.
Stadio FIGO 1988 pazienti
IB 31 IC 105 IIA 9 IIB 21 IIIA 8 IIIB 3
pag. 37
Stadio FIGO 2009 pazientiIB 147
II 21
IIIA 5
IIIB 4
Tab 3.3: Ripartizione delle pazienti del presente studio secondo lo stadio FIGO 2009.
3.2 Caratteristiche dei trattamenti di Radioterapia
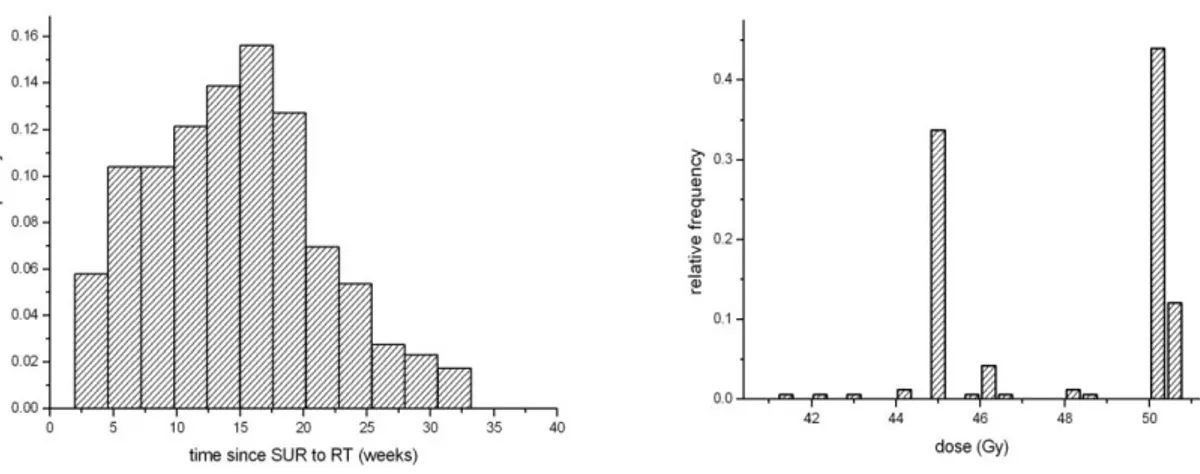
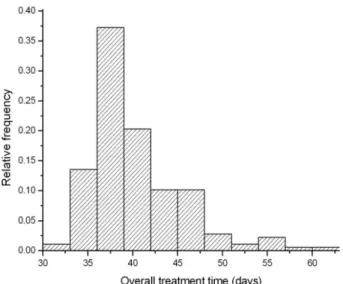
La radioterapia esterna pelvica è stata somministrata dopo un tempo mediano di 14.6 settimane (range, 3-33 settimane) dalla chirurgia. 52 (30%) pazienti sono state sottoposte a radioterapia entro 10 settimane e 125 (70%) pazienti dopo 10 settimane. In figura 3.1 è riportato l‟istogramma degli intervalli di tempo intercorsi tra intervento chirurgico e inizio della radioterapia, espressi in settimane. Il valore mediano è 14,6 settimane, il valor è 15,1 settimane (deviazione standard, 7.6 settimane).
Tutte la pazienti analizzate hanno ricevuto trattamento radioterapico: 7 (3%) pazienti hanno ricevuto una dose totale ≤44 Gy, 65 (37%) pazienti hanno ricevuto una dose complessiva compresa tra 45 e 47 Gy ed infine 105 (60%) pazienti hanno effettuato una dose tra 48 Gy e 50.4 Gy. Le diverse prescrizioni sono anche dovute al regime di frazionamento applicato: 1.8 Gy/frazione in 91 (51%) pazienti e 2 Gy/frazione in 86 (49%) pazienti. L‟istogramma relativo alle dosi ricevute dal campione di pazienti è riportato in figura 3.2.
pag. 38
Figure 3.1 e 3.2: istogramma della distribuzione degli intervalli di tempo tra chirurgia e radioterapia (sinistra) e distribuzione delle dosi totali di radioterapia a fasci esterni (destra) nel presente studio.La radioterapia è stata somministrata in 5 sedute settimanali, 1 frazione al giorno, dal lunedì al venerdì. Al fine dell‟analisi, è stato impiegato il numero di giorni compresi tra l‟inizio e la fine del trattamento.
L‟istogramma della distribuzione della durata del trattamento sul campione di pazienti è stato riportato in figura 3.3. La durata mediana della radioterapia è stata pari a 38 giorni (range 32 a 60).
La brachiterapia vaginale è stata somministrata a 32 (18%) pazienti con coinvolgimento dell‟istmo entro le 2 settimane successive alla conclusione del corso di radioterapia esterna. La dose prescritta è stata di 10-15 Gy in frazioni settimanali di 5 Gy ciascuna. L‟utilizzo della brachiterapia come boost al trattamento a fasci esterni è stato valutato in base ai vari fattori di rischio, in particolare lo stadio di malattia e all‟estensione della malattia all‟istmo.
pag. 39
Figura 3.3: istogramma della durata complessiva di trattamento della radioterapia nel presente studio.3.3 Analisi delle sopravvivenze
Le curve di Kaplan-Meier relative alla sopravvivenza causa-specifica (Overall Survival, OS) e alla sopravvivenza libera da ripresa di malattia (Progression-free Survival, PFS) sono riportate in figura 3.4. Alcuni valori significativi calcolati per le due sopravvivenze sono riportati in tabella 3.4.
Dalla valutazione delle due curve riportate in figura 3.4 si può vedere l‟ andamento nel tempo per le sopravvivenze: in particolare si osserva una riduzione delle probabilità di sopravvivenza fino circa all‟ 80% nei primi 100 mesi di follow-up e una successiva stabilità del numero di sopravviventi.
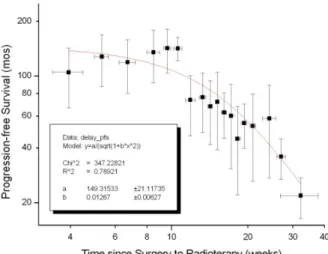
I dati di sopravvivenza sono stati analizzati in funzione del tempo intercorso tra chirurgia e radioterapia e della durata del trattamento radioterapico. In particolare, le pazienti sono state raggruppate in campioni di 10 in base all‟intervallo di tempo tra chirurgia e radioterapia (ritardo); per ognuno di questi sottogruppi è stata valutata la PFS media, che è stata riportata nella figura 3.5.
pag. 40
Per analizzare in maniera più critica l‟andamento della PFS, per ciascun gruppo è stata calcolata sia la deviazione standard dell‟intervallo di tempo, espressa dal segmento orizzontale, che la deviazione standard del parametro di sopravvivenza, espressa dal segmento verticale.
Figura 3.4: curve di Kaplan-Maier per la sopravvivenza globale causa-specifica (quadratini) e per la sopravvivenza libera da malattia (cerchio) nel presente studio.
Si può osservare che la sopravvivenza mostra la tendenza a diminuire in relazione all‟aumento del tempo di attesa della radioterapia.
Figura 3.5: distribuzione della PFS in funzione dell’intervallo tra chirurgia e radioterapia e fit dei dati con un modello matematico (v. testo).
pag. 41
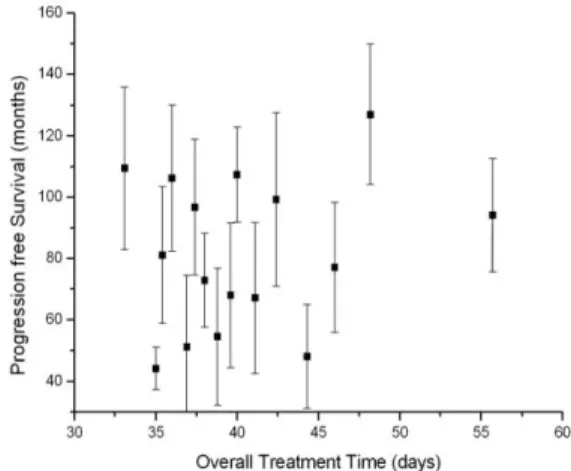
I dati sono stati interpolati con un modello a legge di potenza Bleasdale-Nelder semplificato, come indicato nell‟inserto della figura 3.5. I risultati ottenuti con un fit dei minimi quadrati non lineare evidenzia che il PFS è ragionevolmente costante per tempi di attesa inferiori a 8.9 settimane e successivamente diminuisce linearmente con il tempo. La valutazione successiva è stata centrata sulla durata della radioterapia: anche in questo caso le pazienti sono state divise in gruppi di 10 e ogni sottogruppo è caratterizzato da un simile valore di durata di trattamento.
Analogamente all‟analisi del tempo di attesa della radioterapia, anche per la valutazione della durata del trattamento radiante abbiamo calcolato per ciascun gruppo la PFS media e la rispettiva deviazione standard, come riportato in figura 3.6; dall‟osservazione della distribuzione temporale degli eventi, non si rileva alcun andamento sistematico nei dati analizzati.
Figura 3.6: distribuzione della PFS in funzione della durata temporale del trattamento di radioterapia.
Nell‟intervallo di osservazione, 135 pazienti (76.3%) sono viventi e libere da malattia (NED) dopo un tempo mediano pari a 72 mesi (range, 8-273 mesi); 10 pazienti (5.6%) libere da malattia sono morte per altra causa (NDOD) dopo un tempo mediano pari a 163 mesi (range, 34-263 mesi). 22 Pazienti (12.5%) sono decedute per la malattia (DOD) dopo un tempo mediano di 28 mesi dalla diagnosi (range, 12-109 mesi) e le ulteriori 10 pazienti
pag. 42
(5.6%) sono viventi con malattia (AWD) dopo un tempo mediano di osservazione pari a 63 mesi (range, 14-211 mesi); queste ultime pazienti hanno avuto una sopravvivenza mediana dopo la recidiva pari a 34 mesi (range, 1-122 mesi).
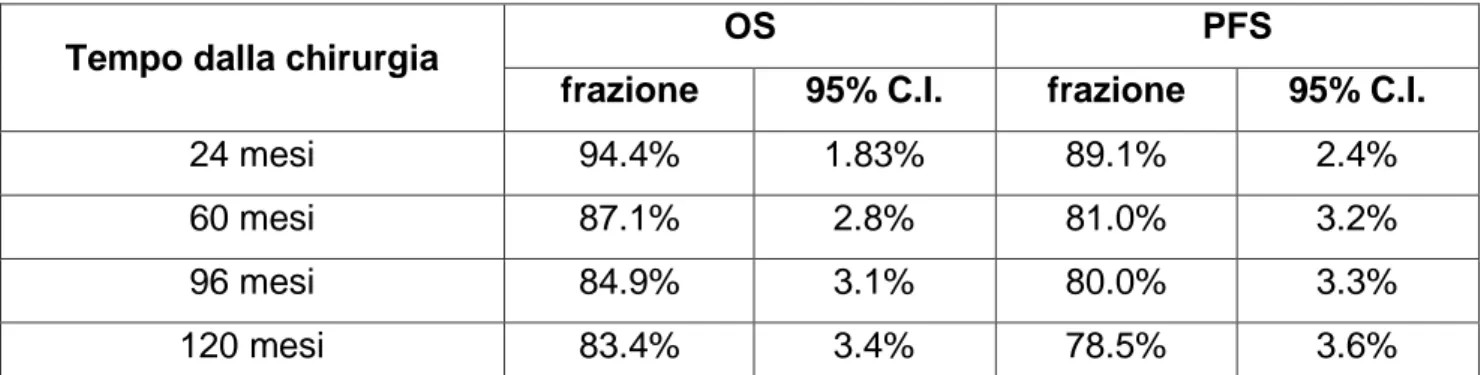
Tempo dalla chirurgia OS PFS
frazione 95% C.I. frazione 95% C.I.
24 mesi 94.4% 1.83% 89.1% 2.4%
60 mesi 87.1% 2.8% 81.0% 3.2%
96 mesi 84.9% 3.1% 80.0% 3.3%
120 mesi 83.4% 3.4% 78.5% 3.6%
Tabella 3.4: percentuali di sopravvivenza e relativi intervalli di confidenza al 95% di significatività per il campione analizzato nel presente studio.
La percentuale di successo terapeutico nel controllo di malattia sul presente campione è stata pari a (NED+ NDOD)/177= 82%.
A causa dell‟insorgenza di effetti avversi severi in corso di trattamento, 7 pazienti hanno interrotto precocemente la radioterapia (in 2 pazienti diarrea di grado G3, 2 pazienti con nausea e proctite G3, 2 pazienti per intenso dolore addominale G3, ed 1 paziente per incontinenza urinaria grave G3).
Per quanto riguarda le tossicità acute maggiormente registrate abbiamo avuto: 13 episodi di cistite acuta di grado G1-G2, 15 episodi di diarrea G1-G2, 8 proctiti G1-G2, 2 pazienti con infezioni opportunistiche G1.
Gli effetti tardivi più gravi registrati dopo il completamento del trattamento radioterapico sono stati due casi di occlusione intestinale di grado G3 , 4 casi di linfedema G1-G2, 10 casi di stenosi vaginali G2, 1 caso di proctite G3, 26 pazienti con subocclusione G1 e 31 pazienti con episodi di secchezza vaginale G2 .
pag. 43
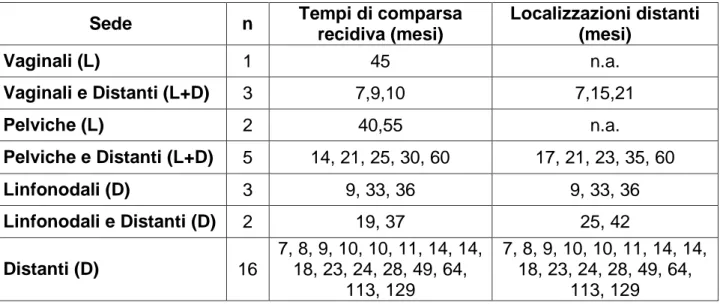
3.4 Analisi delle recidiveLe recidive osservate sono state classificate in locali e distanti: le recidive locali sono state distinte in vaginali o pelviche (centrali e laterali), mentre quelle distanti sono state separate in linfonodali e sistemiche. Sono state registrate 32 (18%) recidive, e in particolare 1 (3%) recidiva vaginale a 45 mesi di follow-up, 3 (9%) sincrone vaginali e a distanza (7, 9 e 10 mesi), 2 (6%) pelviche (40 e 55 mesi), 5 (16%) sincrone pelviche e a distanza (14, 21, 25, 30 e 60 mesi), 3 (9%) para-aortiche (9, 33 e 36 mesi), 2 (6%) sincrone para-aortiche e distanti (19 e 37 mesi) e infine 16 (50%) a distanza (tempo mediano pari a 14 mesi, range 1-129 mesi). Le metastasi a distanza sono state rispettivamente 11(34%) a livello polmonare, 4(12.5%) a livello osseo, 2(6%) epatiche, 3(9%) omentali, 2(6%) carcinosi peritoneali, 1(3%) encefalica, 1 (3%) cutanea ed 1 (3%) localizzata a livello della milza. Il pattern dei fallimenti è riportato in tabella 3.5. Si noti che le recidive locali (pelviche e vaginali) sono state 11, di cui 8 hanno mostrato anche recidive a distanza, con un tempo mediano di comparsa di 14 mesi.
Tabella 3.5: recidive e tempo di comparsa
L‟età media alla recidiva locale è stata di 62 anni; 4 (36%) pazienti avevano grado di differenziazione intermedio (G2), 7 (64%) pazienti presentavano un grading scarsamente
Sede n Tempi di comparsa
recidiva (mesi) Localizzazioni distanti (mesi) Vaginali (L) 1 45 n.a. Vaginali e Distanti (L+D) 3 7,9,10 7,15,21 Pelviche (L) 2 40,55 n.a. Pelviche e Distanti (L+D) 5 14, 21, 25, 30, 60 17, 21, 23, 35, 60 Linfonodali (D) 3 9, 33, 36 9, 33, 36 Linfonodali e Distanti (D) 2 19, 37 25, 42 Distanti (D) 16 7, 8, 9, 10, 10, 11, 14, 14, 18, 23, 24, 28, 49, 64, 113, 129 7, 8, 9, 10, 10, 11, 14, 14, 18, 23, 24, 28, 49, 64, 113, 129
pag. 44
differenziato. Queste pazienti mostravano infiltrazione del miometrio > 50%. L‟invasione linfo-vascolare era presente in 8 (72%) pazienti, assente in una paziente e non nota in 2 (18%)pazienti. Secondo la recente classificazione FIGO 2009, 5 pazienti erano in stadio IB, 4 in stadio II ed infine 2 pazienti in stadio IIIA. Le 11 recidive locali sono state stratificate in base ai fattori di rischio presenti alla diagnosi, risultando 2 con rischio intermedio e 9 con rischio alto. Si noti che solo una delle 32 pazienti sottoposte a brachiterapia ha recidivato a livello vaginale.
Le recidive lombo-aortiche e a distanza sono state 29 (tempo mediano di comparsa, 23 mesi), di cui 8 con recidiva anche a livello locale. Nelle 21 pazienti con recidiva lombo-aortica o a distanza, lo stadio di malattia era IB in 4 pazienti, IC in 11, IIA in 1paziente, IIB in 4 e IIIA in 1 paziente. Secondo la recente stadi azione FIGO 2009 5 pazienti erano i stadio IB, 4 pazienti in stadio II ed 1 pazienti in stadio IIIA. L‟invasione linfovascolare era presente in 9 (42%) pazienti, assente in 3(14%) e non nota in 10 (47%). 16 (55%) pazienti mostravano infiltrazione miometriale > 50%; il grading era G1 in 2 (9%) pazienti, G2 in 11(52%) e G3 in 8(38%); 9(44%) pazienti non avevano interessamento linfonodale, mentre 12(56%) non avevano subito linfadenectomia.
11(52%) pazienti erano classificate in rischio alto e 10 (47%) in rischio medio.
Le recidive di malattia (locali e distanti) sono state analizzate in funzione del tempo di attesa della radioterapia e della durata del trattamento radiante; il grafico relativo è riportato in figura 3.7. Si può osservare che tutte le recidive locali sono occorse nelle pazienti che hanno ricevuto la radioterapia oltre 9,3 settimane dopo l‟intervento, e quest‟osservazione concorda con il risultato del fit di figura 3.5. Si noti inoltre che 10 delle 11 recidive locali intervengono in pazienti con una durata di trattamento superiore alla mediana.
Non si osserva invece un andamento sistematico in rapporto all‟incidenza di recidive a distanza.