1
INDICE
Introduzione 2 I trapianti oggi 4 Europa 4 Italia 5Centro Trapianti di Pisa 9
Quando il trapianto di fegato 10
La chirurgia nel trapianto di fegato 12
Classificazione dei riceventi 15
Classificazione UNOS 16
Classificazione Child-Pugh 17
Classificazione MELD 18
Aumentare il numero dei trapianti 22
Scopo dello studio 40
Materiali e metodi 40
Risultati 48
Conclusioni 55
2
INTRODUZIONE
Il 1 marzo del 1963, Thomas Starzl tenta, a Denver, il primo trapianto di fegato. Operazione “impossibile”, il paziente, un bambino di tre anni affetto da agenesia parziale del fegato, non superò l’intervento per complicanze emorragiche. L’evento sollevò molte critiche ma Starzl ritentò nel maggio 1963 con un uomo affetto da carcinoma epatico; questa volta somministrò al paziente un grande quantitativo di fibrinogeno al fine di evitare l’emorragia, ma il paziente morì tre settimane dopo l’intervento per complicanze tromboemboliche.
Nei primi anni Sessanta, Paul Terasaki (Los Angeles,California), scoprì un metodo di determinazione degli antigeni tissutali responsabili del rigetto; Starzl approfondì la ricerca di nuovi farmaci che potessero bloccare il sistema immunitario del ricevente. Per tutti gli anni Settanta tuttavia, nonostante i miglioramenti della tecnica chirurgica, il rigetto dell’organo determinava una sopravvivenza ad un anno solo del 25% dei pazienti.
La svolta si ebbe negli anni Ottanta con l’avvento della Ciclosporina e della soluzione conservativa della Wisconsin University che rivoluzionarono la sopravvivenza a breve e a lungo termine di questi pazienti.
Le tappe principali del trapianto di fegato:
1963, Denver (USA). Thomas Starzl esegue il primo trapianto di fegato: il paziente morì dopo pochi giorni.
1967, Denver (USA). Thomas Starzl: primo trapianto di successo (sopravvivenza post-trapianto: 13 mesi)
1969-1974. Xenotrapianto. Starzl impianta organi di scimpanzé in bambini, con sopravvivenze che oscillano tra 1 e 14 giorni post-trapianto.
1988, Villejuif (Francia). Primo tentativo di split liver transplantation: il fegato di un donatore, diviso in due metà, venne allocato in due distinti pazienti.
1989, Chicago (USA). Primo trapianto da vivente: Christopher Broelsch trapianta una porzione del fegato di Tery Smith nella figlia di 21 mesi, Alyssa, affetta da atresia biliare. Entrambe sopravvivono.
1992, Duke University (USA). Il fegato di un maiale viene utilizzato come ponte al trapianto per due donne. Una di esse, alla quale il fegato di suino, esterno al corpo, venne connesso mediante le arterie epatiche, sopravvisse fino al trapianto da donatore umano; l’altra, il cui fegato suino era stato allocato dietro il fegato nativo, sopravvisse 32 ore.
3
Applicato agli inizi come una terapia di ultima sponda, il trapianto epatico è ormai il trattamento più efficace delle epatopatie croniche avanzate e delle forme più gravi dell’insufficienza epatica acuta. Questa performance, legata dapprima ai progressi nell’immunosoppressione, alla qualità della conservazione del fegato ed anche ai progressi dell’anestesia e della rianimazione intraoperatoria, è anche da attribuirsi al miglioramento della tecnica di impianto del trapianto.Nella sua opera Experience in hepatic transplantion, edita nel 1969, Starzl descrive il metodo, esponendo i principi fondamentali che, ancora oggi, garantiscono il successo dell’intervento.
4
I TRAPIANTI OGGI
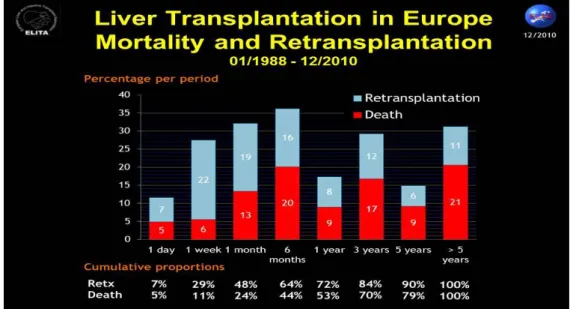
EUROPAIl Registro della Società Europea Trapianti (European Liver Transplantation Registry, ELTR) ha analizzato i dati provenienti da 145 centri trapianti distribuiti in 25 paesi europei dal 1988 al 2010. Dai dati raccolti emerge che la sopravvivenza media dei pazienti nel periodo preso in considerazione sia del 91% ad 1 anno dal trapianto, dell’83% a 3 anni e del 79% nel periodo superiore a 5 anni dal trapianto, con un netto trend in aumento che viene attribuito alla crescente esperienza delle equipe multidisciplinari e ai progressi della terapia immunosoppressiva. Il periodo più critico invece non sembra essersi molto modificato nel tempo: nei 6 mesi post-trapianto si hanno il 44% delle morti e il 64% dei reTOF e all’interno di questo periodo critico risulta essere il sesto mese quello con la mortalità maggiore (20%) e la prima settimana quella con maggiori reTOF (22%). Tra le principali cause di reTOF troviamo: complicanze tecniche, Primary Non Function e rigetto, soprattutto cronico. La morte è dovuta principalmente a cause generali (MOF o complicanze a carico dei singoli apparati), sepsi o ricorrenza della malattia primaria. Sempre dai dati del ELTR dello stesso periodo, si evince che l’eziologia più frequente che porta a trapianto è la cirrosi (64%), seguita dal carcinoma (25%), dall’insufficienza epatica acuta (3%) e altre cause (8%). Per quanto riguarda i fattori di rischio propri del donatore che possono influenzare l’outcome, vengono riportati come significativi solo l’età, il mismatch di gruppo sanguigno rispetto al ricevente e il tempo di ischemia dell’organo.
5
Un’analisi effettuata sui dati provenienti dal database ELTR 1988-2003 e pubblicata su Lancet1 affermava che le cause di morte nei primi mesi post-trapianto sarebbero influenzate dalle condizioni preoperatorie, mentre man mano che ci si allontana dal trapianto il decesso avverrebbe per cause non correlate al trapianto. I limiti principali dell’analisi, come denunciato dagli Autori stessi, sono la mancanza di dettagli sulle condizioni cliniche preoperatorie dei riceventi e la generalizzazione dei dati che riflettono l’andamento medio in Europa senza tenere conto delle differenze esistenti tra i vari Paesi.
ITALIA
Il sistema trapianti in Italia prevede che il coordinamento dell’attività di donazione, prelievo e trapianto sia articolato su quattro livelli: nazionale (Centro Nazionale Trapianti), regionale e interregionale (Centri Regionali Trapianto e Centri interregionali Trapianto) e locale (Asl e Centri Trapianto). Questo tipo di organizzazione ha permesso al sistema trapianti italiano di raggiungere livelli di eccellenza negli ultimi anni sia per la qualità dei trapianti effettuati che per le condizioni dei pazienti trapiantati, due variabili strettamente legate. Il Centro Nazionale Trapianti (CNT) ha sede a Roma, all’Istituto Superiore di Sanità ed è deputato a numerose funzioni tra le quali:
cura la tenuta delle liste delle persone in attesa di trapianto, differenziate per tipologia di trapianto e assicura la disponibilità di tali dati 24 ore su 24;
definisce i parametri tecnici ed i criteri per l'inserimento dei dati relativi alle persone in lista di attesa allo scopo di assicurare l'omogeneità dei dati stessi, con particolare riferimento alla tipologia ed all'urgenza del trapianto richiesto, e di consentire l'individuazione dei riceventi;
individua i criteri per la definizione di protocolli operativi per l'assegnazione degli organi e dei tessuti;
definisce linee guida rivolte ai centri regionali o interregionali per i trapianti allo scopo di uniformare l'attività di prelievo e di trapianto sul territorio nazionale; procede all'assegnazione degli organi per i casi relativi alle urgenze, per i
programmi definiti a livello nazionale e per i tipi di trapianto per i quali il bacino di utenza minimo corrisponde al territorio nazionale;
6 definisce criteri omogenei per lo svolgimento dei controlli di qualità sui
laboratori di immunologia coinvolti nelle attività di trapianto;
individua il fabbisogno nazionale di trapianti e stabilisce la soglia minima annuale di attività per ogni struttura e i criteri per una equilibrata distribuzione territoriale delle medesime;
definisce i parametri per la verifica di qualità e di risultato delle strutture;
promuove e coordina i rapporti con le istituzioni estere di settore al fine di facilitare lo scambio di organi.
I Centri Interregionali costituiti in Italia sono tre: l’Associazione Interregionale Trapianti (AIRT), il Nord Italian Transplant program (NITp) e l’Organizzazione Centro-Sud Trapianti (OCST).
Il Centro regionale o interregionale svolge le seguenti funzioni:
Coordina le attività di raccolta e di trasmissione dei dati relativi alle persone in attesa di trapianto nel rispetto dei criteri stabiliti dal Centro nazionale.
Coordina le attività di prelievo e i rapporti tra i reparti di rianimazione presenti sul territorio in collaborazione con i coordinatori locali.
Assicura il controllo sull'esecuzione dei test immunologici necessari per il trapianto.
Procede all'assegnazione degli organi in applicazione dei criteri stabiliti dal Centro nazionale.
Coordina il trasporto dei campioni biologici, delle èquipes sanitarie e degli organi e dei tessuti nel territorio di competenza.
Cura i rapporti di collaborazione con le autorità sanitarie del territorio e con le associazioni di volontariato.
Quando si presenta il caso di un possibile donatore, l’ospedale ne dà comunicazione all’agenzia locale di allocazione d’organi (CIR di riferimento). L’assegnazione degli organi avviene secondo criteri di rotazione, urgenza, tempo di attesa in lista, compatibilità gruppo-ematica, correlazione antropometrica tra donatore e ricevente. Il CIR provvederà a questo punto ad adempiere a tutte le funzioni sopra esposte mentre l’ospedale di provenienza del donatore si occuperà di proseguire il periodo di osservazione, constatare il decesso, allestire la sala operatoria e trasportare il
7
donatore dalla terapia intensiva alla sala dove convergeranno le equipe esterne e/o locali per il prelievo multiorgano.
Attività di trapianto
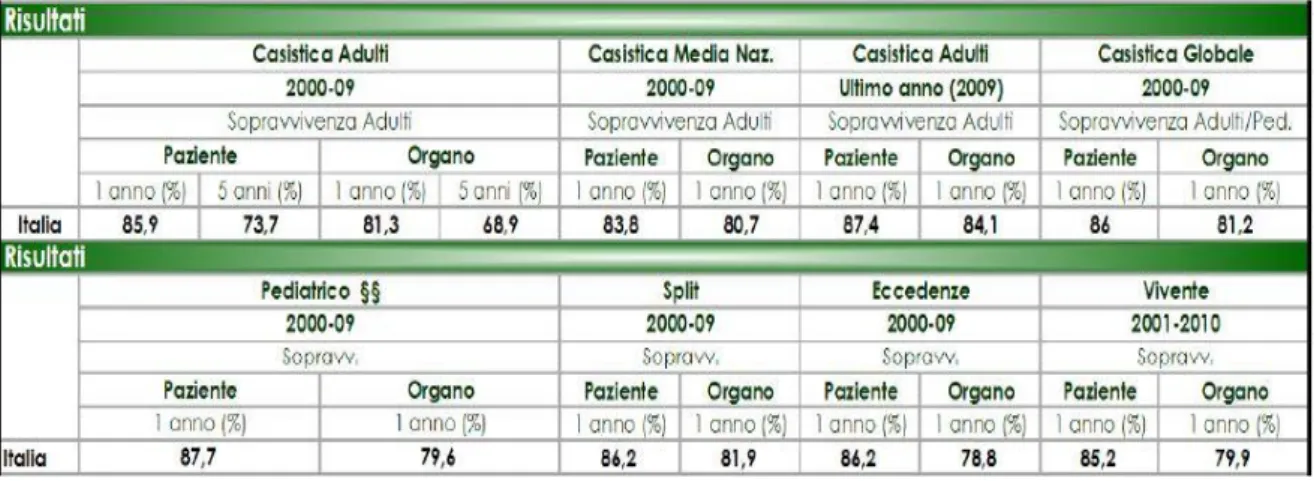
Gli ultimi dati messi a disposizione dal Ministero della Salute circa l’attività del trapianto di fegato riguardano il periodo 2000-20092. Sono registrati in tale periodo 22 Centri Trapianto attivi sul territorio nazionale. I dati in questione riportano un totale di 9470 trapianti effettuati: di questi, in base alle schede di trapianto di cui si abbia rintracciabilità nel Sistema Informativo Trapianti (SIT), sappiamo che 8704 su adulti e 672 pediatrici. L’indice di soddisfacimento della Lista (ovvero il rapporto fra il numero dei trapianti eseguiti ed il numero dei pazienti in lista di attesa) è del 38%. I trapianti ortotopici registrano un tasso di sopravvivenza del paziente ad un anno e a cinque anni rispettivamente dell’85,9% e del 73,7%. I trapianti eseguiti con tecnica Split sono stati 889, con sopravvivenza del paziente ad un anno dell’86,2%. I trapianti da vivente 252, con una sopravvivenza del paziente ad un anno dell’ 85,2%.
I trapianti pediatrici sono stati 672, con un tasso di sopravvivenza del paziente ad un anno dell’87,7%.
Tabella 1 Dal Centro Nazionale Trapianti
Al 31 Agosto del 2011 risultavano iscritti nelle liste per trapianto di fegato in Italia 1013 pazienti, con un tempo di attesa medio in lista di 2,09 anni e una mortalità in lista del 6,9%.
8
Come sottolineato da un lavoro pubblicato sul New England Journal of Medicine da Edwards e coll.3, il tasso di mortalità di un centro trapianti diminuisce all’aumentare del numero di interventi eseguiti: gli Autori individuano in 20 trapianti/anno la soglia per abbattere il tasso di mortalità; tale limite è fissato in Italia dal CNT a 25 trapianti l’anno.
Attività di donazione
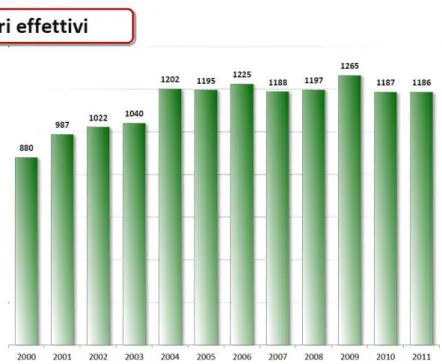
I dati dell’anno 2011 del Sistema Informativo Trapianti (dati preliminari al 31 ottobre 2011) riguardanti l’attività di donazione in Italia riportano un numero di 37,3 donatori segnalati per milione di persone (pmp), 1186 (19,7 pmp) donatori effettivi (donatori da cui sia stato prelevato almeno un organo, indipendentemente se questo sia stato trapiantato oppure no), 1108 (18,4 pmp) donatori utilizzati (che hanno cioè dato esito al trapianto di almeno un organo).
In Toscana, nel 2011, i donatori segnalati sono stati 274 (73,4 pmp), 151 (40,6 pmp) i donatori effettivi e 126 (33,8 pmp) i donatori utilizzati per attività di trapianto.
Sempre nella nostra regione, la percentuale di opposizione alla donazione è stata del 23,2% contro la media del 29% a livello nazionale4.
9
Il Centro Trapianti di PISA
Il Centro Trapianti di Pisa è attivo dal 1996. Dati riguardanti l’anno 2011 (fonte dati: Report CIR),ci indicano che il Centro Trapianti di Pisa figura al secondo posto in Italia per numero di trapianti eseguiti con 115 interventi (30,8 pmp contro 16,9 della media nazionale); primo in Italia il Centro Trapianti di Torino con 137 trapianti eseguiti. Secondo quanto riportato nella valutazione di qualità dell’attività di trapianto di fegato del CNT per l’ultimo periodo da loro analizzato con dati definitivi (periodo 2000-2009), il Centro di Pisa figura ai primi posti in Italia per numero di trapianti: 903 casi, con una sopravivenza del paziente ad un anno dal trapianto dell’84%.
Il processo operativo del coordinamento trapianti
L’Organizzazione Toscana Trapianti (OTT) prevede una collaborazione stretta tra le figure in gioco al fine di ottimizzare al massimo i tempi di trapianto dell’organo donato.
Il Coordinamento Trapianti riceve la segnalazione da parte della Terapia Intensiva dove è ricoverato il potenziale donatore, dell’inizio dell’osservazione della avvenuta morte cerebrale e l’ora indicativa di fine osservazione. I dati del donatore vengono inviati al Coordinamento affinchè venga selezionato un idoneo ricevente dalle liste di attesa. Viene poi eseguito un match tra donatore e ricevente per valutarne la compatibilità e una volta identificato il ricevente più idoneo, questi viene contattato telefonicamente e si cominciano ad organizzare i mezzi di trasporto per farlo pervenire il prima possibile al centro trapianti.
L’intero processo di trapianto vede impegnate due equipe chirurgiche: una per il prelievo d’organo e la chirurgia di banco e una per il trapianto.
Valutando i tempi di trasferimento dell’equipe di espianto verso l’Ospedale del donatore, il Coordinamento organizza il mezzo di trasporto più idoneo e pre-allerta l’equipe chirurgica (2 chirurghi e 1 infermiere) affinchè tale equipe sia in loco al termine dell’osservazione. Il fegato viene prelevato e immerso in una soluzione di conservazione. L’equipe a questo punto torna al centro trapianti.
Durante il prelievo d’organo il Coordinamento provvede ad allertare l’equipe di trapianto (3 chirurghi, 2 infermieri, 1 anestesista) e far predisporre la sala operatoria.
L’equipe di espianto infine, giunta al centro trapianti, prepara al banco il fegato per il successivo reimpianto.
10
QUANDO IL TRAPIANTO DI FEGATO
Inizialmente, a causa della scarsa sopravvivenza postoperatoria, venivano sottoposti a trapianto di fegato solo pazienti affetti da patologie epatiche terminali molto severe, con risultati spesso deludenti. Successivamente, grazie ai progressi della medicina e della chirurgia dei trapianti e delle cure intensive ad essi dedicate, l’aspettativa di vita di questi pazienti è stata rivoluzionata. Prima di tutto la disponibilità di nuove terapie, mediche e non, ha allungato il tempo medio per lo sviluppo della malattia epatica terminale, migliorando le condizioni cliniche generali e la sopravvivenza media dei pazienti affetti da patologia epatica; inoltre, il trapianto ortotopico di fegato (TOF), adottando accorgimenti volti a minimizzare le ingenti perdite ematiche ed ottimizzando i tempi di realizzazione, ha assunto i caratteri di tecnica chirurgica “routinaria” e sicura. Attualmente dunque, alla luce dei dati sulla sopravvivenza post-trapianto riportati dalle varie organizzazioni scientifiche, è stato possibile allargare l’indicazione al trapianto di fegato anche a pazienti per i quali precedentemente i rischi derivati dall’intervento sarebbero stati superiori ai benefici.
INDICAZIONI al TRAPIANTO: Malattie croniche con
insufficienza epatica conclamata
Epatite fulminante Malattie metaboliche
Epatopatie da virus Virale Deficit di
alfa1-antitripsina
Epatopatia alcolica Da farmaci Morbo di Wilson
Epatopatie da farmaci Altre Ipercolesterolemia familiare Epatopatie autoimmuni
Neoplasie epatiche Crigler Nijar tipo I Cirrosi biliare primitiva Carcinoma epatocellulare GIcogenosi tipo I e IV Colangite sclerosante primitiva Carcinoide Tirosinemia
Atresia delle vie biliari
Emangioma Emocromatosi
Sindromi colestatiche ereditarie
Epatoblastoma Amiloidosi familiare
11
Insufficienza epatica post-trapianto Sindrome di Budd-Chiari Acuta (entro 7gg) Non acuta Recidiva di malattia CONTROINDICAZIONI al TRAPIANTO: Assolute
Malattia epatica grave con importante interessamento multiorgano tale da ridurre marcatamente la probabilità di sopravvivere all’’intervento
AIDS conclamato Infezioni attive
Neoplasie non epatobiliari
Cardiopatie, pneumopatie severe Colangiocarcinoma
Relative
Età > 60-65 anni (in base alle condizioni cliniche del paziente) Gravi disturbi psichiatrici
Trombosi dell’asse spleno-mesenterico-portale Ipertensione polmonare
Temporanee
Sepsi al di fuori del sistema epato-biliare Alcolismo e tossicodipendenza
12
LA CHIRURGIA NEL TRAPIANTO DI FEGATO
Il trapianto definito ortotopico è quello in cui l’organo nativo del ricevente viene rimosso e il nuovo organo posizionato nella stessa collocazione fisica ripristinando quindi gli stessi rapporti anatomici e vascolari dell’organo nativo. Esistono trapianti diversi dall’ortotopico, definiti eterotopici o ausiliari, nei quali al fegato nativo del ricevente, lasciato nella sua sede, viene “affiancato” l’intero o parte dell’organo del donatore; questi trapianti tuttavia sono eseguiti molto raramente. Di seguito parliamo di trapianto di fegato intendendo il trapianto ortotopico.
La tecnica del trapianto di fegato è ormai da tempo standardizzata e prevede due varianti principali: la tecnica cosiddetta “convenzionale”, nella quale viene asportato il tratto infraepatico della vena cava inferiore del ricevente ed impiegato un particolare by-pass per la circolazione extracorporea, e la tecnica cosiddetta “piggy-back” nella quale il fegato nativo viene separato dalla vena cava inferiore durante l’epatectomia e l’anastomosi cavale confezionata sulla cuffia delle vene sovraepatiche.
Fasi del trapianto ortotopico di fegato
Il trapianto di fegato si compone di tre fasi principali:
1. Pre-anepatica. Questa prima fase consiste nella procedura, talora laboriosa, di rimozione del fegato nativo. Questo viene liberato dai suoi legamenti, gli elementi del peduncolo epatico vengono isolati ed eventuali circoli venosi collaterali vengono chiusi. Nella tecnica convenzionale, la vena cava viene dissecata e rimossa insieme al fegato nativo; nella tecnica piggy back, si dissecano solo le vene sovra epatiche, escludendo il fegato dalla circolazione ma conservando il flusso nella vena cava inferiore.
In questa fase vi possono essere rilevanti modificazioni emodinamiche per l’apertura dell’addome, la rimozione talvolta di ingenti quantità di ascite, la presenza di grossolani circoli collaterali e di aderenze per precedenti interventi che possono determinare grandi perdite ematiche e di fattori della coagulazione. Inoltre la posizione del paziente, che determina sollevamento delle coste e la presenza talora di versamento pleurico sono spesso causa di ridotti scambi gassosi che necessitano di pronta correzione.
13
2. Anepatica. Tale fase inizia con il clampaggio del peduncolo epatico, continua con la rimozione del fegato nativo, posizionamento dell’organo trapiantato e infine confezionamento delle anastomosi vascolari.
Nella tecnica classica la vena cava inferiore è clampata in due punti: in posizione sotto-diaframmatica e al di sotto dello sbocco delle vene renali; il fegato nativo viene rimosso e il fegato del donatore, comprendente un segmento di vena cava, viene posizionato e si eseguono le anastomosi cavale sovra-epatica, cavale sotto-epatica e portale. Tale clampaggio porta ad una riduzione importante del ritorno venoso al cuore con conseguente diminuzione della gettata cardiaca e pressione arteriosa con contemporaneo aumento delle pressione nel circolo splancnico e nel territorio della vena cava inferiore. Spesso si associa una tachicardia transitoria e un aumento delle resistenze sistemiche con diminuzione della pressione in arteria polmonare e della wedge pressure.
Un modo per ovviare a questa evenienza consiste nell’approntare uno shunt veno-venoso: il sangue viene drenato grazie a due cannule poste nella vena porta e nella vena cava inferiore, attraverso la vena femorale e reinfuso con una pompa (senza ossigenazione) nella vena ascellare. Tale metodo presenta indiscussi vantaggi consentendo un recupero di circa il 40% della gittata cardiaca, riducendo la stasi e la congestione a livello intestinale e agli arti inferiori. La decompressione del circolo splancnico riduce inoltre il sanguinamento. Tra gli sconvenienti di questa tecnica figurano il rischio di embolia polmonare gassosa o trombotica, di decannulazione intempestiva, di infezione, di ipotermia, di lesioni vascolari, lesioni del plesso brachiale o linfocele postoperatorio (soprattutto in caso di accesso chirurgico).
La tecnica piggy back prevede invece un clampaggio laterale sulla faccia anteriore della vena cava inferiore, all’origine delle vene sovra epatiche, senza interrompere il flusso cavale. Prima di tale clampaggio è possibile realizzare un’anastomosi porto-cavale termino-laterale temporanea, funzionante durante la fase anepatica, che ha lo scopo di migliorare la tollerabilità al successivo clampaggio e diminuire il sanguinamento in caso di ipertensione portale importante. Il fegato nativo viene quindi rimosso e il nuovo organo viene collocato in posizione ortotopica. Si procede ad una anastomosi cavo-cavale latero-laterale o termino-laterale. L’anastomosi portale viene eseguita
14
successivamente, dopo aver eliminato l’eventuale anastomosi porto-cavale temporanea, e si ripristina il flusso con declampaggio cavale e quindi portale. Questa tecnica ha il vantaggio di determinare un tempo di anepatica più breve e una diminuzione del fabbisogno di emoderivati. Le principali complicanze sono invece emorragiche, in caso di difficoltà anatomiche o vascolari con ostruzioni al ritorno cavale o sindromi di Budd Chiari, soprattutto in caso di dimensione inadeguata del trapianto.
3. Riperfusiva e post-riperfusiva. Dopo la rivascolarizzazione del nuovo organo, si eseguono l’anastomosi dell’arteria epatica e delle vie biliari (bilio-biliare se le vie biliari sono normali, bilio-digestiva su ansa a Y negli altri casi). In questa fase si verificano importanti alterazioni emodinamiche conseguenti al carico di prodotti tossici che giungono dalla metà inferiore del corpo, dal circolo splancnico e dal fegato trapiantato. Si assiste alla cosiddetta sindrome da riperfusione. Consiste in bradicardia, ipotensione, aumento della pressione venosa centrale, della pressione dell’arteria polmonare e della wedge con diminuzione delle resistenze periferiche. Può durare dai 10 ai 15 minuti e generalmente si risolve senza particolari sequele. Talora però, a causa di possibili meccanismi riflessi di tipo meccanico, termico o metabolico che determinerebbero depressione miocardica, si può assistere all’insorgenza di gravi aritmie fino all’arresto cardiaco. Particolare attenzione in questa fase va posta agli squilibri elettrolitici e alle alterazioni dell’assetto coagulativo.
L’ultima fase del trapianto è generalmente la più tranquilla, tesa al mantenimento del volume plasmatico, all’omeostasi metabolica ed ematologica, al ripristino della temperatura corporea mentre i chirurghi procedono alle ultime fasi di emostasi, posizionamento dei drenaggi e chiusura.
15
CLASSIFICAZIONE DEI RICEVENTI
Preparazione del paziente e verifica della sua idoneità
La valutazione di idoneità del ricevente al trapianto viene effettuata nel rispetto di principi
oggettivi, condivisi e documentabili. Il paziente è sottoposto a valutazione per definire la malattia e lo stato di gravità ed escludere la presenza di controindicazioni assolute o relative all'intervento. La proposta di inserimento in lista è a carico del Medico di Medicina Generale, del
Gastroenterologo o dell' Infettivologo.
Il paziente candidato a trapianto di fegato viene valutato in base a:
indagini cliniche diagnostiche
assenza di controindicazioni assolute o relative;
valutazione psicologica (capacità psicologica di accettazione del trapianto). E' importante per prevedere se il candidato a trapianto sarà in grado di osservare responsabilmente le cure, pertanto vengono valutati lo stile di vita, la stabilità psicologica e il supporto familiare. Sono da considerarsi controindicazioni assolute al trapianto i danni cerebrali irreversibili (qualunque ne sia la causa), la psicosi attiva e l'abuso abituale di alcool e/o sostanze; sono invece considerate controindicazioni relative i disturbi della
personalità, la depressione, i disturbi nevrotici e la limitata capacità di compliance terapeutica,
patologia presente:
epatopatia acuta o cronica irreversibile
patologia refrattaria a trattamenti medico-chirurgici
La valutazione del ricevente consiste nell'indagine di quattro steps principali:
Proposizione, durante la quale vengono effettuati:
esami ernatochimici markers epatite
rilevazione misura antropometriche esami della funzione coagulativa esame obiettivo esami strumentali
Valutazione, che ha lo scopo di evidenziare eventuali fattori di rischio e durante la quale viene
fatto il punto della situazione su ogni singolo organo e vengono valutati gli accertamenti eseguiti nella proposizione.
Approfondimento, durante il quale vengono eseguiti:
esami ematochimlci Indagini Microbiologiche immunologia Valutazione Pneumologica biochimica urinaria Valutazione Odontoiatrica Oligoelementi Valutazione Osteo-Articolare Markers tumorali Valutazione Addominale
Ormoni Se Paziente con Morbo di Wilson Indagini Sierologiche e Virologiche Se Paziente con diabete mellito
Completamento, durante il quale vengono eseguiti:
Valutazione cardiologica Valutazione Neurologica Valutazione Pneumologica Prove Immunologiche Valutazione Addominale
16
Classificazione dei pazienti in lista d'attesa
I pazienti vengono suddivisi5:
in 4 gruppi sanguigni (O, A, B, AB); in ordine di status UNOS
- all'interno dello status, in ordine di score Child-Pugh
- a parità dì score Child-Pugh, per anzianità di permanenza nello specifico status. L'identificazione di uno specifico ricevente viene effettuata in base a:
gravità della malattia in relazione allo status clinico secondo la classificazione UNOS;
data di inserimento nello status clinico; compatibilità di taglia corporea;
compatibilità di emogruppo;
compatibilità di classe di età «20 aa, 20-55 aa, >55 aa).
Classificazione UNOS
Lo score clinico più usato per misurare il rischio di mortalità è stato quello di Child-Turcotte-Pugh (CTP). Il CTP score è stato universalmente usato sia per la definizione dei criteri minimi per l’inserimento in lista di trapianto, sia per stratificare i pazienti in lista in differenti classi di severità, e quindi di priorità per trapianto. Un modello di tale stratificazione in classi di severità, ampiamente diffuso a livello dei vari centri di trapianto, è quello proposto dall’agenzia americana United Network for Organ Sharing (UNOS), indicato nel riquadro nella modifica adottata dal NITp:
17
Tabella 2 Criteri di classificazione UNOS-NITp
All’atto dell’attribuzione degli organi, all’interno delle classi 2B e 3 (che rappresentano >90% dei pazienti in lista) viene di norma utilizzato il criterio temporale dell’iscrizione in lista.
Classificazione Child-Pugh
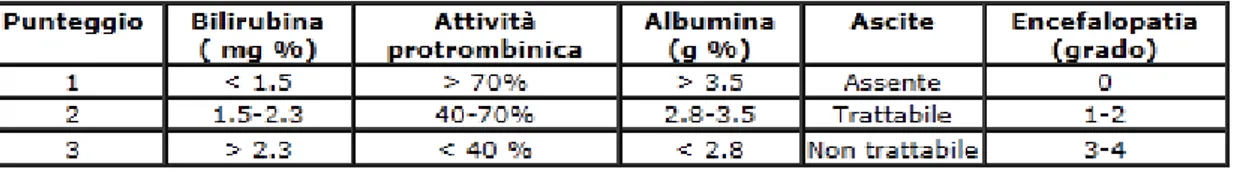
Basato su parametri quali albuminemia, bilirubinemia, INR, presenza d'ascite ed encefalopatia possiede alcuni limiti intrinseci, quali:
la discrezionalità (legata all' interpretazione spesso soggettiva dell' ascite e dell' encefalopatia);
la variabilità dello score conseguente alla variabilità dei dati di laboratorio; la ridotta possibilità di stratificazione (il sistema C-P contempla solo 11 livelli
da 5 a 15);
18
di severità a pazienti che abbiano, ad esempio, una bilirubinemia > 3,5 mg/dl od un'albuminemia < 2,5 gr/di;
il limite rappresentato dal fatto che le cinque variabili che compongono il sistema C-P abbiano lo stesso peso nel determinare la severità dello stadio di malattia epatica (il ché contravviene alla comune esperienza clinica);
scarsa capacità predittiva legata al fatto che non tiene conto della variabilità clinica e biochimica della malattia, spontanea o indotta dall'intervento del medico.
Tabella 3 Criteri di classificazione Child-Pugh
Le disposizioni delle autorità americane hanno generato, quindi, la ricerca di un sistema d'allocazione degli organi che:
consentisse ì.ma più accurata rappresentazione del grado di severità dei pazienti epatopatici rispetto al sistema C-P;
fosse basato su parametri facilmente oggettivabili (a differenza dell'ascite e dell' encefalopatia);
fosse applicabile all'intero spettro della popolazione dei pazienti epatopatici; fosse statisticamente vali dato
Classificazione MELD (Model for End-stage Liver Disease).
Sistema di score a punti introdotto per la previsione della mortalità precoce (3 mesi) in pazienti epatopatici candidati al posizionamento di shunt intraepatico porto-cava transgiugulare (TIPSS)7. Dal febbraio 2002 il MELD è stato adottato dall’UNOS come strumento, evidence–based, di allocazione degli organi per tutti i potenziali candidati,
19
esclusi quelli con epatite fulminante (UNOS status 1). Le modalità per il calcolo del punteggio MELD sono indicate nel riquadro:
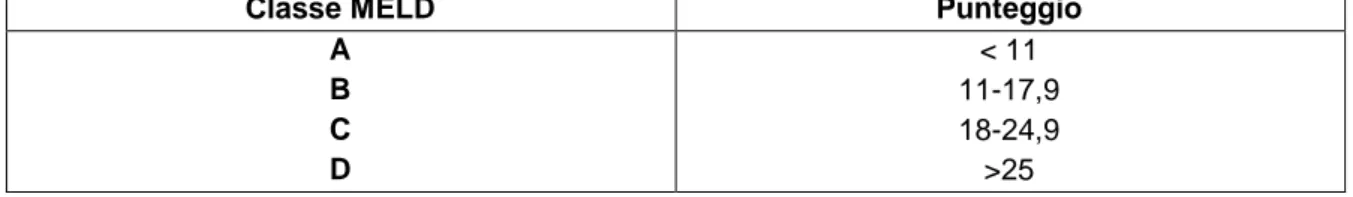
Tabella 4 Punteggio MELD
Tabella 5 Suddivisione in categorie secondo punteggio MELD
I principali vantaggi del MELD consistono:
nell'aver introdotto la creatinina tra i parametri clinici per la definizione della severità della patologia epatica;
nell'attribuire differente peso ai differenti parametri clinici impiegati (INR -> creatinina -> bilirubina);
nel produrre una scala continua di valori assoluti che permettono di distinguere tra due o più pazienti epatopatici (12, 13, 14, ... , 40). In tale modo è possibile dire che un paziente con score MELD 18 ha uno stadio di malattia più grave di un paziente con punteggio pari a 10.
Il sistema MELD presenta numerosi limiti, derivanti, in gran parte, dall'ambiente in cui il sistema è nato (pazienti epatopatici candidati a posizionamento di TIPSS) e dalle successive modalità di validazione statistica (che si sono basate su popolazioni di pazienti epatopatici in fase avanzata dì malattia). Tra i limiti riconosciuti ricordiamo:
il MELD è privo di alcuni parametri quali l'ascite, l'encefalopatia e la natriemia che pur rivestono un peso importante nella definizione del grado di severità della patologia epatica cronica e/o della prognosi (sopravvivenza a 3 mesi); il MELD non contempla alcune complicanze dell' epatopatia cronica, quali
l'ipertensione portale, l'ipersplenismo, l'emorragia digestiva, probabilmente
Classe MELD Punteggio
A B C D < 11 11-17,9 18-24,9 >25
20
essendo nato tra pazienti epatopatici candidati a posizionamento di TIPSS (bias di selezione negli studi originari del 2000);
il MELD sembra possedere capacità discriminativa per pazienti in stadio avanzato di malattia (alti scores > 18, pazienti ospedalizzati), mentre perde tale capacità per pazienti a basso score (<15 o < 10; ambulatoriali). Infatti non è stata mai eseguita una caIibrazione, cioè verificata la capacità del MELD di predire con eguale accuratezza la sopravvivenza nelle varie classi,o strati, di score;
la performance del MELD è inferiore nel definire la prognosi di pazienti affetti da patologie non alcoliche e non virali, ed in particolare per:
le epatopatia colestatiche;
le epatopatie metaboliche congenite o geneticamente determinate; i pazienti affetti da complicanze correlate all'ipertensione portale; i pazienti affetti da sindrome epato-polmonare;
i pazienti affetti da ascite intrattabile;
i pazienti affetti da carcinoma epatocellulare;
le epatopatie acute fulminanti, e tra queste soprattutto per quelle correlate all'abuso di acetaminofene;
i pazienti affetti da patologie pluridistrettuali e candidati a trapianto combinato (fegato-rene, fegato-cuore, ecc.);
i pazienti affetti da peritonite batterica spontanea;
i pazienti affetti da cornorbilità cardiorespiratorie maggiori; i pazienti in stato settico;
i candidati a retrapianto, per i quali appaiono più accurati altri sistemi di scoring come quello suggerito da Rosen (età del ricevente; bilirubina;
creatinina; causa di graft failure; coefficiente
UNOS);
la performance del MELD può essere modificata dalla variabilità delle indagini di laboratorio. Essa inoltre è legata alla terapia somministrata (anticoagulanti, diuretici o albumina) e al regime di vita (domiciliare vs. ospedalizzato) del paziente. In merito alla misurazione della creatininemia gli stessi autori consigliano di rilevare il valore in condizioni di stabilità emodinamica e di idratazione;
21
fini dell'attribuzione di priorità per l'immissione in lista d'attesa. La prassi in ambito UNOS è quella di impiegare l'ultimo valore MELD disponibile, ma alcuni autori hanno suggerito di effettuare una registrazione ogni 30 giorni, ritenendo che un aumento di score > 5 punti sia indicativo di un peggioramento significativo dello stadio di malattia e, quindi, permetta di discriminare tra pazienti con score identici (il cosiddetto delta-MELD);
allo stato attuale non esiste evidenza conclusiva che lo score MELD sia più accurato dello score C-P nel predire la mortalità del paziente in lista d'attesa per trapianto di fegato. Gli studi pubblicati in letteratura a favore di una superiorità MELD vs. C-P sono quattro8 9 10 11 , per un totale di 4512 pazienti, mentre sette sono i lavori che non hanno rilevato alcuna superiorità12 13 14 15 16 17 18 19 ,per un totale di 8020 pazienti;
la presenza dì complicanze della cirrosi non incluse nel MELD (ascite, encefalopatia) sembra in letteratura avere valore predittivo pari al MELD, laddove il MELD all'atto dell’iscrizione in lista (vaseline MELD) è simile nei pazienti con o senza complicanze;
il sistema MELD non contempla alcun parametro relativo alla qualità di vita che pur riveste importanza nella selezione dei pazienti candidati a trapianto e nell'allocazione dei graft.
Allo stato attuale non è ancora chiaro se,ed in quale misura,il MELD possa essere impiegato per predire la mortalià post-trapianto,cioè se,oltre a servire ad una stratificazione dei pazienti in funzione della severità della loro malattia (principio di giustizia individuale), il MELD possa definire i risultati post-trapianto (principio dell'utilità). Vari Autori hanno individuato dei cut off in base alle proprie esperienze che consentissero di definire il limite tra trapianto utile e futile, tuttavia non esiste consenso su quale possa essere considerato un limite (o cut-off) di utilità (15?) o di futilità (24? 30? 36?) universalmente valido. In generale si ritiene che soltanto alti score MELD siano predittivi di sopravvivenza post-trapianto (probabilmente maggiore o uguale di 30) e che complessivamente il MELD non sia un parametro accurato per predire la sopravvivenza posi-trapianto. Ciò è dovuto al fatto che:
la maggior parte dei pazienti inclusi negli studi attualmente disponibili ha MELD < 30;
fattori relativi al donatore e al ricevente, e non rappresentati dal MELD, influenzino la prognosi post-trapianto.
22
AUMENTARE IL NUMERO DEI TRAPIANTI
Il miglioramento della sopravvivenza post-trapianto, ampliando il numero dei pazienti candidati a TOF, ha fatto emergere un nuovo problema: la scarsa disponibilità di organi in rapporto al crescente numero di persone iscritte nelle liste per trapianto. Con il miglioramento delle terapie, sia mediche che chirurgiche, pre- e post-trapianto, e quindi della sopravvivenza media del paziente epatopatico, sono aumentate le indicazioni all'esecuzione del trapianto di fegato. All'ampliamento del numero dei candidati a trapianto iscritti nelle liste, tuttavia, non è corrisposto un altrettanto rapido ampliamento del numero dei donatori, scelti inizialmente secondo criteri di inclusione abbastanza rigidi per poter garantire il buon esito dell’intervento. Per ovviare a questo
problema sono state sviluppate
(e sono tuttora in evoluzione) strategie volte ad aumentare il numero dei trapianti effettuati, consistenti nella sperimentazione dì nuove opzioni chirurgiche e nell'adozione di criteri più permissivi nella selezione dei potenziali donatori.
Strategie chirurgiche per aumentare il numero dei trapianti
Split liver (split liver transplantation)
Lo split liver è una tecnica che prevede la divisione del fegato del donatore in due emifegati funzionalmente autonomi che possono essere trapiantati a due riceventi. La divisione dell' organo può essere effettuata mediante chirurgia di banco, oppure in corso di prelievo a cuore battente (split in situ).
Questa tecnica, introdotta negli anni '80, è stata inizialmente impiegata per ridurre le liste di attesa pediatriche: il segmento epatico sinistro infatti veniva allocato ad un bambino e, grazie a questa tecnica, la mortalità dei pazienti pediatrici in lista di attesa per trapianto è passata dal 50% a quasi zero. La tecnica di split liver rappresenta dunque oggi la metodica di prima scelta per il trapianto pediatrico. Il segmento epatico destro, invece, veniva allocato ad un adulto, in base all'osservazione che la parte di fegato trapiantata debba essere circa l’1 % del peso corporeo del ricevente. La tecnica di split liver da cadavere, debitamente modificata spostando a destra rispetto alla tecnica convenzionale il piano lungo il quale viene diviso il parenchima epatico, consente di ottenere due graft di dimensioni sufficienti per essere trapiantati
23
in due riceventi adulti, anziché in un adulto e un bambino (splittone).
I vantaggi della tecnica sono rappresentati da un lato dall'espansione del pooi dei donatori, e dall'altro dalla perfezione morfologica-strutturale dei fegati che vengono sottoposti a split. Lo svantaggio consiste nel fatto che lo split è un atto di tecnica chirurgica molto delicato, per cui ci si può esporre ad una maggiore incidenza di complicanze rispetto al trapianto tradizionale.
Trapianto da vivente (living donar liver transplantation, LDLT)
Il LDLT è stato inizialmente utilizzato per ridurre le liste di attesa pediatriche con risultati incoraggianti, ed è stato in seguito esteso all’adulto. Nel caso del trapianto sull’adulto, viene prelevato il lobo destro dal donatore sano; le capacità rigenerative dell’organo fanno sì che già 3-4 settimane dopo l’intervento il fegato ritorni alle dimensioni originarie.
Questa tecnica, nata negli anni '80 e diffusasi parallelamente alla tecnica split liver, ha trovato grande successo in alcuni paesi, come il Giappone, dove la donazione degli organi da cadavere è un evento raro. Oltre all'espansione del pool dei donatori, questa tecnica ha il vantaggio di consentire di valutare la qualità dell'organo prima del trapianto, di non utilizzare un organo sottoposto allo stress emodinamico che si ha nella morte cerebrale, di annullare quasi completamente i tempi di ischemia e di poter procedere all’intervento in elezione prima di un decadimento significativo delle condizioni generali del ricevente. Tra gli svantaggi, una tecnica chirurgia a rischio più elevato che comporta maggiori morbilità (10-20%) e mortalità (0,2-1 %)20 21, alla base dei dubbi etici che accompagnano questa tecnica. I fautori del LDLT ritengono tuttavia non etico negare ad un adulto informato e consenziente l’opportunità di partecipare alla donazione.
In Italia la donazione da vivente è regolamentata dalla Legge 16 Dicembre 1999 n. 483 ("Norme per consentire il trapianto parziale di fegato", pubblicata sulla G.U. 297 del 20 Dicembre 1999).
Trapianto da donatore a cuore non battente (Non Heart Beating Donor)
Il donatore a cuore non battente (Non Heart Beating Donor, NHBD) è un soggetto che è andato incontro ad arresto cardiocircolatorio e nel quale dunque sia compromessa
24
la perfusione degli organi: tale periodo di tempo è, di fatto, un tempo di ischemia calda. Il tempo intercorso tra l'arresto cardiocircolatorio e I'espianto degli organi può essere noto con precisione, come caso di un decesso che si verifichi in ambito ospedaliero (definiti NHBD controllati), o meno, come nel caso di soggetti provenienti dal territorio e giunti morti in ospedale (definiti NHBD incontrollati).
Il ricorso al NHBD, approvato alcuni ma ancora in fase di sperimentazione in altri, ha l'evidente vantaggio di ampliare enormemente il pool dei donatori e di snellire le liste di attesa dei riceventi22; esistono tuttavia degli svantaggi, legati alla durata dell’ischemia calda, che si traducono in una più alta incidenza di disfunzioni d'organo precoci, primary non function e complicanze biliari23. I dati della letteratura suggeriscono pertanto di ricorrere al NHBD solo quando questo rappresenti il solo fattore di rischio del donatore, per ischemie calde non superiori ai 30 minuti e riducendo al minimo i tempi di ischemia fredda23.
Tecnica domino
Questo tipo di tecnica, ancora sperimentale e poco praticata, consiste nell’utilizzare il fegato prelevato da un paziente nel corso di un trapianto di fegato, trapiantandolo in un secondo ricevente. In tale tecnica sono dunque coinvolti tre pazienti:
1. il donatore in morte cerebrale;
2. il ricevente l’organo del primo donatore che contemporaneamente funge da donatore per il secondo ricevente;
3. il secondo ricevente;
Le indicazioni a tale tipo di tecnica sono molto limitate; sono candidabili a tale intervento pazienti affetti da una patologia metabolica molto rara, l’amiloidosi familiare portoghese. Tale patologia consiste in un difetto geneticamente trasmesso che determina la produzione a livello epatico di una variante della proteina plasmatica della transtiretina; questa variante causa una esagerata produzione di fibrille di amiloide che si depositano e si accumulano poi a livello di molti tessuti dell'organismo determinando alterazioni neurologiche, renali, cardiache, ecc. In questi soggetti il fegato mantiene perfettamente normale il resto delle sue funzioni e la manifestazione di malattia si verifica solo in età adulta (15-20 anni dalla nascita). Questi pazienti vanno trapiantati per riuscire ad ottenere un arresto della malattia (amiloidosi), ma il fegato che si preleva è funzionalmente e strutturalmente normale, ad eccezione della
25
produzione anomala di amiloide. Se questo fegato viene trapiantato su un altro paziente, la manifestazione di malattia amiloidotica si potrà manifestare (se si manifesterà) dopo circa 10-15 anni dal trapianto. E' evidente quindi che in caso di paziente anziano, con eventualmente uno o più nodi tumorali associati, ed in condizioni cliniche deteriorate che fanno ritenere probabile un suo decesso in lista prima che ci sia la disponibilità di un organo, la scelta di utilizzare questo tipo di fegato può risultare salva-vita e quindi essere ritenuta valida.
Nuovi criteri nella selezione dei potenziali donatori: il concetto di donatore “marginale”
I criteri per la selezione degli organi da utilizzare per il trapianto di fegato sono stati ampliati negli ultimi anni per far fronte alla scarsa disponibilità di organi in relazione alle crescenti necessità. Tale ampliamento ha implicato l’inclusione di donatori non ottimali, o marginali. In linea generale si considera un fegato marginale un organo il cui uso si associa ad un significativo aumento di rischio di morte o di complicanze dopo trapianto. Ciò implica evidentemente la corretta individuazione e definizione di tale “eccesso di rischio”6
. Ne consegue che il termine di fegato marginale è di fatto in continua evoluzione. Ciò sia per la progressiva acquisizione di dati sempre più solidi di outcome dopo il trapianto sia a breve che a lungo termine in relazione alla tipologia del donatore, sia per la individuazione di nuovi criteri di marginalità, sia per la loro migliore definizione di quelli già noti.
l progressi della medicina, unitamente al miglioramento della qualità della vita e a iniziative socioculturali, come l'introduzione dell'uso obbligatorio del casco per i ciclomotori, hanno determinato negli anni un innalzamento dell'età media dei donatori d'organo. La disponibilità di organi sempre più "anziani" (o in condizioni "non ottimali"), parallelamente all' aumento esponenziale del numero dei pazienti iscritti nelle liste di trapianto (e quindi alla necessità di trapiantare un numero maggiore di organi), ha suggerito l'adozione di criteri meno rigidi nella selezione dei donatori, cercando appunto un giusto compromesso tra l'aumentato rischio di disfunzione epatica post-trapianto o di morte del paziente derivante dall'utilizzo tali organi "non ottimali"24 25 26 e la necessità impellente di aumentare il numero dei trapianti eseguiti per soddisfare le liste di attesa.
Inizialmente gli organi da donatore marginale vennero allocati a pazienti gravi, con scarsi risultati in termini di sopravvivenza dell'organo e del paziente; I'allocazione a
26
pazienti più stabili ha tuttavia mostrato risultati soddisfacenti43, tanto che un sempre maggior numero di studi è volto all'ulteriore ampliamento di tali criteri allo scopo di "risolvere" il problema delle liste di attesa.
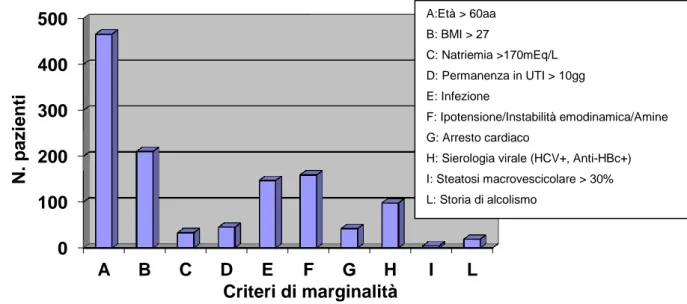
Gli studi condotti allo scopo di definire quali fattori di rischio del donatore contribuiscano
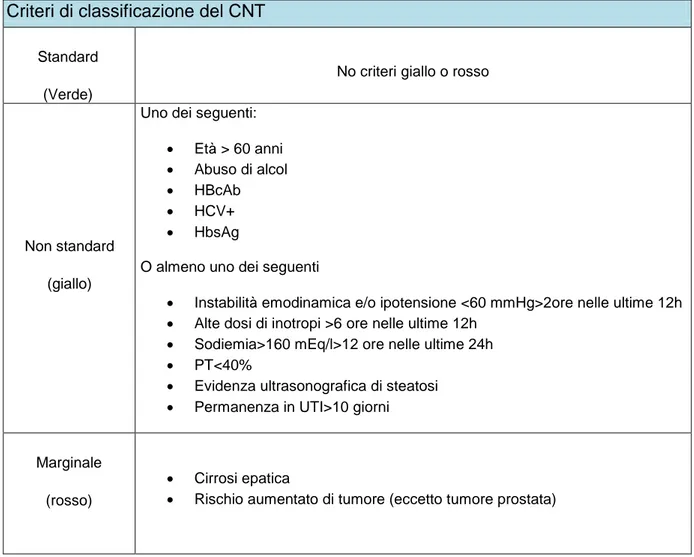
nell’inficiare I'outcome postoperatorio e con che peso relativo, hanno annoverato tra i fattori più rilevanti età, obesità, livelli sierici di sodio, ipotensione prolungata e/o supporto inotropo o vasoattivo, steatosi macrovescicolare, positività HCV o HBc, anamnesi positiva per tumore e/o morte cardiaca; si sono inoltre dimostrati significativamente rilevanti il mismatch di sesso tra donatore e ricevente e la durata dell'ischemia fredda dell'organo espiantato. In base a questi dati e alle singole realtà nazionali, ciascuna organizzazione nazionale trapianti ha stilato linee guida o raccomandazioni per la definizione di donatore "non standard". La classificazione del Centro Nazionale Trapianti (CNT) italiano è mostrata in tabella 6.
Criteri di classificazione del CNT Standard
(Verde)
No criteri giallo o rosso
Non standard (giallo)
Uno dei seguenti: Età > 60 anni Abuso di alcol HBcAb HCV+ HbsAg
O almeno uno dei seguenti
Instabilità emodinamica e/o ipotensione <60 mmHg>2ore nelle ultime 12h Alte dosi di inotropi >6 ore nelle ultime 12h
Sodiemia>160 mEq/l>12 ore nelle ultime 24h PT<40%
Evidenza ultrasonografica di steatosi Permanenza in UTI>10 giorni
Marginale (rosso)
Cirrosi epatica
Rischio aumentato di tumore (eccetto tumore prostata)
27
Età
Nel 1991 solo il 13% dei donatori avevano un'età superiore ai 50 anni, ma già 10 anni più tardi tale percentuale era salita al 30%27. Gli studi non hanno dimostrato differenze significative nell’outcome tra donatori di età superiore ai 50 anni, in assenza di ulteriori fattori di rischio, e donatori più giovani, pertanto l’età non è stata considerata un limite alla donazione28 29 30 31. Tale fenomeno si può spiegare con l’ampia riserva funzionale del fegato, le capacità rigenerative e il duplice apporto ematico che eccede i fabbisogni metabolici32. Tuttavia, sebbene l'età si sia dimostrata fattore non discriminante per la donazione dell' organo, sembra che il fegato di donatori anziani sia più suscettibile alla durata dell'ischemia fredda e abbia una ridotta sintesi di ATP nel periodo post-riperfusione che può ulteriormente diminuire le ridotte capacità rigenerative e la funzione sintetica dell’organo33 34
.
E’ stato osservato che l’utilizzo di fegato da donatore anziano correla con maggior rischio di Primary Non Function e di complicanze post-trapianto quando coesistono i seguenti fattori35 36:
• permanenza del donatore in Unità di Terapia Intensiva superiore a 5 giorni • malnutrizione
• steatosi epatica
• presenza di patologie vascolari da aterosclerosi.
La steatosi, che spesso caratterizza il fegato di donatore anziano, sembra essere il fattore maggiormente predisponente l'organo al danno da ischemia fredda, soprattutto quando questa superi le 8 ore, pertanto in presenza di organo da donatore "anziano" la conservazione dell'organo dovrebbe essere ridotta quanto più possibile46.
Gli studi pubblicati in Letteratura hanno evidenziato un rischio aumentato di ricorrenza del virus epatitico C (HCV) in riceventi fegato da donatore "anziano" e invitano pertanto alla cautela nell'assegnare organi con tale caratteristica a riceventi HCV positivi37 38.
Ipotensione e supporto inotropo
I dati raccolti dalla United Network for Organ Sharing (UNOS) hanno mostrato che l’ipotensione prolungata del donatore non influenza il rischio di perdita d'organo post-trapianto; alcuni Autori, tuttavia, hanno dimostrato un aumento di perdita d'organo qualora al donatore fosse stata somministrata noradrenalina.
28
L'ammina il cui dosaggio si è dimostrato significativamente correlato con I'outcome postoperatorio immediato del ricevente è la dopamina a dosi superiori a 10 y/kg/min. Un'analisi di Cuende e coll.39 su 5150 pazienti ha, inaspettatamente per gli Autori stessi, dimostrato un significativo effetto "protettivo" dell'infusione di noradrenalina sul fegato da trapiantare; tale effetto, presente fino a valori di noradrenalina superiori a 1 y/kg/min, sarebbe dovuto all'azione vasocostrittrice del farmaco, terapeutica nei confronti dell'ipoperfusione splancnica che segue la morte cerebrale.
Compatibilità di gruppo sanguigno (Blood group matching)
La compatibilità di gruppo sanguigno tra donatore e ricevente può essere riassunta in tre categorie: isogruppo, compatibilità e incompatibilità. Il ricorso ad un gruppo non compatibile può essere giustificato in condizioni di emergenza, quando il rischio di mortalità per trapianto non compatibile diventa inferiore al rischio di mortalità derivante dal ritardo per l'attesa di un donatore compatibile. Ovviamente, al rischio di mortalità derivante dal trapianto non compatibile, si aggiunge la mortalità legata alle condizioni di emergenza: confrontando infatti trapianti effettuati in emergenza, la sopravvivenza a 5 anni dei trapianti isogruppo o compatibili è sovrapponibile (48 e 46% rispettivamente) e nettamente superiore a quella dei trapianti non compatibili (24%)40.
Steatosi epatica
La steatosi epatica è un fattore di rischio che spesso si accompagna ad altri come età avanzata, obesità, assunzione di alcol e diabete. La steatosi epatica può essere distinta in micro- e macrovescicolare, a seconda delle dimensioni dei depositi di grasso all'interno dell'epatocita; tale accumulo determina un aumento di volume dell’epatocita stesso che può risultare in una ostruzione parziale o completa dello spazio sinusoidale epatìco41. Il meccanismo per cui la steatosi influenzi la funzionalità epatica post-trapianto non è del tutto noto, ma sembra siano coinvolti alterazioni della microcircolazione e aumento del danno da radicali liberi. Il fegato steatosico è più suscettibile al danno da ischemia-riperfusione: durante l'ischemia il
rigonfiamento dell'epatocita e dei vacuoli adiposi causa
ostruzione dei sinusoidi e alterazioni della microcircolazione e alla riperfusione sono enfatizzate la perdita di cellule endoteliali e l'attivazione di cellule di Kupffer (con
29
conseguente generazione di mediatori dell'infiammazione, come citochine e radicali dell'ossigeno, che danneggiano le cellule endoteliali e l' epatocita).
Studi su animali hanno inoltre dimostrato che fegati steatosici hanno una ridotta capacità di immagazzinare energia durante ischemia fredda e una diminuita capacità di ripristino dei livelli di ATP dopo riperfusione42.
Fattori addizionali che caratterizzano il fegato steatosico e che possono contribuire allo scarso outcome post-trapianto sono la disfunzione delle cellule di Kupffer, l'incremento dell'adesività leucocitaria, la perossidazione lipidica più vigorosa e la necrosi ischemica delle cellule endoteliali43.
E’ stato dimostrato che organi caratterizzati da steatosi in misura superiore al 60% non dovrebbero essere usati a meno dì situazioni d'urgenza nei quali possono rappresentare un ponte in attesa di un nuovo organo44. La steatosi epatica infatti, sopratutto quando superiore al 30%, si associa ad un elevato rischio di primary non function o disfunction, caratterizzata da aumentato rischio di sanguinamento intraoperatorio o da aumento dei valori dì SGOT e diminuita escrezione biliare nei primi 3 giorni postoperatori, condizione reversibile in settimane45 46. L'utilizzo di organi con steatosi uguale e inferiore al 30% non sembra invece essere caratterizzata da differenze significative rispetto all'utilizzo di organi non steatosici; l'utilizzo di tali organi deve comunque essere fatto tenendo conto dei fattori dì rischio aggiuntivi, sia del donatore che del ricevente.
Tempo di ischemia
Il tempo di ischemia è il periodo che intercorre tra il clampaggio della vena porta e la devascolarizzazione del fegato del donatore fino alla riperfusione nel ricevente, ovvero il periodo durante il quale l'organo è privato dell'apporto di sangue e di ossigeno fino al successivo reimpianto nel ricevente. Tale periodo include sia il tempo in cui l'organo, immerso in una apposita soluzione di conservazione, è conservato al freddo (detto tempo di ischemia fredda, Cold Ischemia Time, CIT), sia il tempo di confezionamento delle anastomosi vascolari nel ricevente che precedono la riperfusione, durante il quale l'organo è privato dell'apporto ematico ma si trova a temperatura ambiente (detto tempo di ischemia calda, Warm Ischemia Time, WlT). Scopo primario del CIT è abbassare il metabolismo dell'organo per consentirne la sopravvivenza fino al successivo reimpianto, tuttavia durante questa fase l'organo del donatore attiva un metabolismo di tipo anaerobico con sviluppo di acidosi lattica che si traduce in disfunzioni a livello mitocondriale. Tali alterazioni mitocondriali portano
30
ad un calo dell' ATP e un aumento dei substrati per specie reattive dell'ossigeno, che possono esitare in un potenziamento del danno da ischemia- riperfusione. I danni da prolungato CIT si traducono clinicamente in prolungamento del decorso postoperatorio, danno alle cellule sinusoidali, costrizione delle vie biliari, problemi di ipercoagulabilità e diminuita sopravvivenza dell’organo47 48
.
Sebbene i vari Autori indichino limiti diversi di durata di CIT e WIT, tutti sono concordi nel ritenere tale fattore di rischio variabile indipendente nello sviluppo di danno epatico post-trapianto. I dati dell'ELTR auspicano una durata totale dell'ischemia fredda inferiore a 12 ore per il buon esito del trapianto di fegato49 40.
Tector e coll. suggeriscono di destinare gli organi con un tempo di ischemia fredda superiore alle 12 ore a soggetti giovani, per ridurre lo stress sul sistema cardiovascolare del ricevente, evitando accuratamente i riceventi affetti da cardiopatie50.
Sex mismatch (in congruenza di sesso donatore-ricevente)
Il trapianto d'organo tra sessi diversi si è inizialmente dimostrato associato a diminuita sopravvivenza dell'organo. I dati dimostravano infatti una sopravvivenza media dell'organo a due anni del 55% per un organo da donatore femmina a ricevente maschio, rispetto ai 75% in caso di donatore maschio e ricevente femmina. Se inizialmente si era supposto un semplice "effetto massa" del parenchima, legato cioè esclusivamente all'incongruenza di dimensioni dell'organo del donatore rispetto all'organismo del ricevente, successivamente si è scoperto un meccanismo legato al sistema HLA: trapiantando organi HLA-correlati si è infatti annullato l'effetto del mismatch di sesso51.
Tumori
Il rischio di trasmissione di tumori al momento del trapianto d'organo è monitorizzato fin dal 1968 dal Registro Tumori del Centro Trapianti internazionale Israel Penn; ad oggi, esistono 17 casi documentati di tumore per cui sì è certificata una trasmissione donatore-ricevente52 53.
Nella valutazione del donatore con storia di neoplasia deve essere attentamente valutato l'intervallo libero da malattia; sono considerati tumori fortemente a rischio mammella, colon, polmone, melanoma, tiroide, carcinoma a cellule renali e linfoma. Il rischio di trasmissione dei tumori del SNC è considerato basso, con incidenza
31
similare nei riceventi tra donatori affetti da tumore del SNC e donatori non affetti; fanno eccezione alcune tipologie, come il glioblastoma e il medulloblastoma o i tumori cerebrali per i quali sia stata eseguita una deviazione ventricolo-peritoneale: tali tumori hanno dimostrato un rischio più alto di trasmissione e che devono pertanto essere evitati a meno di condizioni particolari del ricevente che giustifichino il rischio aggiuntivo.
Sierologia virale positiva HCV
Il virus epatitico C è la più frequente causa di malattia epatica terminale e di indicazione al trapianto. La ricorrenza dell'infezione da HCV è un'evenienza che si verifica molto spesso nei pazienti trapiantati e fino al 20% dì tali pazienti sviluppa nuovamente cirrosi a distanza di cinque anni dal trapianto54. Tale ricorrenza dell'infezione sembra addirittura essere più aggressiva di quella che ha portato il paziente in fase terminale, accelerata forse da effetti determinati dall’immunosoppressione o dal particolare stress cui viene sottoposto l'organo durante le fasi del trapianto(ad esempio i tempi di ischemia).
Alcuni studi preliminari hanno analizzato l’outcome di pazienti HCV+
trapiantati con organi HCV+, con risultati accettabili55 56 57 58 59. Sulla base di questi primi risultati, nel 2004 è stata pubblicata un’analisi retrospettiva su più di 10.000 pazienti a cura di Velidedeoglu e coll.60: gli Autori hanno concluso che nel trapianto di fegato da donatore anti-HCV+ in ricevente anti-HCV+, la sopravvivenza di organo e paziente è simile a quella osservata in ricevente anti-HCV+ da donatore anti-HCV-. Analogamente, l’incidenza di ricorrenza di epatite HCV istologicamente confermata in pazienti con pregressa cirrosi HCV che hanno ricevuto un organo da donatore anti-HCV+ è simile a quella dei pazienti che hanno ricevuto un fegato da donatore anti-HCV-. La presenza di infezione da HCV nel ricevente è quindi un fattore predittivo di rischio di malattia epatica nel post-trapianto rispetto a pazienti trapiantati per malattia epatica di eziologia diversa, indipendentemente dalla presenza di anti-HCV positività del donatore.
HBV
La scomparsa dell'antigene di superficie (HBsAg) e la comparsa del relativo anticorpo (antiHBs) viene genericamente intesa come segno di liberazione dal virus e la
32
positività dell’antigene del core virale (HBcAg) risulta essere indice di pregressa infezione da HBV. E' stato dimostrato tuttavia che nonostante la scomparsa dei titoli di antigene e la produzione di anticorpi, l'infezione da HBV può persistere anche a distanza di decenni61. Questa forma di infezione persistente con sierologia negativa, definita infezione HBV occulta, si è dimostrata essere all'origine dei casi di epatite B de novo (ovvero in riceventi mai precedentemente venuti a contatto con il virus B) verificatisi in seguito a trapianto di fegato. Secondo i dati della Letteratura, organi da donatore antiHBc positivo possono trasmettere l 'HBV a riceventi che non sono mai entrati in contatto con tale virus con una frequenza che va dal 38 al 100%62 63 64 65; anche in riceventi anti-HBs positivi, che sembra essere l'anticorpo protettivo nei confronti dell'infezione HlìV, I'epatite de novo si verifica con una frequenza del 17%66. La necessità crescente dì espandere il pool dei donatori, insieme al progresso nelle terapie di profilassi combinata immunoglobuline anti-HBV e lamivudina, hanno portato all'utilizzo pressoché routinario di donatori HBcAc positivi, soprattutto nelle zone in cui l'incidenza della anti-HBc positività è molto alta. La somministrazione di immunoglobuline contro HBV durante la fase anepatica del trapianto e nel postoperatorio, insieme alla lamivudina, hanno reso il trapianto di fegato HBV positivo ben tollerato67: la presenza di HBV DNA nel fegato da trapiantare, valutata mediante PCR (Polymerase Chain Reaction), non sembra avere dunque significato clinico nel predire la ricorrenza del virus68.
HIV
Negli anni Ottanta, prima che il test di screening per I 'HIV divenisse routinario, molti organi trapiantati si dimostrarono contaminati da questo virus. La gran parte di questi pazienti moriva prematuramente, spesso a causa di infezioni opportunistiche, evento che portò a concludere che i soggetti HIV positivi avessero una aspettativa di vita inferiore rispetto ai soggetti HIV negativi69 e che pertanto fosse loro controindicata l' allocazione di un organo da trapiantare.
L'infezione da HIV e l'epatopatia cronica spesso coesistono dal momento che simili sono le vie di contaminazione. Prima dell'avvento delle terapie antiretrovirali, molti pazienti coinfettati morivano per le conseguenze dell' AIDS conclamato prima di sviluppare una chiara epatopatia, oggi, al contrario, grazie a terapie antiretrovirali sempre più efficaci, molti pazienti affetti da HIV progrediscono verso l' epatopatia terminale.
33
L'esperienza di Prachalias e coll.70 su 5 pazienti con infezione già nota al momento del trapianto non mostra significative differenze nell'immediato postoperatorio ma sottolinea la necessità di terapie antivirali (antiepatitiche) più efficaci che impediscano la recidiva della malattia epatica. In maniera del tutto analoga, Gow e Mutimer71 riportano il caso di una donna affetta da HIV e cirrosi HCV correlata, con un buon decorso nell'immediato postoperatorio ma una ricorrenza di infezione da virus C (che gli Autori descrivono come "probabilmente inevitabile") dovuta alla terapia antiretrovirale. I risultati ottenuti su 24 pazienti HIV+ sottoposti a trapianto di fegato hanno portato Ragni e coll.72 ad affermare che la sopravvivenza ad un anno di soggetti HIV+ sia analoga a quella di soggetti HIV-, e che pertanto la positività all'HIV non debba più essere considerata controindicazione
assoluta al trapianto di fegato. Anche nello studio di Ragni e coll. tuttavia i soggetti coinfettati da HCV hanno mostrato una sopravvivenza inferiore, che gli Autori attribuiscono in parte alla carenza di farmaci efficaci contro la ricorrenza dell'HCV. Sugawara e coll.73, in un' ottica di allocazione delle poche risorse disponibili, suggeriscono per questi pazienti con aspettativa di vita più breve per la confezione da HIV il trapianto da vivente.
Ipernatriemia
L'ipernatriemia del donatore si è dimostra fattore di rischio associato a decremento della sopravvivenza dell'organo o del paziente in molti studi. Il meccanismo non è del tutto noto, ma sembra correlato al rigonfiamento dell' epatocita con conseguente esacerbazione del danno da riperfusione.
Gli studi presenti in Letteratura indicano natriemie superiori a 155 mEq/l come associate a maggior sviluppo di complicanze, soprattutto primary non function, tanto più probabile quanto maggiore è stato il tempo di ipernatriemIa74 75.
La semplice correzione dell'ipernatriemia del donatore durante la degenza in ambiente intensivo pre-trapianto mediante utilizzo di vasopressina74 o soluzione glucosata al 5% sembra ridurre l'incidenza di primary non function.
Permanenza in terapia intensiva
Non tutti gli Autori concordano nel ritenere una prolungata permanenza in terapia intensiva del donatore fattore di rischio aggìuntìvo per la donazione d'organo, E,' intuitivo tuttavia, che una prolungata degenza in ambiente intensivo esponga il
34
donatore ad una serie di potenziali pericoli: la necessità prolungata di ventilazione meccanica, di plurimi cateterismi e la nutrizione parenterale rendono il donatore più vulnerabile ad eventuali infezioni nosocomiali (spesso causate da agenti multiresistenti); spesso inoltre, una prolungata degenza in ambiente intensivo sì associa ad una aggressiva gestione emodinamica con farmaci che, come risulta da studi presenti in Letteratura, possano inficiare la qualità dell'organo.
Briceno e collo individuano nella permanenza in UTI > 4 giorni un fattore che aumenta il rischio di ischemia dell'organo trapiantato di ben due volte46.
Infezioni
La prolungata degenza del donatore d'organo nei reparti ospedalieri e/o intensivi aumenta la probabilità dello stesso di sviluppare una positività agli esami colturali; l'esclusione di questi soggetti ridurrebbe peraltro significativamente il pool dei donatori, pertanto alcuni studi hanno indagato specificatamente la correlazione tra positività del donatore agli esami colturali e outcome del ricevente. Gonzàlez-Segura e coll. non hanno riscontrato casi di trasmissione di infezione tra donatore e ricevente: gli Autori attribuiscono un peso importante in parte alla scarsa virulenza dei microrganismi in oggetto e in parte all’elevata sensibilità alla terapia antibiotica76
.
INDICATORI DI QUALITA’
Gli studi volti ad analizzare l'impatto della qualità dell'organo trapiantato sull’outcome postoperatorio del ricevente hanno spesso utilizzato come indicatori di qualità elementi quali i tempi di estubazione postoperatoria, il consumo di emoderivati, il tipo e la gravità di complicanze (epatiche, renali, respiratorie, infettive) e/o l'andamento dei test di laboratorio.
Tempi di estubazione
Il concetto di estubazione precoce (fast tracking); direttamente in sala operatoria o poche ore dopo la fine dell’intervento77
, ha dimostrato da anni di migliorare la qualità delle cure, di ridurre le degenza in terapia intensiva e in ospedale e di ridurre i costi. Il razionale per la prosecuzione nelle 48 ore post-trapianto della ventilazione a pressione positiva sono principalmente la diminuzione dello stress chirurgico e la