SCUOLA DI SPECIALIZZAZIONE IN
EMATOLOGIA
TESI DI SPECIALIZZAZIONE
IL RUOLO DEL T CELL RECEPTOR
NELLE IPEREOSINOFILIE
Candidato: Relatore:
Dr. Elisabetta Sordi Dr. Sara Galimberti
INTRODUZIONE
Le ipereosinofilie comprendono un gruppo eterogeneo di situazioni cliniche che si collocano tra le patologie reumatologiche, infettive, oncologiche ed ematologiche. Nonostante il numero esiguo di casi che si presentano all’attenzione dello specialista, spesso risulta difficile riuscire ad inquadrare correttamente la situazione e soprattutto andare a capire quale sia il primum movens patogenetico. In questa trattazione si andrà a descrivere la fisiopatologia degli eosinofili per poter meglio inquadrare le situazioni cliniche associate ad ipereosinofilia; infine, si illustreranno le conclusioni e le prospettive di uno studio condotto dalle Unità Operative di Reumatologia, Ematologia e Pneumologia su pazienti con Sindrome Ipereosinofila Idiopatica e Sindrome di Churg-Strauss.
I GRANULOCITI EOSINOFILI
Il primo a scoprire l’esistenza dei granulociti eosinofili fu probabilmente Thomas R. Brown alla fine del 19° secolo; tuttavia, il primo a caratterizzare queste cellule fu Paul Ehrlich, che si accorse della specifica affinità tintoriale dei granuli citoplasmatici di un sottogruppo dei leucociti per i coloranti acidi come l’eosina1.
Da questa caratteristica prendono appunto il nome i granulociti eosinofili, o semplicemente eosinofili, una frazione dei leucociti che normalmente costituisce dall’1% al 5-7% del totale, con un valore assoluto compreso tra 0 e 0.7 x 109/L. Al microscopio ottico si
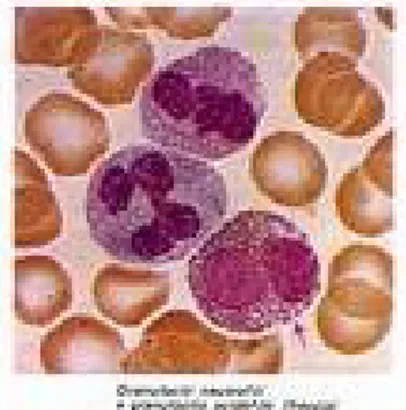
osservano come cellule di 8-10 micron di diametro, mostrano un nucleo generalmente bilobato con cromatina condensata ed un citoplasma chiaro occupato da granuli acidofili che si distinguono in granuli specifici e primari (fig. 1).
Fig. 1: striscio di sangue periferico con due granulociti neutrofili ed un eosinofilo.
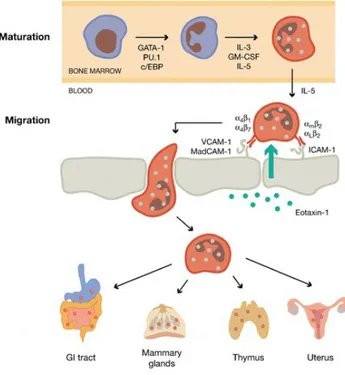
Il processo di eosinofilopoiesi (fig.2) avviene nel midollo osseo; la cellula staminale CD34+ sotto lo stimolo di fattori trascrizionali come GATA1 (appartenente alla categoria delle proteine zinc finger), PU-1 (della famiglia ETS) e c/EBPs (della famiglia dei fattori di trascrizione CCAAT/enhancer binding protein) si differenzia in staminale mieloi-de pluripotente, che dà origine a mieloblasti ibridi e quindi imbocca la via differenziativa eosinofila a seguito della stimolazione da parte di citochine come interleuchina 3 (IL3), interleuchina 5 (IL5) e GM-CSF (fattore stimolante le colonie granulocitarie e macrofagiche); il ruolo principale per la differenziazione e maturazione eosinofila spetta a IL52.
Al termine del processo di differenziazione, è ancora IL5 a promuovere la mobilizzazione degli eosinofili maturi attraverso una riduzione dell’espressione della beta2-integrina di membrana; l’emivita delle cellule circolanti è di circa 8-18 ore, ma solo una piccola quota delle cellule mature rimane in circolo, mentre la maggior parte va a localizzarsi nei tessuti. Il meccanismo principale per l’homing degli eosinofili è legato all’iperespressione di molecole di adesione come VCAM-1 (molecola di adesione dell’endotelio vascolare) e di chemochine note come eotassine, la cui espressione è aumentata da interleuchina 4 (IL4) e interleuchina 13 (IL13)1.
Una delle sedi dove avviene la migrazione degli eosinofili è il timo, dove queste cellule migrano durante il periodo neonatale; è stato ipotizzato che a questo livello svolgano un ruolo regolatorio promuovendo l’apoptosi dei timociti.
Per quanto riguarda la chemiotassi degli eosinofili negli altri organi, hanno un ruolo importante diverse molecole, come il fattore di attivazione piastrinica, fattori del complemento, mediatori infammatori come i leucotrieni. I principali tessuti in cui si localizzano gli eosinofili sono illustrati nella figura 3: milza, linfonodi, timo, ma anche mucosa del tratto gastrointestinale e delle vie respiratorie1.
Figura 3: Maturazione e migrazione degli eosinofili.
I granuli specifici presenti nel citoplasma degli eosinofili contengono proteine cationiche che sono responsabili delle tipiche caratteristiche tintoriali, come la proteina cationica degli eosinofili (ECP), la perossidasi eosinofila (EPO), la neurotossina derivata dagli eosinofili (EDN) e la proteina basica maggiore (MBP), mentre i granuli primari sono analoghi agli altri granulociti con cristalli di Charcot-Leyden3.
La MBP è una piccola proteina basica presente in due omologhi; la forma MBP1 si trova anche nei granulociti basofili, mentre la forma MBP2 è specifica soltanto degli eosinofili; tale proteina viene sintetizzata durante una fase precoce della maturazione dell’eosinofilo, che una volta maturato perde la capacità trascrizionale dell’mRNA specifico. Il ruolo di questa proteina è esplicato nel controllo delle infezioni elmintiche, ma è stato dimostrato un ruolo anche nella patogenesi del danno tissutale durante l’asma legato ad alterazioni della permeabilità di membrana.
La ECP è una proteina ad attività ribonucleasica con un profilo di tossicità legato alla formazione di pori nella membrana dei parassiti, mentre la EDN ha attività ribonucleasica ma svolge un ruolo nel controllo delle infezioni prevalentemente virali a carico dell’apparato respiratorio.
La EPO ha attività battericida mediata dalla formazione di specie reattive dell’ossigeno ed ha una struttura molto simile a quella della mieloperossidasi presente nei granulociti neutrofili, suggerendo una comune origine e quindi anche una comune funzione nella difesa da patogeni esterni.
Inoltre, nel citoplasma sono presenti vescicole contenenti varie chemochine e citochine (come IL2, IL4, IL5, IL11, IL13) che vengono prodotte e immagazzinate nei granuli secretori e quindi rilasciate a seconda della stimolazione ricevuta, contribuendo così alla ulteriore chemiotassi di eosinofili, alla regolazione della cascata infiammatoria e della permeabilità vascolare. Tra i vari mediatori prodotti dagli eosinofili si trovano anche fosfolipasi, metalloproteasi, catalasi ed altri mediatori ad attività prevalentemente enzimatica3.
All’interno dei corpi lipidici citoplasmatici, infine, gli eosinofili sono in grado di produrre derivati lipidici come il leucotriene C4 e le prostaglandine, che contribuiscono alla regolazione del tono vascolare periferico e della muscolatura bronchiale.
Le diverse funzioni che possono essere esplicate dagli eosinofili rendono ragione della varietà di differenti stimolazioni che tali cellule possono riconoscere; pertanto, sulla membrana plasmatica degli eosinofili sono presenti numerosi recettori che si attivano al legame con differenti molecole.
Si va dai recettori per il frammento Fc delle immunoglobuline IgG e IgA, comprese le IgA secretorie, che comportano l’attivazione eosinofila a partenza dalla stimolazione del sistema immunitario, fino ai recettori CCR1 e CCR3 che legando le rispettive chemochine
contribuiscono alla migrazione cellulare mediata da stimoli infiammatori e chemiotattici. Gli eosinofili legano inoltre le interleuchine responsabili del processo di maturazione in senso eosinofilo, come IL3, IL5 e GM-CSF, e altre citochine coinvolte nella chemiotassi e nella regolazione dell’espressione dei vari recettori sulla superficie cellulare come IL4 e TNF alfa 1, 3.
Le caratteristiche chemiotattiche degli eosinofili non possono prescindere dal legame con molecole di adesione vascolare, come selectine ed integrine che interagiscono con recettori sull’endotelio vascolare. Inoltre, in quanto cellule attivate dai processi infiammatori, gli eosinofili mostrano recettori per prostaglandine e leucotrieni.
Altro ruolo riconosciuto per gli eosinofili è quello di cellule presentanti l’antigene (APC).
A seguito dell’interazione con le varie molecole, gli eosinofili vanno incontro a degranulazione e ad incremento della sintesi dei mediatori derivati dall’acido arachidonico nei corpi lipidici citoplasmatici, partecipando così attivamente al processo infiammatorio. Il rilascio di IL5 ha anche come ulteriore effetto l’incremento della mobilizzazione degli eosinofili maturi dal comparto midollare.
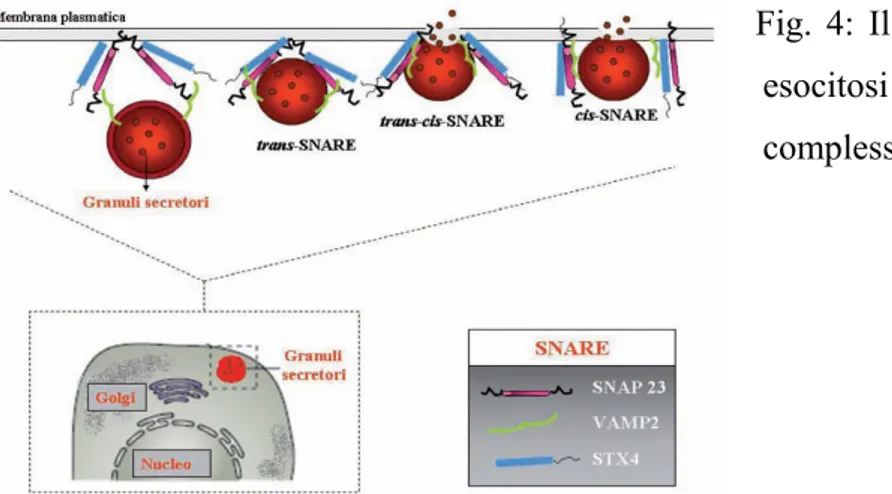
La funzione della degranulazione viene svolta mediante il complesso SNARE (Soluble-N-ethylmaleimide-sensitive-factor Accessory-Protein –SNAP- Receptor) che è essenziale per la fusione delle vescicole dei granuli con la membrana cellulare. Come si osserva nella figura 4, il complesso sulla superficie interna della membrana plasmatica presenta una configurazione trans che viene modificata in cis consentendo la fusione con la membrana dei granuli e la degranulazione all’esterno2.
Fig. 4: Il processo di esocitosi mediato dal complesso SNARE.
Con la degranulazione si ha il rilascio dei mediatori preformati contenuti nei granuli; il rilascio delle citochine, chemochine e degli altri mediatori proinfiammatori risulta inferiore da un punto di vista quantitativo per gli eosinofili che per altri tipi cellulari, per cui svolge probabilmente soltanto un ruolo adiuvante e di regolazione rispetto agli altri leucociti e tipi cellulari coinvolti nei processi infiammatori e nella difesa delle infezioni. Probabilmente il compito degli eosinofili è il rilascio di tali molecole in tempi molto più rapidi rispetto alla sintesi necessaria perché queste molecole vengano rilasciate da parte delle altre cellule coinvolte nel processo infiammatorio come ad esempio i linfociti T.
IPEREOSINOFILIA E SINDROMI IPEREOSINOFILE
Per ipereosinofilia si intende un aumento della quota eosinofila nel sangue periferico; in conseguenza del ruolo che queste cellule svolgono nel controllo delle infezioni e nell’immunità, si può verificare tale incremento secondariamente a diverse condizioni come infezioni parassitarie, utilizzo di farmaci, malattie allergiche o reumatologiche come le vasculiti, neoplasie ematologiche e non.
Si può iniziare a parlare di ipereosinofilia lieve per eosinofili superiori a 0.5 x109/L, ma comunemente il termine viene utilizzato
per indicare una conta eosinofila superiore a 1.5 x109/L, che
corrisponde al livello in grado di determinare danni tissutali e d’organo4.
In realtà non è possibile definire con esattezza quale sia la soglia nel sangue periferico che comporti il rischio di danno d’organo, perché la conta eosinofila circolante è solo in parte indicativa della concentrazione a livello dei singoli organi e tessuti1,
proprio in virtù delle specifiche caratteristiche di distribuzione tissutale degli eosinofili. Infatti, è possibile osservare dei quadri di danno istologico anche in assenza di elevati livelli circolanti di eosinofili. Le principali localizzazioni importanti per il danno d’organo includono la cute, i polmoni, il tratto gastrointestinale, il sistema nervoso centrale o periferico e il cuore.
Nella maggior parte dei casi, l’ipereosinofilia risulta policlonale, conseguente ad una stimolazione citochinica mediata da IL5 prodotta da linfociti T helper CD4+; lo stimolo iniziale che determina l’attivazione linfocitaria TH2 può essere un’infezione (parassitaria, elmintica prevalentemente ma anche batterica) oppure l’esposizione ad allergeni; in questo caso l’ipereosinofilia che si osserva risulta secondaria al processo infettivo/allergico primitivo. Stesso meccanismo mediato da IL5 è stato osservato anche per forme di ipereosinofilia legate a reazioni avverse a farmaci.
Altre cause di forme secondarie includono le malattie reumatologiche e le neoplasie, sia solide che ematologiche, come le neoplasie linfoproliferative (linfomi di Hodgkin e non-Hodgkin).
In una piccola parte dei casi, la popolazione eosinofila è primitivamente clonale: si tratta di patologie mieloproliferative che originano da una mutazione nella cellula staminale; i quadri di ipereosinofilia isolata vengono classificati come leucemie eosinofiliche croniche (CEL, Chronic eosinophilic Leucemia) o acute a seconda delle caratteristiche cliniche e della presenza di una adeguata quota blastica midollare, ma si può osservare anche una ipereosinofilia come risultato dello stimolo proliferativo in corso di altre forme mieloproliferative croniche come Leucemia Mieloide Cronica, Mastocitosi, Leucemia Mielomonocitica Cronica.
Nel momento in cui vengano escluse tutte le possibili forme di ipereosinofilia primitiva e secondaria, il quadro viene definito come Ipereosinofilia idiopatica.
Il termine Sindrome Ipereosinofila (Hypereosinophilic Sindrome, HES) comprende una condizione di ipereosinofilia idiopatica che risponde ai criteri stabiliti da Chusid nel 1975, ovvero che presenta valori di eosinofili superiori a 1.5 x109/L persistenti per
oltre 6 mesi accompagnati da danno d’organo eosinofilia-relato in assenza di altre cause che possano giustificare l’ipereosinofilia5.
La classificazione delle HES e delle ipereosinofilie è tuttora motivo di controversie, perché l’esatta collocazione delle entità nosologiche dovrebbe prevedere una corretta conoscenza di tutti i meccanismi patogenetici coinvolti e, in modo particolare, del primo stimolo proliferativo che porta alla determinazione del quadro.
Ad esempio, alcuni Autori riconoscono come entità distinte all’interno delle HES le forme M-HES e L-HES, ovvero varianti mieloproliferativa e linfocitica all’interno delle ipereosinofilie idiopatiche.
In realtà, queste due varianti sono probabilmente da considerare in modo differente, come suggerito da altri Autori; in
particolare, la variante L-HES riconosce già nella definizione l’esistenza di un clone linfocitico T che sostiene la proliferazione eosinofila attraverso una iperproduzione di IL5; altri autori, proprio per questo ruolo eziologico del clone linfocitario, parlano più correttamente di ipereosinofilia variante linfocitica.
Inoltre la variante mieloproliferativa costituisce una patologia chiaramente definibile, caratterizzata da splenomegalia, incremento della vitamina B12, infiltrato midollare eosinofilo, che può essere accompagnata dalla presenza di uno dei riarrangiamenti a carico del gene PDGFRbeta (platelet-derived growth factor receptor beta) sul cromosoma 5q33, del gene FGFR1 (fibroblastic growth factor receptor1) sul cromosoma 8p11, oppure da una delezione sul cromosoma 4q12 che porta al gene di fusione FIP1L1-PDGFRalfa (FIP1 like1- platelet-derived growth factor receptor alfa); questa situazione clinica può a tutti gli effetti essere considerata una patologia clonale eosinofila all’interno delle malattie mieloproliferative croniche (fig.5)6.
Fig.5: il gene di fusione PDGFRalfa/FIP1L1
I riarrangiamenti che coinvolgono i geni PDGFRalfa e beta portano alla formazione di proteine con attività tirosin kinasica che determinano un’attivazione costitutiva di vie di segnalazione
intracellulare tra cui la via di MAP chinasi, fosfatidilinositolo trifosfato e PKC gamma che sostengono la proliferazione cellulare.
Sono inoltre riportate in letteratura delle forme familiari, alcune delle quali caratterizzate da riarrangiamento a carico della regione 5q33 che coinvolge il gene PDGFRbeta e per le quali sono stati identificati specifici meccanismi di trasmissione autosomica7.
Nella complessità di dover dare una organizzazione a tutte queste forme di ipereosinofilia, la classificazione WHO del 2008 riconosce tra le neoplasie mieloidi l’esistenza della Leucemia Eosinofilica Cronica non altrimenti specificata (CEL-NOS) e di altre forme di neoplasie linfoidi e mieloidi con questi specifici riarrangiamenti come entità a sé stanti8. La parte classificativa
relativa alle ipereosinofilie è riportata nella tabella 1.
Tabella 1 La classificazione World Health Organization delle neoplasie ematologi-che (versione specifica delle forme mieloproliferative)
myeloproliferative neoplasms
chronic myelogenous leukemia, BCR-ABL1-positive chronic neutrophilic leukemia
polycythemia vera primary myelofibrosis essential thrombocythemia
chronic eosinophilic leukemia not otherwise specified/hypereosinophilic syndrome mastocytosis
myeloproliferative neoplasms, unclassifiable
myeloid and lymphoid neoplasms associated with eosinophilia and genetic abnormalities
myeloid and lymphoid neoplasms associated with PDGFRA rearrangement myeloid neoplasms associated with PDGFRB rearrangement
myeloid and lymphoid neoplasms associated with FGFR1 abnormalities
Stone ed altri Autori3 propongono una classificazione delle
HES che comprende 6 gruppi: 1) variante mieloproliferativa inclusa FIP1l1/PDGFR alfa positiva e CEL; 2) variante linfocitica; 3) forma familiare; 4) forme non meglio definite; 5) forme di interessamento d’organo esclusivo come la polmonite o la gastroenterite eosinofila e 6) la forma associata ad altre patologie infettive e reumatologiche come la Sindrome di Churg-Strauss. In questa classificazione, in realtà, tutte le forme di ipereosinofilia vengono considerate come
forme idiopatiche, anche quelle in cui è in effetti riconosciuta una secondarietà ad altre patologie come le forme associate a patologie reumatologiche.
Tefferi ed altri Autori, invece, propongono un algoritmo diagnostico simile per le ipereosinofilie, riconoscendo però più correttamente come HES solo le condizioni in cui sia stata esclusa sia una clonalità T, che vengono classificate come ipereosinofilie con variante linfocitica, sia la presenza di riarrangiamenti a carico dei geni per il recettore PDGFR alfa e beta o per il gene FGFR. In questa proposta di iter diagnostico vengono inoltre escluse le patologie mieloproliferative croniche che possono accompagnarsi ad ipereosinofilia clonale (LMC, LMMC, mastocitosi sistemica) e la stessa CEL-NOS, definibile come una condizione di proliferazione midollare suggestiva di neoplasia mieloide senza caratteristiche ulteriormente definibili accompagnata da ipereosinofilia periferica. Alla fine di questo processo di esclusione si possono identificare i casi realmente inquadrabili come HES4.
In alcuni studi recenti, la dizione HES è stata sostituita dalla dizione CIH, acronimo di Chronic Idiopathic Hypereosinophilia, confermando lo scarso accordo internazionale sulla classificazione di questa patologia.
TRATTAMENTO DELLE IPEREOSINOFILIE
Anche a causa delle differenti proposte classificative, la determinazione dell’esatta causa di ipereosinofilia in un paziente in realtà nella pratica clinica è spesso difficile, ma bisogna considerare che dal punto di vista terapeutico queste forme spesso non differiscono né nei criteri per iniziare un trattamento né nella tipologia del trattamento stesso.
Infatti, in tutti gli studi e le reviews che vengono dedicate all’argomento, viene evidenziata la necessità di iniziare un trattamento solo per una quota di eosinofili circolanti superiore a 1.5 x109/L. In considerazione però delle caratteristiche di affinità
tissutale degli eosinofili e del fatto che elevate concentrazioni di eosinofili a livello d’organo si possono ritrovare anche con livelli sierici normali, va considerato l’aspetto di danno d’organo che può indurre da solo ad iniziare un trattamento.
Ovviamente, nelle forme secondarie il trattamento non può prescindere dalla rimozione, se possibile, o dal controllo della noxa patogena principale, vale a dire dalla terapia specifica dell’infezione, o della neoplasia, o della patologia autoimmunitaria coinvolta nella patogenesi della ipereosinofilia.
Per quanto riguarda le opzioni terapeutiche a disposizione, sicuramente gli steroidi giocano un ruolo fondamentale come trattamento di prima linea; storicamente fin dagli anni ’50 sono stati impiegati nel trattamento delle forme di ipereosinofilia per i diversi effetti terapeutici che sono stati dimostrati e studiati.
Infatti è stato dimostrato che gli steroidi riducono la conta eosinofilica periferica9, 10, 11; 12, 13, 14, 15, 16, 17, 18; riducono il reclutamento
a livello dei tessuti a seguito della stimolazione antigenica, così come riducono la conta eosinofila riscontrabile nel lavaggio broncoalveolare e nelle mucose delle vie aeree 19, 20, 21, 22, 23, 24, 25, 26, 11, 27, 28, 29, 30, 31; aiutano nel controllo dei sintomi correlati all’asma e
alle altre localizzazioni d’organo mediante un blocco della degranulazione 32, 33, 34, 35 .
L’effetto degli steroidi sembra prevalentemente mediato dall’inibizione del corredo citochinico che determina la differenziazione e il reclutamento degli eosinofili da parte dei tessuti, anche se è stata dimostrata una attivazione dell’apoptosi direttamente mediata dagli steroidi 36, 37, 38, 39.
Il trattamento con steroidi è maneggevole e di buona efficacia e garantisce una risposta (completa o parziale) nell’80-85% dei pazienti trattati 40, soprattutto nelle fasi di acuzie della malattia; le
complicanze in genere derivano dalla presenza di svariati effetti collaterali conseguenti ad una terapia continuativa per diverso tempo che comprendono osteopenia ed osteoporosi, aumento della suscettibilità ad infezioni, interferenze con la produzione di ormoni corticosurrenalici.
Quando si verifica una condizione di non risposta e di persistenza della sintomatologia, la seconda linea terapeutica prevede l’utilizzo di farmaci citotossici, come Idrossiurea, oppure farmaci immunomodulanti come Interferone o ancora immunosoppressori come Ciclosporina A.
Il razionale dell’utilizzo dei farmaci citotossici sta nell’effetto generale di citoriduzione che si applica anche alla popolazione eosinofila; il profilo di attività non selettivo però costituisce anche la principale limitazione di questo trattamento che comporta effetti collaterali importanti quali alopecia, mielosoppressione con neutropenia, anemia, piastrinopenia, aumentata suscettibilità alle infezioni, possibile interferenza con la funzione renale ed epatica e soprattutto rischi di possibili effetti oncogenetici specialmente per trattamenti a lungo termine oppure su pazienti giovani. Accanto ai citotossici classici come Idrossiurea e Ciclofosfamide, sono stati segnalati anche casi di utilizzo di Citarabina e 2-cloro-desossiadenosina con tassi di risposta completa del 55% a fronte di una tossicità infettiva durante la neutropenia del 28% 41.
I farmaci immunomodulanti ed immunosoppressori, invece, hanno un razionale simile alla terapia steroidea, andando ad interferire con i meccanismi di promozione della proliferazione eosinofila mediata dagli altri tipi cellulari, in particolare dai linfociti T; inoltre, alcune analogie nella traduzione del segnale tra linfociti T ed eosinofili hanno fatto ipotizzare che ci sia anche un effetto diretto sugli eosinofili 42, 43, 44.
Interferone alfa 2b (INF alfa) è stato utilizzato per gestire quadri di ipereosinofilia non responsiva a steroidi ed ha dimostrato di poter ottenere buone risposte, a fronte però di un profilo di tossicità (principalmente effetti sistemici quali iperpiressia, dolori diffusi simil-influenzali, ma anche mielosoppressione) che può anche limitarne il dosaggio o l’intero trattamento.
Ciclosporina A (CSA), che fa parte della classe farmacologica degli inibitori della calcineurina, ha dimostrato di interferire sia dal punto di vista funzionale sugli eosinofili, attraverso una riduzione della ECP 45, sia sulla conta cellulare vera e propria 46. In ogni caso,
la terapia immunosoppressiva presenta effetti collaterali notevoli, in termini di alterazione della funzione renale ed epatica, interferenza con altri farmaci, aumentato rischio infettivo anche a lungo termine e rischio di promozione di seconde neoplasie, per cui attualmente viene considerata solo dopo fallimento delle altre linee.
Lo studio multicentrico già citato di Ogbogu ed altri autori 40
ha raccolto 188 pazienti affetti da HES trattati con diverse terapie: in quella grande casistica i tassi di risposta completa e parziale alla te-rapia di un mese con Idrossiurea sono del 72%, mentre per Interfero-ne alfa si registra una risposta globale del 50% e per ciclosporina A del 60%. I dati relativi alla tossicità del trattamento confermano la necessità di interrompere la terapia nel 40% dei pazienti trattati con Idrossiurea; tale dato sale al 50% nei pazienti trattati con Interferone e addirittura all’82% dei pazienti trattati con Ciclosporina.
Jabbour nel 2007 47 ha utilizzato il trattamento con interferone
ri-dotta clearance e quindi ad effetto prolungato nei pazienti con malat-tie mieloproliferative croniche e con HES, con tassi di risposta del 25% (1 paziente su 4 trattati) nelle HES; il trattamento ha però pre-sentato tassi di effetti collaterali comparabili con la terapia tradizio-nale con Interferone.
In particolare, circa il 50% dei pazienti ha dovuto ridurre il do-saggio e il 26% ha interrotto il trattamento per la presenza di eventi collaterali quali fatigue, trombocitopenia, dolori diffusi e astenia.
Altri trattamenti segnalati in letteratura comprendono Metotrexate ed Immunoglobuline ad alto dosaggio, oppure l’anticorpo monoclonale anti-CD52, antigene espresso su linfociti B e T che può essere utilizzato soprattutto nei casi che presentano una clonalità T linfocitaria.
Nei casi infine che dimostrano refrattarietà a tutti i trattamenti utilizzati, rimane la possibilità del trapianto midollare allogenico, procedura che però comporta l’utilizzo di chemioterapia ad alte dosi con rischi elevati di mortalità e di effetti collaterali a breve e lungo termine; proprio per la complessità della procedura e per i rischi elevati tale opzione costituisce l’ultimo tentativo terapeutico a disposizione, anche se negli ultimi anni si sono messi a punto dei protocolli terapeutici a ridotta tossicità con trapianto di tipo non-mieloablativo 48.
Se questi trattamenti sono utilizzati sostanzialmente già da decine di anni a questa parte, i recenti progressi nella caratterizzazione delle sindromi ipereosinofile hanno permesso di ipotizzare un razionale di utilizzo anche di altri farmaci; per esempio, è stato messo a punto un anticorpo monoclonale anti-IL5, considerando proprio il ruolo fondamentale che questa citochina svolge nella proliferazione e differenziazione in senso eosinofilo. Gli studi di fase 3 hanno dimostrato il raggiungimento della riduzione della conta eosinofila nel 95% dei pazienti trattati, ed una riduzione della necessità di terapia steroidea in circa l'85% dei
pazienti trattati 49; inoltre, il profilo di tossicità sembra essere molto
ben tollerabile.
Un’altra innovazione terapeutica di grande importanza che è stata introdotta negli ultimi anni parte dal riscontro dell’associazione di alcune forme di ipereosinofilia con la presenza del riarrangiamento PDGFRalfa/FIP1L1, che determina la produzione di una proteina di fusione con attività tirosin-chinasica; questo ha suggerito la possibilità di utilizzare farmaci con attività inibitoria sulle tirosin-chinasi, come ad esempio Imatinib, che è stato sviluppato specificamente per inibire la tirosin-chinasi BCR/ABL tipica della Leucemia Mieloide Cronica, ma che nel tempo ha dimostrato di avere un profilo di attività anche su altre proteine con attività chinasica, come ad esempio c-kit e soprattutto il PDGFR sia alfa che beta.
In realtà il primo caso di paziente con HES resistente al trattamento e responsivo ad Imatinib è stato descritto nel 2001 da Schaller ed altri 50, mentre la documentazione del riarrangiamento
PDGFRalfa/FIP1L1 è stata solo del 2003 51.
Dopo i primi casi episodici trattati con questa terapia 52, 53, a
seguito della dimostrazione di efficacia sono stati disegnati studi specifici 54; i dati ottenuti da queste valutazioni hanno permesso di
aggiungere tra le indicazioni del farmaco sia le malattie mieloproliferative con riarrangiamenti del gene PDGFRbeta sia nelle forme di HES con PDGFRalfa/FIP1L1.
Imatinib, oltre alla documentata efficacia che lo pone di fatto tra le terapie di scelta nelle forme di ipereosinofilia che presentano riarrangiamento del PDGFR alfa o beta, risponde anche alle caratteristiche della terapia ideale: infatti ha un profilo di tossicità molto limitato, specialmente se confrontato con le altre opzioni terapeutiche. Inoltre, la posologia ideale del trattamento è ancora in fase di definizione e, almeno in alcuni studi, sembra che possa essere efficace anche un dosaggio estremamente basso (100 mg/die) che comporta anche ridottissimi effetti collaterali.
Per quanto riguarda i dati di efficacia, si ottiene una risposta completa o parziale nell’88% dei pazienti con riarrangiamento PDGFRalfa/FIP1L1, mentre nelle forme negative tale percentuale scende al 23% 40.
Proprio per l’importanza di questa scelta terapeutica, attualmente nei protocolli diagnostici della HES è fondamentale la valutazione almeno del riarrangiamento PDGFRalfa/FIP1L1.
STUDIO COOPERATIVO UO EMATOLOGIA-REUMATOLOGIA-PNEUMOLOGIA DELL' AZIENDA OSPEDALIERA UNIVERSITARIA PISANA
Proprio per quanto premesso fino a questo punto, appare chiaro come il campo delle ipereosinofilie possa ancora offrire spazi da esplorare specialmente per quanto riguarda alcuni aspetti classificativi e di conseguenza terapeutici.
Le ipereosinofilie si pongono come patologie eclettiche, che possono interessare svariati organi ed apparati, e che quindi non sempre possono giungere in prima osservazione dallo specialista di riferimento; un altro aspetto interessante da valutare è il fatto che spesso risulta difficile anche solo comprendere quale sia il primum movens patogenetico e quindi può risultare complesso anche l’indirizzo del paziente alla terapia per lui più indicata.
Proprio per questa sovrapposizione e per cercare di chiarire criteri diagnostici, classificativi ed opzioni terapeutiche è stato programmato questo studio interessante le Unità Operative di Ematologia, Reumatologia e Pneumologia.
Lo studio prevedeva il reclutamento di pazienti giunti alla osservazione delle UO di Reumatologia e di Ematologia a seguito del riscontro di ipereosinofilia e in cui fossero state diagnosticate una HES oppure una Sindrome di Churg-Strauss (CSS).
Questa patologia fa parte del nutrito gruppo di malattie reumatologiche che presentano una ipereosinofilia di accompagnamento al quadro principale; la Sindrome è caratterizzata sostanzialmente da un corteo di sintomi che comprendono asma, vasculite necrotizzante eosinofila, positività degli anticorpi anti-citoplasma dei neutrofili (ANCA), ipereosinofilia con possibilità di infiltrazione d’organo.
La presentazione clinica della CSS è molto variegata: generalmente l’asma è presente in quasi la totalità dei pazienti, così come spesso è presente una vasculite necrotizzante dei vasi di
piccola e media taglia su base eosinofila documentabile alla biopsia vascolare, mentre la positività degli anticorpi anti-citoplasma dei neutrofili (ANCA-MPO, reattivi alla mieloperossidasi contenuta nei granuli dei neutrofili) è presente solo in alcuni pazienti e, quando è presente, contribuisce alla diagnosi. Possono essere presenti infiltrazioni di vari organi (polmone, cute, SNC, rene, ecc) che vengono documentate istologicamente.
La patogenesi della CSS è ancora da definire in alcuni suoi aspetti; probabilmente sono riconoscibili tre fasi successive: una prima condizione di sintomatologia aspecifica come asma, rinite, che costituiscono i prodromi della fase propriamente infiltrativa dei vari apparati (respiratorio, digerente, urinario) per poi progredire nella fase vasculitica vera e propria 55.
Come già accennato, gli ANCA-MPO sono positivi solo in una parte dei pazienti, circa il 35-40%; pertanto, anche il ruolo patogenetico che ricoprono queste cellule nella CSS è lontano dall’essere chiarito; quando sono presenti, contribuiscono al danno endoteliale mediato dall’attivazione dei neutrofili, ma è invece molto più chiara la partecipazione degli eosinofili, che sono elevati nella maggioranza dei pazienti nelle fasi di attività di malattia e che determinano il danno d’organo mediante l’infiltrazione dei tessuti e dei vasi e il rilascio dei mediatori presenti nei granuli.
Di fatto, la CSS può essere considerata come una patologia che si colloca a metà tra le vasculiti classicamente ANCA-associate e la vasculite da HES, mediata dagli eosinofili; proprio per questo ruolo degli eosinofili in realtà la CSS può essere vista come un’omologa della HES; se in alcuni pazienti la presenza dei caratteristici anticorpi ANCA-MPO oppure la diagnosi istologica di vasculite necrotizzante possono aiutare nell’identificazione del quadro come CSS, quando queste manifestazioni sono assenti oppure sfumate la diagnosi differenziale può essere estremamente complessa.
Nel tempo sono stati proposti diversi sistemi classificativi per cercare di identificare i singoli casi come HES o come CSS; la tabella 2 mostra a confronto i criteri per le due patologie.
Tab 2: criteri classificativi di CSS ed HES. CSS (Criteri American
College of Reumathology 1990)
HES (Criteri di Chusid 1975) Asma Eosinofilia>10% o >1.500/ mm3 Eosinofilia tissutale Mono or polineuropatia Infiltrati polmonari fugaci Sinusopatia Eosinofilia >1.500/ mm3 Danno d’organo da eosinofili Esclusione di forme secondarie
Come si può osservare, la CSS presenta molte possibili localizzazioni specifiche che possono aiutare nella diagnosi; occorre però considerare che come per tutte le patologie autoimmuni, non tutti i criteri sono presenti in tutti i pazienti e soprattutto, al momento dell’osservazione alcuni criteri chiave possono essere mancanti.
Anche la presenza degli eosinofili, che costituisce il punto di contatto tra le due forme, in realtà avrebbe basi ben diverse, stando alle conoscenze attuali; nella CSS, come in altre patologie autoimmunitarie, l’aumento degli eosinofili periferici sarebbe mediato da una ridotta apoptosi legata all’alterazione del segnale tra Fas e Fas-ligand 56. Per questo motivo, la CSS viene presa come
esempio di una patologia che presenta l’ipereosinofilia come forma secondaria al processo patogenetico principale, per quanto siano ancora da chiarire gli esatti meccanismi patogenetici.
Proprio per contribuire allo studio di queste due patologie e per dare un contributo in termini diagnostici è stato disegnato questo studio.
MATERIALI E METODI
Lo studio si è svolto in un periodo di tempo compreso tra il gennaio 2010 e l’aprile 2011; i pazienti affetti da HES e CSS sono stati scelti tra la casistica di pazienti afferiti alla UO di Reumatologia o di Ematologia negli anni precedenti e sono stati reclutati su base volontaria; sono stati sottoposti ad una serie di esami ematochimici comprendenti emocromo con valutazione della formula leucocitaria, valutazione della funzionalità renale ed epatica, proteine totali con protidogramma, valutazione degli indici flogistici (VES, PCR, beta2 microglobulina), ma anche dosaggio di IL2, IL4, IL5, proteina cationica degli eosinofili, ANCA-MPO, fattore reumatoide, anticorpi anti-nucleo.
Tutti gli esami sono stati eseguiti dal Laboratorio Centrale dell’AOUP secondo le metodiche standardizzate per ciascun dosaggio.
Inoltre, per ogni paziente sono stati valutati i sintomi presenti al momento della diagnosi di malattia e al momento dell’arruolamento nello studio con particolare riferimento ai sintomi specifici per le due patologie.
I pazienti sono stati valutati per la presenza della clonalità del riarrangiamento del T cell-receptor (TCR) γ/δ su sangue periferico mediante una PCR (polymerase chain reaction) qualitativa seguita da una elettroforesi capillare su sequenziatore automatico. Dopo una selezione della popolazione linfocitaria mediante separazione su gradiente e successiva estrazione del DNA linfocitario è stata eseguita una amplificazione utilizzando la polimerasi HotStarTaqMasterMix 2X (Qiagen) per 35 cicli di amplificazione; al termine di questo processo i prodotti sono stati caricati su ABIPRISM 3100 per l'analisi dei frammenti su elettroforesi capillare e quindi sono stati mescolati ad un fluorocromo ROX 500 (AppliedBiosystems) e denaturati per rendere possibile il
riconoscimento di ogni singolo segnale fluorescente e quindi l’identificazione della presenza di una clonalità del TCR.
Sui pazienti affetti da HES è stata inoltre eseguita una ricerca retrospettiva dei dati del riarrangiamento TCR su sangue midollare per valutare la concordanza con i dati ottenuti su sangue periferico; inoltre, su un ridotto campione di pazienti è stato anche eseguito uno studio immunofenotipico su sangue periferico per ricercare la clonalità T con un test multiparametrico a 7 colori (BD-FACSCanto II) utilizzando anticorpi monoclonali CD5 FITC, CD2 PE, CD3 PerCP, CD4 PE-Cy7, CD56 APC , CD45 APC-Cy7, CD7 PE, CD 19 PE-Cy7, CD8 APC-Cy-7, CD45 AmCyan, CD4 FITC (BD).
Sul versante degli esami strumentali, per i pazienti con una storia di asma è stata eseguita anche una valutazione completa presso la UO Pneumologia con spirometria, dosaggio degli eosinofili e della ECP su espettorato; per gli altri pazienti è stata eseguita una radiografia del torace per documentare eventuali infiltrati polmonari ed una ecografia addome per valutare la splenomegalia.
La valutazione statistica è stata effettuata con il test del chi quadro, ANOVA e il t-test.
In questa trattazione verranno riportati i dati relativi alla clonalità del riarrangiamento del TCR e la correlazione tra questa e le caratteristiche di sintomatologia, dati anagrafici, storia di malattia dei pazienti.
I pazienti valutabili per il riarrangiamento TCR sono stati 43, divisi tra 24 pazienti affetti da CSS e 19 affetti da HES.
Le caratteristiche complessive dei pazienti sono riassunte nella tabella 3.
Tab 3: caratteristiche dei pazienti.
Caratteristiche cliniche Pazienti (totale 43)
Sesso (M/F) 26/17
Età alla diagnosi (media+/- DS) 51,46 + 16,25 anni Durata di malattia (media) 5,55 anni
Asma alla diagnosi 28
ANCA-MPO positivi 3
TCR positivi 20
RISULTATI
I risultati sono sintetizzati nella tabella sottostante (tab. 4).
Manifestazioni Cliniche CSS (24) HES (19) p-value
Maschi/totale 13/24 13/19 0.37
Età (media ± SD) 58 ± 14 57 ± 16 0.64
Durata di malattia (media ± SD) 6.7 ± 5.3 4.2 ± 4.2 0.09 Asma 24 5 <0.0001 Età all’insorgenza dell’asma (media ± SD) 41 ± 15 31± 20 0.32
Durata dell’asma (media ± SD) 9.7 ± 13 9.8 ± 9.7 0.99 Conta eosinofila all’esordio (media ± SD) 6060 ± 5110 6494 ± 7191 0.83 Sintomi costituzionali 17/24 2/19 0.99 Interessamento enterico 18/24 6/24 0.005 Interessamento renale 1/24 1/19 0.99 Interessamento cardiaco 7/24 3/19 0.47 Porpora 11/24 0/9 0.03 Infiltrati polmonari transitori 13/24 2/19 0.004 Sistema nervoso periferico 13/24 2/19 0.004 Dolore addominale 8/24 6/19 0.99 Splenomegalia 0/24 2/19 0.18 ANCA-MPO 9/24 0/19 0.01 Vasculite 16/24 0/19 <0.0001 TCR clonale 9/24 11/19 0.22
I dati statisticamente significativi sono quelli con p-value inferiore a 0.05. Come è logico attendersi da patologie che si sovrappongono per molti aspetti, ci sono molti criteri che in realtà non presentano differenze statisticamente significative nelle due patologie.
Non ci sono differenze per quanto riguarda la distribuzione tra i due sessi, né per l’età media di insorgenza della sintomatologia o per la durata media della malattia.
Tra i vari sintomi che sono elencati, alcuni sono presenti in entrambe le situazioni in modo indifferente, a cominciare dall’ipereosinofilia, i cui livelli medi all’esordio della sintomatologia sono assolutamente simili nei due gruppi, a conferma del fatto che questo dato da solo non è in grado di orientare verso una o l’altra diagnosi.
Tra i sintomi che invece presentano un valore di p molto basso e quindi che risultano più statisticamente differenti nei due gruppi si trovano quelli che corrispondono ai criteri diagnostici per la CSS, in particolare l’asma, che, seppur presente in qualche caso anche nel gruppo HES, risulta molto più caratteristica della CSS; stesso valore di significatività per la diagnosi istologica di vasculite, come atteso, assente nel gruppo HES così come la positività per gli ANCA-MPO oppure il riscontro di porpora agli arti inferiori.
Per quanto riguarda l’infiltrazione d’organo, dai dati in nostro possesso emerge come l’interessamento gastrointestinale, a carico del polmone e del sistema nervoso periferico siano statisticamente differenti nei due gruppi, mentre l’interessamento cardiaco è simile nei due gruppi.
Discorso a parte merita l’interessamento renale, che presenta un p molto alto ma è presente in un solo caso sia nel gruppo CSS che nel gruppo HES, rappresentando quindi un possibile errore di valutazione, dato che la popolazione con interessamento renale severo potrebbe essere rimasta esclusa dalla valutazione per motivi logistici e di compliance allo studio.
Non statisticamente significativi né i sintomi costituzionali né la presenza di splenomegalia, riscontrata in entrambi i gruppi.
Lo studio ha valutato anche il dosaggio di marcatori di attività eosinofilica come IL2, IL4, IL5, ECP, però va considerato che al momento dell’esecuzione degli esami ematochimici nessuno dei pazienti né con HES né con CSS presentava una malattia attiva. Pertanto, la correlazione dell’attività di malattia con i marcatori sierici in realtà non verrà analizzata perché non valutabile.
Per quanto riguarda la presenza di clonalità del TCR, come si può osservare non si riscontra significativa differenza nei due gruppi; tale questione verrà meglio approfondita nelle discussioni.
La tabella 5 mostra invece i dati relativi al confronto tra clonalità TCR su sangue periferico e midollare eseguita sui pazienti con diagnosi di HES; 16 dei 19 con HES avevano eseguito una valutazione midollare alla diagnosi e, come si può osservare, la concordanza dei due dati si verifica in 14/19 pazienti (74%), mentre in 2 casi (10%) non c’è concordanza, probabilmente perché i prelievi sono stati eseguiti in tempi diversi.
Tab.5: Confronto tra i dati da sangue periferico (PB) e sangue midollare (BM) dei 19 pazienti affetti da HES.
Numero paz TCR su PB TCR su BM 1 Neg Neg 2 Neg Neg 3 Neg Neg 4 Pos Pos 5 Pos Pos 6 Pos Pos 7 Neg Neg 8 Pos Neg 9 Pos Pos 10 Pos Pos 11 Neg Neg 12 Pos Pos 13 Neg Neg 14 Pos Pos 15 Pos Nd 16 Neg Nd 17 Neg Neg 18 Pos Neg 19 Pos Nd
Per meglio approfondire i dati relativi alla clonalità TCR, infine, è stato eseguito lo studio immunofenotipico della popolazione T su un campione ridotto di pazienti; in questo studio sono stati inclusi i pazienti n° 1, 2, 5, 7, 8, tra i quali 3 presentano concordanza positiva per il TCR, uno presenta concordanza negativa mentre uno presenta valori discordanti.
Nelle immagini che seguono sono illustrati i risultati per il paziente n° 8 con la progressiva selezione della popolazione linfocitaria CD4+/CD5+/CD3-; la quantificazione è riportata nella tabella 5.
Tab.6: dati quantitativi dell’analisi immunofenotipica pz n°8.
Come si può osservare, la popolazione linfocitaria T non mostra alcuna clonalità, specialmente per quanto riguarda la sottopopolazione selezionata; analoghi risultati sono stati ottenuti per tutti i pazienti valutati, quindi in analisi immunofenotipica non si è rilevata alcuna clonalità T.
Per quanto riguarda la valutazione morfologica midollare, il mieloaspirato è stato ottenuto in 18 pazienti affetti da HES e in 11 dei 24 pazienti affetti da CSS; i dati sono per entrambi i gruppi relativi ad una fase di attività di malattia, pertanto si rilevano percentuali di eosinofili che vanno dal 5% fino al 50% di infiltrazione nei pazienti affetti da CSS con una mediana di 13,5%, mentre nei pazienti diagnosticati come HES i valori oscillano dal 5-6% al 40-50% con una mediana di 19,5%; tra i due gruppi non sono riconoscibili differenze dal punto di vista morfologico per quanto riguarda gli eosinofili, che si presentano generalmente maturi con alcuni casi di aumento delle forme intermedie ed immature; solo sporadicamente vengono segnalati eosinofili francamente displastici, ma in 4 pazienti che si dividono equamente tra il gruppo HES e il gruppo CSS.
È da notare inoltre che in tutti i 29 campioni midollari non viene osservato un incremento della quota linfocitica nonostante in tutti i pazienti il prelievo sia stato eseguito in una fase di franca attività di malattia.
DISCUSSIONE DEI RISULTATI
I risultati del nostro studio permettono di evidenziare diversi aspetti, in parte noti o attesi, in parte interessanti; per cominciare, viene confermata la forte sovrapposizione tra le due patologie, con sintomi che caratterizzano entrambe le condizioni cliniche.
Nella nostra casistica, alcuni dei sintomi che classicamente vengono riportati come indicativi di una HES o di una CSS in realtà non confermano la loro significatività, come ad esempio la conta eosinofila e l’interessamento cardiaco che appaiono sovrapponibili nei due gruppi. Per quanto riguarda invece l’interessamento renale, è possibile che tale dato sia stato sottostimato, come già accennato nella valutazione dei risultati.
Si possono invece identificare come sintomi più caratteristici della CSS l’asma, come atteso dai criteri classificativi, la vasculite, l’interessamento gastrointestinale, del sistema nervoso periferico, la porpora, la positività degli ANCA-MPO.
Pertanto, una prima considerazione che si può trarre dalla nostra casistica è la conferma della validità di alcune caratteristiche classificative peraltro già largamente utilizzate nella pratica clinica.
Più interessante appare la discussione del ruolo del TCR γ/δ; in passato, il riscontro, in pazienti con ipereosinofilia idiopatica, della presenza di una clonalità T veniva riportato come indicativo di una HES variante linfocitica (L-HES) e veniva anche utilizzato come criterio diagnostico e differenziativo per considerare la ipereosinofilia come di pertinenza ematologica.
In realtà, dalla nostra casistica appare chiaro che il TCR non si presenta in modo statisticamente differente tra i due gruppi, e quindi non può aiutare a dirimere tra HES e CSS.
A seguito di questa osservazione, è stata effettuata una ulteriore analisi per rivalutare i criteri diagnostici dei pazienti classificati come CSS che presentavano la clonalità TCR alla ricerca
di eventuali errori classificativi che potessero giustificare un dato discordante da quanto atteso.
L’analisi eseguita ha dimostrato che i criteri diagnostici di CSS erano rispettati in tutti i pazienti; in particolar modo, 5 dei 9 pazienti CSS con TCR clonale presentavano criteri certi per CSS come la diagnosi istologica di vasculite necrotizzante (3 pazienti) o la positività degli ANCA presente in 2 pazienti.
Recentemente è stato pubblicato un lavoro che sottolinea l’importanza dei linfociti T regolatori CD4+CD25+ nella patogenesi della riattivazione della CSS attraverso il rilascio di citochine come interleuchina 25 e Interleuchina 17 che promuovono uno stato pro-infiammatorio e quindi giocano un ruolo nella riattivazione della patologia autoimmunitaria 57.
Nel febbraio 2011 è stato anche pubblicato come case report il riscontro di una clonalità T in una paziente con diagnosi di CSS 58;
in questo case report viene sottolineato come la paziente presentasse degli elevati valori di IL5 e come quindi il clone linfocitario T potesse avere un ruolo patogenetico nel sostegno della ipereosinofilia attraverso la produzione di questa citochina.
Inoltre, l’esistenza di una oligoclonalità T è stata dimostrata in un gruppo di pazienti CSS 59 in cui si è dimostrata una correlazione
tra la fase di attività della malattia e la disfunzione del sistema CD95/CD95ligand (Fas/Fas ligand) che porta ad una riduzione del meccanismo apoptotico CD95ligand-mediato sia per quanto riguarda i linfociti sia per gli eosinofili. In particolare, lo studio ha dimostrato come sia i linfociti sia gli eosinofili di pazienti con CSS presentino elevati livelli di mRNA per il recettore solubile di CD95, che va a competere con il recettore di membrana per il CD95ligand; in questo modo viene ridotto l’effetto pro-apoptotico che normalmente viene mediato dall’interazione CD95ligand/recettore di membrana.
A seguito dell’inizio di un trattamento immunosoppressivo, nei pazienti analizzati si è verificata una riduzione della concentrazione di CD95 recettore solubile, dimostrando l’efficacia del trattamento.
Lo studio sopra riportato mostra in modo molto elegante come i ruoli del clone linfocitario e degli eosinofili nella CSS siano strettamente correlati e rispondano al medesimo meccanismo.
Per tornare alle caratteristiche della nostra casistica, la clonalità T è stata dimostrata nel 37,5% dei pazienti con CSS, quindi non possiamo trarre la conclusione che il clone T sia indispensabile per la patogenesi della malattia.
Inoltre, considerando che i pazienti si presentavano in remissione di malattia, possiamo dire che il clone T non identifica soltanto la fase di attività di malattia, ma rimane anche nelle fasi di non attività come marcatore di alterazione cellulare T.
Ancora, va osservato che i pazienti del nostro studio si presentavano in remissione ed avevano normali livelli sierici dei marcatori di proliferazione eosinofila, in particolare di IL5, però non abbiamo dati disponibili sul dosaggio di IL5 al momento della diagnosi e quindi non possiamo trarre conclusioni sul ruolo di IL5 nella ipereosinofilia.
Quindi, le considerazioni che possiamo esporre sono diverse; la clonalità T può non essere un fattore determinante nella patogenesi della CSS, però nella nostra casistica è presente nel 37,5% dei pazienti analizzati, compresi pazienti con diagnosi sicura di CSS secondo i criteri ACR; già questo fatto sottolinea l’importanza di una valutazione diagnostica completa, perché il riscontro di una clonalità T non può essere considerato direttamente come indicativo di una L-CEL o di una HES variante linfocitica, ma va integrato con i criteri clinici, in particolare con la presenza di asma, vasculite, ANCA-MPO che nella nostra casistica presentano i valori di significatività più importanti.
Quando presente, possiamo ipotizzare che il ruolo del clone linfocitario T sia quello di sostegno dell’ipereosinofilia attraverso la
produzione di IL5 e quindi indirettamente di mediatore del danno d’organo e dell’endotelio vascolare. Questo aspetto apre interessanti scenari dal punto di vista terapeutico, perché attualmente il caposaldo nel trattamento delle ipereosinofilie rimane comunque la terapia steroidea e le prospettive della ricerca relativa a queste patologie comprendono anche lo studio di possibilità di schemi terapeutici a ridotto utilizzo di steroidi per limitare la tossicità a lungo termine di questi trattamenti.
La presenza di un clone T autorizzerebbe l’utilizzo di trattamenti che vanno ad interferire specificatamente con il clone, come ad esempio l’utilizzo di interferone, di inibitori della calcineurina, di anticorpo monoclonale anti-CD52 (Campath) come strategie terapeutiche di risparmio steroideo.
In uno studio precedentemente condotto dalla UO Reumatologia
60, è stato valutato il TCR insieme ad altri marcatori come FIP1L1 e
BCR/ABL su 11 pazienti con ipereosinofilia. Di questi, 9 presentavano diagnosi di CSS secondo i criteri ACR. Sulla casistica 2 pazienti presentavano una clonalità TCR, ma di questi uno apparteneva al gruppo diagnosticato come CSS.
Questi dati non fanno altro che confermare che il TCR clonale non identifica chiaramente una HES o una L-CEL, ma può essere associato a forme di CSS. A questo punto si può anche ipotizzare che le forme di CSS con TCR clonale appartengano ad una sottocategoria differente rispetto alle forme TCR non clonali.
Un altro aspetto da considerare viene espresso nello studio sopra citato di Muschen et al., che, andando ad analizzare le caratteristiche del riarrangiamento VDJ dei cloni TCR riscontrati, dimostra come alcuni tipi di riarrangiamento del dominio V siano più frequenti nella popolazione CSS rispetto alla popolazione normale di controllo. Anche un altro studio 61 mostra come in un
gruppo di 8 pazienti con diagnosi di CSS è stata dimostrata la presenza di una espansione clonale di uno-due tipi di riarrangiamenti V del TCR.
Questo fatto può aprire una prospettiva molto interessante, perché si può arrivare ad ipotizzare la presenza di un antigene originario che sia in grado di stimolare una proliferazione clonale linfocitaria T, con conseguente produzione di IL5 e proliferazione ed attivazione eosinofila che va ad esplicarsi con le caratteristiche del danno endoteliale e d’organo. Questa potrebbe essere una fase “prodromica” rispetto alle tre fasi classiche di attività della CSS, ma potrebbe in realtà anche portare ad una ridefinizione delle patologie autoimmuni che si presentano con una ipereosinofilia.
Infatti, in questa che al momento è soltanto una ipotesi patogenetica, la presenza dell’antigene potrebbe essere il primo momento comune sia ad una patologia che poi si esplica con le caratteristiche della CSS, sia alla forma di HES variante linfocitaria, oppure alla L-CEL, che a questo punto potrebbero essere comprese nello “spettro” di un’unica manifestazione nosologica.
Va anche considerato un altro aspetto: a seguito del trattamento si può verificare una negativizzazione del TCR, per cui anche nei pazienti TCR negativi della nostra casistica non abbiamo dati relativi alla fase di attività della malattia. Possiamo quindi dire che, per ottenere dati ulteriori per chiarire questo processo patogenetico, bisognerebbe disegnare uno studio in cui il TCR venga valutato soprattutto nella fase di attività di malattia e contestualmente al dosaggio della IL5 per documentare uno stimolo proliferativo eosinofilo.
Nei due casi in cui nella nostra casistica di HES non si è verificata concordanza tra i dati midollari e periferici il TCR appare positivo su SP e negativo alla valutazione midollare eseguita alla diagnosi, suggerendo che l’attività del clone possa avere un andamento altalenante correlabile con le fasi di acuzie cliniche della patologia.
Inoltre, in tutti i pazienti che sono stati valutati con indagine immunofenotipica non è stato possibile identificare il clone T anche in presenza di una biologia molecolare positiva; questo dato
potrebbe essere spiegato con la maggiore sensibilità della PCR rispetto alla tipizzazione immunofenotipica (10-5 per la PCR, 10-4
per la citofluorimetria).
Infatti, la PCR potrebbe identificare un clone T anche quantitativamente molto più piccolo rispetto a quanto può essere visto dalla citofluorimetria; i pazienti valutati nello studio sono tutti pazienti in remissione, quindi in cui il clone T, se presente, deve essere quantitativamente poco rappresentato e questo è confermato anche dalla mancata produzione di IL5 in tutti i pazienti.
Questo dato offre la conclusione che la ricerca della clonalità T, specialmente se viene eseguita in pazienti asintomatici e con una conta eosinofila nei limiti, andrebbe valutata preferibilmente in PCR per una maggiore attendibilità del dato.
Il clone linfocitario T dal punto di vista immunofenotipico è stato ricercato secondo le evidenze presenti in letteratura che descrivono un clone di accompagnamento CD3-/CD4+. Nello studio di Helbig 62 su 42 pazienti affetti da HES analizzati è stato riportato il
77,4% con immunofenotipo CD3−CD4+, il 7.23% di linfociti
CD3+CD8−, il 79.5% di CD2+CD7− e il 73.3% di CD3−CD5+.
Uno studio precedentemente condotto dalla nostra UO 63 ha
mostrato su una casistica limitata un paziente con immunofenotipo CD4+/CD3- atipico di accompagnamento ad una HES.
La valutazione immunofenotipica del clone T linfocitario nelle CSS è molto più rara in letteratura, compatibilmente con l’evidenza dell’associazione della clonalità T alle CSS che in realtà è stata segnalata per la prima volta solo recentemente 58. È stato descritto un
fenotipo CD28- nei linfociti T presenti nelle vasculiti ANCA-correlate che potrebbe essere coinvolto nella riduzione della stimolazione alla proliferazione e sopravvivenza dei linfociti T CD4+ 64 però tale dato viene descritto soprattutto in relazione alla
granulomatosi di Wegener mentre non sono presenti dati relativi alla CSS.
Complessivamente la prevalenza della clonalità TCR nelle HES della nostra casistica è del 58% (11 pazienti su 19) per quanto riguarda il sangue periferico; anche in questo caso i pazienti si presentano in remissione di malattia, per cui il clone T ha probabilmente un ruolo patogenetico di sostegno al clone eosinofilo nelle fasi di attività, mentre rimane come positività isolata nelle fasi di remissione clinica.
L’analisi specifica del riarrangiamento della catena delta del TCR per andare a valutare una eventuale ricorrenza di uno specifico riarrangiamento ha portato ad evidenziare che in alcuni casi si possono identificare cloni situati in stretta prossimità che possono appartenere allo stesso riarrangiamento. Ad esempio, sul campione totale dei 20 TCR positivi, 5 pazienti presentano un riarrangiamento Vδ3-Jδ1 che si colloca tra 423-427 bp, rappresentando così uno stesso cluster. Interessante notare che tra questi pazienti 4 sono pazienti della casistica CSS ed uno è del gruppo HES.
Tra i pazienti affetti da CSS due presentano un riarrangiamento Vδ2-Dδ3 clonale di 249-251 bp. Nel gruppo HES, invece sono presenti due pazienti con riarrangiamento Vδ3-Jδ1 di 440-442 bp e due pazienti che presentano il riarrangiamento Vδ 2-Jδ1 di 427 bp, mentre gli altri pazienti presentano un pattern disomogeneo di riarrangiamenti del TCR.
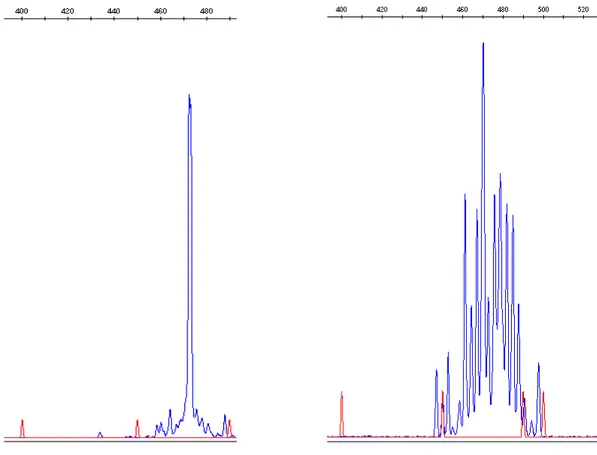
Nelle figure 6 e 7 sono rappresentati, rispettivamente, le immagini di un TCR monoclonale ed uno policlonale relativi al riarrangiamento Vd1-Jd1 (non presente nella nostra casistica); come si può osservare, la figura 6 mostra il picco a 470 bp, mentre nella figura 7 non è osservabile alcuna clonalità.
Fig. 6 (a sinistra) e 7 (a destra): riarrangiamento TCR δ clonale e non clonale.
È interessante valutare la rilevanza numerica della frequenza del TCR clonale nelle HES; infatti, se si escludono dalle forme idiopatiche i casi in cui si dimostra una clonalità T, in realtà il numero delle HES realmente idiopatiche potrebbe essere molto più esiguo rispetto all’attuale.
Come già accennato per quanto riguarda la CSS, il riscontro della clonalità linfocitaria permette l’utilizzo di strategie terapeutiche più diversificate (Interferone, Ciclosporina, Anticorpo anti-CD52, ecc) e soprattutto permetterebbe il risparmio della terapia steroidea da riservare solamente alle fasi più acute di malattia.
Una ultima considerazione da fare riguarda la dimostrazione, in uno studio molto interessante, della clonalità eosinofila in pazienti affetti da HES mediante lo studio dell’inattivazione del cromosoma
X. In questo lavoro 65 è stato dimostrato che i pazienti affetti da HES
presentano eosinofili clonali ma popolazione linfocitaria policlonale, mentre sia i pazienti affetti da CSS che i pazienti con ipereosinofilia secondaria utilizzati come braccio di controllo presentano una popolazione eosinofila policlonale. In questo studio manca la valutazione della specifica clonalità T perché lo studio della clonalità è stato eseguito soltanto mediante la valutazione dell’inattivazione del cromosoma X, però trova conferma il dato che le vere sindromi ipereosinofile idiopatiche abbiano una clonalità della popolazione eosinofila in assenza di clonalità linfocitaria riconosciuta.
Da un punto di vista patogenetico, si potrebbe valutare la possibilità dell’esistenza di uno “spettro” in cui si vadano a collocare tutte le ipereosinofilie con TCR riarrangiato come entità nosologiche ben definibili; in questo caso le HES e le CSS con TCR riarrangiato potrebbero costituire un continuum distinguibile solo sulla base delle caratteristiche sintomatologiche differenti. Nel panorama classificativo complesso che attualmente caratterizza le sindromi ipereosinofile questa potrebbe essere una distinzione logica dal punto di vista patogenetico e soprattutto terapeutico.
BIBLIOGRAFIA:
1: Mark A. Giembycz and Mark A. Lindsay, Pharmacology of the Eosinophil, Pharmacological Reviews June 1, 1999 vol. 51 no. 2 213-340.
2: Giulia Stella, Ernesto Pozzi, Eosinofilo: fisiologia e fisiopa-tologia, Medicina Toracica, settembre 2009
3: Kelly D. Stone, MD, PhD, Calman Prussin, MD, and Dean D. Metcalfe, MD IgE, Mast Cells, Basophils, and Eosinophils J Allergy Clin Immunol. 2010 February
4: Tefferi A, Gotlib J, Pardanani Hypereosinophilic syndrome and clonal eosinophilia: point-of-care diagnostic algorithm and treatment update. A.Mayo Clin Proc. 2010 Feb;85(2):158-64. Epub 2010 Jan 6. Review. 5: Chusid MJ, Dale DC, West BC, The hypereosinophilic syndrome: analysis of fourteen cases with review of the literature.Wolff SM.Medici-ne (Baltimore). 1975 Jan;54(1):1-27. Review.
6: Cools J, Stover EH, Gilliland DG. Detection of the FIP1L1-PDGFRA fusion in idiopathic hypereosinophilic syndrome and chronic eosinophi-lic leukemia. Methods Mol Med. 2006;125:177-87.
7: Rioux JD, Stone VA, Daly MJ, Cargill M, Green T, Nguyen H, Nutman T, Zimmerman PA, Tucker MA, Hudson T, Goldstein AM, Lander E, Lin AY. Familial eosinophilia maps to the cytokine gene cluster on human chromosomal region 5q31-q33. Am J Hum Genet. 1998 Oct;63(4):1086-94.
8: Jason Gotlib, Continuing Medical Education Program in American Journal of Hematology World Health Organization-defined eosinophilic disorders: 2011 update on diagnosis, risk stratification, and management 9: SAUNDERS RH Jr, ADAMS E..Changes in circulating leukocytes following the administration of adrenal cortex extract (ACE) and adrenocorticotropic hormone (ACTH) in infectious mononucleosis and chronic lymphatic leukemia. Blood. 1950 Aug;5(8):732-41
10: Dahl R, Venge P(1978) Blood eosinophil leucocyte and eosinophil cationic protein. In vivo study of the influence of beta2-adrenergic drugs and steroid medication. Scand J Respir Dis 59:319–322
11: Hallgren R, Venge P, Cullhed I, Olsson I(1979) Blood eosinophils and eosinophil cationic protein after acute myocardial infarction or corti-costeroid administration. Br J Haematol 42:147–154
12: Baigelman W, Chodosh S, Pizzuto D, Cupples LA(1983) Sputum and blood eosinophils during corticosteroid treatment of acute exacerba-tions of asthma. Am J Med 75:929–936
13: Gleich GJ, Hunt LW, Bochner BS, Schleimer RP(1996) Glucocorti-coid effects on human eosinophils. in Inhaled GlucocortoGlucocorti-coids in Asth-ma. Lung Biology in Health and Disease, eds Schleimer RP, Busse WW, O’Byrne PM (Marcel Dekker, New York), 97:279–308.
14: Zora J, O’Connell EJ, Sachs MI, Hoffman AD(1984) Eosinophilic gastritis: A case report and review of the literature. Ann Allergy 53:45– 47.
15 Bochner BS, Friedman B, Krishnaswami G, Schleimer RP, Lichten-stein LM, Kroegel C (1991b) Episodic eosinophilia-myalgia-like syndro-me in a patient without L-tryptophan use: Association with eosinophil activation and increased serum levels of granulocyte/macrophage colo-ny-stimulating factor. J Allergy Clin Immunol 88:629–636
16: Butterfield JH, Leiferman KM, Abrams J, Silver JE, Bower J, Gon-choroff N, Gleich GJ (1992) Elevated serum levels of interleukin-5 in pa-tients with the syndrome of episodic angioedema and eosinophilia. Blood 79:688–692
17: Evans PM, O’Connor BJ, Fuller RW, Barnes PJ, Chung KF(1993) Effect of inhaled corticosteroids on peripheral blood eosinophil counts and density profiles in asthma. J Allergy Clin Immunol 91:643–650. 18: Laviolette M, Ferland C, Trepanier L, Rocheleau H, Dakhama A, Boulet LP(1994) Effects of inhaled steroids on blood eosinophils in mo-derate asthma. Ann N Y Acad Sci 725:288–297
19: Rebuck JW, Mellinger RC(1953) Interruption by topical cortisone of leukocytic cycles in acute inflammation in man in vivo. Ann NY Acad Sci 56:715–751.
20: Pipkorn U, Proud D, Lichtenstein LM, Kagey Sobotka A, Norman P, Naclerio RM(1987a) Inhibition of mediator release in allergic rhinitis by pre-treatment with topical glucocorticosteroids. N Engl J Med 316:1506– 1510.
21: Pipkorn U, Proud D, Lichtenstein LM, Schleimer RP, Peters SP, Ad-kinson J, Kagey Sobotka A, Norman PS, Naclerio RM(1987b) Effect of short-term systemic glucocorticoid treatment on human nasal mediator release after antigen challenge. J Clin Invest 80:957–961.
22: Schleimer RP(1988) Glucocorticosteroids: their mechanisms of ac-tion and use in allergic diseases. in Allergy: Principals and Practice, eds
Middleton EJ, Reed CE, Ellis EF, Adkinson NFJ, Yunginger JW (Mo-sby, St. Louis), pp 739–765.
23: Bascom R, Pipkorn U, Proud D, Dunnette S, Gleich GJ, Lichtenstein LM, Naclerio RM (1989) Major basic protein and eosinophil-derived neurotoxin concentrations in nasal-lavage fluid after antigen challenge: Effect of systemic corticosteroids and relationship to eosinophil influx. J Allergy Clin Immunol 84:338–346.
24: Charlesworth EN, Kagey Sobotka A, Schleimer RP, Norman PS, Li-chtenstein LM (1991) Prednisone inhibits the appearance of inflammato-ry mediators and the influx of eosinophils and basophils associated with the cutaneous late-phase response to allergen. J Immunol 146:671–676. 25: Varney V, Gaga M, Frew AJ, De vos R, Kay AB(1992) The effect of a single oral dose of prednisolone or cetirizine on inflammatory cells in-filtrating allergen-induced cutaneous late-phase reactions in atopic sub-jects. Clin Exp Allergy 22:43–49.
26: Taborda Barata L, Jacobson M, Walker S, Njuki F, Ying S, Durham SR, Kay AB (1996) Effect of cetirizine and prednisolone on cellular in-filtration and cytokine mRNA expression during allergen-induced late cutaneous responses. Clin Exp Allergy 26:69–78.
27: Andersson M, Andersson P, Venge P, Pipkorn U(1989) Eosinophils and eosinophil cationic protein in nasal lavages in allergen-induced hy-perresponsiveness: Effects of topical glucocorticosteroid treatment. Al-lergy 44:342–348
28: Bisgaard H, Gronborg H, Mygind N, Dahl R, Lindqvist N, Venge P(1990) Allergen-induced increase of eosinophil cationic protein in nasal lavage fluid: Effect of the glucocorticoid budesonide. J Allergy Clin Im-munol 85:891–895
29: Janson Bjerklie S, Fahy J, Geaghan S, Golden J (1993) Disappearan-ce of eosinophils from bronchoalveolar lavage fluid after patient educa-tion and high-dose inhaled corticosteroids: A case report. Heart Lung 22:235–238
30: Adelroth E, Rosenhall L, Johansson SA, Linden M, Venge P (1990) Inflammatory cells and eosinophilic activity in asthmatics investigated by bronchoalveolar lavage: The effect of anti-asthmatic treatment with budesonide and terbutaline. Am Rev Respir Dis 142:91–99.
31: Djukanovic R, Wilson JW, Britten KM, Wilson SJ, Walls RS, Roche WR, Howarth PH, Holgate ST (1992) Effect of inhaled corticosteroid on airway inflammation and symptoms in asthma. Am Rev Respir Dis 145:669–674