1
Università degli Studi di Pisa
Dottorato di ricerca
Tecnologie per la salute: valutazione e gestione delle innovazioni nel settore
biomedicale
VALUTAZIONE DELLA CONNETTIVITA’ CORTICALE MEDIANTE STUDIO
DI COERENZA EEG DURANTE IL GESTO CHIRURGICO IN CHIRURGIA
LAPAROSCOPICA VERSUS ROBOTICA
(MED 18, MED 26)
Relatore: Chiar.mo Prof. Mauro Ferrari Candidato: Dr. Carlo Moretto
2 Ringraziamenti
La tesi di Dottorato di Ricerca è stata eseguita grazie alla collaborazione fattiva e continua del Prof. Ferdinando Sartucci (Direttore della Sezione Dipartimentale di Neurologia Cisanello) che ha messo a disposizione il suo personale medico e tecnico anche in orario extralavorativo. Un sentito ringraziamento va al Dr. Tommaso Bocci (Medico Specializzando in Neurologia e Neurofisiologia) il cui aiuto è stato fondamentale in tutte le fasi di questa ricerca, compresa la stesura della tesi. L’ultimo ringraziamento va alla scuola di chirurgia pisana diretta dal Prof. Mosca ed al Prof. Mauro Ferrari che hanno sostenuto in questi anni la mia formazione medico-chirurgica.
3 INDICE
Introduzione pag. 3 - 17
Razionale dello Studio pag. 17 - 18
Materiali e Metodi pag. 18 - 26
Risultati pag. 27 - 34
Conclusioni pag. 35 - 37
4 INTRODUZIONE
Nel corso degli anni l’evoluzione tecnologica in medicina ha permesso di curare i pazienti con terapie sempre più selettive e mirate. Grazie all’avvento delle procedure endoscopiche, endovascolari, percutanee eco-TC guidate e della chirurgia mininvasiva (MIS) i pazienti hanno beneficiato di trattamenti chirurgici meno invasivi ma che allo stesso tempo hanno offerto uno standard di cura sovrapponibile, se non talvolta migliore, rispetto alla terapia chirurgica convenzionale, permettendo un rapido recupero funzionale ed una riduzione della mortalità e morbilità postoperatoria.
Il vantaggio terapeutico della MIS nella cura delle malattie benigne e di alcune maligne è oramai indiscutibile. Tuttavia ad oggi la MIS non è il gold standard nel trattamento di tutte le malattie neoplastiche, e nonostante l’ampio ambito di applicazione questa metodica deve essere impiegata laddove esistano linee guida internazionali od all’interno di studi clinici randomizzati. Al di fuori di questi la chirurgia tradizionale è considerata lo standard terapeutico.
Nell’ultimo decennio sono stati sviluppati sistemi robotici, che grazie alla miniaturizzazione della strumentazione chirurgica ed alla implementazione dei sistemi visivi, hanno esteso l’ambito di applicazione della MIS a casi fino ad allora molto complessi in laparoscopia, offrendo uno standard di radicalità oncologica uguale se non superiore rispetto alla chirurgia convenzionale.
Questi sistemi, comunemente chiamati robotici, offrono enormi vantaggi in numerose situazioni rispetto alla MIS che nella sua veste originaria presenta alcuni limiti: fra questi, la perdita della visione tridimensionale, la complessità di manovrare gli strumenti attraverso piccoli accessi con un inevitabile effetto leva e senza la normale coordinazione fra occhio e mano del chirurgo, la difficoltà di operare in siti anatomici difficili da raggiungere e con scarsa camera di lavoro e la inevitabile mancanza di ergonomia per il chirurgo. I sistemi robotici sono diventati disponibili in ambito chirurgico con la finalità di superare tali limitazioni.
La più ampia definizione tecnica degli attuali surgical-robots (SR) è “chirurgia assistita dal computer” (computer-assisted surgery, CAS).
5 I chirurghi, le istituzioni sanitarie sono attratti dall’applicazione di questa nuova tecnologia per le potenzialità che essa offre; i benefici sono di per se legati in parte all’approccio mininvasivo (la riduzione della degenza ospedaliera, il rapido recupero ed il minor dolore post-operatorio), ma sopratutto dalla migliore ergonomia e destrezza legate alla robotica che amplificano la performance chirurgica sia da un punto di vista oncologico che funzionale. Tuttavia il dibattito sui costi correlati all’acquisizione ed al mantenimento di tale tecnologia da parte delle istituzioni sanitarie è tuttora aperto ed è senz’altro quello che ne ha frenato finora la diffusione nelle sale operatorie. A ciò va aggiunto una quota di scetticismo diffuso da parte di molti chirurghi, non validato scientificamente, che non ritengono opportuna l’applicazione e la validazione di questa nuova tecnologia, ma tendono a frenare gli entusiasmi negando l’utilità della robotica riconoscendole solo scarsi benefici terapeutici rispetto allo standard.
La chirurgia robotica viene generalmente proposta e utilizzata come tecnica mininvasiva per interventi che richiedono una elevata precisione e destrezza, ad esempio come operare in un campo operatorio ristretto o dove sia prevista una fase ricostruttiva che risulti fondamentale per la buona riuscita dell’intervento stesso.
Lo sviluppo della tecnologia robotica, nonostante i recenti aggiornamenti tecnici, è ancora ad uno stadio iniziale e tuttavia gli studi clinici condotti fino ad oggi non forniscono informazioni conclusive con evidenza clinica (evidence based medicine) sulla sua efficacia e sui reali vantaggi nella pratica chirurgica.
Il sistema robotico da Vinci (da Vinci Surgical System, dVSS) realizzato e prodotto dalla Intuitive Surgical Inc. (Mountain View, Sunnyvale, California, USA) è quello che è stato maggiormente sviluppato dal punto di vista tecnico, l’unico attualmente in commercio ed autorizzato dagli enti di sorveglianza in ambito sanitario a livello internazionale, nonché il più utilizzato nella pratica clinica dall’introduzione della tecnologia robotica e con il quale sono stati condotti i principali lavori scientifici presenti in letteratura.
6 Per capire bene come funziona il sistema robotico dVSS è necessario fare un digressione tecnica sullo sviluppo e sulla tecnologia di cui stiamo parlando.
L’era dei robots in ambito chirurgico iniziò negli anni ’80, adattando quelli già disponibili sul mercato ad uso industriale: con l’applicazione della stereotassi in neurochirurgia che permetteva un accurato planning per la localizzazione di lesioni intracraniche a scopi bioptici, il Puma 560 fu il robot industriale usato nel 1985 da Kwoh et al per eseguire biopsie neurochirurgiche ad alta precisione. Tre anni dopo, Davies effettuò una resezione transuretrale della prostata usando il Puma 560. Partendo da questo sistema, gli ulteriori sviluppi dell’ingegneria robotica portarono nel 1991 all’introduzione in urologia del PROBOT (Imperial College of London, London, England) per resezioni prostatiche per via transuretrale, e poi in ortopedia del ROBODOC (Integrated Surgical Supplies, Sacramento, CA, USA) (1) (2) progettato per delimitare con estrema precisione gli alloggiamenti dove porre le protesi ossee. ROBODOC è stato il primo robot chirurgico ad essere approvato dalla FDA.
Verso la fine degli anni Ottanta, un gruppo di ricercatori dell’Ames Research Center della NASA che si occupava di studi sulla realtà virtuale applicò le informazioni ottenute dalle ricerche effettuate alla telepresence surgery, ovvero della chirurgia a distanza, che divenne una delle basi fondamentali nello sviluppo della chirurgia robotica (1).
Nei primi anni Novanta, alcuni scienziati della NASA-Ames si unirono ad altri ricercatori ed esperti in realtà virtuale dello Stanford Research Institute (SRI) per lavorare insieme con il principale scopo di realizzare tele-manipolatori in grado di fornire al chirurgo la sensazione di operare direttamente sul paziente pur non trovandosi al letto del malato.
L’US Army venuto a conoscenza dell’SRI volle sviluppare il concetto della telepresence con l’idea di applicare la tecnologia in zone di guerra, “portando virtualmente” il chirurgo al soldato ferito (4). Fu ideato un sistema mediante il quale un soldato ferito in guerra poteva essere trasportato su un veicolo dotato di una sala robotica ed essere operato a distanza da un chirurgo che si trovava in un Mobile Advanced Surgical Hospital (MASH) posto in un luogo lontano dalla zona di guerra.
7 Questo sistema, non ancora testato, venne pensato con il fine di ridurre il numero di vittime di guerra prevenendo il dissanguamento dei soldati feriti (1).
Alcuni dei chirurghi ed ingegneri che lavorarono allo sviluppo di questo progetto, formarono imprese commerciali che portarono poi allo sviluppo definitivo del robot ed alla sua introduzione in ambito medicale civile. La Computer Motion, Inc. (Santa Barbara, CA, USA) usò il denaro fornito dalle Forze Armate per sviluppare l'AESOP (Automated Endoscopic System for Optimal Positioning): un braccio robotico con controllo vocale che è in grado di gestire i movimenti della videocamera laparoscopica.
Nel 1994 l’FDA ne approvò l'utilizzo sull’uomo ed il commercio in ambito medicale: in seguito molti prototipi vennero sviluppati per ampliarne le funzioni e provare ad aumentare la sua utilità, ma senza perdere di vista l’obiettivo iniziale, cioè quello di permettere un approccio chirurgico laparoscopico in solo surgery.
I principali sistemi robotici sviluppati in ambito biomedicale chirurgico sono i seguenti:
- EndoAssist (Armstrong Healthcare Ltd, High Wycombe, Buck, UK): si tratta di un braccio robotico utilizzato come supporto per la telecamera laparoscopica. Il braccio possiede quattro gradi di libertà, usando il trocar di accesso come fulcro di angolazione. L’operatore indossa un casco il cui movimento, rilevato da un sensore infrarossi, viene ripetuto dal braccio robotico. Per attivare il sistema è necessario premere un pedale.
- AESOP (Automated Endoscopy System for Optimal Positioning; Computer Motion, Goleta, CA, USA): analogamente al sistema EndoAssist è stato sviluppato con lo scopo di fungere da braccio di sostegno per la telecamera endoscopica. A differenza di EndoAssist il chirurgo può attivare il robot a comando vocale.
- FIPS EndoArm (Karl Storz, Karlshrue Research Center, Karlshrue, Germania) associa al controllo vocale la possibilità di controllare gli strumenti per via manuale mediante joystick, ed inoltre il braccio robotico può essere direttamente solidarizzato con il letto operatorio.
8 - Il sistema Zeus (Computer Motion Inc., Goleta, CA, USA) è composto da una console di controllo del chirurgo e 3 braccia robotiche montate sul letto operatorio. Il braccio destro ed il sinistro riproducono le funzioni delle braccia del chirurgo mentre il terzo braccio a comando vocale tipo AESOP manovra l’endoscopio nel campo operatorio. Nel sistema Zeus il chirurgo è seduto comodamente su una poltrona con il monitor ed i master degli strumenti posizionati ergonomicamente per consentire la massima comodità e destrezza ed allo stesso tempo avere il completo controllo della sala operatoria. Il sistema utilizza gli stessi strumenti endoscopici della laparoscopia convenzionale, ma rispetto ad essi nella parte distale si possono articolare secondo 7 gradi di libertà. Con questo tipo di robot il 7 Settembre 2001 è stata eseguita dal Prof. Jaques Marescaux la prima colecistectomia laparoscopica in telechirurgia robot assistita (remote robot assisted surgery). Il chirurgo operatore era a New York seduto alla consolle chirurgica mentre il paziente veniva da lui operato a distanza nelle sale operatorie dell’IRCAD di Strasburgo, grazie ad una propagazione dei dati in fibra ottica a banda larga ed alta velocità con una latenza di trasmissione dell’immagine di 150 msec, praticamente in tempo reale.
- Il sistema robotico da Vinci nasce negli Stati Uniti nel 1995, anno in cui viene fondata la Intuitive Surgical Inc. (Mountain View, Sunnyvale, CA, USA), che dal 2003 è anche unico produttore e leader mondiale di questa tecnologia dopo aver rilevato nello stesso anno la rivale Computer Motion Inc. ed aver abbandonato il progetto Zeus a favore del da Vinci.
Il primo utilizzo nell’uomo avviene nel 1997 (Cadiere) e nel Gennaio 1999 viene commercializzata la prima versione del sistema. Nel 2000 diventa il primo sistema robotico chirurgico autorizzato dalla FDA per l’impiego in chirurgia generale. Negli anni successivi la stessa FDA ne approva l’uso anche per la cardiochirurgia, la chirurgia toracica, urologica e ginecologica.
Al 31 Dicembre 2009 figurano installati al mondo 1.395 sistemi da Vinci di cui circa il 75% (1028) negli USA (fonte: Intuitive Surgical Inc., Mountain View, Sunnyvale, CA, USA). Il trend di installazione mostra che nell’anno 2007 vi è stato un deciso incremento più evidente negli USA che
9 nel resto del mondo. Nel mercato Europeo l’Italia è un punto di riferimento con 40 sistemi installati alla fine del 2009 (pari al 19% del totale EU), seguita dalla Francia (18), dal Belgio (17) e dalla Germania (16). I primi quattro paesi (Italia, Francia, Belgio e Germania) posseggono complessivamente il 57% del mercato EU.
In sostanza sono stati concepiti nel tempo due tipi di sistemi robotici per applicazioni di tipo medicale: robot endoscopici e robot telemanipolati o “telemanipolatori”. Ciascun sistema si differenzia dall’altro in relazione alla funzione che realizza: i sistemi endoscopici sono atti a manovrare solo la videocamera durante l'intervento chirurgico (EndoAssist, AESOP, ecc.). Al contrario, i robot telemanipolati o “interfaccia uomo-macchina” anche detti “master-slave”, come Zeus e da Vinci, sono sistemi con braccia multiple che vengono tutte gestite dal chirurgo da una console computerizzata, sia per la parte operatoria che per quella di manovra della telecamera. Questa tecnologia permette una telemanipolazione intuitiva con movimenti piccoli e precisi, grazie agli strumenti EndoWrist® dotati di un gesto simile a quello della mano, ed inoltre filtra i fini tremori tipici della laparoscopia tradizionale.
Il sistema da Vinci Si HD è composto da tre parti fondamentali: il carrello robotico, la console chirurgica e la colonna endoscopica.
10 Il carrello robotico del da Vinci Si HD, dove “S” sta per “streamlined” cioè semplificato, pesa circa 544 kg ma è facilmente posizionabile grazie ad un carrello elettrico su base ruotante. Il carrello, connesso alla console mediante un sistema di cavi, consta di quattro braccia robotiche articolate. Una volta approssimato al letto operatorio il carrello viene bloccato in posizione di lavoro che viene mantenuta fino al termine dell’intervento chirurgico ed è reversibile in qualsiasi momento.
Le quattro braccia meccaniche, rivestite da appositi involucri sterili, sono fissate agli accessi laparoscopici (trocar) dai quali vengono inseriti gli strumenti chirurgici. Ogni braccio è dotato di una serie di giunti meccanici che ne consentono l’articolazione nelle diverse posizioni dello spazio,
11 di un meccanismo all’estremità per l'ancoraggio al trocar e dei tasti dedicati ad ogni snodo che ne permettono l'adattamento manuale: premendo il tasto si attiva una frizione che concede il libero movimento del braccio nello spazio mentre il suo rilascio blocca il braccio nella posizione operativa voluta.
Il team chirurgico presente al tavolo operatorio ha il compito di posizionare i trocar una volta indotto lo pneumoperitoneo, eseguire il setting del sistema robotico, condurre l'installazione dello strumentario robotico. In commercio sono presenti numerosi strumenti chirurgici per la robotica facilmente intercambiabili ed ognuno di questi, come in chirurgia tradizionale open, possiede un uso definito: alcuni servono per clampare vasi, altri per eseguire suture, manipolare e dissecare tessuti.
Ad eccezione del dissettore ad ultrasuoni tutti gli altri strumenti operatori hanno un'articolazione interna detta “endo-wrist”, vale a dire a polso ruotante (EndoWrist, Intuitive Surgical Inc.) e sono progettati per avere sette gradi di libertà alle loro estremità.
12 E’ possibile angolare la parte distale del ferro chirurgico di 90° consentendo un movimento complesso in grado di mimare la destrezza della mano e del polso umano. I movimenti delle mani del chirurgo alla console vengono calibrati, filtrati e tradotti in modo fluido, senza scatti e tremori, in precisi movimenti degli strumenti EndoWrist: tutto ciò è reso possibile da un complesso software che controlla la gestione dei movimenti detto “motion scaling”, che elimina il tremore umano interagendo circa 1500 volte al secondo con il gesto chirurgico consentendo di ridurre in scala i movimenti grossolani del chirurgo trasformandoli in gesti finissimi alle estremità del robot.
Gli strumenti sono risterilizzabili e garantiti per un corretto funzionamento in media per 10 volte ma possono essere riusati in maniera illimitata durante una stessa procedura chirurgica. Il sistema Da Vinci è in grado di rilevare l’utilizzo di uno strumento chirurgico che conta le dieci sessioni d'uso e ne impedisce l’ulteriore impiego, in modo da garantire la massima sicurezza per il paziente: a questo punto lo strumento usato dovrà essere sostituito con uno nuovo.
La console chirurgica, posta fuori dal campo sterile ed a distanza dal tavolo operatorio, è composta dal dispositivo-osservatore binoculare facente parte del sistema di visione Insite, dai master controllers, ovvero i manipoli che controllano gli strumenti, dai pannelli di controllo e di verifica di funzionamento del sistema e da una pedaliera composta da cinque pedali.
La console inoltre contiene la parte hardware e software del sistema robotico che controllano e regolano tutte le principali funzioni.
13 Il sistema video Insite è composto da un endoscopio rigido da 12 mm di diametro che è diviso in due canali ottici separati (uno per l’occhio destro ed uno per il sinistro) ciascuno dei quali è collegato ad una videocamera ad alta definizione (HD nel sistema da Vinci S). La separazione di queste immagini proiettate nel binocolo della consolle consente una percezione dell'immagine realmente stereoscopica e tridimensionale. Due sorgenti luminose ottimizzano l'intensità della luce per i due canali ottici. L’automatizzazione della consolle permette il controllo da parte del chirurgo del fuoco, della posizione nel campo operatorio e dello zoom della telecamera. Il sistema di ingrandimento in tempo reale ad alta risoluzione consente al chirurgo di disporre di una qualità di immagine eccellente e superiore rispetto alla chirurgia laparoscopica tradizionale. Il sistema fornisce più di un migliaio di immagini al secondo e il processore filtra ogni singola immagine eliminando il rumore di fondo.
Il chirurgo è seduto in una posizione ergonomica con i gomiti appoggiati su un bracciolo imbottito, scaricandone il peso: il pollice e l'indice di ciascuna mano sono inseriti all’interno di anelli regolabili connessi ai master controllers posti sotto il display. Questa particolare disposizione spaziale dei manipoli e degli oculari consente principalmente di garantire l’allineamento occhio-mano come nella chirurgia convenzionale. L’estremità degli strumenti visualizzate sul display risultano allineate con le mani e le braccia dell'operatore, come in una sorta di prolungamento virtuale dei propri arti; il chirurgo pertanto, per effetto della visione stereoscopica 3 D, finisce per avere la percezione di trovarsi in una realtà virtuale, come se fosse immerso all’interno del campo
14 operatorio. I master controllers si muovono liberamente in tutte le direzioni dello spazio, dando l’impressione di avere un controllo intuitivo degli strumenti e della videocamera.
Ci sono cinque pedali posti alla base della consolle, partendo da sinistra verso destra;
- il pedale del “clutch”: funziona come una frizione meccanica disimpegna gli strumenti dai controllers, consentendo a questi di muoversi in posizione più ergonomica senza spostare il ferro chirurgico all’interno del campo operatorio.
- il pedale della videocamera: una volta premuto svincola il movimento degli strumenti dai controllers che se mossi a questo punto consentono il posizionamento della telecamera nel punto desiderato.
- il pedale di regolazione del fuoco dell'immagine: viene usato normalmente solo all'inizio della procedura, prima che l'intervento cominci, per regolare la visione telescopica.
- il pedale del coagulo bipolare. - il pedale per il coagulo monopolare.
Due pannelli di controllo sono disposti ai lati della barra dove il chirurgo appoggia i gomiti: quello a sinistra gestisce la videocamera e la calibrazione dell'endoscopio l'altro, posto a destra, governa l'arresto d'emergenza e lo standby del da Vinci. Premendo il tasto di arresto d'emergenza si ha l'immediata disconnessione dei master controllers e nel caso sia necessario convertire l'intervento in open, il sistema può essere rapidamente allontanato dal campo operatorio in pochi minuti mettendolo in modalità standby dopo aver rimosso gli strumenti dall’addome e deconnesse le braccia dai trocar.
Il chirurgo operatore siede alla console, registrabile in altezza, con i gomiti appoggiati su un bracciolo imbottito con la testa appoggiata in un alloggiamento all’interno del quale è presente il binocolo, la cui distanza interoculare può essere anch’essa regolata secondo le necessità individuali.
15 La colonna ha le stesse caratteristiche generali di una colonna laparo/endoscopica standard: comprende il monitor, un insufflatore di CO2, una doppia sorgente di luce ad alta intensità (Intuitive Surgical Inc.) ed 2 videocamere 3 CCD (Insite Vision, Intuitive Surgical Inc.).
Prima che l’intervento abbia inizio è indispensabile eseguire il set-up. La console viene connessa al carrello robotico mediante cavi elettrici e fibre ottiche ed il sistema viene acceso; successivamente, il robot esegue un auto-test di circa 3 minuti, una sorta di check-up automatico per verificare collegamenti ed il funzionamento delle braccia robotiche. Dopo questa sequenza il sistema è attivo ed è possibile rivestire le braccia robotiche con involucri appositi di nylon sterili: in genere questa manovra impegna 2 infermieri per circa 5 minuti. Una volta che la videocamera e l'endoscopio sono stati connessi necessitano di essere calibrati. A questo punto il sistema va quindi in modalità standby autonomamente. Dopo aver assicurato il paziente al letto operatorio nel decubito consono alla procedura chirurgica da eseguire si induce lo pneumoperitoneo, vengono introdotti i trocar robotici e collegate le braccia del da Vinci.
Per eseguire un corretto setting del carrello robotico dobbiamo ricordarci che va posto alle spalle della zona anatomica che dobbiamo operare.
Gli strumenti desiderati vengono inseriti all’interno dei trocar dall'infermiere o dall'assistente lavati al tavolo operatorio. Un sensore a raggi infrarossi posto a livello del poggiatesta della console connette gli strumenti e la videocamera e rende il robot pronto per operare.
Nel sistema è inoltre incorporato un sistema audio con viva-voce grazie al quale l’operatore può dialogare ed impartire ordini al resto dell’equipe durante lo svolgimento della procedura, senza distogliere lo sguardo dal campo operatorio.
16
17 Le novità introdotte in ambito ottico dal sistema da Vinci S sono:
- una maggiore risoluzione delle immagini grazie all’alta definizione;
- un campo visivo maggiore (16:9), proprio dell’alta definizione, che consente di avere una visione periferica del campo operatorio più ampia;
- uno zoom digitale che fornisce 7 livelli di ingrandimento senza alcuna necessità di movimento dell’endoscopio, che viene controllato attraverso i master e visualizzato in una finestra di navigazione periferica.
Nell’ultima versione del sistema sono poi disponibili la funzione Telestration che consente al chirurgo di effettuare annotazioni direttamente sul monitor utilizzando il touch-screen, e la funzione TilePro’s® che fornisce una visione integrata durante le fasi di dissezione tra l’anatomia reale e le ricostruzioni TC del paziente.
RAZIONALE DELLO STUDIO
Molti studi in letteratura hanno cercato di dimostrare se esiste un razionale nell’applicazione della robotica in ambito chirurgico, in modo da delinearne gli aspetti tecnici, clinici e le implicazioni economiche socio-sanitarie.
Questa tesi ha lo scopo di spostare l’attenzione dal paziente al chirurgo: viene comparata la performance chirurgica in termini di attivazione delle aree cerebrali del chirurgo mediante studio di coerenza elettroencefalografica durante l’esecuzione di tasks con l’ausilio del da Vinci vs quella laparoscopica convenzionale.
E’ innegabile che le manovre chirurgiche di dissezione e ricostruttive che in laparoscopia risultano essere molto complesse e faticose sia dal punto di vista mentale che fisico, a causa anche della scarsa ergonomia del chirurgo, con l’ausilio del Da vinci diventano molto più semplici e riproducibili come a cielo aperto.
18 Tuttavia non vi sono però studi pubblicati che ne definiscano la migliore ergonomia, la qualità del gesto chirurgico, il grado di minor stress chirurgico intraoperatorio, né i vantaggi per il paziente. Cerchiamo di dimostrare che l’intervento chirurgico eseguito con il Da Vinci è meno stressante per il chirurgo dal punto di vista dell’impegno cerebrale e motorio e che tutto ciò si riflette su una migliore performance chirurgica, determinando una qualità di cura superiore rispetto alla laparoscopia standard. Ampliando il campo di azione gli studi dei meccanismi neurali coinvolti in compiti visuo-motori, come questo, sta oggi assumendo grande rilievo in ambito neuro-ingegneristico per le molteplici ricadute sia pratiche sia teoriche. Il problema riveste notevole importanza da un punto di vista conoscitivo (per aumentare le conoscenze di base in neurofisiologia), mentre le ricadute pratiche possono riguardare la riabilitazione di pazienti con danni cerebrali, il brain-computer interface e la progettazione di protesi neurali avanzate, utili alla guida di movimenti volontari. Tuttavia, la generazione dell'apprendimento motorio in soggetti sani e patologici è ancora oggetto di indagine e mancano strumenti quantitativi adeguati per l'analisi dei dati e la sintesi delle conoscenze.
MATERIALI E METODI
Grazie al sinergismo dei colleghi Neurologi afferenti alla Sezione Dipartimentale Neurologia Cisanello diretta dal Prof. Sartucci, siamo riusciti ad eseguire le rilevazioni elettroencefalografiche a 12 chirurghi durante l’esecuzione di esercizi con l’ausilio del Da Vinci ed in laparoscopia. Il nostro studio è un lavoro originale in cui si è cercato di valutare quantitativamente, attraverso la rielaborazione dei valori assoluti di coerenza EEG, eventuali differenze nella attivazione di specifiche aree corticali tra soggetti che eseguivano lo stesso compito motorio in laparoscopia o grazie all’ausilio della chirurgia robotica. Lo stesso soggetto è stato invitato a eseguire un semplice task motorio (dare dei punti di sutura) in laparoscopia e in chirurgia robotica, mentre una cuffia da 32 canali registrava il segnale EEG in uscita dallo scalpo; in tal modo, ogni individuo sottoposto allo studio diventava ipso facto controllo di se stesso, rendendo eventuali differenze in termini di
19 età, esperienza chirurgica ed esperienza nel campo della chirurgia robotica assolutamente non significative.
L'EEG è uno strumento diagnostico che misura la registrazione dell'attività elettrica prodotta dal cervello. Il cervello produce correnti elettriche che sono espressione dell'attività propria dei neuroni. I neuroni corticali sono organizzati in modo da formare fasci colonnari ad orientamento perpendicolare alla superficie della corteccia cerebrale, di cui costituiscono le unità funzionali elementari. L'EEG è quindi l'espressione dei processi sinaptici (potenziali elettrici pre- e post-sinaptici).
La tecnologia in campo biomedico ha compiuto negli ultimi anni notevoli progressi nella cura della patologia umana e, in particolare, lo studio dell’ encefalo ha goduto, probabilmente, i maggiori vantaggi in quanto vi sono stati numerosi progressi tecnologici nelle apparecchiature sia per l’ indagine morfologica (TC, RMN) sia funzionale (EEG, Potenziali Evocati, Mapping, PET, SPECT).
Per quanto concerne, poi, lo specifico campo della Neurofisiopatologia di cui ci interessiamo in particolare in questo lavoro, la quantificazione dell’ attività elettrica cerebrale è stato il primo scopo dei ricercatori spingendoli verso sempre maggiori sofisticazioni nello studio dei segnali bioelettrici del cervello. Dopo le prime registrazioni dell’attività elettrica cerebrale da parte di Berger (1928) e l’applicazione al segnale elettrico cerebrale dell’analisi numerica di Fourier da parte di Dietsch, si arriva alla moderna cartografia solo dopo il 1970 con Ueno e Duffy.
Per potere raccogliere le informazioni relative ai potenziali elettrici bisogna applicare degli elettrodi sulla superficie del cranio e possono essere raccolti con due metodi differenti:
• mediante una derivazione monopolare, in cui ogni elettrodo attivo è collegato ad un unico elettrodo indifferente (massa).
20 La configurazione più utilizzata prevede l'applicazione di 19 elettrodi, in posizione fissa, secondo convenzioni internazionali (la più conosciuta è la 10-20 in cui la distanza tra gli elettrodi vicini è pari al 10 % o al 20 % della distanza tra alcuni punti di repere esterni della superficie del cranio). Gli elettrodi vengono poi accoppiati in varie combinazioni che garantiscono di esplorare l'intera superficie cerebrale.
Nel sistema Internazionale di posizionamento 10-20 gli elettrodi vengono applicati sullo scalpo considerando una opportuna distanza tra due punti di repere anatomici: inion, prominenza alla base dell'osso occipitale, e nasion, attaccatura del naso. Tale distanza varia da persona a persona rimanendo in un range che va da 30 a 36 cm. Proprio a causa di questa variabilità personale si utilizzano delle cuffie di materiale elastico in cui sono già posizionati gli elettrodi e che adagiandosi sul cranio mantengono il corretto posizionamento.
Vengono collocati da 10 a 20 elettrodi e una massa, lungo cinque linee: • P1: longitudinale esterna;
• P2: longitudinale interna di destra; • centrale
• P1: longitudinale esterna;
• P2: longitudinale interna di sinistra;
La linea trasversa T4-C4-Cz-C3-T3 viene denominata montaggio P3, ed anch'essa deve seguire la regola del 10-20%.
21 Gli elettrodi fronto-polari sono collocati al 10% della distanza I-N (inion-naison), sopra le sopraciglia, i frontali vengono collocati sulla stessa linea dei fronto-polari, più sopra del 20%, poi vengono i centrali ed infine i parietali e gli occipitali. In questo modo si arriva al 90% della distanza nasion-onion, esattamente ad una distanza del 10% dall'onion.
Alla posizione che ogni elettrodo occupa sullo scalpo fa riferimento una sigla. Le sigle che individuano la posizione di un elettrodo sono formate da una/due lettere, che permettono di identificare la regione della corteccia esplorata (Fp: frontopolare; F: frontale; C: centrale; P: parietale; T: temporale; O: occipitale) e da un numero che identica l'emisfero (numeri dispari: sinistra; numeri pari: destra; z: linea mediana).
Il tracciato EEG è costituito da oscillazioni singole in successione continua. Una successione continua di onde alla stessa frequenza viene definito ritmo.
Se ne distinguono quattro:
• Ritmo Alfa: frequenza compresa tra 8 e 13 Hz, è il più frequente e più rappresentato nelle condizioni di rilassamento e facilità.
• Ritmo Beta: frequenza superiore a 13 Hz, è più rappresentato nel pensiero attivo, calcolo, concentrazione ed attenzione.
22 • Ritmo Theta: frequenza compresa tra 4 e 7 Hz, è presente in corso di stress emotivo (frontale centrale), inspirazione creativa e meditazione, stadio 2 del sommo NREM.
• Ritmo Delta: frequenza inferiore a 4 Hz, è presente nel sonno ad onde lente, meditazione, empatia.
L'EEG di un soggetto normale varia principalmente in relazione all'età ed al livello di vigilanza: minore è l'età e il livello di vigilanza maggiore è l'incidenza dei ritmi lenti.
Con particolari applicazioni delle tecniche elettroencefalografiche si può misurare e registrare l'attività bioelettrica cerebrale e in questo modo è possibile circoscrivere meglio le aree cerebrali responsabili di determinati segnali fisiologici (ritmi cerebrali a riposo e durante compiti motori o cognitivi) o patologici. Mediante particolari tecniche di analisi (analisi spettrale, potenziali evento e movimento correlati, desincronizzazione e sincronizzazione evento correlate dei ritmi EEG, analisi della coerenza EEG) e l'uso di mappe topografiche è possibile descrivere sia localizzazione e decorso temporale di tali attività sia i rapporti funzionali fra diverse aree.
L’avvento di metodiche di analisi ultrasofisticate e lo sviluppo delle co-registrazioni EEG-fMRI hanno permesso di introdurre nel vocabolario neurofisiologico tre diversi concetti relazionabili a quella che definiamo “connettività neuronale”(3):
23 generato in corteccia che si affondano nella sostanza bianca (connessione in serie); 2. la connettività funzionale, ovvero la presenza di regioni ben distanti tra loro sulla
superficie corticale, ma in grado di rispondere a stimoli della stessa natura. Esprime la correlazione temporale fra eventi neurofisiologici distanti spazialmente;
3. la connettività effettiva, che si riferisce agli effetti causali che l’attivazione di una specifica area ha su altre regioni cortico-sottocorticali (connessione in serie), circonvicine o spazialmente separate (per esempio, la PET può individuare variazioni del flusso ematico in aree quali la corteccia temporo-mesiale e i gangli della base); è l’insieme delle influenze, dirette o indirette, che un sistema neurale esercita su un altro. La coerenza EEG misura il grado di ordine dell’attività elettrica cerebrale e fornisce una risposta al seguente interrogativo: “l’attività di una determinata area cerebrale è correlata a quella di un’altra area cerebrale?” Le misurazioni della coerenza vengono ottenute grazie ad una sofisticata analisi computerizzata dei segnali EEG, che consente di confrontare l’attività di due diverse regioni cerebrali e di accertare se vi sia una relazione stabile tra esse, permettendo di determinare quindi in maniera indiretta il loro grado d’integrazione. In altre parole, lo studio di coerenza esprime una stima quantitativa dei concetti di connettività funzionale e connettività effettiva. Da un punto di vista matematico, la funzione coerenza può essere così espressa:
24 Nel presente studio, abbiamo preso in considerazione i due picchi di frequenza ai quali la funzione coerenza, e dunque la somiglianza fra tracce elettroencefalografiche estrapolate da due canali di registrazione differenti, risulta maggiore.
Per capire meglio come funziona l’integrazione tra le varie aree cerebrali possiamo schematizzare il flusso di informazioni tra di esse in questo modo: le aree sensoriali primarie (ad esempio, visiva primaria, acustica primaria, somatosensoriale primaria) proiettano ad aree sensoriali adiacenti all’interno della stessa modalità. Le aree che integrano informazioni all’interno di una singola modalità vengono chiamate aree associative unimodali. Le aree associative unimodali a loro volta proiettano ad aree associative sensoriali polimodali, che integrano informazioni da più di una modalità.
Le aree associative sensoriali polimodali proiettano poi alle aree motorie associative polimodali, localizzate anteriormente nei lobi frontali. Queste pianificano un’appropriata uscita comportamentale ed elaborano i programmi per i movimenti da eseguire. Questi programmi sono inviati alle aree motorie, la premotoria e la motoria primaria, che inviano i segnali ai motoneuroni per l’attuazione dell’uscita motoria.
Le aree associative polimodali sono ritenute il substrato anatomico delle attività cerebrali superiori. Sono tre le aree particolarmente rilevanti:
- l’area associativa posteriore, al confine tra i lobi occipitale, temporale e parietale, che è una aree associativa multisensoriale, implicata nell’attenzione, nel linguaggio e nella percezione. - l’area associativa anteriore (corteccia prefrontale), che è associata con le funzioni esecutive
del comportamento, quali ad esempio la pianificazione del corso delle proprie azioni e l’organizzare eventi in memoria allo scopo di guidare il comportamento.
- l’area associativa limbica, situata lungo le facce mediali degli emisferi cerebrali, è implicata nella memoria e nelle emozioni.
Nel nostro studio sono stati analizzati i valori di coerenza EEG tra i due gruppi (robotico vs laparoscopico) per quel che riguarda i confronti con l’area cerebrale motoria primaria (M1) vs area
25 motoria supplementare (SMA), area sensoriale primaria (S1) vs area motoria supplementare (SMA), area sensoriale primaria (S1) vs area motoria pre-supplementare (pre-SMA) ed area motoria primaria (M1) vs area sensoriale primaria (S1).
L’area della corteccia motoria primaria (M1) che corrisponde all’area 4 di Brodmann controlla direttamente l’esecuzione dei movimenti e possiede dei neuroni con cilindrasse lungo, detti neuroni di Betz, che penetrano nella sostanza bianca.
L’area motoria supplementare (SMA) è posta sulla faccia mediale dell’emisfero frontale e presiede alla coordinazione ed alla pianificazione dei movimenti complessi, cioè quelli che coinvolgono una sequenza di movimenti o la coordinazione dei movimenti.
L’area sensoriale primaria (S1) rappresenta l’organizzazione somatotropica delle afferenze somatosensitive (cutanee) di tutti i distretti del corpo.
L’area motoria pre-supplementare (pre-SMA) ha connessioni prevalentemente con la corteccia prefrontale e pianifica gli aspetti spaziotemporali del movimento.
I sistemi motori sono organizzati in modo gerarchico (su tre livelli) ed in parallelo. Le aree motorie della corteccia cerebrale possono influenzare il midollo spinale sia direttamente che tramite il tronco encefalico. I tre livelli ricevono informazioni sensitive e sono sotto l’influenza di due sistemi sottocorticali indipendenti: i gangli della base ed il cervelletto che, entrambi, agiscono sulla corteccia cerebrale tramite il talamo.
I programmi motori vengono elaborati nelle aree premotorie sulla base delle proprietà degli oggetti (aree visive) e della loro posizione nello spazio (aree parietali) e sono quindi eseguiti dalla corteccia motoria primaria. Il movimento di ogni singola parte del corpo dipende dall’attivazione di popolazioni neuronali nella corteccia motoria e, a seconda del contesto, dalle aree premotorie e parietali del sistema parieto-frontale.
Le prove di abilità chirurgica dovevano essere completate nella stessa maniera e con la medesima sequenza di movimenti a prescindere dalla metodica in uso: il primo esercizio consisteva nel prendere con lo strumento di destra un o-ring in gomma ed inserirlo all’interno di un cono. Questo
26 task motorio doveva essere eseguito sia con la mano destra che con la mano sinistra per un totale di otto volte. Il secondo esercizio motorio consisteva nel passare in maniera sequenziale tre punti all’interno di tre differenti target colorati su di un supporto di gel. Anche in questo caso la procedura doveva essere eseguita bimanualmente, cioè l’ago doveva essere prelevato con lo strumento di sinistra e veniva poi caricato sul portaaghi di destra, veniva passato il punto al centro del primo target, la punta dell’ago veniva afferrata con la pinza di sinistra ed estratta dal target con la destra. La sequenza task motori da eseguire veniva stabilita in maniera randomizzata, in modo tale che i partecipanti non sapevano con quale metodica avrebbero iniziato e concluso la sessione di esercizi.
Il test t di Student ed il test U di Mann-Whitney sono stati utilizzati per le analisi statistiche. I valori di coerenza a picco sono stati quindi ri-analizzati impiegando una ANOVA a due vie. Come soglia di significatività statistica è stata considerata una p<0.05.
27 RISULTATI
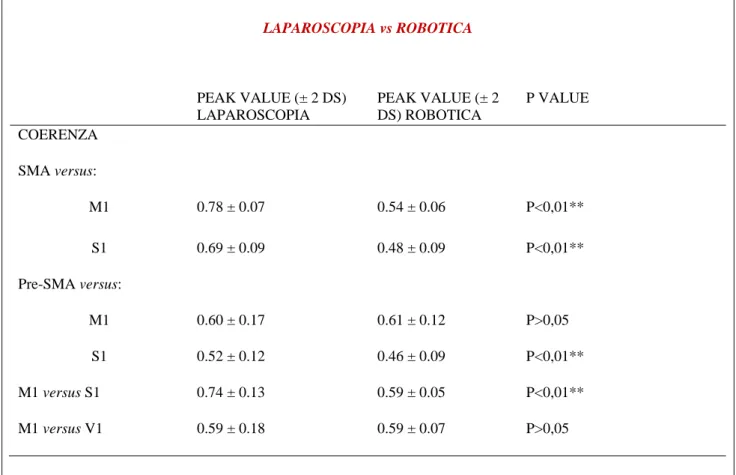
Sono stati analizzati i valori assoluti della funzione di coerenza EEG, confrontando le diverse aree cerebrali precitate, in 2 momenti in cui essa risulta maggiore (picco 1 e 2) ed il valore medio durante l’esecuzione degli esercizi in laparoscopia vs robotica da parte di 10 chirurghi. Più è elevata la coerenza tra aree cerebrali e più il suo valore assoluto si approssima ad 1, più c’è concordanza tra le onde cerebrali di 2 aree diverse, cioè più le onde emesse sono identiche in termini di ampiezza ed altezza, più coerenza esiste tra le aree cerebrali messe a confronto. Sono state messe a confronto prima tutte le aree (M1,S1,pre-SMA e SMA) nello stesso emisfero cerebrale e poi le aree pre-SMA di un lato con le aree M1 ed S1 controlaterali. Come già descritto le aree S1 ed M1 dello stesso emisfero cerebrale sono in contatto diretto tra esse attraverso connessioni corticali dirette e sempre attraverso vie corticali sono connesse con l’area SMA dello stesso lato. A sua volta l’area SMA ha connessioni corticali dirette con l’area pre-SMA dello stesso emisfero, che però non ha collegamenti diretti corticali con M1 ed S1 ipsilaterali, bensì ne possiede interlato tramite vie callosali. Quindi se vogliamo fare un confronto interlato puro dobbiamo raffrontare ad esempio l’area pre-SMA di destra con l’area M1 o S1 di sinistra e viceversa. Dal raffronto ipsilaterale, come possiamo vedere dalla tabella 1-2 e figura 1, abbiamo ottenuto dei dati omogenei in termini di risultato: si può facilmente notare che i valori assoluti di coerenza EEG in laparoscopia sono più alti (cioè si approssimano di più ad 1) rispetto a quelli della chirurgia robotica sia nei due picchi di maggior coerenza che nel loro valore medio con valori di p altamente significativi ad eccezione del raffronto tra area pre-SMA ed M1. In termini pratici c’è un reclutamento maggiore da parte del cervello di più aree cerebrali ipsilaterali che lavorano assieme per eseguire lo stesso compito e quindi c’è un maggior grado di fatica neuronale statisticamente significativo (p <0,01) per completare gli esercizi in laparoscopia rispetto alla robotica.
28 LAPAROSCOPIA
1° PEAK (± 2 DS) 2° PEAK (± 2 DS) PEAK VALUE (± 2 DS)
COERENZA SMA versus: M1 0.80 ± 0.07 0.77 ± 0.08 0.78 ± 0.07 S1 0.70 ± 0.1 0.69 ± 0.09 0.69 ± 0.09 Pre-SMA versus: M1 0.62 ± 0.17 0.59 ± 0.18 0.60 ± 0.17 S1 0.54 ± 0.12 0.49 ± 0.13 0.52 ± 0.12 M1 versus S1 0.76 ± 0.14 0.72 ± 0.13 0.74 ± 0.13 M1 versus V1 0.61 ± 0.17 0.57 ± 0.19 0.59 ± 0.18 CHIRURGIA ROBOTICA
1° PEAK (± 2 DS) 2° PEAK (± 2 DS) PEAK VALUE (± 2 DS)
COERENZA SMA versus: M1 0.55 ± 0.06 0.53 ± 0.05 0.54 ± 0.06 S1 0.49 ± 0.09 0.47 ± 0.1 0.48 ± 0.09 Pre-SMA versus: M1 0.65 ± 0.15 0.57 ± 0.09 0.61 ± 0.12 S1 0.48 ± 0.1 0.44 ± 0.1 0.46 ± 0.09 M1 versus S1 0.61 ± 0.08 0.58 ± 0.09 0.59 ± 0.05 M1 versus V1 0.50 ± 0.06 0.48 ± 0.07 0.59 ± 0.07
Valori assoluti della funzione coerenza espressi per il primo ed il secondo picco (ovvero per le frequenze temporali alle quali la concordanza dei due tracciati è maggiore) e loro valore medio. La tabella in alto riporta i valori per i vari confronti negli esperimenti eseguiti in laparoscopia, mentre la tabella in basso quelli, visibilmente più bassi eccezion fatta per il confronto pre-SMA vs M1, ottenuti dalle registrazioni in chirurgia robotica.
29 LAPAROSCOPIA vs ROBOTICA PEAK VALUE (± 2 DS) LAPAROSCOPIA PEAK VALUE (± 2 DS) ROBOTICA P VALUE COERENZA SMA versus: M1 0.78 ± 0.07 0.54 ± 0.06 P<0,01** S1 0.69 ± 0.09 0.48 ± 0.09 P<0,01** Pre-SMA versus: M1 0.60 ± 0.17 0.61 ± 0.12 P>0,05 S1 0.52 ± 0.12 0.46 ± 0.09 P<0,01** M1 versus S1 0.74 ± 0.13 0.59 ± 0.05 P<0,01** M1 versus V1 0.59 ± 0.18 0.59 ± 0.07 P>0,05 Tabella 2.
Figura 1. Valore assoluto della funzione coerenza nella prova in laparoscopia (in alto) e nella registrazione durante l’esecuzione della procedura in chirurgia robotica (grafici in basso) nello stesso soggetto. Si noti l’aumento dei valori nel primo caso in tutti i confronti, eccezion fatta per il raffronto fra l’area pre-motoria supplementare (pre-SMA) e l’area motoria primaria (M1).
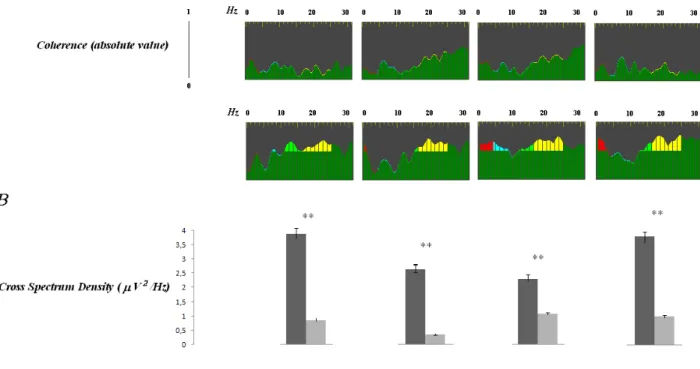
30 Nel confronto interlato, come possiamo vedere dalla tabella 3-4 e figura 2A, dove abbiamo messo a confronto con lo stesso metodo l’area pre-SMA di destra con le aree M1 ed S1 di sinistra, la chirurgia robotica possiede valori assoluti di coerenza EEG più elevati rispetto alla laparoscopia con p value altamente significativo. In pratica le suddette aree vengono attivate contemporaneamente e maggiormente per eseguire un determinato esercizio in chirurgia robotica rispetto alla laparoscopia. Le aree pre-SMA e le aree M1 ed S1 controlaterali sono in contatto tramite circuiti callosali, attraverso i quali è noto da studi clinici che l’elaborazione e la trasmissione dei dati avviene in maniera più rapida, con breve latenza e durata nell’esecuzione del compito rispetto alle connessioni intercorticali. Essendo la via callosale un via più rapida, quindi una via preferenziale attraverso cui la corteccia riesce a lavorare più velocemente (Figura 5). Pertanto anche nel confronto interlato in chirurgia robotica c’è un minor grado di affaticamento neuronale statisticamente significativo (p <0,01) rispetto alla laparoscopia
CONFRONTO INTERLATO
1° PEAK (± 2 DS) 2° PEAK (± 2 DS) PEAK VALUE (± 2 DS)
COERENZA Right pre-SMA versus left M1:
laparoscopia 0.46 ± 0.08 0.51 ± 0.12 0.48 ± 0.1
chirurgia robotica 0.65 ± 0.04 0.64 ± 0.09 0.65 ± 0.07
Right pre-SMA versus left S1:
laparoscopia 0.49 ± 0.1 0.45 ± 0.12 0.48 ± 0.11
chirurgia robotica 0.71 ± 0.11 0.65 ± 0.08 0.68 ± 0.1
Valori assoluti della funzione coerenza espressi per il primo ed il secondo picco e loro valore medio al confronto interlato fra l’area pre-motoria supplementare di un lato e l’area motoria primaria (in alto) e l’area somatosensoriale primaria (in basso) del lato opposto. Si notino, al contrario di quanto emerso al confronto ipsilaterale, i valori significativamente più elevati della funzione coerenza nelle registrazioni in chirurgia robotica.
31 CONFRONTO INTERLATO
PEAK VALUE (± 2 DS) P VALUE
COERENZA Right pre-SMA versus left M1:
laparoscopia 0.48 ± 0.1 P<0,01**
chirurgia robotica 0.65 ± 0.07 P<0,01**
Right pre-SMA versus left S1:
laparoscopia 0.48 ± 0.11 P<0,01**
chirurgia robotica 0.68 ± 0.1 P<0,01**
Tabella 4.
Figura 2. A -Valore assoluto della funzione coerenza nella prova in laparoscopia (in alto) e nella registrazione durante l’esecuzione della procedura in chirurgia robotica (grafici in basso), nello stesso soggetto al confronto interlato: l’area pre-motoria supplementare di un lato è stata confrontata con le aree motoria e somatosensoriale primarie del lato opposto. Si noti l’aumento dei valori in tutti i casi, nelle prove in chirurgia robotica rispetto alle condizioni in laparoscopia, esattamente all’opposto di quanto avviene al confronto fra aree corticali ipsilaterali
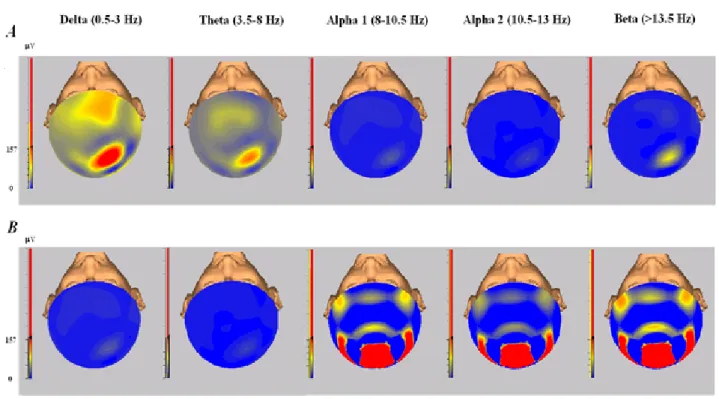
32 Se andiamo ad analizzare le mappe di frequenza allo scalpo nello stesso soggetto mentre veniva eseguito il task per via laparoscopia e mentre eseguiva la stesso compito motorio in chirurgia robotica abbiamo una rappresentazione grafica più evidente di tutto quello che fino ad ora abbiamo detto (Figura 3). Le frequenze cerebrali più rappresentate nella robotica sono quelle di banda alfa e beta sulle regioni posteriori e temporocentrali, a maggior frequenza ed a breve latenza tipiche di un minore affaticamento neuronale, mentre nella laparoscopia sono maggiormente rappresentate le frequenze theta e delta, a minor frequenza ed a maggior latenza confermando un maggiore affaticamento neuronale. Tutti questi risultati vengono mostrati nella tabella ad istogrammi riassuntiva a seguito (Figura 4).
Figura 3. Esempi di mappe di frequenza nello stesso soggetto, mentre eseguiva il task in chirurgia laparoscopica (A, in alto) e mentre eseguiva lo stesso compito motorio con l’ausilio del robot (B, immagini in basso). Meritevole di nota è la maggiore rappresentazione delle frequenze di banda alfa e beta sulle regioni posteriori e temporo-centrali nel secondo caso.
33 Figura 4. Rappresentazione grafica dei dati riportati nelle tabelle precedenti. In alto gli istogrammi mostrano i valori assoluti di coerenza fra le varie aree per il confronto ispilaterale; le colonne grigie scure rappresentano i valori ottenuti dalle
registrazioni in chirurgia laparoscopica, quelle più chiare i valori ottenuti durante l’esecuzione del task motorio con l’ausilio del robot (M1 = area motoria primaria; S1 = area somatosensoriale primaria; V1 = area visiva primaria; SMA = area supplementare motoria; Pre-SMA = area pre-supplementare motoria). In basso, invece (B) è riportato espresso in Hz il valore di frequenza temporale dei due picchi principali ai quali si raggiunge il massimo valore assoluto della funzione coerenza: si noti come nelle acquisizioni in chirurgia robotica siano maggiormente rappresentate le frequenze rapide ed ultrarapide di banda alfa e beta (* p<0.05; **p<0.01).
34 Figura 5. Coerenza interemisferica. In alto (A) gli istogrammi mostrano i valori assoluti di coerenza fra le varie aree per il confronto fra aree non omologhe controlaterali (M1 = area motoria primaria; S1 = area somatosensoriale primaria; Pre-SMA = area pre-supplementare motoria); le colonne grigie scure rappresentano i valori ottenuti dalle registrazioni in chirurgia
laparoscopica, quelle più chiare i valori ottenuti durante l’esecuzione del task motorio con l’ausilio del robot. In basso (B) è riportato espresso in Hz il valore medio di frequenza temporale dei due picchi principali ai quali si raggiunge il massimo valore
assoluto della funzione coerenza. Al contrario di quanto emerso al confronto ipsilaterale, i valori assoluti di coerenza EEG sono
35 CONCLUSIONI
Nel presente studio sono state evidenziate importanti differenze nei valori di coerenza EEG tra i due gruppi (laparoscopico vs robotico) per quel che riguarda i confronti M1 vs SMA, S1 vs SMA, S1 vs pre-SMA e M1 vs S1 (p<0.01); tali dati sembrerebbero suggerire che i soggetti che operano in laparoscopia reclutano contemporaneamente molteplici aree cerebrali per eseguire lo stesso task motorio, come se il cervello fosse costretto a lavorare più intensamente, più a lungo e ad affaticarsi prima per ottenere lo stesso risultato. Tale conclusione potrebbe essere supportata dal fatto che non esistono differenze statisticamente significative fra i valori assoluti di coerenza EEG fra l’area motoria primaria (M1) e l’area pre-motoria supplementare (pre-SMA) ipsilaterale; secondo quanto emerge da precedenti studi (4, 5), infatti, tali aree non presentano connessioni in parallelo, ma la loro attivazione reciproca è unicamente modulata da complessi circuiti cortico-talamici: pertanto, i valori di coerenza non si discostano molto in quanto la frequenza di scarica dei neuroni piramidali nelle due regioni sarebbe costantemente regolata dallo stesso trigger sottocorticale. I maggiori valori di coerenza spettrale per quanto concerne gli esperimenti eseguiti in chirurgia robotica sono stati evidenziati per le alte frequenze, nelle bande alfa e beta; al contrario, l’esecuzione dello stesso compito motorio in chirurgia laparoscopica sembra accompagnarsi alla slatentizzazione di basse frequenze temporali, anche se non è da escludere la possibilità che alcune tracce siano state significativamente parassitate dai numerosi artefatti da movimento oculare. Tipicamente, si ritiene che frequenze rapide ed ultrarapide originino dalla corteccia motoria pre-centrale e si potenzino sia durante l’esecuzione sia nel corso della semplice osservazione di un gesto, insinuando il forte sospetto che le procedure robotiche siano maggiormente in grado di attivare la complessa circuiteria prefrontale dei mirror neurons (4, 7). Si potrebbe facilmente contestare che la maggiore durata degli esperimenti in laparoscopia abbia inevitabilmente condizionato le variazioni in termini di coerenza EEG, falsando l’interpretazione dei dati: in realtà tale possibilità viene esclusa sia dalla mancanza, in accordo con i dati neuroanatomici in nostro possesso, di significative modificazioni al confronto fra l’area motoria primaria e l’area pre-SMA, sia dall’inversione dei risultati al confronto interlato.
36 Un’ulteriore limitazione potrebbe essere costituita dalla non ottimale risoluzione spaziale dell’analisi di coerenza a partire da mappe EEG, a causa di fenomeni di volume condotto; se da un lato non è ovviamente possibile eseguire in soggetti normali una registrazione elettrocorticografica, dall’altro è utile ricordare che nel presente studio è stato impiegato un innovativo sistema di registrazione EEG ad alta frequenza che, seppur non del tutto, contribuisce a ridurre significativamente i limiti legati alla scarsa risoluzione spaziale delle tecniche elettrofisiologiche tradizionali. È auspicabile nel prossimo futuro un ulteriore miglioramento del protocollo di studio, grazie per esempio all’aumento del numero dei canali elettroencefalografici o all’adozione di metodiche di co-registrazione EEG-fMRI.
Curiosa e meritevole di segnalazione è invece la differenza (p<0.01) riscontrata per quel che pertiene il raffronto fra l’area somatosensoriale primaria e l’area pre-motoria supplementare: gli stessi studi citati in precedenza sostengono che fra tali regioni non esistono connessioni dirette, ma solo connessioni mediate da nuclei di relè talamico. Tuttavia, studi successivi hanno contestato tale ipotesi e hanno evidenziato che potrebbero esistere anche connessioni in parallelo, tali da spiegare nel caso specifico la presenza di differenze significative nei due gruppi posti a confronto (7, 8). La nostra ricerca, quindi, supporta indirettamente l’idea che fra le aree S1 e pre-SMA esistano collegamenti diretti e non solo intermediati da nuclei sottocorticali.
Si potrebbe facilmente contestare che gli elevati valori di coerenza fra aree non omologhe ipsilaterali siano determinati dal reclutamento di comuni circuiti sottocorticali che sincronizzano l’attività dei centri superiori; tale ipotesi sembra esclusa dal rapporto inversamente proporzionale fra valori di coerenza e frequenze alle quali tali valori risultano maggiormente espressi, nonché dalla netta prevalenza delle alte frequenze, tipicamente espressione dell’attivazione di connessioni intracorticali. Inoltre, è significativo che i valori di coerenza non si modifichino significativamente esaminando aree, quali la pre-motoria supplementare e la motoria primaria, fra le quali non sussistono connessioni in parallelo ma solo connessioni in serie attraverso nuclei di relè talamico.
37 Una terza intrigante conclusione a cui il nostro studio è giunto concerne l’attivazione di aree omologhe e non omologhe controlaterali: abbiamo posto a confronto i valori di coerenza EEG fra l’area motoria primaria di un lato e l’area pre-motoria supplementare controlaterale. In tal caso, come già accennato, è possibile isolare completamente il contributo offerto al processamento del segnale corticale da parte delle fibre di connessione interemisferica, poiché le due aree non sono direttamente collegate se non attraverso strutture sottocorticali. In termini neurofisiologici, l’attività elettrica dei due emisferi può sincronizzarsi o grazie ad un input talamico diretto che coordina l’attività dei centri superiori o in virtù di un’attivazione riverberante fra aree omologhe e non omologhe controlaterali. Al contrario di quanto emerso al confronto ipsilaterale, i valori assoluti di coerenza EEG sono risultati maggiori nelle registrazioni ottenute in chirurgia robotica; si potrebbe pertanto arguire che l’esecuzione di uno specifico compito in chirurgia robotica attivi preferenzialmente le afferenze trans-callosali. Classicamente, i fenomeni di plasticità interemisferica, a differenza dei più complessi processi di plasticità sinaptica intracorticale, presentano una più breve latenza di comparsa e una più rapida esauribilità. I fenomeni di coerenza interemisferica, inoltre, sono specifici per stimolo, area esplorata e frequenza temporale (7, 8). Si potrebbe pertanto immaginare, interponendo tali concetti ai dati emersi dal presente studio, che l’esecuzione di una procedura interventistica in chirurgia robotica sia di più facile e rapido apprendimento per il nostro cervello, senza che sia necessario alcun tipo di training cognitivo o di feed-back somatosensoriale, ottimizzando quindi il tempo a disposizione del chirurgo in sala operatoria e riducendo significativamente gli anni di apprendistato del giovane medico.
In considerazione della complessità del protocollo di ricerca e della assoluta novità dei dati esposti, saranno necessari ulteriori studi al fine di confermare i risultati ottenuti.
38 BIBLIOGRAFIA
1. Lanfranco AR, Castellanos AE, Desai JP, Meyers WC. Robotic surgery: a current
perspective. Ann Surg. 2004;239(1):14-21.
2. Satava RM. Surgical robotics: the early chronicles: a personal historical perspective. Surg
Laparosc Endosc Percutan Tech. 2002;12(1):6-16.
3. Wasserman, E., C.M. Epstein, and U. Ziemann, The Oxford handbook of transcranial
stimulation. Oxford handbooks series. 2008, Oxford ; New York: Oxford University Press.
xiv, 747 p.
4. Rizzolatti, G., G. Luppino, and M. Matelli, The organization of the cortical motor system:
new concepts. Electroencephalogr Clin Neurophysiol, 1998. 106(4): p. 283-96.
5. Contreras, D., et al., Control of spatiotemporal coherence of a thalamic oscillation by
corticothalamic feedback. Science, 1996. 274(5288): p. 771-4.
6. Hari, R., et al., Activation of human primary motor cortex during action observation: a
neuromagnetic study. Proc Natl Acad Sci U S A, 1998. 95(25): p. 15061-5.
7. Rodriguez, E., et al., Perception's shadow: long-distance synchronization of human brain
activity. Nature, 1999. 397(6718): p. 430-3.
8. Ohara, S., et al., Increased synchronization of cortical oscillatory activities between human
supplementary motor and primary sensorimotor areas during voluntary movements. J
Neurosci, 2001. 21(23): p. 9377-86.
9. Knyazeva, M.G., et al., Visual stimulus-dependent changes in interhemispheric EEG
coherence in humans. J Neurophysiol, 1999. 82(6): p. 3095-107.
10. Zaehle, T. and C.S. Herrmann, Neural synchrony and white matter variations in the human
brain--relation between evoked gamma frequency and corpus callosum morphology. Int J