A mio nonno Giuseppe... ...a mia zia Caterina
Indice
Sommario 1
1 Introduzione 2
1.1 Prognosi delle displasie scheletriche . . . 3
1.2 Embriogenesi delle displasie scheletriche . . . 4
1.3 Diagnosi ecografica prenatale di displasie scheletriche . . . 5
1.4 Tecnica ecografica per la valutazione delle displasie scheletriche . . . . 6
1.5 Il ruolo dell’ecografia tridimensionale nella diagnosi prenatale di di-splasie scheletriche . . . 10
1.6 Il ruolo della tomografia computerizzata tridimensionale nello studio delle displasie scheletriche . . . 12
2 Scopo della tesi 14 3 Pazienti e metodi 15 4 Risultati 17 4.1 Caratteristiche delle gravidanze studiate . . . 17
4.2 Tecnica diagnostica per escludere una diagnosi di ricorrenza . . . 18
4.3 Indicazione all’esame ecografico di II livello . . . 18
4.4 Reperto ecografico di femore corto . . . 19
4.5 Reperto ecografico di demineralizzazione e forma anomala del cranio . 20 4.6 Reperto ecografico di fratture . . . 20
4.7 Reperto ecografico di estremit`a anomale . . . 20
4.8 Reperto ecografico di torace stretto . . . 21
4.9 Reperto ecografico di anomalie della colonna . . . 21
4.10 Reperto ecografico di trigono dilatato . . . 22
4.11 Reperto ecografico di plica nucale aumentata e cariotipo . . . 22
4.12 Reperto ecografico di polidramnios . . . 23
4.13 Reperto ecografico di displasia scheletrica associata ad anomalie ex-trascheletriche . . . 23
4.14 Reperto ecografico tridimensionale . . . 23
4.15 Et`a Gestazionale alla Diagnosi . . . 24
INDICE ii 4.16 Concordanza tra diagnosi clinica postnatale o autoptica e diagnosi
molecolare . . . 24
5 Discussione 26
5.1 Diagnosi di ricorrenza nelle gravidanze successive . . . 27 5.2 Aspetti ecografici delle displasie scheletriche . . . 28 5.3 Il supporto dell’ecografia tridimensionale alla diagnosi prenatale di
displasie scheletriche . . . 32 5.4 Diagnosi clinica e/o autoptica e diagnosi di biologia molecolare . . . . 33
Tabelle 35
Figure 42
Ringraziamenti 64
Sommario
Le displasie scheletriche sono un gruppo di oltre 400 patologie rare, a prognosi variabile e diverso rischio di ricorrenza. Scopo del presente lavoro `e stato rivedere la casistica degli ultimi 30 anni in un singolo Centro di riferimento di ecografia ostetrica, per valutare le possibilit`a di diagnosi prenatale alle diverse et`a gestazionali. Sono stati inclusi nello studio 29 feti riferiti per sospetto di malformazione e 11 feti di donne che avevano avuto un precedente feto con displasia scheletrica (2 casi di ricorrenza). Due neonati sono sopravvisuti, si sono avute 3 morti perinatali, in 18 casi la donna ha richiesto l’interruzione volontaria di gravidanza; gli ultimi 2 casi sono persi al follow-up. Le diagnosi erano: displasia tanatofora (n=8), osteogenesi imperfecta di tipo II (n=4), acondroplasia (n=3), sindrome di Shwachman-Diamond (n=2), disostosi spondilocostale (n=2) ed un caso ognuno di sindrome di Apert, ipocondrogenesi, ipofosfatasia ed ipostaturismo familiare. In 8 casi non `e stato possibile effettuare una diagnosi esatta. La diagnosi `e stata confermata con biologia molecolare in 13 casi, di cui 3 in epoca prenatale. Aspetti ecografici particolari erano riscontrabili nei casi di ipomineralizzazione, in 2/3 di acondroplasia (soltanto nel 3° trimestre), nei 2 di disostosi spondilocostale e nella sindrome di Apert.
Capitolo 1
Introduzione
Le osteocondrodisplasie, o displasie scheletriche sono un gruppo eterogeneo di pa-tologie che coinvolgono lo sviluppo del tessuto osteo-condrale, causando una serie di anomalie di forma, sviluppo e/o integrit`a dei vari segmenti dello scheletro. Possono far parte di complessi sindromici oppure essere limitate al solo apparato scheletrico (Schramm e coll., 2009).
Le displasie scheletriche sono patologie rare, complessivamente la loro incidenza `
e di circa 2.3-3.2 su 10.000 nati; va aggiunto che l’incidenza nei concepiti `e maggiore se si considera che molte osteocondrodisplasie congenite sono letali gi`a prima della nascita (Gon¸calves e coll., 2004).
Per le caratteristiche estremamente eterogenee, sia genetiche che cliniche delle displasie scheletriche, grazie al Nosology Group of the International Skeletal Dyspla-sia Society, nel 1960 `e stato possibile raggiungere un accordo sulla nomenclatura di queste patologie che a quel tempo venivano chiamate “costituzionali (o intrinseci) disturbi dell’osso” (Warman e coll., 2010).
Nel corso degli ultimi 30 anni, la classificazione delle displasie scheletriche si `e molto evoluta: se prima era basata su una descrizione clinica e radiologica, oggi include anche le caratteristiche molecolari, ovviamente per quelle displasie di cui il difetto genetico `e conosciuto (Gon¸calves e coll., 2004).
Nella pi`u recente revisione del 2010 della Nosology and Classification of Genetic Skeletal Disorders sono state incluse 456 differenti patologie, raggruppate in 40 gruppi in base ai criteri molecolari, biochimici e/o radiografici. Il raggruppamento dei disturbi `e necessario a causa del gran numero di patologie incluse ed `e utile per fare una diagnosi differenziale in base ai principali caratteri fenotipici (Warman e coll., 2010).
I criteri utilizzati per l’inclusione di singole patologie in determinati raggruppa-menti sono rimasti immodificati rispetto alla precedente revisione del 2006. Essi sono:
• Il significativo coinvolgimento scheletrico, in base al quale la displasia schele-trica `e definita come disordine metabolico dell’osso, disostosi, sindromi malfor-mative e/o di riduzione dello scheletro.
Capitolo 1. Introduzione 3 • Pubblicazione in MIM (“Mendelian Inheritance in Man”).
• Basi genetiche comprovate dall’albero genealogico o fortemente supportate dal-l’omogeneit`a fenotipica in famiglie non correlate.
• Autonomia nosologica confermata dalle analisi molecolari e/o dalla presenza di caratteristiche diagnostiche distintive e dall’osservazione in molteplici individui oppure all’interno delle famiglie (Warman e coll., 2010).
Per semplificare l’approccio clinico, tradizionalmente le displasie scheletriche posso-no essere classificate come letali e posso-non-letali.
1.1
Prognosi delle displasie scheletriche
La distinzione tra forme letali e non letali di displasia scheletrica `e di fondamentale importanza clinica. Un’accurata ecografia prenatale `e in grado di predire la progno-si nel 91%-100% dei caprogno-si. Il rapporto lunghezza femore/circonferenza addominale < 0.16 indica una prognosi letale; ugualmente, l’ipoplasia polmonare, conseguente alla presenza di torace stretto, suggerisce una prognosi infausta (Hall e coll., 2012; Krakow e coll., 2009).
Tuttavia, non tutte le displasie scheletriche associate ad una riduzione della circonferenza toracica comportano una mortalit`a immediata (Krakow e coll., 2009). Le displasie scheletriche letali possono essere associate a idrope fetale, grave po-lidramnios e anomalie viscerali concomitanti che coinvolgono principalmente il di-stretto renale, cardiaco e cerebrale, e che contribuiscono ad aggravare il quadro clinico (Gon¸calves e coll., 2004; Krakow e coll., 2009).
Le displasie scheletriche non letali costituiscono un gruppo molto pi`u eterogeneo di anomalie scheletriche che interessano soprattutto gli arti e le estremit`a (Schramm e coll., 2009).
Ci`o pu`o comportare un ritardo nella diagnosi delle forme non-letali rispetto alle forme letali, ad esempio nell’acondroplasia si pu`o riscontrare una biometria fetale nella norma fino al 3° trimestre di gravidanza. Il ritardo nella diagnosi delle di-splasie scheletriche `e un problema che pu`o compromettere l’adeguata gestione della gravidanza (Gon¸calves e coll., 2004).
Molte donne con un feto affetto da displasia scheletrica decidono di non portare a termine la gravidanza, in questi feti `e necessario intraprendere un’appropriata valutazione radiografica postmortem e una valutazione autoptica (Krakow e coll., 2009).
Quando la paziente decide di portare a termine la gravidanza `e necessario un accurato management perinatale e postnatale: a causa della macrocefalia, spesso presente, si pu`o optare per un parto cesareo e si pu`o programmare un intervento di rianimazione post natale poich’e molti feti, anche con displasie scheletriche non letali, possono andare incontro a compromissione respiratoria subito dopo la nascita. Alla luce delle informazioni della diagnosi prenatale una decisione preventiva sulla
Capitolo 1. Introduzione 4 gestione e sulla modalit`a del parto con genetisti, neonatologi, ostetrici migliora il management postnatale di questi feti (Krakow e coll., 2009).
La diagnosi di certezza di displasia scheletrica viene fatta in epoca postnatale tramite un esame clinico del neonato che evidenzier`a i tratti dismorfici, le dispro-porzioni e le deformit`a. Deve essere eseguita un’indagine radiografica in proiezione antero-posteriore e latero-laterale. In caso di morte fetale o perinatale, l’esecuzio-ne della radiografia pu`o diventare pi`u difficoltosa, soprattutto nei feti molto piccoli (Hall e coll., 2012).
1.2
Embriogenesi delle displasie scheletriche
Lo scheletro umano si sviluppa e matura nel corso dell’intera gravidanza, la sua organogenesi si realizza, tuttavia, nel corso del primo trimestre di gestazione (Olsen e coll., 2000). In particolare la formazione dello scheletro dipende da cellule che derivano in parte dal mesenchima parassiale e in parte dalla cresta neurale (per la volta cranica e lo splancnocranio). La morfogenesi `e determinata da una serie di programmi molecolari che si sovrappongono e regolano i processi riguardanti la posizione, la differenziazione, il modellamento, la proliferazione, la rigenerazione e l’apoptosi cellulare (Hall e coll., 2012).
Dalla 6asettimana sono presenti gli abbozzi degli arti superiori e poco dopo anche quelli degli arti inferiori, essi crescono e si differenziano con una specifica sequenza, procedendo dai segmenti prossimali a quelli distali. A 8 settimane di gestazione tutte le strutture scheletriche hanno una matrice cartilaginea, si pu`o quindi individuare la conformazione iniziale dei vari segmenti scheletrici, la cui struttura, per`o, sar`a meglio definita quando inizia l’ossificazione (Olsen e coll., 2000).
I meccanismi di ossificazione sono due:
- ossificazione membranosa, in cui la formazione del tessuto osseo origina diretta-mente dal mesenchima;
- ossificazione cartilaginea o encondrale, in cui il processo che parte dal mesenchi-ma e arriva alla formesenchi-mazione del tessuto osseo prevede un passaggio cartilagineo (Hall e coll., 2012; Olsen e coll., 2000).
Lo scheletro assiale e quello appendicolare vanno incontro ad ossificazione en-condrale, mentre il cranio, le porzioni della clavicola e dell’osso pubico ossificano mediante ossificazione membranosa (Olsen e coll., 2000).
Il tessuto osseo si forma e si sviluppa attraverso un processo che comprende la produzione della matrice ossea da parte degli osteoblasti ed il riassorbimento da parte degli osteoclasti. Gli osteoblasti derivano da cellule mesenchimali multipotenti che poi si differenziano in cellule del tessuto osseo di rivestimento ed in osteociti. Gli osteoclasti originano dai precursori cellulari ematopoietici, comuni a monociti e macrofagi (Hall e coll., 2012; Olsen e coll., 2000).
Capitolo 1. Introduzione 5 L’ossificazione si verifica relativamente presto durante l’epoca gestazionale: cla-vicola e mandibola ossificano a 8 settimane, lo scheletro appendicolare a 12 setti-mane, e le ossa metatarsali e metacarpali si ossificano tra la 12a e la 16a settimana di gestazione (Hall e coll., 2012; Larson e coll., 1993).
I centri di ossificazione secondaria compaiono a livello epifisario verso la 20a settimana: sono visibili il nucleo di ossificazione distale del femore e il nucleo di ossificazione prossimale della tibia come aree iperecogene (Van Zalen-Sprock e coll., 1997).
1.3
Diagnosi ecografica prenatale di displasie
sche-letriche
Precedentemente all’uso degli ultrasuoni in medicina le anomalie scheletriche era-no raramente ricoera-nosciute in utero, talvolta per pura casualit`a. Occasionalmente ve-nivano diagnosticate nel 3° trimestre di gravidanza usando la radiografia prenatale (Hall e coll., 2012).
Oggi, la valutazione ecografica del feto per rilevare anomalie congenite `e diventata una pratica standard e la misurazione del femore e la visualizzazione delle ossa lunghe sono considerate parte integrante dell’esame ecografico del 2° trimestre.
Nonostante i recenti progressi dell’imaging, una diagnosi prenatale accurata delle displasie scheletriche rimane una sfida clinica (Gon¸calves e coll., 2004).
Tra i fattori che rendono difficoltosa la diagnosi prenatale troviamo la numerosit`a delle displasie scheletriche, la loro variabilit`a fenotipica, la presenza di caratteristiche sovrapposte, la mancanza in alcuni casi di una precisa diagnosi molecolare, la varia-bilit`a di presentazione nelle diverse epoche gestazionali, e l’esperienza dell’ecografista (Dighe e coll.,2008; Cassart, 2010).
Non `e possibile un approccio diagnostico sistematico e uguale per tutti i ca-si in quanto l’epoca della diagnoca-si `e fortemente influenzata dal tipo di displasia scheletrica.
L’et`a gestazionale in cui si riscontrano le prime caratteristiche ecografiche di di-splasia scheletrica `e compresa in un ampio range che va dalla 12a alla 34a settimana di gestazione. In alcuni casi, come nell’acondrogenesi, la diagnosi pu`o essere gi`a effettuata tra la 11a e la 16a settimana di gestazione; in altri casi, come nell’a-condroplasia, la diagnosi si effettua al 3° trimestre di gravidanza (Schramm e coll., 2009).
La diagnosi prenatale `e pi`u facile in presenza di una storia familiare positiva e una precisa descrizione fenotipica dal momento che molte patologie sono ereditate con modalit`a autosomica dominante o recessiva (Gon¸calves e coll., 2004; Khalil e coll., 2011).
Tuttavia, non `e raro che il primo sospetto di displasia scheletrica si ponga durante un esame ecografico di routine in cui viene rilevata la brevit`a delle ossa lunghe (Gon¸calves e coll., 2004; Krakow e coll., 2009; Papageorghiou e coll., 2008).
Capitolo 1. Introduzione 6 Un femore corto all’ecografia del 2° trimestre pu`o essere una normale caratteristi-ca del feto, un indice di malformazione, un marker di aneuploidia, oppure il primo segno di una restrizione della crescita fetale (Papageorghiou e coll., 2008).
Studi recenti hanno notato che un femore corto isolato durante il 2° trimestre di gravidanza pu`o essere associato ad un feto con ritardo di crescita intrauterino (IUGR), conseguenza di un’insufficienza uteroplacentare rilevabile al Doppler. Il femore corto non isolato pu`o essere la spia di diversi quadri malformativi, anche associati ad aneuploidie, soprattutto la trisomia 18 e la trisomia 13, e pu`o indicare una displasia scheletrica. In quest’ultimo caso `e stato visto che la lunghezza del femore tende ad essere ancora pi`u corta rispetto ad un quadro severo di IUGR. Quindi in prima analisi, quando si riscontra un femore corto, `e necessario stabilire la coesistenza o meno con altre anomalie fetali o con alterazioni al Doppler uterino (Papageorghiou e coll., 2008).
I feti che presentano una misura delle ossa lunghe <5° percentile o molto al di sotto di 3 deviazioni standard (SD) rispetto alla media (M) e/o con una circonfe-renza cranica >75° percentile, devono essere sottoposti ad attenta valutazione della biometria e dell’anatomia fetale includendo l’ecocardiografia e il Doppler delle arte-rie uterina e ombelicale. Un indice di resitenza (IR) >0.58 al Doppler uterino e un indice di pulsatilit`a (PI) >90°percentile sono considerati anomali (Hall e coll., 2012; Todros e coll., 2004).
1.4
Tecnica ecografica per la valutazione delle
di-splasie scheletriche
In caso di sospetta displasia scheletrica lo studio ecografico va proseguito secondo un protocollo preciso valutando in maniera sistematica le immagini delle ossa lunghe, del torace, delle mani e dei piedi, del cranio e della colonna (Schramm e coll., 2009; Dighe e coll., 2008; Yeh e coll., 2011).
Ossa Lunghe
Devono essere valutate le ossa lunghe di tutti e quattro gli arti, quando `e presente l’accorciamento di un arto deve essere definito il segmento coinvolto (Dighe e coll., 2008).
L’accorciamento di un arto viene classificato come rizomelico o prossimale (femore ed omero), mesomelico o intermedio (tibia e perone, radio e ulna), acromelico o distale (piede e mano) (Cassart, 2010).
L’assenza di un intero arto `e definita amelia, quella di pi`u arti diamelia, triamelia, tetramelia. Si definisce focomelia l’assenza dei segmenti rizomelico e mesomelico, con un segmento acromelico attaccato al tronco (Dighe e coll., 2008).
Emimelia `e la condizione in cui il difetto `e confinato ad un solo lato. Per mi-cromelia si intende, invece, il grave accorciamento di un arto (Dighe e coll., 2008; Cassart, 2010).
Capitolo 1. Introduzione 7 I quattro arti da un punto di vista qualitativo devono essere valutati per presen-za/assenza di curvature, fratture, mineralizzazione, svasatura metafisaria (Schramm e coll., 2009; Dighe e coll., 2008).
Si possono calcolare il rapporto lunghezza femore/circonferenza addominale (se <0.16 indica ipoplasia polmonare) ed il rapporto lunghezza femore/lunghezza piede che, se <1 indica displasia scheletrica (normale=1) (Krakow e coll., 2009; Cassart, 2010).
Torace
Il rapporto cardio-toracico e la circonferenza toracica devono essere misurati a livello della scansione quattro-camere del cuore. La misura della circonferenza to-racica con un valore <5° percentile per et`a gestazionale `e un indicatore di ipoplasia polmonare, causa di distress respiratorio nel neonato e indice di letalit`a (Cassart, 2010; Yeh e coll., 2011).
Si pu`o inoltre misurare la clavicola e valutare la presenza/assenza della scapola. Quando le misure del torace risultano particolarmente sproporzionate, pu`o essere applicato il seguente algoritmo:
• Il torace `e eccessivamente piccolo (displasia tanatofora)? • Il torace `e lungo e ristretto (Sindrome di Jeune)?
• Le coste sono molto corte (Sindrome polidattilia-coste corte)? • Ci sono fratture costali (osteogenesi imperfecta tipo II)?
• Ci sono coste fuse tra loro (displasia spondilocostale)? (Hall e coll., 2012) Altri parametri che sono stati proposti da diversi Autori per la valutazione dell’i-poplasia polmonare sono il rapporto circonferenza toracica/circonferenza addomina-le <5° percentile, il rapporto area cardiaca/area toracica <5° percentile, il rapporto torace/lunghezza del tronco <0.32, l’area polmonare <5° percentile, diametro pol-monare destro <5° percentile, rapporto area polmonare destra/area toracica <0.11, misurazione del volume polmonare fetale tramite ecografia tridimensionale. `E ne-cessario anche valutare la forma e l’integrit`a del torace poich’e l’anomalia di dimen-sione e configurazione delle coste `e un altro fattore prognostico negativo associato alle displasie scheletriche letali (Gon¸calves e coll., 2004).
Mani e Piedi
Le estremit`a devono essere valutate per escludere la presenza di polidattilia pre-o ppre-ost-assiale, sindattilia e clinpre-odattilia. Si parla di ppre-olidattilia in caspre-o di una pre-o pi`u dita sovrannumerarie, essa `e preassiale se le dita sovrannumerarie sono localizzate al lato radiale per l’arto superiore e tibiale per l’arto inferiore; `e postassiale se sono
Capitolo 1. Introduzione 8 localizzate al lato ulnare per l’arto superiore e fibulare per l’arto inferiore (Dighe e coll., 2008; Cassart, 2010).
La sindattilia `e causata dalla fusione delle ossa o dei tessuti molli delle dita adia-centi, la clinodattilia presenta la deviazione di una o pi`u dita. Deve essere valutata qualsiasi altra deformit`a delle estremit`a, ad esempio il pollice “da autostoppista”, il piede torto, la mano “a cucchiaio” o “a tridente” (Dighe e coll., 2008).
Cranio
La circonferenza cranica (CC) e il diametro biparietale (DBP) sono misurate sempre nell’indagine ecografica insieme alle misurazioni del trigono ventricolare e del diametro trasverso del cervelletto (DTC): esse valutano la presenza di macrocefalia e di idrocefalia (Gon¸calves e coll., 2004; Warman e coll., 2010).
La forma e il grado di ossificazione delle ossa del cranio sono importanti da ri-levare. L’alta definizione delle strutture intracraniche, associata a distorsione della volta cranica in seguito ad una media pressione esercitata dalla sonda ecografica sull’addome materno indica demineralizzazione ossea, pi`u frequentemente riscontra-ta nell’osteogenesi imperfecriscontra-ta, ma pu`o essere presente anche nell’acondrogenesi e nell’ipofosfatasia (Warman e coll., 2010; Hall e coll., 2012; Cassart, 2010).
La distanza interorbitale viene misurata tramite il diametro binoculare per esclu-dere ipo- o iper-telorismo. Altre caratteristiche che possono essere presenti sono la micrognazia, il bossing frontale, il cranio “a trifoglio” (Dighe e coll., 2008).
Colonna
Le anomalie della colonna comprendono scoliosi, emivertebre, demineralizza-zione, platispondilia. Quest’ultima, per`o, pu`o essere veramente molto difficile da evidenziare all’esame ecografico.
Quando esiste il sospetto di un’anomalia della colonna, pu`o essere utile un ap-proccio algoritmico che si propone di valutare in maniera sequenziale se ci sono parti mancanti della colonna (agenesia sacrale), se ci sono curvature o fusioni (emi-vertebre), se tutte le parti della colonna sono ugualmente ossificate (Hall e coll., 2012).
Pelvi
La forma della pelvi e le ossa pelviche possono essere importanti nella diagnosi di displasia scheletrica, insieme alla presenza dei tre punti di ossificazione (iliaco, pubico ed ischiatico) (Hall e coll., 2012).
Translucenza Nucale
La misura della translucenza nucale (NT) fetale a 10-14 settimane di gestazione rappresenta un metodo di screening per le anomalie cromosomiche dotato di elevata sensibilit`a ed accuratezza diagnostica. La NT aumentata pu`o essere associata anche
Capitolo 1. Introduzione 9 a difetti cardiaci congeniti, altri difetti strutturali, sindromi genetiche e displasie scheletriche. Un aumento di NT pu`o essere visto nell’85% dei feti con una displasia scheletrica letale (Hall e coll., 2012).
Si valutano, inoltre, il volume del liquido amniotico per escludere il polidramnios, e i movimenti fetali attivi. Se la paziente riferisce di non averne percepiti, ovvero se all’ecografia non si osservano movimenti degli arti, dopo aver escluso altre cause (quali l’obesit`a materna e la sofferenza fetale cronica) vanno ipotizzate probabili patologie come l’artrogriposi (Schramm e coll., 2009; Dighe e coll., 2008; Cassart, 2010).
All’esame standardizzato dello scheletro si aggiunge la valutazione degli organi interni per escludere malformazioni associate (uro-genitali, cerebrali ecc..) e l’eco-cardiografia fetale per escludere anomalie cardiache, che riguardano soprattutto il difetto del setto interatriale e interventricolare e i difetti del tessuto di conduzione che possono causare blocco atrioventricolare e fibrillazione atriale (Schramm e coll., 2009; Warman e coll., 2010).
Un esempio tipico di displasia scheletrica associata ad anomalie cardiache `e la Sindrome di Holt-Oram, detta anche Sindrome cuore-mano, ereditata con modalit`a autosomica recessiva e causata da una mutazione del fattore di trascrizione TBX5, importante nello sviluppo del cuore e degli arti superiori (Warman e coll., 2010; Dighe e coll., 2008).
Capitolo 1. Introduzione 10 Approccio Ecografico Standardizzato per le displasie scheletriche
Et`a gestazionale basata sull’ultima mestruazione o sull’ecografia del primo trimestre
Lunghezza delle ossa lunghe (femore, omero, radio, ulna, tibia, fibula e clavicola) Forma delle ossa lunghe
Ecogenicit`a delle ossa lunghe Misura e forma del piede
Mani (numero delle dita, forma delle falangi, mineralizzazione) Misura delle circonferenze (testa, addome e torace)
Visualizzazione laterale della gabbia toracica Mineralizzazione e forma del cranio
Misura e forma della scapola Misura e forma della mandibola
Profilo fetale (bossing frontale, presenza dell’osso nasale, micrognazia) Posizione anomala delle estremit`a
Altre anomalie congenite
Valutazione del volume di liquido amniotico Idrope
1.5
Il ruolo dell’ecografia tridimensionale nella
dia-gnosi prenatale di displasie scheletriche
L’ecografia tridimensionale (3D) non `e usata di routine durante l’esame ecografico ma pu`o essere utilizzata in caso di sospetta displasia scheletrica per chiarire meglio le relazioni spaziali e la configurazione degli arti deformati, e per mostrare ano-malie scheletriche che possono sfuggire all’esaminatore con la tecnica convenzionale bidimensionale (Krakow e coll., 2003).
Il vantaggio dell’ecografia 3D rispetto a quella bidimensionale real-time `e di poter manovrare l’immagine per ottimizzare la visualizzazione di uno specifico elemento anatomico che si vuole studiare, superando i limiti dell’ecografia bidimensionale in cui i movimenti fetali possono rendere difficile lo studio dell’anatomia fetale (Garjian e coll., 2000).
Mediante l’ecografia tridimensionale `e possibile ottenere contemporaneamente le ricostruzioni dell’immagine in 3D e le immagini planari che corrispondono ai piani longitudinale, trasversale e coronale (Garjian e coll., 2000; Krakow e coll., 2003).
Diversi studi hanno evidenziato i vantaggi dell’uso dell’ecografia 3D per migliorare l’accuratezza della diagnosi prenatale di displasie scheletriche, tuttavia, esso non pu`o prescindere dalla primaria valutazione bidimensionale (Ruano e coll., 2004).
Capitolo 1. Introduzione 11 Il ruolo dell’ecografia 3D pu`o essere quello di confermare la diagnosi di displasia scheletrica e, tramite la visualizzazione di alcune particolari caratteristiche difficili da valutare con l’ecografia bidimensionale, diagnosticare, quando `e possibile, il tipo specifico di displasia scheletrica (Krakow e coll., 2003).
Con questa tecnica `e possibile visualizzare il profilo faciale del feto in un’immagine sagittale, inoltre le immagini possono essere ruotate su piani obliqui per apprezzare meglio gli arti (Garjian e coll., 2000).
Gli elementi diagnostici che pu`o essere utile apprezzare con l’ecografia 3D perch`e visualizzati con maggiore accuratezza e definizione rispetto alla tecnica bidimen-sionale sono la depressione del ponte nasale, il bossing frontale (Cassart, 2010), le anomalie degli arti come acromelia, mesomelia e rizomelia, e le anomalia delle estre-mit`a come la brachidattilia, la mano “a tridente” o “a cucchiaio” e il pollice dell’ “autostoppista” (Krakow e coll., 2003). Ruotando l’immagine lungo l’asse longitu-dinale della gamba `e possibile ottenere la proiezione pi`u favorevole per dimostrare la presenza di un piede torto (Dyson e coll., 2000).
La tecnica 3D pu`o facilitare nel conteggio delle coste e delle vertebre grazie alla rielaborazione dell’immagine nei diversi piani dello spazio. Spostando il cursore in senso cranio caudale lungo l’immagine della colonna in sezione sagittale `e possibile esaminare ciascuna vertebra che verr`a contemporaneamente rappresentata anche sul piano trasversale e coronale. Un cursore che si sposta consensualmente sulla raffigurazione della colonna in 3D indica il livello vertebrale che stiamo esaminando. Sulla ricostruzione in 3D della colonna `e possibile contare le vertebre a partire da alcuni punti di repere noti. La maggior parte degli Autori conta le vertebre a partire dalla 12a vertebra toracica, che `e la vertebra su cui si inserisce l’ultimo paio di coste, sebbene vada tenuto presente che il 6% dei feti ha un numero anomalo di coste (Dyson e coll., 2000).
Offrendo una visione della colonna vertebrale nell’insieme, l’ecografia 3D consente di valutare la presenza di un’eventuale anomala curvatura della colonna, allo stesso modo consente di studiare i rapporti tra ossa lunghe ed estremit`a (Dyson e coll., 2000).
Nella sindrome di Apert, l’ecografia 3D migliora l’accuratezza diagnostica sia per la migliore visualizzazione della triade caratterizzata da anomala forma della testa, ipoplasia medio-faciale e sindattilia; sia perch’e, secondo alcuni Autori, tra la 22a e 27a settimana di gestazione permette di misurare la sutura metopica sul piano coronale a livello del setto pellucido che, nella sindrome di Apert misura pi`u di 1,5 cm (Lam e coll., 2006).
Malgrado il parere contrastante di alcuni Autori, per la visualizzazione delle ano-malie della gabbia toracia come le coste corte e il torace stretto, l’ecografia 3D non offre nessun vantaggio rispetto allo studio bidimensionale che resta il gold standard per la misurazione dei rapporti circonferenza toracica/circonferenza addominale, area cardiaca/area toracica (Krakow e coll., 2003).
Capitolo 1. Introduzione 12
1.6
Il ruolo della tomografia computerizzata
tri-dimensionale nello studio delle displasie
sche-letriche
L’utilizzo della tomografia computerizzata tridimensionale (TC 3D) `e stato pro-posto al fine di integrare le immagini ecografiche nella diagnosi prenatale di displasie scheletriche. Le immagini ottenute con TC 3D permettono la visualizzazione di al-cuni dettagli addizionali dello scheletro fetale che non sono chiaramente evidenti all’ecografia, contribuendo alla definizione della diagnosi specifica. La TC 3D pu`o essere particolarmente efficace per confermare o escludere fratture ossee e per la valutazione in dettaglio della colonna vertebrale per quanto riguarda la forma dei corpi vertebrali e gli spazi intervertebrali (Ulla e coll., 2011).
Inoltre, la ricostruzione delle immagini permette la visualizzazione di tutto lo scheletro fetale senza l’interferenza dell’anatomia materna e minimizzando gli arte-fatti da movimento. Le immagini risultano chiare e facilmente decifrabili (Ulla e coll., 2011).
Tuttavia, l’ecografia resta sempre il primo strumento per lo screening prenatale e la per la diagnosi di displasie scheletriche (Krakow e coll., 2009; Dighe e coll., 2008; Ulla e coll., 2011).
L’International Skeletal Dysplasia Registry tramite un’analisi prospettica di 405 casi, analizzati tramite un approccio standardizzato in centri specializzati, ha evi-denziato che la diagnosi ecografica di displasia scheletrica risulta corretta nel 78% dei casi. Ci`o significa che, in mani esperte, la diagnosi precisa pu`o essere sbagliata in 1 caso su 5 (Ulla e coll., 2011).
Al contrario mancano studi altrettanto ampi sull’utilizzo della TC 3D nella diagnosi prenatale di displasie scheletriche (Gon¸calves e coll., 2004).
Tuttavia, ci sono fattori frequenti che possono influenzare la diagnosi ecografica, come l’obesit`a, la posizione fetale e l’et`a gestazionale avanzata, perci`o attualmente la TC 3D pu`o essere riconosciuta come tecnica complementare alla convenzionale ecografia bidimensionale nella diagnosi prenatale di displasie scheletriche (Ulla e coll., 2011; Krakow e coll., 2009).
In particolare, essa risulta molto efficace nella valutazione del cranio, delle coste, delle vertebre, delle mineralizzazione ossea e nel riscontro di fratture. Pu`o dimo-strare caratteristiche scheletriche che possono essere trascurate o risultare non chiare all’ecografia, come la scoliosi e la platispondilia, l’incurvamento delle ossa lunghe, le malformazioni delle ossa pelviche (Ulla e coll., 2011).
La TC 3D espone il feto alle radiazioni ionizzanti. Teoricamente la dose (3mGy) `e simile a quella dell’ormai superata radiografia fetale, ma il rischio di irradiazione deve essere sempre attentamente bilanciato con l’importanza di una diagnosi accurata (Gon¸calves e coll., 2004; Ulla e coll., 2011).
I rischi dell’irradiazione si riducono con l’avanzare dell’et`a gestazionale, e la rico-struzione delle immagini `e pi`u facile quando il feto `e meno mobile. Se combiniamo
Capitolo 1. Introduzione 13 queste caratteristiche `e evidente che l’epoca gestazionale ottimale per eseguire la TC 3D `e il 3° trimestre di gravidanza, a partire dalla 26a settimana di gestazione. Questa caratteristica ne riduce il ruolo nella diagnosi prenatale perch`e `e in con-trapposizione con la necessit`a di avere una diagnosi quanto pi`u precoce possibile al fine di programmare al meglio la gestione della gravidanza (Gon¸calves e coll., 2004; Cassart, 2010).
Capitolo 2
Scopo della tesi
Scopo del presente lavoro `e stato rivedere la casistica degli ultimi 30 anni in un singolo Centro di riferimento di ecografia ostetrica, per valutare le possibilit`a di diagnosi prenatale alle diverse et`a gestazionali.
Sono state esaminate le tecniche sia ecografiche che di biologia molecolare impie-gate nel corso degli anni, ed `e stata valutata sia la precisione del sospetto diagnostico sia la precocit`a della diagnosi per le diverse forme di displasia scheletrica.
Capitolo 3
Pazienti e metodi
Per effettuare il presente studio sono stati raccolti i dati di tutte le gravidanze che, a seguito di un sospetto diagnostico all’ecografia di routine di I livello, sono consecutivamente affluite presso il Centro di ecografia di II livello della Divisione di Ostetricia e Ginecologia del Dipartimento della Medicina Clinica e Sperimentale dell’Universit`a di Pisa, nell’arco di tempo compreso tra il 1984 e il 2013.
Sono state incluse nello studio tutte le gravidanze per le quali il sospetto di displa-sia scheletrica era stato confermato all’ecografia di II livello (gravidanze “indice”).
Sono state incluse, inoltre, le successive gravidanze delle donne che avevano avuto un feto affetto da displasia scheletrica in quella precedente.
Gli esami ecografici sono stati effettuati con l’approccio transaddominale ed ese-guiti da uno specialista ginecologo-ostetrico esperto in diagnostica ecografica prena-tale. Soltanto in alcuni casi `e stato necessario completare l’esame per via transvagi-nale. Dal 2007, quando `e stata acquisita la strumentazione (Voluson E8 della ditta General Electrics), `e stata utilizzata anche l’ecografia tri- e quadri-dimensionale.
L’et`a gestazionale `e stata calcolata in base alla data dell’ultima mestruazione riferita dalla gestante, confermata o corretta dai dati ecobiometrici ottenuti in esami precoci.
Durante le ecografie `e stato effettuato uno studio analitico di tutti i distretti anatomici esplorabili nel feto.
Per la definizione della morfologia fetale, sono state visualizzate le seguenti strut-ture: orbite, cristallino, labbro superiore, quattro camere cardiache, assi lunghi cardiaci, campi polmonari, stomaco, parete addominale, reni, vescica, colonna, ossa lunghe, estremit`a, raggi ossei delle mani.
In tutti i casi sono state effettuate le seguenti misurazioni: diametro biparietale (DBP), diametro occipitofrontale (OF), trigono, diametro trasverso del cervelletto (DTC), diametro addominale medio (MAD), lunghezza del femore (FL), dell’omero, della tibia, della fibula, del radio, dell’ulna e del piede, ed `e stata controllata la biometria fetale confrontando le misure ottenute con quelle delle curve di riferimento di crescita fetale.
Capitolo 3. Pazienti e metodi 16 Per confrontare i dati ottenuti nelle diverse patologie e dalle diverse et`a gestazio-nali la brevit`a del femore `e stata espressa come numero di deviazioni standard (SD) sotto la media (M).
Per quanto riguarda l’ecoanatomia fetale, sono state valutate le anomalie sia scheletriche che extrascheletriche, in particolare della colonna e delle estremit`a, la presenza di piede torto, la presenza di fratture e della demineralizzazione del cranio, la morfologia del cranio.
E’ stata valutata la posizione della placenta ed effettuata una stima della quantit`a del liquido amniotico utilizzando la tecnica della massima tasca verticale.
Per ogni donna inclusa nello studio sono stati considerati i seguenti parametri: anno in cui `e stata effettuata la diagnosi, settimana alla quale `e stata effettuata la diagnosi, indicazione all’esame ecografico di II livello, esito della gravidanza, setti-mana in cui la gravidanza si `e conclusa, esito della diagnosi postnatale/autoptica, diagnosi di biologia molecolare, mappa cromosomica fetale, descrizione ecografica bidimensionale e tridimensionale di tutta l’ecoanatomia fetale, gravidanza “indice” o gravidanza successiva, tecnica diagnostica utilizzata nella successiva gravidanza.
Tutti i dati sono stati rivisti e discussi con un medico specialista in Genetica Clinica presso l’Azienda Ospedaliera Universitaria Pisana. Nell’analisi statistica dei risultati sono stati utilizzati il test “t” di Student, l’analisi di varianza e la regressione lineare, come appropriato.
Capitolo 4
Risultati
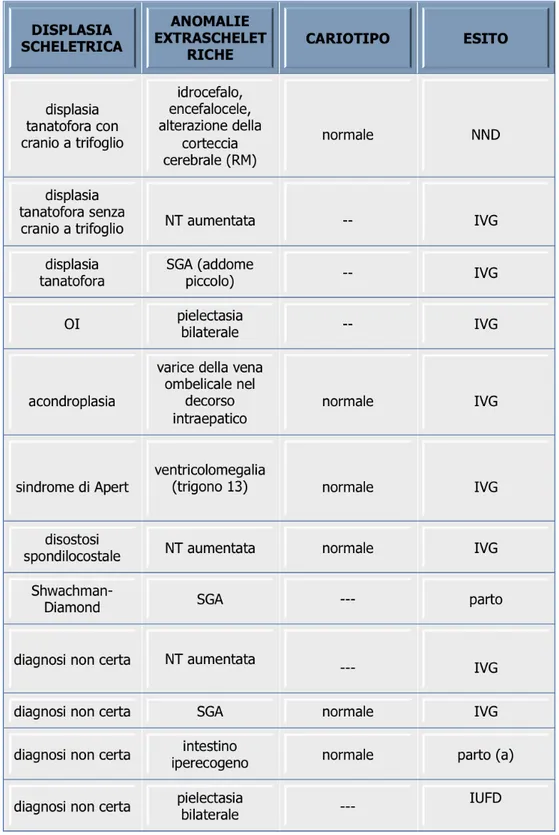
Negli anni dal 1984 al 2013, presso il Centro di ecografia di II livello della Divisione di Ostetricia e Ginecologia del Dipartimento della Medicina Clinica e Sperimentale dell’Universit`a di Pisa, sono stati diagnosticati 31 casi di displasie scheletriche. Le diagnosi definitive sono: 8 displasie tanatofore, 4 osteogenesi imperfette di tipo II, 3 acondroplasie, 2 disostosi spondilocostali, 2 sindromi di Shwachaman-Diamond, 1 sindrome di Apert, 1 ipostaturismo familiare, 1 ipocondrogenesi, 1 ipofosfatasia. In 8 non `e stato possibile ottenere una precisa diagnosi del tipo di displasia scheletrica (Tabella 1).
4.1
Caratteristiche delle gravidanze studiate
Nel nostro studio sono incluse 40 gravidanze: in 29 casi le donne si presentavano per la prima volta alla valutazione ecografica di II livello con un feto affetto da displasia scheletrica (gravidanze “indice”); in 11 casi si trattava invece di donne che eseguivano l’esame nella successiva gravidanza, dopo aver avuto un feto affetto da displasia scheletrica in quella precedente.
Tra le 29 gravidanze “indice”, 4 si sono concluse con il parto di un feto vivo e sopravvissuto per un periodo di follow-up compreso tra 12 e 24 mesi (2 dei quali erano affetti da acondroplasia, 1 da sindrome di Shwachman-Diamond e 1 da ipo-staturismo familiare); 2 con il parto di un bambino deceduto rispettivamente dopo 2 ore dal parto (displasia tanatofora con alterazioni cerebrali) e dopo 6 mesi (sindrome di Shwachman-Diamond); 1 con una morte fetale intrauterina (IUFD), 20 si sono concluse con l’interruzione volontaria di gravidanza (IVG); di 2 gravidanze non si conosce l’esito.
Tra le gravidanze interrotte volontariamente, in 18 casi la IVG `e stata effettuata prima della 25a settimana di gestazione mentre 2 hanno eseguito la IVG all’estero poich´e la Legge Italiana non consente di interrompere la gravidanza ad una epoca in cui il feto `e capace di vita autonoma. Uno di questi era affetto da acondroplasia mentre l’altro, risalente al 1993, non ha ricevuto una diagnosi di certezza anche se si trattava di un caso sicuramente grave (femore corrispondente a M-15 SD).
Capitolo 4. Risultati 18 Per quanto riguarda le 2 gravidanze con esito sconosciuto, si trattava di gravidan-ze viste per la prima volta ad una epoca gestazionale gi`a avanzata: 1 donna straniera a 29 settimane di gestazione il cui feto presentava all’esame ecografico una moderata brevit`a del femore (M -3SD), e una donna che, presumibilmente, ha interrotto la gravidanza all’estero e che a 33 settimane di gestazione presentava un femore di M -11SD. Nel primo caso la misurazione della lunghezza del femore non era tale da indicare con certezza una displasia scheletrica mentre nel secondo caso `e ragionevole ipotizzare la diagnosi di una displasia scheletrica grave e presumibilmente letale.
Nel gruppo delle 11 gravidanze “successive” sono stati registrati 2 casi di ricor-renza, 7 casi di non ricorrenza e 2 gravidanze concluse con un aborto spontaneo al 1° trimestre in cui non era possibile valutare la ricorrenza o meno della patologia scheletrica. I 2 casi di ricorrenza sono una disostosi spondilocostale e una osteogene-si imperfecta di tipo II. Entrambe le disostoosteogene-si spondilocostali, osteogene-sia la prima nel 1995 che la seconda nel 1998, sono state diagnosticate a 20 settimane di gestazione.
Per quanto riguarda l’osteogenesi imperfecta di tipo II, il primo caso, nel 2010, `e stato diagnosticato a 20 settimane di gestazione mentre nel secondo caso, nel 2013, la diagnosi `e stata effettuata oltre 1 mese prima (15 settimane di gestazione).
4.2
Tecnica diagnostica per escludere una
diagno-si di ricorrenza
La tecnica diagnostica utilizzata nelle successive gravidanze per escludere la dia-gnosi di displasia scheletrica `e stata in 2 casi la biologia molecolare: in un caso `e stata effettuata l’amniocentesi per escludere la ricorrenza di acondroplasia, e nell’al-tro la villocentesi per escludere un’ipofosfatasia. L’esclusione della ricorrenza della displasia scheletrica sarebbe stata possibile con tecniche di biologia molecolare an-che in altre 2 gravidanze (con precedente feto affetto da displasia tanatofora e da osteogenesi imperfecta di tipo II) ma `e stata rifiutata per evitare di eseguire una tecnica invasiva.
In questi ultimi 2 casi, per la diagnosi nella gravidanza successiva `e stata utilizzata l’ecografia, cos`ı come in altri 4 casi (displasia tanatofora, osteogenesi imperfecta di tipo II, disostosi spondilocostale, diagnosi non chiara).
In 2 casi non `e stata eseguita nessuna diagnosi poich´e la gravidanza si `e conclusa con aborto al 1° trimestre. L’ultimo caso di gravidanza successiva `e giunto alla no-stra osservazione per uno studio Doppler velocimetrico della funzionalit`a placentare, dopo che la prima gravidanza era stata interrotta nel 1996 per una grave displasia scheletrica senza che fosse stata effettuata l’autopsia.
4.3
Indicazione all’esame ecografico di II livello
Diversamente dalla ecografia di I livello, offerta a tutte le donne in gravidanza e che ha scopi diversi a seconda dell’epoca gestazionale a cui viene eseguita, l’ecografia
Capitolo 4. Risultati 19 di II livello `e un esame eseguito per una particolare indicazione o sospetto diagno-stico. Tuttavia, 4 pazienti erano giunte alla nostra osservazione per indicazioni non correlate alla patologia scheletrica (come minaccia d’aborto ed amniocentesi), ed il riscontro di patologia scheletrica `e stato fortuito. Fra gli altri casi di diagnosi ecografica di displasia scheletrica, 11 erano state inviate per un precedente feto con la stessa patologia, ed uno per aumentato rischio di forme sindromiche in quanto i partners erano consanguinei. In 21 casi le pazienti erano state riferite per l’osserva-zione all’esame ecografico di I livello di una ridul’osserva-zione della lunghezza delle ossa degli arti (in 1 caso erano state definite “assenti”), mentre in 1 caso (ipocondrogenesi) per anomalie della colonna.
Due pazienti erano state inviate per sospetta patologia cerebrale (macrocrania in un feto con acondroplasia e ventricolomegalia in un feto con ipofosfatasia o osteoge-nesi imperfecta di tipo II); anche in altri 2 feti, riferiti per riduzione della lunghezza degli arti, era stata riscontrata idrocefalia al I livello.
4.4
Reperto ecografico di femore corto
In 7 tra le 40 gravidanze da noi studiate `e stato riscontrato un femore con una biometria regolare per l’et`a gestazionale (compreso tra M +1SD e M -1SD), tra questi sono compresi 6 casi di non ricorrenza e 1 feto affetto da sindrome di Apert. In nessun caso abbiamo rilevato un femore con lunghezza compresa tra 2 e 3 SD sotto la M.
Valori della lunghezza del femore inferiori a 3 SD sono stati misurati in una displa-sia tanatofora, 1 caso di disostosi spondilocostale, uno di sindrome di Shwachman-Diamond, 3 casi di cui non abbiamo riscontri postnatali (Tabella 2).
In 14 casi `e stato misurato un femore compreso tra 4 e 6 SD sotto la M: 4 displasie tanatofore, 1 osteogenesi imperfecta di tipo II, 3 acondroplasie, 1 sindrome di Shwachman-Diamond, 1 ipocondrogenesi, 1 ipostaturismo familiare, 1 disostosi spondilocostale e 2 casi di diagnosi incerta (Tabella 2).
I casi in cui `e stato rilevato un femore tra 7 e 15 SD sotto la M sono stati considerati i pi`u gravi. Essi comprendono: 3 displasie tanatofore, 3 osteogenesi imperfette di tipo II, 1 ipofosfatasia, 2 diagnosi incerte (Tabella 2).
Se prendiamo in considerazione le displasie scheletriche pi`u frequenti e valutiamo la correlazione tra l’et`a gestazionale e le SD sotto la M del femore, notiamo che la brevit`a del femore tende ad aumentare con l’aumentare dell’et`a gestazionale per ogni specifica diagnosi. Per alcune diagnosi come l’acondroplasia, la brevit`a del femore `e tardiva e mai oltre le 6 SD sotto la M mentre per altre, come la displasia tanatofora e l’osteogenesi imperfecta di tipo II, `e precoce e spesso supera le 7 SD sotto la M (Figura 1).
Il rapporto femore/piede era inversamente correlato al numero di SD sotto la M del femore (p< 0.0001; R=0.62) (Figura 2). In tutti i casi affetti inclusi nel presente studio era < 0.85 tranne che in 3 feti: uno con ipostaturismo familiare, uno con
Capitolo 4. Risultati 20 sindrome di Shwachman-Diamond ed uno con diagnosi rimasta incerta di possibile displasia scheletrica (Figura 3).
Considerando soltanto le diagnosi per cui abbiamo pi`u di un caso, il rapporto femore/piede era significativamente inferiore nella displasia tanatofora e nell’osteo-genesi imperfecta di tipo II rispetto all’acondroplasia e alla sindrome di Shwachman-Diamond (Figura 4).
In 2 dei 3 casi in cui l’acondroplasia poteva entrare nella diagnosi differenziale (essenzialmente quelli con patologia ossea riscontrata nel 3° trimestre, ma non nel 2°) `e stato misurato anche l’angolo fra diafisi e collo del femore.
Tale misura `e stata effettuata in 2 dei 3 casi di acondroplasia, e in altri due casi di displasia scheletrica che hanno ricevuto una diagnosi tardiva a 32 settima-ne (ipostaturismo familiare e sindrome di Shwachman-Diamond): in questi ultimi l’angolo femorale diafisario era normale (119,6° nell’ipostaturismo familiare; 113,3° nella sindrome di Shwachman-Diamond) mentre in entrambe le acondroplasie era ampiamente aumentato (148.0°; 136.0°) (Figura 5).
4.5
Reperto ecografico di demineralizzazione e
for-ma anofor-mala del cranio
In 10 feti `e stata riscontrata all’ecografia un’alterazione del cranio, compreso un caso, non rilevante ai fini nel nostro studio, in cui `e stata rilevata dolicocefalia dopo rottura prematura delle membrane (PROM), verosimilmente legata alla compressio-ne della testa fetale da parte delle pareti utericompressio-ne per mancanza di liquido amniotico. I 9 feti con anomalie di forma del cranio erano affetti da displasia tantofora in 2 casi (uno con un tipico cranio “a trifoglio” e l’altro con idrocefalia ed encefaloce-le); da osteogenesi imperfecta di tipo II in 4 casi che tipicamente mostravano una teca ossea poco ecogena (Figura 6); da acondroplasia con macrocrania e bossing frontale (un caso), da sindrome di Apert in un caso con lieve ventricolomegalia e bossing frontale (Figura 7). In altri 2 feti (uno con macrocrania, uno con cranio sottile e bossing frontale), la diagnosi definitiva manca per l’assenza del riscontro autoptico/molecolare.
4.6
Reperto ecografico di fratture
Le fratture, singole o multiple, sono state evidenziate in tutti i casi di osteogenesi imperfecta di tipo II a livello costale o delle ossa lunghe (Figura 8). Non sono state rilevate negli altri feti affetti da altri tipi di displasia scheletrica.
4.7
Reperto ecografico di estremit`
a anomale
Per quanto riguarda gli arti inferiori, `e possibile valutare la presenza di piede torto, molto pi`u facile da rilevare rispetto alle anomalie che riguardano le estremit`a
Capitolo 4. Risultati 21 degli arti superiori. La diagnosi di piede torto si ottiene tramite la visualizzazione della pianta del piede nel piano di scansione sagittale della gamba (normalmente non `e possibile essendo l’asse del piede perpendicolare a quello della gamba). Il piede torto `e stato visualizzato in 5 casi: 2 di osteogenesi imperfette di tipo II, un’i-pocondrogenesi, un’ipofosfatasia, una diagnosi non certa con immagini ecografiche suggestive per diagnosi di osteogenesi imperfecta di tipo II o ipofosfatasia.
Un anomalo atteggiamento della mano `e stato repertato in un caso di acondro-plasia (mano “a tridente”) e valutato anche con l’ecografia tridimensionale.
Non `e stato sistematicamente rilevato il numero delle dita dei piedi, mentre in tutti i casi si `e cercato di valutare le dita delle mani. La sindattilia con il tipico aspetto della mano “a chela” (Figura 9) `e stata visualizzata in un caso di sindrome di Apert, consentendo di ipotizzare la diagnosi corretta, che `e stata quindi verificata dall’identificazione della mutazione con tecniche di biologia molecolare. Una diagnosi falsamente positiva di esadattilia `e stata posta in un caso di disostosi spondilocostale.
4.8
Reperto ecografico di torace stretto
Un reperto ecografico soggettivo di torace stretto `e stato riportato in 18 casi: 7 displasie tanatofore, 4 osteogenesi imperfette di tipo II, una disostosi spondiloco-stale, un’ipofosfatasia, un’ipocondrogenesi, 3 diagnosi non chiare, un ipostaturismo familiare. In quest’ultimo caso si `e trattato di un falso positivo in quanto il neo-nato n´e alla nascita n´e dopo ha mostrato sintomi e segni che potessero indicare la presenza di ipoplasia polmonare.
Il rapporto cardiotoracico (v.n. fino a 0.34) `e stato calcolato in 9 casi, ed `e risultato alterato soltanto nel falso positivo appena descritto, mentre `e risultato normale anche in casi come la displasia tanatofora in cui un valore superiore alla norma `e atteso (Tabella 3; Figura 10).
Il rapporto cardio/toracico non era significativamente diverso nei casi soggettiva-mente classificati come torace ristretto o normale (0.21 −+ 0.09 vs 0.24 −+ 0.04)
4.9
Reperto ecografico di anomalie della colonna
All’ecografia la colonna `e risultata alterata in 4 casi: 2 disostosi spondilocostali, un’ipocondrogenesi, una displasia tanatofora.
Nella disostosi spondilocostale `e stata visualizzata all’ecografia un’anomalia della colonna che suggeriva un mancato allineamento della stessa (Figura 11). L’autopsia ha evidenziato alterazioni di segmentazione delle vertebre dorsali e lombari, con riduzione del numero delle coste (11 a destra e 10 a sinistra).
Nell’ipocondrogenesi sono state riscontrate delle alterazioni della colonna localiz-zate a livello cervicale e lombo-sacrale (Figura 12). Le immagini ecografiche mostra-vano un”’interruzione” della colonna, meglio definita dalla radiografia postmortem
Capitolo 4. Risultati 22 che ha chiarito il reperto ecografico evidenziando la mancata ossificazione nelle stesse sedi, tipica della patologia in esame (Figura 13).
Nel caso della displasia tanatofora era stato sospettato (anche con l’ausilio del 3D) un disallineamneto dei corpi vertebrali, mentre l’autopsia aveva evidenziato soltanto le alterazioni tipiche della patologia: platispondilia con forma dei corpi vertebrali “ad H”.
4.10
Reperto ecografico di trigono dilatato
In tutti i feti `e stata misurata l’ampiezza del trigono: in un caso di acondroplasia `
e stato riscontrato un trigono con valori borderline, mentre nel feto con sindrome di Apert era presente una ventricolomegalia moderata (trigono =13mm; valori norma-li <10) (Figura 14). In un feto affetto da displasia tanatofora `e stata evidenziata all’ecografia una grave dilatazione del sistema dei ventricoli cerebrali fra i quali era presente un’ampia comunicazione, soprattutto anteriormente. La corteccia cerebrale appariva gravemente assottigliata e non `e stato possibile visualizzare il cervelletto, anche se e’ ipotizzabile che possa essere stato contenuto in un encefalocele occipitale (Figura 15). Dato l’evidente interessamento cerebrale, per completamento diagno-stico `e stata eseguita una risonanza magnetica (RM) fetale che ha confermato la presenza di un quadro malformativo caratterizzato da macrocrania, idrocefalia, ci-sti interemisferica, anomalie corticali e da due encefaloceli. L’autopsia ha mostrato marcata dilatazione dei ventricoli e giri appena accennati, agenesia del corpo callo-so, cisti mediana verosimilmente corrispondente alla lamina corioidea, protrudente verso la volta cranica. La diagnosi conclusiva `e stata di osteocondrodisplasia a tipo di displasia tanatofora con cranio “a trifoglio” e disgenesia dei lobi temporali.
Una dilatazione del sistema ventricolare era stata erroneamente descritta all’eco-grafia di I livello in altri 2 feti: entrambi presentavano cranio sottile e demineraliz-zato, di cui uno con associazione di anomalie di forma cranica.
4.11
Reperto ecografico di plica nucale
aumenta-ta e cariotipo
In 11 feti non `e stata valutata la plica nucale. E’ stata valutata in 24 casi, di cui 4 mostravano una NT aumentata (disostosi spondilocostale, sindrome di Shwachman-Diamond, displasia tanatofora, diagnosi incerta).
L’analisi del cariotipo tramite amniocentesi `e stata effettuata in 16 casi ed `e sempre risultato normale.
Sulle cellule da amniocentesi `e stata effettuata la biologia molecolare in 3 casi di displasia scheletrica. In 2 feti ha permesso di confermare le diagnosi di sindrome di Apert e di acondroplasia al 3° trimestre.
Capitolo 4. Risultati 23
4.12
Reperto ecografico di polidramnios
Il polidramnios `e stato riscontrato ecograficamente in 6 casi: 2 acondroplasie, una sindrome di Shwachman-Diamond, una displasia tanatofora, 2 casi con diagnosi non chiarita. Si presenta quindi in diversi tipi di displasie scheletriche senza che ci sia una associazione con un tipo specifico di patologia. Inoltre, in tutti i casi in cui si `e osservato polidramnios, l’epoca gestazionale era relativamente avanzata (26-32 settimane).
4.13
Reperto ecografico di displasia scheletrica
as-sociata ad anomalie extrascheletriche
Tra i 31 casi in cui l’esame ecografico evidenziava anomalie dello scheletro, in 12 (38,7%) erano presenti anche anomalie extrascheletriche. Fra questi sono compresi i 3 casi di NT aumentata (igroma cistico), i 2 casi di anomalie intracraniche gi`a descritte, 3 casi di restrizione della crescita, ed altri reperti di minor rilevanza clinica (Tabella 4).
4.14
Reperto ecografico tridimensionale
A partire dall’anno 2007, quando `e stata acquisita la strumentazione necessaria, l’indagine ecografica bidimensionale `e stata correlata con l’acquisizione di “volumi” in ecografia tridimensionale (3D) (per poter rielaborare le immagini ottenendo piani diversi da quelli visibili in tempo reale) o quadrimensionale (4D) (soprattutto per la valutazione del profilo e delle mani). La metodica `e stata utilizzata in 16 gravidanze, di cui 14 con feto affetto e 2 studiate per escludere la ricorrenza di ipofosfatasia e displasia tanatofora.
Siamo ricorsi all’esame 3D in 2 feti con sospetto di acondroplasia: nel primo caso, dalla revisione effettuta assieme al medico genetista dei volumi 3D acquisiti, si sono evidenziati elementi utili per la diagnosi come la radice del naso infossata, la mano “a tridente” (Figura 16); nel secondo caso questi tipici segni dell’acondro-plasia non erano evidenziabili. Anche il nato non mostrava la facies caratteristi-ca dell’acondroplasia, che tuttavia `e stata confermata con le indagini di biologia molecolare.
In un caso di displasia tanatofora ed in uno di osteogenesi imperfecta di tipo II `
e stato possibile riconoscere con maggior facilit`a il torace “a campana” (Figura 17). Nel feto con displasia tanatofora ed anomalie cerebrali multiple la definizione del-l’anatomia intracranica `e stata facilitata dalla ricostruzione in 3D, che ha soprattut-to permesso di visualizzare l’encefalocele (Figura 18). La RM fetale ha completasoprattut-to l’indagine dimostrando displasia corticale, oltre alle malformazioni gi`a diagnosticate per mezzo dell’ecografia. All’ecografia 3D anche il profilo fetale appariva dismorfico
Capitolo 4. Risultati 24 (Figura 19), ma tale osservazione non era particolarmente rilevante data la gravit`a del quadro polimalformativo (Tabella 5).
Sfruttando l’opportunit`a che offre l’ecografia 3D di ottenere contemporaneamente la ricostruzione dell’immagine volumetrica e le immagini planari che corrispondono ai piani longitudinale, trasversale e coronale, abbiamo rielaborato le immagini di un’ipocondrogenesi ruotandole intorno ai tre assi del volume e traslandole fino ad ottenere la proiezione desiderata della colonna che risultava “interrotta” a livello lombare per la mancata ossificazione dei corpi vertebrali (Figura 20). Aspetti par-ticolari come il femore “a cornetta di telefono” e il cranio “a trifoglio” sono stati visualizzati con l’ecografia bidimensionale senza ricercare l’ausilio del 3D, allo stesso modo `e stato calcolato l’angolo tra il collo del femore e la diafisi nell’acondroplasia.
4.15
Et`
a Gestazionale alla Diagnosi
Su 31 feti affetti, la diagnosi prenatale basata sulle caratteristiche ecografiche `e stata posta in 15 casi all’epoca dell’ecografia “morfologica” del 2° trimestre, cio`e tra la 19a e la 22a settimana di gestazione.
Cinque casi sono stati diagnosticati prima delle 18 settimane, 11 casi dopo le 24 settimane. I 5 casi diagnosticati in epoca gestazionale precoce sono: 1 caso di ricor-renza di osteogenesi imperfecta di tipo II grazie all’ecografia morfologica precoce, 3 displasie tanatofore gravi, una diagnosi non suffragata dal reperto autoptico ma presumibilmente grave per le caratteristiche ecografiche.
Tra le gravidanze diagnosticate in epoca non precoce (24-33 settimane): 3 displa-sie gravi risalenti agli anni ’90 (2 hanno richiesto la IVG e una persa al follow-up), una displasia tantofora in cui la grave displasia scheletrica `e stata diagnosticata al primo controllo ecografico effettuato tardivamente (26 settimane) nel 2010 per una situazione di disagio sociale, 3 acondroplasie, 2 sindromi di Shwachman-Diamond, un ipostaturismo, una persa al follow-up.
4.16
Concordanza tra diagnosi clinica postnatale
o autoptica e diagnosi molecolare
Delle 31 gravidanze con feti affetti da displasie scheletriche, 22 hanno ricevuto una diagnosi clinica postnatale e/o autoptica: 8 displasie tanatofore, 4 osteogene-si imperfette di tipo II, 3 acondroplaosteogene-sie, 2 disostoosteogene-si spondilocostali, una osteogene-sindrome di Apert, un’ipocondrogenesi, un’ipofosfatasia, un ipostaturismo familiare, una sin-drome di Jeune alla diagnosi clinica o autoptica, mentre negli altri 9 casi nessuna diagnosi specifica `e stata ipotizzata.
Nove di queste diagnosi cliniche o autoptiche sono state confermate alla diagnosi molecolare. La conferma molecolare `e stata possibile in tutti i casi di acondroplasia ed in quelli di sindrome di Apert e di ipofosfatasia (Tabella 1).
Capitolo 4. Risultati 25 Delle 4 osteogenesi imperfette di tipo II, 2 sono state confermate alla diagnosi molecolare, mentre nelle restanti 2 occorse all’inizio del periodo incluso nello studio, non `e stata eseguita nessuna diagnosi di biologia molecolare (Tabella 1).
Per quanto riguarda le 8 displasie tanatofore: 3 hanno ricevuto la diagnosi mo-lecolare che ha confermato quella clinica, su 2 casi non `e stato possibile effetture la diagnosi molecolare, in 3 casi non `e stata eseguita nessuna indagine molecolare (Tabella 1).
La diagnosi clinica di sindrome di Jeune non `e stata confermata dalla biologia molecolare che, effettuata dopo la revisione retrospettiva del caso da parte del me-dico genetista, ha consentito di porre diagnosi di sindrome di Shwachman-Diamond (Tabella 1).
E’ attualmente in corso la diagnosi molecolare di un’ipocondrogenesi.
Tra i 9 casi che non hanno ricevuto una diagnosi clinica o autoptica precisa: 2 sono vivi (fra questi una sindrome di Shwachman-Diamond `e stata diagnosticata dopo 2 anni); un caso si `e concluso con morte fetale intrauterina (IUFD); 2 casi visti al 3° trimestre di gravidanza non hanno terminato i controlli e sono stati persi al follow-up e 4 IVG. Gli ultimi 4 casi privi di una diagnosi clinica o autoptica sono IVG di cui non abbiamo riscontro autoptico: una effettuata all’estero per una diagnosi nel 3° timestre di una grave displasia scheletrica e 3 effettuate in Italia (una 17 anni fa e le altre due negli ultimi 5 anni).
Capitolo 5
Discussione
Lo sviluppo della diagnosi prenatale ha significativamente modificato il compor-tamento di molte donne che si trovano ad affrontare una gravidanza con feto affetto da probabili malformazioni scheletriche, consentendo loro di ottenere informazioni sulla presenza o assenza della patologia e di praticare la scelta che ritengono mi-gliore. Nella maggior parte dei casi la scelta consiste nel valutare se proseguire la gravidanza, preparandosi ad accogliere un bambino affetto (nel caso la patologia non sia letale), oppure interromperla volontariamente.
Per la diagnosi prenatale delle displasie scheletriche l’ecografia occupa un ruolo fondamentale nella gestione della gravidanza, ma risulta particolarmente difficoltosa data la rarit`a delle patologie e la loro numerosit`a, le caratteristiche sovrapposte e la variabilit`a fenotipica. Inoltre con la scoperta delle basi molecolari di un notevole nu-mero di displasie scheletriche la loro classificazione si `e evoluta: basata inizialmente solo sulla morfologia, derivante principalmente dalle caratteristiche radiologiche e oggi in larga parte incentrata sulla patogenesi.
Il presente studio, che comprende la casistica raccolta in un unico Centro di diagnosi prenatale nell’arco di 30 anni, ha un’elevata copertura di follow-up, con solo 2 casi persi, e conferma l’eterogeneit`a delle displasie scheletriche.
Tra i casi analizzati, le pi`u comuni diagnosi accertate sono state la displasia tana-tofora (25,8%), l’osteogenesi imperfecta di tipo II (13%) e l’acondroplasia (9,68%). Questa distribuzione `e consistente con quanto gi`a noto e cio`e che nelle casistiche postnatali la percentuale delle diverse diagnosi specifiche non corrisponde a quella delle casistiche ecografiche prenatali, dove l’acondroplasia, che `e una delle diagno-si pi`u frequenti dopo la nascita, `e meno rappresentata poich`e diagnosticabile solo tardivamente (Krakow e coll., 2008; Schramm e coll.,2009) (Tabella 6).
In accordo con i dati in letteratura, l’outcome delle gravidanze patologiche `e stato negativo, con solo il 12,9% (4/31) di bambini sopravvissuti al periodo neonatale. Di fronte alla possibilit`a di una patologia letale o la nascita di un bambino con statura estremamente bassa associata ad anomalie scheletriche, il 71% delle donne hanno deciso di interrompere la gravidanza (22/31).
Capitolo 5. Discussione 27
5.1
Diagnosi di ricorrenza nelle gravidanze
suc-cessive
L’ecografia oltre ad essere indispensabile per la diagnosi in caso di sospetto di displasia scheletrica, pu`o essere utilizzata per escludere la ricorrenza. A questo sco-po, nella presente casistica `e stata utilizzata nel 54,4% dei casi, mentre la biologia molecolare tramite tecnica diagnostica invasiva solo nel 18,2%: sono state effettua-te l’amnioceneffettua-tesi e la villoceneffettua-tesi per escludere la ricorrenza, rispettivameneffettua-te, di acondroplasia e ipofosfatasia. Quest’ultima, che `e una delle osteocondrodisplasie pi`u rare, ha un rishio di ricorrenza del 25%, giustificando ampiamente il ricorso alla diagnosi prenatale invasiva. L’acondroplasia invece `e trasmessa con modalit`a autosomica dominante, e se i genitori non sono affetti si tratta di una mutazione insorta de novo; tuttavia, il rischio di ricorrenza, dovuto ad un possibile mosaicismo gonadico, `e del 5%, cio`e superiore rispetto alla popolazione generale ma inferiore a quello della trasmissione mendeliana classica.
In effetti anche nella presente casistica si `e osservato un caso di ricorrenza di una patologia autosomica dominante letale (e quindi con genitori non affetti) e cio`e di osteogenesi imperfecta di tipo II. Dato che i genitori godevano di buona salute, era ragionevole supporre che la mutazione del gene COL1A1 rilevata nel feto si fosse verificata per evento de novo: pertanto, il rischio di ricorrenza `e basso, ma `e da considerarsi quantificabile intorno al 5% per la possibilit`a di mosaicismo germinale. E’ stato quindi proposto alla donna, una volta intrapresa la successiva gravidanza, di effettuare una diagnosi prenatale invasiva, preferibilmente la villocentesi (CVS), per la ricerca della mutazione del gene COL1A1 sul DNA fetale. La paziente ha rifiutato la tecnica invasiva per il rischio di aborto stimato intorno a 0.5-1%. Pertanto, data la familiarit`a per il precedente feto affetto `e stata sottoposta a controlli ecografici precoci, ed in tal modo l’osteogenesi imperfecta di tipo II `e stata diagnosticata nella seconda gravidanza con un anticipo di 5 settimane rispetto alla prima.
L’anticipazione della diagnosi comporta minori rischi per la salute fisica della donna legati alla IVG e una minor sofferenza in quanto l’IVG stessa pu`o avvenire prima che la donna abbia percepito i movimenti fetali. Gli studi rivolti a valutare la possibilit`a di identificare ecograficamente la ricorrenza di displasie scheletriche fra la fine del 1° trimestre e l’inizio del 2° sono ancora scarsi (Khalil e coll., 2011), e quindi la scelta dell’epoca a cui iniziare i controlli nelle gravidanze successive `e arbitraria. L’osservazione che per ogni singola diagnosi di displasia scheletrica il femore ten-de ad essere tanto pi`u breve quanto pi`u `e tardiva la diagnosi (Tabella 2; Figura 1) sottolinea la difficolt`a di questo semplice parametro per effettuare una diagno-si precoce, e quindi la necesdiagno-sit`a di valutare aspetti qualitativi identificati in base alla diagnosi nel caso “indice” (ad esempio la scarsa mineralizzazione del cranio e le fratture costali nel feto affetto da osteogenesi imperfecta di tipo II) (Figura 21). Rispetto alla diagnosi di biologia molecolare, che pu`o essere effettuata sulla villo-centesi a partire da 11 settimane di gravidanza, con tempi di laboratorio variabili a seconda della patologia, `e probabile che una diagnosi ecografica abbastanza specifica
Capitolo 5. Discussione 28 per una scelta grave come la IVG resti ancora oggi pi`u tardiva. Tuttavia l’assenza di rischi dell’esame ecografico rispetto al rischio di perdita fetale di circa l’1% del-la biopsia coriale rende facilmente ragione deldel-la preferenza di alcune donne per del-la diagnosi ecografica.
Tale scelta era ancora pi`u giustificata nel caso della paziente in cui il primo feto era affetto da displasia tanatofora perch´e, a differenza dell’osteogenesi imperfecta, nella displasia tanatofora la quasi totalit`a delle mutazioni del gene FGFR3 (Fibro-blast Growth Factor Receptor 3) si verifica per evento de novo al momento del concepimento e il rischio di ricorrenza `e veramente basso, di poco superiore rispetto a quello della popolazione generale.
La disostosi spondilocostale, anche conosciuta come sindrome di Jarcho-Levin, `e una patologia autosomica recessiva (`e stata anche riportata una forma autosomica dominante ma il gene coinvolto non `e ancora conosciuto) associata a quattro geni che codificano per proteine coinvolte nella via del segnale di Notch, una via cru-ciale per la normale somitogenesi (Hall e coll., 2012). Nella gravidanza “indice” con feto affetto da disostosi spondilocostale esisteva gi`a un’indicazione all’ecografia di II livello non correlata alla patologia scheletrica, ovvero la consanguineit`a dei partners, che comporta un rischio del 6-8% di avere un feto malformato; infatti i genitori consanguinei hanno maggior probabilit`a di essere portatori sani della stessa mutazione genetica. Nella gravidanza successiva il rischio era del 25% considerando il tipo di trasmissione della disostosi spondilocostale, tuttavia in quegli anni (1996) non sarebbe stata comunque disponibile la ricerca molecolare del gene responsabile della patologia.
5.2
Aspetti ecografici delle displasie scheletriche
Fra i casi con displasia scheletrica diagnosticati in assenza di familiarit`a l’esame ecografico di II livello `e stato richiesto in oltre la met`a dei casi per il riscontro della brevit`a delle ossa lunghe, in particolare del femore, in una precedente ecografia di I livello. La definizione di femore “corto” non `e standardizzata; diversi gruppi hanno utilizzato come cut-off il 5° percentile, il 10° percentile oppure le 2 SD sotto la M per l’epoca gestazionale. Un femore corto all’ecografia pu`o rappresentare una normale caratteristica del feto, essere la spia della presenza di un’insufficienza uteroplacentare o di una cromosomopatia, o essere legato ad una displasia scheletrica (Todros e coll., 2009).
In genere, per`o, quando la misura del femore `e molto inferiore a 3 SD sotto la M ed `e associato alla riduzione delle altre ossa lunghe `e particolarmente indicativo di displasia scheletrica (Todros e coll., 2009). Quindi la brevit`a del femore si pu`o considerare marker sensibile, anche se non specifico, di displasia scheletrica.
Come gi`a discusso, ai fini della diagnosi prenatale `e per`o rilevante non solo la possibilit`a di sospettare la patologia per mezzo dell’ecografia ma anche l’et`a gesta-zionale a cui tale sospetto pu`o essere posto. Sia lo studio cross-sezionale di diversi feti affetti da specifiche patologie, sia lo studio longitudinale dello stesso feto
osser-Capitolo 5. Discussione 29 vato ad epoche successive della gravidanza indicano che la riduzione della lunghezza del femore tende ad essere tanto maggiore quanto pi`u avanzata `e l’et`a gestazionale (Figura 1). Di conseguenza la misurazione del femore per la diagnosi di displasie scheletriche `e pi`u sensibile ad et`a gestazionali pi`u avanzate. E’ gi`a ampiamente noto (Chitty e coll., 2009) che l’acondroplasia `e diagnosticabile soltanto nel 3° trimestre di gravidanza, ed anche nella presente casistica i due feti che erano stati studiati a 20 e 21 settimane (rispettivamente perch`e la donna era stata sottoposta ad esami radiologici nel 1° trimestre e per un reperto falsamente positivo di ventricolomega-lia al I livello) avevano in quel momento una lunghezza del femore assolutamente normale per l’epoca gestazionale. Il concetto di evolutivit`a di diverse patologie gi`a durante la vita intrauterina rende ragione della mancata diagnosi di alcune patologie ad epoche precoci della gravidanza (Yagel e Achiron, 1998).
Nell’ipotesi che nelle displasie scheletriche il piede abbia una lunghezza normale, mentre nelle restrizioni della crescita intrauterina o nelle forme costituzionali sia piccolo proporzionalmente al femore, `e stata proposta la utilizzazione del rapporto femore/ piede nella diagnosi di displasia scheletrica. In effetti, nel caso di iposta-turismo familiare incluso nel presente studio il rapporto femore/piede era normale. Era normale anche in un caso di diagnosi rimasta incerta ed in un caso di sindrome di Shwachman-Diamond, mentre per tutti gli altri feti inclusi nello studio era infe-riore alla norma. Il rapporto femore/piede era significativamente minore nelle forme sicuramente letali come la displasia tanatofora o l’osteogenesi imperfecta di tipo II rispetto alle forme meno gravi evidenziate nel 3° trimestre come l’acondroplasia o la sindrome di Shwachman-Diamond, ma non mostrava differenze significative fra queste ultime due patologie (Figura 4).
Al contrario `e risultato utile, per distinguere l’acondroplasia da altre diagnosi tardive, la misurazione dell’angolo femorale. Questo parametro recentemente de-scritto in letteratura (Boulet e coll., 2009) `e di facile rilevazione ecografica. Studi nel topo hanno dimostrato che i geni dell’acondroplasia umana causano un’altera-zione dell’ossificaun’altera-zione encondrale delle ossa lunghe che determinano tipici aspetti radiologici delle metafisi. All’estremo prossimale del femore nei feti con acondro-plasia, il processo patologico di ossificazione porta ad un aspetto caratteristico delle metafisi, che tendono a essere inclinate verso l’esterno ed il basso con un angolo pi`u ampio del normale. Infatti nel nostro studio la misura dell’angolo in 2 acondroplasie `
e risultata aumentata (136.0°;148.0°).
Un reperto che pu`o aiutare nella diagnosi differenziale dei diversi tipi di displa-sie scheletriche gravi, diagnosticabili nel 2° trimestre, `e l’ipomineralizzazione, che si pu`o riscontrare nell’osteogenesi imperfecta di tipo II, nell’ipofosfatasia e nell’ipo-condrogenesi. Nell’osteogenesi imperfecta di tipo II e nell’ipofosfatasia l’ipominera-lizzazione `e soprattutto visibile a carico della volta cranica, che pu`o essere valutata ecograficamente in base alla scarsa ecogenicit`a (tanto che la volta cranica pu`o ri-sultare di ecogenicit`a simile a quella di una struttura non calcificata quale la linea mediana) e deformabilit`a della teca cranica. Nella presente casistica, tutti i feti affetti da osteogenesi imperfecta di tipo II presentavano questo tipico aspetto della