UNIVERSITA’ DEGLI STUDI DI GENOVA
Scuola di Scienze Matematiche, Fisiche e Naturali
Corso di Laurea Magistrale in Scienza ed Ingegneria dei Materiali
Studio dell’ossidazione ad alte temperature e quantificazione
dell’evaporazione del cromo da interconnettori per Pile a
Combustibile ad Ossidi Solidi (SOFCs).
Relatore: Prof. Roberto Spotorno
Candidato: Daniele Paravidino
Abstract
Il presente lavoro si inserisce nell’ampio scenario dello studio dell’ossidazione ad alte temperature delle leghe metalliche utilizzate nel campo della produzione di energia. In particolare, questo studio si focalizza sulla caratterizzazione dal punto di vista della cinetica di ossidazione di due acciai inossidabili ferritici (FSSs) commercialmente disponibili ed attualmente utilizzati come interconnettori per le pile a combustibile ad ossidi solidi (SOFCs). Le SOFCs sono dispositivi che operano a temperature elevate (700-900°C) in presenza di un ambiente ossidante molto aggressivo ed umidità. In tali condizioni, i FSSs subiscono processi ossidativi che portano alla formazione di uno spesso strato di ossido sulla loro superficie, oltre a causare il rilascio di specie volatili del cromo esavalente; l’insieme di tali fenomeni causa la degradazione dell’intera pila. Per queste ragioni, la comprensione dei meccanismi di degradazione dei FSSs è di fondamentale importanza. Lo studio svolto ha come scopo la conoscenza quanto più completa possibile della cinetica di ossidazione dei FSSs partendo da un approccio teorico, con la formulazione di un modello ideale di ossidazione basato sulla teoria di Carl Wagner, per arrivare al suo confronto ed alla discussione dei suoi limiti alla luce dei i risultati sperimentali. Le prove empiriche sono state eseguite su due diverse tipologie di acciai: l’AISI 441 ed il Crofer22 APU. Sulle due diverse leghe sono state svolte termogravimetriche fino a 1000h di invecchiamento, di evaporazione del cromo e di energia di attivazione per la conduzione elettronica dell’ossido; tutte le prove sono state svolte a 750°, 800° e 850°C.
Le misure termogravimetriche sono necessarie per comprendere la cinetica dei FSSs presi in esame attraverso il calcolo della costante cinetica di ossidazione; tali prove, però, necessitano di essere supportate dalla quantificazione dell’evaporazione del cromo poiché questo meccanismo porta alla perdita di massa da parte del campione, rendendone così necessaria la considerazione. Per poter eseguire misure di evaporazione del cromo è stato messo a punto un sistema innovativo in grado di quantificare il cromo evaporato sia in operando, collezionando il diossido di carbonio rilasciato dalla reazione fra le specie volatili del cromo ed il carbonato di calcio per formare cromato di sodio, sia ex situ attraverso la quantificazione per via spettrofotometrica del cromato di sodio reagito. Le misure effettuate in operando compongono uno studio di fattibilità di tale metodo poiché esso risulta una completa novità nel panorama della quantificazione dell’evaporazione del cromo.
Per completare lo studio è stata svolta una completa caratterizzazione metallurgica post sperimentale sui campioni testati al fine di confermare le misure svolte attraverso l’osservazione in sezione degli spessori degli ossidi formati e l’analisi della loro composizione.
INDICE
INDICE DEGLI ACRONIMI ... 1
INTRODUZIONE ... 3
CAPITOLO 1. PILE A COMBUSTIBILE ... 5
1.1 CLASSIFICAZIONE DELLE PILE A COMBUSTIBILE ... 8
CAPITOLO 2. PILE A COMBUSTIBILE AD OSSIDI SOLIDI... 9
2.1 EFFICIENZA DELLE PILE A COMBUSTIBILE... 12
2.2 TENSIONE DI UNA CELLA ... 15
CAPITOLO 3. COMPONENTI DELLE SOFCS ... 19
3.1 SOVRATENSIONE... 19 3.2 FASE TRIPLA ... 20 3.3 ELETTROLITA ... 21 3.4 ANODO... 23 3.5 CATODO ... 24 3.6 INTERCONNETTORI... 29
3.6.1 Acciai Inossidabili Ferritici ... 30
3.7 SIGILLANTE ... 33
CAPITOLO 4. OSSIDAZIONE AD ALTE TEMPERATURE ... 34
4.1TERMODINAMICA DELL’OSSIDAZIONE ... 35
4.2 CINETICA DELL’OSSIDAZIONE ... 37
4.2.1 Difetti puntuali ... 38
4.2.2 Diffusione ... 42
4.2.3 Conducibilità elettrica ... 44
4.2.4 Diffusione Ionica ... 45
4.3 PROPRIETÀ DI TRASPORTO NEL 𝑪𝒓𝟐𝑶𝟑 ... 46
4.3.1 Difetti nella struttura del 𝑪𝒓𝟐𝑶𝟑 ... 48
4.4 TEORIA DI WAGNER ... 51
4.4.1 Legge Parabolica ... 52
4.4.2 Diffusione a bordo grano ... 55
4.4.3 Legge Lineare ... 56
5.1 TRATTAZIONE TERMODINAMICA ... 60
5.2 DIPENDENZA DELL’EVAPORAZIONE DEL CROMO DALLA PRESSIONE ... 62
5.3 DIPENDENZA DELL’EVAPORAZIONE DEL CROMO DALL’UMIDITÀ ... 63
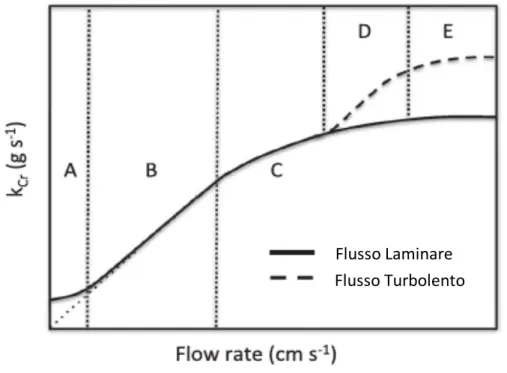
5.4DIPENDENZA DELL’EVAPORAZIONE DEL CROMO DAL FLUSSO... 64
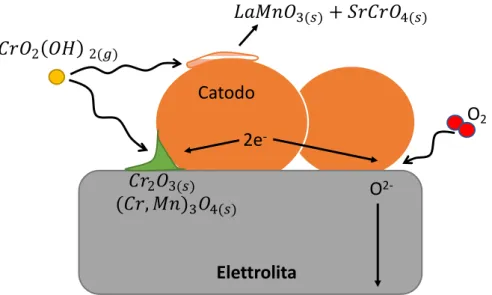
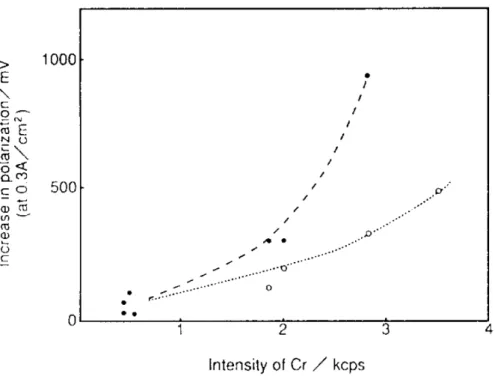
5.5 AVVELENAMENTO DEL CATODO ... 66
5.5.1 Meccanismo ... 67
5.6 MITIGAZIONE DELL’EVAPORAZIONE DEL CROMO ... 71
5.6.1 Rivestimenti protettivi ... 71
5.6.2 Spinello Cromo - Manganese ... 74
CAPITOLO 6. MODELLO DELL’OSSIDAZIONE AD ALTE TEMPERATURE ... 78
6.1 OSSIDAZIONE DEL CROMO PURO ... 78
CAPITOLO 7. MATERIALI E METODI ... 85
7.1 MISURE DI TERMOGRAVIMETRICHE ... 85
7.2 MISURE DI EVAPORAZIONE DEL CROMO ... 87
7.3 MISURE DI RESISTENZA ELETTRICA IN FUNZIONE DELLA TEMPERATURA ... 97
7.4 CARATTERIZZAZIONE METALLURGICA POST-SPERIMENTALE ...100
CAPITOLO 8. RISULTATI ...101
8.1 MISURE GRAVIMETRICHE...101
8.1.1 Confronto delle curve sperimentali col modello di ossidazione ...110
8.2 EVAPORAZIONE DEL CROMO ...113
8.2.1 Taratura dello Spettrofotometro UV-Vis ...113
8.2.2 Misura di controllo del rendimento del sistema ...115
8.2.3 Misura di bianco del metodo ...116
8.2.4 Misura dell’evaporazione del cromo in funzione del flusso ...117
8.2.5 Misure di evaporazione del cromo ex-situ ...118
8.2.6 Misure di evaporazione del cromo in-situ ...127
8.3CARATTERIZZAZIONE POST-SPERIMENTALE ...131
8.3.1 Spessori ossido ...132
8.3.2 Analisi composizionali degli ossidi ...142
8.4 ENERGIA DI ATTIVAZIONE PER LA CONDUZIONE ELETTRONICA ...154
CAPITOLO 9. CONCLUSIONI ...157
Indice degli acronimi
AFC – Alkaline Fuel Cell – Pile a combustibile alcaline ASC – Anode Supported Cell – Celle supportate dall’anodo
ASR – Area Specific Resistance – Resistenza specifica per unità di superficie BCS – Bounded Compliant Seals – Sigillanti
BSD – Back-Scattered Electron Detector – Detector degli elettroni retrodiffusi CDC – Calcium-Doped Ceria -Ossido di cerio dopato calcio
DPC – 1,5-difenilcarbazide
EDXS – Energy Dispersive X-ray Spectroscopy – Spettroscopia dispersiva a raggi x EPD – Electrophoretic Deposition – Deposizione elettroforetica
ESC – Electrolyte Supported Cell – Celle supportate dall’elettrolita FSS – Ferritic Stainless Steel - Acciai inossidabili Ferritici
GDC – Gadolinium-Doped Ceria – Ossido di cerio dopato gadolinio
GSC – Gadolinium Stronzium Cobaltite – Ossido di cobalto, gadolinio e stronzio
ICP-AES – Inductively Coupled Plasma Atomic Emission Spectroscopy – Spettroscopia ad
emissione atomica
LSC – Lanthanum Stronzium Cobaltite – Ossido di cobalto di lantanio e stronzio
LSCF – Lanthanum Stronzium Cobalt Ferrite – Ossido di ferro cobalto, stronzio e lantanio
LSGM – Stronzium Magnesium-doped Lanthanum Gallate – Gallato di lantanio dopato stronzio e
magnesio
LSM – Lanthanum Stronzium Manganite – Ossido di mangnesio, lantanio e stronzio MCFC – Molten Carbonate Fuel Cell – Pile a combustibile a carbonati fusi
OCV – Open Circuit Voltage – Potenziale a circuito aperto
PCFC – Proton Ceramic Fuel Cell – Pile a combustibile ceramiche protoniche
PEMFC – Proton Exchange Membrane Fuel Cell – Pile a combustibile con membrana a scambio
protonico
PVD – Physical Vapor Deposition – Deposizione fisica in fase vapore
RFC – Regenerative Fuel Cell system – Sistema rigenerativo di pile a combustibile SEM – Scanning Electron Microscope – Microscopio elettronico a scansione SDC – Samarium-Doped Ceria – Ossido di cerio dopato samario
SOFC – Solid Oxide Fuel Cell – Pile a combustibile ad ossidi solidi
SSC – Stronzium Samarium Cobaltite – Ossido di cobalto stronzio e samario TPB – Triple Phase Boundary – Fase tripla
YSZ – Yttria Stabilized Zirconia – Ossido di ittrio stabilizzato con ossido di zirconio YDC – Yttrium-Doped Ceria – Ossido di cerio dopato ittrio
YSCF – Yttrium Stronzium Cobalt Ferrite – Ossido di ferro, ittrio, stronzio e cobalto YCCF – Yttrium Copper Cobalt Ferrite – Ossido di ferro, ittrio, rame e cobalto YBCu – Yttrium Barium Copper oxide – Ossido di rame ittrio e bario
Introduzione
La scienza non può in alcun modo rimanere indifferente davanti alle sfide ed alle necessità che il momento attuale pone all’intera umanità. Durante tutta la storia umana quesiti, curiosità, crisi e problematiche sempre nuove hanno caratterizzato le diverse epoche; la necessità di nuove cure a malattie sconosciute, di progressi tecnologici nell’agricoltura, nei trasporti e nel campo energetico sono da sempre il motore primario per le scoperte scientifiche. Come tutte, anche l’epoca moderna ci presenta delle sfide ed in particolare ci pone un serio ed impellente interrogativo: “può lo sviluppo umano essere costantemente volto all’espansione ed alla crescita infinita su di un pianeta inevitabilmente limitato?”. Anno dopo anno questa domanda sta trovando tristemente risposta: “No!”. Ormai la quasi totalità della comunità scientifica ha accettato che “la nostra casa sta andando a fuoco”; i cambiamenti climatici dovuti all’inquinamento legato all’attività umana e la sovrappopolazione stanno rapidamente distruggendo l’ecosistema che ci ospita e sostenta. Gli avvenimenti dei primi mesi del 2020 sono solo l’ultima e più forte testimonianza di quanto la situazione sia critica. Gestire l’impatto dell’attività umana sul nostro pianeta sarà la più grande sfida della nuova generazione di scienziati. Nell’ottica di arginare la deriva distruttiva che la razza umana ha ormai da tempo intrapreso sarà un crocevia fondamentale il superamento dei combustibili fossili, ritenuti i principali colpevoli dei cambiamenti climatici1.
Benché lo scetticismo verso i cambiamenti climatici fra i capi di stato di grandi nazioni metta in dubbio questa realtà perpetrando una politica economica fatta di disboscamenti ed uso indiscriminato di combustibili fossili, molti altri hanno intrapreso la strada del virtuosismo energetico2. In questo quadro geopolitico molto complesso si colloca la ricerca scientifica che mira a sviluppare tecnologie per la produzione di energia sostenibile, rinnovabile e quanto più pulita possibile. Particolarmente interessanti e promettenti sono le tecnologie per lo sfruttamento di una risorsa ampiamente presente sul pianeta: l’idrogeno. Tra queste le più accreditate sono le pile combustibile.
Le pile a combustibile sono state teorizzate per la prima volta nel 1839 e da allora hanno avuto importanti impieghi, tra i quali quello sulla navicella della missione Apollo 11 che portò l’equipaggio del capitano Neil Amstrong sulla Luna. Attualmente le pile a combustibile sono sfruttate per la produzione stazionaria di energia ed è allo studio il loro possibile impiego nel campo dei trasporti. Lo sfruttamento di una risorsa come l’idrogeno ricoprirà un ruolo fondamentale nell’economia energetica mondale non solo come fonte energetica ma anche in qualità di forma di immagazzinamento dell’energia prodotta da fonti rinnovabili.
Negli anni sono state sviluppate moltissime tipologie di pile a combustibile; il presente lavoro si concentra sulle pile a combustibile ad ossidi solidi (Solid Oxide Fuel Cells stacks – SOFCs stacks). Argomenti principe del lavoro saranno lo studio della cinetica di ossidazione degli interconnettori e dell’evaporazione del cromo, fenomeni che causano i principali meccanismi di degradazione delle stacks. Il primo passo del lavoro ha previsto la creazione di un modello dell’ossidazione ideale per prevedere l’ossidazione ad alte temperature delle leghe in grado di passivarsi attraverso la formazione di ossido di cromo. Successivamente si è discusso il modello confrontandolo con un set di misure sperimentali al fine di comprendere da cosa nascano le differenze fra la trattazione ideale e quella empirica. Per l’indagine riguardante la cinetica di ossidazione sono state effettuate misure termogravimetriche (comunemente chiamate aumenti di peso), di resistenza specifica per unità di superficie (Area Specific Resistance – ASR) al fine di valutare l’energia di attivazione per la conducibilità elettronica e di evaporazione di specie volatili del cromo su acciai inossidabili ferritici (FSSs) usati come interconnettori. La quantificazione del cromo evaporato dai campioni è stata effettuata sfruttando un sistema di misura appositamente studiato e realizzato durante questo lavoro. Tale sistema risulta innovativo poiché accoppia sia un metodo in operando che una quantificazione analitica ex situ attraverso la spettrofotometria UV-VIS del cromo evaporato raccolto. I campioni testati sono stati FSSs presenti sul mercato ed attualmente utilizzati come interconnettori, le misure sono state effettuate sugli acciai al loro stato originario, cioè privi di rivestimenti protettivi. I test sperimentali hanno permesso la comprensione, nel loro insieme, dei fenomeni che coinvolgono gli interconnettori causandone il degrado e conseguentemente la perdita di performance della pila stessa3–6. Tutte le misure di questo studio sono state effettuate a 750, 800 ed 850°C poiché sono le tipiche temperature operative delle SOFCs.
Al fine di confermare tutte le informazioni ottenute dai test effettuati è stata eseguita un’ultima analisi sui campioni invecchiati a diversi tempi e temperature sottoponendoli ad una completa caratterizzazione metallurgica attraverso l’osservazione allo al microscopio elettronico a scansione ( Scanning Electron Microscope - SEM) e l’analisi composizionale sfruttando la spettroscopia EDXS (Energy Dispersive X-ray Spectroscopy) per confermare e completare i dati collezionati con la serie di misure precedenti.
Questo lavoro ha permesso di unificare lo studio dei processi di ossidazione a caldo mediante un approccio combinato teorico e sperimentale. I risultati ottenuti mediante misure termogravimetriche confermano i dati di altri autori, mentre lo studio dell’evaporazione del cromo approfondisce la conoscenza dei processi di rilascio di specie volatili, spesso trascurati in questo tipo di indagine.
Capitolo 1. Pile a Combustibile
Il principio alla base del funzionamento delle pile a combustibile è piuttosto semplice: esse sfruttano l’ossidazione e la riduzione rispettivamente di idrogeno ed ossigeno per generare corrente elettrica. In pratica tali dispositivi sfruttano l’energia chimica “immagazzinata” in queste due specie e la convertono direttamente in energia elettrica. La straordinaria potenzialità di questa tecnologia risiede, in parte, nella reversibilità del sistema. Infatti, la cella può generare corrente elettrica nella sua modalità cella a combustibile mentre, se viene imposta una corrente al sistema, essa è in grado di scindere l’acqua nei suoi componenti principali funzionando nella modalità elettrolizzatore7. Nella
Figura 1 è mostrato il funzionamento della cella nelle due possibili modalità; interessante notare gli
elementi circuitali presenti che definiscono la modalità di funzionamento e di conseguenza il verso delle cariche negative (fluiscono dal polo negativo a quello positivo).
Figura 1-La cella nelle due diverse modalità. (a) Cella in cui avviene l’elettrolisi dell’acqua in ossigeno ed idrogeno. (b) Ossigeno ed idrogeno si ricombinano generando corrente elettrica.
In generale tutte le pile a combustibile sono celle elettrochimiche costituite da un anodo, un catodo ed un elettrolita; proprio in base a quest’ultimo si effettua la classificazione delle varie tipologie di celle. Per comprendere a pieno il sistema è necessario aver presente dove e come le reazioni avvengano. Nella modalità cella all’anodo avviene la reazione di ossidazione dell’idrogeno (gassoso) che comporta la perdita di un elettrone per atomo (Reazione 1.1). Essendo la molecola di idrogeno
biatomica gli elettroni persi saranno due. Gli elettroni così rilasciati saranno quelli che circoleranno nel circuito esterno per raggiungere il catodo.
𝐻( → 2𝐻++ 2𝑒. 𝑅𝑒𝑎𝑧𝑖𝑜𝑛𝑒 1. 1
Al catodo, invece, ha luogo la reazione di riduzione dell’ossigeno sfruttando gli elettroni provenienti dall’anodo secondo la Reazione 1.2
𝑂(+ 4𝑒.→ 2𝑂(. 𝑅𝑒𝑎𝑧𝑖𝑜𝑛𝑒 1.2
La reazione complessiva della cella a combustibile consiste nella ricombinazione degli ioni di ossigeno e idrogeno dando la formazione di acqua (Reazione1.3).
2𝐻++ 𝑂(. → 𝐻(𝑂 𝑅𝑒𝑎𝑧𝑖𝑜𝑛𝑒 1.3
Secondo il principio di funzionamento appena riportato si ottiene energia elettrica. La corrente che si genera da una singola cella però è limitata dalla superficie degli elettrodi sui quali le reazioni avvengono. Comunemente una singola cella produce circa 1V di tensione, 500 mA cm-2 di corrente, valori troppo bassi per la maggior parte delle applicazioni. Dunque, è necessario collegare in serie o in parallelo diverse celle per costituire una pila che soddisfi le caratteristiche di corrente e voltaggio necessarie.
L’interesse nella tecnologia delle pile a combustibile risiede in diversi aspetti: in primis esse hanno l’innegabile vantaggio di poter produrre energia sia elettrica che termica con alta efficienza; permettono la produzione di elevate densità di energia; hanno una buona flessibilità sui combustibili utilizzabili; producono una trascurabile quantità di composti inquinanti ed hanno un basso tasso di degradazione nel tempo8,9. Inoltre, utilizzando direttamente idrogeno, gli inquinanti sono completamente assenti (se ottenuto con fonti rinnovabili); bisogna però sottolineare che attualmente alcune pile a combustibile, tipicamente SOFCs, vendute per uso stazionario sfruttano il metano della rete di distribuzione nazionale. Sfruttando il processo di steam reforming si ottiene idrogeno dal metano producendo una piccola parte di gas inquinanti. Le SOFCs inoltre sono anche in grado di utilizzare direttamente quasi tutti i combustibili a base di idrocarburi potendo dare luogo ad un processo di reforming interno alla cella producendo 𝐻( e quantità di 𝑆𝑂; e 𝑁𝑂; pressoché trascurabili. Infine, tra i tanti pregi, le pile a combustibile non producono vibrazioni e rumori che normalmente sono associati ai sistemi di conversione di energia termica e meccanica.
Per via di tutti i vantaggi sopraelencati le pile a combustibile risultano particolarmente interessanti per la produzione stazionaria di energia, aspetto da non sottovalutare poiché, in presenza di una fonte di idrogeno, si può provvedere alla produzione di energia elettrica in loco slegandosi dalla necessità di una rete di distribuzione elettrica. Potersi svincolare da una fitta rete di distribuzione porta con sé molti vantaggi: per prima cosa renderebbe possibile ridurre l’uso di tralicci e di migliaia di chilometri di cavi che corrono lungo tutto il territorio riducendo notevolmente i costi legati alla loro produzione, posa e manutenzione. Secondariamente, si abbasserebbe l’impatto ambientale ed il rischio di black-out causati da guasti della linea. Inoltre, le pile a combustibile producono corrente continua (DC) che quindi non necessita di essere raddrizzata per moltissimi usi, come invece avviene nel caso della corrente alternata.
Va aggiunto che la produzione locale darebbe la possibilità per utenti situati in zone impervie, normalmente non servite, di autoprodurre la corrente ed il calore necessari, garantendone una fornitura costante. Chiaramente per la produzione di energia direttamente in loco anche le tradizionali fonti rinnovabili sono impiegabili (come eolico e solare), ma dipendono da fenomeni naturali non continui nel tempo. Dunque, le tecnologie basate sull’idrogeno possono dare una risposta importante. Non va trascurato che l’energia generata da fonti rinnovabili nei momenti di produzione (in presenza di vento per l’eolico così come durante il giorno per il solare), se inutilizzata od in eccesso, può essere impiegata per alimentare degli elettrolizzatori. L’idrogeno così generato può essere stoccato ed utilizzato per alimentare celle a combustibile al bisogno, permettendo di rendere ampiamente disponibile l’energia generata da fonti rinnovabili anche quando queste non siano sfruttabili e senza ricorrere all’uso di batterie o accumulatori. Un sistema che accoppi un elettrolizzatore ed una pila a combustibile prende il nome di Regenerative Fuel Cell system (RFC).
Attualmente la produzione di energia per mezzo di pile a combustibile sta coinvolgendo anche il settore dei trasporti sia terrestri che marini, laddove possono sostituire le batterie grazie alla densità di energia ottenibile e alla possibilità di lavoro “continuo” senza la necessità di tempi di ricarica prolungati 10.
1.1 Classificazione delle Pile a Combustibile
Come detto in precedenza le diverse tipologie di pile a combustibile sono suddivise in base all’elettrolita che le compone e di conseguenza alle temperature a cui esse operano.
I. Pile a combustibile con membrana a scambio protonico (PEMFC): Operano fra i 70°C e
140° C, l’elettrolita è costituito da una membrana polimerica che consente il passaggio degli ioni 𝐻+(specie attiva), gli elettrodi sono composti da grafite e platino (catalizzatore) e la
reazione avviene al catodo. Fra le PEMFC si annoverano anche le Direct Methanol Fuel Cell (DMFC), le quali utilizzano, come suggerito dal nome, il metanolo tal quale come
combustibile.
II. Pile a combustibile alcaline (AFC): e temperature di utilizzo vanno da 100°C a 250°C,
l’elettrolita è composto di idrossidi alcalini in soluzione, consumano idrogeno e gli elettrodi sono composti da metalli di transizione. Le specie reattive sono gli ioni 𝑂𝐻. e la reazione di
ricombinazione avviene all’anodo.
III. Pile a combustibile ad acido fosforico (PAFC): necessitano di temperature fra i 150°C -
250°C, sfruttano come elettrolita acido fosforico in una matrice di carburo di silicio, gli elettrodi sono costituiti di grafite mentre il combustibile è l’idrogeno. La specie attiva è lo ione 𝐻+ che forma acqua al catodo.
IV. Pile a combustibile a carbonati fusi (MCFC): operano in un range tra 500°C - 700°C con
un elettrolita di carbonati di metalli alcalini fusi, immersi in una matrice ceramica di LiAlO2. Gli elettrodi sono formati da nichel e relativi ossidi, la specie attiva è 𝐶𝑂>(. , utilizza sia
idrogeno che idrocarburi come combustibile e la reazione di ricombinazione avviene all’anodo.
V. Pile a combustibile protoniche ceramiche (PCFC): lavorano fra 700°C e 800°C, come
elettrolita utilizzano un ossido solido, la specie attiva è 𝐻+, la formazione delle molecole
d’acqua avviene al catodo.
VI. Pile a combustibile ad ossidi solidi (SOFC): in quanto oggetto del presente lavoro tratteremo
Capitolo 2. Pile a Combustibile ad Ossidi Solidi
Il soggetto d’interesse del presente lavoro sono le pile a combustibile ad ossidi solidi (Solid Oxide Fuel Cells Stacks – SOFCs Stacks), così denominate per via degli ossidi che costituiscono l’elettrolita. Come già discusso, le SOFCs sono dispositivi elettrochimici per produzione di energia elettrica a partire da idrogeno ed ossigeno; esse sono attualmente di grande interesse poiché mostrano un’alta efficienza, rispetto ad altre tipologie di pile a combustibile, legata alle alte temperature a cui operano (700 - 1000°C). Questo aspetto le rende particolarmente apprezzate per le applicazioni in cui sia richiesta una grande produzione di energia11. La potenza erogata dalle SOFCs per applicazioni stazionarie di grandi dimensioni può variare dai 100 kW fino ad arrivare a diversi MW, mentre per SOFCs di piccole dimensioni o ad uso domestico si varia da 1 a 20 kW12.
L’utilizzo di alte temperature favorisce la catalisi della reazione di riduzione dell’ossigeno (che altrimenti sarebbe piuttosto lenta) senza l’utilizzo di costosi catalizzatori a base di metalli nobili. In origine le pile a combustibile operavano sopra ai 1000°C; attualmente le temperature operative si sono ridotte fra i 700°C ed i 900°C, permettendo una notevole riduzione dei costi legati alla scelta dei materiali utilizzabili, soprattutto per gli interconnettori13. Il range di temperature possibili per le SOFCs può scendere anche fra i 500 - 750°C ma operare a temperature così basse obbliga all’utilizzo di un elettrolita straordinariamente sottile, non facile da produrre e maneggiare14. Inoltre, la diminuzione della temperatura operativa porta con sé la riduzione della densità di potenza e della capacità di attuare il reforming interno delle SOFCs.
Il formidabile avanzamento avuto negli ultimi anni nel campo della produzione di film sottili, con la possibilità di agire sulla microstruttura al livello delle nano scale, ha permesso la creazione di micro-SOFCs. Le dimensioni fortemente ridotte unite all’efficienza hanno permesso di candidare le micro SOFCs come potenziali sostitute delle batterie nei dispositivi elettronici portatili. Proprio a tal proposito la Figura 2 compara l’efficienza energetica di diversi dispositivi di produzione/ conversione di energia, in base alla densità di energia normalizzata per il peso e per il volume (energia specifica). Le micro-SOFCs grazie alle loro dimensioni molto ridotte sembrano mostrare performance superiori alle attuali batterie agli ioni di litio.
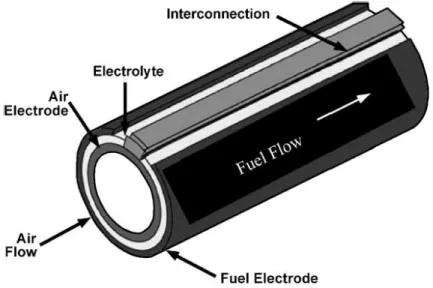
I design attualmente studiati ed in uso per le comuni SOFCs sono tubolari o planari15. Gli schemi delle due tipologie sono presentati in Figura 3
Figura 3–Schema di una SOFC tubolare15.
Figura 4 – Schema di una SOFC planare ed interconnettori15
Osservando i due schemi si possono riconoscere i componenti fondamentali di tali dispositivi: l’anodo, il catodo, elettrolita e gli interconnettori (per SOFCs planari). In verità vi è un ulteriore componente: il sigillante, che permettere di comporre la pila unendo interconnettori e celle.
Ognuno degli elementi citati verrà trattato singolarmente nei prossimi capitoli ponendo particolare attenzione soprattutto alle diverse tipologie di catodi ed interconnettori, essendo i componenti con maggiori implicazioni del lavoro svolto.
2.1 Efficienza delle Pile a Combustibile
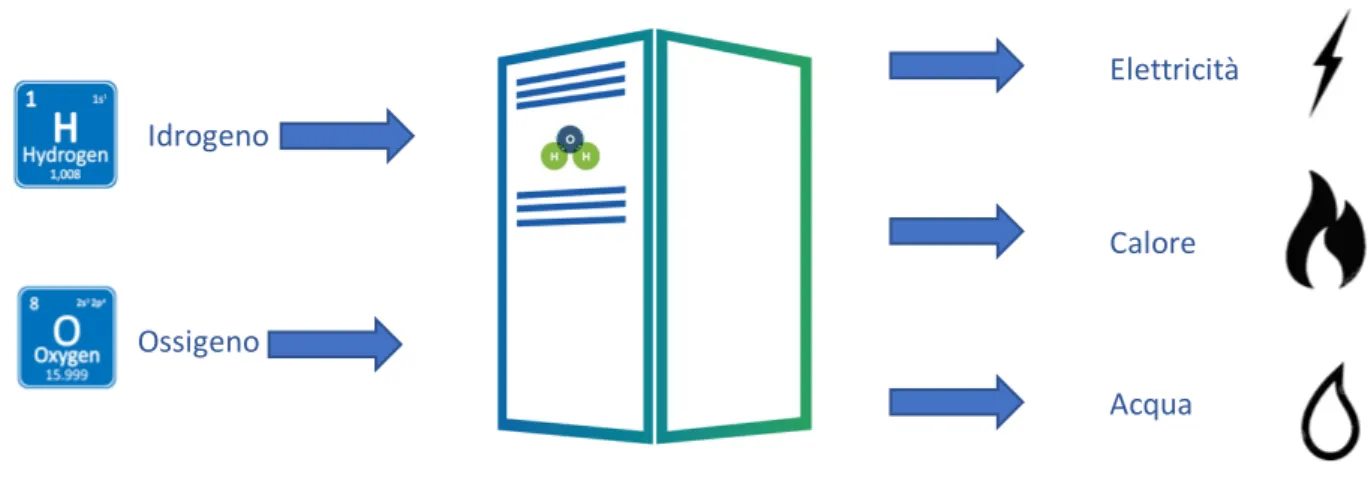
Qualunque sia il sistema di produzione di energia preso in considerazione, il parametro fondamentale per valutare il rapporto costi/benefici e la sua applicabilità è senza dubbio l’efficienza16. A differenza dei dispositivi di generazione di energia elettrica che convertono energia meccanica o termica, in cui la fonte di energia convertita è chiaramente riconoscibile, per le pile a combustibile la situazione è decisamente più complicata. 7,17 (Figura 5).
Figura 5- Schema rappresentante input ed output di una pila a combustibile.
La complessità si cela dietro la definizione di energia chimica. Le quantità che vengono utilizzate per definirla sono: l’entalpia, la funzione di Helmoltz e l’energia libera di Gibbs. Quest’ultima è fondamentale e corrisponde all’energia in grado di compiere un lavoro esterno che, nel caso delle pile a combustibile, consiste nel far circolare gli elettroni in un circuito esterno. Un’altra quantità che può essere impiegata è l’exergia che risulta essere proprio il lavoro esterno che può essere estratto16. Essendo l’energia libera di Gibbs la quantità principale, servirà indagare la variazione dell’energia libera di Gibbs di formazione ∆𝐺A (2.1)
∆𝐺A= 𝐺A(𝑝𝑟𝑜𝑑𝑜𝑡𝑡𝑖) − 𝐺A (𝑟𝑒𝑎𝑔𝑒𝑛𝑡𝑖)
(2.1)
Quindi considerando la Reazione 1.3
∆𝑔̅A = 𝑔̅A(𝐻(𝑂) − 𝑔̅A (𝐻() − L(𝑔̅A(𝑂() (2.2)
𝑔̅A = energia libera di Gibbs molare di formazione. Idrogeno
Ossigeno
Elettricità
Calore
L’equazione (2.2) può apparire piuttosto semplice ma è bene tenere conto che l’energia libera di Gibbs di formazione non è costante ma varia con la temperatura e lo stato fisico delle sostanze. Se si considera un sistema privo di perdite, il processo può essere definito reversibile e dunque tutta l’energia libera di Gibbs potrà essere convertita in energia elettrica; questa considerazione servirà per calcolare il voltaggio a circuito aperto (Open Circuit Voltage - OCV) di una pila a combustibile. Per una reazione in cui 𝑧 elettroni sono trasferiti per ogni mole di combustibile l’OCV sarà:
𝐸 =−∆𝑔̅A
𝑧𝐹 (2.3) In cui 𝐹 è costante di Faraday (96485 C/mol).
L’efficienza massima di un sistema è sempre limitata; così come il ciclo di Carnot segna il limite massimo di efficienza di un motore termico, anche per le pile a combustibile si avrà un limite superiore per tale quantità18. Per poter calcolare il rendimento massimo del sistema bisogna prima definire, similmente alla variazione di energia libera di Gibbs di formazione, la variazione di entalpia di formazione ∆ℎPA (negativa per reazioni esotermiche). Essa è definita come la differenza fra
l’entalpia di formazione dei prodotti meno quella dei reagenti. Ottenute tutte queste grandezze è possibile ricavare l’efficienza massima del sistema che viene detta efficienza termodinamica 𝜂RS;
(2.4).
𝜂RS; =−∆𝑔̅A
∆ℎ̅A ∙ 100 (2.4) In una singola cella ideale, dove tutta l’energia proveniente dalla reazione dell’idrogeno viene convertita in energia elettrica, possiamo calcolare il voltaggio di un sistema con il 100% di efficienza
(2.5).
𝐸 =−∆𝑔̅A
Tale valore dipende dallo stato fisico dell’acqua prodotta dalla reazione come riportato in Tabella 17
Invece, volendo calcolare l’efficienza reale della cella, questa sarà data da: 𝜂 =𝑉X
𝐸 ∙ 100 (2.6) Nell’equazione (2.6) l’efficienza reale corrisponde al voltaggio misurato ai capi della singola cella all’interno di una pila (𝑉X) diviso per quello ideale. Anche in questo caso però non si sta descrivendo fedelmente il sistema perché vi è un ulteriore limite: non tutto il combustibile che viene fornito alla cella viene utilizzato. Dunque, va introdotto un ulteriore parametro di “perdita” chiamato il coefficiente di utilizzo del combustibile 𝜇A (2.7)
𝜇A= 𝑚𝑎𝑠𝑠𝑎 𝑐𝑜𝑚𝑏𝑢𝑠𝑡𝑖𝑏𝑖𝑙𝑒 𝑟𝑒𝑎𝑔𝑖𝑡𝑜
𝑚𝑎𝑠𝑠𝑎 𝑑𝑖 𝑐𝑜𝑚𝑏𝑢𝑠𝑡𝑖𝑏𝑖𝑙𝑒 𝑖𝑛𝑡𝑟𝑜𝑑𝑜𝑡𝑡𝑜 (2.7)
Di conseguenza l’efficienza reale che tiene conto di quanto detto risulterà: 𝜂 = 𝜇A∙𝑉X
𝐸 ∙ 100 (2.8) I valori tipici per 𝜇A si aggirano attorno a 0.95. In ultima istanza è utile notare come l’energia libera di Gibbs sia affetta dalla pressione e dunque dalla concentrazione dei reagenti, di conseguenza si otterranno diversi valori di OCV. Per considerare tale effetto si ricorre all’equazione di Nernst (2.9) (in questo caso verrà fornita con la pressione in bar e l’acqua prodotta verrà considerata allo stato aeriforme, caso più comune per le SOFCs).
𝐸 = 𝐸c+𝑅𝑇
2𝐹 LN g
𝑃ij ∙ 𝑃L(kj 𝑃ijc
l (2.9) Osservando l’equazione (2.9) si trova 𝐸c che corrisponde alla tensione a pressione ambientale, mentre
all’interno della parentesi vi sono i le pressioni parziali dei reagenti al numeratore e quelle dei prodotti al denominatore, tutte elevate per i loro coefficiente stechiometrico. 𝑅 è la costante dei gas [J K-1 mol-1] mentre T [K] è la temperatura.
Tutte le considerazioni fatte fino a questo punto hanno previsto solo elucubrazioni per quanto riguarda la tensione di circuito aperto, nella realtà questa tensione presenta valori inferiori. Inoltre, la tensione operativa diminuisce in funzione del carico elettrico applicato a causa di perdite dovute a irreversibilità presenti nel sistema.
2.2 Tensione di una cella
La tensione di una cella a combustibile ha un valore di tensione teorico che, come accennato nel
Capitolo 2.1, non rispecchia la reale tensione operativa; questo accade per via dei fenomeni di perdita
legati alle irreversibilità. Per comprendere il comportamento di una cella si definisce la curva di tensione in funzione della corrente (I-V) del sistema19.
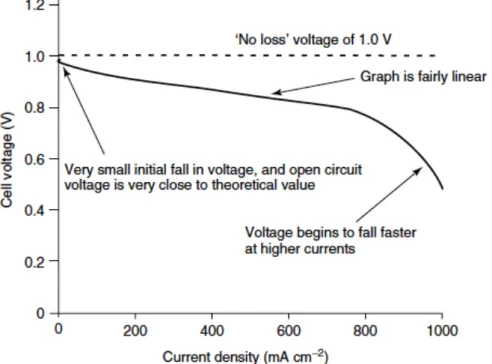
Osservando una tipica curva I-V (Figura 6 e Figura 7) si può notare che la tensione massima non coincide quasi mai con quella corrispondente al sistema privo di perdite; all’aumentare della corrente
Figura 6 -Curva I-V di una pia combustibile operante a basse temperature (circa 100°C) cd a pressione
si ha una immediata caduta rispetto al valore di partenza, successivamente si raggiunge una zona di linearità ed infine, per valori piuttosto alti di corrente si ha una rapida caduta.
Avendo osservato due tipiche curve tensione/corrente sorge spontaneo chiedersi cosa determini tali differenze di andamento e da cosa siano causate le cadute di tensione presenti nei grafici. Fondamentalmente la forma di queste curve per le celle a combustibile è data da quattro tipologie di irreversibilità. Per prima cosa vanno considerate le perdite dovute all’attivazione. Esse sono legate alla velocità con cui le reazioni avvengono all’interfaccia degli elettrodi. Parte della tensione generata viene spesa per guidare la reazione chimica che trasferisce elettroni da ed agli elettrodi.
Questo fenomeno viene descritto dall’equazione (2.10) derivata dall’equazione di Tafel. ∆𝑉SXn = 𝐴 ln r𝑖
𝑖cs (2.10)
𝑖 = densità di corrente
𝑖c = densità di corrente di scambio
𝐴 è una costante che dipende dalla microstruttura e composizione degli elettrodi oltre che della cella in generale.
L’equazione (2.10) è valida solo nelle condizioni in cui i > b.
A partire dall’equazione di Tafel si può trovare l’equazione di Butler-Vollmer (2.11) utile per definire un parametro fondamentale quale 𝑖cIn qualche modo questa grandezza quantifica le reazioni che avvengono negli elettrodi. Per meglio comprendere basti pensare che 𝑖c = 0 significa che non vi è attività sulla superficie dell’elettrodo, dunque nessuna reazione sta avvenendo. Risulta logico pensare che maggiore sarà 𝑖c maggiore sarà l’attività sulla superficie dell’elettrodo. Dunque, la densità di corrente di scambio è un parametro cruciale per definire le performance di un elettrodo.
𝑖 = 𝑖c𝑒t
(uv∆wxyz
{| } (2.11)
𝛼 = coefficiente di trasferimento di carica.
∆𝑉SXn = caduta di tensione dovuta all’attivazione.
Se si prende in considerazione l’equazione (2.11) si comprende come la densità di corrente di scambio affligga sensibilmente il voltaggio della cella e dunque sia responsabile della prima caduta della curva tensione/corrente. Bisogna inoltra segnalare che la densità di corrente di scambio può essere di diversi ordini di grandezza più grande al catodo che all’anodo, questo fatto sarà cruciale nella discussione nei capitoli successivi.
Considerato che questa tipologia di perdita inficia l’efficienza del sistema sarà necessario cercare di limitarla, la sua riduzione si può ottenere nei seguenti modi:
• Innalzare la temperatura la operativa: come osservabile in Figura 6 e Figura 7 la
temperatura modifica sensibilmente la curva I-V. • Utilizzare catalizzatori più efficienti.
• Aumentare porosità dell’elettrodo: permette di aumentare la superficie di reazione effettiva degli elettrodi.
• Aumentare concentrazione reagenti: per esempio utilizzando ossigeno puro invece che aria, questo aumenta l’occupazione dei siti catalitici da parte dei reagenti.
• Aumentare la pressione: anche in questo caso ha effetto sull’occupazione dei siti catalitici. In seconda battuta le perdite derivano dalla diffusione di combustibile o corrente interna, cioè la possibilità che parte del combustibile diffonda attraverso l’anodo e l’elettrolita raggiungendo il catodo dove reagendo con l’ossigeno fa sì che non ci sia corrente prodotta dalla cella. La definizione corrente interna è perfettamente equivalente alla diffusione di combustibile solo che da un diverso punto di vista; in pratica si considerano due elettroni che migrino all’interno della cella dall’anodo al catodo invece che atomi di combustibile. Questo fenomeno giustifica l’utilizzo del parametro 𝜇A per valutare
Un altro fenomeno che contribuisce alle perdite di tensione del sistema sono le perdite Ohmiche. Tali perdite sono dovute alla resistenza al passaggio di ioni o elettroni offerta dai componenti della cella. La caduta di tensione dovuta alle perdite ohmiche è definibile attraverso la prima legge di Ohm (2.12). ∆𝑉•€R = 𝑖𝑟 (2.12) 𝑖 = densità di corrente [mA cm-2].
𝑟 = ASR [Ω cm2]
Quest’ultima tipologia di irreversibilità è particolarmente importante nelle SOFCs; normalmente essa risiede soprattutto nell’elettrolita e negli interconnettori, di conseguenza per limitarla è necessario scegliere un elettrolita con alta conducibilità ionica e progettarlo con il più basso spessore possibile. Questo spesso risulta difficile poiché il suo spessore è limitato dalla sua resistenza meccanica e dalla necessità di separare fisicamente gli elettrodi. Altro aspetto importante è la scelta del materiale del desing degli interconnettori al fine di limitarne la resistenza elettrica20.
L’ultimo meccanismo responsabile dell’andamento della curva tensione/corrente è il trasporto di massa o diminuzione della concentrazione. Tale meccanismo avviene ad elevate densità di corrente quando l’ossigeno viene fornito sotto forma di aria esso viene consumato all’interfaccia col catodo e proprio in quella regione la sua concentrazione diminuisce, similmente all’anodo si possono avere perdite di carico che ne causano la riduzione della pressione parziale. La diminuzione della pressione parziale dei reagenti causa la rapida diminuzione della tensione della cella.
Capitolo 3. Componenti delle SOFCs
Analizzati i concetti generali delle pile a combustibile, in particolare di quelle ad ossido solidi, si analizzeranno i concetti fondamentali ed i materiali riguardanti i componenti delle SOFCs.
3.1 Sovratensione
Prima di proseguire oltre con i dettagli sui materiali è bene soffermarsi sulla definizione di sovratensione 𝜂; con questo termine si definisce la differenza di potenziale della semicella cioè la differenza fra il potenziale di elettrodo misurato 𝐸(𝑖) e quello alle condizioni di equilibrio 𝐸c (3.1)21. 𝜂 = 𝐸(𝑖) − 𝐸c (3.1)
Il valore della sovratensione indica quanta energia elettrica viene fornita dalla cella, maggiore sarà la sovratensione minore sarà l’energia prodotta. Questo si giustifica considerando la sovratensione come un fenomeno dissipativo poiché in effetti porta allo sviluppo di calore per effetto Joule.
La sovratensione di una cella, data dalla differenza dei potenziali di elettrodo, è dovuta ai diversi contributi dei singoli componenti secondo l’equazione
𝐸X‚ƒƒS = 𝐸X‚ƒƒSc + 𝜂
S„− 𝜂XSn+ 𝜂… (3.2)
La sovratensione di una generica cella è dovuta alle due semicelle che la costituiscono ed è quindi dovuta a: caduta ohmica 𝜂…, sovratensione dell’anodo 𝜂S„ e la sovratensione del catodo 𝜂XSn22. Il
termine 𝐸X‚ƒƒSc indica il potenziale della cella all’equilibrio.
La sovratensione delle singole semicelle può essere a sua volta ricondotta a contributi legati al meccanismo che ne determina la polarizzazione, questi sono: sovratensione per polarizzazione di concentrazione, dovuta alla differenza di concentrazione al doppio strato elettronico e la sovratensione per trasferimento di carica porta alla polarizzazione di attivazione. Per la trattazione successiva siamo interessati alla sovratensione per polarizzazione di concentrazione che si definisce:
𝜂X•„X = 𝑘‡𝑇 𝑧𝑒 ln ˆ (𝑂𝑥 𝑅𝑒𝑑⁄ )‹ (𝑂𝑥 𝑅𝑒𝑑⁄ )Œ• = 𝑅𝑇 𝑧𝐹ln ˆ (𝑂𝑥 𝑅𝑒𝑑⁄ )‹ (𝑂𝑥 𝑅𝑒𝑑⁄ )Œ• (3.3) in cui:
𝑘‡ è la costante di Boltzmann. 𝑧 è la valenza delle specie. 𝑒 indica la carica elementare.
3.2 Fase tripla
Un altro concetto estremamente importante per la comprensione dei requisiti che i materiali devono soddisfare per poter essere impiegati per la produzione di catodi è il la fase tripla (Triple Phase Boundary – TPB). Letteralmente il TPB è il confine fra tre diverse fasi: l’elettrolita (conduttore ionico), l’elettrodo (conduttore elettronico) ed una fase “virtuale” cioè le porosità che trasporta le molecole gassose. Questo concetto risulta estremamente importante poiché le reazioni di ossido-riduzione avvengono esclusivamente in questa zona. Per esempio, parlando del catodo la reazione di riduzione dell’ossigeno può avvenire solo nei punti in cui abbiamo l’interfaccia fra le tre fasi descritte prima. Questo fa sì che per ottenere un maggior numero di reazioni di riduzione delle molecole di ossigeno, e dunque un elettrodo più efficace, sia necessario massimizzare l’area di interfaccia che corrisponde al TPB. Il concetto di TPB sarà particolarmente importante quando si parlerà dell’evaporazione del cromo ed il conseguente avvelenamento del catodo. In Figura 8 si può notare quanto sia ridotta la porzione di spazio del TPB rispetto alle dimensioni dell’elettrodo e dell’elettrolita23.
TPB
Elettrodo Porosità
Elettrolita
3.3 Elettrolita
Essendo l’elettrolita il componente che dà il nome a questa tipologia di pile a combustibile e ne determina le temperature operative è buona norma cominciare descrivendo le possibili tipologie di elettrolita e la loro funzione. Nelle SOFCs l’elettrolita è costituito da ossidi solidi che permettono la diffusione di ioni 𝑂(. ed allo stesso tempo separano elettricamente gli elettrodi dove le due semi
reazioni di ossidazione e riduzione avvengono. Normalmente l’elettrolita si presenta come uno strato ceramico denso. In alcuni casi l’elettrolita può fungere da supporto strutturale della cella durante la fabbricazione delle celle supportate dall’elettrolita (Electrolyte Supported Cells - ESCs), sempre più spesso però si predilige delle celle supportate dall’anodo (Anode Supported Cells - ASCs) poiché le più basse temperature operative si accompagnano ad elettroliti più sottili. Gli spessori tipici si aggirano attorno ai 150-250 𝜇𝑚 per le temperature più alte che favoriscono la conducibilità ionica14,24, questo implica che per temperature più basse lo spessore può ridursi anche di due ordini di grandezza. L’elettrolita può essere costituito da un singolo strato od essere bistrato, questo per poter combinare diversi materiali ed aumentarne le performance25. Quando si progetta un elettrolita per pile a combustibile bisogna tener presente quelle che sono le caratteristiche fondamentali che tale componente deve possedere:
• Conducibilità ionica: deve permettere il passaggio degli ioni 𝑂(., tale caratteristica è
quantificata dal numero di trasporto ionico dell’ossigeno t (il cui massimo è 1).
• Isolante elettrico: deve prevenire il cortocircuito fra i due elettrodi in modo da forzare il passaggio di corrente attraverso il circuito esterno.
• Chimicamente stabile alle alte temperature e negli ambienti presenti: in particolare, in ambienti ossidanti e riducenti.
• Impermeabile ai gas: per far sì che non ci sia passaggio di reagenti, soprattutto di combustibile.
• Sottile ed uniforme: lo spessore e l’omogeneità influiscono sulla resistenza elettrica dell’elettrolita.
• Coefficiente espansione termico confrontabile con gli elettrodi: per evitare fratture della cella durante il riscaldamento od il raffreddamento.
In Tabella 2 è riportata una carrellata dei principali composti impiegati per produrre elettroliti14,26,27,28,29.
Acronimo Zirconia Formula chimica YSZ SSZ CaSZ Ceria (ZrO2)1-x(Y2O3)x (x~0.08-0.1) (ZrO2)x(Sc2O3)1-x (x~0.8) Zr0.85Ca0.15O1.85 GDC SDC YDC CDC Lantanio LSGM LSGMC LSGMF LSGMCF LAALO3 CexGd1-x Oy (x~0.8, y~1.8) CexSm1-x Oy (x~0.8, y~1.9) CexY1-x Oy (x~0.8, y~1.96) CexCa1-x Oy (x~0.8, y~1.8) LaxSr1-xGayMg1-yO3 (x~0.9, y~0.8) LaxSr1-xGayMg1-y-zCozO3 (x~0.8, y~0.8, z~0.085) LaxSr1-xGayMg1-y-zFezO3 (x~0.8, y~0.5, z~0.4) La0.8Sr0.2Ga0.32Mg0.08Co0.2Fe0.4O3 La1-xCaxAlO3 (x=0.0027-0.008) La1-xBaxAlO3 (x=0.1)
Tabella 2 - Materiali per elettrolita
Fra i possibili materiali attualmente utilizzati per l’elettrolita quelli preferiti sono l’ossido di zirconio e l’ossido di cerio stabilizzata con struttura di tipo fluorite11. L’ossido di zirconio è in assoluto la soluzione più utilizzata per via del suo basso costo30. Nel range operativo 800-1000°C la zirconia possiede una buona resistenza meccanica ed agli shock termici, particolarmente quando dopata con Y2O3, Sc2O3, Sm2O3 e MgO. Fra i possibili materiali a base ossido di zirconio il più utilizzato come elettrolita per le SOFCs è YSZ poiché caratterizzato da un’ottima stabilità chimica e meccanica, da una buona conducibilità ionica ed è un isolante elettrico31. La conducibilità ionica di questo materiale si deve alla struttura cristallina stabilizzata dalla presenza dell’ittrio; il cristallo di ZrO2 possiede due atomi di ossigeno per ogni atomo di zirconio mentre nel Y2O3 vi sono solo 1.8 atomi di ossigeno per ogni atomo di ittrio. Come conseguenza gli ioni 𝑂(. possono migrare in queste vacanze presenti nella
struttura cristallina.
In alternativa ai materiali a base ossido di zirconio vengono utilizzati alcuni a base ossido di cerio poiché possiedono un’alta conducibilità ionica. In particolare, la ceria dopata Gd, Sm, Y e Ca (GDC, SDC, YDC e CDC). Sebbene questi materiali abbiamo mostrato una stabilità maggiore rispetto a quelli base zirconia hanno la tendenza a diventare instabili a basse pressioni parziali di ossigeno ed al di sopra dei 700°C, temperature a cui la loro conducibilità elettrica comincia diventare importante causando cortocircuiti7.
Un’ulteriore classe di materiali impiegabili come elettrolita sono quelli a base gallato di lantanio con struttura tipo perovskite, tra cui i più comuni sono LSGM e LSGMD. Questi hanno mostrato in diversi studi di possedere una conducibilità ionica superiore rispetto al YSZ10,32,33. Il principali problemi dei materiali a base gallato di lantanio è l’evaporazione del gallio in presenza di basse pressioni parziali di ossigeno od in atmosfere riducenti, una bassa stabilità meccanica a lungo termine (rispetto al YSZ), difficoltà di produrre film sottili34 ed il loro costo.
3.4 Anodo
Dopo aver affrontato l’analisi dei diversi materiali che costituiscono l’elettrolita è ora il momento di analizzare un altro componente: l’anodo. Esso è il così detto elettrodo del combustibile (Fuel Electrode) in cui avviene l’ossidazione dell’idrogeno (Reazione 1.1). Come accennato in precedenza spesso le celle sono supportate dall’anodo durante la fabbricazione, in questo caso tale componente deve presentare sufficiente resistenza meccanica.
Per quanto riguarda i materiali utilizzati per l’anodo i metalli sono i principali per via dell’atmosfera riducente in cui devono operare; in realtà, però, è più comune che siano utilizzati in compositi con materiali ceramici (cermet) al fine di allinearsi il più possibile col coefficiente di espansione termico dell’elettrolita. Anche nel caso dell’anodo vi sono alcuni requisiti sui materiali utilizzabili e sono 35,36,37:
• Conducibilità elettrica: per permettere agli elettroni di circolare passare facilmente al circuito esterno
• Alta attività elettrocatalitica: deve far avvenire la reazione di ossidazione dell’idrogeno • Estesa TPB: Legato alla porosità dell’anodo che normalmente si attesta fra il 20-40% per
consentire il trasporto di massa. Una trattazione più specifica del TPB verrà fatta in seguito. • Resistenza meccanica: nel caso di celle supportate dall’anodo
• Coefficiente espansione termico simile ai componenti vicini: per prevenire fratture • Particelle di piccola dimensione: in modo da aumentare la superficie specifica.
• Permettere reforming interno: nel caso di celle direttamente alimentate con idrocarburi o gas naturali.
Il materiale che meglio sembra soddisfare tutti questi requisiti è il nickel, benché non abbia un basso costo risulta comunque meno dispendioso dei metalli nobili. La percentuale con cui il nickel si trova nei cermet che costituiscono l’anodo è de 40-60%. L’utilizzo del nickel pone anche dei problemi di compatibilità fra l’anodo e l’elettrolita che quindi andrà scelto di conseguenza.
Tra gli elettrodi al nickel il più popolare è il NiO/YSZ (usato con YSZ come elettrolita), esso ha mostrato un ridotto coefficiente di espansione termica, un ingrossamento delle particelle limitato nel tempo ed una elevata estensione di TPB.
In alternativa vengono utilizzati anodi del tipo NiO/SDC e NiO/GDC (Compatibili con elettroliti a base ossido di cerio), questi possiedono una maggiore conducibilità elettronica ed ionica, maggiore attività catalitica e stabilità a lungo terimine14,38, ma portano con se i problemi legati all’elettrolita base ossido di cerio elencati in precedenza.
3.5 Catodo
Il passo successivo, dopo aver analizzato le caratteristiche ed i materiali principali per l’elettrolita e l’anodo e compreso alcuni concetti generali, è passare in rassegna i materiali per la fabbricazione del catodo.
Il catodo è l’elettrodo in cui avviene la reazione di riduzione dell’ossigeno (Reazione 1.2), per questo viene chiamato elettrodo dell’aria o dell’ossigeno (Air Electrode). Per via delle alte temperature e dell’atmosfera ossidante possono essere utilizzati esclusivamente metalli ed ossidi elettronicamente conduttivi per la produzione di catodi. Considerato l’alto costo dei metalli nobili si preferisce utilizzare miscele di ossidi di diversa natura. Bisogna sottolineare, ricongiungendoci al discorso dell’efficienza del sistema, che alle basse temperature la maggior parte della resistenza delle SOFCs risiede nel catodo poiché esso possiede una sovratensione decisamente maggiore rispetto all’anodo; questo per via della sua grande polarizzazione di attivazione e di concentrazione.
Dopo aver trattato la definizione di sovratensione si può passare ad elencare quelle che sono le principali caratteristiche che, i materiali adatti all’utilizzo come catodo, devono possedere:
• Alta conducibilità elettronica e ionica;
• Compatibilità chimica e buona adesione con l’elettrolita: per evitare reazioni d’interfaccia indesiderate.
• Abbastanza sottile e poroso: da permettere il trasporto di massa dei reagenti e prodotti. • Stabile in ambiente ossidante;
• Estesa TPB;
• Catalizzare la dissociazione dell’ossigeno: per una maggior velocità di reazione. • Coefficiente di espansione termico confrontabile con i componenti vicini;
Le prestazioni dei materiali costituenti il catodo sono fortemente dipendenti dalla temperatura (anche se meno dell’elettrolita), dalla taglia delle particelle, dalla microstruttura e dal processo con cui
vengono depositati. I più comuni ossidi misti che hanno dimostrato di soddisfare le proprietà sopra elencate sono riportati in Tabella34,8,14,31,36–41. Per meglio comprendere i materiali utilizzati per il catodo bisogna comprendere la struttura degli ossidi utilizzati che solitamente è di tipo perovskite; la sua formula generate è 𝐴𝐵𝑂> in cui 𝐴 e 𝐵 sono cationi. I cationi 𝐴 possiedono la valenza minore (La,
Sr, Ca, etc.), sono più grandi e sono coordinati con dodici atomi di ossigeno, invece i cationi 𝐵 (Ti, Cr, Ni, Fe, Co, Zr, etc.) sono meno voluminosi e sono coordinati con sei atomi di ossigeno. Spesso vengono effettuate delle sostituzioni dei cationi 𝐴 e 𝐵 e la valenza risultante nei siti corrispondenti può portare a delle lacune di carica e quindi introdurre delle vacanze nei siti reticolari dell’ossigeno45,46. Molto di frequente viene effettuato il dopaggio in entrambi i siti.
La perovskite possiede una struttura cubica che può essere distorta dalla sostituzione di atomi nella struttura (Figura9). Nella maggior parte dei materiali tipo perovskite usati nei catodi i cationi nel
sito 𝐴 sono una miscela di terre rare o metalli alcalini (La, Sr, Ca o Ba), mentre per quanto riguarda il sito 𝐵 i cationi presenti sono di metalli di transizione (Mn, Co, Fe o Ni).
Solitamente il meccanismo catalitico è garantito dai cationi nei siti 𝐵. Grazie alla simmetria ottaedrica intorno allo ione del metallo di transizione comunemente viene promossa una struttura a bande di tipo metallico o semiconduttore che permette di avere una elevata conduzione elettronica alle alte temperature. Per quanto riguarda la conducibilità ionica, essa si può ottenere con scelta attenta dei cationi posti nei siti 𝐴 e B poiché, così facendo, è possibile introdurre un’alta concentrazione di vacanze nel sub reticolo dell’ossigeno. Tali vacanze promuovono il trasporto degli ioni ossigeno alle temperature operative delle SOFCs47. Alcuni dei composti di tipo perovskite spesso utilizzati sono nella forma 𝐴L.;𝐴;𝐵𝑂>, in questo caso si ottiene una regione ossigeno-metallo di transizione sub
stechiometrica che porta ad una situazione di vacanza di ossigeno. La vacanze sono causate dalla sostituzione di 𝐴>+con 𝐴(+e dalla parziale riduzione di 𝐵>+o 𝐵•+ rispettivamente a 𝐵(+o𝐵>+, come
Fra i vari ossidi riportati in Tabella 3 quelli sicuramente di più grande successo sono LSM, LSF, LSC, LSCF e SSC; all’interno dei materiali base lantanio probabilmente il più utilizzato per le SOFCs ad alte temperature risulta essere LSM per via della sua stabilità a contatto con l’elettrolita YSZ. Generalmente in questo composto il sito 𝐴 viene dopato con stronzio (10-30%mol) per garantire la conducibilità elettrica, inoltre il LSM viene spesso miscelato con il YSZ per implementare il TPB. Per via delle sue proprietà elettriche scadenti alle basse temperature, LSM non è adatto alle temperature al di sotto degli 800°C. I migliori candidati per sostituire il LSM a temperature fra i 650-800°C sono LSF e LSCF49. Questi composti sono ottenuti dopando il sito 𝐵 con elementi come il cobalto, il nickel ed il manganese al fine di aumentare la stabilità chimica a lungo termine e la densità di corrente grazie ad valori di sovratensione, a basse temperature, inferiori rispetto al LSM43. LSCF si è dimostrato particolarmente efficiente quando accoppiato con un elettrolita di GDC per via della grande stabilità ed un estremamente compatibile coefficiente di espansione termica29,26. LSCF possiede, però, una maggiore energia di attivazione rispetto al LSC e questo fa sì che la resistenza cresca rapidamente al diminuire della temperatura.
Per quanto concerne i materiali a base stronzio il più popolare risulta essere il SSC poiché ha mostrato conducibilità ionica maggiore rispetto al LSM, performance simili al LSCF ed è particolarmente affine al GDC ed al LSGM. D’altro canto, però possiede una resistenza elettrica superficiale estremamente elevata quando opera insieme al YSZ, il che ne limita l’uso ad alte temperature. Non va trascurato che il samario è un elemento piuttosto costoso, questo ne limita ulteriormente l’applicabilità su larga scala.
I materiali base gadolinio si sono rivelati promettenti per le basse temperature grazie alla loro compatibilità con il GDC. In particolare risulta interessante il GSC poiché ha mostrato una sovratensione a 800°C più bassa di quasi un ordine di grandezza rispetto al LSM a 1000°C 50, inoltre il suo coefficiente di espansione termica risulta essere più compatibile con YSZ e GDC rispetto al LSC. Il GSC è particolarmente promettente quando accoppiato con GDC poiché mostra una particolarmente ridotta resistenza elettrica superficiale.
In ultima battuta vi sono i catodi a base ossido di ittrio come per esempio YSCF, YCCF e YBCu. Il primo si è dimostrato interessante per applicazioni a temperature intermedie (circa 800°C) ed utilizzato con un elettrolita di SDC. YSCF possiede una minore sovratensione rispetto al LSC ma maggiore del LSCF51. YCCF ha una maggiore capacità di ridurre l’ossigeno se confrontato col LSM ma non è compatibile con YSZ. In fine il YBCu avendo un’energia di attivazione piuttosto bassa potrebbe essere applicato in pile a combustibile che lavorino a basse temperature.
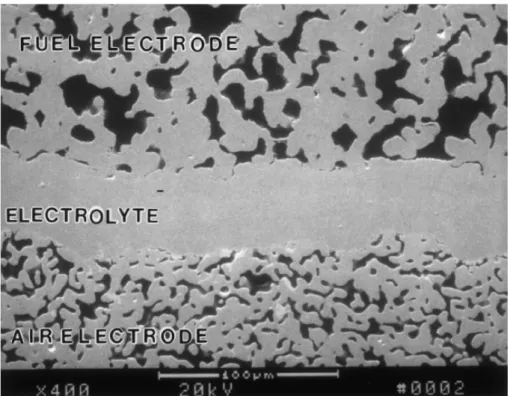
La Figura10 permette di avere una visione di insieme degli elettrodi ed elettrolita. L’attenzione va
posta sulla differente morfologia fra l’elettrolita, sottile e compatto, e gli elettrodi più spessi e porosi. La differente porosità è riscontrabile anche fra anodo e catodo. In questa immagine è anche importante osservare quanto ridotte siano le zone di TPB.
Figura 10–Immagine al SEM con elettroni secondari della microstruttura in sezione trasversale di una cella a combustibile della Siemens-Westinghouse
Acronimo Formula Lantanio LSM LSF LSC LSCF LSMC LSMCr LCM LSCu LSFN LNF LSCN LBC LNC LSAF LSCNCu LSFNCu LNO Gadolinio GSC GSM Ittrio YSCF YCCF YBCu Stronzio SSC NSC BSCCu Prasodimio PSM PCM PBC LaxSr1-xMnO3 (x ~ 0.8) LaxSr1-xFeO3 (x ~ 0.8) LaxSr1-xCoO3 (x ~ 0.6-0.8) La1-xSrxFeyCo1-yO3 (x ~ 0.4, y ~ 0.2) LaySr1-xMayCo1-yO3 (x ~ 0.8) (LaxSr1-x).91MnyCr1-yO3 (x ~ 0.7, y ~ 0.95) LaxCa1-xMnO3 (x ~ 0.5) La1-xSrxCuO2.5 (x ~ 0.2) LaxSr1-xFeyNi1-yO3 (x = 0.8, y=0.8) LaNi1-xFexO3 (x ~ 0.4) LaxSr1-xCoyNi1-yO3 (x ~ 0.6, y ~ 0.98) LaxBa1-xCoO3 (x ~ 0.4) LaxNi1-xCoxO3 (x ~ 0.6) LaxSr1-xAlyFe1-yO3 (x ~ 0.8, y ~ 0.2) LaxSr1-xCoyNi1-y-zCuzO3 (x ~ 0.8, y ~ 0.8, z ~ 0.05) LaxSr1-xFeyNi1-y-zCuzO3 (x ~ 0.8, y ~ 0.8, z ~ 0.05) LaNiO3 GdxSr1-xCoO3 (x ~ 0.8) Gd1-xSrxMnO3 (x ~ 0.3-0.06) Y1-xSrxCoyFe1-yO3 (x ~ 0.3-0.8, y = 0.7) Y1-xCaxCoyFe1-yO3 (x = 0.2, y ~ 0.1-07) YBa2Cu3O7 SmxSr1-xCoO3 (x~ 0.5) NdxSr1-xCoO3 (x ~ 0.8) Bi2Sr2CaCu2O8 PrxSr1-xMnO3 (x~ 0.65) PrxCa1-xMnO3 (x~ 0.7) PrxBa1-xCoO3 (x~ 0.5)
3.6 Interconnettori
Dopo aver analizzato i singoli componenti che compongono la cella è necessario prendere in considerazione ciò che strutturalmente mantiene unite le diverse celle per formare una pila. Risulta necessario sottolineare che gli interconnettori sono il soggetto principe degli studi e degli esperimenti fatti in questo lavoro poiché, come verrà ampiamente trattato nel Capitolo 4, sono i responsabili del rilascio di specie volatili del cromo e del conseguente avvelenamento del catodo.
Gli interconnettori delle prime SOFCs erano costituiti di materie ceramiche, per lo più 𝐿𝑎𝐶𝑟𝑂>, a causa delle temperature operative estremamente alte. Il 𝐿𝑎𝐶𝑟𝑂> è un semiconduttore di tipo p e di conseguenza a basse pressioni parziali di ossigeno mostra deficienze di ossigeno che riducono la sua conducibilità elettrica52. Attualmente, grazie al progresso negli elettroliti utilizzati, le temperature operative si attestano al di sotto dei 1000°C, il che ha permesso ai materiali metallici di essere applicabili. Ovviamente la prima conseguenza di questo è stata una decisa riduzione dei costi di produzione grazie alle più semplici e consolidate tecnologie di lavorazione dei materiali metallici. A livello generale gli interconnettori hanno la funzione strutturale di sostenere la pila a combustibile, fungono da contatto elettrico fra le diverse celle e hanno l’importante compito di distribuire nel migliore dei modi il flusso dei gas che arrivano agli elettrodi mantenendoli separarti nelle diverse celle. Per poter espletare tutte le funzioni che gli si richiedono devono rispondere ad una serie di requisiti14:
• Resistenza all’ossidazione ad alte temperature: gli interconnettori sono esposti ad ambienti molto aggressivi, sia riducenti che ossidanti.
• Stabile chimicamente nell’ambiente operativo: non deve dare luogo a reazioni indesiderate con i componenti vicini.
• Alta conducibilità elettrica: per non introdurre eccessive dissipazioni ohmiche, il valore soglia per la loro ASR è di 0,1 Ω𝑐𝑚(.
• Alta conducibilità termica: per scongiurare gradienti termici, il valore minimo è 5 𝑊/(𝑚𝐾). • Impermeabilità ai gas: non devono permettere il passaggio ed il mescolamento dei gas
presenti nei diversi comparti delle celle.
• Coefficiente di espansione termico confrontabile con elementi vicini: al fine di prevenire rotture dei fragili componenti ceramici. Mediamente il valore si aggira fra 11-12,5 𝜇𝑚/(𝑚𝐾). • Resistenza meccanica alle alte temperature: per evitare di incorrere in deformazioni meccaniche legate sia alle temperature che agli sforzi dovuti alla dilatazione termica dei componenti della cella. Tipicamente è necessaria una buona resistenza al creep.
Considerando tutte le proprietà elencate sopra i materiali metallici più indicati sono: le leghe del cromo, gli acciai inossidabili ferritici (FSSs), acciai inossidabili austenitici e le super leghe base nickel. Per quanto riguarda le leghe del cromo il loro principale limite risiede proprio nelle elevate percentuali di cromo poiché ad alte temperature ed in presenza di vapore acque rilascia specie volatili del cromo che avvelenano il catodo. Le super leghe base Ni e le leghe Ni-Cr presentando una cella cristallina cubica a facce centrate (FCC) posseggono un coefficiente di espansione termica troppo elevato rispetto agli altri componenti della pila. Lo stesso può dirsi per gli acciai inossidabili austenitici poiché grazie ad elementi austenitizzanti, come il Ni, che stabilizzano la fase 𝛾 mostrano una cella FCC. Quindi la scelta è ricaduta inevitabilmente sui FSSs che hanno dimostrato di soddisfare tutti i requisiti necessari.
3.6.1 Acciai Inossidabili Ferritici
Fra le leghe per le alte temperature i preferiti per la fabbricazione degli interconnettori sono i FSSs. Si tratta di acciai altolegati a base Fe-Cr con i tenori di Cr minimi del 12% ma che in alcuni acciai possono raggiungere valori intorno al 30%53. Sebbene gli elementi principali siano ferro e cromo mentre il carbonio è in tenori molto ridotti (minore dello 0,1%) queste leghe ricadono comunque nella categoria degli acciai. I FSSs devono il loro nome alla microstruttura, infatti, data l’alta concentrazione di Creq in lega e la quasi totale assenza di Nieq, la fase stabilizzata è la fase 𝛼 (ferrite). Per prevedere la microstruttura finale sulla base della composizione della lega viene utilizzato il diagramma di Schaeffler (Figura11).
Osservando il diagramma di Schaeffler notiamo che ad alte percentuali di Cr la struttura prevista è ferritica; la ferrite possiede una struttura cubica a corpo centrato (BCC), principale responsabile del coefficiente di espansione termico di questa classe di materiali.
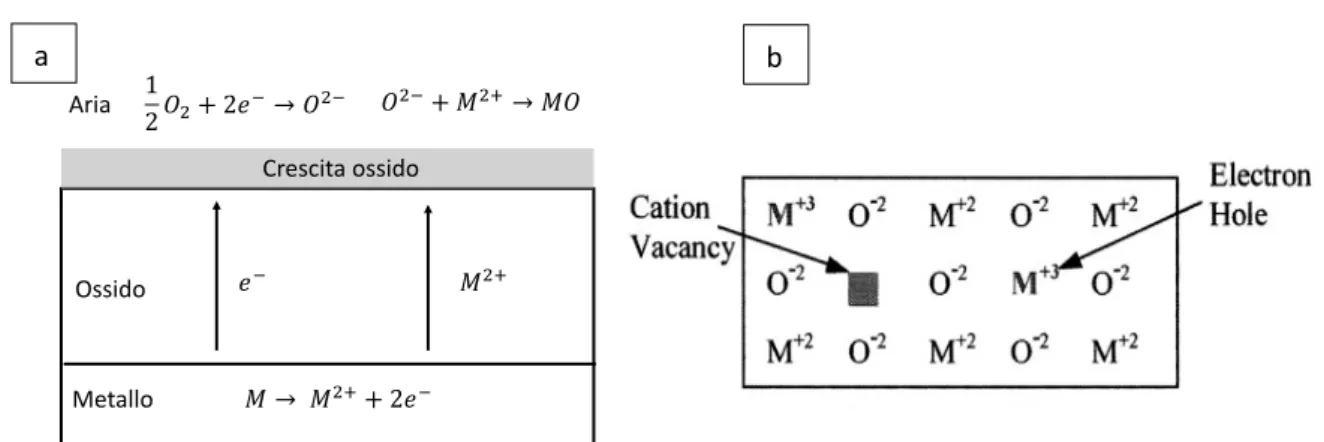
Questi acciai sono stati ideati per garantire ottime proprietà di resistenza alla corrosione, ossidazione a caldo oltre ad una buona lavorabilità. La maggior parte delle proprietà di questi acciai si devono alle alte percentuali di Cr, infatti queste leghe sono chiamate chromia forming per la loro capacità di passivarsi. La protezione del materiale avviene tramite la formazione uno strato superficiale molto sottile, coerente, aderente al substrato e compatto di ossido di cromo (III) (Cr2O3 che in inglese viene chiamato appunto chromia). Sebbene quest’ossido sia ben adeso può essere asportato per abrasione meccanica ed in alcuni casi anche per stress termici. Per le sue caratteristiche l’ossido superficiale è in grado di proteggere in modo estremamente efficace l’acciaio dalla corrosione. La passivazione degli acciai inossidabili è opera dell’ossidazione selettiva dei Cr presente in lega, affinché questo sia possibile esiste una concentrazione minima critica (𝑁‡X–—n ) al di sotto della quale il processo non può
avvenire (3.4)54. 𝑁‡X–—n = 𝑉R 32𝑣 r 𝜋𝑘š 𝐷‡s L ( (3.4) 𝐷‡ = coefficiente diffusione elemento B in lega.
𝑉R = volume specifico della lega.
𝑣 = rapporto ossigeno/ elemento B nell’ossido. 𝑘š = costante parabolica di crescita dell’ossido.
Una proprietà molto importante del Cr2O3 è la sua alta conducibilità elettrica ad alta temperatura (circa 9,9 ∙ 10.> 𝑆/𝑐𝑚 ad 800°C)55, sebbene questo valore sia molto buono per un materiale semiconduttore riduce inevitabilmente la conducibilità dell’acciaio che di per se avrebbe i tipici valori di conducibilità dei metalli.
Il tipico inconveniente di questi FSSs risiede nella composizione reale dell’ossido poiché non si riscontra praticamente mai la formazione del solo 𝐶𝑟(𝑂> puro per via dell’alta presenza di altri elementi, ma si osserva un vasto numero di diversi ossidi tipicamente con struttura di tipo spinello e con composizione mista manganese-cromo e ferro-cromo (𝑀𝑛, 𝐶𝑟)>𝑂•, (𝐹𝑒, 𝐶𝑟)>𝑂•. Tali ossidi
presentano una buona resistenza meccanica allo scagliamento ma diminuiscono sensibilmente la conducibilità degli interconnettori. La problematica più importante di questi acciai è sicuramente lo
lavoro ed in quanto tale seguirà un’approfondita trattazione di questo fenomeno. Inoltre, l’ispessimento dello strato di ossido superficiale dei FSSs porta un progressivo peggioramento delle caratteristiche di conducibilità elettrica del pezzo oltre al rischio di distacco dell’ossido stesso. Prima di impiegare una lega per qualsivoglia applicazione è consigliabile conoscerne il diagramma di stato che in questo caso sarà il diagramma Fe-Cr (Figura12). La motivazione risiede nel fatto che
a particolari composizioni o temperature si possono avere reazioni o diverse solubilità che possono portare a fenomeni indesiderati.
Gli inconvenienti delle leghe Fe-Cr sono tipicamente il 475°C infragilimento e la formazione della fase 𝜎 . Nel primo caso il fenomeno è riferibile all’intervallo di composizione fra il 15% ed il 75% per leghe sottoposte a temperature fra 400-550°C, in cui si ha la decomposizione della lega in una fase ricca di ferro (fase 𝛼) ed una ricca in cromo (fase 𝛼′)56. Inoltre, per leghe con il 25-30% di Cr si può avere la formazione di una fase intermetallica, molto dura e fragile, particolarmente ricca in cromo; la fase 𝜎. La precipitazione avviene fra i 550°C e 800°C, tale fase infragilisce notevolmente l’acciaio ma il suo effetto peggiore si ha dal punto di vista corrosionistico, infatti la formazione della fase 𝜎 comporta l’arricchimento in Cr della zona in cui si forma ed il depauperamento della zona circostante creando rispettivamente una zona catodica ed una anodica che produce fenomeni di corrosione molto spinti.