UNIVERSITA’ DEGLI STUDI DI GENOVA
Scuola di Scienze Mediche e Farmaceutiche
CORSO DI LAUREA MAGISTRALE IN MEDICINA E
CHIRURGIA
Tesi di Laurea
“Ruolo della chemochina CXCL12 nella proliferazione, migrazione e
neoangiogenesi di cellule staminali di meningioma umano”
RELATORE CANDIDATO
Prof. Tullio Florio Iemma Federico
Sommario
ABSTRACT ... 3 1. INTRODUZIONE ... 4 1.1 TUMORI CEREBRALI ... 4 1.2 MENINGIOMA ... 7 1.2.1 Classificazione ... 8 1.2.2 Patologia ... 10 1.2.3 Alterazioni molecolari ... 11 1.2.4 Epidemiologia ... 141.2.5 Eziologia e fattori di rischio ... 16
1.2.6 Diagnosi ... 22
1.2.7 Trattamento ... 27
1.3 CELLULE STAMINALI ... 38
1.3.1 Cellule staminali tumorali ... 40
1.3.2 Identificazione delle CSC ... 42
1.3.3 CD105 come marker delle CSCs di meningioma ... 44
1.4 CHEMOCHINE ... 46
1.4.1 Recettori delle chemochine ... 49
1.4.2 Chemochine e tumori ... 53
1.4.3 Sistema delle chemochine nel meningioma ... 54
1.4.4 CXCR4 e CXCR7 come bersaglio farmacologico ... 58
2. RAZIONALE E SCOPO DELLA TESI ... 60
3.2 ISOLAMENTO E CARATTERIZZAZIONE DI CSC DI MENINGIOMA ... 67
3.3 GLI ASSI CXCR4/CXCR7-CXCL11/CXCL12 NELLE CELLULE DI MENINGIOMA UMANO ... 73
3.4 CXCL11 E CXCL12 POTENZIANO LA PROLIFERAZIONE DI COLTURE STEM DI MENINGIOMA UMANO ... 76
3.5 POTENZIAMENTO DELLA MIGRAZIONE DI COLTURE STEM DI MENINGIOMA INDOTTA DA CXCL11 E CXCL12 ... 77
3.6 CXCL11 E CXCL12 PROMUOVONO LA FORMAZIONE DI TUBI SIMIL-CAPILLARI NELLE COLTURE STEM DI MENINGIOMA ... 80
3.7 L’INIBIZIONE FARMACOLOGICA DI CXCR4 E CXCR7 ARRESTA LA PROLIFERAZIONE, LA MIGRAZIONE E LA FORMAZIONE DI TUBI SIMIL-CAPILLARI INDOTTI DA CXCL11 E CXCL12 NELLE CELLULE STEM DI MENINGIOMA UMANO ... 83
4. CONCLUSIONI ... 88
5. MATERIALI E METODI ... 92
5.1 SEPARAZIONE MECCANICA E COLTURA DI CELLULE DI MENINGIOMA UMANO DA CAMPIONI CHIRURGICI ... 92
5.2 SAGGIO DI PROLIFERAZIONE CELLULARE ... 93
5.3 SAGGIO DI FORMAZIONE DI MENINGOSFERE ... 94
5.4 IMMUNOFLUORESCENZA (IF) ... 95
5.5 SAGGIO DI MIGRAZIONE CELLULARE ... 96
5.6SAGGIO DI FORMAZIONE DEI TUBI SIMIL-CAPILLARI ... 97
5.7 ESTRAZIONE DI RNA E PCR REAL-TIME QUANTITATIVA (QRT-PCR) ... 98
5.8 ANALISI STATISTICA ... 99
Abstract
I meningiomi sono le neoplasie primitive più frequenti del sistema nervoso centrale e sono suddivisi in tre gradi di malignità. Circa il 20% delle forme benigne (grado I) recidiva a lungo termine e progredisce istologicamente a forme più aggressive nonostante la rimozione chirurgica totale, rendendo pertanto il loro comportamento imprevedibile. Alla base di tale trasformazione maligna si ipotizza ci sia la presenza di cellule staminali tumorali (CSC) contraddistinte da caratteristiche tipiche delle cellule staminali normali, quali l’autorinnovamento, l’espressione di marker specifici e la capacità di differenziare in diverse tipologie cellulari. Fattore chiave nella regolazione di questi processi è attribuito al microambiente tumorale, il quale interagisce con le CSC tramite molecole segnale tra cui le chemochine. Su queste premesse, il nostro studio si è focalizzato sull’analisi delle proprietà di induzione dei processi di proliferazione, migrazione e neoangiogenesi indotti dalle chemochine CXCL11 e CXCL12 e dei recettori CXCR4 e CXCR7 in cellule di meningioma. Da 16 campioni di meningioma ottenuti da pazienti operati in Neurochirurgia, abbiamo ottenuto colture cellulari, differenziando le cellule con caratteristiche staminali (STEM) da quelle differenziate (DIFF). Su queste culture abbiamo studiato gli effetti dell’attivazione dei recettori CXCR4 e CXCR7 e del loro antagonismo farmacologico. Abbiamo dimostrato che questi assi di comunicazione intercellulare sono fondamentali per proliferazione, migrazione e neoangiogenesi delle cellule STEM. Inoltre, l’inibizione selettiva di CXCR4 o di CXCR7 compromette tutti questi meccanismi indicando che ambedue i recettori sono coinvolti in questi effetti, verosimilmente tramite il processo di eterodimerizzazione che per questo abbiamo ipotizzato. In conclusione, possiamo affermare che il blocco del sistema chemochinico CXCR4/7 rappresenta un nuovo rilevante
1. Introduzione
1.1 TUMORI CEREBRALI
I tumori cerebrali rappresentano una quota relativamente rara tra le neoplasie, occupando attualmente il 10° posto tra quelle conosciute. Tra questi il 50 % è di origine gliale mentre i meningiomi rappresentano il 36% del totale, con un’incidenza complessiva di 7.61/100 000 (1).
I tumori cerebrali, come tutte le neoplasie, sono neoformazioni anormali di cellule trasformate che con la loro crescita e la diffusione a distanza provocano danni di diverso genere ai tessuti sani. In particolare nel sistema nervoso centrale (SNC), data la scarsa possibilità di espansione e l’elevata concentrazione di strutture vitali, i danni causati “dall’effetto massa” sono molto evidenti anche in fase precoce (2). L’attuale classificazione è stata stilata dal WHO nel 2016 e riprende la precedente del 2007, ma per la prima volta, si pone l’attenzione oltre che ai parametri istologici, anche alle caratteristiche molecolari. Per più di un secolo la classificazione dei tumori cerebrali si è basata esclusivamente su principi istologici, raggruppandoli sulla base di criteri morfologici in relazione alle presunte similitudini d’origine microscopica del tessuto neoplastico rispetto a quello sano e al relativo livello di differenziazione da quest’ultimo. Questa analisi era effettuata su dati provenienti dall’osservazione dei preparati dopo colorazione con ematossilina ed eosina. Questo sistema raggruppava e divideva i tumori cerebrali con fenotipo astrocitario da quelli oligodendrogliali non curandosi se all’interno di questi sottogruppi si osservassero differenze o similitudini di evoluzione clinica.
Gli studi delle ultime decadi hanno permesso di evidenziare e chiarire le basi della genetica tumorale e questo ha cominciato ad attribuire maggiore importanza anche
alle caratteristiche molecolari culminando con la formulazione di linee guida stilate dalla Società Internazionale di Neuropatologia, le quali hanno tracciato la strada per le successive modifiche della classificazione per arrivare a quella dell’OMS (WHO 2016) attualmente in vigore. Questo grande progetto ha richiesto la collaborazione di oltre 117 specialisti provenienti da 20 nazioni diverse (3).
Tabella 1 Classificazione WHO 2016 dei tumori del SNC. “The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary” Louis, David N. Acta Neuropathologica (2016)
1.2 MENINGIOMA
I meningiomi sono tumori che si sviluppano dalle meningi, tessuti che ricoprono il cervello e la spina dorsale che svolgono un ruolo protettivo e trofico per l’intero SNC. Solitamente i meningiomi traggono la loro origine da cellule dell’aracnoide meningoteliale con localizzazione prevalente intracranica. Lo sviluppo embrionale delle cellule aracnoidi è complesso, avendo i precursori di queste cellule origini diverse a seconda della loro posizione: le meningi che coprono la convessità del cervello hanno un'origine diversa da quelle alla base del cranio. Questa differenza interessa non solo i sottotipi istologici predominanti dei meningiomi che derivano da queste cellule, ma anche la distribuzione delle mutazioni somatiche ricorrenti (4).
I meningiomi sono neoplasie capsulate che rimangono generalmente confinate nella sede primaria di insorgenza, comportamento che li rende benigni dal punto di vista clinico in quanto aggredibili con la microchirurgia con esiti spesso risolutivi. Tuttavia, la recidiva e la progressione del tumore dopo il trattamento chirurgico sono frequenti e molti di questi pazienti possono andare in contro ad una scarsa sopravvivenza globale. Pertanto è fondamentale trovare nuovi parametri prognostici per migliorare la valutazione della recidiva e la progressione nei pazienti affetti (5).
1.2.1 Classificazione
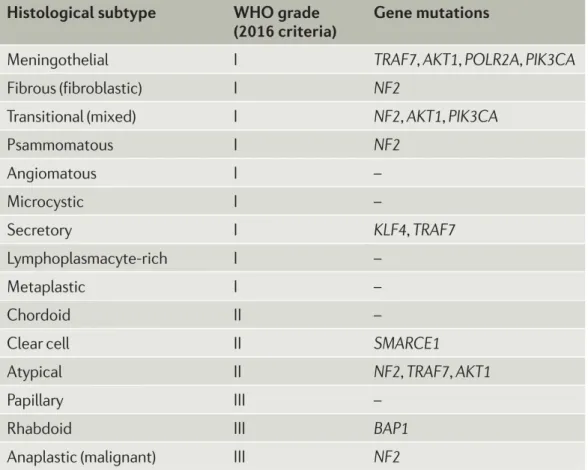
I meningiomi possono essere classificati in base alla sede di insorgenza dividendoli in intrassiali od extrassiali, se ad insorgenza a livello del cranio, oppure in intradurali od extradurali se a livello del midollo spinale. La classificazione istologica e cellulare li divide in quindici sottotipi e li classifica in tre gradi di malignità correlati ad un aumentato rischio di recidiva; nove di questi sottotipi appartengono al grado I, tre al grado II e III rispettivamente (3) come illustrato nella Tabella 1.
Circa l’80% dei meningiomi è classificato come grado I, 4-15% sono atipici (grado II) e 1-3% anaplastici (grado III) (6,7). Le principali differenze tra i vari gradi risiedono nelle caratteristiche istologiche e citologiche, nel tasso di proliferazione e nello stato di dedifferenziamento, maggiormente accentuati nei gradi più elevati in cui sono correlati a prognosi peggiore.
In particolare, meningiomi di grado II includono tumori che mostrano 4-19 mitosi/ 10 HPF ed invasione cerebrale associati a:
- Aumento della cellularità
- Piccole cellule con alto rapporto nucleo/citoplasma - Nucleoli prominenti
- Crescita con un aspetto interrotto
- Necrosi a carta geografica o foci confluenti
Il grado III è assegnato a lesioni che mostrano 20 o più figure mitotiche/10 HPF o con istologia simile ai carcinomi sarcomatosi.
Tabella 2 Sottotipi istologici di meningioma correlati al grado
I sottotipi più comuni sono la forma meningoteliale, fibrosa e transizionale, in cui il primo è caratterizzato dalla presenza di collagene che sepimenta il parenchima tumorale, il secondo da cellule differenziate che assomigliano a normali fibroblasti, e il transizionale ha caratteristiche intermedie ai due precedenti.
La correlazione istologia e clinica ha accesso molti dibattiti negli ultimi anni, sembrano infatti non esserci differenze prognostiche tra i vari sottotipi istologici appartenenti allo stesso grado, anche se ciò potrebbe derivare dai limiti intrinseci al sistema di classificazione basato sull’istologia o sull’invasione dei tessuti sani. Nelle precedenti classificazioni del WHO, l’invasione cerebrale era considerata una caratteristica dello staging piuttosto che del grading e si preferiva trattarla separatamente, nonostante già nel 1997 furono descritte possibili correlazioni fra tassi di recidiva, invasività e mortalità (7). Nella classificazione corrente pubblicata
nel 2016 (3) , lo stato di invasione del parenchima cerebrale associata ad una conta mitotica superiore a quattro cellule/HPF è considerata sufficiente ad identificare un meningioma atipico di grado II.
Come nel passato il meningioma atipico può essere anche identificato tramite le cinque più comuni caratteristiche istologiche illustrate in precedenza. Basandosi solo su queste, la classificazione mostra però delle carenze dovute a parametri mal definiti per i sottotipi oltre all’utilizzo di criteri proni a determinare giudizi arbitrari tra i vari centri di anatomia patologica (8). L’approccio istopatologico, infatti, non tiene in considerazione della complessa biologia del tumore, non fornisce adeguate spiegazioni circa l’alto tasso di recidive, la resistenza alle terapie o la presenza di sottogruppi di pazienti con più elevato tasso di letalità. Per questo l’inserimento di parametri molecolari e genetici all’interno della classificazione ha consentito di identificare ulteriormente sottogruppi tumorali che possano correlare meglio alla prognosi.
1.2.2 Patologia
I meningiomi sono la più comune forma di tumori intracranici, con un’incidenza di 7.86 casi per 100000 persone per anno, di cui circa l’80% dei casi alla diagnosi corrisponde istologicamente al grado I della classificazione WHO 2016 (3).
Circa il 90% dei meningiomi sono a localizzazione intracranica, mentre più raramente sono interessate le strutture spinali. Queste neoplasie sembrano colpire maggiormente gli individui più anziani: l’incidenza maggiore si osserva negli individui di età superiore ai 65 anni, mentre sono rari i casi infantili e ancora meno le forme ad interesse pediatrico dove, quando presenti, possono associarsi ad
alterazioni germinali del gene NF2. L’incidenza cresce, anche se di poco paragonata alla precedente, negli adolescenti e giovani adulti raggiungendo tassi di circa il 16% tra tutte le neoplasie intracraniche, mentre nell’età adulta sembrano essere più colpite le donne rispetto agli uomini con un rapporto di 3,5:1.
I fattori di rischio maggiormente correlati allo sviluppo di meningioma includono: l’esposizione alle radiazioni ionizzanti, il diabete mellito, l’ipertensione arteriosa e probabilmente il fumo di sigaretta, per il quale, tuttavia, i dati non sembrano ancora essere confermati in maniera definitiva (4). Infine sembra non esserci associazione tra l’utilizzo del cellulare e l’incremento di neoplasie cerebrali gliali che meningoteliali (9).
Le radiazioni ionizzanti sembrano indurre multipli fenotipi istologici che presentano un decorso clinico più aggressivo caratterizzato da maggiori recidive. Altri fattori di rischio sono legati alla presenza di recettori del progesterone nella neoplasia in donne con alti livelli ormonali, la combinazione di queste caratteristiche sembra influire sulla patogenesi del meningioma, tuttavia l’utilizzo di trattamenti antiormonali non sembra svolgere un ruolo protettivo (4).
1.2.3 Alterazioni molecolari
Studi recenti hanno mostrato che l’inclusione di alterazioni molecolari specifiche nei processi diagnostici e classificativi, possa migliorare l’identificazione di quei meningiomi che richiedono un approccio di osservazione più stretto o un intervento terapeutico più aggressivo. Nei meningiomi le alterazioni genetiche ed epigenetiche, oltre alla localizzazione sono fortemente associate alle caratteristiche clinico-patologiche e alla prognosi e potrebbero rappresentare un target anche per la terapia farmacologica (4).
Tra le alterazioni epigenetiche, un ruolo di rilievo sembra essere assunto dalla metilazione del DNA. Essa rappresenta una firma molecolare per molte neoplasie, ed in particolare esistono evidenze chiare di una correlazione tra metilazione, biologia e clinica. È stato proposto di utilizzare queste caratteristiche per arricchire la classificazione dei differenti sottotipi di meningioma. Il profilo della metilazione del DNA ha permesso di raggruppare sei distinte classi associate ai modelli di espressione mutazionale, citogenica e genica e quindi di creare modelli clinici maggiormente omogenei in grado di identificare con maggiore accuratezza la prognosi rispetto al modello morfologico della classificazione WHO (8).
Le alterazioni genetiche hanno aperto un’ulteriore strada allo sviluppo di nuovi protocolli farmacologi, soprattutto in relazione ad un possibile intervento terapeutico tramite target therapy.
I meningiomi di grado I generalmente presentano poche duplicazioni geniche rispetto ad altri tumori dell’età adulta (4), mentre solo un piccolo sottoinsieme di questi presenta complessi arrangiamenti genomici.
I meningiomi di alto grado sono invece associati ad un elevato numero di duplicazioni geniche ed alterazioni cariotipiche. Le più comuni alterazioni citogeniche sono la perdita del cromosoma 22 che coinvolge il gene NF2. Altre anormalità genetiche ripetutamente descritte nei meningiomi riguardano la perdita dei geni 1p, 6q, 9p, 10, 14q, 18q e 19.
La prima identificazione molecolare dei meningiomi fu scoperta con la soppressione del gene NF2 che codifica per la proteina Neurofibromina 2, localizzata sul cromosoma 22. L’alterazione può essere di tipo nonsenso, frameshift o splicing che in ogni caso porta alla distruzione del gene NF2 con il risultato di una proteina non funzionante. L’inattivazione del gene avviene secondo un meccanismo a “doppio-colpo”, dove un allele viene distrutto e l’altro è perso
totalmente o parzialmente e solo in rari casi si osservano inattivazioni del gene NF2 dovute a ricombinazione di entrambi gli alleli o singole delezioni multiesone (4). Il meccanismo tramite cui l’inattivazione della neurofibromina 2 conduca alla genesi dei meningiomi rimane tuttora non definito, anche se sono state avanzate alcune ipotesi: questa proteina infatti funziona da ponte tra la membrana citoplasmatica e il citoscheletro e la sua presenza inibisce i meccanismi di proliferazione contatto-dipendente.
Come illustrato nella Tabella 3, le sottoclassi dei meningiomi possono essere anche descritte sulla base delle caratteristiche molecolari; l’introduzione di tecniche d’indagine più dettagliate come il sequenziamento NEXT-GEN, ha rivoluzionato il modo di comprendere la genetica dei meningiomi sporadici permettendo di individuare numerose alterazioni geniche anche in neoplasie prima ritenute prive di queste alterazioni (10). L’alterazione di NF2 rappresenta la mutazione somatica più frequente, tuttavia molte altre quali TRAF7, recettore del TNF associato al fattore 7, KLF4 e AKT1 sono state individuate grazie alla NEXT-GEN sequencing. Studi recenti hanno evidenziato che la perdita dell’espressione di geni come NF2 o DEP-1 possano agire in sinergia durante la genesi dei meningiomi favorendo la rottura degli equilibri molecolari ed instaurando l’avvio dei processi di incremento clonale e modificazione citologica (11).
Tabella 3 Sottotipi istologici di meningioma in relazione al grado e alle mutazioni genetiche più frequenti. “Advances in meningioma genetics: Novel therapeutic opportunities” Preusser, Matthias Nature Reviews
Neurology (2018)
1.2.4 Epidemiologia
I meningiomi rappresentano il 36.4% dei tumori primari del sistema nervoso centrale dove rappresentano il 53% dei tumori non maligni negli Stati Uniti (1), con un tasso d’incidenza del 8.3% per 100,000 persone durante il periodo 2010-2014. Nell’ultima decade si è assistito ad un aumento di 4.52 rispetto al periodo 1998-2002, anche se rimane ancora poco chiaro se ciò sia dovuto ad un aumento dell’incidenza del tumore, ad una maggiore accuratezza diagnostica o all’aumento della speranza di vita (12).
L’incidenza del meningioma è dipendente dall’età, con un incremento di 0.14 su 100,000 tra 0-19 anni fino al 37.75 su 100,000 tra i 75-84 anni (1). Dati
epidemiologici hanno anche rilevato un aumento dell’incidenza in determinate popolazioni Afro-Americane comparate con quelle caucasiche e una predominanza del sesso femminile di 2.27:1 rispetto a quello maschile. La specificità di genere e la presenza di recettori ormonali sulle cellule tumorali suggerisce che gli ormoni sessuali possono giocare un ruolo nello sviluppo delle neoplasie primitive cerebrali, meningiomi compresi. In studi caso-controllo condotti nel sud-est degli Stati Uniti è stato dimostrato che l’età mediana alla diagnosi nella popolazione femminile sia di 53 anni, con un incremento importante in relazione al tempo di esposizione agli estrogeni nell’arco della vita, inoltre il rischio è più elevato nelle nullipare rispetto alle pluripare della stessa età (13).
Alcuni autori hanno suggerito che l’aumento dell’incidenza dei tumori del SNC e dei meningiomi sia correlata ad alcuni artefatti interpretabili dai risultati di (14) :
- Età della popolazione
- Maggiore accuratezza diagnostica e accesso alle cure
- Aumento delle conferme istologiche grazie all’espansione delle procedure neurochirurgiche
1.2.5 Eziologia e fattori di rischio
Fattori genetici ed epigenetici
L’identificazione dei fattori di rischio genetici individuali, e la loro interazione con i fattori ambientali, apre importanti prospettive nel campo della ricerca con l’obiettivo di fornire una maggiore prevenzione primaria.
Come è stato descritto precedentemente, numerosi geni implicati nella riparazione del DNA sono legati alla genesi dei meningiomi, l’alterazione di alcuni di questi meccanismi può incrementare il rischio di genesi dei meningiomi di 3.5 volte, mentre un aumento di 1.57 è stato osservato nei pazienti con suscettibilità genetica ad alcune forme tumorali come il carcinoma mammario (14).
Il gruppo diretto da Inskip ha studiato uno specifico polimorfismo dell’enzima acido d-aminolevolinico deidratasi associato ad un aumento del rischio tra 1.6 e 3.5 volte; successivamente, lo stesso gruppo ha dimostrato come questo rischio possa aumentare ulteriormente in relazione all’esposizione occupazionale (15).
L’aumento del rischio dei meningiomi è osservato anche in alcune rare sindromi ereditarie come la neurofibromatosi tipo 1 e 2, a cui recentemente si sono aggiunte le sindromi di Turner e Werner (14).
Allergia ed auto-immunità
Il ruolo delle allergie nella genesi dei tumori rimane ancora controverso; alcune evidenze sostengono che l’atopia possa potenziare la risposta immune e quindi la sorveglianza immunitaria, altre che questa possa indurre una risposta tumorale. Studi condotti sui gliomi hanno riportato scarsi risultati, mentre quelli sui meningiomi sembrano essere più consistenti, in particolare sembra esserci un legame tra lo sviluppo dei meningiomi e la risposta immunitaria. Recentemente è
stata proposta l’esistenza di una risposta sierologica anti-meningioma, che si differenzia in relazione al genere; se questo fenomeno fosse confermato modificherebbe in modo importante la valutazione dell’incidenza confermando la genere-specificità dei tassi di sviluppo del tumore (16).
Storia medica personale
Le cicloossigenasi-2 (COX-2) sono enzimi molto espressi nei meningiomi, e il trattamento con inibitori selettivi delle COX-2 ha dato importanti risultati in vivo in modelli animali. Pertanto, è stato valutato l’uso clinico di farmaci anti-infiammatori non steroidei (FANS) per ridurre il rischio di tumori cerebrali (17). Tuttavia, i risultati non sono stati quelli sperati: in un ampio studio caso-controllo è stato registrato addirittura un aumento del rischio di sviluppo di meningioma correlato all’assunzione di FANS, pari a 1.35 volte. Successivamente sono state effettuate revisioni dei dati, per escludere eventuali errori sistematici, che però hanno rafforzato l’ipotesi di una correlazione diretta tra l’uso di questi farmaci e l’aumentato rischio di avere un meningioma. Saranno comunque necessari ulteriori studi per chiarire meglio questa correlazione (18).
Recenti meta-analisi hanno identificato anche l’associazione tra l’indice di massa corporea (IMB) e l’aumentato rischio di meningioma, che sale di 1.27 volte nelle femmine e 1.58 nei maschi. In queste situazioni sembra giocare un ruolo importante anche la predisposizione genetica all’accumulo di massa grassa (19). L’ipotesi del meccanismo alla base di questa correlazione risiede nella resistenza insulinica cronica, nell’aumento delle incretine e dei livelli circolanti di estrogeni per una maggiore espressione dell’enzima aromatasi.
Radiazioni ionizzanti
Il ruolo delle radiazioni ionizzanti come fattore di rischio dei meningiomi, ma più in generale di tutti i tumori primitivi del SNC, è ormai ben definito (20). Le sorgenti causa di esposizioni possono riguardare: l’occupazione lavorativa, le procedure diagnostiche o terapeutiche ed incidenti con diffusione di sostanze radioattive, come nell’uso di armi nucleari.
L’invenzione delle apparecchiature a raggi X ha rappresentato un enorme progresso per la medicina moderna, poiché queste sono in grado di analizzare le strutture corporee senza il bisogno di aprire chirurgicamente la sede anatomica indagata, o più recentemente hanno acquisito anche un importante approccio terapeutico in alcune patologie (14). Tuttavia, di pari passo, si sono anche compresi i potenziali danni che queste sono in grado di arrecare alle cellule, in particolare possono rompere le delicate funzioni di riarrangiamento genico e potenzialmente indurre processi neoplastici. Gli effetti a lungo termine sul SNC sono documentati nella letteratura, inclusi numerosi casi di meningioma indotti dalle radiazioni in relazione alle situazioni di esposizione e alla dose (20):
- L’esposizione della testa nei bambini a scopo terapeutico o diagnostico anche a basse dosi aumenta il rischio di tumori del SNC (14)
- Radioterapia per la tinea capitis o l’emangioma della pelle è associato ad un aumento del rischio di 10 volte per l’insorgenza di meningiomi (18)
- Esposizione a raggi X a scopo odontoiatrico è associato ad alta incidenza di meningiomi, anche se sembra questo fosse dovuto principalmente alle apparecchiature utilizzate in passato, caratterizzate da un alto tasso irradiante (14)
In conclusione, numerosi studi caso-controllo dimostrano in maniera certa la correlazione tra esposizione alle radiazioni ionizzanti e l’aumento del rischio di meningioma, anche se gli studi in alcuni casi possono apparire eterogenei e non scevri di errori sistematici che possono essere commessi lungo le diverse fasi di sperimentazione (18).
Campi elettromagnetici
Il legame tra l’esposizione ai campi elettromagnetici ad alta frequenza (EMF) e l’incremento del rischio di tumori cerebrali è un argomento che ad oggi gode di un’attenzione particolare nel dibattito scientifico mondiale. Nelle ultime decadi si è assistito ad un avanzamento tecnologico nel campo delle EMF senza eguali nella storia dell’umanità, con l’utilizzo dei campi elettromagnetici nei dispositivi di comunicazione quali prima telefoni cellulari ed ora i moderni smartphone, hanno reso questa tecnologia molto diffusa e accessibile alla maggior parte della popolazione. Nel corso degli anni numerosi studi hanno cercato di dimostrare l’associazione tra l’esposizione ad EMF ed il rischio di neoplasie cerebrali. Infatti nel 2011 l’International Agency for Research on Cancer (IARC) ha pubblicato una monografia in cui valutava le potenzialità del rischio di carcinomi relativi all’uso dei telefoni cellulari, classificando le EMF nel gruppo 2B, ovvero con possibili effetti cancerogeni per l’uomo (18), ma con l’indicazione che ulteriori verifiche a lungo termine fossero necessarie per la conferma. Recenti indagini epidemiologiche hanno invece riportato come non si osservi un incremento del rischio dovuto all’esposizione di EMF nell’utilizzo di telefoni cellulari, e questo sembra confermato empiricamente dal fatto che l’incidenza dei meningiomi non sia cresciuta in relazione all’aumento dell’utilizzo degli smartphone (21).
Sostanze tossiche
L’esposizione a sostanze tossiche è da tempo sospettata come possibile fattore di rischio per i tumori cerebrali (22). Tra questi hanno un ruolo di rilievo i composti N-nitrosi (NOCs), classificati dall’IARC nel gruppo 2A come probabili cancerogeni. Questi contengono le nitrosamine, sostanze che in taluni casi richiedono un’attivazione metabolica per assumere una forma cancerogena, mentre altre sono attive nella forma originale. Queste molecole sono contenute in numerosi alimenti dove svolgono la funzione di conservanti e nonostante siano stati valutati come possibili rischi di genesi tumorale, gli studi condotti per determinarli si sono avvalsi esclusivamente di specie animali come roditori, per cui alcuni ricercatori ipotizzano che gli esseri umani possano essere ancora più sensibili all’esposizione di queste sostanze (23). L’ipotesi su cui si fonda il meccanismo eziopatogenetico per l’induzione di una trasformazione neoplastica si basa sul fatto che queste piccole molecole potrebbero essere in grado di attraversare la barriera ematoencefalica, entrare nelle cellule e provocare danni al DNA (20). Le nitrosammine sono contenute in numerose altre sostanze quali il tabacco, cosmetici, interni degli automobili, materiali plastici e numerosi farmaci oltre ad una quota prodotta in modo endogeno in particolari condizioni di pH gastrico, batteri e altri parametri fisiologici (24).
Infine, un ruolo di rilievo sembra essere occupato dai pesticidi chimici come possibile fonte di rischio. Questo è stato suggerito da diversi studi condotti in Scandinavia e Stati Uniti dove l’esposizione a queste sostanze nelle fattorie ha aumentato il tasso di mortalità da tumori (20). Attualmente sono state identificate più di mille molecole prodotte per questo uso e molte di queste sono state classificate nel gruppo 2A dalla IARC, ma nonostante ciò le evidenze su una
possibile associazione nell’aumento del rischio deve essere ancora oggetto di ulteriori indagini.
Indice di proliferazione
L’aumento dell’attività di proliferazione cellulare è considerato il meccanismo più importante alla base dell’oncogenesi (25). Ki-67/MIB-1 è un tipico marker immunoistochimico per la proliferazione cellulare ed è sempre più utilizzato grazie ai suoi requisiti minimi per la ricerca e alla sua alta specificità. L’impatto negativo di elevati livelli di Ki-67 (e quindi di un elevato numero di mitosi) sulla prognosi è stato ampiamente identificato nella maggior parte dei tumori solidi e secondo alcuni studi risulta più predittivo della sopravvivenza rispetto all’espressione di p53 (26) e all’antigene proliferante nucleare delle cellule (PCNA) nei tumori cerebrali. Tuttavia, il ruolo prognostico del Ki-67 nei meningiomi rimane ancora molto controverso, diversi studi hanno dimostrato come questo indicatore possa essere un predittore indipendente della prognosi nei meningiomi, altri hanno riportato risultati non statisticamente rilevanti. Probabilmente l’incoerenza dei dati può essere attribuita alla grande diversità dei valori di cut-off e composizione del campione di grado tumorale tra gli studi e queste ipotesi sembrano essere confermate da recenti meta-analisi, dove si sono osservati per un 40% valori arbitrari dovuti all’eterogeneità tra gli studi (5). Tuttavia, nonostante questi dati, il Ki-67 potrebbe essere un promettente biomarcatore per la valutazione prognostica dei meningiomi.
1.2.6 Diagnosi
Sintomi
I meningiomi possono rimanere asintomatici per lungo tempo oppure mostrare un lento peggioramento del quadro clinico. La sintomatologia riflette fondamentalmente la sofferenza dell’area interessata dalla compressione della massa tumorale. Le alterazioni tipiche sono determinate, oltre che dai processi di aumento del volume totale, da alterazioni della barriera ematoencefalica e della dinamica liquorale che portano ad un quadro di sindrome da ipertensione endocranica. Altre alterazioni sono legate al danno osseo, ben visibili all’esame radiografico standard. Si tratta di aree di sclerosi, dilatazione dei canali vascolari e lisi, dove quest’ultima quando presente indica invasione ossea (27).
Sintomi aspecifici possono presentarsi anche dopo anni e sono legati alla compressione che la massa tumorale esercita sulle strutture sane; questo può portare ad una progressiva sindrome da ipertensione intracranica, caratterizzata dalla triade sintomatologica di cefalea, vomito a getto e papilla da stasi. Meno frequentemente l’evoluzione di questo fenomeno può condurre ad una erniazione transtentoriale o delle tonsille cerebellari, accompagnata da gravi alterazioni dello stato di coscienza, del linguaggio e crisi epilettiche (28).
In alcuni casi può comparire una sintomatologia specifica caratterizzata da manifestazioni focali relative alla sede colpita ed instaurare alterazioni patologiche quali edema cerebrale o irritazione corticale con conseguenti disturbi neuropsichiatrici. Tra questi, i segni e sintomi più caratteristici comprendono alterazioni dell’umore, psicosi, compromissione della memoria, cambiamenti della personalità, ansia e anoressia nervosa (29). Vi è una stretta relazione tra localizzazione del tumore e la sintomatologia: nella regione prefrontale
dorsolaterale tipicamente si assiste ad un deficit delle funzioni esecutive, a livello orbitofrontale disturbi della personalità con sindrome da disinibizione e iperoralità, nella mediale-cingolata apatia e abulia. Ed infine lesioni della temporo-limbica possono condurre a psicosi (30).
La sintomatologia psichiatrica spesso rappresenta solo una parte del complesso corteo sintomatologico dei meningiomi. Pazienti con disturbi psichici di origine sconosciuta con caratteristiche cliniche atipiche dovrebbero essere sempre valutati per escludere possibili correlazioni della sintomatologia a lesioni espansive, tra cui quelle provocate dai meningiomi. Un approfondito controllo diagnostico, della storia clinica e della appropriate indagini di neuro-imaging sono essenziali per formulare diagnosi precoci (31).
Indagini diagnostiche
L’utilizzo delle moderne tecniche di neuro-imaging ha permesso di rivoluzionare completamente il campo della ricerca diagnostica apportando cambiamenti importanti nell’outcome dei pazienti. Intervenire precocemente spesso rappresenta un importante vantaggio in campo oncologico; in particolare questo potrebbe tradursi in maggiori possibilità di guarigione per il paziente anche per i meningiomi. Il riscontro di queste neoplasie rimane però ancora prevalentemente incidentale e gli accertamenti diagnostici vengono avviati a seguito di riscontri occasionali di alterazioni riscontrate in radiografie eseguite a scopo odontoiatrico od osteoarticolare, oppure, come descritto precedentemente, a seguito di alterazioni neuropsichiatriche di forma e contenuto atipico in cui vengono richieste indagini di risonanza magnetica per accertarne le cause.
Fare diagnosi di meningioma non è dunque così semplice, l’indagine diagnostica più indicata è la risonanza magnetica nucleare (MRI) con contrasto, che può essere
utilizzata anche nel follow-up a lungo termine viste le sue spiccate proprietà di fornire immagini dei tessuti ad alta risoluzione e senza l’impiego di radiazioni ionizzanti (32).
L’interpretazione delle immagini radiologiche richiede una grande conoscenza di base, la comprensione delle caratteristiche cliniche del paziente e l’esperienza. La migliore interpretazione del quadro clinico la si può ottenere analizzando tutte le caratteristiche quali (33):
- progressione (acuta-rapida, subacuta-smoldering, cronica-prolungata) - localizzazione (intra-extrassiale)
- effetti secondari (volume, edema, erniazione)
- caratteristiche della MRI (enhancement e sequenze di diffusione)
L’angiografia intrarteriosa non ha ruolo nelle indagini di routine per la diagnosi dei meningiomi, ma può essere utilizzata per pianificare più correttamente un trattamento adeguato o valutare la vascolarizzazione nel preoperatorio (32). Le cellule di meningioma esprimono molto bene i recettori per la somatostatina del sottotipo 2 (SSTR2) e l’indagine PET ha acquisito un ruolo importante negli ultimi anni. È infatti possibile utilizzare ligandi per questi recettori, come Ga-DOTATOC (DOTA-(Tyr3)-octreotide) e Ga-DOTATATE (DOTA-D-Phe1-Tyr3-octreotate), per aggiungere ulteriori dettagli utili alla comprensione generale del quadro (34).
Figura 1 Immagini PET GaTate ed MRI con e senza contrasto. Le immagini MRI pre- e post- contrasto (b e c rispettivamente) evidenziano un rinforzo omogeneo alla base durale, caratteristico di un meningioma. “How we read: The combined use of MRI and novel PET tracers for the characterisation and treatment planning of masses in neuro-oncology” A. Lasocki, R. Hicks (2019) (34).
L’utilizzo della PET a scopo diagnostico ha permesso di colmare i limiti della MRI nella diagnosi e nella caratterizzazione di alterazioni neurologiche. Frequentemente le indagini diagnostiche forniscono esiti incerti e questo richiede l’utilizzo di manovre neurochirurgiche invasive sia a scopo diagnostico che terapeutico. In questi contesti la PET può fornire una maggiore precisione diagnostica evitando indagini più invasive (34). Nella Figura 1 si può apprezzare una massa (freccia) in fossa cranica posteriore destra nell’indagine GaTate-PET, se pur di dimensioni modeste si evidenzia un’importante captazione del radiotracciante, e le indagini MRI con presa di pre- e post-contrasto confermano una massa omogenea ancorata alla dura madre, presumibilmente di un meningioma.
La sinergia dell’indagine PET e della MRI presenta vantaggi anche nella diagnosi differenziale. Una grande varietà di lesioni intracraniche può mimare radiologicamente un meningioma. Se localizzato negli emisferi cerebrali, un meningioma può essere difficile differenziarlo da metastasi cerebrali provenienti da sedi tumorali primarie come prostata, polmone, rene, mammella (35,36) o neoplasie
primitive ematologiche come i linfomi non-Hodgking nei soggetti immunocompromessi (37).
Nella Figura 2 è presentata la MRI in sequenza T1 con contrasto al Gadolinio in un paziente di 55 anni che a seguito di cefalea frontale sinistra, resistente alla terapia da più di 6 mesi, svolge degli accertamenti diagnostici. Come è visibile nella prima immagine, sia in sequenza T1 che FLAIR, è presente una presa di contrasto alla base del cranio senza un esatto delineamento dei margini della massa. La sequenza di recupero dell’inversione attenuata dal fluido mostra cambiamenti di segnale diffusi. Al contrario, l’immagine PET con Ga-DOTATE, è in grado di individuare molto bene i margini del meningioma rispetto al tessuto sano e l’immagine di fusione (ultima sulla destra) permette di raggiungere un livello di contrasto tumore-sfondo davvero eccellente (38).
Figura 2 Immagini MRI con contrasto e PET Ga-DOTATATE. Diagnostic challenges in meningioma – M. owosielski. “Diagnostic challenges in meningioma”. Nowosielski M, Galldiks N, Iglseder S. Neuro Oncol. (2017) (38)
In conclusione, la neuro-imaging come la MRI è la scelta più adeguata nella diagnosi iniziale di meningioma, ma soprattutto nel follow-up dei pazienti affetti o trattati chirurgicamente al fine di individuare precocemente le recidive. Altre indagini come la MRI con perfusione e la PET per i ligandi di SSTR2, possono
superare i limiti delle metodiche precedenti ed aiutare nel processo diagnostico di diagnosi differenziale oltre che valutare con maggior precisione la prognosi.
1.2.7 Trattamento
Approccio osservazionale
Anche se la chirurgia rappresenta il trattamento di prima linea per i meningiomi, in alcuni casi può essere considerato un approccio osservazionale che potrà permettere al paziente di evitare l’intervento neurochirurgico limitandosi a trattare, in modo mirato, l’eventuale sintomatologia. Questo approccio non può prolungarsi per molto tempo e sono necessarie diverse condizioni per poter essere attuato (39) :
- diametro alla diagnosi inferiore a 2.5 cm - assenza di sintomi neurologici
- assenza di calcificazioni e segnali di ipointensità alla MRI
Grande attenzione va prestata per i pazienti in trattamento con estrogeni di sintesi, o anti androgeni come il ciproterone acetato prescritti per irsutismo, acne giovanile, seborrea e alopecia; la sospensione dei trattamenti potrebbe essere sufficiente a stabilizzare le dimensioni del tumore (40). Alcuni studi hanno riportato come l’interruzione della terapia ormonale possa portare ad una riduzione del 80% del volume in un anno (41). Per le stesse ragioni, i meningiomi potrebbero spontaneamente decrescere dopo la gravidanza (42). Il trattamento sintomatico di base è composto da terapia steroidea che può essere somministrata per bocca oppure in forma endovenosa, questo può favorire la riduzione della massa edematosa che classicamente circonda la neoplasia e di conseguenza temporaneamente ridurre anche la sintomatologia da compressione concomitante. Questo approccio viene
impiegato anche nel preoperatorio al fine di rendere più agevole il lavoro chirurgico. Nei pazienti sintomatici che presentano crisi epilettiche è possibile introdurre farmaci antiepilettici. Tuttavia, il loro impiego a scopo preventivo/precauzionale è tuttora sconsigliato (39).
Chirurgia
La rimozione chirurgica del tumore dipende principalmente dalla sede, anche se generalmente è possibile nella maggior parte dei casi, rimuovere completamente il tumore tramite escissione (43). Nelle ultime due decadi le tecniche neurochirurgiche sono evolute progressivamente fino alla nascita della recente chirurgia endoscopica transfenoidale che permette di approcciare le forme di meningioma della base del cranio che precedentemente erano difficilmente accessibili (44). Recentemente, la sua popolarità è diminuita a causa di serie complicazioni neurologiche e locali che possono manifestarsi nel periodo peri-operatorio, come la rinoliquorrea (45).
Uno dei parametri fondamentali nella predizione del rischio di recidiva, si basa sulle caratteristiche della resezione attuata dal chirurgo. Attualmente viene utilizzata la scala del grading di Simpson stilata nel 1957 (46), dove la qualità della resezione è valutata sulla base della stima macroscopica dei margini puliti che il chirurgo stabilisce durante la rimozione.
Il grading di Simpson si articola in cinque livelli divisi in: - grado I: resezione totale del tumore
- grado II: il tumore è macroscopicamente resecato e l’attaccamento della dura madre è coagulato
- grado III: resezione totale senza la coagulazione dell’attaccamento alla dura madre o resezione incompleta
- grado IV: parziale resezione con possibili residui macroscopici di tumore - grado V: semplice biopsia
Il grande vantaggio di questa classificazione consiste nel fatto che permette una predizione del rischio di recidiva sintomatica a 10 anni che varia dal 10 al 100% indipendentemente dal grado istologico (46). Tuttavia, questo potrebbe rappresentare allo stesso tempo sia un vantaggio che un importante fattore limitante. Diversi studi hanno evidenziato i limiti di questo sistema di classificazione che risale al 1957, carente dal punto di vista dell’imaging recente e delle importanti implicazioni che la MRI ha apportato anche nelle diverse peri operatorie.
Ad oggi le più recenti linee guida in vigore (Tabella 4) sono state stilate dell’Associazione Europea di Neuro-Oncologia (EANO, 2016) e indicano il follow-up post-chirurgico nei pazienti affetti da meningioma basato sul grading di Simpson e il grado intrinseco del tumore stabilito dal WHO.
Tabella 4 Grado WHO correlato alla scala Simpson con relative line guida per il trattamento e follow-up. “Management of meningioma” Euskirchen, Philipp, Presse Medicale (2018)
Il grado I totalmente resecato, segue un regime di osservazione ogni 3 mesi dall’intervento per 5 anni a seguire e se assenti recidive, ogni 2 anni. All’aumentare del grado seguono follow-up più stringenti e la chirurgia viene progressivamente affianca da altre opzioni terapeutiche.
Radioterapia
Nonostante la chirurgia detenga un ruolo centrale nel corollario terapeutico dei meningiomi, recentemente anche al terapia radiante ha acquisito un importante ruolo arrivando a giocarsi la scelta come trattamento di prima linea in particolare per le lesioni che interessano la base del cranio e le strutture vascolo-nervose come il nervo ottico o i seni cavernosi (47), strutture anatomiche difficilmente trattabili con la chirurgia. Numerose metodiche possono essere impiegate per il trattamento radioterapico come la radioterapia frazionata e ipofrazionata stereotassica o la radiochirurgia a singole o multiple dosi, entrambe portano ad un beneficio per il paziente con un alto rate di controllo della neoplasia dal 85% al 100% in 5 anni (48).
La radioterapia è anche impiegata come trattamento adiuvante nei meningiomi di grado I, trattati primariamente con chirurgia, per rimuovere eventuali rimanenze di crescita tumorale. I gradi II e III sono tumori aggressivi, con un alto rischio di recidiva e la terapia radiante può essere impiegata come adiuvante nella chirurgia con resezione totale o parziale di grosse masse di cui la valutazione dei margini è incerta. Molto importante in questo caso è la scelta della terapia più adeguata, che dovrà basarsi sui parametri intrinseci del tumore: grading, dimensione e localizzazione. La scelta della metodica radiante da utilizzare può influenzare in modo importante l’esito della terapia. Ad oggi, nonostante i numerosi trial svolti per confermare o meno l’utilità della terapia radiante con ruolo adiuvante nelle
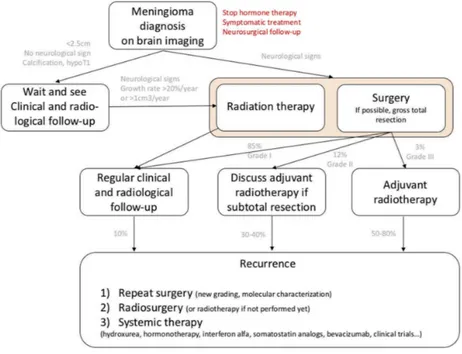
recidive, non si è arrivati ancora a stilare delle linee guida comuni nell’utilizzo di questo trattamento. Come mostrato nella Figura 3, molti pazienti con grado elevato sembrano trarre benefici dalla terapia adiuvante subito dopo la chirurgia, mentre i restanti possono accedere al trattamento, anche se di grado inferiore, a seguito di recidive. Ad oggi questo algoritmo diagnostico è il più utilizzato dalla maggior parte dei centri (39,49).
Figura 3 Algoritmo diagnostico per il trattamento di meningioma e delle recidive a lungo termine. “Current treatment options for meningioma” C.Apra, M.Peyre, Expert Review of Neurotherapeutics (2018)
Embolizzazione vascolare
L’embolizzazione vascolare del tumore è una tecnica utilizzata in numerosi ambiti dell’oncologia con lo scopo principale di indurre la necrosi della massa neoplastica su base ischemica e facilitarne la rimozione chirurgica. A livello intracranico, questa tecnica può essere impiegata per separare il tumore dai tessuti altamente vascolarizzati come l’osso, la dura madre e il parenchima cerebrale riducendo il
rischio di sanguinamento intraoperatorio, il tempo di intervento e le difficoltà chirurgiche associate alla resezione (50). Nonostante questo trattamento sembri promettente il suo ruolo rimane tuttora molto controverso; i benefici effettivi non sembrano chiariti a sufficienza e ciò è legato alle complicanze che questa procedura potrebbe arrecare danni al paziente. La sua applicazione riguarda perciò una piccola parte dei meningiomi trattati. In alcuni studi retrospettivi sono stati analizzati diversi casi di meningioma intracranici trattati con embolizzazione endovascolare prima della resezione. È risultato che nel 16,7% dei casi i pazienti hanno manifestato complicazioni quali emiparesi permanente e gonfiore del tumore (51). Sono stati analizzati altri parametri relativi all’embolizzazione come il tempo di esposizione e il tipo di farmaco impiegato, ma ad oggi il tasso complessivo di complicanze, che varia tra il 6-21%, e la mancanza di studi randomizzati rende difficile trarre conclusioni significative sull’utilità generale dell’embolizzazione preoperatoria durante la gestione dei meningiomi per considerarla una pratica standard (51).
Trattamento medico
La terapia sistemica rappresenta la strategia terapeutica nei pazienti che non hanno tratto vantaggi dalla chirurgia e/o dalla terapia radiante o in cui l’efficacia di questi approcci risulta essere limitata.
Chemioterapia. Raramente utilizzata nel trattamento dei meningiomi come
approccio adiuvante dopo chirurgia e radioterapia. Lo schema chemioterapico più frequente è rappresentato da temozolomide, irinotecan, doxorubicina e ifosfamide. Nonostante questo sia stato utilizzato per molto tempo, a discapito dei suoi effetti collaterali come leucocitosi, fibrosi polmonare, insufficienza renale e
neurotossicità, i benefici sono stati inferiori alle attese, mostrando in alcuni casi addirittura bassa efficacia (49,52).
L’idrossiurea, un inibitore della ribonucleotide reduttasi, è usata nei pazienti in cui non si è ottenuta resezione tumorale completa, e in questo caso viene utilizzata per ridurre il rischio di recidiva nei 24 mesi successi alla chirurgia. Alcuni clinical report hanno mostrato come l’idrossiurea sia in grado di indurre stabilizzazione dell’attività di malattia nelle forme recidivanti e progressive, confermando la sua efficacia mentre in altri e più recenti studi questi dati non sembrano essere stati confermati (53,54). È stato ipotizzato che la risposta ai chemioterapici possa essere legata all’espressione di alcuni geni che inducono farmaco-resistenza (55). Come prova di questo collegamento, l’efficacia del mitoxantrone e dell’idrossiurea è stata riportata in una specifica selezione di pazienti in cui l’analisi genica ha predetto la sensibilità a questi farmaci (56). L’idrossiurea è un chemioterapico impiegato nel trattamento di numerose neoplasie nonostante sia estremamente tossico e con un basso indice terapeutico, dovuto al fatto che inibisce la sintesi del DNA provocando un danno soprattutto a livello degli apparati caratterizzati da un elevato turnover cellulare come il midollo osseo, l’intestino e la cute e per questo si utilizza off-label nel trattamento dei meningiomi recidivanti (57).
Trattamenti ormonali. Come detto precedentemente, sembra esserci una certa
correlazione tra l’esposizione ormonale estrogenica e l’aumentato rischio di meningiomi. Questo ha supportato l’uso di farmaci antiormonali, utilizzati nel carcinoma del seno, per manipolare lo sviluppo e le recidive dei meningiomi. Il tamoxifene, che fa parte della famiglia dei modulatori selettivi dei recettori per gli estrogeni (SERMs), inibisce l’attività estrogeni tramite deacetilazione degli istoni e blocco del legame con il DNA del complesso estrogeno-recettore. Tuttavia, questo
farmaco ha dato risposta in un numero ristretto di pazienti e senza nessun impatto sulla progressione della malattia o sopravvivenza (58). Un altro farmaco antiormonale impiegato è il mifepristone, inibitore del progesterone utilizzato come farmaco abortivo per interrompere la gravidanza. A basse concentrazioni sembra inibire l’attività di trascrizione dei recettori del progesterone (59) espressi dai meningiomi la cui recente scoperta apre la strada a nuove opzioni terapeutiche. Una recente revisione sistemica degli studi fino ad oggi condotti circa l’uso di questi farmaci, ha valutato l’efficacia e gli effetti collaterali del mifepristone nei meningiomi ricorrenti, non resecabili o multipli. L’obiettivo primario è stato studiare l’efficacia in termini di regressione del tumore e della sintomatologia clinica. Sono stati analizzati 7 studi in totale, incluso uno studio controllato randomizzato di Fase III. Sebbene alcuni abbiamo restituito risultati molto incoraggianti con miglioramento clinico evidente e riduzione delle dimensioni del tumore, la risposta è stata però solo temporanea. Tuttavia, la somministrazione a lungo termine di mifepristone è ben tollerata a lungo termine e quindi potrebbero essere instaurate terapie croniche senza particolari effetti collaterali (60). Ad oggi, i risultati relativi all’uso delle terapie antiormonali sono contrastanti e sarebbero necessari ulteriori studi preclinici per evidenziare i possibili meccanismi di azione.
Interferoni. Numerose evidenze supportano l’uso dell’interferone a (IFNa) ricombinante nel promuovere l’inibizione della proliferazione cellulare in vitro (61). In un primo studio, sei pazienti con meningioma ricorrente non resecabile che hanno ricevuto IFNa 2b per cinque giorni alla settimana hanno mostrato una riduzione modesta del tumore, mentre altri quattro hanno mostrato malattia stabile che è durata fino a 14 mesi (62). Un altro studio con follow-up più lungo e più ampio su 12 pazienti ha riportato 9 pazienti in malattia stabile, dopo trattamento con IFNa,
con durata fino a otto anni (63). Infine, in uno studio più recente, 35 pazienti affetti da meningioma ricorrente di grado I, hanno ricevuto IFNa una volta al giorno per via sottocutanea. Dieci pazienti hanno presentato una tossicità che richiedeva la riduzione della dose del farmaco, ma nel complesso il trattamento è stato ben tollerato. Venticinque pazienti (74%) hanno ottenuto stabilizzazione della malattia con tempo mediano alla progressione del tumore di sette mesi e nove pazienti (26%) erano progrediti (64,65). Il tempo di sopravvivenza mediano è stato di otto mesi e non è stata trovata alcuna risposta radiografica. Altri approcci immunotropici non sono attualmente utilizzati o in fase di studio. Per comprendere meglio il meccanismo di funzionamento si potrebbero utilizzare modelli di meningioma geneticamente determinati in topi immunocompetenti, come quello innescato dall’inattivazione di Nf 2 e Cdkn2ab (66). Questo potrebbe aiutare a definire e caratterizzare meglio l’induzione della risposta immunitaria e la potenziale efficacia degli interventi terapeutici con interferoni e inibitori dei checkpoint immunitari. Meningiomi di alto grado mostrano infiltrazione di cellule PD-L1+, le quali bloccano i checkpoint della risposta immunitaria e dunque farmaci come pembrolizumab, un anticorpo anti-PD1, potrebbero riattivare la risposta immune ed indurre l’aggressione delle cellule tumorali come avviene in alcune forme di mesotelioma e carcinoma pancreatico (39,67).
Trattamenti anti-angiogenici. Trovano sempre maggiore spazio nella pratica
clinica. Alcune molecole hanno come target il fattore di crescita vascolare-endoteliale (VEGF), e molecole come il sunitinib e vatalanib sono state in grado di prolungare l’intervallo libero da malattia in pazienti affetti da meningioma recidivante di grado II e III (68). È noto che i meningiomi hanno un’alta vascolarizzazione e quindi interferire con la nutrizione tumorale potrebbe essere associarsi ad un buon outcome (69).
Una delle molecole più importanti che guidano la vascolarizzazione del tumore è il VEGF, e farmaci anti-VEGF come quelli citati precedentemente, sono stati approvati e utilizzati nella pratica clinica di diversi tumori (70). I meningiomi esprimono sia il VEGF (ligando) che il VEGF-R (recettore) e questa espressione è direttamente correlata al grado del tumore poiché le forme atipiche esprimono livelli di VEGF 2 e 10 volte superiori rispetto ai meningiomi benigni (37). Un trial clinico iniziato nel 2018 per valutare l’efficacia del bevacizumab (anticorpo monoclonale anti VEGF) nelle recidive o nella progressione dei meningiomi, ha mostrato nei pazienti selezionati un rischio di sanguinamento, con emorragie intracraniche, aumentato del 20% rispetto ai pazienti non in trattamento con il farmaco (39).
Virus oncolitici. Sono una classe di agenti biologici antitumorali che uccidono
selettivamente le cellule tumorali lasciando intatte le cellule normali. Diversi virus oncolitici sono stati studiati per vari tumori tuttavia, non ci sono ancora stati studi clinici sui meningiomi (69). In passato, alcune sperimentazioni precliniche hanno tentato la terapia con questi virus contro sferoidi derivati da cellule di meningioma. Il trattamento con virus oncolitici ha prodotto un’efficiente regressione tumorale sia nelle forme benigne, che atipiche e maligne (71). Attualmente il virus oHSV G47Δ sembra essere il più promettente in quanto ha restituito risultati incoraggianti nella sperimentazione preclinica in vitro e in vivo provocando la lisi selettiva di cellule primarie di meningioma umano (72), e risultando anche sicuro negli studi primari. Il meccanismo di azione dei virus oncolitici non si basa sull’induzione di mutazioni specifiche nei tumori, piuttosto dipende da una stimolazione della risposta immunitaria innata, resa meno efficace dai meccanismi di sopravvivenza del tumore. Questo permette dunque di colpire sia meningiomi intatti che quelli caratterizzati da alterazioni geniche: a prescindere da queste caratteristiche,
l’efficacia del trattamento sarà sempre la stessa non essendo correlata agli aspetti genetici del tumore (69).
Prospettive per il futuro
Il comportamento dei meningiomi, nonostante questi siano clinicamente ritenuti benigni, sta diventando sempre di più oggetto di revisione. L’alta frequenza delle recidive a lungo termine, e l’assenza di una terapia medica sostitutiva alla chirurgia, rendono questo tumore più aggressivo rispetto a quanto considerato negli anni passati, sia nelle forme maligne (grado II e III) che in quelle iniziali (grado I) che apparentemente hanno un’istologia benigna. Tuttavia, la ricerca clinica e preclinica di oggi possono godere di una nuova comprensione della complessa biologia del tumore: marker molecolari, alterazioni genetiche, aspetti epidemiologici possono interagire fra loro per permettere uno sviluppo importante della terapia migliorando la prognosi a lungo termine dei pazienti.
1.3 CELLULE STAMINALI
Le cellule staminali sono una popolazione non-specializzata di cellule del corpo umano. Sono caratterizzate dalla capacità di auto-rinnovamento, che consente di mantenere la popolazione staminale, e di differenziamento (73). Le cellule staminali esistono sia nell’organismo adulto, dove hanno il ruolo di rigenerare le cellule dei tessuti differenziati, sia durante lo sviluppo dove svolgono principalmente il ruolo di costruzione dell’intero organismo nelle prime fasi di vita e durante la crescita. Esiste un perfetto bilanciamento tra la morte di cellule mature e la differenziazione delle cellule staminali al fine di mantenere un equilibrio omeostatico ed impedire sia una perdita cellulare sia un’eccessiva proliferazione. Le caratteristiche chiave delle cellule staminali sono:
- l’auto-rinnovamento: caratteristica che permette ad una popolazione staminale di mantenere un numero costante di precursori tramite replicazione simmetrica, cioè la capacità di produrre due cellule figlie identiche. In questo modo viene ripopolata la popolazione staminale una volta che i cloni andranno incontro al differenziamento. In altre condizioni le cellule staminali si dividono in maniera asimmetrica: una cellula figlia mantiene le caratteristiche staminali e l’altra prende direttamente la via del differenziamento.
- Differenziamento: capacità di generare diversi lignaggi di cellule mature Esistono molte tipologie di cellule staminali classificate in base al loro potenziale di differenziazione. A partire dalla cellula zigote, fusione dei gameti maschili e femminili, si origina la prima cellula staminale dell’organismo che viene definita totipotente. Questa cellula ha il più elevato potenziale di differenziazione che
consente la generazione di qualunque tipologia cellulare sia in strutture embrionali che extra-embrionali. Dopo circa quattro giorni, la cellula evolve in una massa cava che prende il nome di blastocisti, al cui interno le cellule diventano pluripotenti. Le cellule staminali pluripotenti (PSC) formano tutte le cellule degli strati germinali, ma hanno perso la capacità di dare origine ai tessuti extraembrionali come la placenta. Le cellule staminali embrionali (ESC) ne sono un esempio e derivano dalla massa cellulare interna degli embrioni pre-impianto (73). Un altro esempio di PSC sono le cellule staminali pluripotenti indotte (iPSC) derivate dallo strato epiblasto di embrioni impiantati. Le iPSC sono generate artificialmente da cellule somatiche, funzionano in modo simile alle PSC ed è possibile valutare la loro attività tramite il test di formazione del teratoma. La loro coltivazione e utilizzo è promettente per la medicina rigenerativa presente e futura.
Le cellule staminali multipotenti hanno uno spettro di differenziazione più ristretto rispetto alle PSC ma possono specializzarsi in cellule discrete di specifici lignaggi cellulari. Un esempio sono le cellule staminali emopoietiche da cui possono originare tutti gli elementi costitutivi del sangue. Dopo la differenziazione una cellula staminale emopoietica diventa oligopotente. In questa forma viene persa molta della capacità di differenziamento e sono quindi limitate alle cellule di un determinato lignaggio. Tuttavia, alcune cellule multipotenti sono in grado di convertirsi in tipi cellulari non correlati, il che suggerisce che potrebbero essere considerate come cellule pluripotenti (73). Infine, l’ultima famiglia di cellule staminali fisiologiche, comprende le cellule staminali unipotenti. Queste sono caratterizzate dalle capacità di differenziazione più strette e da una proprietà speciale di divisione ripetuta. Quest’ultima caratteristica le rende un candidato
promettente per l’uso terapeutico nella medicina rigenerativa, poiché sono in grado di formare un solo tipo di cellula.
1.3.1 Cellule staminali tumorali
Il concetto di cellule staminali tumorali (CSC) è stato proposto decenni fa e afferma che la crescita del tumore, analoga allo sviluppo di organi e tessuti sani, è alimentata da un piccolo numero di cellule staminali dedicate. Con il tempo si è scoperto che praticamente tutti i tumori derivano e crescono grazie alle CSC, ospitate in strutture specifiche presenti nella massa tumorale, definite nicchie, eppure la loro identificazione ed eradicazione non è così ovvia come inizialmente sperato. La scoperta delle CSC ha rappresentato un punto di svolta nella comprensione dei meccanismi di insorgenza dei tumori solidi, sostituendo progressivamente l’ipotesi stocastica di cancerogenesi che descrive la massa tumorale composta da popolazioni cellulari con uguale potenziale neoplastico in grado di auto-rinnovarsi e contribuire in modo sostanziale alla crescita del tumore (74). Il modello delle CSC afferma invece che una neoplasia è costituita da diverse sottopopolazioni cellulari caratterizzate da elevata eterogeneità fenotipica e funzionale. Come osservato nei tessuti normali, la maggior parte delle cellule tumorali che costituiscono la massa tumorale sono “differenziate”, mentre una piccola sottopopolazione di cellule non differenziate è responsabile sia della genesi iniziale del tumore che nel suo auto-mantenimento tramite processi rigenerativi (74,75). Queste cellule divergono nella loro espressione genica, interazioni immunitarie, potenziale di propagazione del tumore e risposta alla terapia (75). Le spiegazioni di queste importanti differenze sono moltissime e alcune ancora da definire, ma sicuramente vi sono implicazioni di variazione genetica ed epigenetica clonale, nonché di caratteristiche metaboliche e microambientali (76).
Negli ultimi anni la caratterizzazione binaria gerarchica delle cellule tumorali in “staminali” e “non-staminali” e i tentativi di descrivere le CSC attraverso le normali gerarchie di sviluppo dei tessuti, stanno lentamente cedendo a una comprensione più sfumata del concetto di staminalità come proprietà emergente e contestuale delle interazioni con il microambiente e altri tipi di cellule, sia all’interno della neoplasia che nella normale gerarchia fisiologica (75).
La modulazione epigenetica e i segnali microambientali influenzano l’eterogeneità, la plasticità e l’evoluzione all’interno della popolazione di CSC che a sua volta modifica le nicchie tumorali (75,77). Questo reciproco scambio comunicativo è una componente cruciale nell’evoluzione e crescita del tumore, nel mantenimento della staminalità e per la resistenza terapeutica. All’interno di ciascuna nicchia, le CSC scambiano una complessa serie di segnali reciproci con le cellule della massa tumorale e le cellule normali che formano la nicchia (fibroblasti, cellule del sistema immunitario, cellule mesenchimali), regolando proliferazione e migrazione cellulare, la secrezione di fattori angiogenici che promuovono la neovascolarizzazione, e provocando l’inibizione del sistema immunitario (75). Definire le CSC è stato un processo non privo di insidie a causa delle limitazioni tecniche di purificazione e caratterizzazione di queste cellule. Mentre gli stati dinamici di differenziazione cellulare sono stati modellati in molti tipi di tessuti, la maggior parte dei modelli rimane in un doppio stato in cui si trovano sia CSC che altre cellule neoplastiche “differenziate” che rende difficile la loro caratterizzazione. Recentemente sono state proposte numerose strategie di tracciamento del lignaggio e ablazione cellulare che hanno fornito spunti importanti sulla plasticità, quiescenza, rinnovo e risposta terapeutica delle CSC (78).
1.3.2 Identificazione delle CSC
Sebbene negli ultimi anni le CSC siano state caratterizzate con successo in diversi tumori umani e animali (78), una specifica popolazione di CSC all’interno di un dato tumore che mostri proprietà cellulari e molecolari omogenee non è ancora identificata. La mancanza di marcatori specifici rende ancora difficile la caratterizzazione e pertanto allo stato attuale è disponibile solamente un pannello di marcatori imputabili alle CSC. L’espressione di alcuni marcatori, come i fattori di trascrizione NANOG, OCT4, SOX2, responsabile del mantenimento della staminalità, è stata dimostrata recentemente in studi su CSC di glioblastoma (79), carcinoma a cellule squamose orale (80), carcinoma della prostata (81) e carcinoma della mammella (82).
L’identificazione di CSC nei meningiomi, come in altri tumori a bassa malignità, non è stata ancora ottenuta in maniera definitiva anche se sono state individuate caratteristiche comuni con altre neoplasie del sistema nervoso come adenomi ipofisari e gliomi (83).
Tra le caratteristiche utilizzabili per l’identificazione della staminalità in colture cellulari rientra la formazione di sferoidi in vitro. Queste formazioni sono studiabili attraverso diverse tecniche, tra cui la recente coltura cellulare 3D che preserva le caratteristiche biologiche del tumore originale in modo più dettagliato rispetto alle tecniche convenzionali basate su colture 2D monostrato. La formazione di sferoidi è una caratteristica unica, attribuita all’espressione di determinati fattori di staminalità che sono caratteristica delle CSC o di altre cellule staminali ed è interpretata come indice di auto-rinnovamento. Queste sfere crescono in sospensione in terreni di coltura a composizione selettiva, dove il microambiente favorisce il mantenimento delle caratteristiche staminali (84). Studi in vitro hanno
individuato cellule staminali di meningioma umana capaci di formare sfere e che questa popolazione cellulare possa in determinate condizioni esprimere le caratteristiche di staminalità (85). Le cellule di meningioma sferoidi (MgSCs) esprimono marcatori cellulari dei progenitori come CD133, SOX2, OCT4, Nestina e Vimentina (79).
CD133 è una glicoproteina transmembrana ed è stata identificata per la prima volta
nelle cellule staminali emopoietiche umane e neuroepiteliali del topo (86) , (87). Attualmente è utilizzato come biomarcatore di staminalità per l’isolamento di cellule staminali di molti tessuti normali e patologici sin dalla sua scoperta. È selettivamente localizzato nei microvilli e in altre sporgenze della membrana plasmatica (86). Le cellule CD133+ e CD133- presentano caratteristiche differenti (86):
- Cellule di glioma CD133+ e CD133- derivano da popolazioni di cellule staminali indipendenti (88),
- Cellule CD133+ di glioma possono derivare da precursori CSCs CD133-, - CSCs CD133- mantengono le caratteristiche staminali e la capacità di
tumorigenesi e possono riacquistare l’espressione del CD133 in vivo, - Sia CSCs CD133+ che CD133- hanno profili di espressione diversi nelle
attività di trascrizione e molecole di matrice extracellulare (88,89).
L’espressione di CD133 è stata correlata in diversi studi con l’esito clinico dei meningiomi: pazienti affetti da meningioma di grado II/III che presentano CD133 hanno una prognosi peggiore (90). Tuttavia, i limiti di questo marker rimangono legati alla bassa affidabilità degli anticorpi CD133 utilizzati per l’analisi e alla modulazione nell’espressione legata a fattori di sviluppo (stress, ipossia) che possono portare a gradi discrepanze nei risultati (74).