2
INDICE……….2
INTRODUZIONE ... 4
1. Epilessia: definizione ed epidemiologia ... 4
2. Epilessia farmaco-resistente ... 6
3. Anatomia del nervo vago ... 9
4. Storia della VNS. Dai modelli sperimentali all’approvazione FDA ... 12
5. Meccanismo d’azione della VNS ... 22
6. Effetto anti-crisi / anti-epilettico/ anti-epilettogeno della VNS ... 27
7. Esiste un candidato ideale alla VNS? ... 30
PAZIENTI E METODI... 32
1. Pazienti ... 32
2. Metodi ... 35
2.1 Raccolta dati e analisi statistiche ... 37
RISULTATI ... 39
1. Complicanze chirurgia-correlate e eventi avversi perioperatori ... 39
2. Complicanze croniche ... 39
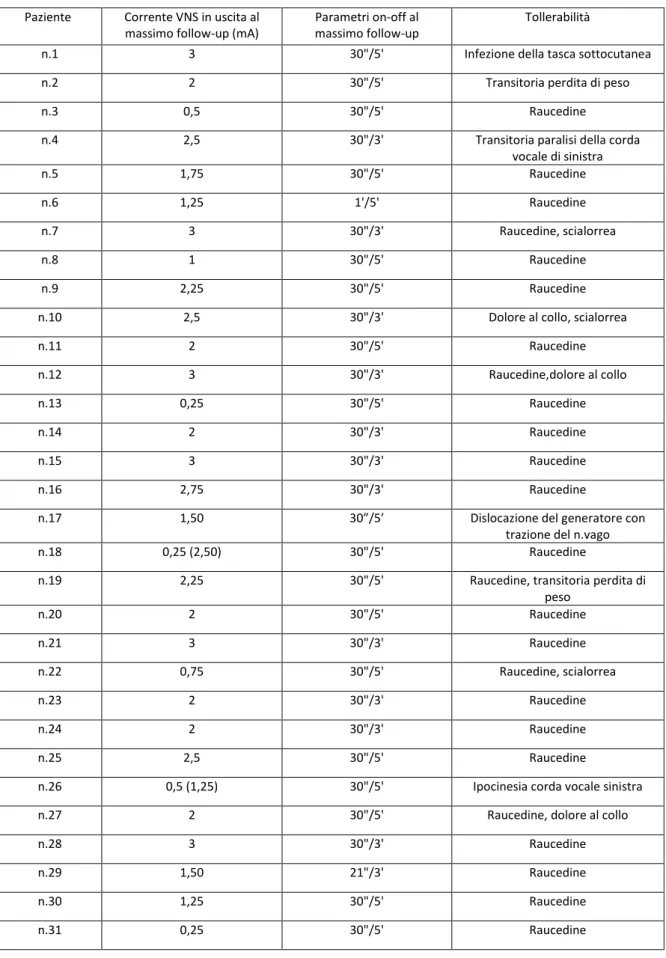
3. Parametri VNS ... 41
4. Efficacia globale della VNS ... 42
3
6. Outcome nel sottogruppo di pazienti con epilessia focale ... 46
7. Outcome nel sottogruppo di pazienti con epilessia generalizzata ... 47
8. Effetti della VNS sulle crisi con caduta ... 48
9. Identificazione di parametri predittivi di miglior risposta alla VNS ... 49
DISCUSSIONE ... 52
1. Analisi dell’efficacia della VNS ... 52
2. Analisi dell’identificazione di parametri predittivi di miglior risposta alla VNS ... 57
CONCLUSIONI ... 59
TABELLE E GRAFICI ... 60
BIBLIOGRAFIA ... 72
4
INTRODUZIONE
1. Epilessia: definizione ed epidemiologia
L’epilessia è definita come “una disfunzione cerebrale caratterizzata da una predisposizione duratura a generare crisi epilettiche e dalle conseguenze neurobiologiche, cognitive, psicologiche e sociali di questa condizione. La definizione di epilessia richiede il verificarsi di almeno una crisi epilettica”. Questa è la proposta più recente di definizione prodotta dalla Lega Internazionale Contro l’Epilessia (ILAE), la principale associazione internazionale che si occupa di epilessia sia a fini scientifici che socio-culturali.
Una definizione “operativa” spesso utilizzata per finalità epidemiologiche stabilisce che l’epilessia è una condizione patologica caratterizzata da due o più crisi epilettiche ricorrenti, non provocate da una causa immediatamente individuabile (Hauser and Kurland, 1975).
La diagnosi di epilessia si fonda in prima istanza su un’accurata anamnesi, che includa i dettagli dell’evento critico, eventuali segni premonitori, fattori precipitanti, tipologia e durata degli episodi critici, frequenza, semeiologia critica. Inoltre si effettuano esami ematochimici di routine e indagini strumentali neurofisiologiche e di neuroimmagine che includono: EEG basale, EEG prolungato dopo deprivazione di sonno, RM encefalo. In casi selezionati possono essere condotti esami endocrinologici e test genetici. La misdiagnosi di epilessia ha importanti ripercussioni sia sul paziente che sui costi sanitari connessi ad essa.
L’epilessia è una delle malattie neurologiche più diffuse. Secondo l’OMS ( Organizzazione Mondiale della Sanità) circa 50 milioni di persone al mondo ne sono affette. Più di 80 persone su 100.000 ricevono ogni anno una nuova diagnosi di epilessia, più comunemente durante l’adolescenza (Wallace et al., 1998).
5
In Italia le persone con epilessia sono circa 500.000 (1 persona su 100) con 30.000 nuovi casi l’anno, nella maggior parte dei casi (60% del totale) con epilessia focale (Hauser et al., 1996).
Analizzando più specificamente la prevalenza dell’epilessia in relazione anche a diverse fasce di età, si calcola che in Europa siano affetti da epilessia attiva circa 1 milione di bambini e adolescenti (prevalenza 4,5-5/1.000), circa 2 milioni di adulti tra 20 e 64 anni (prevalenza 6/1.000) e mezzo milione di ultrasessantacinquenni (prevalenza 7/1.000) (Forsgren et al., 2005). Circa il 20-30% dei soggetti presenta più di una crisi al mese e lo 0,5-15% dei pazienti presenta crisi ricorrenti con frequenza minore di un episodio al mese (Kwan and Brodie, 2000).
6
2. Epilessia farmaco-resistente
Per il trattamento dell’epilessia la terapia farmacologica con un singolo farmaco o con l’associazione di più farmaci consente di ottenere un soddisfacente controllo delle crisi in circa il 60-70% dei pazienti. Inoltre, ad oggi, la disponibilità in farmacopea di un gran numero di farmaci antiepilettici ha migliorato la qualità di vita dei pazienti grazie a nuovi farmaci con ottimi profili di tollerabilità ed efficacia.
Tuttavia, il 30-40% dei pazienti continua a presentare crisi nonostante che assuma un’adeguata terapia antiepilettica e costituisce pertanto la popolazione dei pazienti farmaco-resistenti. Non esiste una definizione univoca di farmaco-resistenza e diverse definizioni possono essere appropriate a seconda della forma di epilessia o delle finalità per cui tale definizione viene utilizzata (Berg, 2006). La ILAE definisce ‘epilessia farmaco-resistente’ come il fallimento nel raggiungere una duratura libertà dalle crisi con 2-3 farmaci antiepilettici (FAE), in mono- o politerapia, ben tollerati, scelti ed utilizzati in modo appropriato secondo il tipo di epilessia e le caratteristiche cliniche del paziente (Kwan et al., 2009). Questa considerazione deriva dai dati riportati in letteratura, secondo cui con l’introduzione di un primo farmaco antiepilettico le crisi sono controllate in circa il 45% dei pazienti, con un secondo farmaco in add-on si può ottenere il controllo delle crisi in un ulteriore 13% dei casi, e aggiungendo un terzo farmaco si ottiene il controllo in soltanto un ulteriore 1% dei pazienti. A questo punto le probabilità che con un ulteriore farmaco in add-on si possa ottenere la libertà dalle crisi sono estremamente basse.
Pertanto dopo il fallimento di tre farmaci antiepilettici utilizzati in modo appropriato come principio attivo e dose raggiunta, nel caso che persistano le crisi, il paziente può essere giudicato farmaco-resistente (Kwan and Brodie, 2000).
Secondo le categorie di Perucca (1998) si distinguono tre gradi di farmaco-resistenza a seconda del numero dei farmaci antiepilettici (AEDs) utilizzati e valutati come inefficaci:
7
Grado I: crisi non controllate (qualsiasi frequenza) con la massima dose tollerata di un adeguato AED
Grado II: crisi non controllate con l’utilizzo di due AEDs adeguati, alla dose massima tollerata, utilizzati sequenzialmente (grado II A) o in maniera combinata (grado II B) Grado III: crisi non controllate con l’utilizzo di tre AEDs adeguati, utilizzati alla massima dose tollerabile in maniera sequenziale (grado III A) o combinata (grado III B)
In base a questo sistema la probabilità di ottenere libertà dalle crisi è del 30% dopo il fallimento del primo AED, si riduce al 10–15% dopo il fallimento di due AEDs (in successione o combinazione) ed al 5% dopo il fallimento di tre AEDs (in successione o combinazione). L'utilizzo di questo sistema graduato, nella ricerca clinica, avrebbe offerto maggiori informazioni riguardo il livello di refrattarietà nei pazienti, rispetto all’utilizzo della singola definizione stabilita dalla Lega Internazionale contro l’Epilessia. Dai dati riportati in letteratura risulta poi che il fenomeno della farmaco-resistenza ha tre possibili pattern di presentazione (Schmidt and Löscher, 2005). Il primo pattern è quello della farmaco-resistenza ab initio. Il secondo è quello dello sviluppo tardivo di farmaco-resistenza dopo un periodo iniziale di controllo delle crisi. Il terzo pattern, infine, è quello di tipo intermittente nel quale a fasi di remissione seguono fasi di scarso controllo della malattia.
Per i pazienti con epilessia farmaco-resistente una opzione da prendere in considerazione è rappresentata dalla chirurgia dell’epilessia, la quale ha come fine la guarigione del paziente mediante la resezione della zona epilettogena. Si tratta di un’opzione terapeutica invasiva che si effettua al termine di un iter prechirurgico durante il quale viene definita la zona epilettogena. Tale definizione si ottiene attraverso un’anamnesi epilettologica accurata, registrazioni videoEEG prolungate talora in stereoEEG ed in particolare registrazione di episodi critici; alla fine, mediante l’analisi mirata delle indagini elettrofisiologiche e di neuroimmagine ed adeguate
8
correlazioni elettrofisiologiche-anatomiche, si definisce tale zona epilettogena e può essere posta indicazione all’intervento. Secondo alcune casistiche, in particolare in pazienti con epilessia temporale le percentuali di guarigione sono estremamente elevate, fino all’85% dei casi (Wiebe, 2001).
Laddove la chirurgia non fosse percorribile, per esempio per l’impossibilità a definire un'unica area epilettogena o perché questa coincide con una regione corticale eloquente, per la presenza di controindicazioni generali all’anestesia e/o all’intervento chirurgico o per un rifiuto da parte dello stesso paziente, si aprono eventualmente altre possibilità terapeutiche. Una di queste è rappresentata dalla stimolazione del nervo vago (VNS). La VNS si effettua mediante l’impianto di un dispositivo tipo pace-maker che esercita un’ azione di neuromodulazione centrale attraverso la stimolazione periferica intermittente del nervo vago.
La stimolazione del nervo vago è stata sviluppata nel mondo a partire dagli anni Ottanta ed attualmente rappresenta un’opzione valida nella scelta terapeutica per i pazienti con epilessia farmaco-resistente, non idonei al trattamento chirurgico o che non hanno ottenuto beneficio da tale trattamento (Ben-Menachem, 2003). Nel 1997 è stata approvata dalla Food and Drug Administration (FDA) come "terapia aggiuntiva per ridurre la frequenza di crisi in soggetti adulti e in adolescenti di età maggiore ai 12 anni con crisi focali refrattarie ai farmaci antiepilettici". Ad oggi ci sono circa 100.000 pazienti con epilessia, nel mondo, impiantati.
9
3. Anatomia del nervo vago
Il nervo vago o “migrante” (dal latino : nervus vagus), decimo nervo cranico, deve il suo nome alla ampia distribuzione che ha all’interno del corpo, che si estende dalla base cranica fino a gran parte della cavità addominale. E’ il più lungo tra i dodici paia di nervi cranici. Emerge in corrispondenza del solco laterale posteriore del bulbo con una decina di radicole poste in serie verticale in continuità con le radicole del nervo glossofaringeo, poste superiormente. Dalla sede di emergenza le radicole convergono in alto, lateralmente e in avanti, raccolte in un tronco unico che attraversa obliquamente lo spazio aracnoideo. Il nervo, così costituitosi, passa nella parte anteromediale del foro giugulare assumendo un decorso verticale che manterrà anche nel collo. Il nervo vago inizia quindi con direzione verticale il suo decorso extracranico che lo porta attraverso il collo e il torace fino alla cavità addominale. Possono perciò essere descritti tre segmenti del percorso del nervo: cervicale, toracico e addominale.
Circa l’80% delle fibre del nervo vago sono afferenti. Questa grande popolazione di afferenti specifici e generali viscerali trasporta informazioni gustative dalla porzione periepiglottica della faringe e informazioni viscerali provenienti da faringe, laringe, trachea e visceri toraco-addominali. Inoltre un numero limitato di fibre trasporta informazioni somatosensitive dalla cute dell’orecchio esterno e dalla regione limitrofa. I corpi cellulari delle fibre afferenti vagali si trovano in due gangli parasimpatici: il ganglio giugulare superiore e il ganglio nodoso inferiore, situati in corrispondenza del foro giugulare.
Le fibre afferenti vagali formano il tratto solitario nel tronco cerebrale. La maggior parte degli afferenti vagali creano sinapsi nel nucleo del complesso midollare dorsale del vago. Il nucleo del tratto solitario (NTS) riceve il maggior numero di sinapsi afferenti vagali e ciascun nervo vago crea sinapsi bilateralmente sul NTS. Le sinapsi afferenti vagali utilizzano i comuni neurotrasmettitori eccitatori (glutammato e aspartato) e inibitori (GABA) nonché l’acetilcolina e una vasta gamma di neuropeptidi. Le fibre afferenti
10
viscerali generali del vago trasportano informazioni provenienti dagli organi toracici e addominali, dai barocettori aortici e dai chemocettori dell’arco aortico. Queste afferenti svolgono un ruolo cruciale nella regolazione della funzione respiratoria, digestiva e cardiovascolare. Tali fibre si portano ai neuroni sensitivi del ganglio nodoso e le ritrasmettono alla parte caudale del NTS. Il NTS manda informazioni a interneuroni vasomotori coinvolti nel controllo della pressione sanguigna. Il NTS proietta anche a motoneuroni del nucleo ambiguo che innervano la muscolatura striata responsabile del riflesso della deglutizione, e a neuroni premotori parasimpatici conivolti nel controllo della frequenza cardiaca. La parte caudale del NTS stabilisce connessioni con la sostanza grigia periacqueduttale, permettendo così la modulazione centrale del dolore. Gli afferenti vagali, tramite il NTS, si proiettano anche al locus coeruleus (LC), principale sistema neuromodulatore noradrenergico cerebrale, al nucleo del rafe, principale sistema neuromodulatore serotoninergico, alla formazione reticolare mediana e al nucleo parabrachiale. Dal locus coeruleus le informazioni giungono all’amigdala, all’ippocampo e all’archicortex. Dal nucleo parabrachiale le afferenze giungono al nucleo ventrale postero-mediale del talamo che raggiunge la neocortex. Il nucleo ventrale postero-mediale del talamo riceve anche afferenze viscerali speciali provenienti dalla regione epiglottidea e proietta alla corteccia gustativa, alla strato granulare della corteccia dell’insula e alla parte interna dell’opercolo frontale.
Il 20% di fibre efferenti del vago fornisce invece fibre motorie parasimpatiche a tutti gli organi interni (ad eccezione delle ghiandole surrenali) dal collo fino al colon. Queste efferenti hanno origine da due coppie di nuclei della sostanza midollare: il nucleo motore dorsale del vago e il nucleo ambiguo. Le fibre pregangliari si interrompono quindi in piccoli gangli microscopici o a livello di agglomerati di cellule gangliari parasimpatiche distribuite lungo il decorso del nervo vago, in genere in vicinanza dell’organo che viene innervato (meta simpatico).
11
Il nervo vago inoltre controlla alcuni muscoli scheletrici a livello della laringe e della faringe. I motoneuroni di queste fibre efferenti hanno origine nel nucleo ambiguo. Ciascun nervo vago contiene inoltre efferenti che innervano le corde vocali, unilateralmente.
Pertanto il nervo vago è responsabile di un numero importante di attività diversificate a livello del corpo, tra cui il controllo della pressione arteriosa e della frequenza cardiaca, della peristalsi gastrointestinale, del vomito, della tosse, della deglutizione, della parola e della respirazione. Si ritiene generalmente che la frequenza cardiaca sia maggiormente influenzata dal nervo vago di destra, deputato all’innervazione del nodo seno-atriale (considerato il pacemaker fisiologico cardiaco) e delle camere atriali; il nervo vago di sinistra sarebbe invece principalmente deputato all’innervazione del nodo atrio-ventricolare e dei ventricoli cardiaci. Pertanto l’anatomia vagale favorisce la stimolazione a sinistra per ridurre gli effetti sul ritmo cardiaco.
Infine è opportuno ricordare, ai fini della trattazione, che, nel suo decorso a livello cervicale, il nervo vago stacca due rami deputati all’innervazione motrice e sensitiva della laringe: il nervo laringeo superiore e il nervo laringeo inferiore (o ricorrente). Il nervo laringeo superiore è deputato all’innervazione motrice del muscolo cricotiroideo della laringe e a quella sensitiva della mucosa sottoglottidea, della glottide e della laringe. Tale ramo viene stimolato secondariamente durante la VNS e può dare un senso di tensione o dolore alla gola. Il nervo laringeo ricorrente dà invece fibre sensitive ai restanti muscoli intrinseci della laringe (ad eccezione del cricotiroideo) e fornisce rami collaterali cardiaci, tracheali, laringei, faringei ed esofagei, oltre ad anastomizzarsi con il nervo laringeo superiore formando l’ansa di Galeno. Data la notevole vicinanza di tale nervo al vago, esso viene quindi influenzato dalla VNS provocando la vibrazione delle corde vocali di sinistra e la raucedine che compare durante la fase ON di stimolazione.
12
4. Storia della VNS. Dai modelli sperimentali all’approvazione FDA
E’ nel 1952, a Pisa, che fu applicata per la prima volta la procedura della stimolazione vagale a livello sperimentale. Nei laboratori di ricerca della Fisiologia diretti dal Professor Moruzzi si studiarono infatti gli effetti prodotti dalla VNS sull’elettroencefalogramma (EEG) nel gatto e la stimolazione periferica del nervo vago fu impiegata come modalità di “accesso” al Sistema Nervoso Centrale (SNC). In realtà già precedentemente Bailey e Bremmer ( Bailey and Bremmer, 1938) avevano studiato le conseguenze della stimolazione vagale, partendo dall’errata considerazione che la stimolazione del nervo vago, per mezzo di alterazioni negli organi periferici, potesse influenzare indirettamente l’attività cerebrale corticale producendo una caduta della pressione sanguigna. I loro studi tuttavia non supportavano l’ ipotesi di un’azione inibitoria diretta del nervo vago sulla corteccia cerebrale, ma un’azione indiretta della stimolazione vagale correlata ad una caduta pressoria. Quindi solo a metà del secolo scorso, grazie agli studi del Professor Moruzzi, si è potuto comprendere meglio il meccanismo d’azione della VNS. I risultati ottenuti indicavano che le basse frequenze di stimolazione del nervo vago producevano un effetto di sincronizzazione dell’EEG, mentre le alte frequenze producevano una desincronizzazione dei tracciati. La desincronizzazione delle frequenze EEG fu ritenuta il meccanismo attraverso cui si produceva un’inibizione alla sincronizzazione della scarica epilettica, ottenendo, di fatto, un effetto antiepilettico. Questa teoria della “desincronizzazione corticale” fu quindi alla base dell’applicazione della VNS all’epilessia. Fu chiaro che tali effetti non erano correlati a fenomeni periferici né ad un effetto secondario sulla pressione sanguigna, visto che la sezione prossimale del nervo, in assenza di effetti vasopressori, produceva gli effetti corticali suddetti (Zanchetti et al., 1952). Studi successivi di Chase e coll. (1967,1968) evidenziarono una correlazione tra VNS e tipo istologico di fibre stimolate, dimostrando come la desincronizzazione fosse correlata all’alta frequenza di stimolo di fibre con basso livello di mielinizzazione, mentre la sincronizzazione corticale fosse indotta dalle basse frequenze di stimolo su fibre ad alto livello di mielinizzazione (Chase et al., 1967; Chase and Nakamura, 1968). Il primo
13
che propose la VNS come metodica per antagonizzare le crisi epilettiche desincronizzando l’attività elettrica cerebrale fu Jacob Zabara nel 1985. Egli aveva osservato che la VNS, nel cane, era in grado di interrompere le crisi indotte da stricnina (Zabara, 1985). Negli anni successivi questa ipotesi fu testata su vari modelli animali: Woodbury e Woodbury nel 1989 studiarono gli effetti della stimolazione vagale sulle crisi nei modelli di elettroshock massimale nel ratto (Woodbury and Woodbury , 1989). Essi dimostrarono che l’efficacia anticonvulsivante della stimolazione vagale (VS) era in grado di abolire la componente in estensione della fase tonica nella crisi massimale da elettroshock, mentre riduceva o preveniva la crisi tonica indotta tramite somministrazione sistemica di pentilentetrazolo; che la stimolazione vagale sembrava agire attraverso il rilascio di grandi quantità di neurotrasmettitori inibitori, GABA e glicina, attraverso ampi volumi cerebrali; e che l'efficacia anticonvulsivante della VNS era direttamente correlata alla frazione di fibre C vagali stimolate e alla frequenza di stimolazione. Per quanto riguarda questo ultimo punto, in realtà, studi più recenti hanno dimostrato che l’interruzione delle fibre C periferiche non altera la soppressione delle crisi ottenuta dalla VNS (Krahl et al., 2001).
Negli stessi anni Lockard e coll. dimostrarono l’efficacia antiepilettica della VNS nel modello di crisi indotte da idrossido di alluminio applicato alla corteccia sensitivo-motoria nella scimmia (Lockard et al., 1990).
Tuttavia il contributo fondamentale per il successivo utilizzo della stimolazione vagale nell’uomo risale al 1992, quando lo stesso Zabara dimostrò che la VNS era in grado di interrompere crisi epilettiche indotte nel cane con somministrazione sistemica di stricnina. Più precisamente Zabara osservò che la stimolazione elettrica ripetitiva del nervo vago cervicale interrompe o abolisce le crisi motorie indotte da stricnina e i tremori indotti da pentilentetrazolo (PTZ). Egli induceva tali crisi iniettando boli di stricnina o PTZ ogni minuto a intervalli di 4 minuti fino a quando l'attività muscolare prolungata veniva osservata all’elettromiografia. Osservò così che la stimolazione del
14
nervo vago era in grado di interrompere le crisi epilettiche in 0,5-5 secondi. A sostegno del fatto che il meccanismo antiepilettico era correlato agli effetti centrali delle proiezioni afferenti vagali, Zabara notò che gli effetti antiepilettici della VNS non venivano annullati dalla sezione del vago distalmente alla sede di stimolazione (Zabara , 1992). I parametri ottimali di stimolo stimati erano: la forza, a circa 20 V (resistenza di omega 1-5),la frequenza di 20-30 Hz e la durata di circa 0,2 ms. Questi dati suggeriscono infine che gli effetti anti-crisi derivano dalla stimolazione di fibre afferenti demielinizzante piccolo diametro del nervo vago. E’ da questi risultati che è che si è potuto intraprendere successivi studi che hanno costituito la base di un nuovo approccio terapeutico all'epilessia.
Il primo impianto del dispositivo VNS nell’uomo è stato effettuato da Penry JK nel 1988 (Penry and Dean , 1990). Sono stati tuttavia necessari ulteriori studi per chiarire l'efficacia e la sicurezza della procedura nell’uomo e per definire i criteri di selezione dei pazienti.
Tra gli anni ‘80 e ’90 sono stati effettuati i primi trials clinici, da EO1 a EO5, rivolti a valutare l’efficacia antiepilettica della VNS nell’uomo. Lo scopo degli studi era quello di stabilire se l’uso aggiuntivo della stimolazione ottimale del nervo vago di sinistra potesse ridurre la frequenza delle crisi in pazienti con epilessia farmaco-resistente.
Gli studi EO1 e EO2 erano studi prospettici, pivotali, in singolo cieco condotti su numeri limitati di pazienti (Uthman et al., 1993 ). Erano stati arruolati 15 pazienti con epilessia focale (con crisi parziali complesse o semplici, secondariamente generalizzate), di cui uno è stato successivamente espiantato per una complicanza chirurgica. I pazienti erano stati seguiti da un minimo di 14 mesi fino ad un massimo di 35,6 mesi dopo l’impianto. Dai risultati emergeva che la riduzione media della frequenza delle crisi era del 46,6%. Dei 14 pazienti, cinque (35,7%) avevano avuto una riduzione del 50% o più della frequenza delle crisi. Due pazienti, uno dei quali aveva avuto da 10 a 100 episodi critici al giorno prima della stimolazione, risultava libero da crisi per oltre un anno. I pazienti
15
avevano inoltre ben tollerato l’impianto e la stimolazione vagale, senza manifestare problemi psicologici o cambiamenti nello stile di vita. Gli effetti collaterali erano limitati ad una sensazione di formicolio in gola e raucedine durante la stimolazione. Una complicanza maggiore che si era verificata era stata l’interruzione meccanica del circuito filo-elettrodo, con conseguente cessazione della stimolazione. Il piccolo numero di pazienti e il relativamente breve periodo di follow-up fanno di questo uno studio pilota, i cui risultati erano indubbiamente promettenti.
Lo studio EO4 era invece uno studio longitudinale aperto, non controllato, di uso compassionevole, in cui la VNS veniva impiegata in pazienti affetti da forme gravemente farmaco-resistenti di varia natura, più spesso generalizzate sintomatiche.
Tuttavia gli studi sicuramente più importanti e significativi, anche per la successiva approvazione della VNS da parte del FDA come trattamento aggiuntivo per l’epilessia farmaco-resistente, sono i due studi controllati attivi, in doppio cieco, randomizzati EO3 e EO5.
Nello studio EO3 erano stati arruolati 125 pazienti (Ben-Menachem et al., 1994). I pazienti erano stati visitati ogni quattro settimane (da -12 a 0 settimane) durante il periodo baseline. I pazienti che soddisfacevano i criteri di eleggibilità erano stati successivamente sottoposti all’impianto dello stimolatore vagale. I criteri di eleggibilità erano i seguenti: (i) pazienti con epilessia parziale farmaco-resistente da almeno 6 mesi, (ii) predominanza di crisi di tipo parziale (semplici, complesse o secondariamente generalizzate), (iii) età maggiore di 12 anni. I criteri di esclusione comprendevano invece: (i) malattia neurologica progressiva oltre all’epilessia, (ii) qualsiasi condizione medica instabile, (iii) gravidanza, (iv) utilizzo di un AED sperimentale al momento dell’ingresso nello studio. Due settimane dopo l’impianto i pazienti venivano randomizzati in due diversi gruppi di stimolazione, ALTO o BASSO; successivamente il generatore di impulsi veniva attivato. Il gruppo ALTO era teoricamente quello di trattamento, quello BASSO del placebo. Nel dettaglio, per i pazienti appartenenti al gruppo ALTO erano stati
16
impostati i seguenti parametri: ciclo di lavoro ON-OFF 30-90 secondi e 5-10 minuti, frequenza di stimolo 20-50 Hz, ampiezza dell’impulso 500 µs, intensità di corrente da 0,25 fino a 3 mA. I parametri impostati invece per i pazienti appartenenti al gruppo BASSO erano: ciclo di lavoro ON-OFF 30 secondi e 60-180 minuti, frequenza di stimolo 1-2 Hz, ampiezza dell’impulso 130 µs, intensità di corrente da 0,1-25 a 1-2,75 mA. L’endpoint primario dell’efficacia (riduzione percentuale del tasso delle crisi) era stato calcolato in un periodo di 14 settimane. Durante lo studio i pazienti avevano continuato a ricevere la terapia farmacologica antiepilettica e le concentrazioni plasmatiche dei farmaci erano state mantenute costanti. Durante ciascuna visita dei pazienti erano stati inoltre valutati gli eventi avversi. I risultati dei 114 pazienti sottoposti all’impianto del dispositivo VNS hanno dimostrato una riduzione media delle crisi giornaliere del 24,5 % per il gruppo ALTO e del 6,1% per il gruppo BASSO (p=0,01), con una percentuale di responders (riduzione della frequenza delle crisi di almeno il 50%) di 30% per il gruppo ALTO e 14% per quello BASSO. Questi dati indicavano pertanto che la stimolazione cronica intermittente del nervo vago era effettivamente efficace e terapeutica nel setting ALTO; invece i pazienti stimolati in modo placebo con setting BASSO non ottenevano effetti antiepilettici. Gli effetti avversi erano risultati accettabili e consistevano principalmente in transitoria raucedine durante la stimolazione. La VNS può essere quindi una valida alternativa per i pazienti che non mostrano un accettabile controllo delle crisi con la terapia farmacologica e che non sono candidati alla chirurgia.
Nello studio EO5 (Handforth et al., 1998 ) erano invece stati studiati 254 pazienti durante un periodo baseline di 12- 16- settimane, a intervalli regolari, per un totale di 4 visite. I pazienti che soddisfacevano i criteri di inclusione erano stati successivamente impiantati. Tali criteri comprendevano: (i) pazienti che avevano avuto almeno sei crisi parziali negli ultimi 30 giorni tra cui crisi parziali complesse o secondariamente generalizzate (ii) pazienti in grado di fornire un diario mensile delle crisi, (iii) pazienti con età compresa tra 12 e 65 anni (iv) pazienti in terapia con 1-3 AEDs e terapia stabile nell’ultimo mese. Erano stati esclusi i pazienti con malattia neurologica progressiva,
17
malattia cardiaca o polmonare, gravidanza, più di un episodio di stato di male epilettico negli ultimi 12 mesi, precedente vagotomia cervicale, precedente VNS, precedente DBS. Erano stati impiantati 198 pazienti randomizzati anche in questo studio in due gruppi di stimolazione, ALTO e BASSO, simili ai setting analoghi dello studio EO3. Nel dettaglio, per i pazienti appartenenti al gruppo ALTO erano stati impostati i seguenti parametri: ciclo di lavoro ON-OFF 30secondi- 5minuti, frequenza di stimolo 30 Hz, ampiezza dell’impulso 500 µs. I parametri impostati invece per i pazienti appartenenti al gruppo BASSO erano: ciclo di lavoro ON-OFF 30 secondi-3 ore, frequenza di stimolo 1 Hz, ampiezza dell’impulso 130 µs. I pazienti venivano poi seguiti per oltre 3 mesi e valutati per quanto riguarda la modificazione della frequenza delle crisi e la sicurezza della procedura. La variabile primaria di efficacia era la variazione percentuale della frequenza totale delle crisi rispetto al valore basale. Dai risultati dello studio emergeva che i pazienti trattati con la stimolazione ALTA (94 pazienti, età 13-54 anni), avevano avuto una riduzione media del 28% nella frequenza totale delle crisi giornaliere a fronte di una riduzione del 15% nel gruppo con stimolazione BASSA (102 pazienti, età da 15 a 60 anni, p = 0,04). Il gruppo ad alta stimolazione aveva avuto anche maggiori miglioramenti sui punteggi di valutazione globale da parte del medico e dei caregivers. Era inoltre stata osservata una maggiore alterazione della voce e dispnea nei pazienti appartenenti al gruppo ALTO. Non si era verificato nessun cambiamento nella funzionalità gastrica, cardiaca e polmonare. La VNS aveva mostrato anche un profilo favorevole per quanto riguarda la tollerabilità, i rischi connessi alla procedura chirurgica e gli effetti avversi.
Da questi due importanti studi , EO3 e EO5, si è quindi potuto concludere che la stimolazione del nervo vago rappresenta un trattamento aggiuntivo, efficace e sicuro per i pazienti con epilessia focale farmaco-resistente.
Essi hanno rappresentato la base per l’approvazione “ufficiale” della VNS come terapia per l’epilessia. Infatti nel 1997 la metodica è stata approvata dalla FDA, in U.S.A. e in
18
Europa, come terapia aggiuntiva per il trattamento dell’epilessia focale farmaco-resistente.
Da allora sono stati quindi condotti studi con evidenze di classe II, prospettici di coorte, volti a stabilire la longevità della VNS. Già George e coll. nel 1994, enucleando 67 pazienti dello studio di Ben-Menachem e coll., sopra citato, avevano esteso a tutti i 67 pazienti ( quindi sia a quelli che nel precedente studio appartenevano al gruppo ad alta stimolazione sia a quelli del gruppo a bassa stimolazione) una stimolazione ALTA della VNS con visite di controllo trimestrali. La frequenza delle crisi durante tale follow-up era stata confrontata con quella delle 12 settimane basali. Si era potuto osservare che per entrambi i gruppi, in tutto il periodo di alta stimolazione, c’era stata una diminuzione significativa nella frequenza delle crisi (p <0,01) rispetto al basale. Per il periodo di VNS di 16-18 mesi, i dati erano risultati disponibili per 26 dei 31 pazienti randomizzati nel gruppo ALTO. Questo gruppo aveva realizzato una riduzione media delle crisi del 52% rispetto al basale. Per quelli convertiti dalle basse alle alte stimolazioni VNS, i dati erano disponibili per 24 dei 36 pazienti nel periodo di 16-18 mesi. Questo gruppo aveva riportato una riduzione media delle crisi del 38,1% rispetto al basale. Nessun cambiamento significativo nel profilo di sicurezza e negli effetti avversi era stato segnalato durante tutto il periodo di follow-up. Gli effetti indesiderati riportati in precedenza come raucedine e cambiamento di voce, tosse, parestesie (sensazione nel collo e mandibola) avevano continuato a verificarsi durante le alte stimolazioni. Questi effetti indesiderati erano stati tuttavia ben tollerati. Durante il periodo di follow-up, un paziente era deceduto per porpora trombotica trombocitopenica (TTP) e cinque pazienti avevano interrotto il trattamento a causa di efficacia non soddisfacente. Questo studio ha quindi mostrato come l’estensione a tutti i pazienti degli alti paramentri di stimolo offra un migliormento nella riduzione delle crisi epilettiche. Questo è vero anche per i pazienti inizialmente appartenenti al gruppo a bassa stimolazione (George et al., 1994).
19
Vonck e coll. nel 1999 presentano la loro esperienza di VNS con un follow-up fino a 4 anni. Il loro studio includeva venticinque pazienti (13 femmine e 12 maschi) con epilessia focale farmaco-resistente che venivano trattati con VNS. I primi 15 pazienti, con età media di 30 anni ed una durata media di epilessia di 17,5 anni, forniscono un sufficiente follow-up per l'analisi. La media post-impianto di follow-up era di 29 mesi, e la corrente media in uscita aveva un’ ampiezza di 2,25 mA. Tale studio aveva evidenziato una riduzione media della frequenza delle crisi da 14 crisi parziali complesse (CPS) nel mese pre-impianto, a 8 CPS nel mese post-impianto, con un P value statisticamente significativo. Sei pazienti erano risultati liberi da CPS per almeno un anno. Gli effetti avversi si eranoverificati in sei pazienti, tre dei quali avevano richiesto, a tal proposito, una riduzione temporanea della corrente in uscita. Nove pazienti non avevano riportato alcun effetto collaterale. Tale studio conclude quindi che il trattamento con VNS rimane efficace anche nel lungo termine (Vonck et al., 1999 ).
Anche Ben Menachen e coll. valutano nello stesso anno l'efficacia della stimolazione del nervo vago, su un follow-up di oltre 5 anni, in 64 pazienti con epilessia farmaco-resistente (Ben-Menachemet al., 1999). Il tempo medio di trattamento era stato di 20 mesi. L’analisi aveva evidenziato una riduzione della frequenza delle crisi di oltre il 50% in 19 dei 47 pazienti con epilessia focale, in cinque dei nove pazienti con epilessia generalizzata idiopatica, e in cinque degli otto pazienti con sindrome di Lennox-Gastaut. Gli effetti collaterali erano stati lievi. La VNS è stata riconfermata anche da questo studio essere un trattamento sicuro ed efficace per l'epilessia farmaco-resistente.
Cinque anni dopo l’approvazione della VNS da parte della Food and Drug Administration un articolo pubblicato su Neurology nel 2002 mostra come nei 16.000 pazienti impiantati fino ad allora, la VNS risulti una terapia aggiuntiva sicura, efficace e ben tollerata per i pazienti trattati con tale terapia; ricordando due considerazioni:
20
(1) che l’adeguatezza del paziente come candidato per la resezione chirurgica e che la risposta alla terapia farmacologica dovrebbero essere presi in considerazione prima di optare per tale procedura,
(2) che gli effetti potenziali positivi sulla qualità di vita e la possibilità della riduzione del numero di AEDs dovrebbero essere pesati anche sulla base degli aspetti chirurgici connessi all’impianto, i potenziali effetti avversi della metodica e la posssibilità che il paziente possa non migliorare in maniera significativa nonostante la VNS.
Gli studi con evidenze di classe III, retrospettivi, rappresentano ad oggi il più ampio database di pazienti impiantati ( Janszky et al., 2005, Murphy et al., 1999, Chavel et al., 2003, Murphy et al., 2003, Benifla et al., 2006, Saneto et al., 2006, De Herdt et al., 2007, Montavont et al., 2007, Ghaemi et al., 2010 , Elliott et al., 2011). Qesti studi mostrano come la riduzione della frequenza delle crisi VNS indotta continui ad aumentare nel tempo. Lo studio di Chavel e coll. (Chavel et al., 2003 ) evidenzia una riduzione >50% nel 54% dei pazienti ad un anno e nel 61% a due anni. De Herdt e coll., nel 2007, con un massimo follow-up di 10 anni (media di 44 mesi), mostrano nel loro studio come l’aumento di riduzione delle crisi non sia immediato, ma tenda a crescere nelle settimane e nei mesi fino a raggiungere un plateau dopo 18-24 mesi. Gli effetti avversi risultano principalmente correlati alla stimolazione, sono reversibili, e tendono a ridursi nel tempo (De Herdt et al., 2007). Janszky e coll. cercano di identificare i paramentri predittivi di responders su 47 pazienti con almeno un anno di follow-up. Dal loro studio emerge che le uniche due variabili significative sono la presenza di displasia corticale alla RM e l’assenza bilaterale di scariche epilettiformi interictali (Janszky et al., 2005 ). Uno studio condotto da Uthman e coll. su 12 anni di osservazione, giunge alle seguenti conclusioni: che coloro che rispondono alla VNS mantengono una significativa riduzione nel tempo, che la risposta non è dipendente dall’elevata intensità di stimolo, e che pazienti con anomalie EEG unilaterali rispondono meglio rispetto a quelli con anomalie EEG bilaterali (Uthman et al., 2004 ).
21
E’ quindi possibile affermare, data la notevole quantità di dati provenienti dalla letteratura, che la VNS rappresenta un’efficace terapia antiepilettica in pazienti farmaco-resistenti. Da tali studi emerge globalmente che circa un terzo dei pazienti risulta responder, circa un terzo ha una riduzione delle crisi compresa tra il 20 e il 50%, mentre il terzo rimanente presenta una assenza di risposta alla VNS. Nell’ambito dei pazienti responders vi è una piccola percentuale di soggetti, circa il 10%, che mostra un completo controllo delle crisi (Labiner et al., 2000; Uthman et al., 2004). Come più volte sottolineato l’indicazione FDA è per i pazienti con epilessia focale, tuttavia sin dall’inizio sono stati trattati anche pazienti con crisi generalizzate. In particolare l’efficacia della VNS è stata osservata nella Sindrome di Lennox-Gastaut, tant’è che confrontando l’efficacia della VNS con quella della callosotomia sono stati ottenuti risultati sovrapponibili per i due trattamenti, con una tollerabilità sicuramente superiore per la VNS (Nei et al., 2006). A tale proposito la Regione Toscana ha recepito la VNS nell’ambito delle Linee Guida per la Diagnosi ed il Trattamento delle Epilessie, come trattamento per la sindrome di Lennox-Gastaut, da praticarsi prima della callosotomia. Nonostante che siano molti ormai i soggetti impiantati non sono stati ancora individuati chiaramente marcatori clinico-strumentali predittivi di una maggiore risposta alla VNS.
22
5. Meccanismo d’azione della VNS
La comprensione del meccanismo d’azione della VNS può fornire utili indicazioni riguardo l’ottimizzazione dei parametri di stimolazione e la selezione dei pazienti più idonei al trattamento.
L’ipotesi di base di tale meccanismo è basata sul fatto che il nervo vago, come precedentemente esposto, presenta numerose connessioni verso il Sistema Nervoso Centrale e che la stimolazione del nervo vago possa influenzare l’eccitabilità corticale (Berthoud and Neuhuber , 2000).
Tuttavia per comprendere più a fondo il meccanismo d’azione con cui la VNS agisce, bisogna soffermarci su 3 punti interdipendenti:
-le afferenze anatomiche coinvolte -le strutture del SNC interessate
-i neurotrasmettitori rilasciati a livello di tali strutture.
Connessioni anatomiche
L’obiettivo della VNS è la stimolazione delle fibre vagali afferenti che rappresentano una porta di accesso al S.N.C. ed alla corteccia cerebrale. La stimolazione selettiva delle fibre afferenti sarebbe, a livello teorico, da preferire perché questa rappresenta la via “terapeutica” della VNS, mentre la stimolazione delle fibre efferenti è considerata alla base degli effetti collaterali (e.g. raucedine, disfonia, disconfort laringeo).
A sostenere questo vi è uno degli esperimenti condotti da Zabara (Zabara , 1992) che ha mostrato come la lesione del nervo vago al di sotto del livello di stimolazione non influenzi la soppressione delle crisi da parte della VNS, suggerendo quindi che la stimolazione afferente è la via principale coinvolta nel meccanismo antiepilettico.
23
Tuttavia, tale modalità di stimolazione selettiva delle afferenze vagali non è attuabile con le tecnologie oggi disponibili.
Il nervo vago contiene tre diversi tipi di fibre: fibre A : mieliniche e di grande diametro fibre B: mieliniche e di diametro intermedio
fibre C: mieliniche e di diametro ridotto, sono le più rappresentate (65-80%).
La stimolazione elettrica richiede correnti diverse nei vari tipi di fibre per indurre i potenziali d’azione. Nella fibre A è necessaria una densità di corrente inferiore rispetto alle fibre C, e questo implica che per la generazione dei potenziali d’azione nelle fibre C siano necessari impulsi di durata e ampiezza maggiori.
Anche se i primi studi condotti su modelli animali mostravano che la gravità delle crisi veniva ridotta solo se i parametri di stimolazione superavano la soglia di attivazione per le fibre C (Zabara , 1992), gli studi successivi accumulavano invece evidenze a favore del non coinvolgimento delle fibre C nel meccanismo d’azione della VNS. Per esempio Krahl e coll. hanno dimostrato che la lesione selettiva delle fibre C con capsaicina, nel ratto, non elimina l’effetto di soppressione delle crisi indotto dalla VNS (Krahl et al., 2001). In realtà quale sia lo specifico coinvolgimento delle fibre vagali nel meccanismo d’azione della VNS resta ancora da chiarire.
Strutture del SNC
Sono stati effettuati molti studi per capire quali siano le strutture corticali, sottocorticali e del tronco encefalico coinvolte nel meccanismo d’azione della VNS.
Naritoku e coll. (1995) hanno studiato l’espressione cerebrale di c-Fos con tecniche di immunoistochimica, nel ratto. c-Fos è una proteina nucleare che viene espressa nei
24
neuroni ad elevata attività corticale. Negli esperimenti veniva utilizzata come marcatore funzionale per identificare le regioni cerebrali che si attivavano nella stimolazione del nervo vago. Questi autori hanno dimostrato che la VNS induceva una marcatura bilaterale simmetrica con c-Fos in numerose strutture quali l’amigdala posteriore, la corteccia del cingolo, i nuclei arcuato e ventromediale dell’ipotalamo. A livello del tronco encefalico era presente una marcatura c-Fos nel locus coeruleus e nel nucleo del tratto solitario (Naritoku et al., 1995).
Krahl e coll. (2001) hanno dimostrato, nel ratto, che l’efficacia della VNS nella soppressione delle crisi indotte da elettroshock massimale veniva annullata dalla lesione selettiva del locus coeruleus. E’ stato quindi ipotizzato un ruolo chiave del locus coeruleus nel meccanismo d’azione della VNS.
Sono stati anche effettuati numerosi studi sul flusso sanguigno cerebrale in pazienti sottoposti a neurostimolazione, sia per il trattamento dell’epilessia che della depressione, allo scopo di identificare strutture implicate nei meccanismi dell’epilessia e della depressione e substrati anatomici eventualmente condivisi dalle due patologie. Dai diversi studi è risultato chiaro che la VNS è in grado di indurre variazioni misurabili nel flusso sanguigno cerebrale in specifiche regioni. Numerose strutture corticali, sottocorticali e del tronco encefalico presentano modifiche del flusso sanguigno indotte dalla VNS. L’ampia varietà di strutture anatomiche coinvolte è verosimilmente dovuta alla diversa tipologia dei pazienti trattati, all’uso di diversi parametri di stimolazione, all’impiego di tecniche diverse di scansione e rilevazione delle modifiche di flusso (SPECT, PECT, RM funzionale), ai diversi tempi di stimolazione e alla durata del trattamento. Tuttavia, le strutture più frequentemente coinvolte sarebbero rappresentate dal talamo e dal sistema limbico. Questi dati sono molto interessanti perché contribuiscono a individuare substrati anatomici comuni di epilessia e depressione, la modulazione dei quali potrebbe avere un ruolo rilevante nell’efficacia della terapia.
25
Neurotrasmettitori
Sono stati condotti molti studi con lo scopo di identificare quale sia/siano i neurotrasmettitori rilasciati una volta generato il potenziale d’azione nelle fibre del nervo vago.
Dai loro studi iniziali sui ratti Woodbury e Woodbury avevano concluso che l’acido gamma-idrossi-butirrico (GABA), principale neurotrasmettitore inibitorio del SNC, era coinvolto nel meccanismo d’azione della VNS (Woodbury and Woodbury , 1989). I due ricercatori avevano evidenziato che la VNS era in grado di interrompere le crisi indotte da 3-mercaptoproprionato e pentilentetrazolo. Questi due composti inducono crisi interferendo con il sistema GABAergico. Inoltre Woodbury e Woodbury avevano ipotizzato il coinvolgimento della glicina poiché la VNS interrompe le crisi motorie indotte da stricnina che, a sua volta, interferisce con le funzioni inibitorie della glicina. L’esperimento più significativo per quanto riguarda l’analisi dei neurotrasmettitori implicati nella VNS è stato condotto da Krahl e coll. che hanno individuato la noradrenalina come neurotrasmettitore principale nel meccanismo d’azione della VNS (Krahl et al., 1998 ). Nel modello sperimentale di ratto, mediante l’infusione della neurotossina 6-idrossidopamina (6-OHDA) gli autori hanno indotto una deplezione selettiva cronica di noradrenalina nel locus coeruleus, la principale fonte di noradrenalina nel S.N.C. Due settimane dopo hanno valutato la suscettibilità degli animali alle crisi epilettiche indotte da elettroshock massimale. E’ stato osservato che la lesione del locus coeruleus determinava l’abolizione della la soppressione delle crisi mediata dalla VNS. In un altro esperimento dello stesso gruppo gli autori producevano una inattivazione acuta del locus mediante lidocaina e ottenevano gli stessi risultati in termini di perdita dell’efficacia antiepilettica della VNS.
Questi risultati sono di estrema importanza nel definire il ruolo fondamentale della noradrenalina nel meccanismo d’azione dello Stimolatore Vagale. In altre parole, è
26
essenziale l’integrità del sistema noradrenergico perché la VNS eserciti la propria efficacia antiepilettica, mentre in assenza di noradrenalina tale efficacia viene meno. Le afferenze vagali terminano nei nuclei del complesso dorsale bulbare del vago; tra questi il nucleo del tratto solitario rappresenta la struttura che riceve il maggior contingente di fibre. Questo nucleo a sua volta proietta a numerosissime strutture bulbo-ponto-cerebellari, tra cui il nucleo parabrachiale, i nuclei del rafe ed il locus coeruleus. Le proiezioni del locus coeruleus raggiungono diffusamente l’intera corteccia cerebrale. Un ruolo fondamentale per l’effetto antiepilettico della VNS è svolto proprio dalle connessioni che comprendono il locus, come hanno dimostrato Krahl e i suoi collaboratori. Il meccanismo noradrenergico potrebbe spiegare anche l’effetto antidepressivo e il miglioramento della qualità di vita, VNS correlati, che sono stati dapprima osservati nei pazienti epilettici trattati con VNS, e poi specificamente anche nei pazienti depressi (infatti dal 2005 la FDA ha approvato la VNS per il trattamento della depressione farmaco-resistente). E’ proprio tramite l’attivazione del locus coeruleus, con conseguente aumento dell’attività noradrenergica, che potrebbe essere contrastato uno dei meccanismi neurobiologici ormai riconosciuti alla base della depressione, il deficit di noradrenalina.
27
6. Effetto anti-crisi / anti-epilettico/ anti-epilettogeno della VNS
I primissimi studi su modelli animali mostravano già un effetto anti-crisi della VNS. Un trattamento ha effetto anti-crisi quando è in grado di interrompere la crisi. Questo viene solitamente valutato iniettando nell’animale da esperimento una sostanza convulsivante per poi procedere alla somministrazione del trattamento in studio. L’efficacia anti-crisi riguarda il sintomo, ma non la causa sottostante. Woodbury e Woodbury avevano descritto l’effetto benefico della VNS nella prevenzione o riduzione delle crisi indotte da pentilentetrazolo (Woodbury and Woodbury , 1989). Zabara aveva riscontrato che la VNS abolisce le crisi motorie indotte da stricnina nei cani (Zabara , 1992). Lo stesso magnete consegnato al paziente, che viene passato sopra il generatore d’impulsi durante l’avvertimento dell’aura epilettica, permette l’aborto della crisi stessa. Inoltre alcuni case reports descrivono l’uso della VNS per interrompere, in casi selezionati, lo stato di male epilettico (O’Neill et al., 2011; Helmers et al., 2012).
L’effetto anti-epilettico implica invece che il trattamento sia in grado di prevenire la crisi, e viene quindi valutato con la capacità di prevenire la ricorrenza inattesa delle crisi. Poiché molti farmaci antiepilettici vengono somministrati quotidianamente, si suppone che l’effetto anti-epilettico possa essere dovuto anche al raggiungimento di livelli plasmatici costanti del farmaco in circolo, e che quindi sia un effetto anti-crisi cronico piuttosto che un effetto anti-epilettico vero e proprio.
Con la VNS si aprono nuove prospettive riguardo ad un reale, e più facilmente valutabile, effetto anti-epilettico. Questo è legato alla modalità di stimolazione intermittente del nervo vago, in relazione alla quale sembrerebbe che la prevenzione delle crisi si verifichi anche durante la fase OFF di stimolazione. Già Zabara nel 1985 aveva osservato che la stimolazione per un minuto nell’animale da esperimento, poteva produrre una soppressione della crisi per i cinque minuti successivi (Zabara, 1985). Takaya e coll. avevano studiato l’effetto anti-epilettico della VNS mediante stimolazione continua e/o intermittente per 60 minuti del nervo vago nell’animale da esperimento, mentre
28
iniettavano a intervalli di 0, 3, 5, 10 minuti pentilentetrazolo per indurre le crisi (Takaya et al., 1996). Dai risultati era emerso che il più grande effetto anticonvulsivante si verificava dopo 60 minuti di VNS continua. La VNS intermittente di 60 minuti era invece meno efficace di quella continua per 60 minuti, ma comunque più efficace rispetto ad un periodo intermittente minore di stimolazione. Takaya e coll. hanno quindi potuto osservare come l'effetto anticonvulsivante declini in modo tempo-dipendente dopo la sospensione della VNS, suggerendo un effetto cumulativo per l’efficacia a lungo termine. Resta tuttavia da chiarire se la VNS continui ad avere efficacia anche una volta che la batteria si sia scaricata. Se così fosse risulterebbe certamente molto probabile anche un effetto anti-epilettogeno della VNS, in grado di modificare i circuiti neuronali alla base della patologia. A tal proposito è importante notare come la maggior parte dei pazienti trattati con VNS rispondano meglio soprattutto nel lungo periodo, dove si osservano le percentuali più alte di soggetti responders. Infatti per valutare con maggior correttezza l’efficacia o meno della VNS sarebbe necessario un follow-up di almeno due/tre anni. Questa osservazione potrebbe essere giustamente interpretata come un argomento a favore dell’attività anti-epilettogena della VNS, in grado di modificare reti neuronali preesistenti, e quindi valutabile solo nel lungo follow-up. La reale efficacia anti-epilettogena della VNS andrebbe però studiata una volta che il dispositivo si sia scaricato e quindi sia stato spento. Solo in questo modo è possibile esplorare completamente il potenziale anti-epilettogeno generale della neurostimolazione. Generalmente le crisi tendono a ripresentarsi una volta che la batteria risulti scarica, tant’è che spesso i pazienti ricorrono a un secondo intervento di sostituzione del generatore. In letteratura è disponibile un solo case report che descrive il controllo delle crisi a lungo termine dopo lo spegnimento del dispositivo (Labar and Ponticello, 2003 ); tuttavia non ci sono ancora solidi studi a favore di questa considerazione.
Alla base dell’efficacia della VNS c’è molto probabilmente la combinazione di effetti acuti e cronici. Questi potrebbero includere sia effetti sui recettori, i canali, le correnti,
29
con attività in acuto; sia meccanismi di trascrizione genica con effetto in acuto (trascrizione di c-Fos ,prodotto immediato precoce del gene), e in cronico (trascrizione della variante splice FosB , con attivazione più ritardata ma più duratura, considerato marker di attivazione neuronale cronica) (Naritoku et al., 1995).
E’ probabile quindi che tutto ciò determini, nel lungo periodo, il reclutamento di diverse reti e sistemi neuronali, e questo potrebbe essere in accordo col fatto che pazienti impiantati con VNS mostrano benefici anche alcuni anni dopo l’impianto e non necessariamente nel breve follow-up.
30
7. Esiste un candidato ideale alla VNS?
Nel corso degli anni sono stati intrapresi alcuni studi volti a valutare la possibile esistenza di fattori predittivi di risposta all’efficacia antiepilettica della VNS, e quindi volti ad individuare l’esistenza o meno di un ‘candidato ideale’ a tale metodica.
Tanganelli e coll. (Tanganelli et al., 2002) nel loro studio effettuato su 47 pazienti, in cui la VNS si è dimostrata una metodica sicura ed efficace per il trattamento dell’epilessia farmaco-resistente, hanno studiato la correlazione tra efficacia clinica della VNS e tipo di crisi/alterazioni EEG. I risultati della loro analisi hanno però riscontrato che tra le variabili considerate non c’era nessun tipo di crisi e di alterazione EEG che potesse essere predittivo di migliore risposta. Al contrario Janszky e coll. hanno individuato tra i parametri predittivi di miglior risposta alla VNS la presenza di displasia corticale e l’assenza bilaterale di scariche epilettiformi interictali all’EEG (Janszky et al., 2005 ). Ghaemi e coll. hanno individuato, in un’analisi effettuata su 144 pazienti seguiti per almeno due anni, come variabili indipendenti al trattamento con VNS: l’età di impianto,la displasia corticale e la presenza unilaterale di scariche epilettiformi interictali (Ghaemi et al., 2010 ). Casazza e coll. (Casazza et al., 2006 ) hanno evidenziato una maggiore risposta in pazienti con epilessia del lobo temporale rispetto a quelli con epilessia del lobo frontale, tuttavia data la piccola casistica di pazienti questa ipotesi deve essere supportata da successivi studi.
Al momento, data la scarsità di dati presenti, e con risultati talora anche in disaccordo, non è quindi possibile affermare che esista un candidato ideale al trattamento con VNS. Quello che però è sicuramente vero è che si osserva una migliore risposta nei bambini, rispetto agli adulti. Questa considerezione è supportata da moltissimi dati della letteratura. Alexopolous e coll. (Alexopoulos et al., 2006 ) evidenziano una mediana di riduzione delle crisi del 74% a 36 mesi, con il 43,3% di pazienti che mostra una riduzione della frequenza delle crisi >75% al massimo follow-up. Lundgren e coll., dopo l’impianto
31
dello stimolatore in 16 bambini con epilessia focale, generalizzata o Sindrome di Lennox-Gastaut, su un follow-up di 12-24 mesi evidenziano una riduzione della frequenza critica >50% in sei pazienti e condizione di seizure-free in un paziente, oltre ad una globale riduzione della severità delle crisi e ad un miglioramento della qualità di vita (Lundgren et al., 1998 ). Uno studio multicentrico condotto su 28 bambini trattati con VNS, mostra una riduzione della frequenza media delle crisi >50% in 15 pazienti e >75% in nove. Inoltre nello stesso studio il profilo di efficacia della VNS si estende anche sul piano del miglioramento della qualità di vita (comportamento, umore, competenze verbali), riscontrando un notevole beneficio in tutti i 28 pazienti trattati (You et al., 2007 ). Al fine comunque di identificare un candidato ideale, in relazione al tipo epilessia, tipo di crisi epilettiche, alterazioni alla RM e all’EEG, servono tuttavia ulteriori studi perché nessun parametro fino ad ora individuato può essere considerato come variabile indipendente di migliore risposta al trattamento con VNS e pertanto eventualmente predittivo di efficacia clinica.
32
PAZIENTI E METODI
1. Pazienti
La popolazione dei pazienti analizzata nel presente studio è costituita da 31 soggetti sottoposti ad impianto di Stimolatore Vagale e seguiti presso il Centro di Riferimento Regionale per la Diagnosi e Terapia Epilessia dell’Azienda Ospedaliero-Universitaria Pisana.
Tutti i pazienti sono affetti da epilessia farmaco-resistente: quattro da epilessia
generalizzata sintomatica ed i restanti ventisette da epilessia focale
criptogenica/sintomatica. L’opzione della chirurgia resettiva era stata precedentemente esclusa per una delle seguenti ragioni: (i) localizzazione della zona epilettogena in zone corticali eloquenti, (ii) presenza di foci epilettogeni multipli, (iii) ritardo mentale severo/disturbi psichiatrici, (iv) rifiuto del paziente (#3, #6, #30).
Venti maschi e undici femmine di età compresa tra 23 e 68 anni (46,3±2,7) sono stati impiantati tra marzo 1995 e giugno 2013.
L’età d’insorgenza delle crisi era compreso tra un mese e 21 anni (8,8±6,9). La durata di malattia al momento del primo impianto era compresa tra 5 e 57 anni (32,2 ±12,2). L’età del primo impianto con VNS era compresa tra 20 e 74 anni (47±11,6). Il numero di AEDs prima della VNS variava da 2 a 5 (3,6±0,2). In particolare, un paziente era in trattamento con 2 AEDs (3,3%), nove pazienti con 3 AEDs (30%), quindici pazienti con 4 AEDs (50%), cinque pazienti con 5 AEDs (16,7%).
Escluso il paziente #31 il cui follow-up è ancora troppo breve per essere sottoposto ad analisi (data di impianto 10 giugno 2013), la durata del follow-up è compresa tra 1 e 17 anni (6,9±4,2).
Per ciascun paziente sono state eseguite registrazioni EEG multiple di routine e monitoraggi videoEEG prolungati. I tipi di crisi sono stati classificati secondo la
33
Classificazione delle Crisi Epilettiche proposta nel 1981 e rivista nel 2001 (Commission, 1981; Engel, 2001). Il tipo di epilessia è stato classificato secondo la Classificazione delle epilessie e delle sindromi epilettiche proposta nel 1989 e rivista nel 2001 (Commission, 1989; Engel, 2001).
Dei quattro pazienti con epilessia generalizzata sintomatica (#7,#10,#16,#29), due sono affetti da sindrome di Lennox-Gastaut (#7, #10), uno da epilessia mioclonica progressiva (#16), una da sindrome Lennox-Gastaut like (#29) . I pazienti #7 e #10 hanno presentato spasmi nei primi sei mesi di vita, tipi multipli di crisi (assenze atipiche, crisi con caduta, crisi generalizzate tonico-cloniche, crisi miocloniche) e ricorrenti condizioni di stato di male epilettico. Il paziente #16 presentava assenze miocloniche e disturbo cognitivo progressivo associato a severi sintomi psichiatrici. Le assenze sono divenute progressivamente atipiche e in aggiunta si sono presentate anche crisi generalizzate tonico-cloniche e crisi atoniche, definendo in tal modo un quadro di epilessia mioclonica progressiva.
Ventisette pazienti sono affetti da epilessia focale criptogenica/sintomatica. In base alla semeiologia ictale e interictale ed ai risultati delle indagini neurofisiologiche abbiamo
individuato dieci pazienti affetti da epilessia del lobo frontale
(#1,#5,#6,#8,#9,#15,#17,#18,#19,#22), dieci affetti da epilessia del lobo temporale
(#2,#3,#4,#11,#12,#20,#23,#28,#30,#31), tre affetti da epilessia bitemporale
(#24,#25,#27), quattro affetti da epilessia multifocale (#13,#14,#21,#26).
La paziente #31 è riportata soltanto a scopo descrittivo e non è stata inclusa nell’analisi dei dati per il follow-up ancora troppo breve. E’ tuttavia interessante notare che si tratta dell’unico paziente trattato con VNS dopo chirurgia resettiva (cortectomia temporale sinistra) risultata inefficace.
34
In particolare nella stessa tabella è riportata l’eziologia dell’epilessia per ogni singolo paziente. Le cause di epilessia riscontrate nella casistica sono costituite da
malformazioni dello sviluppo corticale (#1,#11,#14,#17,#20,#21,#28,#29,#30),
encefalopatia ipossico-ischemica perinatale (#4,#7,#8,#9,#10,#13,#15,#18,#22), post-traumatica (#5,#6,#12,#19), neoplasia (#25,#27), altro (#2,#16,#23,#24), criptogenica (#3, #26).
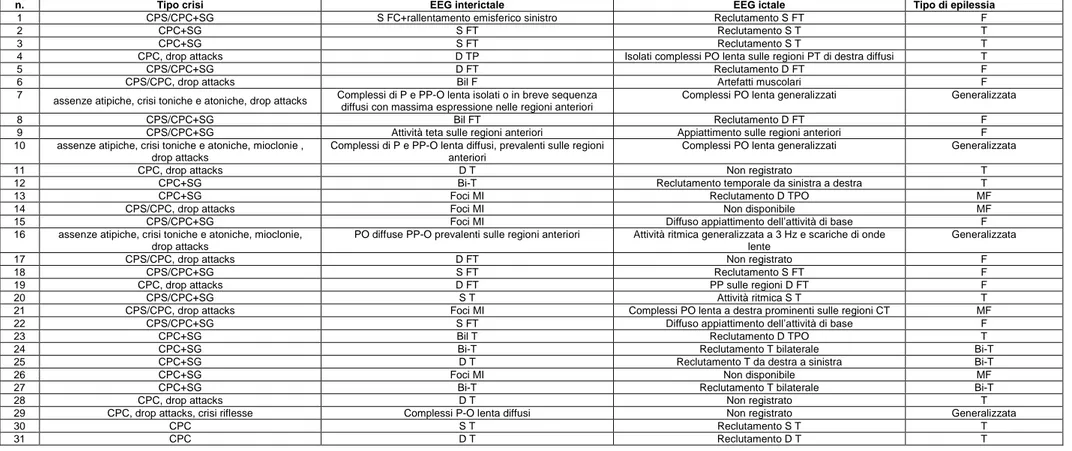
La semeiologia delle crisi con i reperti EEG ictali e interictali e il tipo di epilessia sono riportati in Tabella 2.
In questa analisi è stata inclusa inoltre una nosografia dettagliata riguardante le crisi con caduta. Tali crisi possono verificarsi sia come crisi primariamente generalizzate (nel contesto di forme di epilessia generalizzata idiopatica o criptogenica/sintomatica), sia come crisi secondariamente generalizzate (nei pazienti affetti da epilessia focale). Uno specifico tipo di crisi con caduta è rappresentato dai drop attacks, clinicamente definito come il manifestarsi di crisi con caduta senza avvertimento, con o senza perdita di coscienza (Pazzaglia et al., 1985; Tinuper et al., 1998). I drop attacks possono verificarsi sia nelle forme di epilessia focale sia in quelle di epilessia generalizzata sintomatica, come la sindrome di Lennox-Gastaut. Nei pazienti analizzati le crisi con caduta sono state distinte come segue: 1) drop attacks nelle forme di epilessia generalizzata sintomatica, 2) crisi parziali con secondaria generalizzazione, 3) drop attacks nelle forme di epilessia focale.
Dei 27 pazienti con epilessia focale, 17 mostravano crisi con caduta dovute a secondaria generalizzazione ( cinque pazienti con epilessia temporale, sette con epilessia frontale, tre con epilessia bitemporale, due con epilessia multifocale), mentre otto soggetti mostravano drop attacks (tre pazienti con epilessia frontale, tre con epilessia temporale, due con epilessia multifocale) (vedi Tabelle 2 e 3).
35
Come precedentemente riportato, la paziente #31, affetta da epilessia focale temporale, non è stata inclusa nell’analisi dei dati perché il suo follow-up è ancora troppo breve.
2. Metodi
Il sistema dello stimolatore vagale è costituito da un generatore di impulsi elettrici impiantato in una tasca sottocutanea a livello sottoclaveare sinistro e da un elettrocatetere posizionato attorno al nervo vago per la trasmissione degli impulsi prodotti dal generatore al nervo.
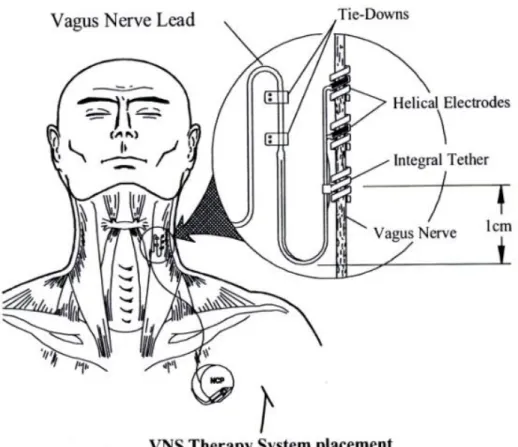
I pazienti di questo studio sono stati sottoposti ad impianto presso l’U.O. Neurochirurgia Universitaria dell’Azienda Ospedaliero-Universitaria Pisana ed il sistema per la VNS utilizzato (Neurocybernetic Prosthesis, NCP Generator Cyberonic, Inc. Webster, TX, USA) è schematicamente rappresentato in Figura 1.
Tale dispositivo viene impiantato durante un intervento di circa 2 ore in anestesia generale. Nella procedura standard di impianto viene utilizzato il nervo vago di sinistra. Questo è dovuto al fatto che si ritiene generalmente che la stimolazione del nervo vago di sinistra abbia una minore influenza sul ritmo cardiaco; sembra infatti che il nervo vago di sinistra innervi principalmente il nodo atrio-ventricolare, un pacemaker basso e non dominante, mentre il nervo vago di destra sarebbe maggiormente deputato all’innervazione del nodo seno-atriale, il pace-maker cardiaco principale.
Durante l’intervento viene effettuata un’incisione a livello della membrana cricotiroidea accanto al margine anteriore del muscolo sternocleidomastoideo sinistro. L’incisione è effettuata medialmente al muscolo sternocleidomastoideo ed il nervo vago, nella sua porzione cervicale inferiore, è identificato in una loggia posteriore alla carotide. Vengono successivamente isolati 3 cm del nervo e l’elettrocatetere viene posizionato sul nervo stesso mediante due elettrodi bipolari ad elica fissati intorno ad esso, distalmente al ramo del laringeo ricorrente. Una volta fissato al nervo vago, l’altra estremità
36
dell’elettrocatetere viene fatta passare mediante un tunnellizzatore sotto la clavicola, tra il sito di incisione nel collo e la tasca sottoclaveare, e qui viene connesso con il generatore di impulsi sopra la fascia pettorale. E’ molto importante che il chirurgo posizioni l’elettrocatetere al di sotto del punto in cui i rami cervicali superiore e inferiore si separano dal nervo vago, visto che la stimolazione di uno o dell’altro ramo può causare conseguenze rilevanti sul ritmo cardiaco.
Al termine dell’intervento, prima che vengano apposti i punti di sutura a livello dell’incisone sottocutanea, il programmatore esterno viene posizionato sopra il generatore di impulsi e viene valutata la corretta impedenza dell’elettrocatetere. Cause di elevata impedenza sono la fibrosi tra il nervo e l’elettrodo, la discontinuità dell’elettrocatetere, lo scollegamento dell’elettrocatetere dal generatore di impulsi. Cause di bassa impedenza includono invece il cortocircuito all’interno dell’elettrocatetere o un generatore di impulsi difettoso.
Mediante lo stesso programmatore esterno che funziona da interfaccia con il generatore, lo stimolatore vagale viene attivato solitamente due settimane dopo l’intervento.
Nel corso del follow-up i parametri di stimolazione vengono controllati ed eventualmente modificati al fine di ottenere la migliore risposta terapeutica (per maggiori dettagli in proposito si rimanda al paragrafo specifico Parametri VNS della Sezione dei Risultati).
La sostituzione del generatore viene effettuata una volta che la batteria si sia scaricata. La durata della batteria varia a seconda delle impostazioni di programmazione selezionate e del tipo di dispositivo (quelli di più vecchia generazione, modelli 100-101, erano meno longevi oltre che più “ingombranti” degli attuali modelli 103-104). Tale sostituzione non richiede la sostituzione dell’elettrocatetere, a meno che non sia presente un suo disfunzionamento.
37
La rimozione del vecchio generatore “esaurito” ed il posizionamento del nuovo generatore di impulsi richiede semplicemente l’incisione della tasca sottocutanea e la connessione con l’elettrocatetere già in sede. Tale intervento è molto più semplice e di durata di gran lunga inferiore a quella del primo impianto.
2.1 Raccolta dati e analisi statistiche
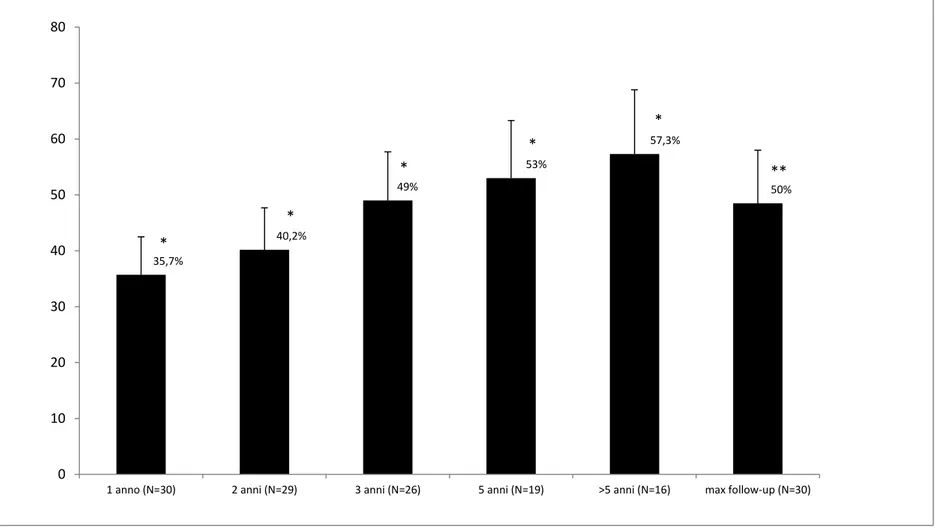
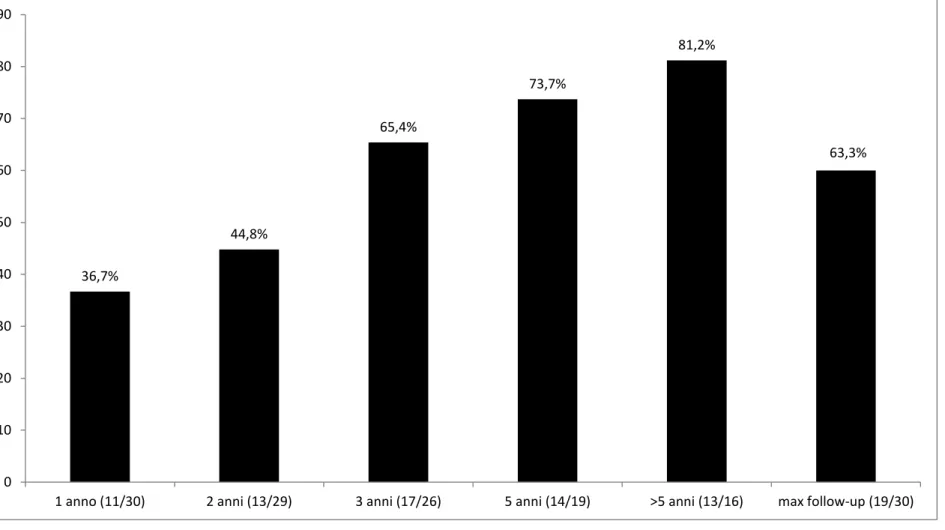
In questo studio retrospettivo è stato valutato il profilo di efficacia e tollerabilità della VNS nei pazienti impiantati presso il Centro Epilessia di Pisa durante un follow-up a lungo termine a vari intervalli di tempo dopo l’impianto: 1, 2,3, 5, >5 anni e al ‘massimo follow-up’. Il massimo follow-up è definito come il tempo più lungo di follow-up per ciascun paziente, indipendentemente dalla durata del periodo di osservazione. I pazienti sono stati sottoposti a controlli ambulatoriali periodici ogni 3-6 mesi. La frequenza individuale delle crisi è stata monitorata mediante la compilazione da parte del paziente/familiari di un diario delle crisi in cui vengono riportati il numero, il tipo e la severità delle crisi. Durante ciascuna visita è stata registrata la frequenza delle crisi, gli effetti avversi e l’eventuale modifica dei parametri della VNS.
I pazienti con una riduzione percentuale delle crisi di almeno il 50% rispetto al basale sono considerati “responders”, mentre quelli con una riduzione inferiore al 50% sono considerati “non responders”.
La percentuale media di riduzione delle crisi viene calcolata ad ogni intervallo di tempo di follow-up (1,2,3,5, >5 e massimo follow-up) usando la seguente formula: [crisi al baseline/mese – crisi post VNS/mese] / [crisi al baseline/mese] x 100.
Tutti i dati sono espressi come media ± S.E.M. Per ciascun gruppo, le analisi della varianza per misure ripetute sono state usate per comparare la frequenza delle crisi durante il follow-up con i valori pre-trattamento.
38
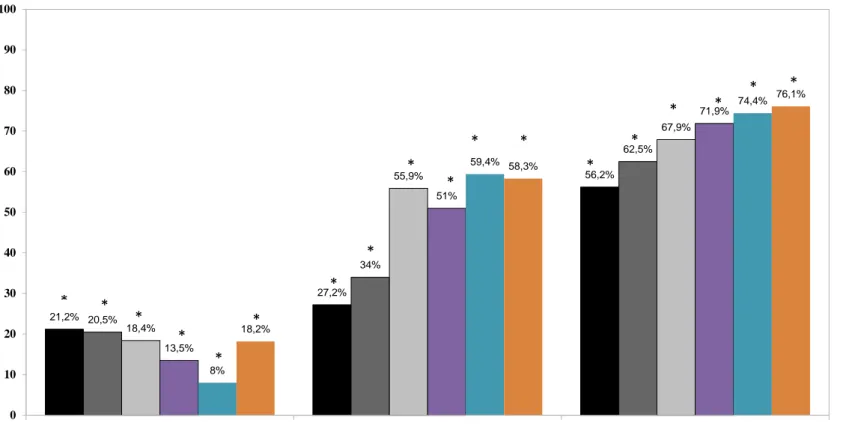
Per valutare i fattori predittivi dell’outcome della VNS (responders vs non responders) nell’epilessia del lobo frontale rispetto a quella del lobo temporale, abbiamo utilizzato il test esatto di Fisher per una tabella di contingenza 2x2.
Il test non parametrico di Wilcoxon dei ranghi segnati è stato utilizzato per comparare il ruolo predittivo delle caratteristiche dei pazienti selezionati (eziologia dell’epilessia, alterazioni EEG, tipo di epilessia, durata dell’epilessia) con l’efficacia della VNS.