U
NIVERSITÀ DI
P
ISA
F
ACOLTÀ DIS
CIENZEM
ATEMATICHE,F
ISICHE EN
ATURALI Dipartimento di Chimica e Chimica IndustrialeTesi di Laurea
Sintesi di un legante tris-salicilaldimminico pseudo C3 e
studio computazionale sul nuovo legante libero e sulla
spontanea interconversione in soluzione di complessi
dinucleari a doppia elica in specie mononucleari.
Candidato:
Domenico Pannuti
Relatore:
Prof.
ssaBenedetta Mennucci
Controrelatore:
Prof. Guido Pampaloni
INDICE
1 Introduzione . . . 1
1.1 La Chimica Supramolecolare . . . 1
1.2 Self-Assembly . . . 3
1.3 Strategia sintetica nella chimica supramolecolare inorganica . . . . 8
1.3.1 Modello dell’interazione delle simmetrie . . . 8
1.3.2 Strategia delle Librerie Molecolari . . . 9
1.3.3 Strategia delle Librerie dei pannelli Molecolari . . . 11
1.4 Gli elicati e loro strategia sintetica . . . 12
1.5 Scopo della tesi . . . 16
2 Sintesi del Legante e calcolo QM . . . 19
2.1 Il gruppo funzionale salicilaldimminico . . . 21
2.2 Strategia di sintesi di una legante tris-saliciladimminico con simmetria C3 . . . 22
2.3 Sintesi del legante tris-saliciladimminico con simmetria C3 H3L . . 25
2.4 Calcoli quanto-meccanici . . . 29
2.5 Valutazione della struttura del legante H3L . . . 31
3 Equilibrio in soluzione tra complessi a diversa nuclearità . . . 33
3.1 Interconversione spontanea tra specie mononucleari e doppi elicati . . . 34
3.1.1 Complesso con ponte penta-metilenico . . . 34
3.1.2 Complesso con ponte otta-metilenico . . . 36
3.2 Studio dell’interconversione tra specie mononucleari e doppi elicati mediante calcoli quanto-meccanici . . . 38
3.2.1 Considerazioni preliminari . . . 38
3.2.2 Complesso con ponte penta-metilenico . . . 41
3.2.3 Complesso con ponte otta-metilenico . . . 44
3.2.4 Conclusioni . . . 48
Parte sperimentale . . . 50
CAPITOLO 1
INTRODUZIONE
1.1 La Chimica Supramolecolare
La Chimica Supramolecolare e’ un campo della scienza sempre più interdisciplinare che coinvolge proprietà chimiche, fisiche e biologiche di specie molecolari ad alto livello di complessità, costituite da molecole legate e organizzate tramite forze intermolecolari di diverso genere di tipo non-covalente. Le sue basi si estendono nelle procedure sintetiche di strutture molecolari della chimica organica, negli studi teorici e sperimentali dell’interazione della chimica-fisica, nei complessi ione mettallico-legante della chimica di coordinazione, nei processi biologici della biologia e nelle proprietà meccaniche dei solidi in scienze dei materiali.
Il concetto e il termine Chimica Supramolecolare venne introdotto da Lehn nel 19781
, come sviluppo e generalizzazione di precedenti lavori, e affermò che, proprio come esiste un campo della chimica molecolare basata sul legame covalente, esiste un campo della Chimica Supramolecolare basata sulla chimica delle molecole e del legame intermolecolare.
La chimica supramolecolare può essere in alternativa definita anche come la “chimica che sta al di sopra delle molecole” poiché tratta di entità organizzate ad elevata complessità derivanti dall’associazione di due o più specie chimiche tenute assieme da forze intermolecolari. In altre parole, possiamo affermare che le supramolecole stanno alle molecole e al legame intermolecolare come le molecole stanno agli atomi e al legame covalente2
.
Questa disciplina scientifica trova le sue radici in lavori come quello di Paul Ehrlich, nel quale egli riconobbe che le molecole non agiscono se non si legano (“Corpora non agunt nisi fixata”), e quello di E. Fischer3
, nel quale il concetto di legame selettivo e’ ben rappresentato dalla ormai famosa immagine di ‘chiave e serratura’ (“lock and key”) che descrive molto bene l’importanza della
complementarità geometrica, concetto base del processo di riconoscimento molecolare.
Comunque, anche se meccanismi di associazione molecolare erano stati riconosciuti e studiati da molto tempo, solo negli ultimi decenni hanno avuto una continua crescita. Questo principalmente perché una supramolecola, caratterizzata da alto grado di complessità ed elevata labilità, richiede solide basi sintetiche per la preparazione delle singole entità che la costituiscono e disponibilità di metodologie investigative molto accurate, per permettere di studiarne le sue proprietà strutturali, dinamiche e chimico-fisiche.
Le specie supramolecolari sono caratterizzate dall’arrangiamento spaziale dei suoi componenti molecolari e dei legami intermolecolari che le tengono unite assieme. Esse possiedono proprietà strutturali, conformazionale, termodinamiche, cinetiche e dinamiche ben definite. Le interazioni intermolecolari possono avere differenti gradi di forza, di direzionalità e angoli: legami di coordinazione di ioni metallici, legami ad idrogeno, interazioni di Van der Waals, interazioni di tipo elettrostatico, ecc. Quindi il loro intervallo di forza può variare da debole-moderata, come nel caso di legami ad idrogeno, a molto forte, come nel caso dei legami di coordinazione degli ioni metallici. Comunque, le forze intermolecolari sono, in generale, più deboli rispetto ai legami di tipo covalente, così avremo che una specie supramolecolare sarà termodinamicamente meno stabile, cineticamente più labile e dinamicamente più flessibile di una molecola tradizionale.
Di particolare interesse, tra i vari tipi di interazioni intermolecolari, sono quelle coordinative, realizzate impiegando leganti organici e ioni metallici, generando specie il cui campo di studio rientra nell’ambito della Chimica Supramolecolare
Inorganica. L’interesse che questa nuova aerea scientifica riscuote e’ giustificato
dal fatto che l’uso dei metalli di transizione permette di modulare diverse proprietà quale la forza di legame, gli angoli di legame, con valori non realizzabili con chimica del carbonio, la natura chimica e strutturale del centro metallico, variando lo stato di ossidazione, e la possibilità di fornire, alla supramolecola, proprietà fotochimiche, redox o introdurre elementi di chiralità. Inoltre, dobbiamo rimarcare l’importanza del legame coordinativo, tra le interazioni più forti tra quelle di tipo non-covalente, perché conferisce alla specie supramolecolare una stabilità cinetica e termodinamica confrontabile alle classiche strutture covalenti.
1.2 Self-Assembly
Il riconoscimento molecolare e’ stato definito come un processo che coinvolge il legame e la selezione di un substrato da parte di una molecola recettrice4. Questo
non e’ un semplice processo di interazione tra diverse molecole, ma e’ un modello di processo di riconoscimento che opera attraverso un insieme di interazioni intermolecolari strutturalmente ben definite e che genera una supramolecola caratterizzata da una propria stabilità e selettività (sia cinetica che termodinamica). Il riconoscimento molecolare implica una complementarità geometrica e connettiva tra le molecole coinvolte nel processo, meglio noto come principio della doppia complementarità. Quindi, in un processo di riconoscimento molecolare i fattori che determinano il processo stesso possono essere: sterici, connettivi, di area di contatto tra le unità coinvolte nel processo e dovuti alla presenza di siti capaci di instaurare interazioni intermolecolari multiple.
Il riconoscimento molecolare così richiede l’immagazzinamento e l’interpretazione delle informazioni molecolari, che devono essere ‘memorizzate’ nelle unità sotto forma di una sua particolare architettura (dimensione, forma, conformazione, chiralità e flessibilità) e di particolari siti leganti (proprietà elettroniche, dimensione, forma, numero e reattività).
È unanimemente accettato che il processo di riconoscimento, nel quale ha un ruolo chiave l’informazione molecolare, e’ alla base della chimica supramolecolare, tanto da considerare questa scienza come la scienza
dell’informazione chimica, o meglio, come l’informatica molecolare ed il
processo di costruzione di sintoni contenenti tali informazioni come la programmazione molecolare.
Sempre in linea con il parallelismo con le scienze dell’informazione, un processo di sintesi nel quale le interazioni selettive intermolecolari sono il risultato di una programmazione molecolare possiamo chiamarlo Sistema Supramolecolare
Programmato5. Tali sistemi permettono di creare e controllare processi chimici automatici, self-process, che in altro modo sarebbero difficilmente realizzabili; cioè possiamo considerare le istruzioni immagazzinate nei frammenti molecolari come degli strumenti che ci consentono di controllare il decorso della reazione. Il self-assembly di una supramolecola e’ il risultato di una spontanea associazione di un definito e limitato numero di unità molecolari regolata dalla idonea
compatibilità conformazionale e connettiva tra i diversi frammenti. Il passaggio chiave del processo e’ la formazione della connessione tra due building block che deve essere uno stadio reversibile e cineticamente labile, così da consentire un’esplorazione energetica dell’ipersuperficie del sistema con l’ottenimento del prodotto desiderato, a condizione che le informazioni chimiche fornite siano corrette. Ciò conferisce al metodo la proprietà di auto ripararsi o di correggere eventuali errori di assemblaggio, cosa impossibile in un processo con formazione di legami covalenti che non presentano una labilità cinetica; inoltre il processo genererà un prodotto che sarà il più stabile termodinamicamente tra i possibili con una resa complessiva quasi quantitativa e con alte velocità di formazione6
.
Nei frammenti covalenti possono essere immagazzinati tre differenti livelli di informazioni:
il riconoscimento molecolare, che porta alla formazione di legami selettivi tra componenti complementari;
l’orientamento, che permette la crescita attraverso il legame di componenti nella corretta disposizione relativa;
la terminazione, che richiede il segnale di stop per specificare che il processo è arrivato a completezza.
Attraverso queste informazioni avviene la costruzione di una suprastruttura con una successione di stadi che hanno la caratteristica di guidare la sequenza di aggiunta dei building block e di predisporre sempre il sistema per lo stadio successivo, cosi' da raggiungere un alto grado di complessità nella struttura finale. Questa strategia sintetica ha dimostrato di essere un valido strumento da utilizzare per la preparazione di architetture supramolecolari discrete, alternativo ad un’analoga via sintetica di tipo covalente. Questo perché l’ottenimento del prodotto desiderato procede attraverso il simultaneo assemblaggio di predeterminati building block in condizioni di equilibrio termodinamico, quindi il tutto risulta essere altamente convergente ed inoltre solitamente richiede un numero inferiore di passaggi rispetto ad equivalente sintesi covalente7
.
Tramite processi di self-assembly sono state sintetizzate svariate tipologie di strutture supramolecolari, quali elicati lineari e circolari8
, anelli interlacciati9
, gabbie molecolari10
e network mono, di e tri-dimensionali con interessanti tipologie di strutture11
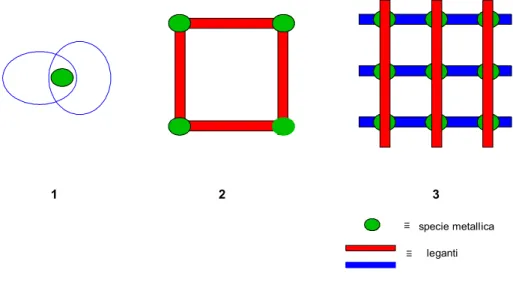
Figura 1.1 Esempio di catenato (1), box molecolare (2) e griglia molecolare (3)
Comunque, un processo di self-assembly non dipende solo dalla corretta scelta dei più adatti building block ma e’ necessario impostare anche le condizioni operative aggiustando altri fattori, quali natura del solvente12
, concentrazione13
, controioni14
e temperatura15
, che giocano un ruolo importante nella formazione del prodotto termodinamicamente o cineticamente favorito.
Un particolare interesse e' rivolto verso il self-Assembly di sistemi supramolecolare mediante metalli di transizione.
I primi studi su sistemi supramolecolari furono condotti su sistemi ciclici e policiclici ed in particolare, riguardarono la sintesi di leganti come eteri corona, criptandi, calixareni o di sistemi ciclici alifatici come i ciclofani. La possibilità di poter modellare in modo opportuno l’architettura del legante (numero di siti coordinanti, tipologia degli stessi e grandezza dell’anello ciclico) portò alla sintesi di sistemi capaci di coordinare in modo altamente specifico e selettivo opportune molecole o ioni metallici.
Figura 1.2 Esempio di ciclofano (1), calixarene (2), etere corona (3) e criptando (4)
O O O O O O NH NH HN N H O H OH OH O H 1 2 3 4 1 2 3 specie metallica leganti
Successivamente, la strategia di sintesi che ha previsto l’utilizzo dei metalli di transizione e dei legami di coordinazione16
nella formazione di strutture supramolecolari ha acquistato sempre maggior rilevanza ed è emersa come una alternativa concreta alla formazione di aggregati tramite legami a idrogeno, forze di Van der Waals e interazioni π-π.
Il self-assembly inorganico coinvolge la spontanea generazione di ben definite architetture metallo supramolecolari da leganti organici e ioni metallici. Ovviamente, la formazione di un qualunque composto di coordinazione da un legante organico ed uno ione metallico è un processo di assemblaggio che avviene spontaneamente, ma l'enfatizzazione17
che viene generalmente fatta riguarda il disegno del legante e la scelta dello ione metallico in modo da controllare l'architettura della supramolecola. Lo ione metallico ha la funzione di congiungere e fissare assieme le singole unità e di orientarle in una data direzione, oltre ad essere un componente attivo della struttura supramolecolare. Infatti, sia la geometria di coordinazione dello ione metallico che la propagazione delle informazioni steriche e di connessione immagazzinate nelle unità leganti regolano il processo di self-assembly18
. L'approccio sintetico che utilizza i metalli di transizione, presenta quindi alcuni vantaggi rispetto all’approccio classico covalente:
un vantaggio di tipo geometrico, in quanto i composti di coordinazione permettono l'introduzione nel sistema di angoli di legame difficilmente ottenibili nella chimica organica classica, in particolare angoli a 90°. A seconda della natura del metallo e del suo intorno coordinativo è possibile scegliere non solo la geometria del complesso (lineare, planare, tettraedrica, ottaedrica) ma anche il numero e la geometria dei siti labili da impegnare nella costruzione della supramolecola;
Geometrie di coordinazione modificabili, variando semplicemente lo stato d’ossidazione del metallo. Per esempio CuI
e’ tetraedrico mentre CuII
è planare quadrato;
nell'ambito delle interazioni non covalenti, i legami di coordinazione sono decisamenti i più forti: la forza di legame è intermedia fra i forti legami covalenti e le interazioni deboli nei sistemi biologici. Sistemi supramolecolari ottenuti in questo modo saranno quindi, in generale, sufficientemente stabili da poter essere isolati e trattati come una qualsiasi molecola discreta al
contrario di sistemi ottenuti, ad esempio, con legami ad idrogeno, che spesso risultano instabili in soluzione;
legami labili o inerti: Per esempio variando il centro metallico, come PtII
inerte e PdII
labile, o variando lo stato d’ossidazione, RuII
labile e RuIII
inerte; specie supramolecolari contenenti siti con proprietà redox, fotochimiche o
chirali.
I metalli di transizione possono essere impiegati come “ioni nudi”, oppure come ioni parzialmente protetti (composti di coordinazione o organometallici). Si preferisce impiegarli come ioni parzialmente protetti perché ciò ci consente un maggior controllo sulla geometria della specie supramolecolare con opportune scelte del numero e della disposizione dei siti labili sul centro metallico. E’ evidente, inoltre, che la presenza di leganti ancillari potrà essere determinante per introdurre nella supramolecola tutta una serie di proprietà altrimenti non accessibili agli ioni nudi (ad esempio centri chirali) o di modulare alcune caratteristi del metallo (ad esempio il potenziale redox). Comunque, la struttura finale della specie ottenuta con processo di self-assembly non dipende solamente dalla geometria di coordinazione del centro metallico, ma e’ imposta anche attraverso l’orientazione del sito coordinante di un dato legante7
.
Nei processi di self-assembly inorganici solitamente si ottiene un prodotto che risulta essere il più favorito termodinamicamente, in ogni caso sono stati identificati altri possibili processi di self-assembly19:
self-assembly irreversibile, costituito da un susseguirsi di passaggi irreversibili governati dalla cinetica.
self-assembly assistito, dove la presenza di un agente esterno evita la formazione di intermedi che porterebbe a prodotti non desiderati.
self-assembly guidato, il processo e’ assistito da una specie che permette la corretta costruzione della struttura finale.
self-assembly con modifica del precursore, nel quale il processo avvia solo quando la modifica al precursore e’ avvenuta.
self-assembly con modifica finale, il prodotto si ottiene solo quando avviene un ultimo stadio che, con un passaggio irreversibile, rende la struttura stabile cineticamente.
self-assembly intermittente, e’ un processo risultante dalla combinazione dei precenti.
Nell’ambito del self-assembly inorganico sono stati ottenuti sistemi supramolecolare con strutture di doppia o tripla elica20
che possono essere descritti parlando della loro struttura primaria, secondaria, ternaria e quaternaria; proprio come avviene in molti sistemi biologici.
Fino ad oggi, molti studi sono stati effettuati su specie molecolari con alta simmetria, ad esempio, poligoni bidimensionali quali macrocicli a geometria triangolare, quadrata, pentagonale o esagonale, e strutture tridimensionali quali tetraedriche, cubiche, esagonali, tipo diamante o dodecaedriche. Di particolare interesse sono le strutture supramolecolare con motivi geometrici quali nodi molecolari e catenanti21
, boxes molecolari22
, griglie molecolari ed altri ancora23
. Comunque, molta dell’attenzione si e’ rivolta verso la sintesi di specie supramolecolare con strutture a minor simmetria e di relativa semplicità, tipo rettangolari nel bidimensionale o gabbie prismatiche nel tridimensionale.
1.3 Strategia sintetica nella chimica supramolecolare
inorganica
La struttura e le proprietà di una specie supramolecolare sono il risultato delle informazioni contenute nei singoli componenti e dalle intrinseche caratteristiche delle diverse unità dovute alla presenza di particolari gruppi funzionali. La sua forma, nell’ambito supramolecolare inorganico, non dipende solamente dalla geometria coordinativa dello ione metallico ma anche dall’orientazione del sito coordinante del legante. Un semplice e generale concetto, per generare strutture ordinate, e’ basato sullo assemblaggio spontaneo derivato dal processo di riconoscimento tra sub-unità complementari.
Qui riportiamo alcune strategie sintetiche sviluppate per razionalizzare la progettazione di alcune tipologie di specie supramolecolare di particolare interesse.
1.3.1 Modello dell’interazione delle simmetrie
Questo modello strategico é stato largamente impiegato da Saalfrank24, Lehn25,
and Raymond26
macrociclici che contengono gruppi di diversa natura o metalli di transizione. Il metodo enfatizza l’importanza degli elementi di simmetria nella scelta di opportuni building block. Una delle strutture più semplici che possiamo immaginare può incorporare due centri metallici congiunti da due o più leganti, che generano un macrociclo o macropoliciclo rispettivamente, con struttura elicoidale se i leganti sono tutti identici. Volendo razionalizzare la progettazione di un elicato M2L3 con idealizzata simmetria D3, dovremo creare una struttura con
tre assi C2 disposti a 90° da un asse C3. Otteniamo ciò utilizzando tre leganti
identici bis(bidentati), che provvedono agli assi binari, e due centri metallici idonei a generare una coordinazione pseudo-ottaedrica con tre unità chelanti bidentate, che danno origine all’asse ternario. Quindi questi due differenti elementi di simmetria devo trovarsi a 90° l’uno dall’altro, condizione verificata in quanto l’asse ternario deve essere lo stesso per i due centri metallici, di conseguenza, i due piani di coordinazione devono essere disposti parallelamente, in quanto ortogonali agli assi ternari, imponendo ai leganti una disposizione con gli assi binari ortogonale all’asse ternario. Comunque questa strategia sintetica e’ molto utile nel sintetizzare tripli elicati e strutture tetraedriche.
1.3.2 Strategia delle Librerie Molecolari
Un altro modello strategico impiegato per disegnare strutture supramolecolari e’ il modello delle Librerie molecolari che fu inizialmente applicato da Verdake27,
successivamente elaborato da Fujita28
e infine perfezionato da Stang29
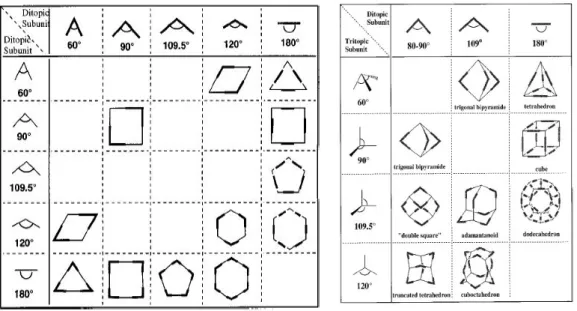
. A diffenza della ‘Symmetry interaction’, nella quale focalizziamo l’attenzione sugli elementi di simmetria, in questa strategia consideriamo che tipo di building block (leganti ditopici impiegati quali spigoli e tritopici quali vertici delle figure geometriche) e quanti di questi siano necessari per la costruzione di una voluta architettura supramolecolare.
In questa metodologia si utilizzano leganti poli-topici e ioni metallici, coordinativamente insaturi, che instaurano tra di loro legami dativi con alto grado di direzionalità. Le possibili strutture macrocicliche, bi- e tri-dimensionali, sono progettate scegliendo delle sub unità capaci di generare, con i centri metallici, angoli di legame compatibili con la struttura che ci proponiamo di ottenere. I frammenti molecolari impiegati sono di tipo lineari, con siti leganti disposti a
~180°, e angolari, dove i siti hanno angoli compresi tra 0° e 180°. Per esempio l’assemblaggio di una supramolecola quadrata può esse ottenuta o combinando quattro frammenti lineari ditopici con quattro a 90° sempre ditopici o, alternativamente, combinando due frammenti angolari a 90°. Nella fig.1.3 e' riportato uno schema di sintesi di due esempi utili per la costruzione di una struttura quadrata30
e di una esagonale31
.
Figura 1.3. Esempi di sintesi di una struttura quadrata e una esagonale.
Il maggior vantaggio di questa strategia e’ la sua capacità combinatoria: differenti combinazioni degli stessi building block, lineari e angolari, possono essere utilizzati per costruire svariate strutture poligonali o poliedriche. Nella figura 1.4 sono riassunte alcune possibili combinazioni.
Figura 1.4. Esempi di uso di librerie molecolari di poligoni molecolari bi e tri-dimensionali.
Da notare che in questa strategia, durante la fase di progettazione, si tiene conto degli angoli dei siti leganti, appartenenti ai singoli building block, liberi e che
questi vengono estrapolati nella struttura finale. Quindi si considera che la direzionalità dei building block rimanga invariata nella struttura prodotta dal self-assembly, attribuendo ai singoli frammenti un alto grado di rigidità conformazionale; anche se nella realtà delle distorsioni di diversa entità sono essere osservate, ma solitamente ignora per il loro piccolo grado32
.
1.3.3 Strategia delle Librerie dei pannelli Molecolari
Questo metodo e’ stato messo a punto da Fujita33
e, a differenza dei due precedenti che richiedono building block utilizzati come vertici o spigoli nella costruzione della struttura supramolecolare, impiega frammenti organici molecolari bi-dimensionali planari che, congiunti da legami di coordinazione con ioni metallici, generano la struttura tri-dimensionale finale. I frammenti sono usati come se fossero dei pannelli e generano comunemente strutture poligonali regolari con spigoli e vertici tutti equivalenti. Così sono stati costruiti alcuni frammenti organici, da utilizzare come pannelli (vedi figura), che in presenza di complesso di Pd(II) o Pt(II), con posizioni in cis protette con en, generano una specie supramolecolare, un ottaedro e un nanotubo34
.
Variando i building block si potranno realizzare strutture con cavità molto larghe, che potenzialmente rappresentano uno spazio da impiegare per processi di riconoscimento molecolare o di catalisi.
1.4 Gli elicati e loro strategia sintetica
Il termine elicato, introdotto da Lehn17
, è derivato dalla parola elica (da greco ελιξ = avvolgimento, spirale) con il suffisso –ato, che caratterizza i complessi host-guest tra recettori (pre)organizzati e ioni metallici, come i coronati (complessi macrociclici di metalli alcalini o alcalino terrosi) o criptati (complessi macropoliciclici con uno o più ioni metallici).
Un elicato è un specie supramolecolare costituita da uno o più leganti organici avvolti ad elica e coordinati ad una serie di ioni metallici che definiscono l'asse dell'elica. La principale proprietà di questa classe di composti è la chiralità associata alla forma elicoidale della molecola35
(Figura 1.5), che è appropriatamente descritta dal senso della rotazione dei leganti intorno all'asse definito dai centri metallici, e può essere destra (plus, P) o sinistra (minus, M) se il senso di rotazione è orario o antiorario.
unità chelanti
centro metallico
Figura 1.5 Rappresentazioni di un elicato
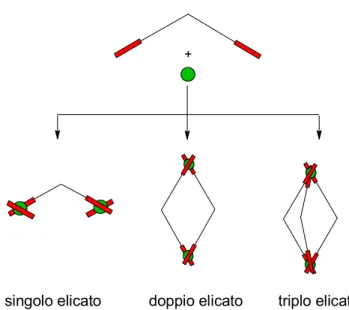
Gli elicati vengono generati dall'assemblaggio di leganti polidentati e ioni metallici e sono completamente caratterizzati da tre termini (Figura 1.6):
1) il numero di leganti coordinati intorno al centro metallico: mono-, doppi-, tripli-elicati;
2) presenza di leganti ancillari coordinati al centro metallico (insaturi se presenti, saturi se assenti);
3) la natura del legante: omotopici se hanno le sub-unità coordinanti uguali,
+
singolo elicato doppio elicato triplo elicato
Figura 1.6. Definizione di un elicato in base al numero di leganti coordinati
I primi studi su processi di self-assembly furono compiuti su leganti contenenti gruppi ripetuti di 2-2’ bipiridina che, in presenza di ioni Cu(I), davano origine al processo di self-assembly generando un elicato nel quale i due leganti si intrecciano in una struttura a doppia elica e sono congiunti dagli ioni metallici17
. Di questa classe di composti sono molto studiate le proprietà meccanicistiche e strutturali, necessarie per un loro prossimo impiego per future applicazioni, come reattivi nelle sintesi organiche o come sintoni utili per preparare composti che altrimenti sarebbe di difficile sintesi (come ad esempio la preparazione di catenati36
).
Nell’esempio su riportato, la doppia elica e’ il prodotto preferenziale risultante da un corretto processo di riconoscimento, che possiamo identificare nella compatibile coordinazione tetraedrica Cu(bipy), e un’idonea programmazione molecolare del legante, tale da sfavorire una struttura contenente una sola molecola di legante. Il doppio elicato così costruito può essere considerato come un analogo inorganico degli acidi nucleici, dove i filari che formano la doppia elica e le congiunzioni realizzate da legami coordinativi si sostituiscono rispettivamente alla sequenza polinucleotidica e ai legami ad idrogeno.
Come già detto, la principale proprietà di questa classe di composti è la chiralità associata alla forma elicoidale della molecola. L’informazione chirale che impone una determinata struttura elicoidale molto spesso e’ contenuta nella preferenziale
geometria di coordinazione dello ione metallico37
. Inoltre, se utilizziamo un legante organico achirale, otteniamo una miscela racema di destro e sinistro elicato; quindi se vogliamo indurre una discriminazione tra le due possibili enantiomeri elicoidali dobbiamo impiegare del legante otticamente attivo un solo enantiomero17
.
La formazione di un elicato dipende dalla natura del centro metallico e del legante, e, in alcuni casi, anche da informazioni addizionali quali condizioni di reazione e effetti templanti. Gli ioni metallici ideali per formare una struttura a doppia e tripla elica sono quelli che si coordinano tetraedricamente e ottaedricamente, rispettivamente con leganti bidentati38
. Con leganti tridentati, gli elicati doppi o tripli elicati, possono essere generati con metalli che presentano coordinazione pseudo-ottaedrica e prismatica triangolare tricappata, rispettivamente. Seguendo i principi su enunciati sono stati approntati una grande varietà di leganti organici atti ad assemblarsi in un struttura elicoidale, contenti funzionalità chelanti (bis o tri dentate) ripetute con regolarità, idonee a coordinare gli ioni metallici con geometrie compatibili con le strutture desiderate. Giocano un ruolo predominante sistemi contenenti atomi di azoto, quali bi-Py, ter-Py, immine, benzimidazoli, etc dove l’atomo di azoto con un’ibridizzazione sp2 e' inserito in un intorno aromatico o altra situazione insatura che lo rende un eccellente elettron-donatore39
. Ad esempio, oltre alla tris bi-piridina gia descritto in precedenza, riporto alcuni esempi (vedi figura) come la bis ter-piridina con
spaziatore etilenico, che con ioni ferro(II) genera un doppio elicato dinucleare40
, o la bis piridin-immina con spaziatore metilenico o atomo di ossigeno, che genera con nichel e cobaldo strutture a tripla elica41
. Comunque anche leganti aventi sistemi coordinanti di natura ossigenata sono molto impiegati, essi sono costituiti principalmente da derivati 1,3 carbonilici, acetilacetone, e o-catecoli. In figura possiamo vedere alcuni esempi di tali leganti quali il simmetrico bis(β-dichetone) con spaziatore m-fenilene, che con metalli quali Titanio(III) o ferro (III) genera
un triplo elicato, o il bis(dicatecolo) con spaziatore etilenico, che con metalli quale Titanio (II) genera un triplo elicato che ha la particolarità d’incapsulare all’interno della sua struttura un controione (sodio(I), a destra nella figura). E
inoltre sono stati approntati leganti di natura mista, azoto/ossigeno, sia come combinazione di siti coordinati, tipo quelli precedentemente descritti, che di siti contenenti entrambi gli elementi, quali idrossichinoline, catecol/immine, o-benzaldeide immine e così via.
Se il legante ha una natura eterotopica, con una sequenza di unità leganti elettronicamente differenti ma con geometria coordinante similare, noi possiamo controllare l’orientazione mediante la scelta di un opportuno ione metallico o miscela di ioni. Infatti l’impiego di un solo tipo di ione metallico porta ad una struttura antiparallela, con disposizione dei leganti testa-coda e coda-testa, mentre l’impiego di una coppia di ioni metallici nel rapporto 1:1 porta ad una struttura parallela, con disposizione testa-testa e coda-coda. Evidenza di ciò è il catecolo/ammino-fenolo, mostrato in figura, che in presenza di uno solo ione
metallico (gallio(III) o Titanio(IV)) forma un elicato con disposizione antiparallela e in presenza di un rapporto 1:1 dei due metalli genera una struttura con disposizione parallela42
.
Altro fattore importante nella formazione di un elicato e’ quello della natura dello spaziatore; infatti quando sono di tipo alchilico con numero dispari di metileni, il prodotto finale ha una struttura tipo meso, con numero pari si genera un elicato chirale. Comportamento motivato dalla conformazione della catena alchilica che
assume una disposizione a zig-zag, conservata nel prodotto finale, contenente un piano di riflessione per numero di metileni dispari e un asse C2 per numero pari. Spaziatori di altra natura e con altre proprietà di flessibilità sono determinanti nella struttura finale preorganizzando il legante alla disposizione elicoidale e determinando anche la dimensione dell’elicato stesso.
1.5 Scopo della tesi
In questa tesi ci siamo occupati di sintetizzare un legante tris-salicilaldimminico avente una simmetria di tipo pseudo-C3 e, viste le difficoltà incontrate nell’ottenere dei complessi metallici che risultassero caratterizzabili, il lavoro e' proseguito con uno studio teorico sulle conformazioni di questo nuovo legante, finalizzato alla comprensione della possibilità di ottenere delle strutture supramolecolari ben definite. Inoltre, al lavoro computazionale sul legante libero abbiamo affiancato lo studio teorico, partendo dai dati sperimentali ricavati da precedenti lavori di Isola e coll., sulla spontanea interconversione in soluzione di complessi dinucleari a doppia elica in specie mononucleari.
Il lavoro di questa tesi trae spunto dalla valutazione che a fronte di una vasta letteratura sullo studio di complessi salicilaldimminici di metalli di transizione43
, e delle loro applicazioni nel campo della catalisi44
e come materiali ottici non lineari45
, solo pochi lavori sono riportati sull'utilizzo di tale unità legante nella chimica metallo-supramolecolare.
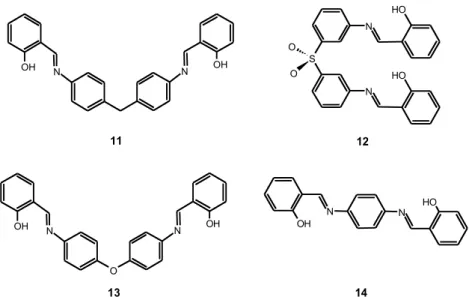
Yoshida e coll. hanno utilizzato: il legante 11 per la preparazione di un complesso dinucleare a doppia elica con il ZnII 46, 12 per la preparazione di un
complesso tetranucleare a doppia elica con il CuII 47
e 13 per la preparazione di un complesso dinucleare a doppia elica con il CuII 48. Il legante 14 è stato utilizzato da
McNeils per la preparazione di un metallociclofano dinucleare del CuII
N N OH OH 11 12 S O O N N O H O H N OH N O H 13 N O N OH OH 14
Figura 1.15. Leganti bis-salicilaldimminici utilizzati in processi di assemblaggio
Dal punto di vista strutturale, i leganti salicilaldimminici utilizzati nella costruzione di strutture supramolecolari, è stata caratterizzata, come evidenziato in Figura 1.15, da un ponte spaziatore che unisce le unità chelanti attraverso l’azoto imminico. Questa soluzione sintetica, che certamente presenta dei vantaggi pratici, riduce sostanzialmente la possibilità di modifiche strutturali al legante rispetto a quella che utilizza altri punti di aggancio per il ponte spaziatore. Di recente, Isola e coll. hanno utilizzato un differente approccio nella sintesi di leganti bis-salicilaldimminici saldando le due unità le unità chelanti ad un ponte spaziatore attraverso un legame etereo nella posizione 3 dell’anello aromatico (Figura 1.16).
Figura 1.16. Leganti bis-salicilaldimminici preparati da Isola e coll.
Infatti in tal modo è stato possibile modificare separatamente le caratteristiche del ponte (lunghezza e flessibiltà) e la natura del sostituente sull’azoto imminico.
Quest’ultima possibilità presentava particolare interesse in quanto è noto che l’ingombro sterico del gruppo R sull’azoto imminico nei complessi bis-chelati del NiII
e CuII
, del tipo mostrato in Figura 1.17, condiziona pesantemente la geometria di coordinazione dello ione metallico.
Figura 1.17. Complessi bis-salicilaldimminici di metalli di transizione
I risultati ottenuti dagli studi effettuati sui complessi del NiII
hanno mostrato che nel caso delle specie metalliche derivate da leganti contenenti ponti polimetilenici, la complessità strutturale dipende sensibilmente dalla lunghezza dello spaziatore: in presenza di poche unità metileneniche le specie hanno tendenza ad assumere strutture ad alta nuclearità; l’allungamento progressivo del ponte favorisce la formazione di specie a bassa nuclearità, fino all’ottenimento esclusivo di una specie mononucleare quando il ponte è costituito da una unità dodecametilenica. I leganti contenenti gli spaziatori penta-, esa- e otta-metilenico, di lunghezza intermedia tra quelli esaminati, si comportano coerentemente con la posizione che occupano nella serie, mostrando di poter dar vita ad una specie dinucleare a doppia elica, allo stato solido, e ad una mononucleare, tra loro in equilibrio in soluzione50
.
Quindi, per il lavoro realtivo alla seconda parte, quello riguardante i complessi inerenti la spontanea interconversione in soluzione dei complessi salicilaldimminici, che risultano essere i primi esempi presenti in letteratura di equilibri d'interconversioni a diversa nuclearità e con la presenza di una inusuale struttura a doppia elica, come composti da sottoporre allo studio sono stati scelti il complesso di nichel(II) contenente un ponte penta-metilenico e il complesso del nichel(II) contenente un ponte otta-metilenico
O N R O N R M
Capitolo 2
Sintesi del Legante e calcolo QM
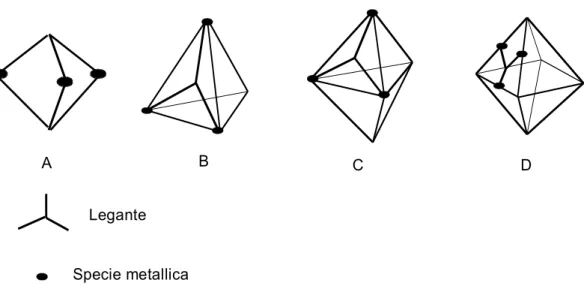
Come già riportato nel paragrafo 1.5, un parte della tesi è stata dedicata alla messa a punto di una metodologia di sintesi di leganti contenenti tre unità chelanti di tipo salicilaldimminico e lo studio della coordinazione nei confronti del Ni(II). Da sottolineare un particolare l’interesse verso la sintesi di leganti tris-bidentati aventi una simmetria C3 . Da un punto prettamente strutturale, le caratteristiche geometriche di questa classe di leganti permettono la costruzione di complessi multinucleari aventi strutture poliedriche più o meno complesse, come riportato negli esempi della seguente figura:
Legante Specie metallica
A B C D
Figura 2.1. Rappresentazione di strutture complesse da leganti con simmetria C3 e specie
metalliche: A, capsula molecolare; B, tetraedro molecolare; C, esaedro molecolare, D, ottaedro molecolare.
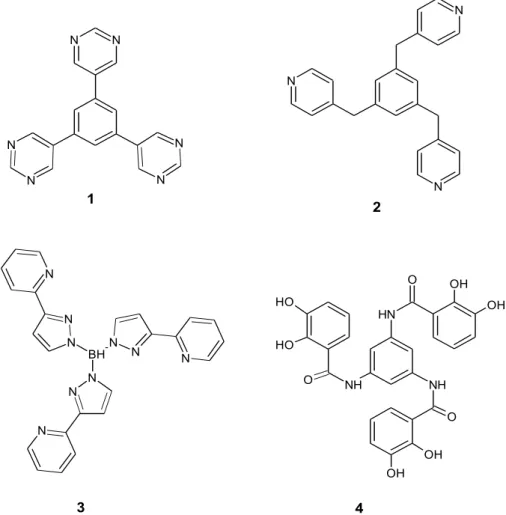
N N N N H NH NH O O O OH OH OH OH O H O H BH -N N N N N N N N N 1 2 3 4 N N N N N N
Figura 2.2. Esempi di leganti aventi simmetria C3 .
Il legante 1 è stato utilizzato da Fujita e coll.51
per preparare un complesso con struttura molecolare esaedrica (trigonale-piramidale) con il Pd, avente la formula [(1)6{(en)Pd}18]36+. La struttura del complesso metallico formato da quattro leganti 2 e sei gruppi trans-PdCl2, di formula [(2)4(PdCl2)6] è stata descritta come un
tetraedro52
. I leganti 353 e 454
formano invece, rispettivamente con ioni Mn2+
e Ti(IV), dei complessi tetranucleari con struttura tetraedrica e formula [(3)4Mn4]4+ e
[(4)4Ti4]8+.
Come si evince dagli esempi riportati in figura 2.1, una caratteristica geometrica importante di tale classe di leganti è la presenza di un nucleo centrale rigido che porta le tre unità leganti, posti in posizione terminale, a predisporsi spazialmente in direzioni differenti. Tale tipo di disposizione, favorisce la coordinazione delle tre unità leganti a tre diversi centri metallici, generando strutture tridimensionali complesse.
Da sottolineare che i classici leganti tripodalici (per esempi vedere Cotton-Wilkinson) come ad esempio quello riportato in figura 2.3, aventi una simmetria
C3 e utilizzati per coordinare singoli centro metallici, non sono ovviamente idonei a formare strutture molecolari come quelle riportate in figura 2.1.
N NH N H NH C H3 CH3 CH3 O O O 5
Figura 2.3. Esempio di legante C3 di tipo tripodalico.
2.1 Il gruppo funzionale salicilaldimminico
Il gruppo saliciladimminico e’ il derivato imminico della funzionalità salicilaldeidica e rientra nella famiglia delle basi di Schiff. Questi composti, sintetizzati nella seconda metà del 180055
, furono oggetto di studio per le loro potenzialità coordinative nei confronti di diversi metalli di transizione56
. Le particolari caratteristiche stereoelettroniche delle immine saliciliche permettono, un volta deprotonate, di comportarsi da legante bidentato costituito nelle posizioni 1 e 5 da due atomi elettronegativi, uno di N e l’altro di O, che hanno buone capacità coordinanti: H N O R N O -R
Figura 2.4. Salicilaldimmina e sua forma deprotonata
Come evidenziato in fig. 2.4, nella saliciladimmine è attivo un legame ad idrogeno intramolecolare, vista la presenza contemporanea e geometricamente favorevole, tra l’azoto imminico e l’ossidrile in posizione 2.
Il “dente” salicilaldimminico, facilmente ottenibile dalla reazione tra la salicilaldeide ed un ammina primaria, la natura del sostituente R sull’azoto
salicilaldimminico ed il centro metallico, coinvolto nel legame, permettono di modulare le caratteristiche fisiche-chimiche dei complessi risultanti e, quindi, di avere a disposizione una vasta serie di strutture idonee per lo studio di fenomeni fisici e chimici di particolare interesse.
Infatti, importanti processi biochimici coinvolgono la funzionalità imminiche, mentre nel campo della sintesi organica sono oggetto di ricerche indirizzate ad esaltarne le qualità di catalizzatori. Anche nel campo della chimica analitica i leganti trovano impiego come estrattori in fase liquida di ioni metallici. Sulle caratteristiche chimico–fisiche del gruppo azometinico C=N, anche se in letteratura meno studiato rispetto al gruppo carbonilico, possiamo dire :
la lunghezza del legame C=N varia intorno al valore di 1.29-1.31 A° e risulta poco variabile con l’eventuale coniugazione
il momento dipolare di ca. 0.9 D è approssimativamente la metà di quello del carbonile, indice di una minore polarizzazione
la frequenza di stretching associata al doppio legame C=N cade tra 1660 e 1670 cm-1 nelle immine alifatiche, tra 1655 e 1630 cm-1 in quelle aromatiche, e si abbassa all’aumentare della coniugazione. Nel passaggio da salicilaldeide a immina e infine a complesso,si ha generalmente un abbassamento progressivo della frequenza v c=y (Y= O,N). Al contrario, passando da basi libere a ioni imminio (raggrupamento >C=N+<), la frequenza di stretching associata al doppio legame aumenta, in accordo con i calcoli teorici.
Nelle salicilaldeidi, così come nelle rispettive basi di Schiff, c’è l’esistenza di un legame ad idrogeno intramolecolare, vista la presenza contemporanea e geometricamente favorevole del gruppo azometinico e dell’ossidrile in posizione 2.
2.2 Strategia di sintesi di una legante tris-saliciladimminico
con simmetria C
3Come osservato precedentemente, la strategia di sintesi di leganti con simmetria C3 prevede la presenza di una nucleo strutturalmente rigido. Partendo da questo
principio, è stato individuata l’unità trifenilmetilica (figura 2.5) come possibile candidata di nucleo avente le caratteristiche di simmetria e rigidità idonee.
Figura 2.5. Struttura del (trifenil)metano
Appare evidente che la struttura riportata in figura 3.4 non risulta idonea all’accoppiamento a strutture saliciladimminiche o precursori salicilaldeidiche (facilmente trasformabili in saliciladimmine mediante reazione con ammine primarie). A tal fine è stato quindi utilizzato il metodo di sintesi messo a punto da Isola e coll.57
i quali hanno accoppiato ponti xilenici con unità idrossi-saliciladeidiche mediante l’utilizzo di sintoni α-dibromo-xilenici.
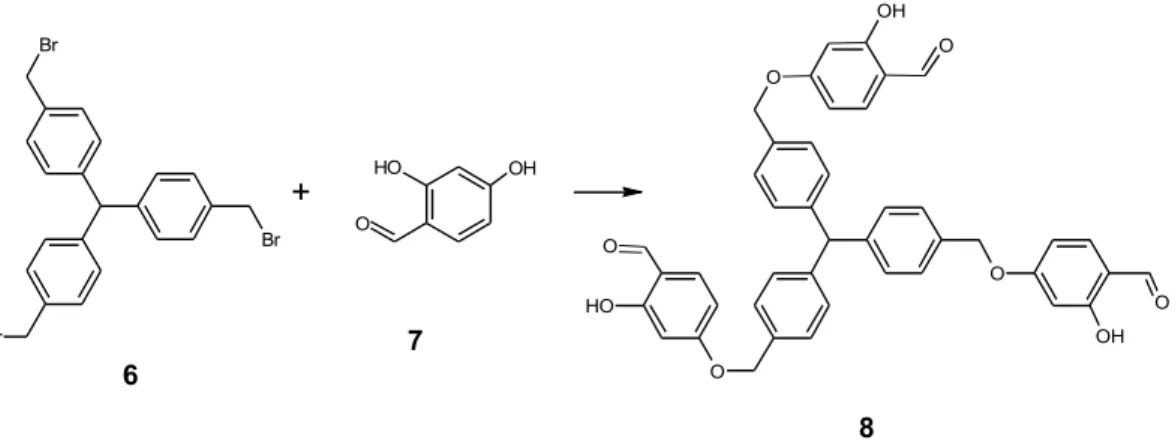
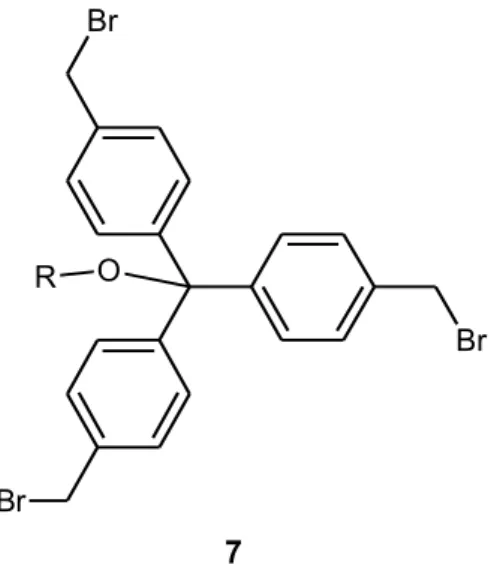
In base a tali considerazioni, una prima strategia di sintesi ipotizzata ha previsto l’utilizzo di un’unità tris(p-bromo-tolil)metano e la 4-idrossi-saliciladeide (figura 2.6). Br Br Br O H O OH O O O OH O H OH O O O + 6 7 8
Figura 2.6. Ipotesi di sintesi di legante tris-saliciladimminico con simmetria C3
Un analisi della letteratura ha escluso la possibilità di poter utilizzare il tris(p-bromo-tolil)metano 6, non noto, ed un’eventuale sua sintesi risultava alquanto difficoltosa.
L’analisi della letteratura ha comunque permesso di pianificare la sintesi di una molecola simile al tris(p-bromo-tolil)metano ma avente una funzionalità eterea sul carbonio centrale (figura 2.7).
Br Br Br O R 7
Figura 2.7. Intermedio per la sintesi del legante tris-saliciladimminico con simmetria C3
Il lavoro di progettazione, effettuato in base alle informazioni reperite in letteratura, ha permesso quindi di ipotizzare la seguente strategia sintetica del legante H3L (Figura 2.8): Br Br Br O R 7 CH3 Br O O O OH O H OH N N N R R R O Et H2L
2.3 Sintesi del legante tris-saliciladimminico con simmetria
C
3H
3L
Un primo schema utilizzato nella sintesi del legante H3L è stato il seguente:
O O O OH O H OH N N N R R R O Et H3L CH3 Br 1) Mg, Et2O 2) Et2CO, 1 h D C H3 C H3 CH3 O H 1) HCl, benzene 2) NaOEt, EtOH C H3 C H3 CH3 EtO NBS, CCl4 2 h D EtO Br Br Br 1) KI, KHCO3, ACN, 15 h D
OH OH O 2) NH2R, EtOH, 2 h D 8 9 10
Figura 2.9. Schema di sintesi del legante tris-saliciladimminico H3L
L’intermedio 8 è noto in letteratura58
. La sua sintesi viene effettuata mediante reazione di un equivalente di carbonato dietilico con 3 equivalenti del reattivo di Grignard del 4-bromotoluene.
La successiva reazione di 8 con HCl gassoso anidro, generato dalla reazione tra NaCl ed H2SO4 concentrato ed anidrificato mediante passaggio in una colonna di
CaCl2 anidro, in benzene, anch’esso anidro, porta con rese quasi quantitative alla
formazione del derivato clorurato di 8.
Il cloro derivato di 8 viene fatto successivamente reagire con NaOEt in etanolo ottenendo, dopo purificazione, 9.
Lo spettro 1
1.5 1.5 2.0 2.0 2.5 2.5 3.0 3.0 3.5 3.5 4.0 4.0 4.5 4.5 5.0 5.0 5.5 5.5 6.0 6.0 6.5 6.5 7.0 7.0 7.5 7.5 1.0 0.9 0.3 1.3 0.5 Figura 2.10. Spettro 1 H-NMR dell’etil-tris(p-tolil)metil etere 9 Dallo spettro 1
H-NMR di figura 3.9 si possono notare i segnali del gruppo etilico presente con un terzetto a 1.3 ppm (CH3 terminale) e con un quartetto a 3.2 ppm
(O-CH2). I gruppi metilici presentano un singoletto a 2.4 ppm mentre a 7.2 e 7.4
ppm sono presenti i due doppietti degli idrogeni arilici.
La sintesi dell’etil-tris(p-tolil)metil etere 9 è stata successivamente semplificata e migliorata, diminuendo il numero delle reazioni e di conseguenza il numero delle operazioni di purificazione.
Com’è noto59
l’alcol trifenilmetilico da origine, in opportuni condizioni, ad un carbocatione molto stabile denominato tritile (figura 2.11).
C+
Figura 2.11. Carbocatione tritilico
Partendo da questa dato, si è allora cercato di ottenere l’etil-tris(p-tolil)metil etere
9 direttamente dopo reazione tra il carbonato dietilico e il reattivo di Grignard del
p-bromotoluene. Infatti, il prodotto di questa reazione, isolato mediante estrazione (vedere parte sperimentale) non è stato ulteriormente purificato (si utilizzava generalmente la cromatografia su gel di silice con CHCl3 come eluente) ma è stato
posto in etanolo ed addizionato di alcune gocce di H2SO4. Dopo una notte si sono
l’etil-tris(p-tolil)metil etere 9. Dalle acque madri è stato possibile recuperare altro prodotto mediante concentrazione. Tale tipo di procedura semplifica notevolmente la preparazione facendo aumentare notevolmente le rese della reazione.
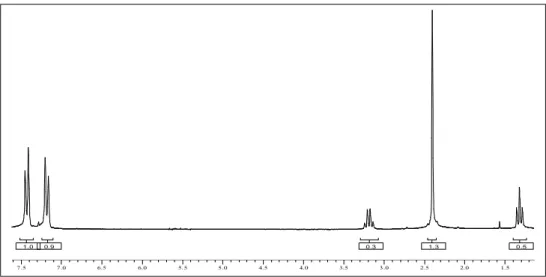
L’etil-tris(p-tolil)metil etere è stato quindi bromurato nella posizione α dei gruppi metilici utilizzando l’N-bromosuccinimmde in CCl460. Il prodotto ottenuto dopo
purificazione presentava il seguente spettro 1
H-NMR: 1.0 1.0 1.5 1.5 2.0 2.0 2.5 2.5 3.0 3.0 3.5 3.5 4.0 4.0 4.5 4.5 5.0 5.0 5.5 5.5 6.0 6.0 6.5 6.5 7.0 7.0 7.5 7.5 0.2 0.1 0.5 1.0 Figura 2.12. Spettro 1 H-NMR dell’etil-tris(α-bromo-p-tolil)metil etere 10 Dallo spettro 1
H-NMR si può notare come il segnale del metile, posto in figura 2.12 a 2.4 ppm, sia scomparso, mentre è comparso un segnale a 4.5 ppm che è assegnabile agli idrogeni del gruppo CH2Br. Risultano anche spostati i segnali di
dei due idrogeni in orto al gruppo metilico, che si trovano a circa 7.4 ppm, cioè a campi più bassi rispetto a quanto si trovano gli stessi idrogeni nella molecola 9. Quest’ultima osservazione conferma la sostituzione di un idrogeno del gruppo metilico con un atomo più elettronegativo come il bromo. Da notare comunque che nello spettro sono presenti due segnali di bassa intensità a 2.4 e 6.7 ppm rispettivamente. Tali impurezze sono da assegnare a due differenti strutture: la prima ad un gruppo toluenico non reagito; la seconda ad un gruppo α-α -dibromo-toluenico, cioè ad un toluene su cui si è avuta una doppia sostituzione di idrogeno con bromo. Comunque, data la piccola quantità di queste impurezze (< 3 %, come evidenziato dal rapporto degli integrali nello spettro 1
H-NMR), il prodotto non è stato ulteriormente purificato.
La reazione tra l’etil-tris(α-bromo-p-tolil)metil etere e la 2,4-diidrossibenzaldeide è stata effettuata mediante una metodologia nota in letteratura61
, utilizzando KHCO3 come base, KI come catalizzatore e l’acetonitrile come solvente.
Lo spettro 1
H-NMR ottenuto dopo purificazione, è riportato nella seguente figura.
1 1 2 2 3 3 4 4 5 5 6 6 7 7 8 8 9 9 10 10 11 11 1 2 1 2
Figura 2.13. Spettro 1H-NMR del prodotto di accoppiamento tra la 2,4-diidrossibenzaldeide e 9
Lo spettro 1
H-NMR evidenzia la presenza del gruppo etilico con segnali a 1.3 e 3.1 ppm circa, dei gruppi O-CH2 con un singoletto a 5 ppm circa. Tra 6.6 ppm e
7.8 ppm circa sono presenti i segnali dei gruppi arilici. In particolare, il singoletto a 6.6 ppm ed il doppietto a 6.8 ppm sono assegnabili all’anello arilico della 2,4-diidrossi-benzaaldeide. A 9.8 ppm è presente il segnale dell’aldeide mentre a 11.6 ppm quello dell’ossidrile in orto rispetto alla funzionalità aldeidica. Il segnale a 1.5 ppm circa è da assegnare all’acqua presente nel CDCl3 (come è stato verificato
facendo uno spettro del solvente deuderato), mentre risultano presente dei segnali, che non è stato possibile quantificare data la piccola intensità di questi dovute ad impurezze presenti dopo purificazione.
L’aldeide ottenuta è stata trasformata direttamente in complesso del nichel(II) mediante un metodo ben noto62
facendo reagire direttamente, in solvente alcolico, l’aldeide, un sale di nichel(II) e l’ammina primaria scelta.
La complessazione è stata quindi effettuata in etanolo utilizzando 2 equivalenti di aldeide, 3 equivalenti di Ni(OAc)2.4H2O e 10 equivalenti di n-propilammina
(l’eccesso di ammina è necessario per garantire le condizioni basiche per la formazione dell’immina e per la successiva coordinazione con il nichel(II)) facendo rifluire per circa 1 ora.
Il prodotto verde che si separa dalla soluzione ha mostrato nello spettro IR, un segnale a 1614 cm-1
, tipico degli stretching C=N di tipo saliciladimminico complessati con ioni Ni(II)63
punto di fusione maggiore di 350 °C.
Tale prodotto è risultato comunque insolubile nei comuni solventi organici per cui non è stato possibile indagare la sua struttura. Sono state effettuate altri tentativi di preparazione del complesso variando la quantità di ammina aggiunta e l’ordine delle aggiunte dei singoli reattivi. I prodotti ottenuti nei vari tentativi risultavano
avere uguali caratteristiche nello spettro infrarosso ma risultavano tutti insolubili nei comuni solventi organici.
La caratteristica d’insolubiltà del complesso del Ni(II) è stata attribuita alla formazione di specie oligomeriche tra metallo e legante64
. Con tali caratteristiche è stato risultato alquanto impossibile effettuare uno studio strutturale del complesso.
In base ai risultati ottenuti è stato quindi deciso di effettuare uno studio teorico per vedere quali fossero le conformazioni più stabili del legante H3L e come queste
potevano coordinare lo ione Ni(II).
I risultati e le metodologie di questo studio sono presentati nei successivi paragrafi.
2.4 Calcoli quanto-meccanici
In questo elaborato di tesi l'uso di tecniche computazionali di quanto-meccanico (QM) è rivolto principalmente alla determinazione delle geometrie di equilibrio delle strutture molecolari di interesse, al fine di effettuare un'analisi energetica della stabilità relativa dei sistemi molecolari.
Lo studio QM dei sistemi molecolari di nostro interesse, è stato realizzato mediante l'impiego dei metodi Density Functional Theory (DFT). I metodi DFT vengono in genere considerati metodi ab-initio ma in realtà al loro interno contengono dei funzionali parametrizzati, impiegati nella descrizione della correlazione elettronica, per la quale non sono note le forme esatte.
Il vantaggio offerto dai metodi DFT deriva dalla possibilità di ottenere risultati con una richiesta di risorse di calcolo paragonabile a quella dei più semplici metodi ab-initio, tipo Hartree-Fock (HF), ma con una maggiore accuratezza, paragonabile a quella ottenuta con livelli di calcolo più elevati e decisamente più onerosi.
I metodi DFT sono basati sui teoremi di Hohenberg e Kohn (HK) i quali dimostrano che l'energia elettronica dello stato fondamentale di una sistema multielettronico e tutte le altre proprietà elettroniche sono completamente determinate dalla funzione densità elettronica. In altre parole esiste una corrispondenza univoca tra la densità elettronica di un sistema e la sua energia. All’interno dell’approccio DFT, la scelta è ricaduta sul funzionale ibrido,
M06-2X65
, sviluppato nel 2007 dal team di Truhlar e collaboratori. Tale funzionale contiene una dipendenza dalla densità elettronica, dal suo gradiente e dalla densità di energia cinetica.
Nella teoria DFT di Kohn-Sham la densità elettronica viene espressa in termini di orbitali di KS (φKS) che, nel processo iterativo di risoluzione del problema elettronico, vengono espansi su un insieme di funzioni di base secondo lo schema Linear Combination of Atomic Orbitals (LCAO). Oltre al funzionale, è necessario quindi scegliere un set di funzioni di base ovvero una rappresentazione matematica degli orbitali KS, in modo analogo a quanto avviene per l’espansione degli orbitali molecolari nei metodi tipo HF.
Gli orbitali atomici hanno una dipendenza, rispetto alla distanza r dei nuclei, di tipo e−r
. L’integrazione di tali funzioni, nel calcolo delle interazioni elettrone-elettrone, risulta numericamente complessa ma il problema può essere risolto sostituendo queste ultime con delle funzioni Gaussiane di forma e−r2
di cui `e nota la soluzione analitica degli integrali. Combinando funzioni Gaussiane diverse, pesate con opportuni coefficienti, si cerca la migliore approssimazione della reale funzione d’onda atomica. La scelta della base è dettata sia dal tipo di sistema in esame sia dalle proprietà che si vogliono calcolare, senza dimenticare che il costo computazionale cresce in modo non lineare all’aumentare delle dimensioni della base stessa.
In particolare, il set di base gaussiano impiegato nei calcoli di ottimizzazioni di geometria è di tipo 6-311G(d). Si tratta di un set di base denominato “split-valence” in quanto gli orbitali interni sono rappresentati da un singolo set di funzioni mentre quelli di valenza sono suddivisi in tre set costituiti rispettivamente da tre, una e una Gaussiane. La denominazione d aggiunge delle funzioni di polarizzazione per gli atomi diversi da H.
Per l’atomo di Nichel è stato invece utilizzato un approccio diverso in termini di “Effective core potentials” (ECPs) del tipo LANL2DZ66
. Gli ECP rappresentano un metodo approssimato per rimpiazzare gli elettroni di “core” con un potenziale efficace, eliminando quindi la necessità di utilizzare funzioni di base per tali elettroni che richiederebbero un gran numero di funzioni gaussiane.
2.5 Valutazione della struttura del legante H
3L
Come riportato nell’introduzione di questo capitolo, ed anche nel capitolo 1, la classe dei legante con simmetria di tipo C3 richiede delle precise condizioni conformazionali per la formazione selettiva di specie supramolecolari.
Appare chiaro che la conformazione idonea deve prevedere che tutti e tre gli anelli coordinativi puntano verso la stessa direzione, come riportato nella seguente figura:
Figura 2.14
D’altro canto, se almeno uno dei siti coordinativi punta in direzione differente, come riportato nella seguente figura, si avrà la formazione di specie oligomeriche.
Figura 2.15
È stato quindi effettuata un’ottimizzazione della struttura del legante H3L
mediante calcoli quanto-meccanici e la struttura ottenuta è riportata nella seguente figura:
Come si può notare, due “bracci” del legante risultano paralleli, puntando i siti coordinativi nella stessa direzione, mentre il terzo braccio assume una posizione quasi perpendicolare si primi due puntando il proprio sito coordinativo in direzione differente rispetto ai primi due.
Tale particolare è reso più chiaro nella seguente figura in cui sono stati riportati solo i gruppi arilici della struttura calcolata.
Figura 2.17. Posizione dei gruppi arilici nella struttura calcolata per il legante H3L.
Dalla figura si evidenzia quanto detto precedentemente ed in aggiunta si può osservare come il gruppo etossilico influenza la struttura. Difatti, il gruppo etilico risulta puntato su un anello benzenico, con una distanza dell’atomo di idrogeno terminale a circa 3 Å dall’anello benzenico (distanza in cui si possono avere interazione di tipo π - C-H). D’altro canto, gli altri due anelli benzenici si pongono in posizione parallela, rispetto all’asse C-O, probabilmente per minimizzare le interazioni con i due doppietti elettronici dell’ossigeno.
In definitiva, la conformazione del legante H3L risulta, dai calcoli effettuati,
pesantemente influenzata dalla presenza del gruppo etossilico. Le informazioni ottenute dalla struttura calcolata, in cui solo due siti coordinativi puntano nella stessa direzione e quindi portano alla formazione di specie oligomriche, spiegano come sperimentalmente nella coordinazione si formano specie insolubili.
Capitolo 3
Equilibrio in soluzione tra complessi a diversa
nuclearità
Il processo d’interconversione tra complessi di differente nuclearità che coinvolgono elicati o altre strutture supramolecolari, sono stati riportati essere operanti in diversi sistemi.
In certi casi, questi processi sono attivati addizionando un catione67
o un anione68
esterno che mediante interazioni di tipo host-guest, promuove la conversione della struttura iniziale in strutture più complesse in cui lo ione addizionato risulta incapsulato.
Interessante il processo descritto da Lehn e coll.69
, in cui l’addizione di ioni Ag+
ad un mono-elicato polieterociclico ne promuove la conversione a doppio-elicato metallico. La conversione è reversibile in quanto l’aggiunta di un criptando, scavenger di ioni Ag+
, riporta il sistema a mono-elicato. In un altro lavoro Lehn70
riporta uno studio sul self-assembly reversibile di oligopiridine mono-elicati in doppi elicati dimeri. La causa di tale reversibilità è dovuta ad un bilanciamento d’interazioni competitive come legami ad idrogeno, intra- ed inter-molecolari, ed interazioni di stacking aromatici.
Per quanto riguarda processi d’intercorvesione spontanei tra specie a diversa nuclearità i pochi studi presenti in letteratura sono a dovuti a M. Isola e coll. (che hanno studiato la classe dei complessi del Ni(II) del tipo bis-saliciladimminico aventi ponti alchilici. I risultati più importanti di questi studi sono riportati nel prossimo paragrafo.
3.1 Interconversione spontanea tra specie mononucleari e
doppi elicati
Come già riportato in precedenza, Isola e coll. hanno studiato approfonditamente il processo di self-assembly dei complessi del Ni(II) di leganti bis-salicladimminici (figura 3.1). Ni O O N O O N (CH2)n nPr nPr n=3, 4, 5, 6, 8, 12
Figura 3.1. Complessi bis-salicilaldimminici del Ni(II) studiati da Isola e coll.
I risultati ottenuti hanno mostrato che nel caso dei complessi, riportati schematicamente in figura 3.1, la complessità strutturale dipende sensibilmente dalle unità metiliche presenti nel ponte spaziatore: in presenza di poche unità metileneniche le specie hanno tendenza ad assumere strutture ad alta nuclearità; l’allungamento progressivo del ponte favorisce la formazione di specie a bassa nuclearità, fino all’ottenimento esclusivo di una specie mononucleare quando il ponte è costituito da una unità dodecametilenica. I leganti contenenti gli spaziatori penta-, esa- e otta-metilenico, di lunghezza intermedia tra quelli esaminati, si comportano coerentemente con la posizione che occupano nella serie, mostrando di poter dar vita ad una specie dinucleare a doppia elica, allo stato solido, e ad una mononucleare, tra loro in equilibrio in soluzione.
3.1.1 Complesso con ponte penta-metilenico
La coordinazione del legante bis-salicilaldimminico contenente un ponte con cinque unità metileni che e ioni Ni++
porta all’ottenimento di una miscela di due prodotti che l’analisi 1
H-NMR e ESI-MS hanno indicato essere la specie mononucleare e la specie dinucleare.
La cristallizzazione da una miscela CHCl3/Eptano ha portato all’ottenimento di
un prodotto che l’analisi cristallografica ha rivelato essere una specie dinucleare a doppia elica.
Nella seguente figura è riportata la struttura della specie dinucleare a doppia elica ottenuta dall’analisi cristallografica.
Figura 3.2. Struttura del complesso dinucleare a doppia elica del Ni++
avente il legante con ponte penta-metilenico
Effettuando la cristallizzazione in condizioni diverse da quelle riportate, si ottiene un solido microcristallino il cui spettro 1
H-NMR indica la presenza di entrambi sia la specie dinucleare che mononucleare, in percentuali molto simili71
. Studi 1
H-NMR effettuati su cristalli di specie dinucleare, condotti in CDCl3,
hanno mostrato che la specie dinucleare in soluzione da luogo ad un processo di conversione portando alla formazione di una specie mononucleare. All’equilibrio, raggiunto dopo circa una settimana, la percentuale di specie dinucleare nel sistema è del 53 % mentre la percentuale di specie mononucleare è del 47 %. Nella seguente figura sono riportati gli spettri 1
H-NMR subito dopo dissoluzione della specie dinucleare e dopo una settimana.
Figura 3.3. Spettri 1H-NMR (CDCl3)del complesso elicato dinucleare con ponte penta-metilenico
dopo dissoluzione (a) e dopo una setimana (b).
3.1.2 Complesso con ponte otta-metilenico
In comportamento del complesso ottenuto dalla coordinazione del legante bis-salicilaldimminico con ponte otta-metilenico ed il Ni++
è simile a quanto discusso precedentemente.
Il prodotto ottenuto dopo coordinazione, è stato caratterizzato, con analisi 1H-NMR ed ESI-MS, essere quasi esclusivamente una specie mononucleare con la presenza di tracce di specie dinucleare.
Dalla cristallizzazione da THF/Et2O, si sono ottenuti di cristalli che l’analisi
cristallografica ha mostrato essere una specie dinucleare a doppia elica.
Nella seguente figura è riportata la struttura, ottenuta dall’analisi cristallografica, del complesso dinucleare a doppia elica.
pp m 4. 0 4. 5 5. 0 5. 5 6. 0 6. 5 2 3)2] a b pp m 4. 0 4. 5 5. 0 5. 5 6. 0 6. 5 pp m 4. 0 4. 5 5. 0 5. 5 6. 0 6. 5 a b
Figura 3.4. Struttura del complesso dinucleare a doppia elica del Ni++
avente il legante con ponte otta-metilenico
Da considerare che nel caso in cui la cristallizzazione viene effettuata in condizioni differenti da quelle riportati, si ottiene un prodotto a carattere micro-cristallino il cui spettro 1
H-NMR indica la presenza della specie mononucleare71
(percentuali maggiori del 97%).
Anche questo in caso, come evidenziato da studi 1
H-NMR condotti in CDCl3, la
specie dinucleare a doppia elica da luogo ad un rapido, rispetto a quanto riportato prima, processo d’interconversione spontaneo trasformandosi nella specie mononucleare.
All’equilibrio, raggiunto dopo circa 1 giorno, la specie monocleare è preponderante (97 %) rispetto alla specie dinucleare (3 %).
Nella seguente figura sono riportati gli spettri 1
H-NMR (CDCl3), registrati a tempi
differenti, dopo la dissoluzione del complesso dinucleare a doppia elica.
Figura 3.5. Spettri 1H-NMR (CDCl3)del complesso elicato dinucleare con ponte otta-metilenico