Indice
1. Introduzione ... 1
1.1. Inquinamento atmosferico ... 1
1.2. L’ozono troposferico ... 5
1.3. I licheni ... 15
1.3.1. Natura e struttura dei licheni ... 15
1.3.2. Forme riproduttive ... 19
1.4. I licheni e l’inqinamento atmosferico ... 20
1.5. Scopo del presente lavoro ... 30
2. Materiali e metodi ... 33
2.1. Parmotrema perlatum ... 33
2.2. Campionamento, pretrattamento e conservazione dei talli ... 34
2.2.1. Siti di campionamento e metodologie di raccolta ... 34
2.2.2. La pulizia e la scelta dei campioni ... 35
2.2.3. Metodologia di condizionamento e conservazione dei campioni ... 35
2.3. Esposizione del lichene all’ozono ... 37
2.4. Analisi della fluorescenza della clorofilla a ... 38
2.5. Determinazione del contenuto in anione superossido ... 40
2.6. Determinazione dell’attività enzimatica della superossido dismutasi ... 41
2.7. Determinazione del contenuto di acqua ossigenata ... 41
2.8. Attività enzimatica dell’ascorbato perossidasi ... 42
2.9. Determinazione della quantità di AsA totale e ridotto ... 42
2.10. Determinazione dell’attività enzimatica della deidroascorbato reduttasi ... 43
2.11. Determinazione del contenuto di glutatione ... 44
2.12. Determinazione dell’attività enzimatica della glutatione reduttasi ... 45
2.13. Analisi statistica dei dati ... 45
3. Risultati e discussione ... 47
3.1. Analisi della fluorescenza della clorofilla a ... 47
3.2. Analisi dei metaboliti e degli enzimi del ciclo di Halliwell-Asada ... 50
4. Considerazioni conclusive ... 59
Riassunto
I licheni sono associazioni simbiotiche tra funghi e uno o più partner fotosintetici, quali alghe o cianobatteri. Essi non dispongono né di organi attivi per l’assorbimento di acqua, né di strutture di scambio gassoso e tessuti protettivi, per cui l’intera superficie del tallo dipende direttamente dall’atmosfera in termini di apporto idrico e nutrizione minerale. Per questo motivo, essendo estremamente reattivi in presenza di sostanze in grado di alterare la normale composizione dell’aria, i licheni possono fornire preziose informazioni sullo stato dell’ambiente. Nei paesi industrializzati, negli ultimi decenni l’inquinamento da anidride solforosa (SO2), che fino a ieri rappresentava la principale causa del declino delle comunità licheniche, è progressivamente diminuito grazie alla costante riduzione delle emissioni. Tuttavia, è aumentata la concentrazione di altri agenti nocivi, tra cui l’ozono (O3), che, potendo persistere ad alte concentrazioni anche lontano dalle aree in cui si forma, è da considerarsi il contaminante potenzialmente più pericoloso a cui gli ecosistemi agro-naturali e urbani sono (e saranno) esposti, soprattutto nell’area Mediterranea.
Nel presente studio è stata valutata la risposta fisiologica e biochimica all’O3 (250 ppb, 5h d-1, per 14 giorni consecutivi), di talli di Parmotrema perlatum (Huds.) M. Choisy (specie epifita moderatamente idrofitica), idratati e non, mantenuti ad una umidità relativa dell’80% (optimum metabolico per la simbiosi in esame). L’indagine ha preso in considerazione (i) l’attività dei principali metaboliti ed enzimi coinvolti nel ciclo di Halliwell-Asada e (ii) alcuni parametri fisiologici (mediante misure in vivo della fluorescenza della clorofilla a) legati all’efficienza del trasporto elettronico. È emerso che la fumigazione non determinava cambiamenti significativi dell’efficienza del PSII, in termini di rapporto Fv/Fm, rispetto ai controlli in aria filtrata, indicando che la funzionalità del fotosistema e la sua capacità di ridurre l’accettore primario (QA) non sono disturbate dall’inquinante. Dall’analisi delle risposte biochimiche è stato osservato un significativo accumulo del contenuto in acqua ossigenata (H2O2) per entrambi i set di campioni (idratati e non), con un incremento pari a 39% e 31%. L’attività dell’ascorbato perossidasi è aumentata solo
nei talli non idratati (+74% rispetto al controllo); in quelli idratati si è assistito ad un significativo aumento dell’attività della superossido dismutasi, della deidroascorbato reduttasi e del contenuto in glutatione nella sua forma ossidata, rispettivamente con un +21%, +60% e +14% rispetto al controllo.
La disidratazione influenza in maniera più marcata rispetto all’O3 la vitalità di P. perlatum, inducendo la progressiva formazione di elevati livelli di ROS nel mico- e nel fotobionte. L’esposizione all’inquinante non aggrava significativamente la situazione sopracitata e gli stessi meccanismi biochimici e fisiologici, che permettono al lichene di fronteggiare gli scompensi idrici, vengono attivati come risposta allo stress ossidativo.
1
1. Introduzione
1.1. Inquinamento atmosferico
Con il termine atmosfera (dal greco àthmos - vapore e sphàira – sfera) si intende una miscela di gas che circondano un corpo celeste. Essa viene suddivisa in vari strati che presentano caratteristiche diverse (Fig. 1). Quello più basso, a diretto contatto con la superficie terrestre, prende il nome di “troposfera”, in cui prevalgono alcune specie chimiche (gas permanenti), la cui concentrazione non cambia apprezzabilmente nel tempo, quali azoto (N2, il 78% dell’aria secca), ossigeno (O2, 21%) e i gas nobili (argon, neon, elio, xeno e idrogeno). Altre molecole, seppur presenti in misura estremamente ridotta, possono influenzare la qualità della vita sul pianeta.
2
Secondo quanto riportato dal D. Lgs. 13 agosto 2010, n. 155, per “inquinante” si intende: “qualsiasi sostanza presente nell’aria ambiente che può avere effetti nocivi sulla salute umana o sull’ambiente nel suo complesso”. La modificazione della normale composizione dell’aria può essere determinata sia dall’immissione di nuove sostanze sia dalla variazione nella concentrazione di quelle normalmente presenti. Non è facile individuare un aspetto della vita dell’uomo che non sia alterato dall’inquinamento atmosferico: ovviamente, il primo pensiero va alla salute umana, ma bisogna anche tener presenti gli ingenti danni ai manufatti (ad esempio opere d’arte) (Lorenzini e Nali, 2005).
Ad oggi, sono diverse le possibili classificazioni dei contaminanti atmosferici. In primo luogo, essi possono essere distinti in gassosi e particellari (diametro da 0,1 sino a 100 µm); questi ultimi a loro volta si dividono in liquidi (aerosol, nebbie) e solidi (polveri, fumi) e, di solito, sono considerati di minore importanza, anche se - talvolta - possono costituire un serio pericolo in determinati ambienti (ad esempio, polvere di cemento o particelle fuligginose acide nelle vicinanze della fonte). Viceversa, alcuni gas sono di interesse pressoché universale, facilmente rinvenibili in ogni zona industriale e metropolitana. L’interesse sull’inquinamento da particolato è cresciuto negli ultimi anni ed è ora l’aspetto della tossicologia ambientale su cui si concentrano ricerche e dibattiti. Una relazione dell’OMS (Organizzazione Mondiale della Sanità) sulle emissioni veicolari di particelle in tre stati europei ha evidenziato che queste hanno causato più morti degli incidenti stradali (WHO, 1999). In generale, studi epidemiologici hanno rivelato un forte legame tra un’elevata concentrazione di particolato fine nell’atmosfera e un aumento della mortalità e delle malattie nell’uomo (Dockery e Pope, 1994). Il problema ha raggiunto l’opinione pubblica il primo gennaio 2005, quando l’UE ha posto come soglia media massima 50 µg per m3 di aria di PM10 (quella frazione particellare con diametro aerodinamico inferiore a 10 µm) per un periodo di 24 ore, da non oltrepassare per più di 35 giorni l’anno e un livello di 40 µg/m3 per la concentrazione media annuale (Nali et al., 2006). Le città sono obbligate a monitorare anche la frazione più leggera e più pericolosa delle polveri sottili, il PM2,5, ovvero il materiale il cui diametro è inferiore a 2,5 µm e che, a causa di queste piccole dimensioni, rappresenta la parte più pericolosa delle polveri. Il decreto non fissa un limite giornaliero in modo analogo al PM10.
3
Con “emissioni” vengono indicate le sostanze introdotte nell’atmosfera a livello delle rispettive sorgenti; “immissioni” sono quelle che raggiungono il recettore.
“Deposizione secca” è il termine usato per quei processi di varia natura (micrometeorologica, chimica, biochimica, biologica, etc.) che, senza coinvolgere l’acqua presente in atmosfera, determinano un flusso verso il basso di inquinante all’interfaccia aria-suolo. Essa implica che dall’aria venga rimosso il contaminante e quindi costituisce uno dei processi di autodeposizione dell’atmosfera, forse uno dei più importanti, visto che risulta sempre attivo nel tempo. Quella umida, invece, interessa gli acidi e la maggior parte dei sali e avviene essenzialmente mediante le precipitazioni piovose, nevose e le nebbie, prevedendo azioni di rain out (processi all’interno delle nuvole) e di wash-out. L’importanza di questo tipo di deposizione è tanto maggiore quanto più frequenti sono le precipitazioni.
È possibile distinguere sostanze ossidanti, quali: ossidi di azoto (NOx), nitrato di perossiacetile (PAN), ozono (O3); sostanze riducenti, tipo: anidride solforosa (SO2), acido solfidrico (H2S), acido fluoridrico (HF), acido solforico (H2SO4), acido solforoso (H2SO3), acido cloridrico (HCl), acido nitrico (HNO3); fitoeffettori: etilene (C2H4), erbicidi e fitofarmaci. Rispetto alla loro origine, gli inquinanti sono classificati in primari e secondari. I primi sono emessi direttamente nell’ambiente e manifestano la loro tossicità nella forma e nello stato in cui sono liberati, a seguito di uno specifico processo chimico che li ha prodotti (in particolare derivano dai processi naturali). Si tratta di agenti fitotossici noti già da tempo, come SO2, HF, NOx, C2H4, ammoniaca (NH3), cloro (Cl-) e HCl. Successivamente alla loro introduzione in atmosfera, essi vanno incontro a diffusione, trasporto e deposizione, ma fortunatamente, di norma, sono ben distribuiti nel tempo e nello spazio, andando ad interessare aree vaste; pertanto, la diluizione che subiscono è tale che raramente costituiscono un problema. Essi sono soggetti, inoltre, a processi di trasformazione chimico-fisica che possono portare alla formazione degli inquinanti secondari, che spesso risultano più tossici e di più vasto raggio d’azione rispetto ai composti originari. Tra i processi di formazione di questi, ha notevole rilevanza la reazione che coinvolge gli NOx e gli idrocarburi (HC), in presenza di luce solare (detto “ciclo fotolitico di NO2”).
4
Gli inquinanti possono derivare anche da sorgenti naturali, quali: eruzioni vulcaniche e geotermiche, metabolismo microbico, aerosol marini, incendi forestali, emanazioni gassose da parte dei vegetali (idrocarburi da conifere, per esempio), dispersione di polvere di terreno, formazione di O3 a seguito di scariche elettriche o sue intrusioni dalla stratosfera. Le fonti antropiche comprendono principalmente: attività produttive e altre di vario tipo, che comportano combustioni (specialmente impianti di riscaldamento, centrali termoelettriche, inceneritori di rifiuti solidi urbani e, soprattutto, motori dei veicoli). La contaminazione determinata dai processi industriali è stata a lungo considerata al primo posto, non solo per l’aspetto quantitativo, ma anche perché si tratta in genere di turbative degli ecosistemi con carattere di continua presenza. È, questa, una sorgente eterogenea di sostanze, in funzione delle tipologie di lavorazione, delle materie prime e dei catalizzatori impiegati, delle peculiarità degli impianti di scarico degli effluenti. Tra le fonti antropiche si annovera il riscaldamento domestico, alquanto omogeneo e in grado di produrre derivati della combustione di prodotti solidi (carbone, legna), liquidi (gasolio, kerosene) e gassosi (metano).
Ad oggi, però, è il traffico veicolare a determinare i più gravi fenomeni di degrado della qualità ambientale, non limitati soltanto ai centri urbani, anche se proprio nelle aree metropolitane ha la sua massima incidenza. La rete stradale nazionale si estende per oltre 800 x 103 km e sono più di 36 x 106 le autovetture circolanti (fonte ACI; dati riferiti al 31 dicembre 2010), pari a 61 ogni 100 abitanti (erano 14 solo 50 anni fa) (fonte Istat; dati riferiti al 1 gennaio 2011). I principali componenti dei gas di scarico che preoccupano sono: monossido di carbonio (CO), NOx, idrocarburi incombusti e composti organici volatili (COV), tra i quali spiccano le aldeidi. Non si possono, poi, tralasciare altre fonti, come le centrali termoelettriche (che in Italia garantiscono il 64% della produzione energetica totale di ENEL e rappresentano importanti sorgenti di SO2) e gli inceneritori di rifiuti solidi urbani, il cui impatto ambientale è quanto mai complesso, in relazione all’elevatissimo numero di composti che possono emettere (oltre 200, soltanto tra quelli organici).
Sulla base delle loro caratteristiche, le sorgenti possono essere distinte in istantanee e continue e, in relazione alla collocazione geografica, in:
5
localizzate (o puntiformi o puntuali), ovvero impianti isolati, per i quali la diluizione e la dispersione degli effluenti sono tali che gli effetti che provocano sono di norma limitati ad un raggio di qualche chilometro, in virtù dell’altezza dei camini e del regime dei venti; si conoscono, comunque, casi in cui l’impatto diretto di una struttura di vasta portata dotata di camini elevati si è risentito per centinaia di chilometri;
lineari, quali quelle connesse con il traffico veicolare extraurbano; le conseguenze dirette sono generalmente apprezzabili in una fascia di alcune centinaia di metri dalla sede stradale; appartiene a questa categoria anche il fronte mare, in relazione alla presenza di aerosol salini;
di grossa ampiezza (o areali o diffuse), costituite da un grande numero di piccole fonti distribuite su una vasta zona ed aventi altezze simili tra di loro, come le aree urbane (riscaldamento, traffico) e gli impianti concentrati in comprensori industriali; in questi casi è praticamente impossibile interpretare gli effetti sull’ambiente di ognuna di esse.
1.2. L’ozono troposferico
Tra i vari inquinanti atmosferici, l’O3 risulta essere certamente uno dei più importanti (Levy, 1971; Crutzen, 1974). Si tratta della forma allotropica triatomica dell’O2, gas altamente reattivo, di odore particolarmente pungente, agliaceo (il limite di percezione olfattiva è circa 10 ppb) e con un grande potenziale ossidoriduttivo (+2,07 V), in virtù del quale attacca direttamente matrici animali e vegetali, nonchè materiali non biologici. E’ localizzato naturalmente nella stratosfera e nella troposfera; nella prima, dove è presente circa il 97% del totale, le sue molecole svolgono il compito fondamentale di assorbire le radiazioni ultraviolette (UV) ad onda corta (λ < 242 nm) emesse dal Sole, che sarebbero, a causa della loro azione mutagena, incompatibili con la vita sulla Terra. Il cosiddetto “buco dell’O3” rappresentato proprio dalla riduzione di questa fascia protettiva causata dall’emissione nell’atmosfera dei derivati completamente alogenati di idrocarburi, quali cloro-fluoro-carburi (CFC) e cloro-fluoro-bromo-carburi (CFBC), usati in modo diffuso per molti anni come propellenti per aerosol nelle bombolette spray, refrigeranti, espandenti per materie plastiche, solventi e fitofarmaci.
6
La formazione dell’O3 nella stratosfera avviene attraverso la combinazione dell’ossigeno monoatomico (O) - generato dalla fotolisi dell’O2 per azione dei raggi UV - con l’O2, in presenza di una molecola (M) in grado di assorbire l’energia in eccesso della reazione (meccanismo di Chapman) (Chameides et al., 1994):
O2 + hv (λ ≤ 242 nm) O + O O + O2 + M O3 + M
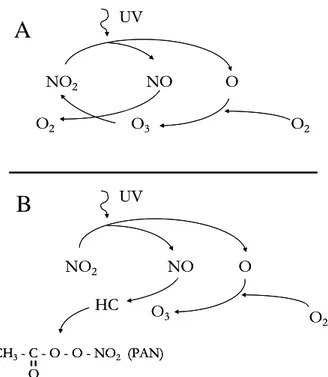
A livello troposferico, esso è prodotto da una reazione in equilibrio O2/O3, che coinvolge gli NOx e la luce (Rao et al., 2000), che porta alla formazione e alla distruzione, in uguale quantità, di O3 e monossido di azoto (NO), in quello che prende il nome di “ciclo indisturbato del biossido di azoto” (NO2) (Fig. 2A). Quando, però, nella troposfera sono presenti anche specie chimicamente attive, quali gli idrocarburi, l’equilibrio viene spostato verso l’aumento dell’inquinante, attraverso la sottrazione diretta di NO a formare altri composti, anch’essi inquinanti (Fig. 2B). Inoltre, la fotossidazione del CO, la presenza di idrocarburi incombusti (come il metano), la formaldeide ed altre sostanze organiche non metaniche possono contribuire alla formazione di questo contaminante (Fishman et al., 1985):
CO + 2O2 + hv → CO2 + O3 CH4 + 4O2 + 2hv → HCOH + H2O + 2O3 RH + 4O2 + 2hv → R’CHO + H2O + 2O3
Fenomeni di intrusione del gas negli strati più bassi possono verificarsi grazie a scambi tra stratosfera e troposfera che avvengono sotto particolari condizioni meteorologiche (Junge, 1962). Questi ed altri eventi, quali ad esempio le scariche elettriche durante i temporali, mantengono la concentrazione di questo inquinante “al suolo” ad un livello di background naturale pari a 20-40 ppb (per l’O3, 1 ppb = 1,96 µg m-3 a 20 °C e 101,325 kPa).
Nel suo meccanismo di formazione svolgono un ruolo fondamentale la componente antropogenica e quella meteo-climatica. Di conseguenza, l’O3 è caratterizzato da una distribuzione geografica peculiare, strettamente legata alla concentrazione dei precursori ed alle condizioni atmosferiche (intensità della radiazione solare, elevata temperatura e stabilità atmosferica). Esso è un tipico contaminante secondario, la cui formazione si realizza nell’ambito delle reazioni dello “smog fotochimico”, innescate soprattutto dagli idrocarburi volatili presenti
7
negli scarichi veicolari (ma anche quelli di origine biogenica possono contribuire). Spesso, i livelli più alti si registrano in prossimità di fonti di emissione, come nelle aree urbane e/o industriali, ma, in conseguenza del fatto che la sintesi richiede un certo tempo e della facilità con la quale si spostano i precursori, è frequente il caso in cui la concentrazione di O3 è superiore in aree poste alcune decine di chilometri sotto vento rispetto ai centri urbani, che non negli agglomerati stessi. Inoltre, proprio nelle zone più inquinate si verificano con maggiore intensità le reazioni che portano alla sua deplezione (titolazione), in particolare la combinazione con NO (Ball e Bernard, 1978).
Fig. 2: A) Ciclo fotolitico indisturbato del biossido di azoto; B) interazione con gli idrocarburi a
formare lo smog fotochimico (da Lorenzini e Nali, 2005).
La possibilità di trasporto a lunghe distanze (anche diverse centinaia di chilometri) dei precursori e dello stesso inquinante in remote aree rurali e forestali (e in alto mare) è ben dimostrata. Ad esempio, la maggior parte del contaminante che si ritrova all’isola di Creta trae origine dalla terraferma (Kouvarakis et al., 2000). E’ stata riscontrata una situazione analoga a Tenerife (Isole Canarie), dove i venti, che hanno provenienza prevalente da nord-est, trasportano l’O3, così da contribuire, insieme a quello prodotto sull’isola, agli alti livelli dell’indice di esposizione accumulata sopra la soglia di 40 ppb (Accumulated exposure Over a Threshold of 40
NO O O2 O3 O2 NO2 HC UV O O3 NO2 NO O2 UV CH3- C - O - O - NO2 (PAN) O NO O O2 O3 O2 NO2 HC UV O O3 NO2 NO O2 UV CH3- C - O - O - NO2 (PAN) O CH3- C - O - O - NO2 (PAN) O
A
B
8
ppb, AOT40, ovvero la somma della differenza tra le concentrazioni orarie superiori a 40 ppb in un dato periodo di tempo, utilizzando solo i valori orari rilevati ogni giorno tra le 8.00 e le 20.00, ora dell’Europa centrale, secondo la Direttiva 2008/50/CE del 21 maggio 2008, recepita in Italia con il D. Lgs. n. 155 del 13 agosto 2010) (Guerra et al., 2004). Studi con tecniche di biomonitoraggio hanno evidenziato la presenza di significative concentrazioni dell’ossidante nelle isole minori dell’Arcipelago Toscano (Gorgona e Capraia), dove la produzione locale di precursori è irrilevante (Lorenzini et al., 1995). Quindi, nonostante che la produzione di O3 sia tipica delle aree urbane con elevata densità di traffico, questo inquinante è facilmente trasportato verso le zone suburbane e periferiche, con risvolti negativi sulla crescita e lo sviluppo di colture agricole, essenze forestali e vegetazione spontanea (Lefohn, 1992). I risultati di programmi di monitoraggio su scala internazionale hanno confermato che il problema non è di soluzione locale, ma necessita di un intervento su scala multi-regionale, attraverso programmi di cooperazione.
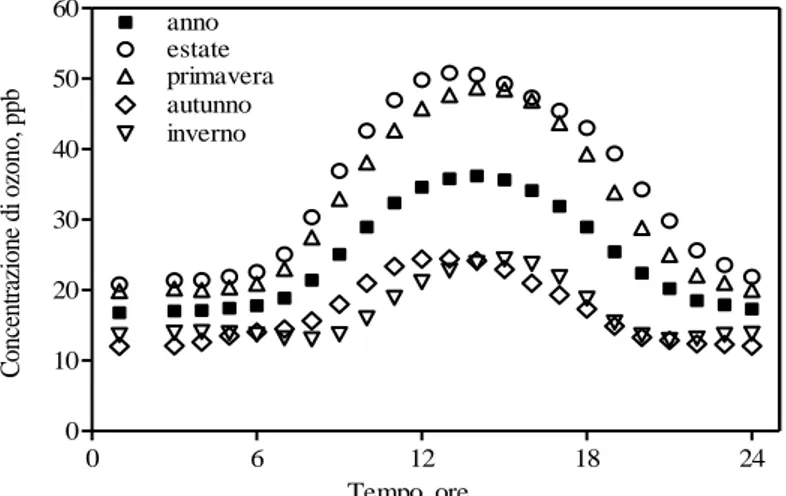
Si possono avere elevate concentrazioni al suolo di O3 anche di notte. Tre sono i possibili meccanismi che giustificano il fenomeno: trasporto orizzontale da altre località; discesa dalla stratosfera; intrappolamento dell’O3 durante il giorno in uno strato di inversione termica. La dipendenza dalle condizioni climatiche e, in particolare, dall’intensità della radiazione solare è, inoltre, alla base delle caratteristiche modulazioni temporali dei livelli dell’inquinante. I profili giornalieri manifestano, infatti, un ben definito ritmo circadiano caratterizzato da bassi livelli durante la notte e da un picco di concentrazione durante le ore centrali della giornata; esiste, poi, un’ampia variabilità stagionale con i periodi estivi maggiormente soggetti al rischio (Fig. 3).
E’ evidente, quindi, che i parametri numerici classici utilizzati per descrivere il comportamento di altri contaminanti (medie giornaliere e annuali) hanno importanza relativamente scarsa nel caso dell’O3 e devono essere integrati con descrittori multiorari e cumulativi. Generalmente, elevati livelli di questo gas si registrano quando la temperatura ambiente raggiunge valori compresi tra i 27 ed i 32 °C, ma in città situate ad altitudini elevate (ad esempio, Città del Messico), dove la
9
radiazione solare è più intensa, sono stati raggiunti notevoli livelli di concentrazione (> 300 ppb) anche a temperature inferiori (McKee, 1993).
Fig. 3: Variazioni giornaliere e stagionali dell’ozono a Pisa nel periodo 1999-2004.
Anche se ormai è difficile valutare i livelli di “background” della molecola divenuta ubiquitaria, le concentrazioni di fondo – come accennato – sono stimabili nell’ordine di poche decine di ppb; in zone fortemente inquinate i picchi giornalieri possono superare 200 ppb.
In Italia, i livelli di O3 spesso si avvicinano, e talvolta superano, i valori definiti come “critici” dai riferimenti normativi stabiliti per la tutela della qualità dell’aria. Nonostante ciò, l’argomento ha ricevuto, fino ad ora, scarsa attenzione, contrariamente a quanto si verifica in Nord America e in Europa occidentale, dove le politiche di controllo delle emissioni di NOx e di COV, dovrebbero portare, nei prossimi anni, ad una riduzione nei picchi di concentrazione di O3 (Ashmore, 2005). Tuttavia, le concentrazioni di fondo dell’inquinante potrebbero aumentare, tanto che i modelli di calcolo matematico mostrano per l’emisfero nord, alle medie latitudini, un tasso di incremento annuo della sua concentrazione troposferica pari allo 0,5-2% (Vingarzan, 2004). Questa crescita è dovuta prevalentemente all’aumento delle emissioni antropogeniche di precursori nelle regioni industrializzate, ma anche al loro trasporto intercontinentale (Ashmore, 2005; Fiscus et al., 2005).
Dal 1851 è nota l’azione irritante dell’O3 a carico dei polmoni e, da allora, numerose pubblicazioni hanno descritto le principali manifestazioni sintomatiche riconducibili all’inquinante; ad esso vengono attribuiti ruoli primari nei numerosi casi di mortalità associati alle “ondate di calore” (Pellegrini et al., 2007), che talvolta
0 6 12 18 24 0 10 20 30 40 50 60 estate primavera autunno inverno anno Tempo, ore C on ce nt ra zi on e di o zo no , p pb
10
affliggono il nostro Paese in estate. Anche i mezzi di informazione sono attenti al problema. Per questo motivo, esso è da tempo oggetto di interventi normativi in sede sia nazionale sia comunitaria. L’O3 è ritenuto il contaminante atmosferico fitotossico più pericoloso nelle nazioni sviluppate e la maggior parte dell’attività sperimentale nel settore delle interazioni biologiche degli inquinanti oggi riguarda proprio questo tema.
In epoca recente (Direttiva 2002/3/CE del 12 febbraio 2002), è invalso l’uso di quantificare la presenza dell’O3 in termini di AOT40, in relazione anche all’approccio metodologico dei “livelli critici”. Dal momento che le direttive 96/62/CE del 27 settembre 2006 in materia di valutazione e gestione della qualità dell’aria ambiente, 1999/30/CE del 22 aprile 1999 concernente i valori limite per SO2, NO2, NOx, particelle e piombo, 2000/69/CE del 16 novembre 2000 sui valori limite per il benzene e CO nell’aria ambiente, 2002/3/CE del 12 febbraio 2002 relativa all’O3 nell’aria, 97/101/CE, che instaura uno scambio reciproco di informazioni e di dati provenienti dalle reti e dalle singole stazioni di misurazione dell’inquinamento atmosferico, erano da modificare sostanzialmente per incorporarvi gli ultimi sviluppi in campo scientifico e sanitario, nonché le esperienze più recenti degli Stati membri, è entrata in vigore un’unica Direttiva, che sostituisce i cinque atti citati (2008/50/CE del 21 maggio 2008, relativa alla qualità dell’aria ambiente e per un’aria più pulita in Europa), recepita in Italia attraverso il D. Lgs. n. 155 del 13 agosto 2010.
Con riferimento all’O3, la normativa definisce:
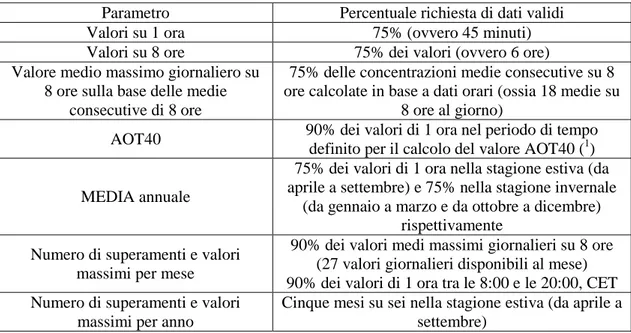
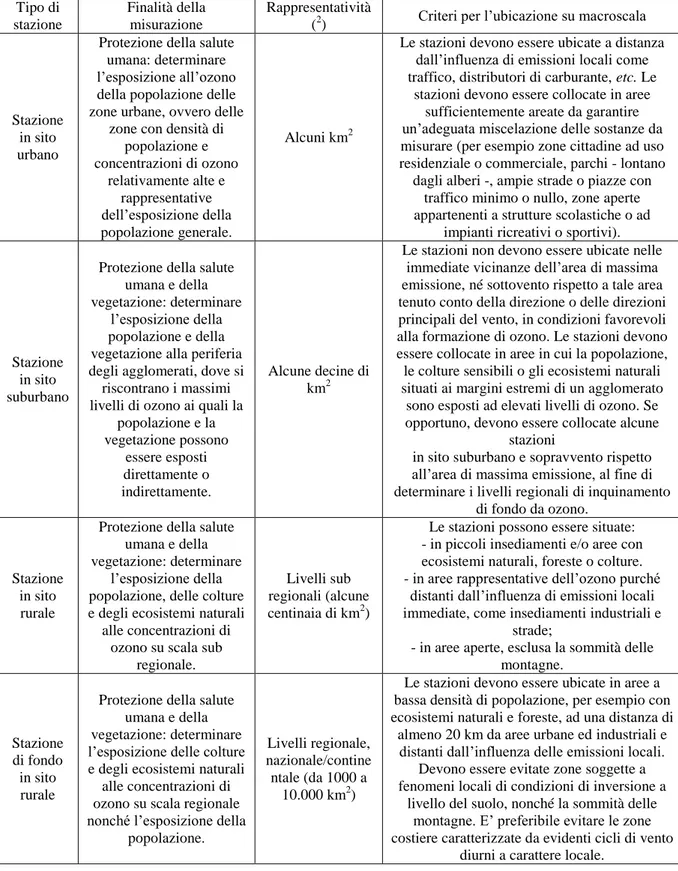
criteri di valutazione, allo scopo di verificare la validità dell’aggregazione dei dati e del calcolo dei parametri statistici (Tab. 1);
ubicazione dei punti di campionamento (Tab. 2); valori-obiettivo e obiettivi a lungo termine (Tab. 3);
misurazione dei precursori dell’inquinante, che deve comprendere gli NOx e i COV;
soglie di informazione (180 µg m-3
, 1 ora) e di allarme (240 µg m-3, 1 ora);
11
definire e stabilire obiettivi di qualità dell’aria ambiente al fine di evitare, prevenire o ridurre gli effetti nocivi per la salute umana e per l’ambiente nel suo complesso;
valutare la qualità dell’aria ambiente sulla base di metodi e criteri comuni su tutto il territorio nazionale;
ottenere informazioni sulla qualità dell’aria ambiente come base per individuare le misure da adottare per contrastare l’inquinamento e gli effetti nocivi dello stesso sulla salute umana e sull’ambiente e per monitorare le tendenze a lungo termine, nonché i miglioramenti dovuti alle misure adottate;
mantenere la qualità dell’aria ambiente, laddove buona, e migliorarla negli altri casi;
garantire che le informazioni sulla qualità dell’aria ambiente siano messe a disposizione del pubblico;
realizzare una migliore cooperazione tra gli Stati dell’Unione Europea in materia di inquinamento atmosferico.
Nonostante i notevoli passi avanti, dal punto di vista sia scientifico che giuridico, in merito agli indici di esposizione della vegetazione all’O3, rimangono numerosi dubbi riguardo l’attendibilità dei livelli critici. L’AOT40, infatti, non fornisce informazioni circa il flusso effettivo dell’inquinante nella foglia (Emberson et al., 2000), che varia in dipendenza delle caratteristiche fisiologiche della pianta e ambientali, e la presenza di molecole ad azione antiossidante (gli isoprenoidi, ad esempio; Loreto e Fares, 2007). Altre incertezze sono legate anche al fatto che: (a) le funzioni dose/risposta si basano su studi condotti in Open Top Chambers (OTC), in cui le condizioni microclimatiche sono in parte alterate, e su un numero ridotto di specie; (b) i dati sulle esposizioni stimate sono stati ottenuti in Nord Europa, mentre la situazione concernente il Sud viene estrapolata; (c) in zone urbane, suburbane e rurali, l’emissione biogenica rappresenta una sorgente significativa di idrocarburi precursori dell’O3 (De Santis, 2000).
Il superamento delle soglie indicate dalla Direttiva è comune in molti Paesi del Mediterraneo (Ribas e Peñuelas, 2003), compresa l’Italia (Ferretti et al., 2007). Uno studio condotto nel territorio toscano dal 1997 al 2007, utilizzando il sistema di
12
monitoraggio Trifolium repens cv. Regal cloni NC-S (O3-sensibile) e NC-R (resistente), mostra come l’approccio dei livelli critici basato sull’AOT40 non sia un indicatore soddisfacente per predire il rischio da O3 sulla vegetazione (Nali et al., 2009).
Tab. 1 - Criteri di valutazione, allo scopo di verificare la validità dell’aggregazione dei dati e del
calcolo dei parametri statistici (da Allegato VII del D. Lgs. n. 155 del 13 agosto 2010).
Parametro Percentuale richiesta di dati validi
Valori su 1 ora 75% (ovvero 45 minuti)
Valori su 8 ore 75% dei valori (ovvero 6 ore)
Valore medio massimo giornaliero su 8 ore sulla base delle medie
consecutive di 8 ore
75% delle concentrazioni medie consecutive su 8 ore calcolate in base a dati orari (ossia 18 medie su
8 ore al giorno)
AOT40 90% dei valori di 1 ora nel periodo di tempo
definito per il calcolo del valore AOT40 (1)
MEDIA annuale
75% dei valori di 1 ora nella stagione estiva (da aprile a settembre) e 75% nella stagione invernale
(da gennaio a marzo e da ottobre a dicembre) rispettivamente
Numero di superamenti e valori massimi per mese
90% dei valori medi massimi giornalieri su 8 ore (27 valori giornalieri disponibili al mese) 90% dei valori di 1 ora tra le 8:00 e le 20:00, CET Numero di superamenti e valori
massimi per anno
Cinque mesi su sei nella stagione estiva (da aprile a settembre)
Per queste considerazioni, da tempo è stata focalizzata l’attenzione dei ricercatori sul bacino del Mediterraneo (Hidy e Mueller, 1986; Butkovic et al., 1990; Lorenzini et al., 1994; Pont e Fontan, 2000; Sanz e Millán, 2000); i dati mostrano, infatti, un aumento della concentrazione di questo contaminante durante gli ultimi decenni, come risultato dell’incremento dei livelli dei suoi precursori (Crutzen, 1988; Ashmore e Bell, 1991; Marenco et al., 1994; Yienger et al., 2000). Più precisamente, l’analisi delle tendenze sembra individuare leggere riduzioni dei valori di picco, ma significativi incrementi dei livelli medi e delle superfici nelle quali vengono superate le soglie di tossicità ambientale (Lefohn et al., 2008).
1 Qualora non siano disponibili tutti i dati misurati possibili, i valori di AOT40 saranno calcolati in base ai seguenti fattori:
(*)Il numero di ore compreso nel periodo di tempo di cui alla definizione di AOT40 (ossia tra le 8:00 e le 20:00, dal 1° maggio al 31 luglio di ogni anno per la protezione della vegetazione e dal 1° aprile al 30 settembre di ogni anno per la protezione delle foreste).
13
Tab. 2 - Ubicazione dei punti di campionamento per la valutazione delle concentrazioni di ozono (da
Allegato VIII del D. Lgs. n. 155 del 13 agosto 2010). Tipo di
stazione
Finalità della misurazione
Rappresentatività
(2) Criteri per l’ubicazione su macroscala
Stazione in sito urbano
Protezione della salute umana: determinare l’esposizione all’ozono della popolazione delle zone urbane, ovvero delle
zone con densità di popolazione e concentrazioni di ozono relativamente alte e rappresentative dell’esposizione della popolazione generale. Alcuni km2
Le stazioni devono essere ubicate a distanza dall’influenza di emissioni locali come traffico, distributori di carburante, etc. Le
stazioni devono essere collocate in aree sufficientemente areate da garantire un’adeguata miscelazione delle sostanze da misurare (per esempio zone cittadine ad uso residenziale o commerciale, parchi - lontano dagli alberi -, ampie strade o piazze con
traffico minimo o nullo, zone aperte appartenenti a strutture scolastiche o ad
impianti ricreativi o sportivi).
Stazione in sito suburbano
Protezione della salute umana e della vegetazione: determinare
l’esposizione della popolazione e della vegetazione alla periferia degli agglomerati, dove si riscontrano i massimi livelli di ozono ai quali la
popolazione e la vegetazione possono essere esposti direttamente o indirettamente. Alcune decine di km2
Le stazioni non devono essere ubicate nelle immediate vicinanze dell’area di massima emissione, né sottovento rispetto a tale area tenuto conto della direzione o delle direzioni principali del vento, in condizioni favorevoli alla formazione di ozono. Le stazioni devono essere collocate in aree in cui la popolazione, le colture sensibili o gli ecosistemi naturali situati ai margini estremi di un agglomerato
sono esposti ad elevati livelli di ozono. Se opportuno, devono essere collocate alcune
stazioni
in sito suburbano e sopravvento rispetto all’area di massima emissione, al fine di determinare i livelli regionali di inquinamento
di fondo da ozono.
Stazione in sito rurale
Protezione della salute umana e della vegetazione: determinare
l’esposizione della popolazione, delle colture e degli ecosistemi naturali
alle concentrazioni di ozono su scala sub
regionale.
Livelli sub regionali (alcune centinaia di km2)
Le stazioni possono essere situate: - in piccoli insediamenti e/o aree con ecosistemi naturali, foreste o colture. - in aree rappresentative dell’ozono purché
distanti dall’influenza di emissioni locali immediate, come insediamenti industriali e
strade;
- in aree aperte, esclusa la sommità delle montagne.
Stazione di fondo in sito rurale
Protezione della salute umana e della vegetazione: determinare l’esposizione delle colture e degli ecosistemi naturali
alle concentrazioni di ozono su scala regionale nonché l’esposizione della
popolazione.
Livelli regionale, nazionale/contine
ntale (da 1000 a 10.000 km2)
Le stazioni devono essere ubicate in aree a bassa densità di popolazione, per esempio con ecosistemi naturali e foreste, ad una distanza di
almeno 20 km da aree urbane ed industriali e distanti dall’influenza delle emissioni locali.
Devono essere evitate zone soggette a fenomeni locali di condizioni di inversione a
livello del suolo, nonché la sommità delle montagne. E’ preferibile evitare le zone costiere caratterizzate da evidenti cicli di vento
diurni a carattere locale.
2 Le stazioni di misurazione devono essere ubicate in modo tale da risultare, per quanto possibile, rappresentative anche di aree
14
Tab. 3 - Valori-obiettivo e obiettivi a lungo termine per l’ozono (da Allegato VII del D. lgs. n.155 del
13 agosto 2010).
Finalità Periodo di mediazione Valore - obiettivo
Data entro la quale deve essere raggiunto il valore-obiettivo(3) Protezione della salute umana
Media massima giornaliera calcolata su 8
ore (4)
120 μg/m3 da non superare
più di 25 volte per anno civile come media su tre
anni (5) 1.1.2010 Protezione della vegetazione Da maggio a luglio
AOT40 (calcolato sulla base dei valori di 1 ora) 18000
μg/m3
-h come media su cinque anni (5)
1.1.2010
Finalità Periodo di mediazione Valore - obiettivo
Data entro la quale deve essere raggiunto il valore-obiettivo Protezione della salute umana
Media massima giornaliera calcolata su 8 ore nell’arco
di un anno civile
120 μg/m3 non definito
Protezione della
vegetazione Da maggio a luglio
AOT40 (calcolato sulla base dei
valori di 1 ora) 6000 μg/m3 h
non definito
A tal proposito, Nolle et al. (2005) osservano che gli attuali valori di inquinanti atmosferici registrati nel bacino del Mediterraneo risultano essere ben cinque volte superiori rispetto a quelli di mezzo secolo fa. In particolare, negli ultimi decenni, la concentrazione di O3 è pressochè raddoppiata raggiungendo e superando, in molte regioni europee, i limiti di tossicità per le specie vegetali sensibili (Schmieden e Wild, 1995). A causa della sua posizione, l’Italia può essere considerata un hot-spot per questo inquinante, in quanto Paese rappresentativo per il suo impatto sulla vegetazione (Paoletti, 2006).
In virtù di quanto affermato, appare evidente come l’O3 abbia iniziato ad interessare sempre di più i fitotossicologi, al punto che attualmente, nei paesi
3 Il raggiungimento dei valori obiettivo è valutato nel 2013, con riferimento al triennio 2010-2012, per la protezione della salute
umana e nel 2015, con riferimento al quinquennio 2010-2014, per la protezione della vegetazione.
4La massima concentrazione media giornaliera su 8 ore deve essere determinata esaminando le medie consecutive su 8 ore,
calcolate in base ai dati orari e aggiornate ogni ora. Ogni media su 8 ore così calcolata sarà assegnata al giorno nel quale finisce; in pratica, la prima fascia di calcolo per ogni singolo giorno sarà quella compresa tra le ore 17:00 del giorno precedente e le ore 01:00 del giorno stesso; l’ultima fascia di calcolo per ogni giorno sarà quella compresa tra le ore 16:00 e le ore 24:00 del giorno stesso.
5 Se non è possibile determinare le medie su tre o cinque anni in base ad una serie intera e consecutiva di dati annui, la
valutazione della conformità ai valori obiettivo si può riferire, come minimo, ai dati relativi a: un anno per il valore-obiettivo ai fini della protezione della salute umana. tre anni per il valore-obiettivo ai fini della protezione della vegetazione.
15
industrializzati, gli viene attribuita la stragrande maggioranza (oltre il 90%) degli effetti fitotossici imputati all’azione dei contaminanti atmosferici (Krupa e Manning, 1988).
1.3. I licheni
1.3.1. Natura e struttura dei licheni
I licheni costituiscono un’associazione simbiotica (un’unione stabile tra due organismi diversi) tra un fungo (micobionte) appartenente alla classe degli Ascomiceti (più del 98%) o più raramente dei Basidiomiceti e una o più popolazioni di alghe o cianobatteri (fotobionti), il cui metabolismo dipende dalla disponibilità ambientale di acqua, essendo privi di organi di assorbimento attivo e di difesa dalla disidratazione (Kershaw, 1985).
Le alghe verdi (Chlorophyceae) unicellulari nella maggior parte dei casi, raramente pluricellulari e filamentose, si distinguono per il colore verde chiaro oppure aranciato (nel genere Trentepohlia). I cianobatteri (detti anche alghe azzurre, Cyanophyceae), che possono appartenere a diversi generi delle Chroococcales ed Hormogonales di cui i più importanti sono Nostoc e Gloeocapsa, conferiscono solitamente al tallo un colore scuro. Tali licheni sono in grado di vivere in ambienti poveri di nutrienti, grazie alla capacità dei cianobatteri di utilizzare direttamente l’azoto molecolare (N2) per produrre molecole organiche.
L’associazione tra mico- e fotobionte porta alla formazione di un organismo con un alto grado di organizzazione e con caratteri morfologici e fisiologici peculiari, non riscontrabili nei due partner osservati singolarmente (Nash, 1996). I due simbionti, quindi, convivono traendo reciproco vantaggio: il fungo, eterotrofo, sopravvive grazie ai composti organici prodotti dall’attività fotosintetica del cianobatterio o dell’alga; mentre questi ultimi ricevono in cambio protezione, sali minerali ed acqua (Hale, 1983). Proprio grazie a questo consorzio, i licheni sono in grado di colonizzare gli ambienti più diversi, a ogni latitudine e altitudine, anche quelli caratterizzati da condizioni di vita estreme, dove, separatamente, fungo e alga non potrebbero sopravvivere. Lo stato di quiescenza può durare a lungo nel tempo, ma nel momento in cui si verificano le condizioni favorevoli alla ripresa delle normali attività metaboliche si comportano da organismi pionieri. La capacità di
16
sopravvivenza è dovuta alla loro abilità di resistere alla disidratazione, interrompendo quasi completamente le attività metaboliche in assenza di acqua, per poi riprenderle in seguito all’inumidimento senza subire danni (organismi peciloidrici). Tuttavia, non avendo strutture di approvvigionamento idrico, come le radici, essi dipendono dall’acqua atmosferica (organismi ectoidrici). Grazie alle loro caratteristiche morfologiche e fisiologiche, essi possono insediarsi su vari tipi di substrati: terreno (terricoli), superfici rocciose (epilitici) e quelle prodotte dall’attività umana, come cemento, tegole, vetro, cuoio. Possono adattarsi a condizioni di vita estreme: se disidratati, tollerano temperature bassissime (in Antartide possono sopportare fino a -196 °C), ma anche molto alte (+100 °C); inoltre, possono resistere ad un elevato irraggiamento.
Fino ad oggi sono state identificate 13500 specie di licheni (Hawksworth, 1988), oltre 2300 delle quali sono state censite sul territorio italiano (Nimis, 2000), tra cui 780 epifite.
Il corpo vegetativo del lichene, denominato tallo, in base alla sua organizzazione interna, viene classificato come:
eteromero (Fig. 4A): quando sono distinguibili vari strati, caratteristico della maggior parte dei licheni, in cui alghe ed ife si organizzano in:
1. cortex superiore, costituito da ife agglutinate, sulla cui superfice si ritrovano strutture riproduttive e vegetative che vanno a formare la parte superiore del lichene;
2. strato algale o gonidiale, costituito da ife lasse in cui si addensano le cellule algali;
3. medulla di ife lasse disposte a “rete” con ampi spazi, che facilitano gli scambi gassosi;
4. cortex inferiore (presente quasi esclusivamente nei licheni fogliosi), formato da ife appressate.
Omeomero (Fig. 4B): non differenziato, caratteristico delle specie più primitive, in particolare quando il fotobionte è un cianobatterio; è costituito da ife e cellule algali che formano un intreccio omogeneo;
17
Fig. 4: A) Tallo lichenico eteromero, in sezione trasversale, con cortex superiore, strato gonidiale,
medulla e cortex inferiore; B) Tallo lichenico omeomero, in sezione trasversale (tratto da Nimis, 1987).
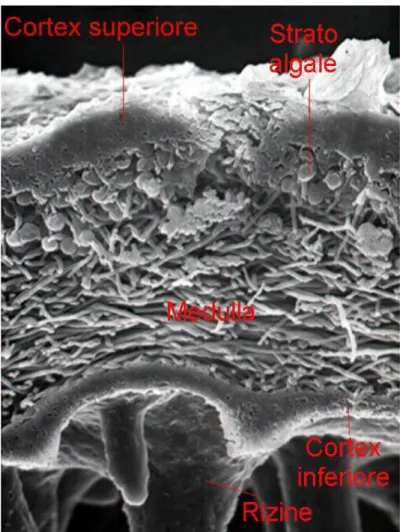
Volendo confrontare la struttura anatomo-istologica di un lichene eteromero (Fig. 5) con quella della foglia di una pianta superiore, il cortex superiore, strato gonidiale, medulla e cortex inferiore sono analoghi, rispettivamente, all’epidermide superiore, al mesofillo a palizzata, a quello lacunoso e all’epidermide inferiore. I licheni, però, essendo privi di cuticola e di stomi, non possiedono alcun tipo di meccanismo di esclusione degli inquinanti presenti nell’aria (Piervittori, 1998).
18
Fig. 5: Tallo lichenico eteromero al microscopio elettronico a scansione.
In base alle forme di crescita, individuabili su base morfologica, i licheni si possono distinguere in cinque categorie:
crostosi: caratterizzati da un tallo strettamente aderente al substrato, privo di cortex inferiore e rizine che può essere continuo, areolato (suddiviso in areole piatte), verrucoso (areole convesse), peltato (areole con margini ascendenti attaccate per un punto centrale), leproso (di aspetto pulverulento costituito da una massa indifferenziata di ife e alghe), placodiomorfi (lobati marginalmente);
squamulosi: sono una variante dei precedenti, il cui tallo è costituito da squamule ascendenti o suberette, o da verruche fortemente convesse raggruppate in cuscinetti (talli bullati); sono caratteristici di molti licheni epigei;
19
fogliosi: il tallo, facilmente asportabile, è costituito da lobi più o meno appiattiti, a organizzazione dorsiventrale (superfice inferiore differente dalla superiore), disposti parallelamente al substrato al quale si ancorano mediante rizine; le dimensioni dei lobi variano da pochi millimetri ad alcuni centimetri;
fruticosi: il tallo, a sviluppo tridimensionale, è formato da ramificazioni (lacinie) a sezione piatta o circolare; il portamento può essere eretto, prostrato o pendente; in alcuni casi da un tallo primario crostoso o squamuloso si dipartono strutture suberette, di forma variabile (bastoncello, trombetta, cespuglietto, etc.) dette podezi, che si originano dall’apotecio e sono parte del corpo fruttifero, anche se spesso il tallo primario scompare e il podezio rappresenta l’intero tallo;
crostosi, fogliosi e fruticosi, il cui fotobionte è un cianobatterio: presentano generalmente un colore scuro e consistenza gelatinosa allo stato umido; in condizioni disidratate appaiono rigidi e fragili (licheni gelatinosi).
1.3.2. Forme riproduttive
La riproduzione dei licheni è riconducibile a due principali strategie: moltiplicazione vegetativa e riproduzione sessuata. Alcuni di essi sono in grado di avvalersi di entrambe le modalità, ma la maggior parte delle specie si è specializzata in una sola, quella asessuata. Nel consorzio lichenico, la presenza dell’alga non influenza il processo riproduttivo del partner fungino, mentre l’alga perde la facoltà di produrre zoospore, moltiplicandosi solo per via vegetativa. Questa avviene sia tramite frammentazione del tallo mediante propaguli specifici contenenti sia il fungo che l’alga. I principali tipi di propaguli sono i soredi e gli isidi.
La riproduzione sessuata viene svolta dal fungo tramite la produzione e la dispersione di spore, contenute in strutture sacciformi dette aschi, che una volta disperse dal vento, dall’acqua o da altri fattori, daranno vita a talli lichenici, qualora trovino un’alga adatta già al momento della loro germinazione. In alcuni casi, all’interno dei corpi fruttiferi cellule algali si associano alle spore, favorendo quindi la formazione di nuovi talli.
20
I licheni, giunti a maturità, producono piccoli corpi fruttiferi:
peritecio: è una struttura a forma sferoidale con un lungo collo, più o meno affossato nel tallo, al cui interno vi sono parafisi e aschi, aprentesi per un poro apicale (ostiolo).
apotecio: a forma di disco, concavo o convesso; può essere sessile, peduncolato o portato su strutture erette come i podezi; si distinguono un disco (formato dall’imenio) e un margine, che può essere di colore diverso e contenere alghe (apotecio lecanorino), oppure di colore simile e privo di queste (apotecio lecideino); tali caratteristiche risultano importanti per la classificazione ed il riconoscimento delle specie.
1.4. I licheni e l’inqinamento atmosferico
Tra gli organismi viventi, i licheni, ed in particolare quelli epifiti, occupano un posto di primaria importanza tra i biomonitor per la valutazione della contaminazione dell’aria (Nimis, 1990; Loppi, 1995), fornendo indicazioni sulla qualità dell’ambiente, in quanto il loro metabolismo dipende essenzialmente dall’atmosfera. Sono stati effettuati studi di vegetazione lichenica in relazione all’inquinamento intorno a sorgenti puntiformi e in molte città, ma anche in aree più ampie, in Italia (Piervittori, 1999; Loppi et al., 2002; Loppi e Corsini, 2003; Isocrono et al., 2007; Munzi et al., 2007) e all’estero (van Herk, 1999; Gombert et al., 2004; Larsen et al., 2007).
Le prime osservazioni sul deperimento dei licheni in aree soggette ad inquinamento atmosferico risalgono alla seconda metà del XIX secolo, quando nel 1859 Grindon suggerì che il loro declino nel Lancashire potesse essere attribuito proprio a questo. Pochi anni dopo, la minor abbondanza di licheni sugli alberi di Parigi rispetto alla campagna circostante fu correlata alla scarsa qualità dell’aria (Nylander, 1866). Successivamente, verso la fine degli anni ’20 del XX secolo, studi condotti nel Nord Europa evidenziarono come il centro di molte città mostrasse una zona definita “deserto lichenico” (Sernander, 1926) per indicare l’assenza di questi organismi. Le ricerche in questo campo sono proseguite lentamente, soprattutto a causa del fatto che la carenza di dati diretti di chimica ambientale impediva la
21
quantificazione precisa delle relazioni tra questo e la vegetazione lichenica (Nimis, 1989). È solo a partire dall’inizio della seconda metà del ‘900 che si è assistito ad un notevole incremento di pubblicazioni sull’uso come indicatori (Nimis, 1990; Loppi, 1995) poiché, in virtù della loro capacità di rivelare numerosi contaminanti gassosi (Conti e Cecchi, 2001; Nimis et al., 2002; Gombert et al., 2006; Nali et al., 2007), forniscono utili informazioni circa il deterioramento dell’ecosistema sottoposto a varie tipologie di stress. Questi studi hanno dimostrato che è possibile correlare la loro distribuzione geografica con i livelli medi dei contaminanti (“indicatori di presenza”). Occorre, però, sottolineare che il lavoro di valutazione della qualità dell’aria di una regione, in base a tale parametro ed alla relativa caduta di biodiversità, non si presenta facile. Infatti, nessun sintomo specifico può consentire di abbinare un danno subito da una specie ad un certo inquinante. La risposta è esclusivamente di tipo quantitativo (“aria più o meno inquinata”) e non qualitativo (natura dei contaminanti presenti).
Le principali caratteristiche che rendono i licheni degli ottimi indicatori biologici sono riassumibili nei punti che seguono. Non presentano strutture di protezione e selezione rispetto alle sostanze presenti nell’ambiente esterno: essendo sprovvisti di apparato radicale, essi traggono le sostanze di cui hanno bisogno (acqua, sali minerali, etc.) direttamente dall’atmosfera; la mancanza di barriere specifiche, quali la cuticola e le aperture stomatiche, non consente loro di “selezionare” le sostanze assorbite, assumendo perciò, in modo continuo, sia nutrienti che contaminanti sia sotto forma gassosa, sia in soluzione che associati al particellato (Tuominen e Jaakkola, 1973; Nieborer et al., 1978; Brown e Beckett, 1985); a differenza di quanto avviene nelle piante superiori, i processi di assorbimento hanno luogo su tutta la superficie del tallo, nell’arco di molti anni e ciò spiega perché siano tra i primi organismi a risentire della presenza di sostanze fitotossiche e riescano ad accumulare a livelli facilmente apprezzabili quei contaminanti atmosferici persistenti (metalli, idrocarburi, radionuclidi, fluoruri, etc.) difficilmente misurabili in campioni di aria; talvolta i licheni possono contenere concentrazioni elevate di contaminanti senza dimostrare danni fisiologici o morfologici e ciò è dovuto al fatto che alcuni di questi non risultano essere tossici per il lichene, oppure si trovano in forma particellata ed insolubile negli spazi
22
intercellulari della medulla (Richardson, 1988). Essi hanno un’attività metabolica ininterrotta nell’arco dell’anno; per questo motivo la resistenza agli stress ambientali consente loro di avere un’attività fisiologica continua sia nel periodo invernale, quando la concentrazione di inquinanti atmosferici raggiunge nelle aree urbane i suoi massimi livelli, che durante la stagione “fotochimica” quando la concentrazione di O3 è elevata.
I licheni sono fotosinteticamente attivi in condizione di idratazione, dipendente dal tasso di umidità atmosferica; in situazioni di stress idrico rallentano le attività metaboliche, per cui aumenta la loro resistenza agli inquinanti atmosferici. Tuttavia, l’aridità protratta provoca un deterioramento delle cellule gonidiali (Deruelle e Lallemant, 1983). Con l’aumento dell’umidità molte sostanze presenti nell’atmosfera determinano un progressivo danneggiamento delle cellule algali, con conseguente depressione dell’attività fotosintetica.
Un’azione depressiva sull’attività fotosintetica è stata dimostrata, sulla base di esperimenti di fumigazione ad esposizione controllata, per le seguenti sostanze: SO2 (Pearson e Skye, 1965; Rao e Le Blanc, 1966; Showman, 1972; Puckett et al., 1973; Le Blanc e Rao, 1975), idrocarburi (Lallemant e Van Haluwyn, 1981), O3 (Nash e Sigal, 1979, 1980), piombo (Pb) (Page et al., 1971, Lawrey e Hale, 1979; Deruelle 1983, Deruelle e Petit, 1983), zinco (Zn) e cadmio (Cd) (Nash, 1972, 1975), fluoruri (Gilbert, 1971; Nash, 1971; Takala et al., 1978; Perkins et al., 1980), mercurio (Hg) (Nicolardi et al., 2012). Una vastissima letteratura scientifica è concorde sul fatto che l’SO2 sia la principale causa del declino dei licheni. Scarse e contraddittorie sono le informazioni sugli effetti dell’O3 su questi organismi (Ross e Nash III, 1983; Tarhanen et al., 1997; Calatayud et al., 2000; vanHerk, 2001; Cirimele et al., 2002), che traggono il proprio sostentamento quasi esclusivamente dall’atmosfera e che pertanto sono particolarmente esposti alla presenza di contaminanti nell’aria che, interagendo con entrambi i simbionti, possono danneggiare di volta in volta quello meno tollerante, con conseguenti alterazioni dei delicati equilibri tra i due partner (Calatayud et al., 2000). Quanto affermato deriva dal fatto che le ricerche sui licheni a livello: molecolare sono ancora molto scarse (Lorenzini e Nali, 2005); eco-fisiologico hanno ricalcato alquanto acriticamente gli studi sulle piante vascolari, che, però, si distinguono dai licheni in alcuni tratti
23
fondamentali, che possono influenzare i meccanismi di azione e le risposte a vari agenti di stress (Kirschbaum e Wirth, 1995).
Non va trascurato che le precipitazioni acide sono tra le maggiori responsabili della progressiva scomparsa di Lobaria pulmonaria dalle Isole Britanniche e dalla Scandinavia (Gilbert, 1986; Hallingbach, 1986) e che in natura la rarefazione dei consorzi lichenici non è quasi mai attribuibile ad un singolo inquinante, ma alle interazioni ed ai sinergismi tra più sostanze presenti in atmosfera. A differenza della maggior parte delle piante superiori, in essi non avviene il fenomeno dell’abscissione fogliare; per questo motivo i talli non hanno la possibilità di liberarsi periodicamente dalle parti vecchie o danneggiate e quindi nemmeno dalle sostanze contaminanti accumulate tramite meccanismi di secrezione attiva. La lentezza del metabolismo sembra la causa della maggiore resistenza dei licheni crostosi, più di quelli foliosi, nei centri cittadini, mentre la longevità permette di ottenere dagli stessi una stima dell’inquinamento su tempi lunghi (James, 1973). Le varie specie presentano diversi gradi di tolleranza rispetto alle sostanze nocive. Alcune di esse sono in grado di assorbire e trattenere al loro interno concentrazioni notevoli di alcuni contaminanti persistenti (metalli pesanti, radionuclidi, idrocarburi clorurati, fluoruri, etc.) senza subire alterazioni nel medio termine, rendendoli ottimi accumulatori.
In Europa, negli ultimi anni, le concentrazioni di SO2 sono apprezzabilmente diminuite, grazie ad interventi di controllo sui processi produttivi (European Environment Agency, EEA, 2006), mentre il decremento di NOx è stato piuttosto contenuto e le concentrazioni di O3 sono ben oltre le soglie limite fissate per la salute umana e per la protezione della vegetazione, sopratutto in Italia (EEA, 2008). La comprensione degli effetti che questi gas esercitano sui licheni sono un argomento di attuale interesse per la comunità scientifica e non solo, ma le conoscenze a riguardo sono per molti aspetti lacunose e di problematica interpretazione (Holopainen e Kärenlampi, 1985; Egger et al., 1994; Calatayud et al., 2000).
I licheni vengono impiegati per il monitoraggio dell’inquinamento atmosferico sia come indicatori di presenza che come accumulatori. Nel primo caso, viene sfruttata la loro notevole sensibilità ai contaminanti. In particolare, in aree con forti livelli di idrocarburi aromatici, polveri, NOx, CO, anidride carbonica (CO2), e SO2, la loro crescita è limitata, così come la loro possibilità di insediamento (Nimis,
24
1994; Loppi et al., 1997). Nell’altro, è utilizzata la capacità delle specie più interessanti di vivere e di accumulare alte concentrazioni di molecole persistenti, metalli pesanti in particolare (Gasparo et al., 1989; Loppi et al., 1992; Nimis, 1994).
Manning e Feder (1980) sostengono che nei licheni le particelle dei metalli pesanti sono immobilizzate nel partner fungino e non vanno ad interferire con il simbionte algale. Il bioaccumulatore è tanto migliore, quanto più risulta lineare la correlazione fra presenza di contaminante nell’aria e concentrazione dello stesso nel tallo lichenico. Se, superata una certa soglia di inquinante nell’atmosfera, esso non è più in grado di assorbirlo, si perde l’informazione relativa ai massimi livelli di contaminazione, che sono i più interessanti. Esso accumula le sostanze in dipendenza dei livelli di queste nell’atmosfera e dal tempo di esposizione: a parità dei primi, risulta più alta la contaminazione nel soggetto più vecchio, sottoposto per più tempo all’inquinamento.
Nel lichene folioso Parmelia caperata sono state misurate le concentrazioni dei metalli pesanti in porzioni sia periferiche che centrali del tallo del medesimo individuo (Gasparo, 1989). Considerando la superficie inferiore del lichene, si è distinta la porzione periferica, bruno-chiara, dalla parte centrale, più scura. Si è visto che per i metalli pesanti a prevalente deposizione secca, la quantità al centro è sensibilmente maggiore. Potendo escludere fenomeni di eliminazione, si può assumere che quanto più vecchio è un tallo, tanto più è contaminato. Per questo motivo è necessario analizzare porzioni aventi età corrispondenti.
Per ridurre le fluttuazioni dovute a particolari condizioni in cui è stato raccolto il lichene (forte dilavamento, esposizione diretta alla luce solare, substrato molto rugoso con trattenimento di acqua), si preferisce, dove possibile, raccogliere e sottoporre ad analisi un numero consistente, almeno equivalente alla mezza dozzina, di esemplari della stessa specie per ogni stazione. Esperimenti condotti presso l’Università degli Studi di Trieste con la collaborazione dell’Università degli Studi di Siena (Gasparo, 1989) hanno dimostrato che da un miscuglio di campioni si ottiene una caratterizzazione precisa della stazione: l’analisi del materiale fornisce un dato prossimo alla media ottenuta considerando numerosi campioni analizzati singolarmente.
25
Il biomonitoraggio della qualità dell’aria svolto con questi organismi ha il vantaggio di poter essere eseguito durante tutto l’arco dell’anno, al contrario di quanto accade per altri bioindicatori. Cosi è possibile monitorare, oltre agli inquinanti presenti durante la stagione invernale, anche quelli, come l’O3, che creano problemi durante la stagione estiva. È altrettanto vero che spesso i risultati ottenuti da campagne di monitoraggio con i licheni non sono correlabili con quelli conseguiti, ad esempio, con le piante di tabacco (Lorenzini et al., 2003). Questo fenomeno è riconducibile ai processi di trasporto dell’O3 a lunga distanza (Lorenzini et al., 1995), vale a dire che questo inquinante può giungere facilmente anche in aree remote e rurali dove la qualità dell’aria è comunque soddisfacente.
Sfruttando la capacità di assorbire ed accumulare i contaminanti persistenti, generalmente presenti nell’atmosfera in basse concentrazioni, negli ultimi anni questi organismi sono stati ampiamente impiegati nel monitoraggio di metalli pesanti, radionuclidi, non-metalli come lo zolfo ed il fluoro, e di composti xenobiotici come per esempio gli idrocarburi clorurati (Nieborer e Richardson 1981; Thomas et al., 1984; Mackenzie, 1986; Bacci et al., 1986; Perkins e Millar 1987). La metodologia è stata impiegata soprattutto in prossimità di sorgenti puntiformi (complessi industriali e minerari) dove, in assenza di flora lichenica spontanea, possono essere trapiantati gli stessi, raccolti in aree non contaminate (Gailey et al., 1985; Gailey e Lloyd 1986). Il controllo di queste sostanze permette di studiare indirettamente il loro grado di diffusione e deposizione, e quindi di risalire alle fonti di inquinamento. Garty et al. (1985), applicando il metodo in zone urbane e rurali di Israele, hanno stimato la capacità di dispersione di metalli associati al particellato ed hanno individuato le fonti inquinanti.
Le alterazioni indotte dall’inquinamento atmosferico sui licheni epifiti a livello fisiologico si manifestano: con una generale depressione della fotosintesi e della respirazione cellulare, nonché un’evidente riduzione della fertilità; morfologicamente, con evidente scolorimento e modificazione della forma del tallo; a livello ecologico, con una generale diminuzione della copertura di specie e alterazione della comunità lichenica. Mentre le prime non sono agevolmente quantificabili e spesso si rivelano di difficile interpretazione, le ultime permettono di tradurre le risposte in valori numerici.
26
Per contro, i principali limiti dell’utilizzo di questi organismi quali bioindicatori della qualità dell’aria, sono rappresentati da: (i) difficoltà di applicazione dove sia infrequente il substrato di crescita adatto; (ii) drastica diminuzione della sensibilità di alcune tecniche per valori estremi di concentrazione atmosferica di determinati inquinanti; (iii) incapacità di rilevare fenomeni acuti, in quanto la loro reazione richiede un certo tempo per essere apprezzabile; (iv) impossibilità di elaborare un’unica scala d’interpretazione dei dati biologici in termini di inquinamento valida per tutto il territorio nazionale, vista l’estrema variabilità climatica e geomorfologica che lo caratterizza (ANPA, 2001).
Alcuni degli effetti negativi indotti da inquinanti fotochimici si traducono nella produzione di molecole direttamente o indirettamente coinvolte nei processi ossidativi, le cosiddette Reactive Oxygen Species (ROS), che vengono prodotte anche in reazioni dipendenti dall’ossigeno durante il normale metabolismo. Tra queste, l’ossigeno singoletto, ad esempio, si forma all’interno delle cellule, nell’apparato fotosintetico.
L’energia luminosa viene intrappolata dalla clorofilla e trasferita all’ossigeno tripletto, formando ossigeno singoletto; questo può reagire con catene di acidi grassi per formare perossilipidi. L’anione superossido (O2•-) deriva dalla cattura di un elettrone dell’ossigeno ed è un’inevitabile conseguenza della respirazione aerobica. La maggior parte dei superossidi reagisce con se stessa enzimaticamente e non, costituendo il perossido di idrogeno (H2O2). Dalla reazione di quest’ultimo con un’altra molecola di superossido si hanno i radicali idrossilici (Beckett e Minibayeva, 2007). Generalmente, nelle piante la produzione intracellulare di ROS può causare danni cellulari attaccando acidi nucleici, lipidi e proteine. La produzione extracellulare, invece, gioca un ruolo importante in alcuni processi biologici (quelli di maturazione e di naturale invecchiamento dei tessuti vegetali, come foglie, fiori e frutti), rimanendo tuttavia una comune risposta delle piante a molte avversità (di tipo abiotico e biotico). Nei licheni, invece, la loro produzione è stata scarsamente studiata, sebbene essi mostrino notevole tolleranza ad una vasta gamma di stress (Holopainen e Kärenlampi, 1985; Munzi et al., 2009).
Come per le piante, anche nel caso dei licheni, i bersagli preferenziali dell’azione dell’O3 sono le membrane cellulari (soprattutto cloroplastiche), su cui
27
viene indotta una forte perdita di stabilità, con conseguente rilascio di elettroliti. Il danno prodotto è, quindi, il risultato di reazioni biochimiche e fisiologiche, cui possono conseguire cambiamenti del tasso fotosintetico, dei suoi pigmenti accessori e nell’allocazione del carbonio. Da un lato, trattamenti acuti (da 30 minuti fino ad una settimana) con alte concentrazioni di O3 (200-1600 ppb) non hanno evidenziato alcun effetto sul contenuto in clorofilla nel lichene Cladonia arbuscula (Rosentreter e Ahmadjian, 1977) e sull’attività fotosintetica di C. rangiformis (Brown e Smirnoff, 1978), quando sottoposta a concentrazioni da 4000 a 12000 ppb di O3; dall’altro, come osservato da Nash e Sigal (1979), si registra una significativa riduzione dell’assimilazione di CO2 dopo tre ore di fumigazione a 500 ppb di O3 in Parmelia sulcata, mentre in Flavoparmelia caperata e in Umbilicaria mammulata analoga risposta è stata riscontrata dopo 12 ore di esposizione a 30 ppb (Eversman e Sigal, 1987). Ancora, Scheidegger e Schroeter (1995) osservano, dopo trattamento cronico (80 giorni a 90 ppb di O3), una riduzione dell’attività del PSII e del tasso fotosintetico in diversi tipi di licheni, quali Anaptychia ciliaris, Collema nigrescens, Evernia prunastri, Hypogymnia batteria e Lobaria pulmonaria.
In altri studi, la sensibilità di alcuni biomarker, quali la SOD e la malonildialdeide (MDA), è stata evidenziata mediante esperimenti di trapianto lichenico (Egger et al., 1994), senza per altro evidenziare alcun effetto a carico della fotosintesi e delle clorofille, al contrario di quanto riportato da altri autori (Zambrano e Nash, 2000). La specie-specificità della risposta sembra essere legata all’ecologia della singola specie: in esperimenti con OTC, specie sciafile hanno mostrato effetti, sia a livello fisiologico che ultrastrutturale, già a 40 ppb dopo 30 giorni (Scheidegger e Schroeter, 1995; Balaguer et al., 1996), mentre in specie eliofile non sono stati riscontrati danni significativi, nemmeno a 300 ppb (Calatayud et al., 2000). Contraddicendo le conclusioni di uno studio condotto in California, che identificava nell’O3 e nei PAN la causa del declino della biodiversità lichenica (Sigall e Nash, 1983), in Europa non è mai stata osservata una rarefazione della flora lichenica in presenza di elevati valori di O3 (Lorenzini et al., 2003; Ruoss e Vonaburg, 1995). Anche per gli NOx i dati sono scarsi e sporadici, e derivano principalmente da indagini floristico-vegetazionali, fisiologiche e ultrastrutturali. Il deterioramento è stato messo in relazione con gli NOx in diversi studi (Loppi et al., 1996; Davies et