Indice
Sezione I: INTRODUZIONE
Introduzione 2 Epidemiologia 3 Caratteristiche molecolari 4 Metodiche di laboratorio 4Caratteristiche cliniche ed opzioni terapeutiche 6
Sezione II: STUDIO
Materiali e metodi 8Risultati 10
Discussione e conclusioni 14
Sezione III: TABELLE E GRAFICI
Tabelle
20Grafici
23Introduzione
I carbapenemici sono antibiotici utilizzati nel trattamento delle infezioni gravi causate dalle Enterobatteriaceae produttrici di β-lattamasi a spettro espanso (ESBL) (Pitout et al., 2008). L’emergenza di enterobatteri resistenti ai carbapenemici genera notevole preoccupazione, poiché in tal caso le opzioni terapeutiche sono estremamente limitate.
La resistenza ai carbapenemici può essere determinata da diversi meccanismi: alterazione della permeabilità della membrana esterna e “up-regulation” delle pompe di efflusso o produzione di enzimi capaci di idrolizzare i carbapenemici (carbapenemasi).
Klebsiella pneumoniae carbapenemasi (KPC) è una carbapenemasi a
serina, generalmente codificata da un gene plasmidico, appartenente alla classe A di Amber.
Il primo isolato produttore di KPC era una K. pneumoniae identificata in North Carolina, USA, nel 1996 (Yigit H et al., 2001). Tale germe era resistente a tutti i β-lattamici, compresi i carbapenemici. Negli anni sono state identificate sette varianti di KPC, in grado di idrolizzare tutti i β-lattamici, comprese penicilline, cefalosporine e monobattami (Yigit et al., 2001; Alba et al., 2005).
Epidemiologia
Dopo il primo isolamento, Klebsiella pneumoniae produttrice di KPC (KP-KPC) si è rapidamente diffusa nell’area di New York e successivamente in quasi tutti gli Stati Uniti (Bratu et al., 2005; Bradford et al., 2004). Le principali carbapenemasi identificate negli USA sono KPC-2 e KPC-3 ed oltre ad essere prodotte da K. pneumoniae, si riscontrano meno frequentemente anche in altre Enterobatteriaceae (E. coli, Enterobacter cloacae, Proteus mirabilis, Klebsiella
oxytoca, Pseudomonas aeruginosa, Pseudomonas putida) (Landman et al.,
2007).
La prima epidemia da KP-KPC al di fuori degli Stati Uniti è stata identificata in Israele (Leavitt et al., 2007). Anche in questo caso i responsabili dell’epidemia erano cloni di KP produttori di KPC-2 e KPC-3.
Nel 2006 è stata documentata la diffusione di KP-KPC in numerosi ospedali colombiani. Successivamente altre nazioni dell’America del sud (Brasile ed Argentina) hanno documentato l’isolamento di cloni produttori di KPC (Peirano et al., 2009; Pasteran et al., 2008).
In Europa la maggior parte dei casi sono stati segnalati in Grecia (Cuzon et al., 2008; Tsakris et al., 2008). In Francia sono stati identificati cloni KP-KPC in pazienti provenienti da USA, Grecia ed Israele (Naas et al., 2005). Analogamente anche in Svezia è stato riportato un caso di infezione da KP-KPC in un paziente proveniente dalla Grecia (Tegmark et al., 2007). Infine, due casi di KP-KPC sono stati documentati nel Regno Unito, uno in Scozia nel 2007 ed uno a Londra nel 2008 (Woodford et al., 2008).
Caratteristiche molecolari
Il gene responsabile della produzione di KPC, blaKPC è un gene plasmidico,
che quindi può essere facilmente trasmesso da un ceppo all’altro (Ygit et al., 2001; Miriagou et al., 2003; Smith Moland et al., 2003). Negli stessi plasmidi sono spesso presenti anche determinanti di resistenza agli aminoglicosidi e geni responsabili della produzione di altre β-lattamasi, ad esempio blaCTX-M-15 (Cai et
al., 2008).
Metodiche di laboratorio
Spesso i batteri produttori di KPC presentano sensibilità ai carbapenemici in vitro (Bratu et al., 2005); infatti, per esprimere la piena resistenza ai carbapenemici generalmente occorre la presenza di un secondo meccanismo di resistenza, come ad esempio un’alterazione della permeabilità della membrana esterna (Ygit et al., 2001; Zhang et al., 2008). La determinazione della sensibilità ai carbapenemici dei ceppi produttori di KPC è quindi difficoltosa, qualunque sia la metodica utilizzata.
La grande diffusione di KP-KPC potrebbe essere in parte dovuta alla mancata identificazione di ceppi produttori di carbapenemasi. E’ infatti fondamentale riuscire ad identificare i pazienti colonizzati da KP-KPC al fine di mettere in atto misure di isolamento che prevengano la diffusione di ceppi multi resistenti.
Si rende dunque necessaria l’esecuzione di test che permettano di confermare la produzione di KPC. Un nuovo terreno cromogeno, Cromagar KPC ha mostrato una maggiore sensibilità e specificità rispetto all’agar Mc
Conkey contenente dischetti di carbapenemici nella rapida identificazione di ceppi produttori di KPC (Samra et al., 2008). Altro test rapido per l’identificazione di batteri produttori di KPC è l’utilizzo di dischetti di carbapenemici contenenti acido boronico: l’alone d’inibizione attorno al dischetto contenente il carbapenemico viene confrontato con l’alone d’inibizione attorno al dischetto contenente carbapenemico ed acido boronico, se il diametro del secondo alone è di almeno 5 mm meggiore rispetto al diametro del primo alone il testo è positivo per la produzione di KPC (Tsakris et al., 2008).
Caratteristiche cliniche ed opzioni terapeutiche
La maggior parte delle infezioni da batteri produttori di KPC colpiscono pazienti allettati, generalmente lungodegenti e già sottoposti a numerose terapie antibiotiche, pazienti immunocompromessi, portatori di cateteri venosi centrali, tracheostomie o sottoposti a ventilazione meccanica assistita (Bratu et al., 2005).
Non sono stati identificati specifici fattori di virulenza associati a ceppi produttori di KPC (Nordman et., 2009), anche se studi hanno dimostrato come la mortalità in pazienti infetti da enterobatteri resistenti ai carbapenemici sia maggiore rispetto alla mortalità in pazienti infetti da ceppi sensibili ai carbapenemici (Marchaim et al., 2008).
Le opzioni terapeutiche nei pazienti con infezione da KP-KPC sono estremamente limitate: infatti i ceppi produttori di KPC sono generalmente resistenti a molti antibiotici non β-lattamici, fluorochinoloni, aminoglicosidi e cotrimoxazolo (Bratu et al., 2005; Marchaim et al., 2008).
Spesso KP-KPC conserva sensibilità a gentamicina, tigeciclina e colistina.
La tigeciclina è un antibiotico con buona attività nei confronti degli enterobatteri, compresi i ceppi produttori di ESBL e KPC. E’ un farmaco batteriostatico ed ha un elevato volume di distribuzione, per cui, poco dopo la somministrazione, tale antibiotico si distribuisce nei tessuti ed i livelli plasmatici risultano bassi; perciò l’uso della tigeciclina nel trattamento delle batteriemie è molto limitato (Muralidharan et al., 2005; Rodvold et al., 2006). Inoltre, anche le concentrazioni urinarie di
tigeciclina sono molto basse, per cui tale farmaco non viene considerato una valida opzione nel trattamento delle infezioni delle vie urinarie (Meagher et al., 2005).
La colistina è un antibiotico potenzialmente nefrotossico e presenta una scarsa penetrazione polmonare (Bratu et al., 2005), infatti nelle infezioni delle vie respiratorie viene spesso somministrata tramite aereosol. L’attività battericida della colistina è concentrazione dipendente.
La terapia di associazione è una valida opzione nel trattamento di infezioni da ceppi produttori di KPC, mancano purtroppo dati clinici che dimostrino ne dimostrino l’efficacia (Endimiani et al., 2009). L’unico dato in letteratura è emerso dallo studio di Bratu et al., che ha dimostrato il sinergismo in vitro di polimixina B e rifampicina contro un isolato di KP-KPC.
Materiali e metodi
Da aprile 2010 al 2 gennaio 2012 167 pazienti infetti o colonizzati da
Klebsiella pneumoniae KPC sono stati identificati dal database del Laboratorio
di Malattie Infettive dell’Azienda Ospedaliera Universitaria Pisana.
Le cartelle cliniche dei pazienti ricoverati nelle diverse Unità Operative dell’AOUP sono state retrospettivamente revisionate. In particolare sono stati raccolti dati riguardati età, sesso, comorbidità, eventuale trattamento con carbapenemici precedente all’isolamento di KP-KPC, terapia antibiotica effettuata ed esito clinico e microbiologico.
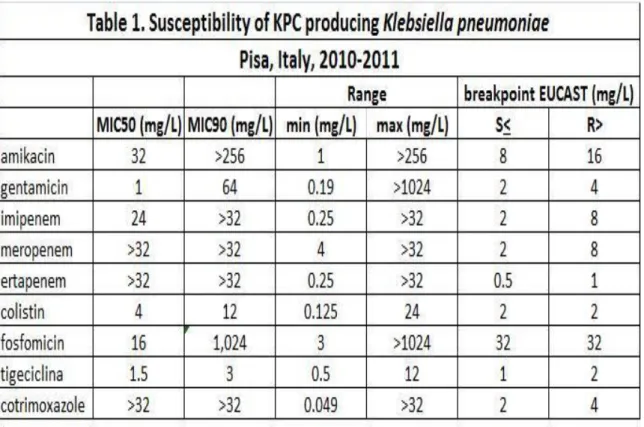
Per ogni paziente è stato considerato un unico isolato (l’isolato responsabile della prima colonizzazione o della prima infezione). L’identificazione di specie dell’isolato è stata eseguita mediante il sistema di identificazione API 20 E (bioMerieux). Le MIC di imipenem, meropenem, gentamicina, colistina, fosfomicina e tigeciclina sono state determinate utilizzando il metodo Etest (bioMerieux). I risultati sono stati confrontati con i break points proposti dalla European Comitee on Antimicrobial Testing (EUCAST) (sensibilità ≤ 2 mg/l per imipenem, meropenem, gentamicina e colistina, ≤ 32 mg/l per fosfomicina, ≤ 1 mg/l per tigeciclina).
La produzione di KPC è stata rilevata mediante test fenotipico di screening con dischetto di meropenem più o meno acido boronico. Dopo aver inoculato l’isolato su McConkey agar o Mueller Hinton agar vengono posti sulla piastra due dischetti, uno contenente meropenem (MEM 10 μg) e l’altro contenente meropenem (10 μg) più acido 3-aminofenilboronico (PB 600 μg); le piastre vengono quindi lasciate in incubazione per circa 24 ore alla temperatura di 37°C. Il test viene considerato positivo per la produzione di KPC nel caso in
cui l’alone di inibizione attorno al dischetto MEM-PB sia maggiore di almeno 5 mm rispetto a quello attorno al dischetto MEM.
La presenza del gene blaKPC è stata determinata mediante reazione
polimerasica a catena (PCR).
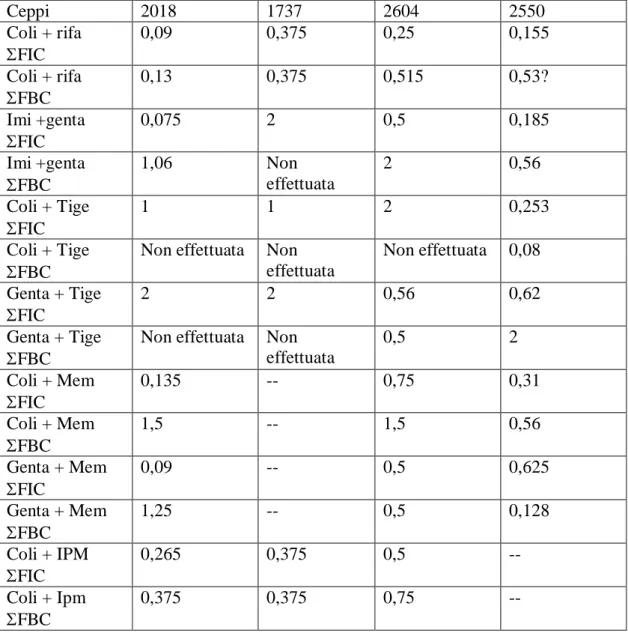
Infine, su 4 isolati di KP-KPC è stato eseguito uno studio di sinergismo mediante checkerboard tra le seguenti combinazione di antibiotici: colistina + rifampicina, imipenem + gentamicina, colistina + tigeciclina, gentamicina + tigeciclina, colistina + meropenem, gentamicina + meropenem, colistina + imipenem. Per ciascun isolato sono state valutate MIC ed MBC per ogni singolo antibiotico e per ogni combinazione di antibiotici. I risultati sono stati interpretati mediante il calcolo dell’indice di concentrazione frazionata inibitoria (FIC) e dell’indice di concentrazione frazionata battericida (FBC): l’associazione tra gli antibiotici è stata definitapienamente sinergica per valori di ΣFIC < 0,5, parzialmente sinergica per 0,5 ≤ ΣFIC < 1, additiva per ΣFIC =1, indifferente per 1 < ΣFIC ≤ 4, antagonista per ΣFIC > 4.
Risultati
Da aprile 2010 al 2 gennaio 2012 nell’AOUP sono stati identificati 167 pazienti con colonizzazione asintomatica (82 pazienti, pari al 49%) o infezione (85 pazienti, pari al 51%) da KP-KPC.
Nonostante la messa in atto di misure di sorveglianza e prevenzione, il numero dei casi di infezione o colonizzazione da KP-KPC è andato progressivamente aumentando (grafico 1).
Come mostrato nel grafico 2, al momento dell’isolamento il 52% dei pazienti (87) era ricoverato in un reparto di terapia intensiva, il 13% (22) in un reparto chirurgico, l’11% (19) in Pneumologia, il 6% (11) in Ematologia, il 5% (9) in Neuroriabilitazione, il 5% (8) in Diabetologia, il 5% (8) in Malattie Infettive ed il 3% in altri reparti (Cardiologia, Medicina Generale, Centro Ustioni).
Precedentemente all’isolamento di KP-KPC 55 pazienti (33%) erano stati sottoposti a terapia antibiotica con carbapenemici (in 48 casi era stato somministrato meropenem, in 4 casi imipenem, in 1 caso ertapenem ed in 2 casi sia meropenem sia ertapenem).
La principale sede di colonizzazione asintomatica è risultata essere quella rettale (77% dei casi), a seguire quella delle vie aeree superiori (5%) e quella urinaria (4%); nel 14% dei casi sono state identificate sedi multiple di colonizzazione.
Dei 75 pazienti con colonizzazione rettale asintomatica 16 (21%) sono stati sottoposti a terapia con gentamicina orale: in 6 casi (37%) si è ottenuta la decontaminazione intestinale, in 6 casi è stato documentato il fallimento della terapia decontaminante, in 10 casi non è stato eseguito alla dimissione del paziente tampone rettale di controllo. Analogalmente in 3 casi di
contaminazione asintomatica delle vie aeree superiori è stato effettuato un tentativo di decontaminazione con somministrazione di colistina (2 casi) e gentamicina (1 caso) aereosol: solo in 1 paziente, sottoposto a terapia con colistina aereosol è stata ottenuta la decontaminazione delle vie aeree.
Nell’83% dei casi (71) con infezione clinicamente evidente è stato possibile identificare la sede di colonizzazione da cui ha probabilmente ha avuto origine l’infezione: ancora una volta la sede di colonizzazione più frequente è quella rettale (47 casi, pari al 66%), a seguire quella delle vie respiratorie (5 casi, pari al 7%) ed urinarie (3 casi, pari al 4%), si segnalano 16 casi (23%) di colonizzazione multipla, bronchiale e rettale.
Dai dati clinici in nostro possesso non è stato possibile stabilire l’intervallo di tempo intercorso tra colonizzazione ed infezione.
Tra i pazienti con infezione clinicamente evidente sono stati descritti 55 casi di batteriemia di cui 17 (31%) in pazienti portatori di catetere venoso centrale (CVC), 23 casi di infezioni respiratorie (21 casi di VAP e 2 casi di polmonite nosocomiale), 8 delle quali batteriemiche, 14 casi di infezioni urinarie, 4 delle quali batteriemiche, 10 casi di infezioni addominali, 4 delle quali batteriemiche ed infine 7 casi di infezione di ossa, cute e tessuti molli, 4 delle quali batteriemiche (grafico 3)
Il 64% (55) delle infezioni è stata trattata con successo utilizzando diverse combinazioni di antibioticoterapia, comprendenti nella maggior parte dei casi (76%) almeno due farmaci tra tigeciclina, gentamicina, colistina e fosfomicina, utilizzati in 3 casi (5%) in associazione con un carbapenemico (imipenem o meropenem). In particolare, gentamicina è stata utilizzata in 31 casi (56%), fosfomicina in 18 casi (33%), tigeciclina in 33 casi (60%) e colistina in 24 casi (44%) di cui 5 in associazione a rifampicina. In 10 casi (18%) l’infezione ha risposto ad una monoantibioticoterapia: 2 infezioni (1 batteriemia ed 1 infezione urinaria) trattate con colistina, 2 trattate con gentamicina (1 infezione urinaria ed
osteomielite, 2 batteriemie di cui 1 relata) ed 1 batteriemia catetere-relata trattata con amoxicillina/acido clavulanico (grafico 4). In 1 caso non è stato possibile ricostruire la terapia antibiotica effettuata.
Si segnala persistente colonizzazione al momento della dimissione in 19 casi (35%) di infezione con risposta clinica alla terapia antibiotica. In 3 casi non è stato documentato l’esito microbiologico dell’infezione.
Nel 23% dei casi (20) non c’è stata né risposta clinica né microbiologica alla terapia antibiotica somministrata. Le combinazioni terapeutiche utilizzate in tali casi comprendevano gentamicina nel 55 % dei casi (11), fosfomicina nel 45% (9), tigeciclina nel 75% (15) e colistina nel 60% (12) (grafico 4). Nel 20% dei casi la terapia antibiotica comprendeva un carbapenemico (meropenem o imipenem) (grafico 4).
In 10 casi non è stato possibile documentare l’outcome dell’infezione. Nonostante la mortalità globale tra i soggetti con infezione da KP-KPC da noi esaminati sia del 45% (38), KP-KPC è stata ritenuta direttamente responsabile del decesso del 23% (20) dei pazienti infetti. La mortalità nei pazienti con sepsi è risultata essere del 33%, in quelli con infezione addominale del 50%, in quelli con infezioni delle vie urinarie del 28%, in quelli con VAP del 14 % e del 50% in quelli con polmonite (grafico 3).
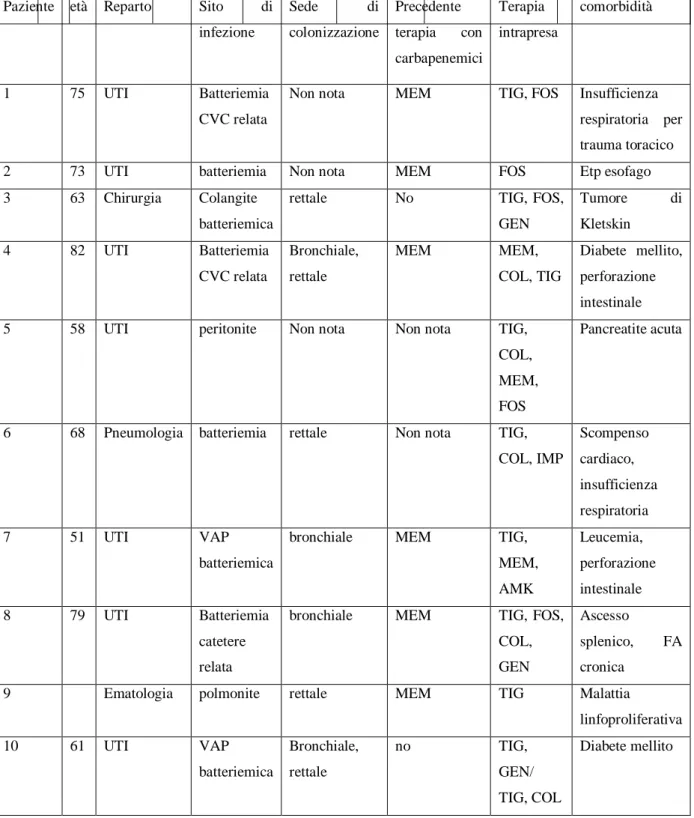
L’età media dei pazienti deceduti per infezione da KP-KPC è di 65 anni (range 26-82). L’80% di tali pazienti presentava importanti comorbidità (tumori di organo solido, diabete mellito, patologie linfoproliferative) ed era ricoverato in un reparto di terapia intensiva. Dati riguardanti i 20 pazienti deceduti per infezione da KP-KPC sono riportati nella tabella 1.
Lo spettro di sensibilità antimicrobica degli isolati di KP-KPC è mostrato nella tabella 3.
Almeno la metà degli isolati presentava completa sensibilità a gentamicina e fosfomicina e sensibilità intermedia a tigeciclina. Solo il 6% degli isolati non mostrava completa resistenza ad imipenem (MIC≤ 8 mg/l) ed il 19%
era sensibile a colistina (MIC≤ 2 mg/l). Tutti gli isolati erano resistenti a meropenem (MIC > 8 mg/l).
Su 4 isolati di KP-KPC sono stati inoltre condotti studi di sinergismo. Le combinazioni di antibiotico testate ed i risultati ottenuti sono riportati nella tabella 2. Oltre alla MIC per ciascun farmaco e per farmaci in combinazione è stata misurata anche la minima concentrazione battericida (MBC) per ciascun farmaco e per farmaci in associazione. La combinazione colistina + rifampicina è risultata sinergica per tutti gli isolati, mentre, al contrario, la combinazione tigeciclina + gentamicina non è risultata sinergica per nessuno degli isolati testati. Per quel che riguarda le altre associazioni i risultati dello studio di sinergismo presentano notevole varietà in funzione dell’isolato testato.
Discussione e conclusioni
Nonostante la messa in atto di misure di sorveglianza e prevenzione, KP-KPC si sta diffondendo nel nostro ospedale: da aprile 2010, data del primo isolamento, alla fine di dicembre 2011 il numero di casi è andato progressivamente aumentando. I reparti maggiormente colpiti sono le terapie intensive e le lunghe degenze.
La colonizzazione costituisce un fattore di rischio per lo sviluppo della successiva infezione. Essendo quella rettale la principale sede di colonizzazione di KP-KPC è raccomandabile eseguire tamponi rettali di sorveglianza per diagnosticare precocemente la colonizzazione, prevenire la diffusione del germe con misure di isolamento da contatto e, nel caso di insorgenza di segni di infezione, iniziare tempestivamente una terapia antibiotica empirica attiva anche nei confronti di KP-KPC. Nonostante precedenti studi (Zuckerman et al, 2010; Tascini et al., 2010, Gatt et al., 2007) abbiano riportato dati incoraggianti riguardo alla decontaminazione intestinale con aminoglicosidi o polimixine ed abbiano proposto l’uso di agenti decontaminanti come possibile strategia nella prevenzione dello sviluppo di infezione, in base ai risultati contrastanti della letteratura (Van Saene et al, 2003) e a quelli ottenuti nella nostra popolazione, la decontaminazione non sembra essere efficace ed è sicuramente da scoraggiare per il rischio di selezione di cloni batterici resistenti agli agenti decontaminanti in quei pazienti che stiano contemporaneamente assumendo per via sistemica altri antibiotici non attivi nei confronti di KP-KPC.
Nel nostro studio le infezioni più frequenti da KP-KPC sono risultate essere le batteriemie, spesso associate alla presenza di catetere venoso centrale, le polmoniti, in particolare le VAP, le infezioni urinarie e le infezioni addominali.
I dati presenti in letteratura riguardanti la mortalità globale nei pazienti con infezione da KP-KPC variano dal 48,8% al 58,8% per le diversi sedi di
infezione e dal 47% al 78% in caso di batteriemia. In letteratura l’incremento della mortalità nei pazienti con infezione da KP-KPC è riportato in associazione alle seguenti condizioni: storia clinica di scompenso cardiaco, insufficienza renale, scompenso epatico, recente trapianto di organo solido, tumori e terapia antibiotica inappropriata. Nella nostra popolazione la mortalità globale è risultata essere del 45% per le diverse sedi di infezione e del 57% in caso di batteriemia e, in accordo con quanto riportato in letteratura, la maggior parte dei pazienti deceduti presentava comorbidità e fattori di rischio quali scompenso cardiaco, insufficienza renale, tumori di organo solido, malattie linfoproliferative, diabete mellito, obesità, pregresso trapianto di organo solido e recente intervento chirurgico per patologie addominali (pancreatite acuta, perforazione intestinale).
Nel nostro studio la mortalità attribuibile ad infezione da KP-KPC è risultata essere del 23%, di poco inferiore a dati riportati in letteratura (nello studio di Souli et al. veniva calcolata una mortalità attribuibile del 27,8%). I 20 decessi attribuibili all’infezione da KP-KPC sono avvenuti in seguito a sepsi, in pazienti con importanti comorbidità: tumori d’organo solido, malattie linfoproliferative, perforazione intestinale, pancreatite acuta, diabete mellito.
Gli isolati di KP-KPC identificati nel nostro studio presentano resistenza nei confronti di quasi tutti gli antibiotici testati: penicilline, cefalosporine, carbapenemici, fluorochinoloni. Le opzioni terapeutiche sono molto limitate: gli unici antibiotici che generalmente sembrano mantenere in vitro la loro attività nei confronti di KP-KPC sono colistina, tigeciclina, gentamicina e fosfomicina
La colistina è un antibiotico potenzialmente nefrotossico e presenta una scarsa penetrazione polmonare (Bratu et al., 2005), infatti nelle infezioni delle vie respiratorie viene spesso somministrata tramite aereosol. L’attività battericida della colistina è concentrazione dipendente: lo studio di Daikos et al. ha dimostrato come la monosomministrazione giornaliera di colistina ( 9 milioni
somministrazione sembra essere associata ad un’aumentata tossicità renale nel modello animale. (Wallace et al., 2008). In letteratura sono riportate basse percentuali di successo nei soggetti trattati con colistina in monoterapia, mentre le percentuali di successo aumentano nei casi trattati con colistina in associazione (Hirsh et al., 2010); nel nostro studio la colistina è stata utilizzata in monoterapia in 2 soli casi, entrambi con buon out come clinico.
La tigeciclina è un farmaco batteriostatico ed ha un elevato volume di distribuzione, per cui, poco dopo la somministrazione, tale antibiotico si distribuisce nei tessuti ed i livelli plasmatici risultano bassi; perciò l’uso della tigeciclina nel trattamento delle batteriemie è molto limitato (Muralidharan et al., 2005; Rodvold et al., 2006). Inoltre, anche le concentrazioni urinarie di tigeciclina sono molto basse, per cui tale farmaco non viene considerato una valida opzione nel trattamento delle infezioni delle vie urinarie (Cunha et al., 2009). In letteratura sono stati riportati casi di infezioni da germi multi-resistenti trattate con successo con tigeciclina utilizzata off label, al dosaggio di 100 mg ogni 12 ore. E’ stato infatti riportato come la dose standard di 50 mg ogni 12 ore possa essere insufficiente a raggiungere il target terapeutico, soprattutto nel caso di infezioni sostenute da ceppi batterici che presentano MIC elevate alla tigeciclina (Cunha et al., 2009).
La gentamicina è un antibiotico da utilizzare con cautela a causa della sua nefrotossicità, inoltre non rappresenta una scelta ottimale nel trattamento degli ascessi o delle infezioni intra-addominali a causa della sua scarsa penetrazione negli ambienti acidi (Wagner et al., 2006; Strausbaugh et al., 1978).
Infine, la fosfomicina è un farmaco difficile da reperire, responsabile in alcuni casi di squilibri elettrolitici (ipernatriemia ed ipokaliemia).
Anche se in letteratura sono riportati casi trattati con successo con terapie di associazione comprendenti carbapenemici (Lomaestro et al., 2006; Wei et al., 2007), nel nostro studio sono state prevalentemente utilizzate combinazioni di antibiotici “carbapenem sparing”. Tale approccio è giustificato dal tentativo di
ridurre la pressione selettiva esercitata dai carbapenemici sulla flora batterica intestinale. L’uso dei carbapenemici in monoterapia è associato ad un’alta percentuale di fallimenti (Hirsh et al, 2010).
Nella popolazione da noi presa in esame è stata impostata una terapia antibiotica appropriata (definendo come appropriata una terapia antibiotica comprendente almeno un farmaco con MIC nel range di sensibilità per KP-KPC) solo nel 51% dei casi, mentre nel 49% dei casi il regime terapeutico adottato comprendeva antibiotici nei confronti dei quali KP-KPC si era dimostrata resistente in vitro. L’outcome clinico della popolazione da noi presa in esame non sembra essere stato modificato dall’appropriarezza della terapia antibiotica impostata: la percentuale di fallimento è del 27% nei casi trattati con una terapia appropriata e del 28% in quelli trattati con antibiotici nei confronti dei quali KP-KPC aveva mostrato resistenza in vitro. E’ possibile considerare l’eventualità che diverse molecole, che prese singolarmente presentano scarsa o nulla attività nei confronti di KP-KPC, siano in grado di agire sinergicamente nei confronti del germe. Appare quindi decisiva l’importanza di condurre studi di sinergismo in vitro al fine di riuscire a delineare la migliore terapia di associazione possibile per ciascun isolato.
Dagli studi di sinergismo condotti su 4 isolati di KP- KPC è emerso, come già descritto in letteratura (Bratu et al., 2005) che colistina e rifampicina presentano un’azione sinergica nei confronti di KP-KPC; per quel che riguarda le altre combinazioni, i risultati dei test eseguiti hanno mostrato notevole varietà in funzione dell’isolato testato. Al momento, dato l’esiguo numero di isolati testati, non è possibile trarre alcuna conclusione, ma sicuramente lo studio dei sinergismi tra antibiotici costituisce un’importantissima risorsa nella scelta della terapia antibiotica appropriata in corso di infezioni da batteri multi-resistenti.
La terapia proposta in caso di infezione da KP-KPC è sicuramente una terapia di associazione che preveda l’utilizzo di tre farmaci, da scegliere in base
esaminati presentavano una residua suscettibilità all’imipenem, tale antibiotico dovrebbe essere tenuto in considerazione nella scelta del terzo farmaco.
L’epidemia di KP-KPC è la dimostrazione di come un uso non corretto degli antibiotici, in particolare dei carbapenemici, possa selezionare dei cloni batterici potenzialmente resistenti a tutti gli antimicrobici attualmente in uso e ciò deve far riflettere sulla necessità di investire nella ricerca di nuovi antimicrobici e di impostare programmi di “antibiotic stewardship” che permettano un uso appropriato e prudente degli antimicrobici, che tenga conto delle caratteristiche farmacocinetiche e farmacodinamiche dei singoli farmaci.
Tabella 1: caratteristiche e comorbidità dei 20 pazienti deceduti per infezione da KP-KPC.
Paziente età Reparto Sito di
infezione Sede di colonizzazione Precedente terapia con carbapenemici Terapia intrapresa comorbidità 1 75 UTI Batteriemia CVC relata
Non nota MEM TIG, FOS Insufficienza
respiratoria per trauma toracico
2 73 UTI batteriemia Non nota MEM FOS Etp esofago
3 63 Chirurgia Colangite
batteriemica
rettale No TIG, FOS,
GEN Tumore di Kletskin 4 82 UTI Batteriemia CVC relata Bronchiale, rettale MEM MEM, COL, TIG Diabete mellito, perforazione intestinale
5 58 UTI peritonite Non nota Non nota TIG,
COL, MEM, FOS
Pancreatite acuta
6 68 Pneumologia batteriemia rettale Non nota TIG,
COL, IMP Scompenso cardiaco, insufficienza respiratoria 7 51 UTI VAP batteriemica
bronchiale MEM TIG,
MEM, AMK Leucemia, perforazione intestinale 8 79 UTI Batteriemia catetere relata
bronchiale MEM TIG, FOS,
COL, GEN
Ascesso
splenico, FA
cronica
9 Ematologia polmonite rettale MEM TIG Malattia
linfoproliferativa 10 61 UTI VAP batteriemica Bronchiale, rettale no TIG, GEN/ TIG, COL Diabete mellito
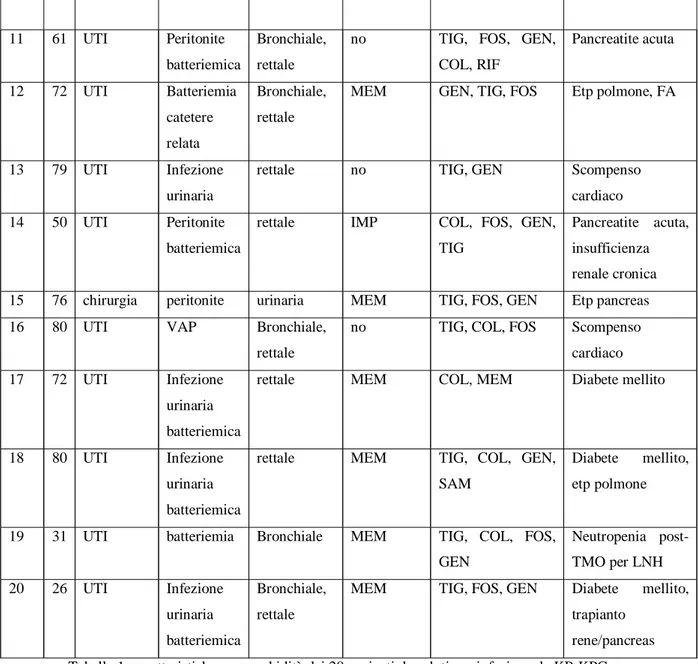
Tabella 1: caratteristiche e comorbidità dei 20 pazienti deceduti per infezione da KP-KPC.
11 61 UTI Peritonite
batteriemica
Bronchiale, rettale
no TIG, FOS, GEN,
COL, RIF Pancreatite acuta 12 72 UTI Batteriemia catetere relata Bronchiale, rettale
MEM GEN, TIG, FOS Etp polmone, FA
13 79 UTI Infezione
urinaria
rettale no TIG, GEN Scompenso
cardiaco
14 50 UTI Peritonite
batteriemica
rettale IMP COL, FOS, GEN,
TIG
Pancreatite acuta, insufficienza renale cronica
15 76 chirurgia peritonite urinaria MEM TIG, FOS, GEN Etp pancreas
16 80 UTI VAP Bronchiale,
rettale
no TIG, COL, FOS Scompenso
cardiaco
17 72 UTI Infezione
urinaria batteriemica
rettale MEM COL, MEM Diabete mellito
18 80 UTI Infezione
urinaria batteriemica
rettale MEM TIG, COL, GEN,
SAM
Diabete mellito,
etp polmone
19 31 UTI batteriemia Bronchiale MEM TIG, COL, FOS,
GEN Neutropenia post-TMO per LNH 20 26 UTI Infezione urinaria batteriemica Bronchiale, rettale
MEM TIG, FOS, GEN Diabete mellito,
trapianto rene/pancreas
Ceppi 2018 1737 2604 2550 Coli + rifa FIC 0,09 0,375 0,25 0,155 Coli + rifa FBC 0,13 0,375 0,515 0,53? Imi +genta FIC 0,075 2 0,5 0,185 Imi +genta FBC 1,06 Non effettuata 2 0,56 Coli + Tige FIC 1 1 2 0,253 Coli + Tige FBC
Non effettuata Non effettuata Non effettuata 0,08 Genta + Tige FIC 2 2 0,56 0,62 Genta + Tige FBC
Non effettuata Non effettuata 0,5 2 Coli + Mem FIC 0,135 -- 0,75 0,31 Coli + Mem FBC 1,5 -- 1,5 0,56 Genta + Mem FIC 0,09 -- 0,5 0,625 Genta + Mem FBC 1,25 -- 0,5 0,128 Coli + IPM FIC 0,265 0,375 0,5 -- Coli + Ipm FBC 0,375 0,375 0,75 --
1 9 7 17 43 48 42 0 10 20 30 40 50 60 Apr - Giu 2010 Lug - Set 2010 Ott - Dic 2010 Gen - M ar 2011 Apr - Giu 2011 Lug - Set 2011 Ott - Dic 2011
Grafico 1: numero di isolamenti per trimestre nell’AOUP da aprile 2010 a dicembre 2011
Grafico 2: numero di isolamenti di KP-KPC per reparto 87 22 19 11 9 8 8 3 UTI chiru rgia pneu mol ogia emat olog ia neur oria bilit azio ne diab etol ogia mal attie infe ttive altri repa rti N p a z ie n ti
55 23 14 10 7 18 4 4 5 0 sepsi infezioni respiratorie infezioni urinarie infezioni addominali infezioni ossa, cute e tessuti molli N p a z ie n ti
pazienti totali pazienti deceduti
38 33 26 18 3 15 11 12 9 4
tigeciclina gentamicina colistina fosfomicina carbapenemico
N p a z ie n ti
successo terapeutico fallimento terapeutico Grafico 4: antibiotici utilizzati nel trattamento di infezioni da KP-KPC
Riferimenti bibliografici
Borer A, Saidel-Odes L, Riesenberg K, Eskira S, Peled N, Nativ R, Schlaeffer F, Sherf M. Attributable mortality rate for carbapenem-resistant Klebsiella pneumoniae bacteremia. Infect Control Hosp Epidemiol. 2009 Oct;30(10):972-6.
Bratu S, Landman D, Haag R, Recco R, Eramo A, Alam M, Quale J. Rapid spread of carbapenem-resistant Klebsiella pneumoniae in New York City: a new threat to our antibiotic armamentarium. Arch Intern Med. 2005 Jun 27;165(12):1430-5.
Bratu S, Tolaney P, Karumudi U, Quale J, Mooty M, Nichani S, Landman D. Carbapenemase-producing Klebsiella pneumoniae in Brooklyn, NY: molecular epidemiology and in vitro activity of polymyxin B and other agents. J Antimicrob Chemother. 2005 Jul;56(1):128-32.
Calfee D, Jenkins SG. Use of active surveillance cultures to detect asymptomatic colonization with carbapenem-resistant Klebsiella pneumoniae in intensive care unit patients. Infect Control Hosp Epidemiol. 2008 Oct;29(10):966-8.
Cunha BA. Pharmacokinetic considerations regarding tigecycline for multidrug-resistant (MDR) Klebsiella pneumoniae or MDR Acinetobacter baumannii urosepsis. J Clin Microbiol. 2009 May;47(5):1613
Daikos GL, Markogiannakis A. Carbapenemase-producing Klebsiella pneumoniae: (when) might we still consider treating with carbapenems? Clin Microbiol Infect. 2011 Aug;17(8):1135-41.
Daly MW, Riddle DJ, Ledeboer NA, Dunne WM, Ritchie DJ. Tigecycline for treatment of pneumonia and empyema caused by carbapenemase-producing Klebsiella pneumoniae. Pharmacotherapy. 2007 Jul;27(7):1052-7.
Elemam A, Rahimian J, Doymaz M. In vitro evaluation of antibiotic synergy for polymyxin B-resistant carbapenemase-producing Klebsiella pneumoniae. J Clin Microbiol. 2010 Oct;48(10):3558-62.
Elemam A, Rahimian J, Mandell W. Infection with panresistant Klebsiella pneumoniae: a report of 2 cases and a brief review of the literature. Clin Infect Dis. 2009 Jul 15;49(2):271-4.
Endimiani A, Patel G, Hujer KM, Swaminathan M, Perez F, Rice LB, Jacobs MR, Bonomo RA. In vitro activity of fosfomycin against blaKPC-containing Klebsiella pneumoniae isolates, including those nonsusceptible to tigecycline and/or colistin. Antimicrob Agents Chemother. 2010 Jan;54(1):526-9.
Gasink LB, Edelstein PH, Lautenbach E, Synnestvedt M, Fishman NO. Risk factors and clinical impact of Klebsiella pneumoniae carbapenemase-producing K. pneumoniae. Infect Control Hosp Epidemiol. 2009 Dec;30(12):1180-5.
Gupta N, Limbago BM, Patel JB, Kallen AJ. Carbapenem-resistant Enterobacteriaceae: epidemiology and prevention. Clin Infect Dis. 2011 Jul 1;53(1):60-7.
Hirsch EB, Tam VH. Detection and treatment options for Klebsiella
pneumoniae carbapenemases (KPCs): an emerging cause of multidrug-resistant infection. J Antimicrob Chemother. 2010 Jun;65(6):1119-25.
Lee J, Patel G, Huprikar S, Calfee DP, Jenkins SG. Decreased susceptibility to polymyxin B during treatment for carbapenem-resistant Klebsiella pneumoniae infection. J Clin Microbiol. 2009 May;47(5):1611-2.
Livermore DM, Warner M, Mushtaq S, Doumith M, Zhang J, Woodford N. What remains against carbapenem-resistant Enterobacteriaceae? Evaluation of chloramphenicol, ciprofloxacin, colistin, fosfomycin, minocycline, nitrofurantoin, temocillin and tigecycline. Int J Antimicrob Agents. 2011 May;37(5):415-9.
Mouloudi E, Protonotariou E, Zagorianou A, Iosifidis E, Karapanagiotou A, Giasnetsova T, Tsioka A, Roilides E, Sofianou D, Gritsi-Gerogianni N. Bloodstream infections caused by metallo-β-lactamase/Klebsiella pneumoniae carbapenemase-producing K. pneumoniae among intensive care unit patients in Greece: risk factors for infection and impact of type of resistance on outcomes. Infect Control Hosp Epidemiol. 2010 Dec;31(12):1250-6.
Nordmann P, Cuzon G, Naas T. The real threat of Klebsiella pneumoniae carbapenemase-producing bacteria. Lancet Infect Dis. 2009 Apr;9(4):228-36. Patel G, Huprikar S, Factor SH, Jenkins SG, Calfee DP. Outcomes of carbapenem-resistant Klebsiella pneumoniae infection and the impact of
Pournaras S, Vrioni G, Neou E, Dendrinos J, Dimitroulia E, Poulou A, Tsakris A. Activity of tigecycline alone and in combination with colistin and meropenem against Klebsiella pneumoniae carbapenemase (KPC)-producing Enterobacteriaceae strains by time-kill assay. Int J Antimicrob Agents. 2011 Mar;37(3):244-7.
Schwaber MJ, Klarfeld-Lidji S, Navon-Venezia S, Schwartz D, Leavitt A, Carmeli Y. Predictors of carbapenem-resistant Klebsiella pneumoniae acquisition among hospitalized adults and effect of acquisition on mortality. Antimicrob Agents Chemother. 2008 Mar;52(3):1028-33.
Schwaber MJ, Lev B, Israeli A, Solter E, Smollan G, Rubinovitch B, Shalit I, Carmeli Y; Israel Carbapenem-Resistant Enterobacteriaceae Working Group. Containment of a country-wide outbreak of carbapenem-resistant Klebsiella pneumoniae in Israeli hospitals via a nationally implemented intervention. Clin Infect Dis. 2011 Apr 1;52(7):848-55.
Souli M, Galani I, Antoniadou A, Papadomichelakis E, Poulakou G, Panagea T, Vourli S, Zerva L, Armaganidis A, Kanellakopoulou K, Giamarellou H. An outbreak of infection due to beta-Lactamase Klebsiella pneumoniae Carbapenemase 2-producing K. pneumoniae in a Greek University Hospital: molecular characterization, epidemiology, and outcomes. Clin Infect Dis. 2010 Feb 1;50(3):364-73.
Yigit H, Queenan AM, Anderson GJ, Domenech-Sanchez A, Biddle JW, Steward CD, Alberti S, Bush K, Tenover FC. Novel carbapenem-hydrolyzing beta-lactamase, KPC-1, from a carbapenem-resistant strain of Klebsiella pneumoniae. Antimicrob Agents Chemother. 2001 Apr;45(4):1151-61.