INDICE
RIASSUNTO ANALITICO ...
1. INTRODUZIONE ... 1
1.1GAMMA-GLUTAMMILTRANSFERASI (GGT) ... 1
1.1.1 Struttura e localizzazione ... 1
1.1.2. Meccanismo d'azione della GGT e substrati fisiologici ... 3
1.1.3. Funzioni fisiologiche della GGT ... 4
1.1.3.1 Ruolo antiossidante: sintesi del glutatione ... 4
1.1.3.2 Azione pro-ossidante ... 4
1.1.3.3 Escrezione degli acidi biliari ... 5
1.1.3.4 Metabolismo del nitrosoglutatione ... 6
1.1.3.5 Metabolismo dei leucotrieni ... 6
1.1.3.6 Effetti sulla proliferazione cellulare e apoptosi... 7
1.1.3.7 Ruolo della GGT nei tumori e resistenza a farmaci ... 8
1.2LA GGT SIERICA ... 9
1.2.1 Aspetti analitici e strutturali ... 9
1.2.2 Speciazione chimica della GGT nel siero ... 10
1.2.3 Valore predittivo della GGT sierica per le malattie epatobiliari ... 11
1.2.4 Nuovi significati della GGT sierica nelle patologie umane ... 12
1.2.4.1 GGT e rischio cardiovascolare ... 12
1.2.4.2 GGT e aterosclerosi ... 13
1.2.4.3 GGT e rischio metabolico ... 15
1.2.4.4 GGT e nefropatia cronica ... 16
1.2.4.5 GGT e malattie neurologiche ... 17
1.2.5 Frazioni della GGT sierica ... 18
1.3IL TRAPIANTO DI CELLULE STAMINALI EMOPOIETICHE ... 21
1.3.1 Generalità ... 21
1.3.2 Sorgenti di cellule staminali ... 22
1.3.3 Condizionamento e regimi preparativi ... 24
1.3.4 Procedure di trapianto ... 26
1.3.4 Complicanze del trapianto ... 29
1.4GRAFT-VERSUS-HOSTDISEASE ... 33
1.4.1 Definizione ... 33
1.4.2 Patogenesi e fattori di rischio ... 34
1.4.2 GVHD acuta ... 39
1.4.3 GVHD cronica ... 45
1.4.4 Biomarcatori di GVHD ... 49
2.
SCOPO DELLA TESI ... 52
3.
MATERIALI E METODI ... 53
3.1REAGENTI... 53
3.2SOGGETTI PARTECIPANTI ALLO STUDIO ... 53
3.3DETERMINAZIONE DELLE FRAZIONI PLASMATICHE DI GGT ... 55
3.4QUANTIFICAZIONE DELLE FRAZIONI DI GGT ... 57
3.5STATISTICA ... 57
4.
RISULTATI E DISCUSSIONE ... 58
4.2VALUTAZIONE DEL DIVERSO PATTERN DELLE FRAZIONI SIERICHE DI GGT IN CORRELAZIONE ALL’OUTCOME CLINICO DEI PAZIENTI ... 67 4.3VALUTAZIONE DELLA VARIAZIONE DELLE DIVERSE ISOFORME DI GGT NEL TEMPO NEI SOGGETTI TRAPIANTATI 83
5.
CONCLUSIONI ... 87
6.
BIBLIOGRAFIA ... 88
RINGRAZIAMENTI……….….………
RIASSUNTO ANALITICO
Il trapianto di cellule staminali emopoietiche (CSE) è una procedura medica lar-gamente impiegata al giorno d’oggi nel trattamento di molte patologie ematologi-che, sia neoplastiche che non neoplastiche. Le due principali tipologie di trapianto vengono definite “allogenico” ed “autologo”, a seconda che le cellule staminali emopoietiche, reinfuse dopo opportune terapie di condizionamento, derivino ri-spettivamente da un donatore sano o dal paziente stesso.
La GVHD (Graft-versus-host disease, “malattia del trapianto contro l’ospite”) è la principale complicanza immunologica del trapianto allogenico, ed è caratterizzata da una reazione di cellule immunocompetenti del donatore contro tessuti del rice-vente. Le manifestazioni di tale affezione possono colpire diversi tessuti e organi, come cute, fegato, intestino, stomaco, occhio e cavo orale. Fino ad oggi sono stati studiati molti biomarcatori diagnostici per la GVHD; lo studio delle isoforme del-la gamma-glutammiltranferasi (GGT) come potenziale biomarcatore deldel-la GVHD è stato l’oggetto di questo studio.
Abbiamo analizzato un totale di 65 pazienti sottoposti a trapianto di cellule stami-nali emopoietiche (51 trapianti allogenici e 14 autologhi) tra il 2008 e il 2013 presso la U.O. Ematologia Universitaria di Pisa, Centro Trapianti di Midollo. Per ciascun paziente abbiamo raccolto campioni di sangue venoso a tempi prestabiliti, a partire dal giorno d’inizio della chemioterapia di condizionamento.
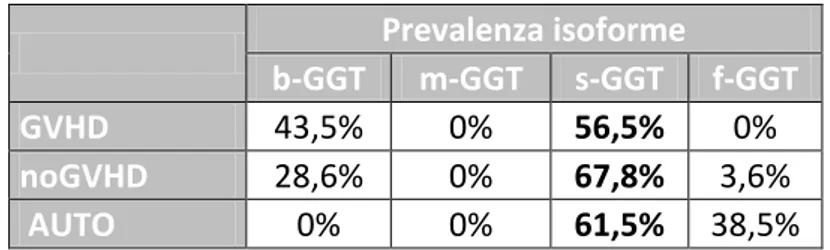
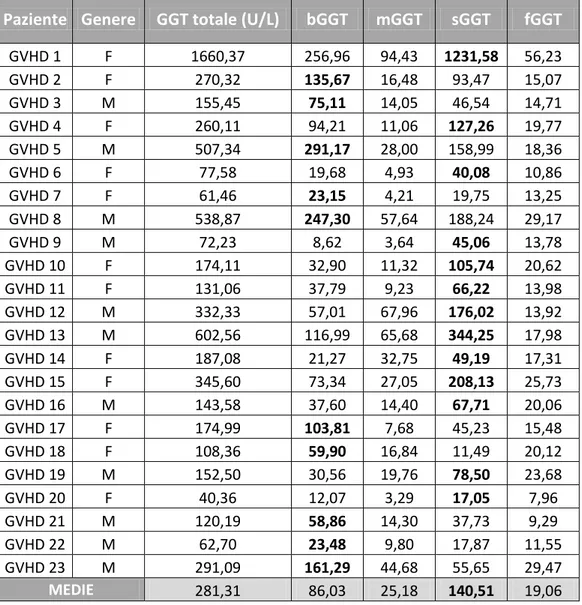
Nella maggior parte dei soggetti analizzati, soprattutto gli allo-trapiantati, abbia-mo osservato un incremento della GGT totale. La frazione con maggiore incre-mento percentuale rispetto al valore basale risulta essere la m-GGT, caratteristica che distingue il nostro gruppo di studio dalla popolazione generale dei soggetti sani, dove la frazione prevalente è la f-GGT, e da altri gruppi di soggetti malati, ad esempio affetti da malattie epatiche, dove prevalgono le forme b-GGT e s-GGT.
Si è poi valutato l’andamento delle frazioni di GGT nei pazienti che sviluppano GVHD, sia acuta che cronica, in seguito a trapianto allogenico. Abbiamo
osserva-to come, soprattutosserva-to nei pazienti trattati con condizionamenosserva-to mieloablativo, ci sia un aumento delle GGT totale al giorno +7 dal trapianto, correlato alla tossicità farmacologica, e come poi nel gruppo di pazienti che sviluppano GVHD si assiste ad un secondo picco di aumento della GGT totale, in corrispondenza della com-parsa delle manifestazioni cliniche di GVHD, a cui contribuiscono maggiormente le isoforme b-GGT e s-GGT. Non abbiamo evidenziato differenze specifiche nell’incremento delle singole frazioni tra le varie manifestazioni cliniche di GVHD (cute, intestino, fegato, stomaco). I valori di GGT totale si normalizzano in seguito ad un’adeguata terapia immunosoppressiva nei pazienti responsivi al trattamento.
Abbiamo osservato un aumento della GGT totale al giorno +7 post-trapianto an-che per i pazienti sottoposti a condizionamenti a ridotta intensità (RIC), ma i valo-ri massimi raggiunti sono minovalo-ri valo-rispetto ai trapianti mieloablativi; anche in que-sto caso prevalgono le isoforme b-GGT e s-GGT. Nei trapianti autologhi, la GGT si mantiene nella maggior parte dei casi all’interno del range di riferimento; quan-do aumenta, si ha un incremento consensuale di tutte le frazioni.
Per quanto riguarda la mortalità trapianto correlata (TRM), abbiamo notato che nel gruppo dei pazienti deceduti, circa il 50% di tutti i soggetti indagati (molti dei quali erano ad alto rischio e pluritrattati), si ha un aumento di tutte le frazioni di GGT in corrispondenza del giorno +7 dal trapianto, dato che conferma precedenti studi sulla TRM; in particolare si ha un aumento della b-GGT rispetto alle altre isoforme.
In conclusione, lo studio delle frazioni della GGT plasmatica nei soggetti sottopo-sti a trapianto di CSE ha rivelato una notevole diversità nel comportamento delle stesse nelle fasi immediatamente precedenti e seguenti alla procedura. Sebbene i risultati, allo stato attuale, appaiano ancora preliminari a causa della modesta nu-merosità campionaria in esame, è già evidente che ciascuna frazione assume nel tempo andamenti diversi non solo rispetto alle altre frazioni, ma anche rispetto all’esito della procedura e agli eventi associati alla GVHD.
L’attribuzione di uno specifico significato fisiopatologico alle variazioni di cia-scuna frazione di GGT potrebbe fornire in futuro un utile strumento diagnostico e prognostico nell’ambito dei trapianti di midollo.
1
1. INTRODUZIONE
1.1 γ-glutammiltransferasi (GGT)
1.1.1 Struttura e localizzazione
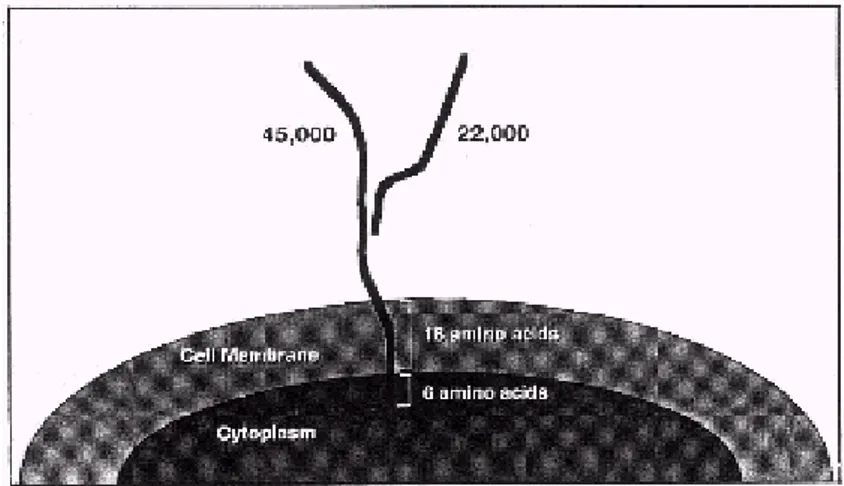
La GGT è una glicoproteina di membrana di tipo II, costituita da una sub unità pesante (380 amminoacidi, 55-62 KDa) e una leggera (189 amminoacidi, 20-30 KDa) unite da legami non covalenti. L'inserzione dell'enzima nella membrana cellulare è garantito da un dominio idrofobico trans-membrana in posizione N-terminale della catena pesante. Il dominio intracellulare è costituito da quattro amminoacidi, mentre la restante porzione della proteina si trova nell'ambiente ex-tracellulare1 e corrisponde alla catena leggera, che agisce su substrati all'esterno della cellula2.
Fig 1.1 Rappresentazione della GGT. Il sito catalitico dell’enzima è sulla
sub unità leggera situata sul lato extra-cellulare della membrana. La GGT pertanto agisce su substrati extra-cellulari. (Hanigan,1998).
2 Nei mammiferi, grazie a studi di immunoistochimica, è stato dimostrato che la GGT è situata sulla membrana di tutte le cellule ed è preferenzialmente localizza-ta nei tessuti epiteliali con attività secretoria e di assorbimento3.
Nel rene, in particolare sulla superficie luminale delle cellule del tubulo contorto prossimale, è stata osservata la più alta attività di GGT, mentre le cellule del tu-bulo distale e dei glomeruli ne sono prive.
Nel fegato l'attività della GGT si ritrova a livello delle cellule epiteliali delle vie biliari extraepatiche e dei canalicoli epatici, mentre nel pancreas la maggior atti-vità si trova nelle cellule acinose. Attiatti-vità di GGT è stata ritrovata anche nelle cellule delle ghiandole sudoripare, delle ghiandole sottomandibolari, dei dotti ga-lattofori, dell'epitelio bronchiale, dell'epididimo, delle vescicole seminali, e della prostata.
Marcata immunoreattività è stata osservata anche sulla superficie delle cellule endoteliali del corpo ciliare, del midollo spinale, dei capillari del cervello, come ad esempio nel plesso coroideo e negli astrociti che avvolgono questi ultimi. A livello cerebrale l'attività della GGT sembra contribuire alla funzionalità della barriera ematoencefalica, favorendo il metabolismo dei leucotrieni e la detossifi-cazione degli xenobiotici4.
É possibile individuare l'attività di GGT anche sulla membrana e nei granuli in-tra-citoplasmatici delle piastrine, dei granulociti e dei linfociti, il cui aumento di attività è considerato come un marcatore di differenziazione e trasformazione neoplastica5. L'attività della GGT è presente anche nel siero, dovuta probabilmen-te al rilascio da parprobabilmen-te delle membrane cellulari dei parenchimi dei vari organi6. La GGT è una glicoproteina altamente glicosilata e, in base alla sequenza prima-ria, sono state individuate sei possibili sequenze consenso di N-glicosilazione. La N-glicosilazione rappresenta il 25-30% della massa totale della GGT ed è tessuto-specifica, infatti la GGT purificata da organi diversi presenta un diverso peso mo-lecolare e, quindi, una diversa mobilità elettroforetica. Ha, inoltre, punti isoelet-trici differenti in dipendenza dal contenuto di acido sialico. Per questa eterogeni-cità di glicosilazione si può pensare ad “isoforme” enzimatiche per la GGT, men-tre non sono stati individuati isoenzimi per la sequenza amminoacidica.
3
1.1.2. Meccanismo d'azione della GGT e substrati fisiologici
La GGT catalizza la scissione del legame γ-glutammilico tra il gruppo carbossile in posizione γ dell'acido glutammico e un'ammina, e il successivo trasferimento dell'acido glutammico formatosi su un accettore. La reazione catalizzata dalla GGT segue un meccanismo definito a “ping-pong”1: nello stadio di acilazione il gruppo γ-glutammilico della molecola substrato è trasferito sul gruppo OH della Thr N-terminale della catena leggera ed è liberata l'ammina. L'intermedio acil-enzima lega una molecola accettore e, in seguito, nel successivo stadio di deacila-zione, l'acido glutammico è trasferito sul gruppo amminico dell'accettore con la formazione di un nuovo legame-glutammilico. Questo processo rappresenta una reazione di transpeptidazione. In mancanza di un accettore l'acil-enzima può rea-gire anche con una molecola d’acqua con la liberazione di acido glutammico con una reazione di idrolisi.
Figura 1.2. Reazione catalizzata dalla GGT (Hanigan, 1998).
In questo genere di reazione la GGT è molto specifica per il tipo di legame quan-to è aspecifica per il substraquan-to, quesquan-to perché solo la posizione γ-glutammilica è critica per il legame con l'enzima GGT; tutti i γ-glutammilcomposti sono quindi possibili substrati per la GGT. I principali substrati fisiologici della GGT sono il glutatione o γ-glutammilcisteinglicina (GSH), il leucotriene C4 (coniugato del GSH), i coniugati del glutatione prodotti dalla GSH-transferasi e il nitrosogluta-tione. La GGT riconosce solo gli L-amminoacidi (Cis, Met, Gln, Glu) o i dipepti-di amminoacilglicina come molecola accettore.
4
1.1.3. Funzioni fisiologiche della GGT
L'enzima GGT è coinvolto in diverse funzioni fisiologiche, e in alcuni casi queste funzioni risultano essere contrapposte, come ad esempio la duplice azione anti-ossidante e pro-anti-ossidante.
1.1.3.1 Ruolo antiossidante: sintesi del glutatione
La GGT ha un importante ruolo antiossidante, può infatti dare inizio alla degra-dazione del glutatione extracellulare, permettendo la captazione da parte della cellula degli amminoacidi che lo costituiscono. Il mantenimento della concentra-zione intracellulare del glutatione (γ-glutammilcistenilglicina, GSH) è fondamen-tale per la sopravvivenza delle cellule7 poiché il GSH ha molte funzioni biologi-che importanti, tra cui: la coniugazione di composti elettrofili, il mantenimento dello stato redox dell'ambiente intracellulare attraverso reazioni di interscambio tiolico e azione scavenger dei radicali liberi. É inoltre cofattore di enzimi con funzione anti-ossidante (perossidasi, deidroascorbato reduttasi GSH-dipendente).
La concentrazione intracellulare di glutatione dipende dall'equilibrio che si viene a creare tra la sua sintesi, regolata dall'apporto di amminoacidi costituenti, e il suo consumo. L'enzima γ-glutammiltransferasi avrebbe quindi un ruolo protettivo contro il danno ossidativo intracellulare8, poiché è considerato un enzima ancilla-re dei sistemi antiossidanti basati sul glutatione.
1.1.3.2 Azione pro-ossidante
La GGT ha anche un’azione pro-ossidante: in presenza di metalli di transizione, come il ferro (Fe3+) e il rame (Cu2+), favorisce la formazione di specie reattive dell'ossigeno (ROS) nell'ambiente extracellulare. L'equilibrio tra l'azione
antiossi-5 dante e quella pro-ossidante dipende quindi dalla disponibilità degli ioni metallici e, in particolare, di Fe3+.
La produzione di un'eccessiva quantità di specie reattive dell'ossigeno, da parte del catabolismo del glutatione, può provocare mutazioni genetiche9 o innescare il processo di perossidazione lipidica (LPO).
In particolare è stato dimostrato che le reazioni pro-ossidanti conseguenti all’azione di GGT:
sono responsabili dell’ossidazione dei tioli esposti sulla superficie della membrana cellulare per azione del perossido di idrogeno10;
rappresentano uno stimolo pro-apoptotico per la linea cellulare di cancro dell’ovaio A2780, ma anche anti-apoptotico per la linea cellulare di lin-foma istiocitario U93710;
promuovono il legame con il DNA dei fattori di trascrizione NF-kB e AP111;
modulano lo stato di ossido-riduzione dei domini ricchi in Cys del recetto-re TNFR-I12.
1.1.3.3 Escrezione degli acidi biliari
A livello epatico, l’attività di GGT è regolata dagli acidi biliari liberi e coniugati. Gli acidi biliari liberi (colato, chenodesossicolato, desossicolato) stimolano l’attività enzimatica della GGT con conseguente incremento delle reazioni di idrolisi e di transpeptidazione del GSH fondamentali per il rifornimento di ammi-noacidi utilizzati nei processi di coniugazione. Gli acidi biliari coniugati con gli-cina e taurina stimolano la reazione di idrolisi a livello di dotti biliari, ma inibi-scono quella di transpeptidazione con un meccanismo di feed-back negativo, ri-ducendo così la disponibilità degli amminoacidi necessari per la formazione dei coniugati13.
6
1.1.3.4 Metabolismo del nitrosoglutatione
Altra importante funzione della GGT si ha sul nitrosoglutatione, trasportatore del monossido di azoto. Quest’ultimo è un mediatore di diverse funzioni biologiche: è in grado di regolare il tono vascolare con funzione vasodilatatrice, di inibire l'aggregazione piastrinica, ha funzione di neurotrasmettitore e, in quanto radicale, può agire come pro-ossidante con un’azione citotossica, o come anti-ossidante. Poiché l'emivita del monossido di azoto è di pochi millisecondi, i suoi effetti di-retti si osservano nel sito di formazione della molecola. Tuttavia, l' NO può essere stabilizzato e trasportato14, reagendo con gruppi tiolici di proteine come albumina ed emoglobina, o con tioli a basso peso molecolare quali glutatione, CysGly, Cys e omocisteina, in modo da formare con essi i nitroso tioli (RSNO). In particolare, il nitrosoglutatione (GSNO) ha numerose attività farmacologiche simili a quelle del monossido di azoto libero15. Essendo il nitrosoglutatione un trasportatore del monossido di azoto, l'azione dell'enzima GGT, ovvero la trasformazione del ni-trosoglutatione in nitrosocistenil-glicina (CG-SNO) che, in presenza di ioni me-tallici di transizione, si dissocia spontaneamente in Cys-Gly e NO16, potrebbe permetterne l'utilizzo favorendo la dissociazione del nitrosoglutatione stesso, e probabile bersaglio potrebbero essere proprio i vasi sanguigni perché la GGT è espressa dalle cellule endoteliali.
1.1.3.5 Metabolismo dei leucotrieni
La GGT è implicata nel metabolismo dei leucotrieni (LTs), classe di mediatori lipidici attivi nell'infiammazione, derivati dal turnover dell'acido arachidonico per azione dell'enzima lipossigenasi, che vengono sintetizzati e rilasciati dai leucociti e dalle cellule dei tessuti sottoposti a stimolo infiammatorio. Questa classe di mo-lecole comprende: il diidrossieicosatetraenolato LTB4 e i cisteinil-leucotrieni (LTC4, LTD4, LTE4) che rappresentano composti biologicamente attivi, cono-sciuti come “sostanze della risposta lenta all'anafilassi”. L'LTA4 è il precursore sia del LTB4 che dei cistenil-leucotrieni. Il LTC4 deriva dal LTA4, dopo aver
7 reagito con una molecola di GSH, e, a sua volta, è convertito in LTD4 (glicilci-steinil-LT) dall'attività enzimatica della GGT. La successiva idrolisi del residuo di Gly porta alla formazione del LTE4 (cisteinil-LT)17. I leucotrieni C4 e D4 si legano sulle cellule muscolari lisce a specifici recettori e possono provocare pro-lungata broncocostrizione18, ma anche esercitare una potente azione vasocostrit-trice sulle arterie coronarie. É stato ipotizzato, inoltre, che i cisteinil-LTs svolga-no un ruolo importante e attivo nella patogenesi e nelle manifestazioni cliniche dell'aterosclerosi. In modelli animali di ischemia è stato dimostrato che inibitori dell'enzima 5-lipossigenasi e antagonisti dei recettori per i cisteinil-LTs sono ef-ficaci per ridurre l'estensione dell'infarto e dell'aritmia indotta da riperfusione. É stato osservato che le lesioni aterosclerotiche si associano ad una più marcata espressione dei recettori per i cisteinil-LTs19. Tuttavia, non è ancora definito se i tre cisteinil-LTs presentino la stessa attività biologica, come non è certo il ruolo dell'enzima GGT nel processo infiammatorio.
1.1.3.6 Effetti sulla proliferazione cellulare e apoptosi
L’apoptosi ha un importante ruolo biologico di regolazione nella maggior parte dei processi fisiologici come il differenziamento, l’omeostasi e la rimozione di cellule anormali in tutti i tessuti. Il controllo del meccanismo di morte cellulare programmata è modificato se non addirittura eliminato in cellule tumorali. E’ no-ta da tempo l’interconnessione tra proliferazione cellulare, regolazione del ciclo e apoptosi, tanto che un’alterazione del ciclo cellulare, peraltro inevitabilmente presente nelle cellule cancerose, può influenzare in maniera diretta la sensibilità della cellula agli stimoli apoptotici20.
I dati raccolti nel corso di ricerche sulla linea cellulare di carcinoma ovarico umano A2780 hanno messo in evidenza come l’H2O2 e l’ossidazione dei tioli
prodotti dall’attività di GGT durante il catabolismo del GSH svolgessero una azione anti-proliferativa, mentre, nella linea cellulare U937 di istiocitoma umano, Del Bello e collaboratori hanno osservato che la produzione di specie ossidanti mediata dalla GGT costituiva uno stimolo anti-apoptotico per le cellule e di
con-8 seguenza l’inibizione dell’enzima determinava arresto della crescita e frammen-tazione del DNA caratteristica dell’apoptosi21
.
1.1.3.7 Ruolo della GGT nei tumori e resistenza a farmaci
La GGT è espressa in condizioni fisiologiche in numerosi organi e tessuti ed è stata trovata espressa ad alti livelli in lesioni maligne e premaligne, nelle quali è considerata un fattore conferente un vantaggio moltiplicativo per le cellule neo-plastiche. Inoltre l’attività di GGT sembra essere coinvolta nella resistenza delle cellule maligne ai farmaci alchilanti22.
Il vantaggio sulla crescita cellulare si pensa sia dovuto al fatto che la GGT, con la sua attività, favorisce la ricostituzione del GSH intracellulare e, conseguentemen-te, fornisce una protezione nei confronti del danno ossidativo. Inoltre, la GGT permette lo sfruttamento del GSH extracellulare come fonte di cisteina, ammi-noacido essenziale e limitante la sintesi proteica.
Come è stato già detto, la GGT cellulare può influenzare il ciclo cellulare (proli-ferazione e apoptosi) e modulare l’attività di numerose proteine come recettori o fattori di trascrizione (TNFR1, NF-kB).
Il catabolismo del GSH extracellulare ad opera della GGT di membrana genera il dipeptide Cys-Gly; sono state fatte importanti osservazioni circa un ruolo di que-sto dipeptide nella resistenza ai farmaci antiblastici dei tumori che esprimono GGT. È stato dimostrato che la Cys-Gly formaun complesso con il cis-diammino-dicloro-platino (CDDP) riducendo la citotossicità del farmaco23.
9
1.2 La GGT sierica
1.2.1 Aspetti analitici e strutturali
L'enzima GGT può essere determinato nel plasma, con l'utilizzo di anticoagulante eparina o litio eparina e nel siero, anche se il campione preferito è il siero. Nel sangue a temperatura ambiente l'enzima è poco stabile e si osservano abbassa-menti significativi nell'arco della giornata, mentre nel plasma e nel siero l'enzima è stabile per anni a -20° C e per circa una settimana a 4-8° C oppure a 20-25° C24. Numerose variabili preanalitiche di tipo biologico sono in grado di causare varia-zioni della concentrazione di attività catalitica dell'enzima nel sangue interferen-do con i valori misurabili della GGT. Alcune possibili variabili sono rappresenta-te da: età, genere, gravidanza, parto, etnia, fumo di sigaretta e uso di contraccetti-vi orali.
Dal 1961 la determinazione della GGT sierica è usata come indicatore diagnosti-co di disfunzione epatica25, neoplasie e abuso di alcool26. La misura dell'attività sierica della GGT viene effettuata con un semplice test di laboratorio che utilizza, come substrato, la γglutamil-p-nitroanilide ed è considerato il marcatore più sen-sibile nella diagnosi di colestasi e di steatosi epatica. Tuttavia l’esame è caratte-rizzato da una bassa specificità visto il numero elevato di condizioni cliniche in cui ne viene rilevato un aumento (pancreatiti, diabete, obesità, abuso d’alcool, farmaci). L'aumento della GGT sierica può essere riscontrato anche in persone con epatopatia cronica, dovuta ad infezione da HCV. In questo caso può rappre-sentare un indice prognostico sfavorevole di risposta al trattamento con interfero-ne27. Quindi nonostante la sensibilità del test, l'uso diagnostico della GGT sierica è limitato dalla bassa specificità.
10
1.2.2 Speciazione chimica della GGT nel siero
La GGT che si ritrova nel siero sembra derivare dal fegato, come suggeriscono le sue caratteristiche chimico-fisiche e cinetiche. La GGT sierica ed epatica presen-tano uguale peso molecolare, tipo di glicosilazione, contenuto di acido sialico, stesso punto isoelettrico e caratteristiche cinetiche simili, ma diverse rispetto all'enzima purificato dal pancreas, dal rene o dalle urine28.
La GGT sierica può essere suddivisa in due frazioni, una idrofilica ed una idrofo-bica con caratteristiche diverse per densità, dimensione e carica.
La frazione idrofobica, a sua volta, è formata da un insieme di complessi moleco-lari, costituiti probabilmente da GGT trasportata dalle lipoproteine sieriche VLDL, LDL, HDL, e chilomicroni grazie al dominio lipofilico, situato all'estre-mità N-terminale della catena pesante della GGT, responsabile della normale in-serzione dell'enzima nella membrana plasmatica. La frazione idrofilica sarebbe, invece, costituita da GGT priva del peptide lipofilico N-terminale, quindi non le-gata ad alcun trasportatore plasmatico. La parte idrofilica rappresenta circa il 60-70% dell'attività totale nei soggetti normali, mentre solo il 15-30% nei pazienti con patologie epatiche, in cui si osserva un marcato aumento della componente idrofobica, probabilmente costituita da enzima associato alle lipoproteine plasma-tiche29.
In uno studio di Huseby del 1982, la GGT sierica è stata sottoposta a cromatogra-fia per esclusione molecolare, che ha consentito di separare tre picchi di attività: il picco I di PM di circa 1000 kDa, il picco II con PM compreso tra 250 e 450 kDa, il picco III corrispondente all'enzima libero e solubile. Successive indagini hanno permesso di stabilire che nel picco I veniva eluita attività di GGT associata alle VLDL e alle LDL; il picco II, invece, sembrava essere formato da GGT asso-ciata alle lipoproteine HDL.
In uno studio condotto successivamente da Wenham e collaboratori del 1984, la GGT sierica è stata separata, tramite cromatografia per esclusione molecolare, in tre frazioni con PM relativo di 1000 kDa, 250-500 kDa e circa 120 kDa. In questo studio l’attenzione è stata focalizzata principalmente sulla frazione di GGT con PM intermedio (250-500 kDa) isolata da pazienti con malattie epatiche. Anche in
11 questo studio è stato dimostrato che tale frazione consisteva in un complesso tra GGT e lipoproteine ad alta densità (HDL). Inoltre le proprietà fisiche di questa frazione, sia la carica che la massa, potevano essere alterate in seguito all’incubazione del siero con la bile30
.
La GGT sierica è quindi un insieme eterogeneo di complessi o frazioni solo in parte caratterizzati nella struttura e nella composizione, per i quali è ancora sco-nosciuto il meccanismo di rilascio in circolo. Si pensa che le forme ad alto peso molecolare possano essere costituite da GGT associata a lipoproteine29, o da frammenti di membrana plasmatica, derivante dagli epatociti31.
1.2.3 Valore predittivo della GGT sierica per le malattie
epatobi-liari
Il problema della natura fisica delle isoforme (frazioni) della GGT sierica non può essere disgiunto da quello del suo valore diagnostico e predittivo, infatti seb-bene la GGT venga eseguita come esame di routine fino dagli anni ’6025
, solo re-centemente è emersa la complessità del suo coinvolgimento con la patologia umana. Sebbene tradizionalmente l’elevazione della GGT sierica sia stata asso-ciata alle malattie epatobiliari ed all’abuso di alcool, studi recenti hanno rivelato una straordinaria complessità, che può essere riassunta in uno schema per cui, mentre valori di GGT superiori alla norma sono diagnostici per danno epatico, valori di GGT all’interno dell’intervallo di riferimento, ma nella parte alta dello stesso hanno valore predittivo nei confronti della malattie cardiovascolari connes-se con l’aterosclerosi32
.
Logicamente, il complesso delle patologie epatiche associate a valori patologici di GGT è assai eterogeneo e a tali valori di GGT si osservano anche nelle malat-tie renali33 e in caso di abuso di alcool26. La determinazione della GGT non per-mette di fare una distinzione tra questi diversi gruppi di pazienti, ne consente di identificare i numerosi soggetti che mostrano valori elevati di GGT in assenza di malattia o di abuso di alcool.
12 Per tale motivo negli ultimi anni si sono rese disponibili diverse tecniche capaci di individuare diverse frazioni di GGT, ognuna associata ad un diverso rischio di malattia34. Queste tecniche, purtroppo, non sono mai entrate a far parte della pra-tica clinica a causa della scarsa sensibilità e dell'altrettanto scarsa riproducibilità.
1.2.4 Nuovi significati della GGT sierica nelle patologie umane
A partire dagli anni '80 è emersa l’importanza della GGT sierica, per valori all' interno dell’intervallo di riferimento, come fattore di rischio di mortalità per nu-merose cause, indipendentemente da patologie epatiche e dal consumo di alcool. Nei diversi studi epidemiologici è stato approfondito il significato della GGT sie-rica nella patologia umana ed è stata dimostrata la sua importanza come fattore di rischio indipendente di mortalità per tutte le cause, per cause vascolari legate ad aterosclerosi e insorgenza di diabete di tipo 2, di ipertensione, di sindrome meta-bolica e di nefropatia cronica.
1.2.4.1 GGT e rischio cardiovascolare
Dai primi studi epidemiologici è emerso che livelli moderatamente elevati di GGT (> 24 U/L) erano associati ad un importante aumento di mortalità per car-diopatia ischemica35, tale aumento risultava più evidente in pazienti con un pre-cedente infarto del miocardio al momento del reclutamento nello studio. Da qui l'ipotesi dell'esistenza di un collegamento tra GGT sierica e l'evoluzione della malattia aterosclerotica, ulteriormente sostenuta da altri studi effettuati su popola-zioni con sindrome ischemica e malattia coronarica accertata, e dall'osservazione che la GGT sierica risulti associata anche a un'aumentata incidenza di ictus emor-ragico36.
Un recente studio prospettico, condotto su soggetti adulti austriaci, ha confermato che i livelli di GGT nel siero sono un fattore prognostico indipendente per eventi fatali di forme croniche di malattia coronarica e per eventi cardiaci acuti; tale
13 conclusione è vera per entrambi i sessi ed ha una maggiore importanza in soggetti giovani (< 60 anni). Anche per questo studio i valori considerati prognostici per eventi cardiovascolari sono all'interno dell'intervallo fisiologico, e sono stati pro-posti come valori soglia per discriminare i soggetti a rischio 28 U/L per gli uomi-ni e 18 U/L per le donne37.
Dopo questo, ulteriori studi condotti sempre sulla popolazione generale, hanno confermato ulteriormente il significato prognostico dell'attività sierica di GGT per le malattie cardiovascolari38. Da questi studi è stato evidenziato che il valore prognostico dell'attività sierica della GGT è più forte nei soggetti giovani, nei diabetici e che i livelli sierici di GGT sono indicatori indipendenti per l'insorgen-za della sindrome metabolica.
In tutti gli studi la GGT continua ad essere un fattore prognostico indipendente rispetto alla patologia cardiovascolare anche dopo che l'analisi statistica è stata aggiustata per età, genere, consumo di alcool e per i noti fattori di rischio cardio-vascolare (dislipidemia, pressione arteriosa, insulino-resistenza, fumo).
1.2.4.2 GGT e aterosclerosi
L'ipotetico legame tra la GGT sierica e la patologia aterosclerotica ha avuto con-ferma grazie ad uno studio prospettico della durata di sei anni36, che ha coinvolto pazienti con sindrome ischemica e malattia coronaria documentata angiografica-mente. Dopo un’adeguata correzione per gli altri fattori di rischio cardiovascolare (età, fumo, colesterolo, diabete mellito e indice di massa corporea) e per fattori confondenti come il consumo di alcool, viene confermato il valore prognostico dell'attività della GGT sierica per morte cardiaca e infarto non fatale. In particola-re, il significato prognostico della GGT sierica è più evidente in pazienti con ate-rosclerosi diffusa e un precedente infarto del miocardio. Il rischio aumenta usan-do due differenti valori soglia della GGT (25 o 40 U/L) e la maggior parte degli eventi cardiaci sono concentrati nei primi tre anni dopo il primo infarto. Il signifi-cato prognostico dell'enzima si osserva essere associato alla diffusione delle le-sioni aterosclerotiche nelle arterie coronariche. Il valore prognostico perde di
si-14 gnificato in soggetti sottoposti a rivascolarizzazione con angioplastica o by-pass, procedure che portano alla stabilizzazione della placca39. La prognosi sfavorevole sembra, quindi, essere applicabile in individui con placche vulnerabili, e fa pensa-re ad una associazione tra la GGT e i processi coinvolti nella destabilizzazione della placca36.
Studi istochimici hanno dimostrato la presenza di un elevata attività di GGT nella placca aterosclerotica a livello del core lipidico dove si accumulano anche le li-poproteine LDL ossidate40.
Fig. 1.3: Co-localizzazione dell’attività di GGT con le LDL ossidate. Placca di un’arteria
cerebrale umana: (A) dimostrazione istochimica dell’attività di GGT; (B) immunofluore-scenza indiretta per le LDL ossidate (Emdin et al, 2002).
Nella placca aterosclerotica è presente glutatione, substrato della GGT, oltre a deposito di ferro, lipidi ossidati, ferro redox attivo e un accumulo di ferritina, ul-teriore possibile fonte di Fe3+ per la GGT. In questo contesto possono essere fa-vorite reazioni pro-ossidanti per azione della GGT come descritto nei paragrafi precedenti. Lo stress ossidativo indotto dall'azione della GGT a questo livello po-trebbe contribuire alla progressione e alla destabilizzazione della placca atero-sclerotica favorendo l'ossidazione delle LDL41.
15 La GGT presente nella placca potrebbe avere due origini distinte: una endogena, prodotta dagli elementi della placca come le cellule infiammatorie, ipotesi soste-nuta dalla presenza di mRNA per la GGT42, ed una esogena derivante dal traspor-to dell'enzima dalle lipoproteine come le LDL stesse.
1.2.4.3 GGT e rischio metabolico
Come si evince dai capitoli precedenti, l’attività della GGT è positivamente lega-ta a riconosciuti fattori di rischio cardiovascolare; lega-tale enzima ha però anche un ruolo come marcatore di alterato metabolismo lipidico e glucidico: resistenza in-sulinica e diabete, indice di massa corporea (BMI), ipertensione e dislipidemia (trigliceridi alti e colesterolo HDL basso).
In soggetti con alterata tolleranza glucidica o con diabete mellito di tipo 2, la GGT è tendenzialmente più elevata rispetto a gruppi di controllo. In uno studio prospettico eseguito su giovani adulti non diabetici, è stato dimostrato che la GGT, per valori all'interno della distribuzione normale, predice l'insorgenza di diabete di tipo 243 indipendentemente dal consumo di alcol e dal BMI.
É emersa anche l'esistenza di un interazione tra i livelli di GGT e il BMI nel pre-dire l'insorgenza di diabete, in quanto il rischio di ammalarsi di diabete aumenta progressivamente all'aumentare dei valori di GGT e tale associazione diviene più forte all'aumentare del BMI. Quest'ultimo, invece, è associato con l'insorgenza di diabete solo per valori di GGT oltre i 22 U/L, mediana della distribuzione44. Un'ipotesi alternativa considera la possibilità che l'elemento scatenante del diabe-te possa essere rappresentato dalle sostanze inquinanti organiche persisdiabe-tenti che si ritrovano nel tessuto adiposo aumentato a causa di obesità, eccessivo apporto ca-lorico e ridotta attività fisica. Queste sostanze, a loro volta, sarebbero responsabili dell'aumento della GGT poiché l’enzima è associato, come visto nei paragrafi precedenti, alle difese antiossidanti e ai sistemi di detossificazione44.
La forte correlazione positiva tra GGT e obesità, quantificata nel BMI, è stata confermata anche in soggetti non diabetici. In particolare, l'aumento della GGT è prevalentemente associata a una distribuzione della massa grassa di tipo centrale,
16 infatti, in maniera indipendente dal BMI, è correlata con il rapporto di circonfe-renze vita-fianchi, con il contenuto di grasso viscerale a livello dell'area addomi-nale, ma non con l'adiposità sottocutanea45.
Una correlazione positiva è stata individuata anche tra i livelli sierici di GGT, sempre all'interno dei valori di riferimento, e pressione arteriosa sistolica e
dia-stolica. Questa associazione è risultata indipendente dal consumo di alcool,
dall'età, dall'attività fisica e dal BMI. Tuttavia da alcuni studi l'associazione tra GGT e pressione arteriosa è risultata essere condizionata dalla distribuzione dell'adiposità in quanto la GGT sierica è significativamente associata con l'inci-denza di ipertensione solo nei soggetti con aumentati indici di obesità addominale (BMI > 26 Kg m-2, circonferenza vita > 86 cm, altezza addominale > 19 cm)46. Infine, è stato dimostrato che la GGT sierica è un fattore predittivo indipendente di insorgenza di sindrome metabolica47. La sindrome metabolica comprende una serie di fattori di rischio, quali alterata glicemia a digiuno, diabete, obesità, iper-tensione e ipertrigliceridemia, fattori questi per i quali è descritta un'associazione positiva e indipendente con i livelli sierici di GGT.
1.2.4.4 GGT e nefropatia cronica
L'ipotesi che la GGT sierica possa essere un indicatore precoce di sviluppo di ne-fropatia cronica (“chronic renal disease”, CRD) è stata analizzata in un recente studio prospettico, condotto su uomini adulti non diabetici, normopeso, e con normale funzione renale33. In questo studio è stata osservata una correlazione po-sitiva tra aumento dei valori di GGT sierica e rischio di insorgenza di CRD, con un rischio relativo nel quartile più alto (GGT ≥ 40 U/L) della distribuzione della GGT rispetto al primo quartile (GGT < 18 U/L) di 1,9 dopo correzione dell'anali-si statistica per età, livelli basali di velocità di filtrazione renale, trigliceridi e co-lesterolo HDL.
17
1.2.4.5 GGT e malattie neurologiche
La distrofia miotonica è una malattia genetica neuromuscolare degenerativa a ca-rattere autosomico dominante, caratterizzata da un quadro clinico ampiamente va-riabile e da un decorso lentamente progressivo, il cui esordio può avvenire a qua-lunque età. Rappresenta la seconda forma di distrofia muscolare più diffusa dopo la distrofia muscolare di Duchenne, ed è la più frequente forma di distrofia mu-scolare dell’adulto. Il quadro clinico è caratterizzato da perdita di massa muscola-re, miotono, cataratta, anomalie del sistema di conduzione cardiaco, alterazioni endocrine e riproduttive, diabete mellito e deficit cognitivi nei casi congeniti. La distrofia miotonica è causata da un’esagerata ripetizione di una tripletta nu-cleotidica localizzata nella regione 3 non traslata del braccio lungo del cromoso-ma 19 (19q13.3), in corrispondenza del gene che codifica per la proteina DMPK (“Myotonic Dystrophy protein kinase”).
La patogenesi della malattia rimane ancora sconosciuta, ma studi eseguiti su fi-broblasti murini con presenza della tripletta anomala, dimostrano che queste cel-lule sono molto più sensibili allo stress ossidativo in vitro48, mentre in vivo i sog-getti affetti da distrofia miotonica hanno livelli aumentati di radicali liberi in cir-colo49.
Uno studio condotto da Siciliano et al., basato sulla concentrazione di AOPPs (“advanced oxidation protein product”), una famiglia di proteine che si formano in seguito all’esposizione a vari ossidanti, e di GGT sierica, ha mostrato che en-trambi i parametri presi in considerazione appaiono significativamente aumentati nei pazienti con MD1 rispetto al gruppo di controllo, avvalorando l’ipotesi che lo stress ossidativi possa avere un ruolo cruciale nella patogenesi della malattia50 (Siciliano G. et al, 2005).
La sclerosi laterale amiotrofica (SLA) è una malattia degenerativa caratterizzata dalla progressiva perdita dei motoneuroni delle corna anteriori del midollo spina-le, del bulbo e della corteccia. La causa della morte dei motoneuroni rimane ad oggi sconosciuta, anche se recentemente ha preso campo l’ipotesi di un possibile ruolo dello stress ossidativo. Questa ipotesi è avvalorata dal fatto che una muta-zione del gene che codifica per la superossido dismutasi-1 (SOD-1) è
responsabi-18 le approssimativamente del 20% dei casi familiari e viene trasmesso come carat-tere dominante51.
Successivi studi hanno confermato la presenza di stress ossidativo nella SLA, in-dicando come i suoi effetti possano essere stratificati e quindi implicati differen-temente nella patogenesi delle diverse forme cliniche della SLA52.
1.2.5 Frazioni della GGT sierica
Sono stati messi a punto diversi metodi per la separazione e quantificazione delle frazioni circolanti dell'enzima con lo scopo di migliorare la specificità della de-terminazione della GGT. Il metodo più utilizzato per lo studio delle frazioni cir-colanti di GGT in ambito clinico, è basato sull'elettroforesi in acetato di cellulosa, ma, anche, su gel di agarosio e poliacrilammide.
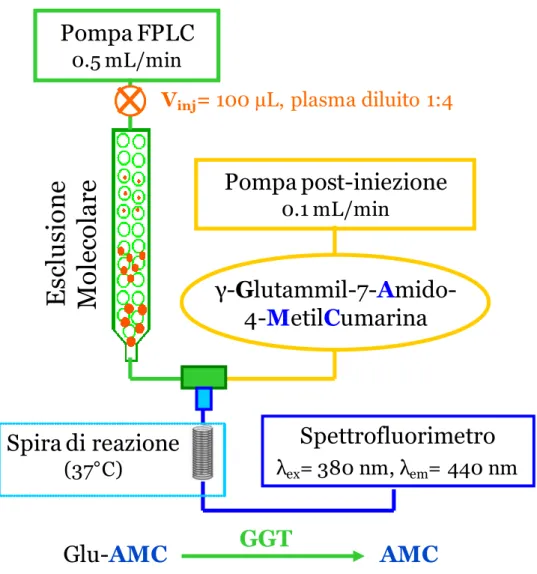
Recentemente è stato proposto un metodo alternativo di separazione per la deter-minazione delle frazioni di GGT, basato su un sistema FLPC (“fast liquid protein
crhomatography”)53
.
Diversamente dalle tecniche di routine, che consentono di valutare le frazioni di GGT solo nei soggetti con valori molto elevati dell'enzima, la nuova procedura consente lo studio della GGT in tutti i soggetti, compresi quelli con livelli di GGT all'interno dell'intervallo di riferimento. Principale svantaggio di questo me-todo è il tempo necessario per una determinazione (50 minuti) ma, d'altra parte, la rilevazione dell'enzima è più semplice, sensibile e riproducibile.
Con l'utilizzo di questo metodo è stata caratterizzata la distribuzione delle frazio-ni di GGT in 200 soggetti donatori di sangue (100 uomifrazio-ni e 100 donne). In tutto sono state identificate quattro frazioni di GGT chiamate big-GGT (b-GGT, 2000kDa), medium-GGT (m-GGT, 940 kDa), small-GGT (s-GGT, 140 kDa) e
free-GGT (f-GGT, 70 kDa). I pesi molecolari delle frazioni b-, m-, e s-GGT sono
rispettivamente compatibili con quelli dei complessi con le lipoproteine VLDL, LDL, HDL, mentre quello di f-GGT è indice di una forma enzimatica libera. Il peso molecolare delle singole frazioni è indipendente dai livelli di GGT associati ad esse, e ciò fa pensare all'esistenza di un'interazione specifica tra l'enzima e il
19 trasportatore piuttosto che ad un adsorbimento casuale in circolo. Questo suggeri-sce una possibile secrezione e rimozione delle singole frazioni in maniera indi-pendente l'una dall'altra.
Dall'analisi dell'andamento dell'attività delle quattro frazioni in funzione dell'atti-vità totale della GGT è emerso che, in entrambi i generi, la frazione f-GGT è la più rappresentata a valori bassi di GGT totale, mentre l'aumento di questi ultimi dipende principalmente dalle frazioni s- e b-GGT53.
Lo studio delle frazioni dell'enzima GGT nel siero si prospetta interessante sia per un miglior utilizzo diagnostico e prognostico, sia per una più chiara compren-sione della patogenesi delle malattie associate all'enzima.
Figura 1.4: Profili di eluizione delle frazioni plasmatiche di GGT nella popolazione di
riferimento analizzata. A) Uomini (n = 100), B) Donne (n = 100). I cromatogrammi rap-presentano l’andamento del 25° (linea tratteggiata), 50° (linea continua), 75° (linea pun-teggiata) percentile del segnale fluorescente registrato ad ogni volume di eluizione.
È possibile che le frazioni della GGT abbiano almeno in parte origine non epati-ca, ed esiste la possibilità che l’elevata sensibilità diagnostica della GGT nei con-fronti delle malattie anche diverse da quelle epatiche derivi proprio dal rilascio di GGT da parte di questi tessuti patologici extraepatici.
10 15 20 25 0 20 40 60 80 100 10 15 20 25 0 20 40 60 80 100 A, uomini B, donne Volume di eluizione (ml) F lu o re s ce n za (u n it à a rb it ra ri e )
20
Tab.1.1: Attività totale e delle frazioni di GGT plasmatica in soggetti sani
Uomini (n = 100) Donne (n = 100) Mediana 5°–95° percentile Mediana 5°–95° Percentile P GGT* totale 25.3 12.3 – 60.5 14.4 8.4 – 30.9 < 0.001 b-GGT* 2.4 0.7 – 10.7 1.1 0.4 – 5.2 < 0.0001 m-GGT* 1.0 0.2 – 3.3 0.5 0.2 – 1.2 < 0.0001 s-GGT* 9.2 2.8 – 33.7 3.9 1.5 – 11.6 < 0.0001 f-GGT 13.2 8.3 – 19.6 8.9 5.9 – 12.5 < 0.0001
21
1.3 Il trapianto di cellule staminali emopoietiche
1.3.1 Generalità
L’applicazione delle tecniche trapiantologiche ha registrato nel tempo una pro-gressiva estensione delle indicazioni (inizialmente limitate a pochi pazienti, gene-ralmente con malattia in fase avanzata), sino a diventare un trattamento di I° linea già nelle fasi iniziali di alcuni disordini neoplastici. I processi ottenuti nelle cono-scenze biologiche del trapianto hanno inoltre consentito un’estensione di questa procedura a situazioni cliniche non maligne, come nel caso delle emoglobinopa-tie. Tutto ciò è stato reso possibile dalla riduzione della mortalità trapiantologica, dovuta all’acquisizione di esperienze cliniche sempre più consolidate, all’adozione di regimi di condizionamento ridotti che tengano conto anche delle comorbidità del paziente, alla maggiore efficacia della terapia di supporto e a una migliore prevenzione delle complicanze infettive. La scelta per quanto attiene il tipo di trapianto (allogenico, autologo, aploidentico, da cordone ombelicale) di-pende dall’indicazione al trapianto stesso, dall’urgenza e dall’età del paziente. La procedura di trapianto consiste di alcuni passaggi fondamentali, costituiti dalla scelta delle cellule staminali (da midollo, sangue periferico, cordone ombelicale), dall’uso di regimi preparativi detti di condizionamento, dall’esecuzione del tra-pianto e dei problemi connessi (tipizzazione HLA e scelta del donatore nel caso del trapianto allogenico, eventuale decontaminazione “purging” cellulare nel caso di trapianto autologo) e infine dalle complicanze quali GVHD, malattia veno-occlusiva (VOD), infezioni, mucositi, seconde neoplasie.54
22
Tab.1.2: Principali indicazioni al trapianto di midollo osseo
PATOLOGIE MALIGNE LEUCEMIE:Leucemie (linfatica acuta; mieloide
acuta e cronica); Sindromi mielodisplastiche LINFOMI
MIELOMA MULTIPLO
POLICITEMIA VERA,MIELOFIBROSI IDIOPATICA
TUMORI SOLIDI
PATOLOGIE NON MALIGNE
SINDROMI DA INSUFFICIENZA MIDOLLARE:ipoplasie
midollari congenite; aplasia midollare severa
STATI DI IMMUNODEFICIENZA:immunodeficienze congenite; sindrome di Wiscott-Aldrich
DISTURBI EMATOLOGICI:talassemia major, ane-mia falciforme, neutropenia congenita, gravi disturbi piastrinici congeniti
DISTURBI GENETICI NON EMATOLOGICI: osteope-trosi, mucopolisaccaridosi, leucodistrofie, altre pato-logie metaboliche rare
AMILOIDOSI
PATOLOGIE AUTOIMMUNI
1.3.2 Sorgenti di cellule staminali
Sono rappresentate dal midollo osseo, dal sangue periferico e dal cordone ombe-licale.
Il midollo osseo rappresenta la fonte classica di cellule staminali utilizzabili ai fi-ni trapiantologi. Il tessuto midollare viene generalmente aspirato dalla cresta ilia-ca posteriore in anestesia loilia-cale o generale, e risulta costituito da una commistio-ne di elementi midollari e di sangue periferico. La quantità di cellule staminali necessarie per un ripopolamento midollare adeguato deve essere proporzionale al
23 peso corporeo del ricevente e preferenzialmente sempre superiore ad una soglia minima di 2x108/Kg di peso del ricevente; questo dato comporta l’acquisizione di un volume di sangue midollare variabile da 700 a 1500 ml, a seconda del grado di diluizione. Le cellule staminali vengono dapprima identificate sulla base dell’espressione sulla membrana cellulare del marker denominato CD34+ (pre-cursori emopoietici maturi ma indifferenziati); grazie a metodi citofluorimetrici è possibile valutare la percentuale di cellule CD34+ presenti nel campione e, sulla base del volume totale del materiale da infondere, è possibile ottenere un conteg-gio assoluto delle cellule CD34+55.
Per quanto riguarda l’utilizzo di sangue periferico, la presenza di cellule stamina-li in questo distretto è estremamente esigua, pari allo 0,01-0,05 % delle cellule staminali totali; tuttavia il loro numero può essere aumentato notevolmente me-diante opportune procedure di mobilizzazione56. Numerosi fattori di crescita, da soli o in associazione con chemioterapia (in caso di mobilizzazione a scopo di au-totrapianto), si sono dimostrati idonei a mobilizzare le cellule staminali, in parti-colare G-CSF e GM-CSF. L’uso di G-CSF (10 mg/kg/die) seguito da aferesi in 4-5° giornata sembra rappresentare il regime di elezione, sebbene altri fattori quali SCF e Flt-3 siano stati usati in combinazione con G-CSF.
Le cellule staminali mobilizzate hanno le stesse caratteristiche fenotipiche delle cellule CD34+presenti nel midollo osseo, per cui la determinazione citofluorime-trica del numero assoluto delleCD34+/kg di peso corporeo del ricevente può esse-re considerato un mezzo adeguato a valutaesse-re la esse-resa ottimale del prodotto a fini trapiantologici. Un valore di CD34+ >2x106/kg dà luogo a una rapida rigenera-zione midollare. Le cellule CD34+ mobilizzate sono in grado di indurre un recu-pero ematologico temporalmente più rapido che non con l’infusione di cellule midollari, sebbene queste cellule possano apparire fenotipicamente e funzional-mente più immature della loro controparte midollare.
Alcuni problemi particolari connessi con l’uso delle cellule staminali periferiche sono la mancata mobilizzazione , che si riscontra in circa il 10-30% dei pazienti, e la contaminazione con un gran numero di linfociti nelle raccolte aferetiche, che aumentano il rischio di sviluppare GVHD, principalmente la forma cronica57.
24 Altra possibile sorgente di cellule staminali è il cordone ombelicale; le cellule staminali in esso contenute sono dal punto di vista fenotipico 1% CD34+ e 5% c-kit+ (rispetto a valori di 2% e 3,5% nel midollo adulto); questa relativa immaturi-tà delle cellule staminali consente di superare più facilmente la barriera immuno-logica nelle fasi di attecchimento rispetto alle cellule derivanti da altre sorgenti. Le tecniche di prelievo attuali consentono di prelevare un volume di sangue di circa 80-160 ml, contenente fino a 2x106 cellule CD34+, quota sufficiente per un trapianto allogenico in età pediatrica, ma non nell’adulto. Per tale motivo sono attualmente in studio tecniche intese ad ottenere un espansione clonale in vitro di cellule staminali derivate da cordone58.
1.3.3 Condizionamento e regimi preparativi
Il termine condizionamento si riferisce a quelle procedure che precedono l’infusione di cellule staminali emopoietiche e che consistono nella somministra-zione, in un periodo di tempo variabile da 2 a 9 giorni, di alte dosi di chemiotera-pia e/o radioterachemiotera-pia.
Il condizionamento riveste un ruolo fondamentale nel trapianto di cellule stami-nali, ed è basato su tre principali obiettivi:
1. La creazione dello spazio necessario alle cellule progenitrici del dona-tore sano per il ripopolamento midollare;
2. Il superamento della barriera immunologica dell’ospite mediante l’uso di agenti chemioterapici con potente effetto immunosoppressore, per evitare il rigetto nel caso di trapianto allogenico;
3. La totale scomparsa del compartimento di cellule staminali totipotenti malate del paziente, mediante l’utilizzo di dosi sovra massimali di chemio-radioterapia.
Distinguiamo tre tipi di regimi di condizionamento: (1) mieloablativi, cioè capaci di distruggere completamente il midollo del ricevente; (2) mieloablativi
alternati-25
vi, e (3) a ridotta intensità (“Reduced Intensity Conditioning, RIC) o anche detti
non mieloablativi, con conservazione parziale dell’emopoiesi del ricevente ed impianto delle cellule staminali del donatore, portando alla formazione di una “chimera”59
.
Vengono oggi considerati eleggibili per un trapianto allogenico con
condiziona-mento “mieloablativo” i pazienti di età inferiore a 55-60 anni in buone condizioni
generali, con funzionalità cardiaca, renale e respiratoria conservata, che non pre-sentino altre gravi patologie al momento del trapianto.
A partire dalla seconda metà degli anni ‘90, per poter estendere la procedura tra-piantologica allogenica anche a pazienti non in grado di tollerare regimi di condi-zionamento “mieloablativi”, è iniziata la sperimentazione clinica di regimi di
condizionamento ad intensità ridotta, basati sull’impiego di agenti
immunosop-pressivi e mielotossici a dosi non mieloablative, con conseguente minore tossicità globale. I condizionamenti RIC basano il loro potere terapeutico non tanto sull’azione citoriduttiva della chemio-radioterapia, quanto sull’effetto immunote-rapeutico del trapianto stesso, quindi sull’effetto “Graft-versus-Leukemia” (GVL). Il trapianto allogenico con condizionamento RIC è ben tollerato e risulta ormai eseguibile anche in pazienti di età avanzata, fino anche a più di 70 anni, o nei pazienti più giovani con performance status non adeguato ad un regime di condizionamento mieloablativo.
Le procedure di condizionamento si basano sull’utilizzo di tecniche diverse:
Radiazioni: TBI (“total body irradiation”) con dose totale che oscilla tra 800 e massimo 1320 cGy, spesso associata alla somministrazione di Ciclofosfa-mide (120 mg/m2) o di Etoposide (60 mg/kg).
Combinazioni di più chemioterapici: uno dei cicli più usati riguardava la combinazione di Busulfano per via orale (16 mg/kg per 4 giorni), con Ciclofo-sfamide (120 mg/kg per 2 giorni), attualmente sostituito dall’utilizzo del Busulfa-no per via endoveBusulfa-nosa (o TreosulfaBusulfa-no), visto la possibilità di moBusulfa-no- mono-somministrazione giornaliera, il minore effetto emetizzante, la minore epatotossi-cità, il ridotto rischio di VOD. Oggi si sono aggiunti nuovi schemi TBF (combi-nazione di Thiotepa, Busulfano, Fludarabina), e regimi di condizionamento ad in-tensità ridotta come Thiotepa+Ciclofosfamide e Melphalan, Fludarabina e basse
26 dosi di TBI. Altri regimi come il BEAM, contenente Carmustina (BCNU), Etopo-side, ARA-C e Melphalan, FEAM (sostituzione della Carmustina con Fotemusti-na), TEAM (sostituzione della Carmustina con Thiotepa), Melphalan e Novan-trone, sono utilizzati soprattutto come regimi di condizionamento in pazienti can-didati al trapianto autologo.
1.3.4 Procedure di trapianto
Esistono diversi tipi di trapianto di midollo osseo: autologo, allogenico da dona-tore consanguineo, allogenico da donadona-tore non consanguineo, e infine, allogenico da donatore aploidentico.
Nel trapianto autologo le cellule staminali sono isolate dal paziente stesso, il qua-le poi viene trattato con procedura di condizionamento e successivamente riceve per via endovenosa le proprie cellule staminali, da espianto o da mobilizzazione da sangue periferico mediante leucoaferesi nella maggior parte dei casi. La quan-tità di cellule staminali necessaria per una ricostituzione midollare è pari a 4-8x106 cellule CD34+/kg, corrispondenti a 8-10x104 CFU-GM. Le cellule ottenute vengono conservate in azoto liquido, utilizzando sacche o provette sottoposte a discesa graduale della temperatura, in presenza di un crioprotettore (DMSO, di-metilsulfossido); il DMSO è importante perché mantiene le cellule vitali ed evita i possibili danni dell’esposizione alle basse temperature.
Lo scongelamento, prima dell’infusione, viene eseguito in maniera rapida a 37°C e il prodotto viene infuso al termine del regimi di condizionamento. Questo tipo di trapianto ha un ruolo nel trattamento di patologie di tipo oncologico, comprese le neoplasie ematologiche, quando la quantità di cellule neoplastiche residue è modesta e potenzialmente eliminabile con l’elevata dose di farmaci impiegati du-rante il condizionamento.
Le sacche contenenti cellule staminali emopoietiche periferiche o il sangue mi-dollare espiantato sono sottoposte a controlli mediante metodiche di citogenetica, PCR, o citofluorimetria per valutare l’eventuale presenza di cellule patologiche,
27 come ad esempio i precursori plasmacellulari nel caso di mieloma multiplo o lin-fociti neoplastici nel caso di linfomi non-Hodgkin59.
Infatti, la presenza di cellule neoplastiche comporta un notevole rischio di rie-spansione della malattia a distanza di tempo rispetto all’esecuzione del trapianto. Il TMO autologo comporta bassi rischi di complicanze post-trapiantologiche e permette la ricostruzione dell’emopoiesi in tempi rapidi.
Nel trapianto allogenico le cellule staminali sono isolate da un donatore sano consanguineo o non consanguineo (“Matched Unrelated Donor”, MUD), identi-co totalmente o solo parzialmente per il sistema maggiore di istoidenti-compatibilità HLA, e infuse nel ricevente. Prima della infusione, il paziente viene sottoposto a regime di condizionamento al fine di eliminare le cellule patologiche della malat-tia di base e creare la premesse per la loro sostituzione (attecchimento) da parte delle cellule del donatore compatibile. Questo tipo di trapianto è usato nei casi di malattie che non hanno la probabilità di guarire con le terapie convenzionali e in quelle nelle quali il midollo emopoietico è affetto da patologie primitive come, ad esempio, l’aplasia midollare o la mielofibrosi idiopatica60
.
Inizialmente, sulla base della tipizzazione HLA, si individua un donatore compa-tibile. Si studiano prima i consanguinei, i gemelli monocoriali o i fratelli germani, ma considerando la situazione demografica dei paesi Occidentali, circa il 75% dei pazienti candidati al trapianto allogenico non dispone di un familiare identico dal punto di vista del sistema HLA. In questi casi, si esegue la ricerca di un donatore compatibile non consanguineo (MUD) nell’archivio informatico delle “banche del midollo”. Generalmente viene effettuato un primo screening con tipizzazione molecolare a bassa risoluzione (I° livello) e, successivamente si procede, in caso di identità molecolare, ad un’analisi in PCR ad alta risoluzione (II° livello), even-tualmente seguita da un potenziamento genomico. La probabilità di identificare un donatore compatibile nel gruppo etnico caucasico è del 50% circa ed è molto inferiore se si considerano gruppi etnici meno numerosi.
Si parla di matched 8/8 in caso di compatibilità di tutti gli alleli dei loci HLA-A, B, C e DRB1; si parla invece di matched 6/6 se si considerano gli alleli dei loci HLA-A, B e DRB1. E’ essenziale che il match degli alleli HLA riguardanti le
28 molecole HLA-A, HLA-B e HLA-DR del donatore sia completo; un singolo mi-smatch può essere tollerato se non è stato identificato nessun match completo.
Esistono valide alternative al MUD: la prima consiste nella scelta di un trapianto da donatore aploidentico, incompatibile per due-tre loci; ciascun paziente condi-vide esattamente un aplotipo HLA con ogni genitore e figlio biologico e con metà della fratia, pertanto un donatore può essere facilmente reperito praticamente in tutti i casi61. Tuttavia il trapianto aploidentico è stato associato ad un rischio si-gnificativo di rigetto o di GVHD severa, entrambe manifestazioni di un’eccessiva allo-reattività tra le cellule T dell’ospite e quelle del donatore; tali rischi possono essere ridotti con regimi di condizionamento intensivi e utilizzando trapianti T-depleti o T-depleti in maniera selettiva delle cellule T allo-reattive.
Un’altra alternativa al trapianto allogenico consiste nell’impiego di cellule stami-nali isolate dal cordone ombelicale geneticamente non correlato.
Il trapianto allogenico ha buone possibilità di guarigione se eseguito in pazienti in remissione completa di malattia o in pazienti con malattia minima residua poten-zialmente eradicabile da parte di cellule immunocompetenti derivanti dall’emo-poiesi del donatore62.
Il materiale contenuto nelle sacche (PBSC, sangue midollare da espianto, cellule staminali di cordone ombelicale) viene infuso nel ricevente per via venosa, in ge-nere impiegando un catetere venoso centrale (CVC) o un PICC (“Peripherally
in-serted central catheter”). L’infusione viene eseguita al giorno 0, quando il
rice-vente ancora non mostra le conseguenze del trattamento di condizionamento, per cui i livelli di leucociti, emoglobina e piastrine sono simili a quelli registrati nei giorni precedenti. La riduzione dei parametri dell’emocromo si osserva nei giorni successivi; si può affermare che è avvenuto l’attecchimento (engraftment) del trapianto quando il numero assoluto dei neutrofili è superiore a 500 per microlitro di sangue, per almeno due giorni consecutivi59.
29
Figura 1.5: Comportamento di leucociti, neutrofili e piastrine in corso di trapianto
allo-genico. L’attecchimento avviene alla terza settimana post-trapianto.
1.3.4 Complicanze del trapianto
Nel primo periodo post-trapianto il paziente deve essere supportato con un ade-guato programma nutrizionale che assicuri un sufficiente apporto calorico e quan-tità adeguate di nutrienti essenziali, di liquidi ed elettroliti. E’ necessaria una ade-guata gestione del CVC per limitare le possibilità di insorgenza di infezioni CVC-correlate, inoltre è importante la gestione dei sintomi legati alla mucosite sistemi-ca sistemi-causata dagli effetti della terapia di condizionamento (soprattutto in quei pa-zienti che ricevono un’irradiazione corporea frazionata, nell’ambito del regime di condizionamento). Il trattamento del dolore provocato dalla mucosite è difficolto-so: può essere necessario ricorrere a oppiacei o anestetici locali. Si rende spesso necessario l’impiego di fattori di crescita granulocitaria e/o di eritropoietina ri-combinante per sostenere la ripresa dell’emopoiesi63
30 Le complicanze del TMO possono essere distinte in: (1) complicanze precoci, (2) complicanze infettive, (3) GVHD e, infine, (4) complicanze tardive.
Le più importanti complicanze precoci, non molto frequenti, sono:
cistite emorragica (causata dalla Ciclofosfamide e da alcuni virus, come Adenovirus o Polivirus);
patologie di tipo vascolare, quali la malattia veno-occlusiva del fegato (VOD), la sindrome di disfunzione multiorgano (MODS), la microangio-patia trombotica, l’emorragia alveolare diffusa e la sindrome da
en-grafment;
fallimento del trapianto, più frequente nei pazienti trapiantati per aplasia midollare, che in quelli trapiantati con midollo o con PBSC T-depleti.
In particolare, la malattia veno-occlusiva (VOD) è una temibile complicanza del trapianto allogenico e del trapianto autologo, conseguenza di un danno epatico dovuto al regime di condizionamento che può portare a morte in oltre l’80% dei pazienti. Clinicamente si manifesta con un incremento di peso non giustificato, ittero, dolenzia in corrispondenza della zona ipocondriaca destra con epatomega-lia, ascite, e ritenzione idrica. Non vi sono attualmente test diagnostici definitivi e la diagnosi è fondamentalmente clinica. Si ritiene che valori sierici elevati dell’inibitore-1 del plasminogeno possano essere associati a pazienti con VOD. L’esecuzione di una biopsia epatica può essere necessaria per convalidare la dia-gnosi. Dal punto di vista istopatologico il tessuto epatico mostra la deposizione di fibrinogeno e fattore VIII a livello delle vene centro-lobulari con danno delle cel-lule endoteliali sinusoidali (SEC), formazione di gap tra le celcel-lule stesse con im-bibimento ematico dello spazio di Disse, dissezione delle SEC e loro embolizza-zione a valle. Tale fenomeno comporta l’ostruembolizza-zione dei sinusoidi, riducendo l’efflusso venoso epatico e comportando un’ipertensione portale post-sinusoidale. La terapia, basata sull’utilizzo dell’ attivatore del plasminogeno di tipo tissutale ed eparina, è in grado di ottenere risposte in circa il 30-40% dei pazienti, peraltro in associazione a rischi emorragici importanti; in alternativa è stato proposto l’uso di Defibrotide dotato di attività antitrombotiche e fibrinolitiche, ma con scarsa azione anticoagulante sistemica54.
31 Dopo un trapianto di midollo la ricostruzione immunologia sostenuta dalle cellule staminali del donatore avviene lentamente. Il timing della ricostruzione immuno-logia è alla base della tipoimmuno-logia delle possibili complicanze infettive a carico del ricevente64.
Nella fase aplastica, che va dall’inizio della terapia di condizionamento fino ai segni di ripresa dei livelli di neutrofili, prevalgono le infezioni batteriche a carico delle mucose danneggiate dal condizionamento, le infezioni fungine soprattutto da Aspergilli, le infezioni virali soprattutto da Herpes virus, e sono relativamente frequenti le infezioni CVC-correlate. La mortalità in questa fase è causata soprat-tutto da severe infezioni batteriche (es. setticemia o polmonite).
Nella seconda fase, che va dall’attecchimento fino al terzo-quarto mese post-trapianto, la caratteristica principale è il deficit dell’immunità cellulo-mediata, soprattutto a causa della riduzione del numero di cellule citotossiche specifiche ed aspecifiche. Le infezioni più frequenti sono provocate da citomegalovirus (CMV)65, Adenovirus, e virus di tipo respiratorio. L’entità della GVHD condi-ziona il grado di immunodeficienza tipica di questa fase.
La terza fase, che inizia a partire dal terzo-quarto mese post-trapianto, è influen-zata soprattutto dalla presenza e dalla gravità della GVHD. I pazienti presentano ipogammaglobulinemia con deficit soprattutto a carico delle IgG2, responsabili della elevata incidenza di infezioni causate da batteri con parete polisaccaridica, ma possono svilupparsi infezioni sostenute da batteri capsulati come S. Pneumo-nite e H. Influenzae. Questa fase può essere di breve durata (circa 2 mesi), ma in un certo numero di pazienti questa condizione di immunodeficienza può durare tutta la vita successiva al trapianto64.
Le complicanze tardive si verificano attualmente con maggior incidenza perché la sopravvivenza dei soggetti trapiantati tende ad aumentare. Vi sono complicanze tardive di tipo maligno, cioè neoplasie di tipo secondario come linfomi o leuce-mie, ma anche complicanze tardive di tipo non maligno, le quali riguardano es-senzialmente polmoni (malattie croniche occlusive), occhi (cataratta e sindrome sicca), apparato osseo (osteoporosi e necrosi avascolare) e sistema endocrino (ipotiroidismo, infertilità e insufficienza gonadica)66.
32 In particolare, uno dei capitolo più importanti è rappresentato dalla occorrenza della malattia linfoproliferativa post-trapianto (“post-transplant
lymphoprolife-rative disease”, PTLD) che comprende un ampio spettro di manifestazioni.
Isto-logicamente, la malattia linfoproliferativa che compare precocemente dopo il tra-pianto è tipicamente policlonale e sembra simile a un quadro di mononucleosi in un ospite immunocompromesso, con localizzazione orofaringea e linfonodale. La stragrande maggioranza delle linfoproliferazioni presentatesi precocemente nel post-trapianto è legata all’EBV54.
La mortalità trapiantologica rappresenta ancora oggi il maggior ostacolo al suc-cesso del trapianto allogenico. Si definisce mortalità trapiantologica (“transplant
related mortality”, TRM) il decesso del paziente non dovuto alla malattia, ma ad
una complicanza legata alla procedura trapiantologica. La sua incidenza, legata sia alle caratteristiche cliniche del paziente sia a fattori direttamente correlati al trattamento, può variare nelle diverse casistiche dal 10 al 50%67.
Negli ultimi anni con il miglioramento delle conoscenze fisiopatologiche delle principali complicanze trapiantologiche e della capacità diagnostica precoce delle infezioni, la disponibilità di un sempre più ampio ventaglio di farmaci attivi e il miglioramento della terapia di supporto, la mortalità correlata al trapianto (TRM) si è andata progressivamente riducendo. La riduzione del rischio di TRM si è os-servata quasi esclusivamente per i pazienti in fase di malattia precoce, mentre continua a incidere pesantemente nelle fasi avanzate.
33
1.4 Graft-versus-host disease
1.4.1 Definizione
La GVHD (Graft-versus-host disease, “malattia del trapianto contro l’ospite”) è la principale complicanza immunologia del trapianto allogenico. Si verifica in tutti i casi in cui le cellule immunologiche competenti dei donatori sono trapianta-ti in riceventrapianta-ti immunologicamente deficitari, e le cellule trasferite riconoscono allo-antigeni nell’ospite68. La GVHD è più frequente in caso di trapianto di mi-dollo osseo, ma fa seguito anche al trapianto di organi solidi ricchi di cellule lin-fatiche come il fegato, o alla trasfusione di sangue non irradiato.
Tradizionalmente si riconoscono due forme di GVHD, acuta (aGVHD) e cronica (cGVHD). Si parla di GVHD acuta quando la malattia si manifesta entro i primi 100 giorni dal trapianto, mentre si definisce GVHD cronica se insorge dopo i primi 100 giorni dal trapianto. Questa ultima può seguire l’evoluzione della GVHD acuta o manifestarsi per la prima volta come tale. Questa classificazione tradizionale è stata ormai sorpassata dalla classificazione del National Institutes of Health, che include la forma “late-onset acute GVHD” (dopo i 100 giorni dal TMO) e la “overlap-syndrome”, con caratteristiche intermedie tra forma acuta e cronica69. Queste ultime due forme si sviluppano più frequentemente nei pazienti sottoposti ad un regime di condizionamento a ridotta intensità.