PARTE I
DIAGNOSTICA PER IMMAGINI E
CENNI DI ANESTESIOLOGIA
ESAME RADIOGRAFICO DEL SISTEMA
CARDIOPOLMONARE
La radiografia toracica non costituisce lo strumento principale per lo studio del cuore, tuttavia consente l’identificazione di numerose affezioni cardiorespiratorie, grazie alla visualizzazione dei segni secondari che queste patologie possono indurre e alla valutazione della vascolarizzazione toracica e polmonare. Per questo motivo l’esame radiografico è ancora un valido approccio all’indagine di patologie toraciche, anche di origine cardiogena.
Per poter studiare radiograficamente in modo completo la regione toracica, sono necessarie almeno due proiezioni ortogonali tra loro (Suter e Lord, 1984), poiché ogni proiezione è indicata soltanto per la visualizzazione di alcune strutture e, inoltre, l’osservazione di due proiezioni diverse della stessa regione anatomica, consente di correlare i diversi rilievi radiografici e poter effettuare dei confronti, in modo da escludere o confermare sospetti di patologie.
Normalmente si effettuano una latero-laterale (cioè con il paziente in decubito laterale) destra o sinistra ed una ventro-dorsale o dorso-ventrale (con il paziente in decubito dorsale o sternale).
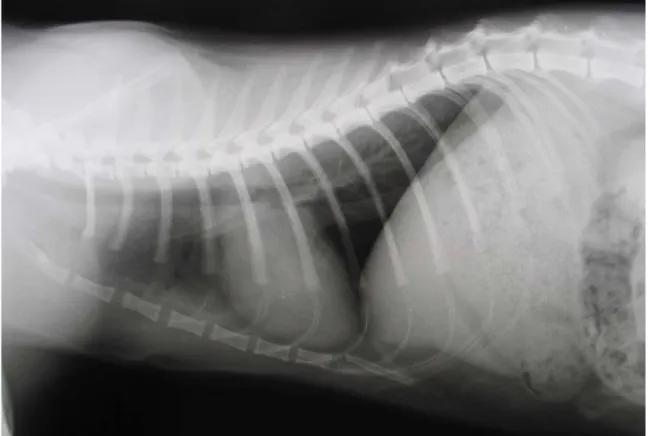
Per le radiografie latero-laterali, il paziente deve essere collocato in decubito laterale, con gli arti anteriori estesi e la colonna vertebrale parallela al tavolo radiografico; il fascio radiogeno deve essere centrato in corrispondenza dell’area cardiaca, in maniera che la cavità toracica sia interamente compresa nella pellicola.
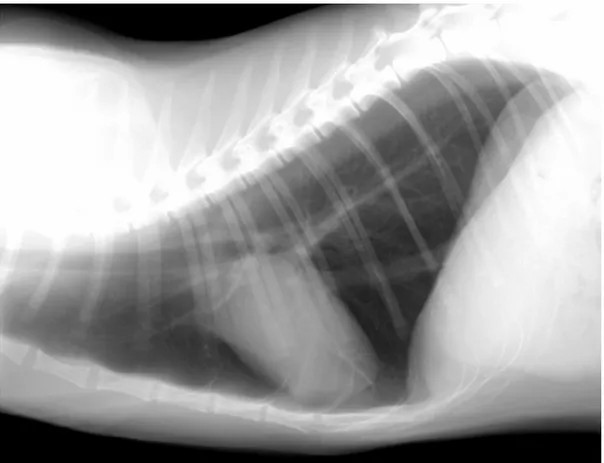
Fig I-1 Radiografia toracica di un gatto sano, proiezione LL destra.
Il polmone declive risulta maggiormente compresso e conseguentemente meno insufflato, pertanto il contrasto tra aria contenuta negli alveoli (radiotrasparente) e strutture radiopache (cuore, vasi, lesioni..) sarà minore rispetto al controlaterale (non declive).
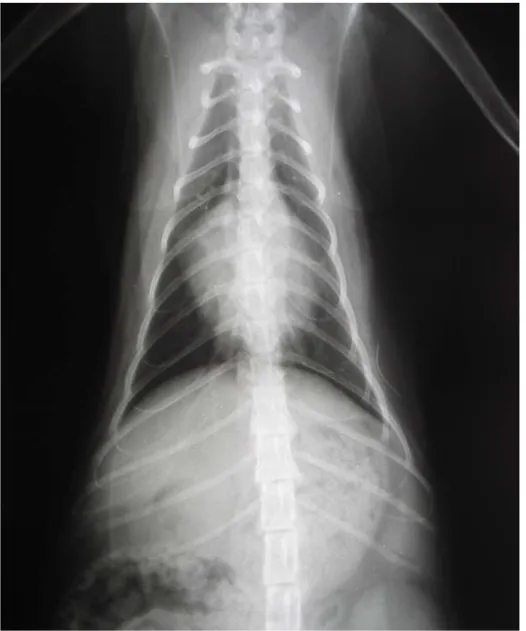
Per le radiografie VD o DV il paziente deve essere posizionato in modo che l’asse sterno-vertebrale sia perpendicolare al tavolo radiologico e gli arti anteriori devono essere estesi.
Per convenzione vengono scelte la LL destra e la VD, tuttavia in casi particolari si possono preferire le altre proiezioni: se avessimo bisogno di studiare l’emitorace destro, per sospetto di una lesione monolaterale, risulterebbe necessaria la LL sinistra; se, invece, il nostro paziente presentasse una grave difficoltà respiratoria, sarebbe fortemente indicato il decubito sternale, a discapito di quello dorsale.
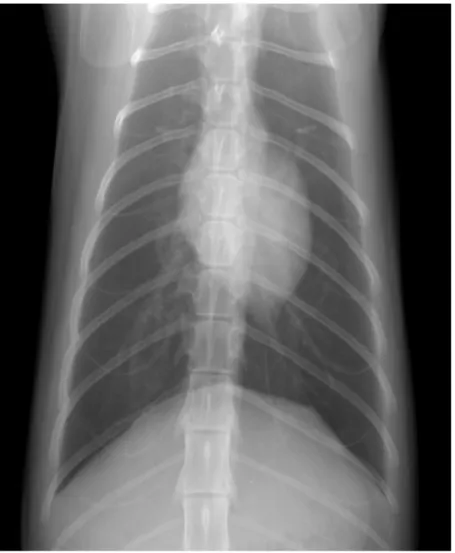
Fig I-2 Radiografia toracica di un gatto sano, proiezione VD.
L’efficacia di questo mezzo diagnostico per valutare lo stato dell’apparato cardiovascolare è fondato sul riconoscimento delle diverse strutture che lo costituiscono e sull’interpretazione dei segni radiografici che queste offrono all’osservatore; ciò risulta possibile grazie al contrasto che si crea naturalmente in una radiografia toracica a causa della spiccata radiotrasparenza del parenchima polmonare su cui risaltano strutture radiopache come cuore, grossi vasi e vasi lobari.
In cardiologia questo strumento diagnostico viene sfruttato soprattutto per identificare alterazioni di forma e dimensioni della silhouette cardiaca o di una sua camera, alterazioni del calibro dei grossi vasi, irregolarità del parenchima polmonare o
della sua vascolarizzazione che si manifestano secondariamente a patologie cardiovascolari (Kittleson e Kienle, 1998).
Modificazioni della radiotrasparenza dei campi polmonari in un soggetto sano, si possono manifestare in corso di anestesia: in questo caso, infatti, il parenchima alveolare risulta meno insufflato, rispetto allo stesso in un soggetto sveglio, e inevitabilmente si ottiene una diminuzione del contrasto e del dettaglio (Suter e Lord, 1984).
ANATOMIA RADIOGRAFICA DEL SISTEMA
VASCOLARE POLMONARE
La radiotrasparenza dei campi polmonari è fisiologicamente ridotta dalla presenza di strutture che si distribuiscono uniformemente andando a creare una sottile impalcatura radiopaca; questa è costituita dalla trama interstiziale, ovvero i setti connettivali che costituiscono le pareti alveolari e bronchiali, e da quella vascolare, determinata dal sangue contenuto in arterie e vene dirette alla periferia dei lobi polmonari (Suter e Lord, 1984).
La vascolarizzazione di ciascun lobo polmonare è assicurata da un ramo dell’arteria e della vena polmonare principale, che procedendo verso la periferia si diramano ulteriormente e si assottigliano.
I vasi lobari risultano nettamente visibili nella regione periilare e nella parte centrale del polmone, soprattutto in animali di taglia grande e gigante; nelle radiografie di cani piccoli o gatti ed in quelle scattate durante la fase espiratoria, invece, arterie e vene appaiono più sfocate e difficilmente distinguibili. Allo stesso modo, tutte le condizioni che alterano la normale radiotrasparenza polmonare (edema polmonare, presenza di essudato intraalveolare..) inducono una maggiore difficoltà nella visualizzazione di queste sottili strutture vascolari (Suter e Lord, 1984).
Arterie e vene si differenziano per la loro origine, posizione, opacità e profilo: le arterie originano dall’arteria polmonare principale, che si trova cranialmente alla biforcazione tracheale, sono più radiopache, leggermente curve e ben definite, rispetto al disegno più corto e tozzo delle vene (Suter e Lord, 1984).
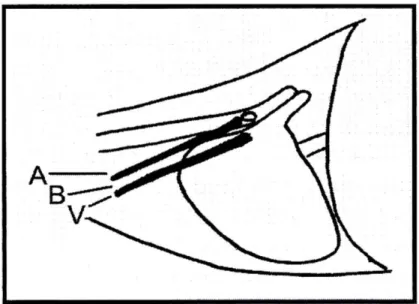
La proiezione LL è ideale per lo studio dei vasi diretti ai lobi craniali: essi originano in prossimità della biforcazione tracheale e, seguendo il decorso cranio-ventrale del bronco principale collaterale, costituiscono con esso una triade che si porta alla periferia del lobo apicale. L’arteria occupa sempre una posizione dorsale rispetto al bronco e la vena, quella ventrale; si viene quindi a creare un disegno assai particolare, ottenuto dal contrasto di due strutture rettilinee radiopache tra cui è posizionato il bronco radiotrasparente.
Fig I-5 Localizzazione della vascolarizzazione polmonare lobare craniale in proiezione LL. (A: arteria, B: bronco, V: vena)
Da diversi studi condotti per differenziare la triade destra da quella sinistra sembra che, nel cane, la radiopacità osservata cranialmente alla biforcazione tracheale corrisponda all’origine del bronco diretto al lobo apicale destro. Questo bronco ed i vasi che lo accompagnano occuperebbero frequentemente una posizione ventrale e leggermente craniale rispetto alla triade diretta al lobo apicale sinistro (Burk et al., 1978).
Errori di posizionamento e variabilità individuale sono i fattori che possono indurre una parziale o completa sovrapposizione delle due triadi (Suter e Lord, 1984), in questo caso i vasi dei due lati risultano indistinguibili (Kittleson e Kienle, 1998).
Anche i vasi diretti ai lobi caudali, studiati in proiezione VD, seguono il decorso del bronco principale collaterale creando una triade, che, costituita dall’arteria lateralmente e dalla vena medialmente, si sovrappone all’ombra cardiaca e si porta caudo-lateralmente attraversando interamente il lobo caudale ed oltrepassa il diaframma (Kittleson e Kienle, 1998).
Fig I-6 Localizzazione della vascolarizzazione polmonare lobare in proiezione VD. (A: arteria, B: bronco, V: vena)
Suter e Lord (1984) affermano che, per avere informazioni sulla vascolarizzazione polmonare e sulla funzionalità cardiaca, possa essere utile effettuare alcune misurazioni dei vasi e non ritengono attendibili le eventuali correlazioni tra strutture vascolari ed ossee. Altri autori, invece, preferiscono rapportare le dimensioni vascolari con quelle
costali: Thrall et al. (1976) e Hayward et al (2004) suggeriscono di misurare in LL i vasi lobari apicali facendo il rapporto tra la loro dimensione all’intersezione con la IV costa e quella del terzo prossimale della costa stessa, che dovrebbe avvicinarsi al valore di 0,75. Per quanto concerne i vasi lobari caudali troviamo in letteratura pareri discordanti: Kittleson e Kienle (1998) affermano che questi vasi, laddove intersecano la VII costa, dovrebbero avere dimensioni uguali al diametro della costa stessa, Hayward et al (2004) evidenziano la IX costa, come termine di confronto, Jackson (1969), infine, afferma che l’ampiezza massima dei vasi dovrebbe essere il 60% del diametro delle coste in DV.
SEMEIOTICA RADIOGRAFICA DELLA
VASCOLARIZZAZIONE POLMONARE
Qualsiasi modificazione del normale disegno radiografico del polmone viene studiato e classificato secondo quattro tipi di pattern, che indicano diverse tipologie di alterazioni polmonari.
Il comparto vascolare, uno dei distretti che comporta cambiamenti del quadro radiografico polmonare, può subire variazioni (sia aumento che diminuzione) di dimensioni, morfologia, radiopacità, numero e decorso; queste alterazioni, se caratterizzate da una maggiore visualizzazione dei vasi, prendono il nome di pattern vascolare.
Se si osserva un mutamento delle dimensioni di arterie e/o vene polmonari, questo risulta spesso associato ad una corrispondente modificazione di tutte le altre caratteristiche del vaso, dal momento che la forma, la radiodensità, il numero ed il decorso dei vasi sono correlati con la quantità di sangue che questi contengono.
Valutando diametro, morfologia e radiopacità dei vasi lobari, possiamo suddividere genericamente le immagini polmonari in quadri di ipo o iperperfusione, che possono coinvolgere l’organo interamente o in modo parziale (Suter e Lord, 1984).
Alcuni autori segnalano una maggiore semplicità nell’individuare una irregolarità di perfusione polmonare localizzata, rispetto ad un’alterazione che coinvolge l’organo in toto (Suter e Lord, 1984), dal momento che nel primo caso si trovano a coesistere manifestazioni diverse a carico dello stesso distretto polmonare.
Modificazioni localizzate della vascolarizzazione polmonare possono essere conseguenti a fenomeni fisiologici o patologici; in tutti i casi, comunque, la riduzione
della perfusione polmonare localizzata è causa o conseguenza dell’aumento dell’afflusso ematico in altra regione polmonare: questo effetto prende il nome di “ridistribuzione del flusso polmonare” (Milne, 1978).
La gravità, per esempio, rappresenta uno dei fattori fisiologici responsabili della modificazione del flusso ematico polmonare: le aree dell’organo più declivi, infatti, risulteranno maggiormente irrorate, anche in assenza di patologie.
Altre cause che spieghino un’irregolare distribuzione della perfusione polmonare sono: vasocostrizione dovuta ad ipossia locale ed anormalità organiche o strutturali, come trombosi, vasculiti, tromboembolismo polmonare, diminuzione del letto vascolare conseguente ad enfisema, proliferazione di cellule endoteliali o deposizione di materiale nella parete del vaso (Suter e Lord, 1984).
Quando, invece, il polmone intero è coinvolto da modificazioni vascolari, l’aspetto della radiografia si presenta maggiormente alterato, poiché ne consegue un complessivo mutamento della radiopacità.
Prima di soffermarsi sulla vascolarizzazione, sarà necessario valutare la qualità della radiografia e considerare le condizioni del soggetto, poichè errori nell’esposizione e l’utilizzo di anestetici inducono importanti alterazioni delle immagini radiografiche.
Quindi si analizzeranno i vasi lobari, prendendo in considerazione il loro diametro, l’aspetto e la radiopacità: Thrall et al. (1976) indicano come valore limite per le dimensioni dei vasi diretti ai lobi apicali 1,2 volte il diametro del terzo prossimale della IV costa (in LL); nel 95% dei casi in cui questa soglia venga superata, si può affermare che il vaso sia aumentato. Jackson (1969), invece, riporta che i vasi diretti ai lobi caudali, non dovrebbero superare il 60% della larghezza delle coste in DV.
Emergono, invece, maggiori difficoltà nella valutazione di una riduzione delle dimensioni dei vasi: Thrall et al. (1968), infatti, individuano un range, entro cui arterie e
vene risulterebbero diminuite, talmente ampio (da 0,25 a 1,25 volte il diametro della costa) che spesso la misurazione si rivela insignificante.
Un quadro di ipoperfusione, può comunque essere determinata radiograficamente valutando contemporaneamente il volume della vena cava caudale, le dimensioni del cuore, la radiopacià polmonare, arterie polmonari piccole e grandi e l’aorta (Suter e Lord, 1984). Quando una o più di queste strutture supportano il sospetto di una riduzione del volume ematico circolante, anche una lieve riduzione delle dimensioni dei vasi polmonari può essere considerata attendibile.
IPERPERFUSIONE POLMONARE
L’iperperfusione polmonare è genericamente riconosciuta in seguito ad evidenziazione di un’aumentata radiopacità polmonare, che consegue alla visualizzazione di un maggior numero di vasi, di dimensioni e radiopacità maggiori, che si estendono più in periferia rispetto alla norma; talvolta le strutture vascolari in sezione trasversale sono così numerose da dare l’impressione di un pattern nodulare diffuso (Suter e Lord, 1984).
Si possono, poi, differenziare quadri di ipertensione polmonare arteriosa, venosa o caratterizzata da un aumento di entrambi i comparti.
Tra le cause che giustifichino un aumento del distretto arterioso polmonare si individuano alcune parassitosi, tra cui la filariosi cardiopolmonare e la angiostrongilosi, e l’ipertensione polmonare secondaria a broncopneumopatia cronica.
L’indagine radiografica polmonare assume grande rilievo nella diagnosi e prognosi in corso di dirofilariosi, specialmente nel cane, poichè le alterazioni radiografiche vascolari e parenchimali proprie di questa patologia risultano numerose e variabili nel corso dell’infezione.
La presenza fisica di adulti e microfilarie nel letto arterioso e capillare polmonare (oltre che nel cuore destro) comporta inevitabilmente un danno endoteliale che si concretizza con lo sviluppo di un’endoarterite cronica caratterizzata da proliferazioni fibroelastiche dell’intima (Suter e Lord, 1984). La conseguenza di questo fenomeno è l’ostruzione dei vasi colpiti e la sclerosi ad essa secondaria; ciò conduce inevitabilmente alla perdita di alcune porzioni del letto vascolare funzionale e del corrispondente parenchima polmonare .
In particolare, è importante soffermarsi sulle alterazioni radiografiche che assumono le arterie polmonari periferiche, dal momento che queste si manifestano precocemente rispetto alle modificazioni cardiache e polmonari e variano con il decorso della patologia (Suter e Lord, 1984). Le alterazioni osservabili nel cane sono: aumento in dimensioni delle arterie periferiche che risultano sempre maggiori rispetto alle vene corrispondenti; dilatazioni sacciformi a carico della porzione terminale delle arterie lobari caudali; repentina interruzione delle arterie lobari (immagine di “potatura” o “troncamento”) che non si continuano, assottigliandosi, in arteriole e capillari; tortuosità e aspetto irregolare del vaso caratterizzato da numerosi restringimenti e successive dilatazioni; disegno vascolare sfumato e confuso (Suter e Lord, 1984). Simili reperti radiografici possono essere osservati in cani affetti da angiostrongilosi in forma grave e cronicizzata (Suter e Lord, 1984).
Fig I-7 Due radiografie (LL e VD) di un cane affetto da filariosi cardiopolmonare.
Risulta decisamente meno severo e variegato il quadro polmonare del gatto affetto da dirofilariosi; infatti in seguito a diversi studi effettuati in questa specie, si può affermare che manifestazioni radiografiche indicative di questa patologia siano caratterizzate quasi esclusivamente da una dilatazione delle arterie lobari caudali, visibile prevalentemente in VD, ed un leggero aumento del cuore destro (Schafer e Berry, 1995).
Una patologia respiratoria cronica di tipo ostruttivo o restrittivo può, invece, scatenare un quadro di iperafflusso arterioso polmonare poiché responsabile di un deficit negli scambi gassosi: si viene a creare, quindi, uno stato di ipossia che l’organismo animale tenta di compensare tramite alcuni meccanismi, quali la vasocostrizione arteriolare e l’aumento della gittata cardiaca (Goodwin, 1958). Inoltre, la compromissione di alcune porzioni di parenchima polmonare, causata dalla patologia, comporta la sopradescritta ridistribuzione del flusso polmonare, che risulterà inevitabilmente aumentato nelle regioni dell’organo ancora funzionanti.
Radiograficamente si osserverà un aumento delle dimensioni delle arterie polmonari, localizzato specialmente ai rami principali, ed una concomitante dilatazione del ventricolo destro.
Un aumento della visualizzazione del disegno vascolare venoso, invece, può presentarsi in caso di insufficienza cardiaca sinistra, patologia miocardica cronica caratterizzata da manifestazioni radiografiche caratteristiche e di crescente gravità durante la sua progressione.
Lo scompenso cardiaco sinistro origina da un danno miocardico primario che compromette la normale gittata cardiaca (alterazioni funzionali o strutturali del ventricolo sinistro, patologie valvolari.), a questo consegue l’aumento della pressione nell’atrio corrispondente e la successiva stasi venosa a livello polmonare: radiograficamente si osserverà, in fase iniziale, un quadro di congestione polmonare, caratterizzata da aumento della radiopacità nella regione periilare e dilatazione delle strutture venose, i cui margini assumeranno un aspetto sfumato (Suter e Lord, 1984).
Nelle fasi avanzate della patologia, il pattern vascolare risulterà meno evidente dal momento che subentreranno altre manifestazioni radiografiche destinate a modificare più profondamente l’aspetto ed il contrasto tipici del polmone (edema polmonare prima interstiziale, poi alveolare) (Suter e Lord, 1984).
Il pattern vascolare caratterizzato da dilatazione contemporanea di arterie e vene è osservabile esclusivamente in due occasioni: l’ipervolemia e l’iperafflusso ematico polmonare secondario a shunt sinistro-destro. Quest’ultima patologia, che si realizza per esempio in seguito alla persistenza del dotto arterioso, presenta diverse modificazioni radiografiche, oltre all’aumento del disegno vascolare accompagnato da congestione ed edema, che, osservate simultaneamente, possono risultare patognomoniche (Suter e Lord, 1984).
Fig I-8 Radiografia VD di un gatto affetto da shunt destro-sinistro: dilatazione simultanea di arterie e vene lobari
IPOPERFUSIONE POLMONARE
Numerose risultano le affezioni che giustifichino un quadro di ipoafflusso ematico al polmone; prime tra tutte, si ricordano le patologie circolatorie o endocrine caratterizzate da una diminuzione del volume ematico circolante.
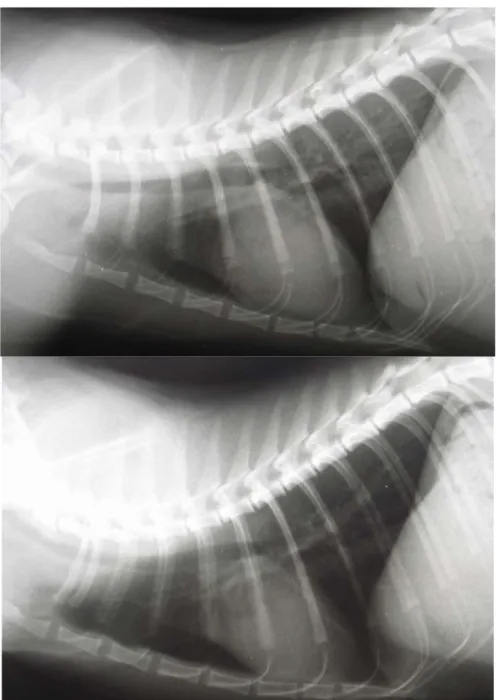
Fig I-9 Radiografia toracica di un gatto in corso di ipovolemia, proiezione LL destra.
In caso di shock ipovolemico secondario ad emorragia acuta, morbo di Addison, prolungato stato di cachessia e disidratazione grave, la massa ematica circolante risulterà significativamente ridotta e questo fenomeno si renderà evidente nelle immagini radiografiche (Suter e Lord, 1984). E’ il torace la regione che manifesta le alterazioni maggiori, a causa del contrasto esistente tra parenchima polmonare e strutture vascolari. Le modificazioni sono caratterizzate dall’aumento di radiotrasparenza nei campi polmonari in seguito alla diminuzione della taglia cardiaca (microcardia), alla riduzione delle dimensioni della trama vascolare polmonare ed alla concomitante iperinsufflazione dell’organo, meccanismo compensatorio indotto dall’ipossia tissutale (Suter e Lord, 1984).
Fig I-10 Radiografia toracica di un gatto in corso di ipovolemia, proiezione VD.
Una ridotta estensione del disegno vascolare, spesso associata a modificazioni morfologiche della silhouette cardiaca, è caratteristica frequente di patologie propriamente miocardiche, quali scompenso cardiaco destro, shock cardiogeno, patologie congenite del cuore destro caratterizzate da una parziale esclusione del circolo polmonare (shunt destro/sinistro).
Nello scompenso cardiaco destro, si osserverà questa modificazione in fase iniziale, prima, cioè che si manifestino tutti gli eventi secondari all’ipertensione venosa periferica ed al coinvolgimento del cuore sinistro; in caso di shock cardiogeno, invece, i
campi polmonari risulteranno ipoperfusi soltanto se l’insufficienza destra prevarrà su quella sinistra (Suter e Lord, 1984).
Occorre sottolineare che il disegno vascolare, nonostante diminuito in estensione, risulti, in questi casi, molto evidente poiché ben contrastato dall’aumentata radiotrasparenza dei lobi polmonari.
MODIFICAZIONI CARDIOVASCOLARI IN CORSO DI
ANESTESIA
Molti anestetici comunemente utilizzati in medicina veterinaria possono indurre effetti sul sistema cardiovascolare.
Segue la descrizione di alcuni dei farmaci e delle associazioni tra questi, più frequentemente usati in anestesiologia veterinaria; particolare attenzione verrà dedicata alle modificazioni che l’apparato cardiocircolatorio subisce in seguito alla somministrazione di queste molecole.
DESCRIZIONE DEI FARMACI E DELLE
ASSOCIAZIONI IMPIEGATE
MEDETOMIDINA
La medetomidina (Domitor®) è l’α-2-agonista più recente approvato per l’uso veterinario.
Tra i farmaci appartenenti a questa classe è il più potente ed efficace, poiché dotato di maggiore selettività per gli α-2-adrenocettori (Seymour e Gleed, 2003).
Gli effetti di questo farmaco sono gli stessi di tutti gli α-2-agonisti e comprendono sedazione ed analgesia dose-dipendente, miorilassamento e riduzione dell’ansia; se usato in premedicazione, a causa del potenziamento che esercita su tutti i farmaci depressanti del SNC, permette la diminuzione della dose successiva di anestetici endovenosi ed inalatori fino al 50% (Seymour e Gleed, 2003; Sinclair, 2003).
Alcuni degli effetti indesiderati da medetomidina sono rappresentati da: marcata depressione respiratoria, ipotermia, vomito, tremori muscolari, iperglicemia, eccitazione e sedazione prolungata.
Gli α-2-agonisti, inoltre, soprattutto se somministrati IV, modificano la funzionalità del sistema cardiovascolare, provocando una risposta bifasica: inizialmente la pressione ematica aumenta in seguito ad incremento della resistenza vascolare sistemica. Poi diminuisce, per effetto di un calo della frequenza e della gittata cardiache. Quindi, la pressione sanguigna viene mantenuta entro limiti normali o inferiori alla norma (Pypendop, 2007).
gittata cardiaca è correlato, invece, all’effetto bradicardico, mediato da barocettori aortici e dalla diminuzione del tono simpatico (Lamont et al., 2001; Pypendop, 2007).
L’intensità e la durata dell’incremento della resistenza vascolare dipendono da diversi fattori: la selettività della molecola per gli α-2-adrenocettori, il dosaggio e la via di somministrazione; la xilazina, meno selettiva della medetomidina, non provoca un’ipertensione così marcata e prolungata, infatti, nei primi studi, veniva segnalata come potenziale agente ipotensivo (Sinclair, 2003).
E’ improbabile, al contrario, che la medetomidina induca una significativa ipotensione, a causa della sua maggiore selettività recettoriale: sembra più plausibile che si manifesti ipotensione in seguito alla somministrazione di un α-2-agonista in associazione con un altro sedativo o anestetico.
Nel gatto, animale che vive in modo più stressante alcune operazioni veterinarie, si hanno spesso valori elevati di pressione ematica basale: questo potrebbe spiegare le minori escursioni pressorie, durante la sedazione con medetomidina (Sinclair, 2003). Un’altra teoria ipotizzata per motivare questa differente risposta pressoria nel gatto suggerisce che, in questa specie, potrebbero prevalere gli effetti α-2-adrenergici centrali, rispetto a quelli periferici.
Nonostante i numerosi effetti avversi, questa molecola rimane la più utilizzata nella pratica veterinaria grazie alla sua reversibilità: è presente, infatti, un antagonista specifico, l’atipamezolo (Antisedan®), in grado di annullare, in pochi minuti, sia gli effetti sedativo-analgesici, che quelli cardio-respiratori.
L’uso di questo sedativo, quindi, consente l’esecuzione di numerose manualità indispensabili nell’esercizio professionale quali sutura di ferite, interventi di chirurgia minore, effettuazione di radiografie o endoscopie; risulta, invece, fortemente sconsigliato in soggetti debilitati, in stato di shock, ed in animali affetti da patologie cardiovascolari o respiratorie (Sinclair, 2003).
KETAMINA
La ketamina è un derivato della fenciclidina, usato in medicina umana dal 1965 e dal 1970 in ambito veterinario (Paddleford, 2000).
Essa appartiene alla classe degli anestetici dissociativi, infatti induce nel paziente uno stato dissociativo nei confronti dell’ambiente circostante, caratterizzato da profonda analgesia somatica e leggero stato di incoscienza (Seymour e Gleed, 2003).
E’ responsabile dell’inibizione di legame del GABA nel SNC e del potenziamento dei meccanismi inibitori mediante il sistema del GABA; nel cane e nel gatto può ridurre la soglia di stimolazione del SNC al punto da creare crisi convulsive (Paddleford, 2000). Fenomeni convulsivi si possono verificare anche nella fase di risveglio, che risulta agitata, specialmente nel gatto in seguito alla percezione di rumori, luci e manipolazioni improvvise (Seymour e Gleed, 2003).
La ketamina aumenta il flusso ematico cerebrale ed il consumo cerebrale di ossigeno, inducendo un aumento della pressione endocranica e del liquido cefalorachidiano, per questo motivo è fortemente controindicata in soggetti con trauma cranico (Paddleford, 2000).
Provoca ipertono muscolare e si possono osservare movimenti muscolari involontari che talvolta esitano nello spasmo tonico-clonico dei muscoli degli arti.
La ketamina induce una ventilazione apneustica, caratterizzata, cioè da una lunga pausa successiva all’inspirazione. Se somministrata ad alte dosi, la respirazione può risultare irregolare e superficiale.
Spesso si verifica una diminuzione della frequenza respiratoria e, talvolta, una riduzione del volume corrente minuto (Paddleford, 2000).
Si osserva anche un aumento della salivazione e della lacrimazione (Seymour e Gleed, 2003).
La valutazione della profondità dell’anestesia risulta particolarmente difficoltosa dal momento che i riflessi faringeo, laringeo, corneale e podale rimangono sostanzialmente inalterati e gli occhi restano aperti (Seymour e Gleed, 2003).
La ketamina provoca a livello centrale il rilascio di catecolamine, cui consegue una stimolazione indiretta della funzione cardiovascolare. In soggetti sani esercita sul miocardio un effetto selettivo inotropo positivo ed induce tachicardia, aumento della gittata cardiaca, della pressione ematica arteriosa, della pressione arteriosa polmonare e di quella venosa centrale. Queste risposte, dose-dipendenti, sono provocate dalla stimolazione centrale del sistema simpatico e dall’aumentata attività del SNC (Paddleford, 2000). Gli effetti stimolanti sul sistema cardiovascolare possono essere ridotti con l’uso di benzodiazepine ed α-2-agonisti, in premeditazione.
I pazienti con carenza di catecolamine, al contrario, sperimentano l’effetto inotropo negativo, causato dall’azione diretta della ketamina sul cuore (Seymour e Gleed, 2003).
La somministrazione IV di ketamina induce, talvolta, un’ipotensione transitoria, poiché produce una temporanea depressione miocardica (Paddleford, 2000; Seymour e Gleed, 2003).
L’uso di questa molecola da sola è molto limitato a causa dei suoi effetti avversi: l’ipertono muscolare e la frequenza delle convulsioni, infatti, motivano il suo principale impiego in associazione con altri farmaci che presentino caratteristiche ad essa complementari. Come accennato in precedenza particolarmente efficaci risultano le combinazioni della ketamina con benzodiazepine, α-2-agonisti e tranquillanti fenotiazinici (Seymour e Gleed, 2003).
ACEPROMAZINA
L’acepromazina è il tranquillante fenotiazinico più utilizzato in medicina veterinaria. I suoi effetti sono sovrapponibili a quelli delle altre fenotizine, sebbene l’acepromazina sia ben più potente di promazina e clorpromazina.
Esercita la sua attività neurolettica sul SNC mediante il blocco dei recettori dopaminergici, coinvolti nella trasmissione degli impulsi nervosi. Deprime il SNC, agendo sui gangli basali, sull’ipotalamo, sul sistema limbico, sul tronco encefalico e sulla sostanza reticolare attivata (Paddleford, 2000).
Presenta, inoltre, proprietà antiemetiche, miorilassanti e leggermente antistaminiche; deprime il centro termoregolatore e, secondo alcuni autori, esercita un effetto anticonvulsivante (Seymour e Gleed, 2003).
A dosi terapeutiche produce irrilevanti effetti sull’apparato respiratorio: può determinare una riduzione della frequenza respiratoria, ma normalmente viene compensata da un aumento del volume tidalico, con il risultato di una ventilazione corrente/minuto normale. Al contrario, alte dosi di acepromazina o l’uso concomitante di narcotici o ipnotici, possono provocare depressione respiratoria (Paddleford, 2000).
L’uso di questo farmaco ad alti dosaggi o ripetute somministrazioni se non si ottenesse il grado di sedazione desiderato, è fortemente controindicato dal momento che non si ottiene una maggiore tranquillizzazione, ma soltanto un aumento degli effetti collaterali (Seymour e Gleed, 2003).
Tutti i derivati fenotiazinici provocano ipotensione non dose-dipendente; questa è causata da un blocco dei recettori α-1-adrenergici, dall’attività antiadrenergica periferica e dalla diretta azione vasodilatatoria. L’ipotensione, in soggetti premedicati con acepromazina, può determinare l’insorgenza di tachicardia sinusale riflessa (Paddleford, 2000). In caso di ipotensione profonda è importante intervenire somministrando fluidi
IV ed, eventualmente, utilizzando vasocostrittori o catecolamine (Seymour e Gleed, 2003).
Questa molecola, inoltre, inibisce la sensibilizzazione del miocardio alla catecolamine ed induce un effetto inotropo negativo (Paddleford, 2000).
Può causare diminuzione della temperatura corporea, in seguito alla marcata vasodilatazione periferica, alla ridotta attività muscolo-scheletrica ed alla depressione del centro termoregolatore (Paddleford, 2000).
L’acepromazina, inoltre, non ha proprietà analgesiche (Paddleford, 2000; Seymour e Gleed, 2003).
ASSOCIAZIONE MEDETOMIDINA-KETAMINA
L’associazione tra questi farmaci sembra essere molto efficace nella pratica veterinaria poiché l’attività dei due principi attivi si potenzia, andando a bilanciare le risposte che si otterrebbero in seguito a somministrazione di una sola delle molecole.
Secondo un studio condotto sulla specie felina, in particolare, la medetomidina indurrebbe un potenziamento dell’effetto anestetico della ketamina che si traduce in una riduzione del dosaggio necessario di quest’ultima (Moens e Fargetton, 1990).
La profondità e la durata dell’anestesia sono soddisfacenti, come anche l’analgesia ed il miorilassamento (Verstegen et al., 1991); inoltre, utilizzando bassi dosaggi di ketamina, l’intubazione endotracheale risulta agevole e non si osservano crisi convulsive né salivazione profusa (Ko et al., 2000).
L’incidenza del vomito è soprendentemente bassa (Moens e Fargetton, 1990; Verstegen et al., 1991); molto lievi risultano anche le variazioni della temperatura corporea (Moens e Fargetton, 1990, Ko et al., 2000).
La frequenza respiratoria e la circolazione polmonare non subiscono modificazioni significative, ad eccezione della fase iniziale di anestesia, caratterizzata da una transitoria bradipnea associata a lieve acidosi respiratoria (Serteyn et al., 1993). E’ stato osservato che queste alterazioni si presentano con intensità e frequenza direttamente proporzionali al dosaggio di ketamina somministrato. La transitoria ipoventilazione, osservata durante la fase di induzione, talvolta si rende responsabile di fenomeni di cianosi periferica (Moens e Fargetton, 1990, Ko et al., 2000).
L’effetto bradicardizzante della medetomidina viene in parte contrastato dalla ketamina, infatti si osserva una significativa diminuzione della frequenza cardiaca a 5 minuti dalla somministrazione dei due anestetici, ma già dopo 10 minuti questa raggiunge valori prossimi a quelli basali (Verstegen et al., 1991; Ko et al., 2000). La
riduzione della frequenza cardiaca risulta, comunque, meno pronunciata all’aumentare della dose di ketamina (Moens e Fargetton, 1990).
Anche la gittata cardiaca può subire una forte diminuzione, a causa della bradicardia e soprattutto in seguito all’aumento della resistenza vascolare sistemica; quest’ultima è inoltre responsabile della marcata ipertensione che è stata osservata in numerosi studi (Verstegen et al, 1991; Dobromylskyj, 1996; Ko et al., 2000), specialmente nei 15 minuti iniziali (Serteyn et al., 1993).
Sembra, infatti, che la pressione ematica non sia significativamente influenzata dalla ketamina, dal momento che le modificazioni pressorie tipiche della medetomidina, ovvero, un’ipertensione iniziale, seguita da ipo o, più spesso, normotensione, sono state ottenute anche in seguito all’associazione tra i due farmaci (Serteyn et al., 1993; Ko et al., 2000).
Valutando complessivamente gli effetti di questa associazione si può affermare che sia molto vantaggiosa, in quanto fornisce una buona anestesia, una completa analgesia, (dal momento che i due farmaci si potenziano poiché la ketamina determina analgesia somatica, mentre la medetomidina provoca analgesia viscerale) e miorilassamento; essa, inoltre, minimizza molti effetti avversi dei due farmaci: risulta assente o rara la comparsa di vomito, ipersalivazione ed ipotermia (Verstegen et al., 1991).
La combinazione medetomidina-ketamina, comunque, non è priva di alterazioni cardiovascolari; tuttavia sembra che queste siano provocate non tanto dall’associazione tra i due principi attivi, quanto dalla componente α-2-agonista, la cui azione viene in parte modulata dalla ketamina (Serteyn et al., 1993).
ASSOCIAZIONE ACEPROMAZINA-KETAMINA
La somministrazione di acepromazina, associata alla ketamina è pratica di largo uso poiché consente la drastica riduzione del dosaggio di quest’ultima e ne riduce, in parte, gli effetti avversi.
I principali vantaggi ottenuti da questa associazione sono l’effetto anticonvulsivante ed una riduzione degli spasmi muscolari.
Questa combinazione, tuttavia, non sembra essere particolarmente indicata nell’induzione di un’anestesia chirurgica, dal momento che la durata dell’effetto anestetico è piuttosto breve e l’analgesia viscerale ottenuta non è sufficiente (Verstegen et al., 1991).
Si osserva, inoltre, una marcata depressione della funzionalità cardiaca che si manifesta principalmente con una riduzione della gittata cardiaca: questa potrebbe essere provocata dalla somma degli effetti inotropo negativo, vasodilatatorio ed ipotensivo esercitati dall’acepromazina; quest’ultima, inoltre, inibendo la sensibilizzazione miocardica alle catecolamine, è responsabile anche della riduzione degli effetti stimolanti della ketamina sull’attività cardiovascolare.
La frequenza cardiaca non sembra subire particolari alterazioni; quella respiratoria, invece risulta significativamente ridotta (Farver et al., 1986).
Nel cane e nel gatto, quindi, si suggerisce l’uso di questa combinazione quando non si desidera una stimolazione cardiopolmonare; tuttavia, risulta fortemente sconsigliata in pazienti in stato di ipotensione o con funzionalità cardiorespiratoria depressa (Farver et al., 1986; Ingwersen et al., 1988a; Ingwersen et al., 1988b).