2. GLI AUTOANTICORPI NELL’AR
2.1. Valore predittivo degli autoanticorpi nella diagnosi e nell’evoluzione dell’AR: confronto fra Fattore Reumatoide e Anticorpi Anti Proteine/peptidi Citrullinati
La natura autoimmune dell’artrite reumatoide è indicata dalla presenza di anticorpi verso antigeni self nel siero e nel fluido sinoviale dei pazienti (24). Fra i vari autoanticorpi identificati nel tempo, due categorie hanno ricevuto particolare attenzione: quella dei Fattori Reumatoidi (FR), descritti per la prima volta nel 1940 da Waaler, e quella degli Anticorpi Anti Proteine/peptidi Citrullinati (Anti-
Citrullinated Protein Antibodies, ACPA), comprendenti, fra gli altri, gli anti-CCP (anti- Cyclic Citrullinated Peptides) il cui studio è iniziato nel 1964 con la scoperta del primo anticorpo del gruppo (Anti-Perinuclear Factor, APF), ma si è affermato negli anni Novanta del secolo scorso (21).
I Fattori Reumatoidi sono autoanticorpi prodotti localmente dalle plasmacellule situate nei follicoli linfoidi e in quelle strutture simili ai centri germinali dei linfonodi che si sviluppano nella sinovia infiammata. Essi appartengono alle classi IgM, IgG o IgA e reagiscono contro il frammento costante Fc delle immunoglobuline di classe IgG. L’osservazione di varie mutazioni somatiche e dello scambio di classe (switching) della catena
pesante (o “dell’isotipo”), vale a dire di quel riarrangiamento genico che
avviene durante la maturazione dei linfociti B e conduce all’espressione di Ig con una catena pesante diversa da quella espressa dalla plasmacellula fino a quel momento, prova che la produzione di queste immunoglobuline è diretta dai linfociti T helper, poiché tale processo dipende dalla cooperazione T-B (23). Le funzioni fisiologiche dei FR sembrano essere:
• aumentare la clearance degli immunocomplessi aumentandone le dimensioni e la capacità di interagire con vari recettori;
• favorire l’endocitosi degli immunocomplessi da parte dei linfociti B, e quindi l’efficacia del loro ruolo come APC verso i linfociti T;
• favorire la fissazione del complemento attraverso il legame con le IgG dell’immunocomplesso.
Si ritiene che i FR esercitino queste funzioni nell’AR in senso patogenetico, aumentando l’infiammazione e l’intrappolamento di antigeni artritogenici nella sinovia per deposizione degli immunocomplessi (23).
Il FR maggiormente rappresentato nei sieri dei pazienti è di classe IgM (IgM RF), rinvenibile nel 60-80% dei casi (23) ed è stato tradizionalmente utilizzato per la diagnosi e la valutazione sierologica dell’AR: infatti esistono test convalidati e standardizzati per la ricerca dei FR di classe IgM (RA test:
Rheumatoid Arthritis Test; Reazione di Waaler-Rose; Test ELISA). Tuttavia la presenza di FR non è specifica per AR, poiché esso viene riscontrato anche nel 5% dei soggetti sani, e la sua frequenza nella popolazione generale aumenta con l’età (il 10-20% dei soggetti sopra i 65 anni presenta un test positivo). Inoltre, anche numerose altre condizioni patologiche si associano alla sua presenza (Lupus eritematoso sistemico- LES-, sindrome di Sjogren, Sclerosi sistemica, Connettivite mista, infezioni virali come epatiti, HIV, EBV, parassitarie o batteriche).
Di conseguenza, il valore predittivo della presenza dei soli FR per la diagnosi di AR è scarso.
Ulteriori alterazioni siero-immunologiche presenti nell’AR sono rappresentate dalla presenza di anticorpi RA33 (hnRNP-A2), anti-calpastatina (un inibitore della proteasi neutra calcio-dipendente calpaina), ANCA (anticorpi citoplasma dei neutrofili), ANA (anticorpi anti-nucleo), anti-fibronectina, anti-collagene di tipo II e anti-GPI (glucosio-6-fosfato isomerasi). Ma anche in questo caso molti di questi autoanticorpi sono presenti in altre malattie immunitarie ed in individui sani.
Quindi la scarsa specificità di tutti gli anticorpi fin qui citati ha reso necessaria la ricerca di anticorpi che, oltre ad una buona sensibilità, si pregino anche di un’elevata specificità per poter approntare tests diagnostici attendibili.
Nel corso degli anni sono stati trovati e analizzati numerosi tipi di autoanticorpi. Inizialmente quelli diretti verso BiP (Heavy chain Binding Protein), mai utilizzati però nella routine clinica per l’assenza di dati sul loro valore predittivo; in seguito APF Fattore Perinucleare) e AKA (anti-cheratina) (26; 35), risultati poi membri della stessa famiglia anticorpale avente come bersaglio la pro-filaggrina, gli AFA (anti-filaggrina) (26), ma anch’essi mai utilizzati per la difficoltà nella standardizzazione e nel reperimento dei substrati; infine gli anti-CCP (anti-peptide ciclico
citrullinato). In realtà è stato recentemente scoperto che anche la reattività
degli AFA é citrullino-specifica, come nel caso degli anti-CCP.
Dall’inizio degli anni ’90, quindi, quando gli anti-CCP sono stati per la prima volta utilizzati per testare sieri umani in ELISA (36), e passando attraverso modificazioni successive del test che hanno portato alla produzione di kit diagnostici di seconda e terza generazione con caratteristiche di sensibilità e specificità sempre maggiori (del 70% e 96% rispettivamente) (22), essi nel 2007 sono stati infine inseriti dalla European League against Rheumatism nelle nuove linee guida per una diagnosi precoce di AR (1).
Gli anti-CCP sono, infatti, risultati predittivi dello sviluppo di AR: due diversi studi, che utilizzavano entrambi campioni sierici di pazienti con AR che erano stati donatori di sangue negli anni precedenti all’analisi, hanno riportato la presenza di anticorpi anti-CCP molto prima dell’esordio clinico della malattia (circa dieci anni prima) (37); in tali pazienti la positività agli anti-CCP inoltre aumentava gradualmente negli anni fino alla presentazione dei primi sintomi.
Dati recenti provenienti da numerosi studi longitudinali confermano l’abilità predittiva degli anti-CCP per l’insorgenza di AR. Inoltre pazienti con elevati livelli di tali markers sono particolarmente predisposti alla progressione radiografica delle lesioni ossee erosive (1; 2): ciò indica che la loro determinazione può aggiungere importanti informazioni sulla prognosi della malattia.
Gli anticorpi anti-proteine/peptidi citrullinati (ACPA) sono presenti in più
del 70% dei sieri di pazienti affetti da artrite reumatoide; tali autoanticorpi hanno un’alta specificità per la malattia (90-95%) e sono raramente presenti in sieri di pazienti affetti da altre patologie o in soggetti sani.
In generale gli ACPA hanno un più elevato valore diagnostico rispetto al Fattore Reumatoide in termini sia di sensibilità che di specificità (39).
Così come il FR, essi sono associati con forme più erosive di AR.
Sebbene gli ACPA possano essere distinti in diversi tipi di autoanticorpi a seconda dell’antigene utilizzato per la loro individuazione, la citrullina, un amminoacido non codificato nel DNA, è il componente critico comune del loro determinante antigenico; la sua assenza, infatti, porta al mancato riconoscimento dell’antigene da parte dell’anticorpo anche se, come verrà
precisato in seguito, la sua presenza da sola non è sufficiente ad innescare la risposta anticorpale.
Nella sinovia infiammata dei pazienti con artrite reumatoide, la citrullinazione a carico di proteine autologhe le rende potenzialmente antigeniche, innescando la risposta autoimmune che presiede alla produzione degli ACPA.
2.2 La reazione di citrullinazione
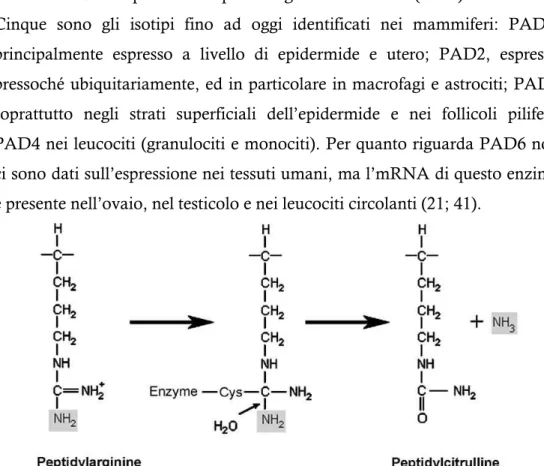
La citrullinazione è una modificazione post-traduzionale in cui un residuo di peptidil-arginina viene convertito in uno di peptidil-citrullina dal complesso enzimatico Ca++-dipendente Peptidil-Arginina Deiminasi (PAD).
Cinque sono gli isotipi fino ad oggi identificati nei mammiferi: PAD1, principalmente espresso a livello di epidermide e utero; PAD2, espresso pressoché ubiquitariamente, ed in particolare in macrofagi e astrociti; PAD3 soprattutto negli strati superficiali dell’epidermide e nei follicoli piliferi; PAD4 nei leucociti (granulociti e monociti). Per quanto riguarda PAD6 non ci sono dati sull’espressione nei tessuti umani, ma l’mRNA di questo enzima è presente nell’ovaio, nel testicolo e nei leucociti circolanti (21; 41).
Figura 14. La citrullinazione consiste nella trasformazione enzimatica dell’arginina in
citrullina. L’enzima che catalizza la reazione è la peptidilarginina deiminasi (PAD). Durante la reazione, l’Arg è attaccata dal residuo di Cys dell’enzima, formando un addotto tetraedrico, mentre viene rilasciata ammoniaca. L’addotto viene scisso dall’attacco nucleofilo di una molecola d’acqua, che libera il residuo di Cys e forma il gruppo chetonico.
Come descritto nella fig.12, la reazione comporta la perdita di un gruppo amminico primario del gruppo guanidinico come NH3: per questo motivo dovrebbe essere considerata, più propriamente, come deaminazione, ma poiché il prodotto è un amminoacido deiminato, è chiamata “deiminazione” (21).
Tale modificazione, convertendo un amminoacido basico, l’Arg, in uno neutro, la citrullina, altera la struttura, l’antigenicità e la funzione della proteina.
Nel tessuto sinoviale infiammato dei pazienti con AR, gli isoenzimi maggiormente espressi sono PAD2 e PAD4, ma quest’ultimo è quello maggiormente studiato per il suo ruolo in varie patologie autoimmuni, AR compresa (19). Si tratta di una proteina di 663 amminoacidi e 74 kDa codificata da una sequenza genica costituita da 55000 paia di basi suddivisi in 16 esoni. La struttura quaternaria è quella di un dimero le cui due molecole hanno una disposizione testa-coda. Ciascuna ha una forma allungata e vi si possono distinguere il dominio ammino-terminale (dall’amminoacido Met-1 alla Pro- 300) da quello carbossi-terminale (26). Il primo presenta due sottodomini di struttura simile a quella delle immunoglobuline: uno è costituito da nove foglietti β e reca la sequenza di localizzazione nucleare 56
PPAKKKST63, che nel ripiegamento della molecola si viene a ritrovare in una regione ripiegata esposta sulla superficie della stessa, a formare ponti H con l’acqua; il secondo sottodominio è formato da dieci foglietti β, quattro brevi α- eliche e lega tre dei cinque ioni Ca++.
Il dominio carbossi-terminale si estende dai residui Asn-301 a Pro-663, e presenta cinque moduli ββαβ disposti circolarmente in una struttura detta αβ-
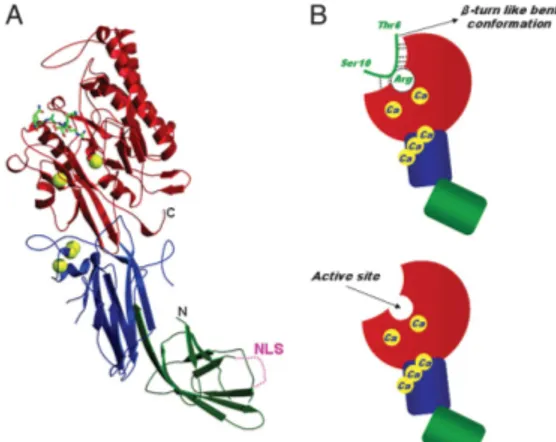
propeller: è questa ad ospitare il sito attivo dell’enzima, che lega i restanti due ioni Ca++ e le proteine-substrato. In figura è rappresentato l’enzima, legante il Ca++ ed uno dei suoi substrati, il peptide costituito dalla sequenza ammino-terminale dell’istone H3 (25):
Figura 15. Struttura della PAD4 legata al Ca++ e complessata con il peptide H3-1 (A)
Struttura a nastro: gli ioni Ca++ ed il peptide istonico sono mostrati, rispettivamente, come sfere gialle e bastoncino verde. I sottodomini N-terminali 1 e 2 sono colorati in verde e blu, il dominio C-terminale in rosso. Il segnale di localizzazione nucleare (NLS) nel sottodominio 1 è rappresentato dalla linea tratteggiata. (B) Schema della struttura mostrata in (A), con analoga distribuzione dei colori. Le linee tratteggiate sono ponti H attraverso i quali PAD 4 riconosce una regione – consenso del substrato.
Da esperimenti in vitro, risulta che gli enzimi PAD necessitano di una concentrazione intracellulare di calcio relativamente alta per essere attivi (10-5 M o più), mentre in condizioni normali essa varia fra 10-8 e 10-6 M. Ciò indica, e gli studi confermano, che la citrullinazione necessita, in molti casi, di condizioni “estreme”: nell’attivazione cellulare e nelle cellule che stanno andando incontro a morte, quando la membrana cellulare permette il trasferimento di ingenti quantità di calcio extracellulare all’interno della cellula o il calcio viene liberato dai depositi intracellulari. La citrullinazione è, infatti, implicata nell’apoptosi.
Anche l’infiammazione però è uno dei momenti in cui, sia in modelli animali, sia nella sinovia dei pazienti affetti da AR, è possibile ritrovare proteine citrullinate. Tuttavia, normalmente il sistema immunitario non entra in contatto con tali proteine, che rimangono confinate all’interno delle cellule apoptotiche prima che le cellule stesse vengano fagocitate dai macrofagi; ma quando invece i meccanismi di clearance diventano inefficienti a causa, per esempio, di una massiva morte cellulare, i PAD e le proteine citrullinate possono uscire dalle cellule ed “incontrare” il sistema immunitario.
Sempre nell’ambito dei potenziali antigeni citrullinati che l’ambiente infiammatorio può offrire alla risposta immune specifica, è stato individuato recentemente un meccanismo che vede come attori i neutrofili (30; 31), e che consiste nella liberazione, da parte di queste importanti cellule dell’immunità naturale, delle Trappole Extracellulari dei Neutrofili (Neutrophil Extracellular
Traps, NETs). Si è scoperto, infatti, che i neutrofili utilizzano un sistema
particolare per rendere inoffensivi i microrganismi durante le infezioni, oltre alla fagocitosi: durante la loro degranulazione, i neutrofili in via di apoptosi espellono al loro esterno, con un meccanismo ancora non chiarito, una rete di cromatina decondensata che intrappola il potenziale patogeno, facilitandone l’eliminazione da parte delle altre cellule immunitarie preposte.
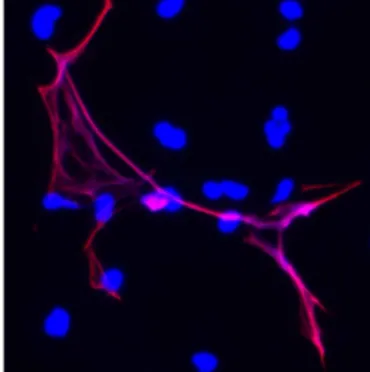
Figura 16. Una trappola extracellulare dei neutrofili (NET, in rosso) cattura dei microbi di
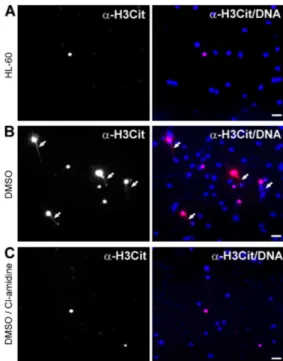
I granuli dei neutrofili contengono PAD4 in quantità elevata, e così anche le linee cellulari leucemiche HL-60 in via di differenziazione in granulociti. Sono stati condotti esperimenti su queste ultime, indotte alla differenziazione con DMSO ed incubate col batterio Shigella flexneri, noto per indurre la formazione di NETs nei neutrofili del sangue periferico, in presenza di IL-8 (30), cioè di una chemochina pro-infiammatoria. I risultati ottenuti hanno dimostrato un significativo aumento della citrullinazione dell’istone H3 e della concomitante formazione di NET.
Figura 17. PAD 4 promuove la formazione di NET dopo trattamento con citochine e batteri e per la perdita dell’eterocromatina e della struttura nucleare multilobata. Le figure mostrano la
citrullinazione dell’istone H3 e lo staining del DNA in cellule HL-60 non differenziate (A), differenziate con DMSO (B), differenziate con DMSO e pretrattate con Cl-amidina, inibitore della PAD4 (C) dopo trattamento con IL-8 ed il batterio S. flexneri. Le frecce indicano la cromatina decondensata marcata con l’anticorpo anti- H3 Citrullinato (H3Cit). (30)
Se la citrullinazione durante la flogosi è ben spiegabile, devono esistere nondimeno altri fattori coinvolti nell’attività dell’enzima, diversi dalla concentrazione di Ca++, che la permettono in condizioni fisiologiche: infatti la citrullinazione è coinvolta in diversi processi, fra i quali la regolazione genica (19; 21; 22). PAD 4, l’unico dei cinque isoenzimi ad avere una sequenza amminoacidica che agisce come segnale di localizzazione nucleare, antagonizza la metilazione dei residui di Arg a livello di sequenze-promotore negli istoni H3 ed H4 da parte delle rispettive metiltransferasi durante l’attivazione trascrizionale indotta da ormoni. Tale antagonismo consiste nella citrullinazione anche di residui di Arg già metilata, laddove il prodotto secondario della reazione è la metilammina al posto dell’ammoniaca.
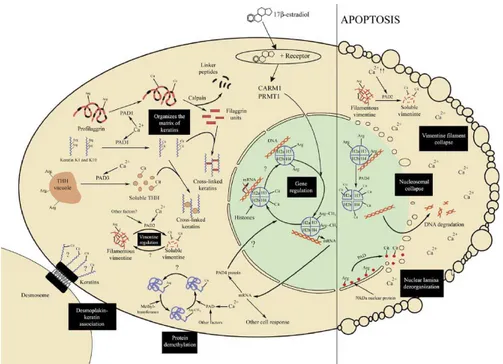
La figura seguente riporta una panoramica dei processi in cui è coinvolta la citrullinazione nella cellula in apoptosi e non.
Figura 18. Schema dei processi intracellulari di citrullinazione nelle cellule non apoptotiche e apoptotiche. I processi principali sono indicati dai rettangoli neri:
demetilazione delle proteine, organizzazione della matrice cheratinica, associazione fra desmoplachina e cheratina nei desmosomi, regolazione genica; disorganizzazione della lamina nucleare, regolazione dell’assemblaggio- disassemblaggio dei filamenti di vimentina,
unfolding dei nucleosomi (21).
2.3 Antigeni riconosciuti dagli ACPA
Esistono diversi antigeni self riconosciuti dagli ACPA, ed alcuni di essi sono stati utilizzati in metodi commerciali impiegati per la determinazione di questi anticorpi. Il primo sfrutta peptidi ciclici citrullinati (CCP) derivati dalla filaggrina, ma altri si basano sulla vimentina ricombinante deiminata (MCV), o peptidi virali citrullinati (VCP) derivati da proteine codificate dal virus di Epstein-Barr (in questo caso l’antigene è non-self). Inoltre possono essere utilizzati il fibrinogeno/fibrina, il collagene di tipo II e l’α-enolasi, tutte proteine espresse a livello articolare; la fibrina in particolare si trova in quantità aumentate nella sinovia dell’AR.
Il titolo di anticorpi reattivi con questi vari substrati è simile: i vari metodi per la rilevazione di ACPA sono tutti fortemente correlati fra di loro. Esistono però sieri che reagiscono in modo differente con i vari substrati, indicando quindi che gli ACPA costituiscono una famiglia di anticorpi con specificità simili ma non identiche.
Inoltre, esistono sieri che reagiscono con differenti antigeni citrullinati: ciò può dipendere dalla presenza di una singola popolazione di anticorpi cross-reattivi con antigeni diversi, oppure dall’esistenza di diverse popolazioni anticorpali, ciascuna delle quali può reagire con uno specifico antigene. E’ stato dimostrato che alcuni sieri di AR contengono anticorpi crossreattivi, mentre altri contengono popolazioni indipendenti di ACPA.
L’identificazione di molti antigeni citrullinati potrebbe suggerire che sia la mera presenza della citrullina a conferire l’antigenicità e che le molecole su cui tale residuo si trova siano in realtà non significative. E’ bene precisare, invece, che la risposta anticorpale nell’AR sembra determinata dalla presenza sì di residui citrullinati ma che questi si debbano trovare vicini ad alcuni
particolari aminoacidi nelle sequenze peptidiche degli antigeni chiamati in causa; cioè la citrullina deve trovarsi in un appropriato “ambiente
aminoacidico” affinché possa agire da innesco per la risposta anticorpale. I dati più recenti sulla cross-reattività degli anticorpi supportano invece la tesi che sia l’intera molecola antigenica, piuttosto che lo specifico epitopo contenente la citrullina, a guidare la risposta autoimmune. Esiste quindi un generale consenso sul fatto che l’autoimmunità specifica dell’AR sia caratterizzata dalla reattività verso una “famiglia” di antigeni strutturalmente o funzionalmente correlati (28).
Fatte queste considerazioni, la domanda da porsi rimane quella su quanti e quali possano essere gli antigeni specifici che, una volta citrullinati, determinano la produzione degli ACPA.
2.4 Fattori che influenzano la produzione di ACPA
La presenza delle sole proteine citrullinate non conduce di per sé alla produzione di ACPA, in quanto essa è strettamente dipendente dal
background genetico del paziente.
Il fattore genetico di rischio più importante per l’AR è costituito da alcuni alleli dei geni che codificano per le proteine dell’antigene leucocitario umano di classe II (HLA-DR; 28). Queste proteine, espresse sulla membrana di cellule presentanti l’antigene (APC) come macrofagi, linfociti B, cellule dendritiche, sono degli eterodimeri costituiti da una catena α (codificata dal locus HLA-DRA) ed una β (codificata dal locus HLA-DRB1), aventi struttura simile: 2/3 della molecola sono situati sul versante extracellulare, e
sono distinti in una regione di tipo immunoglobulinico (α2 e β2, rispettivamente), più vicina alla membrana plasmatica, ed una regione di legame per il peptide, cioè per l’antigene (α1 e β1), di sequenza estremamente variabile. La restante parte della catena di ciascun monomero è formata da una regione transmembrana di circa 25 residui amminoacidici idrofobici che formano un’α-elica e dalla regione citoplasmatica carbossi-terminale, di lunghezza variabile (3).
Le regioni α1 e β1 sono ripiegate a formare una tasca che accoglie l’antigene, il cui fondo è costituito da domini planari di foglietti β e le pareti da domini ad α-elica.
Alcuni alleli HLA-DRB1 sono fortemente associati con la presenza di AR: HLA-DRB1*0101, HLA-DRB1*0102, HLA-DRB1*0401, HLA-DRB1*0404, HLA-DRB1*0405, HLA-DRB1*0408, HLA-DRB1*0410 HLA-DRB1*1001, HLA-DRB1*1402. Essi condividono la codifica di una sequenza amminoacidica chiamata “epitopo condiviso” (Shared epitope, SE) costituita dai residui da 70 a 74 della terza regione ipervariabile della catena β1 (27). Questa sequenza può essere QKRAA, QRRAA o RRRAA, e rientra in un’α-elica che forma uno dei lati della tasca per l’antigene. Inoltre, questi allelinon solo sono associati con la produzione di ACPA, ma rendono la produzione anticorpale degli ACPA altamente specifica(42).
Mediante i test diagnostici per la ricerca di ACPA, è possibile distinguere tra due veri e propri sottotipi di malattia: l’AR ACPA- positiva e l’AR ACPA- negativa (28): la prima, come detto, associata alla presenza dello “shared epitope” e presente in più dei due terzi dei pazienti; la seconda, non associata allo “shared epitope” bensì con l’allele DRB1*03.
Per quanto riguarda l’AR ACPA- positiva, accanto ai fattori genetici possono concorrere alla produzione di tali anticorpi anche alcuni di tipo
ambientale: sono state fatte molte ipotesi, come quella su infezioni da
micobatteri o virus di Epstein-Barr che innescherebbero la risposta immune iniziale, ma a tutt’oggi non è stata dimostrata una relazione patogenetica fra alcun antigene di derivazione batterica e l’AR (2). L’unica causa ambientale attualmente provata è il fumo di sigaretta, confermata anche da modelli murini di AR, come quello dell’artrite indotta da collagene tipo II (29). Cellule provenienti da lavaggi broncoalveolari di pazienti fumatori esprimono diversi antigeni citrullinati, mentre questi sono assenti in pazienti non fumatori (2; 43).
2.5 Effetti biologici degli ACPA
Le evidenze sperimentali ottenute negli anni recenti che suggeriscono un ruolo degli
ACPA nella patogenesi dell’artrite reumatoide sono le seguenti:
1. In modelli animali di artrite, l’immunizzazione con collagene di tipo II induce la produzione di anticorpi anti collagene e di ACPA. Negli stessi modelli, la somministrazione di ACPA contemporaneamente ad anticorpi anti collagene induce artriti più gravi rispetto alla somministrazione di soli anticorpi anti collagene (22).
2. Nei pazienti con AR sono presenti immunocomplessi circolanti (IC) contenenti fibrinogeno deiminato; tali IC colocalizzano con il fattore 3 del complemento a livello sinoviale, suggerendo l’attivazione della via classica del complemento ad opera dei complessi ACPA-antigeni citrullinati (56).
3. Gli ACPA legano la Grp78, una proteina intracellulare che nella sua forma troncata è espressa sulla membrana delle U937 e contiene citrulline; il legame degli ACPA alla membrana di tali cellule aumenta l’attività di NF-kB e induce la sintesi di TNF-alfa (57).