Capitolo 1
Il tumore della mammella
1.1
Aspetti biologici
1.1.1
Il tumore
Il termine tumore viene usato per descrivere una vasta famiglia di malattie, il cui denominatore comune `e la riproduzione incontrollata, in un determinato distretto corporeo, di cellule modificate. Tali cellule (dette anche neoplastiche, perch´e di “nuova formazione”) hanno origine da un’unica cellula dell’organismo che, dopo una normale differenziazione, ha subito una serie sequenziale di danni genomici trasmissibile alla sua progenie. Nella maggior parte dei casi le cellule neoplasti-che formano una massa rilevata sul sito anatomico di origine (da cui il nome di tumore, che letteralmente significa tumefazione). Se le cellule tumorali riescono a penetrare nei vasi sanguigni o nei dotti linfatici possono essere trasportate dalle correnti ematiche o linfatiche e raggiungere altri organi anche lontani dalla sede di origine, generando colonizzazioni neoplastiche note con il nome di metastasi.
Dal punto di vista del comportamento biologico i tumori si suddividono in “be-nigni” e “maligni”, anche se a volte non `e possibile attribuirli con precisione all’u-na o all’altra categoria (tumori “borderline” o tumori a comportamento biologico incerto). Nel tumore benigno le cellule neoplastiche mantengono pressoch´e
terate le loro caratteristiche morfologiche e funzionali, pur esibendo autonomia moltiplicativa in quanto non rispondono ai meccanismi di controllo della prolife-razione cellulare; inoltre sono caratterizzate da uno sviluppo detto “espansivo”, cio`e si espandono comprimendo le cellule vicine, ma rimanendo ben distinte da esse. Il tumore benigno presenta una lenta velocit`a di crescita, non d`a luogo a metastasi e, una volta rimosso, solo raramente `e recidivo: grazie a queste peculia-rit`a la prognosi `e normalmente fausta. Al contrario, le cellule che costituiscono il tumore maligno (detto anche cancro) presentano caratteristiche morfologiche e funzionali molto diverse da quelle del tessuto di origine, con mancanza di unifor-mit`a nella forma e nelle dimensioni (polimorfismo). In questo caso lo sviluppo `e detto “espansivo/infiltrativo”: i tessuti limitrofi vengono infiltrati e distrutti dalle cellule tumorali che si sostituiscono a quelle normali (fenomeno noto col termine di invasivit`a neoplastica), i confini del tumore non sono netti e ci`o rende il tu-more stesso pi`u difficile da individuare. Queste caratteristiche, unite all’elevata velocit`a di crescita, alla frequente presenza di metastasi e a un’alta recidivit`a, ren-dono la prognosi del tumore maligno severa e se non trattato normalmente infausta [Men95].
1.1.2
Il cancro della mammella
Anatomia
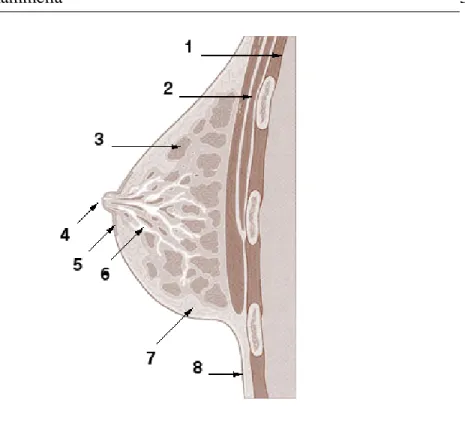
Nella donna la mammella (fig. 1.1) `e costituita dalla struttura ghiandolare che produce il latte (organizzata in lobuli), dai canali che collegano i lobuli al capez-zolo (dotti galattofori), da tessuto adiposo in cui sono immerse le strutture ghian-dolari e da tessuto fibroso di sostegno. La mammella `e inoltre percorsa da una fitta rete di vasi sanguigni e di dotti linfatici: questi ultimi contengono la linfa, il fluido che trasporta le cellule del sistema immunitario (linfociti) e i prodotti di scarto dei tessuti. I dotti linfatici afferiscono ai linfonodi, che fungono da stazioni in cui i linfociti possono maturare e accumularsi per combattere i virus e i batteri che minacciano l’organismo. La maggior parte dei dotti linfatici mammari conduce ai linfonodi ascellari: perci`o la presenza di cellule tumorali in questi linfonodi `e in-terpretato come un chiaro segno di tumore maligno della mammella. Nonostante questa struttura generale, la conformazione della mammella e le proporzioni tra i vari tipi di tessuto possono variare molto da un caso all’altro e in particolare sono fortemente dipendenti dall’et`a [Bal93].
Figura 1.1: Anatomia della mammella. 1. Cassa toracica; 2. Muscoli pettorali; 3. Lobuli; 4. Capezzolo; 5. Areola; 6. Dotti; 7. Tessuto adiposo; 8. Cute.
Epidemiologia
Nella mammella possono svilupparsi diversi tipi di tumori, la maggior parte dei quali sono benigni e non costituiscono una minaccia per la vita. Ciononostante, il tumore maligno della mammella `e il cancro pi`u frequente nel sesso femminile ed `e la principale causa di morte nelle donne occidentali fra i 40 ed i 50 anni.
In Italia si registrano oltre 11000 decessi l’anno, accompagnati da un sensi-bile incremento dell’incidenza: ci sono circa 32000 nuovi casi di cancro che si sviluppano ogni anno. Negli ultimi anni si `e registrato un aumento dei casi di cancro mammario e, se tale tendenza proseguir`a, prossimamente si prevede circa 1 milione di nuovi casi l’anno in tutto il mondo [Ist06] [WHO03] [WHO06].
In Toscana il tumore al seno ha rappresentato il 24.8% delle diagnosi per tu-more (anni 2000-2003) e per il 2006 sono stimati 3506 nuovi casi. Come in altri paesi occidentali, negli ultimi anni `e stata registrata una significativa riduzione della mortalit`a. Ci`o `e in gran parte dovuto ai progressi terapeutici e alla diffusione dei programmi di screening mammografici che hanno contribuito al miglioramen-to della diagnosi precoce. Questa tendenza indica che `e molmiglioramen-to importante
raffor-zare le strategie di diagnosi precoce e prevenzione, dando anche facilit`a di accesso a cure efficaci, e consentendo un equo trattamento a livello nazionale. Anche la sopravvivenza a 5 anni `e migliorata nel corso degli anni e oggi si attesta intorno al 90% se il tumore `e individuato precocemente [Cspo06].
Classificazione
I tumori maligni della mammella pi`u comuni sono [Hen95]:
• Carcinoma lobulare in situ (LCIS): `e un tumore che non si diffonde oltre il lobulo dove si `e sviluppato. Pur non essendo un cancro a tutti gli effetti, il LCIS aumenta nella donna il rischio di tumore maligno.
• Carcinoma lobulare infiltrativo (ILC): si sviluppa in un lobulo e pu`o dif-fondersi in altre parti del corpo; l’incidenza di questo tumore `e compresa fra il 10% e il 15%.
• Carcinoma duttale in situ (DCIS): `e il cancro della mammella al suo stadio iniziale ed `e confinato nei dotti. Quasi il 100% delle donne affette dal cancro in questa fase possono essere guarite.
• Carcinoma duttale infiltrativo (IDC): questo tipo di cancro si sviluppa in un dotto, ne attraversa le pareti e invade il tessuto adiposo della mammella. Da qui pu`o diffondersi in altre parti del corpo. L’IDC `e il cancro della mammella pi`u comune (circa l’80% dei casi).
1.2
Diagnosi e stadiazione del cancro della
mammel-la
Il fattore decisivo nella cura del cancro della mammella `e la diagnosi precoce: pi`u piccole sono le dimensioni del tumore diagnosticato, maggiore `e la probabilit`a di guarigione. Nella maggior parte dei casi il tumore si presenta alla donna o al medico come un nodulo duro alla palpazione; ogni nodulo che compare dopo i 30 anni deve essere considerato dubbio. Per essere palpabile il nodulo deve essere abbastanza grande (circa 1 cm di diametro) e questo incide negativamente sulla probabilit`a di guarigione. Spesso `e il radiologo durante una mammografia o un’ecografia a vedere un tumore non palpabile: questi sono i veri casi iniziali, che guariscono quasi al 100%.
La stadiazione `e il processo grazie al quale `e possibile determinare lo stadio di evoluzione del tumore e il suo grado di diffusione nell’organismo. `E di fondamen-tale importanza, in quanto da essa dipendono il trattamento medico e l’aspettativa di vita della paziente. La stadiazione del cancro della mammella segue la clas-sificazione TNM [Fle97], che dipende da tre fattori: le dimensioni del tumore primario (Tumor, T), la presenza di metastasi nei linfonodi ascellari (Node, N) e la presenza di metastasi negli organi distanti (Metastasis, M).
Seguendo la classificazione TNM (limitatamente al fattore T), le dimensioni del tumore possono essere definite nel modo seguente:
• T1a: diametro del tumore maggiore di 0.1 cm (' 0.0042 cc) e minore o uguale a 0.5 cm (' 0.52 cc).
• T1b: diametro del tumore maggiore di 0.5 cm (' 0.52 cc) e minore o uguale a 1 cm (' 4.2 cc).
• T1c: diametro del tumore maggiore di 1 cm (' 4.2 cc) e minore o uguale a 2 cm (' 33.5 cc).
Il limite fra gli stadi T1b e T1c definisce approssimativamente la soglia che separa i tumori palpabili da quelli non palpabili. Attualmente, la diagnosi del tumore allo stadio T1a o T1b rappresenta il passo fondamentale per il successo della terapia: infatti l’incidenza di linfonodi positivi in questi stadi `e solo del 3%. Invece nello stadio T1c l’incidenza di linfonodi positivi `e del 49%, con alto grado di invasivit`a [Bar97]. Data l’importanza della diagnosi precoce, una tecnica diagnostica sar`a tanto pi`u importante quanto pi`u sar`a efficace nel rivelare tumori di piccole dimensioni.
L’efficienza di una tecnica diagnostica `e caratterizzata dalla sua sensibilit`a e dalla sua specificit`a, definite come:
Sensibilit`a = numero di veri positivi
numero di veri positivi + numero di falsi negativi Specificit`a = numero di veri negativi
numero di veri negativi + numero di falsi positivi La sensibilit`a misura la capacit`a della tecnica di diagnosticare la malattia, mentre la specificit`a misura la capacit`a della tecnica di accertarne l’assenza.
1.2.1
Le tecniche diagnostiche standard
Attualmente gli esami pi`u importanti per la diagnosi di un tumore mammario sono:
• Autopalpazione: `e l’autoesame del seno che la donna fa per ricercare ogni nodularit`a che compaia nelle mammelle.
• Visita senologica (palpazione): `e l’esame eseguito da un medico che potr`a cos`ı riscontrare un nodulo sospetto.
• Mammografia Rx: `e la radiografia (immagine 2D ottenuta ai raggi X) della mammella. `E la tecnica normalmente usata per lo screening primario, cio`e l’esame preventivo cui vengono sottoposte le donne apparentemente sane. Tutte le donne dai 40 anni in poi dovrebbero eseguire periodicamente una mammografia (nei casi di familiarit`a viene consigliato di anticipare la prima mammografia a 35 anni). Quando la mammella `e molto compatta e densa la mammografia perde efficacia e deve essere accompagnata dall’ecografia. • Ecografia: `e una tecnica che utilizza le riflessioni di un fascio di ultrasuoni per ottenere un’immagine degli organi interni del corpo. Di solito si esegue nelle donne di et`a inferiore a 35 anni, le cui mammelle sono troppo dense per essere ben visualizzate alla mammografia, e nelle donne che non hanno allattato. In generale comunque, essendo innocua, `e indicata anche annual-mente nelle donne prima della menopausa e in modo complementare alla mammografia ogni qualvolta questa non risulti “conclusiva”. Si usa anche per vedere se un nodulo `e solido o contiene liquido (cisti).
Quando gli esami clinici e radiologici evidenziano un nodulo sospetto `e ne-cessario fare accertamenti pi`u approfonditi, come l’agoaspirato. L’agoaspirato `e la prima delle manovre in grado di dare una diagnosi citologica di certezza di un nodulo giudicato sospetto. Pu`o essere effettuato a mano libera se il nodulo `e palpa-bile o sotto guida ecografica o mammografica se `e evidenziapalpa-bile solo dagli esami strumentali. Per avere un esame pi`u conclusivo `e per`o necessaria l’analisi istologi-ca, che si ottiene oggi con il MammotomeT M, una biopsia mininvasiva consistente nel prelievo di campioni di tessuto con un’unica introduzione di una sonda steri-le monouso. In altri casi, sempre pi`u rari, `e necessaria la biopsia intraoperatoria [Lega07].
1.2.2
Lo screening mammografico
Con il termine “screening oncologico” si intende l’insieme delle prestazioni svolte dalla sanit`a pubblica per sottoporre un’intera popolazione sana a test dia-gnostici, per individuare in modo precoce l’insorgenza di tumori e permettere cos`ı che possano essere curati. Secondo le Linee Guida indicate dal Ministero della Salute, i programmi di screening del cancro mammario devono prevedere l’ese-cuzione a cadenza biennale di un esame mammografico ed essere indirizzati alle donne nelle fasce di et`a a maggior rischio, con priorit`a per le donne in et`a compre-sa tra 50 e 69 anni, per le quali `e stato rilevato il miglior rapporto costo-beneficio [Lin96].
`
E dimostrato che la diagnosi precoce di un cancro della mammella ai primi stadi aumenta la probabilit`a di guarigione: dati scientifici dimostrano infatti che lo screening mammografico `e in grado di ridurre la mortalit`a per cancro alla mam-mella, nelle donne di et`a compresa tra i 50 e i 69 anni, di circa il 30% [WHO1]. L’immagine mammografica `e ottenuta facendo attraversare la mammella da una fascio di raggi X (di circa 20-30 keV) proveniente da una sorgente puntiforme (' 300 µm). L’attenuazione del fascio `e proporzionale alla densit`a elettronica dei tessuti attraversati, cosicch´e l’immagine mammografica 2D risulta essere una proiezione della distribuzione 3D della densit`a elettronica. Un aumento dell’at-tenuazione pu`o essere interpretato come una formazione tumorale. Durante la mammografia la mammella viene compressa fra due piastre per ridurre la quantit`a di tessuto fra la sorgente di raggi X e il rivelatore: questo aumenta notevolmente il rapporto segnale/rumore e il contrasto nell’immagine, permettendo cos`ı la dia-gnosi di tumori pi`u piccoli. La sensibilit`a di questa tecnica, combinata con altri test, `e pi`u alta dell’85%; tuttavia, come gi`a accennato, essa si riduce drasticamente in presenza di mammelle dense [Bau97].
Il successo dimostrato dalla mammografia nel diagnosticare precocemente i tumori non deve far pensare che questa tecnica permetta da sola di effettuare la diagnosi corretta. Infatti, non essendo in grado di distinguere chiaramente le le-sioni benigne da quelle maligne, essa ha una bassa specificit`a: circa il 15-30% per i tumori non palpabili e circa il 20-30% per quelli palpabili; la bassa specificit`a `e evidenziata da un’alta percentuale (70-80%) di biopsie negative (lesioni benigne) [Kop92].
In conclusione, lo screening mammografico pu`o essere considerato la migliore tecnica di screening per le donne asintomatiche (screening primario); per fare una diagnosi `e per`o necessaria una tecnica di screening secondario (cio`e, dedicata alle donne che potrebbero avere il cancro). La definizione dei requisiti che dovrebbe
avere una tecnica di imaging utilizzabile per lo screening secondario in termini di sensibilit`a e specificit`a `e piuttosto complessa, e non esistono valori di riferimento. Certamente, la specificit`a dovrebbe essere superiore all’80%, per poter ragione-volmente escludere la presenza di un tumore maligno; ma, allo stesso tempo, la caratteristica principale della tecnica dovrebbe essere la capacit`a di individuare la sua presenza con sufficiente sensibilit`a. A questo proposito, c’`e da tener presente che una tecnica che dimostrasse una sensibilit`a del 100% per tumori pi`u grandi di 1 cm non avrebbe grande rilevanza clinica; invece, una tecnica con una sensibi-lit`a del 75% ottenuta su tumori oltre il 50% dei quali pi`u piccoli di 1 cm avrebbe un’alta valenza diagnostica, perch´e permetterebbe un trattamento con alta proba-bilit`a di guarigione. Va comunque detto che in alcuni casi la diagnosi definitiva di un tumore della mammella pu`o darla solo la biopsia.
1.3
I metodi della Medicina Nucleare: SPECT e PET
La mammografia fornisce immagini ad alta risoluzione della mammella, per-mettendo di “vedere” la sua struttura interna (tecniche di questo tipo sono dette di imaging morfologico), ma non d`a alcuna informazione sulle caratteristiche biochi-miche e sull’attivit`a metabolica dei tessuti indagati, che potrebbero essere “spia” della presenza di un cancro.
Negli ultimi anni la comunit`a scientifica si `e mostrata sempre pi`u interessata verso tecniche di imaging per il cancro della mammella che prevedono l’utilizzo di radioisotopi (scintimammografia), specialmente per lo screening secondario. La SPECT (Single Photon Emission Computed Tomography) e la PET (Positron Emission Tomography) sono tecniche adoperate in Medicina Nucleare che per-mettono l’indagine in vivo dei processi metabolici e fisiologici che avvengono nei tessuti biologici, e sono perci`o dette di imaging funzionale. Esse sono in grado di ricostruire la distribuzione 3D di un radioisotopo emettitore di fotoni (SPECT) o di positroni (PET) entro un determinato campo di vista (Field of View, FoV).
Nella SPECT, un singolo fotone viene emesso da un nucleo radioattivo (ad esempio, un fotone da 140 keV da parte di un nucleo di 99mTc). Un rivelatore di raggi γ, accoppiato ad un collimatore di piombo a fori paralleli, determina la linea di volo (Line of Flight, LoF) del fotone. Tutto il sistema ruota attorno al FoV, permettendo cos`ı l’acquisizione di un set di misure, una per ogni vista (ac-quisizione tomografica). A partire dai dati acquisiti, algoritmi di ricostruzione dedicati permettono di risalire alla distribuzione del radioisotopo. Nella PET, un positrone emesso dal nucleo annichila con un elettrone del mezzo circostante
do-po aver percorso una breve distanza (da 1 mm a do-pochi mm in acqua). Il risultato dell’annichilazione `e la produzione di due fotoni da 511 keV ciascuno, emessi in direzioni contrapposte. L’arrivo in coincidenza temporale dei due fotoni sul rive-latore permette di ricostruire la LoF senza l’ausilio del collimatore. Anche nella PET l’acquisizione `e tomografica, e le immagini sono ricostruite con algoritmi simili a quelli usati per la SPECT.
L’aspetto pi`u interessante delle tecniche di imaging funzionale `e che `e pos-sibile inserire gli isotopi radioattivi in particolari molecole biologiche, formando nuove molecole chiamate radiotraccianti. Queste molecole hanno il compito di “tracciare” i processi metabolici o fisiologici, che possono quindi osservati attra-verso la SPECT o la PET. Spesso vengono usati radioisotopi che corrispondono ad elementi stabili presenti nella molecola, in modo da non modificare le sue ca-ratteristiche biochimiche; in ogni caso una delle caca-ratteristiche di queste tecniche `e l’uso di quantit`a ridottissime di radiotracciante (dell’ordine delle nano-moli o delle pico-moli), cos`ı che nei tessuti i processi sotto indagine avvengano senza alterazioni. I traccianti pi`u usati in oncologia sono il99mTc-sestamibi (MIBI) per
la SPECT e il fluorodesossiglucosio (FDG) marcato con 18F per la PET. Questi due radiotraccianti si accumulano di pi`u nelle cellule ad alta attivit`a metabolica, come nel caso delle cellule cancerose. La possibilit`a di individuare un cancro con le tecniche di imaging funzionale dipende da questa maggiore concentrazione del radiotracciante nelle lesioni maligne rispetto a quelle benigne (il rapporto di con-centrazione varia da 2:1 a 10:1 usando 18F-FDG). L’uso di scintimammografia,
SPECT e PET, come tecniche di screening secondario, per misurare le differenze di metabolismo fra il tessuto sano e le lesioni sospette, pu`o aumentare la quantit`a di informazioni a priori circa il tipo di tumore prima della biopsia.
1.3.1
La scintimammografia
Il99mTc-sestamibi `e il radiotracciante pi`u usato per la scintimammografia. Que-sta tecnica, introdotta da Khalkhali nel 1993, `e diventata oggi di uso frequente [Khal94]. Essa consiste nel posizionare una Anger camera lungo il corpo del-la paziente in posizione prona con del-la mammeldel-la pendudel-la. La tecnica standard garantisce un ampio campo di vista: se da una lato questo `e un vantaggio, dal-l’altro comporta lo svantaggio di esporre il rivelatore alla radiazione γ di disturbo proveniente dal torace (principalmente cuore e fegato); inoltre il tempo richiesto dall’esame `e troppo lungo in rapporto alla capacit`a della paziente di restare ferma. Malgrado i risultati incoraggianti ottenuti dalla scintimammografia nella diagnosi di lesioni al seno (specificit`a 90%), il limite di visibilit`a per i carcinomi invasivi
usando la tecnica standard (paziente prona con mammella pendula) sembra ristret-to ai tumori di 1 cm di diametro [Vax95]. La limitata sensibilit`a per tumori pi`u piccoli di 1 cm (40-50%) `e dovuta principalmente alla difficolt`a di posizionare la Anger camera, che non `e un rivelatore adatto per un organo di dimensioni variabili e deformabile come la mammella. La risoluzione spaziale intrinseca relativamen-te modesta (tipicamenrelativamen-te circa 3 mm) e l’impossibilit`a di posizionare il rivelatore vicino al tumore riducono il contrasto con cui `e possibile osservare la lesione.
1.3.2
Scanner clinici SPECT
L’utilizzo di un’acquisizione di tipo tomografico per la diagnosi del cancro della mammella, mediante SPECT convenzionale (cio`e, 360◦, asse di rotazione oriz-zontale e parallelo alla colonna vertebrale della paziente), ha messo in evidenza una sensibilit`a variabile e una specificit`a mediamente inferiore a quella della scin-timammografia [Wang97]. Questi risultati, che denunciano un’apparente inutilit`a della SPECT, sono in contrasto con i precedenti confronti fra questa tecnica e altre tecniche di imaging 2D. Le ragioni di ci`o sono dovute principalmente a tre fattori: 1. L’impossibilit`a di mantenere il rivelatore vicino al seno durante
l’acquisi-zione degrada la risolul’acquisi-zione spaziale.
2. Il torace scherma la mammella per almeno met`a delle proiezioni durante un’acquisizione completa di 360◦.
3. L’alta concentrazione di radiotracciante nel cuore e nel fegato causa la de-gradazione dell’immagine, diminuendo la visibilit`a della lesione.
1.3.3
Scanner clinici PET
Fin dai primi tentativi di utilizzare tomografi PET standard per lo studio del tumore della mammella, `e apparso evidente che l’aumentata attivit`a metabolica che caratterizza le cellule cancerose causa in esse un maggiore assorbimento del
18F-FDG rispetto ai tessuti sani [Adl93]. La PET pu`o dare informazioni sulla
na-tura benigna o maligna del tumore e su alcuni parametri metabolici utili per la prognosi. `E considerata un esame molto valido per la stadiazione del carcinoma mammario attraverso l’analisi dei linfonodi ascellari, per la quale studi clinici ef-fettuati su tumori agli stadi T1b e T1c hanno messo in evidenza una sensibilit`a prossima al 100%. Molto interessante, inoltre, si dimostra la sua capacit`a di in-dividuare eventuali recidive dopo il trattamento terapeutico. Nonostante questi
risultati, la PET presenta gli stessi problemi della SPECT, sia per la tecnica di ac-quisizione ad asse orizzontale, sia per il fatto che la forte radiazione proveniente dal torace diminuisce il rapporto segnale/rumore nella regione di interesse (mam-mella). In pi`u, per la PET c’`e il problema del costo elevato e della complessit`a dell’apparato tomografico, della sua limitata diffusione e della necessit`a di ave-re un ciclotrone nelle vicinanze (per la produzione di radiotraccianti emettitori di β+).
1.4
Sistemi dedicati: SPEM e PEM. La SPEMT
Gli scanner clinici SPECT e PET convenzionali non soddisfano appieno i re-quisiti necessari alla diagnosi, alla stadiazione e agli studi di follow-up del cancro della mammella: ad esempio, la risoluzione spaziale di un tipico apparato clinico della Medicina Nucleare non `e adeguata allo studio di piccoli organi. Perci`o molti gruppi di ricerca in ogni parte del mondo stanno lavorando allo sviluppo di sistemi dedicati allo studio del tumore della mammella.
Per quanto riguarda la SPECT, l’uso della stessa proiezione della mammo-grafia con compressione ridotta del seno aumenta fino all’80% la sensibilit`a per tumori di diametro compreso fra 0.5 e 1 cm (T1b) , mantenendo la stessa speci-ficit`a della scintimammografia standard (90%). Una gamma camera dedicata che utilizza la stessa proiezione della mammografia `e chiamata SPEM (Single Photon Emission Mammography). Il vantaggio pi`u grande della tecnica SPEM sta nella possibilit`a di minimizzare la distanza tumore-camera per mezzo di una compres-sione ridotta del seno: questo produce un aumento della risoluzione spaziale, una diminuzione della radiazione di fondo proveniente dal tessuto sano e una maggior stabilit`a dell’organo sotto esame (grazie al bloccaggio della mammella). Com-pressioni pi`u decise, come quelle ottenute in campo radiologico per aumentare ulteriormente il rapporto segnale/rumore in sistemi ad alta risoluzione, non sono praticabili a causa del lungo tempo di acquisizione (10 minuti). Recentemente, per risolvere il problema della limitata compressibilit`a dovuta alla poca elasticit`a della pelle del seno, sono stati introdotti per la SPEM sistemi in cui una forte compressione `e applicata solo localmente (spot compression).
Il principio guida dello sviluppo di strumenti dedicati allo studio del cancro della mammella basati sulla PET (la tecnica utilizzata viene solitamente chiamata Positron Emission Mammography, PEM) `e che un rivelatore il cui FoV sia ristretto a una singola mammella assicura prestazioni pi`u elevate e costo inferiore rispetto a una camera PET standard [Tho94]. Il miglioramento delle prestazioni riguarda
due aspetti: l’ampiezza dell’angolo solido utilizzabile e l’attenuazione. Mediante il posizionamento del rivelatore pi`u vicino alla mammella, la geometria PEM rie-sce a sfruttare un angolo solido di emissione pi`u ampio rispetto a un sistema PET convenzionale; inoltre, nella PEM i raggi γ emessi devono attraversare al pi`u una lunghezza di attenuazione (' 10 cm) nel tessuto, mentre nella PET convenzionale possono attraversare fino a quattro lunghezze di attenuazione nel tessuto. Questi due fattori aumentano significativamente la sensibilit`a (intesa come rate di eventi in coincidenza rivelati per unit`a di attivit`a nel FoV) nella PEM. Una limitazione della PEM `e rappresentata dal fatto che la sensibilit`a `e bassa ai confini del FoV: infatti questa si riduce (approssimativamente in modo lineare) quando ci si allon-tana dal centro, perch´e diminuisce l’angolo solido sotteso dalla coppia di rivelatori (nella SPEM questo non accade perch´e il collimatore seleziona solo le linee di vo-lo perpendicolari al rivelatore; per contro, la presenza del collimatore riduce la sensibilit`a nella SPEM di un fattore 103-104 rispetto alla PEM). L’uso delle li-nee di volo inclinate permette inoltre alla PEM di ottenere immagini pseudo-3D dell’oggetto sotto indagine, rispetto alle immagini planari prodotte dalla SPEM.
Le motivazioni che stanno alla base dello sviluppo di sistemi dedicati possono essere riassunte nel modo seguente:
• Flessibilit`a - Uno scanner pi`u piccolo pu`o essere posizionato pi`u facilmente e pi`u accuratamente vicino alla mammella.
• Esclusione del torace dal FoV - Un sistema dedicato pu`o essere progettato in modo da escludere il torace dal campo di vista. Questo pu`o aiutare a ridurre la radiazione di scattering e il fondo, migliorando cos`ı il contrasto dell’immagine, specialmente se ottenuta con mammella compressa.
• Rivelatore pi `u vicino - La ridotta distanza tumore-rivelatore pu`o migliorare la risoluzione spaziale e la sensibilit`a del sistema.
• Utilizzo dei sistemi di compressione esistenti - Un sistema PEM o SPEM pu`o essere progettato in modo da poter utilizzare i sistemi di compressione gi`a esistenti.
• Coregistrazione con i raggi X - Un sistema compatto pu`o essere posi-zionato in modo da ottenere immagini nella stessa proiezione dei raggi X, permettendo cos`ı la coregistrazione delle immagini.
• Costo - Una testa di rivelazione pi`u piccola implica la riduzione degli ele-menti impiegati per costruirla: questo pu`o ridurre il costo degli scanner dedicati.
1.4.1
La SPEMT
Negli ultimi anni lo sviluppo di sistemi dedicati ha coinvolto, oltre alla strumen-tazione per imaging 2D, anche gli apparati tomografici: `e nata cos`ı la SPEMT (Single Photon Emission Mammo Tomography), che `e la tecnica che viene utiliz-zata dal tomografo descritto nel presente lavoro di tesi. Questa tecnica prevede l’uso di un tomografo SPECT di dimensioni ridotte, ottimizzate per l’esame di una singola mammella (diametro del FoV di circa 14 cm), e con asse di rotazione verticale (Vertical Axis of Rotation, VAoR). La paziente `e sdraiata in posizione prona con mammella pendula. Il fatto che la mammella rimanga staccata dal resto del corpo per azione della forza di gravit`a consente di ridurre il FoV al minimo indispensabile e di escludervi il resto del torace: come abbiamo visto, questo per-mette di migliorare la risoluzione spaziale e nel contempo di ridurre notevolmente le radiazioni di disturbo provenienti dagli altri organi. A questi vantaggi si unisce la capacit`a intrinseca della SPECT di fornire immagini a pi`u alto rapporto segna-le/rumore rispetto alle tecniche di imaging planare. Queste motivazioni, unite ai primi confortanti risultati degli esperimenti su fantocci [Tor03], giustificano l’in-teresse per la costruzione e messa a punto di un tomografo SPEMT per lo studio del tumore della mammella.