4. RISULTATI
4.1 Produzione costrutto SIN
Per poter sfruttare a scopo terapeutico la capacità dei virus di penetrare nelle cellule bersaglio e farvi esprimere i propri geni, è necessario produrre virus ingegnerizzati che, pur perdendo le proprietà infettive, siano comunque in grado di garantire l’espressione di geni eterologhi. A questo scopo, a partire dal clone molecolare p34TF10 ed attraverso la produzione di una serie di costrutti intermedi mostrati nella sezione Materiali e Metodi, è stato realizzato un vettore lentivirale di terza generazione basato su FIV del tipo SIN.
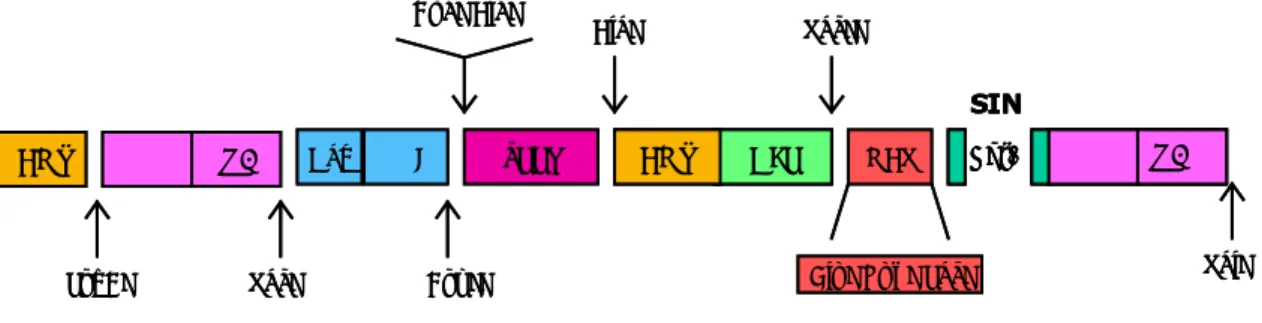
In primo luogo nel p34TF10 è stato prodotto il costrutto mostrato in Fig. 3.2 mediante sostituzione della regione U3 all’estremità 5’ dell’LTR con il promotore CMV, allo scopo di ridurre la regione di omologia dell’LTR al 5’ con quella al 3’ e minimizzare, quindi, il rischio di ricombinazione. Allo stesso tempo l’inserimento di un promotore molto forte e costitutivamente espresso, come il CMV, garantiva la trascrizione dei geni a valle e la produzione dell’mRNA anche in cellule eterologhe. Infatti, il tropismo specie-specifico di FIV è in parte determinato dalla bassa attività promotrice del suo LTR in cellule non feline. Per quello che riguarda le cellule umane, è stato osservato, infatti, che l’attività trascrizionale dell’LTR varia nei diversi istotipi cellulari ed è particolarmente rilevante nelle cellule mononucelari del sangue periferico (PBMC) (Johnston and Power, 1999).
Sulla base di questa premessa, sono state delete 130 bp nella regione U3 al 3’ LTR che contengono la TATA box e siti di legame per diversi fattori di trascrizione quali AP-1, AP-4, ATE, C/EPB, NF1, e NF-kB. La delezione è stata effettuata allestendo una strategia basata su due PCR iniziali con le quali sono state amplificate separatamente le regioni a monte e a valle della porzione di genoma da eliminare. I frammenti ottenuti, che grazie
all’impiego di appositi primer presentavano una regione complementare, sono stati uniti in una terza reazione di PCR dando origine ad un filamento finale mancate della regione interessata dell’U3, che è stato clonato nel costrutto intermedio mostrato in Fig. 3.3 utilizzando appropriati enzimi di restrizione.
Durante il processo di retrotrascrizione, questa delezione viene trasferita anche all’estremità 5’, cosicchè il DNA provirale integrato nelle cellule trasdotte ha entrambe le LTR inattive.
Grazie a questa strategia viene espressa la regione del genoma provirale che si trova sotto la guida del promotore interno, successivamente inserito. In tale modo sono stati ridotti sia il rischio di attivazione di un proto-oncogene a seguito dell’insersione del provirus nel genoma umano, sia la possibilità di ricombinazione dell’LTR con formazione di una particella infettante.
Al fine di minimizzare le regioni di omologia tra i diversi costrutti del sistema split-component, nel vettore di trasferimento sono state delete le regioni gag, pol ed env, che vengono fornite in trans dal costrutto di
packaging e dal VSV-G, mentre sono state mantenute quelle cis-agenti,
necessarie per l’espressione del transgene e l’incapsidamento dell’RNA (Fig. 3.4). In particolare, seguendo una strategia analoga a quella descritta in Fig. 3.1 (capitolo Materiali e Metodi), sono state mantenute soltanto le prime 120 bp di gag e la sequenza RRE. Nelle prime 120 bp di gag è contenuta parte della sequenza d’incapsidamento ψ indispensabile per la produzione del vettore, mentre l’RRE è necessario per l’export nucleare dell’mRNA unspliced o single spliced. Nella realizzazione del vettore, infatti, è stato mantenuto il sistema Rev-RRE, proprio di FIV, per il passaggio attraverso la membrana nucleare.
Il gene env è stato sostituito, tramite PCR, con un polylinker contenente una serie di siti di restrizione che ha favorito il clonaggio della cassetta CMV-GFP (Fig. 3.5). Il costrutto vettore nella sua veste definitiva ed utilizzato nelle prove successive è illustrato in Fig. 4.1.
La GFP è stata utilizzata come gene reporter per valutare la percentuale di cellule CrFK e 293T trasfettate e l’efficienza di trasduzione del vettore in
cellule CrFK, 293T,fibroblasti embrionali murini (NIH 3T3) e skin rabbit cells (SRC) misurando al FACS l’indice di fluorescenza.
CMV R U5 Gag RRE R U5 SIN Not1 MCS GFP CMV
PshAI SacI AsuII
ClaI SacII
BlpI KpnI PacI SalI
CMV R U5 Gag RRE R U5 SIN Not1 MCS GFP CMV
PshAI SacI AsuII
ClaI SacII
BlpI KpnI PacI SalI Figura 4.1: Costrutto SIN CMV-GFP realizzato
4.2 Produzione del costrutto SIN cPPT
Nella regione U3 dei lentivirus è presente il PPT, una regione ricca di purine che fa da innesco per la sintesi del filamento positivo di DNA da parte della RT. Al centro del genoma di HIV è stata individuata una duplicazione del PPT denominata central polypurine tract (cPPT) corrispondente a un secondo sito di inizio della sintesi del filamento positivo. La sintesi contemporanea a partire da due punti diversi del genoma provoca lo spiazzamento di una porzione a singolo filamento di 88-98 nt denominata DNA Flap che gioca un ruolo fondamentale nell’import nucleare del complesso di pre-integrazione virale (Charneau et al., 1994).
Recenti studi hanno individuato un’analoga sequenza nel genoma di FIV a livello dell’ORF di pol che, a differenza di quella di HIV, è significativamente divergente dalla sua controparte all’estremità 3’ (Whitwam et al., 2001). Poiché è stato dimostrato che l’aggiunta del cPPT in vettori basati su HIV comporta un notevole incremento nell’efficienza di trasduzione (VandenDriessche et al., 2002), è stato realizzato un nuovo costrutto a
partire dal SIN CMV-GFP nel quale questa sequenza è stata inserita tra l’RRE e la cassetta di espressione CMV-GFP (Fig. 4.2).
Il clonaggio in questa posizione è stato scelto affinché il cPPT si venisse a trovare in posizione centrale del costrutto vettore, rispecchiando la localizzazione originaria nel genoma. Il clonaggio è stato realizzato per PCR utilizzando l’enzima di restrizione ClaI presente all’interno del polylinker.
CMV R U5 Gag RRE R U5 SIN Not1 MCS GFP CMV cPPT
PshAI SacI AsuII
ApaI ClaI
ClaI SacII
BlpI KpnI PacI SalI
CMV R U5 Gag RRE R U5 SIN Not1 R U5 SIN Not1 MCS GFP CMV GFP CMV cPPT
PshAI SacI AsuII
ApaI ClaI
ClaI SacII
BlpI KpnI PacI SalI
Figura 4.2: Costrutto SIN cPPT realizzato
4.3 Costrutto di packaging
Per la produzione del vettore, è stato utilizzato un costrutto di packaging già presente nel nostro laboratorio denominato p∆env2, che esprime tutte le proteine richieste in trans necessarie per il corretto svolgimento del ciclo cellulare del virus, ma che manca dell’ env fornita dal VSV-G.
Il costrutto è stato realizzato a partire dal p34TF10, dal quale è stata rimossa un’ampia regione di env di circa 2 Kb senza intaccare l’RRE e la sequenza codificante Rev.
In questo modo l’organizzazione dei geni accessori non è stata alterata ed il trasporto degli mRNA è rimasto sotto il controllo del sistema Rev-RRE.
Le LTR al 5’ e al 3’ sono state interamente deletate e sostituite rispettivamente con il promotore CMV e la sequenza di poliadenilazione
dell’ormone della crescita bovino (BGH polyA) che, oltre a stabilizzare l’RNA, garantisce il trasporto dell’RNA messaggero al citoplasma per la traduzione. Per evitare che il costrutto di packaging venga incapsidato insieme al vettore di trasferimento, aumentando il rischio di ricombinazione e formazione di una particella wild type, è stata deleta la sequenza ψ compresa tra l’LTR e le prime basi di gag (Fig 4.3).
orf-A rev env RRE ∆ (2Kb) BGH poly A
gag pol vif
∆ ψ CMV orf-A rev env RRE ∆ (2Kb) BGH poly A BGH poly A
gag pol vif
∆ ψ
CMV
Figura 4.3: Costrutto di packaging utilizzato
4.4 Caratterizzazione costrutti vettore
Per testare la funzionalità del costrutto vettore SIN CMV-GFP sono state effettuate diverse trasfezioni su CrFK e 293T e, dopo 2 giorni, è stata osservata la fluorescenza delle cellule tramite analisi al citofuorimetro. Per eliminare una possibile fluorescenza di fondo, le cellule sono state trasfettate con costrutti non contenenti GFP come controllo negativo. Come controllo positivo di trasfezione è stato utilizzato un plasmide esprimente costitutivamente GFP posta sotto controllo del CMV.
I risultati ottenuti e mostrati in Fig.4.4 sono espressi come percentuale di cellule GFP positive.
A due giorni dalla trasfezione è stata anche valutata la quantità di p25 prodotta e dai risultati ottenuti si osserva che nonostante la percentuale di CrFK trasfettate sia inferiore (25%) rispetto a quella ottenuta sulle 293T (80%), la produzione di p25 su CrFK è nettamente maggiore rispetto a quella su 293T. Il surnatante delle cellule trasfettate è stato utilizzato per
trasdurre CrFK e 293T e la percentuale di trasduzione è stata misurata a 4 giorni. I risultati dell’esperimento sono mostrati in Fig 4.5.
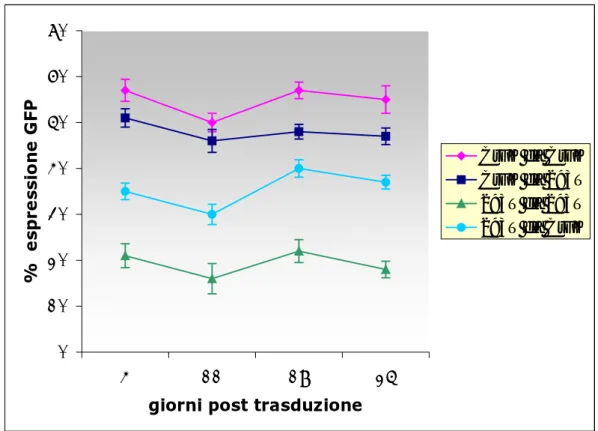
Le cellule trasdotte sono state mantenute in coltura per circa un mese. L’analisi al FACS del livello di espressione di GFP nelle cellule trasdotte è stata effettuata a undici, diciotto e venticinque giorni. Dai dati ottenuti si rileva un’espressione a lungo termine della GFP (Fig. 4.6) giustificabile con l’avvenuta integrazione del vettore nel genoma della cellula bersaglio.
Durante il periodo in cui le cellule sono state mantenute in coltura è stata misurata periodicamente la p25 che si è rilevata sempre uguale a zero, a conferma che nessun costrutto ha infettività residua e che non si è avuta formazione di un virus replicazione competente per ricombinazione dei vari costrutti.
In seguito alla produzione del vettore SIN cPPT si è voluto testare l’efficienza di trasduzione dei due costrutti realizzati. La produzione dei vettori è stata effettuata solo sulle 293T. A seguito della trasfezione è stata rilevata una percentuale identica di cellule GFP-positive; la produzione di p25, misurata a due giorni dalla trasfezione, è risultata, invece, maggiore nel costrutto non contenente la sequenza cPPT (Fig. 4.7).
Sempre a 2 giorni dalla trasfezione CrFK e 293T sono state trasdotte e dopo 4 giorni sono state staccate con tripsina ed analizzate mediante citofluorimetro. Dall’analisi dei dati è emerso che il costrutto privo di cPPT mostra una maggiore efficienza di trasduzione rispetto al SIN cPPT sia su CrFK che su 293T (Fig. 4.8).
Sulla base di questi risultati abbiamo, quindi, scelto il costrutto SIN CMV-GFP per valutare l’efficienza di veicolazione di CMV-GFP in cellule di specie e istotipo diverso. In una serie di esperimenti attualmente in corso, è in fase di valutazione la capacità di trasduzione di cellule NIH 3T3, SRC, CrFK e 293T (le ultime utilizzate come controllo).
Per questi esperimenti il virus vettore è in fase di produzione su cellule 293T.
A)
0 20 40 60 80 100 CrFK 293T % cellule GFP positiveB)
0
0,5
1
1,5
2
2,5
CrFK
293T
O.D. p25
Figura 4.4: (A) Percentuale di cellule CrFK e 293T GFP positive analizzata a
due giorni dalla trasfezione con il costrutto SIN CMV-GFP; (B) Quantità di p25 misurata nel surnatante dei due tipi cellulari trasfettati prima della concentrazione.
0
10
20
30
40
50
60
70
80
CrFK
293T
% trasduzione
Surnatante da CrFK Surnatante da 293TFigura 4.5
:
Percentuale di trasduzione del costrutto SIN CMV-GFP su CrFK e 293T misurata a 4 giorni0 10 20 30 40 50 60 70 4 11 18 25
giorni post trasduzione
% espressione GFP
CrFK da CrFK CrFK da 293T 293T da 293T 293T da CrFK
Figura 4.6: Percentuale di espressione di GFP del costrutto SIN CMV-GFP
misurata su CrFK e 293T a 4, 8, 11, 25 giorni dalla trasduzione. Il surnatante delle CrFK trasfettate è stato utilizzato per trasdurre CrFK (CrFK da CrFK) e 293T (293T da CrFK). Il surnatante delle 293T trasfettare è stato utilizzato per trasdurre CrFK (CrFK da 293T) e 293T (293T da 293T).
La p25 misurata negli stessi giorni è sempre risultata uguale a zero [dati non mostrati].
A)
0 10 20 30 40 50 60 70 80 90 100 SIN CMV-GFP SIN cPPT % cellule GFP-positiveB)
0 0,5 1 1,5 2 2,5 SIN CMV-GFP SIN cPPTO.D. p25
Figura 4.7: (A) percentuale di cellule 293T GFP positive misurata a due
giorni dalla trasfezione; (B) Quantità di p25 rilevata prima della concentrazione,nel surnatante delle cellule trasfettate.
0 10 20 30 40 50 60 70 80 SIN CMV-GFP SIN cPPT % trasduzione CrFK 293T
Figura 4.8: Percentuale di trasduzione dei costrutti SIN cPPT e SIN