1
INTRODUZIONE
La patologia della cuffia dei rotatori rappresenta una delle cause più frequenti di dolore alla spalla sia nella popolazione giovane attiva, in particolare in coloro che praticano un sport che richiede movimenti dell’arto superiore sopra la testa, sia nella popolazione di fasce di età più avanzate i cui prevalgono i fenomeni degenerativi.
Storicamente la prima descrizione di rottura dei tendini della spalla dopo un trauma risale al 1834 (Smith) ed i primo intervento chirurgico di riparazione della cuffia risale al 1909 ad opera di Codman. Oggi vi è ormai un accordo generale sula genesi multifattoriale delle lesioni della cuffia dei rotatori, includendo fattori estrinseci come una sindrome da conflitto sottoacromiale, un sovraccarico meccanico, la presenza di stress ripetitivi, e fattori intrinseci, quali un’alterata vascolarizzazione, un’alterazione delle caratteristiche elastiche del tessuto stesso tipiche dell’invec-chiamento. Va però immediatamente precisato come questa eziopatogenesi multifattoriale non debba essere assunta come valore assoluto, poiché tipicamente nel giovane (< 35 anni) la quasi totalità delle lesioni della cuffia è da ricondurre ad un evento traumatico puro come testimoniano le frequenti avulsioni ossee associate.
Mai come negli ultimi anni il chirurgo ortopedico ha potuto disporre di nuove informazioni sulla patologia della cuffia dei rotatori; infatti l’avvento ed il perfezionamento delle tecniche di imaging, come la RMN, da una parte, e l’espansione ed raffinamento della tecnica artroscopica, dall’altra, hanno consentito sia di garantire diagnosi sempre più precise e
2
precedentemente mai conosciute, sia di offrire trattamenti chirurgici sempre più mirati e meno invasivi..
Pertanto dopo un’accurata anamnesi, un specifica valutazione clinica ed uno studio di imaging il chirurgo ortopedico è in grado di orientarsi verso il trattamento chirurgico più idoneo per ciascun tipo di lesione della cuffia sia esso parziale o totale di piccole dimensioni (< 1,5 cm), in cui si preferisce un approccio esclusivamente artroscopico, sia esso di dimensioni superiori (> 2cm) in cui all’approccio artroscopico se ne unisce uno aperto (mino open) che consiste nell’ampliamento dell’accesso artroscopico laterale.
Il periodo post-opertorio, dopo immobilizzazione con tutore in abduzione per alcune settimane (circa 4-5) si sviluppa con un periodo riabilitativo che si conclude dopo circa 12 settimane con il ritorno all’attività fisica e lavorativa dopo circa 24 settimane per il ritorno all’attività agonistica.
3
EZIOPATOGENESI
E’ importante ricordare brevemente la complessità della composizione microscopica del complesso inserzionale della cuffia che p costituito da 5 strati (Clark, Harryman 1992) e la relativa vascolarizzazione, si può comunque affermare che le lesioni della cuffia dei rotatori hanno una genesi multifattoriale costituita da fattori estrinseci (s. d contatto subacromiale, sovraccarico meccanico, stress ripetitivi) e da fattori intrinseci (alterata vascolarizzazione, alterazioni delle caratteristiche tensili, modificazione della matrice, invecchiamento, instabilità, alterata cinematica – SLAP).
Partendo da questi concetti e dagli innumerevoli lavori di moltissimi autori (Meyer, De Palma, Brewer, Kumagai, Codmanb, Fukuda e altri) possiamo riunire le teorie delle rotture traumatiche e degenerative della cuffia dei rotatori sintetizzando per entrambe una visione unificata della loro patogenesi. Va però immediatamente precisato come questa eziopatogenesi multifattoriale non debba essere assunta come valore assoluto, poiché tipicamente nel giovane (< 35 aa) la quasi totalità delle lesioni di cuffia è da ricondurre d un evento traumatico puro come testimonino le frequenti avulsioni ossee associate. Tuttavia gran parte delle lesioni della cuffia dei rotatori (traumatiche e non) presentano 2 caratteristiche comuni: il tendine dei sovra spinato è quasi sempre la sede iniziale della lesione e la zona articolare inserzionale è quella che più frequentemente è interessata, con relative molteplici spiegazioni. A
4
parziale interpretazione di questo dato va sottolineato come nel tendine del sovra spinoso nella sua porzione preinserzionale sia presente una zona ipervascolarizzata, la cosiddetta “zona critica” e come il suo apporto ematico sia destinato a diminuire con l’età. A ciò va associato quanto dimostrato da Rathbun e McNab ossia come in particolari posizioni del braccio nello spazio, specialmente in abduzione, possano aumentare le pressioni di contatto subacromiale con ulteriore relativa riduzione della vascolarizzazione. Secondo Flatow l’acromion è nella sua posizione più vicina alla cuffia dei rotatori tra i 60° e i 120° di elevazione, con zona di contatto principalmente a livello dell’inserzione del tendine del sovra spinato, specialmente se il movimento è associato ad una rotazione interna di 20°. La possibilità che una degenerazione del tendine sia causata da variazioni della composizione intrinseca del tendine stesso è anche questo un elemento ampiamente studiato. Itoy e coll. hanno osservato che vi erano modificazioni delle proprietà tensili del tendine del sovraspinato. Nakajima e coll. hanno comparato le caratteristiche tensili del versante articolare del sovraspinato con quelle del versante bursale. Il lato bursale ha dimostrato in questo studio un modulo d’elasticità più basso e una maggiore resistenza alla trazione. Da ciò gli Autori hanno concluso che il lato articolare del tendine poteva essere più suscettibile a una lesione meccanica che non il lato bursale una volta sottoposti a carichi di uguale entità. Nirschi ha supposto che la tendinopatia degenerativa osservata nella cuffia sia per certi aspetti simile a quella che si verifica nell’epicondilite o nelle rotture del tendine di Achille che sostanzialmente rappresenti un displasia angiofibroblastica. Un’alterata risposta ripartiva associata ad alterazioni della matrice in seguito a microtraumi e le conseguenti microlesioni sono state indicate da Flatow
5
come ulteriori cause di degenerazione tendinea; in pratica microtraumatismi ripetitivi potrebbero causare delle microlesioni che potrebbero superare la capacità rigenerativa del tendine stesso causando una disorganizzazione delle fibre e una concentrazione degli stress.
Circa 60 anni fa Meyer suppose che fosse l’attrito meccanico al di sotto dell’acromion sia la causa della degenerazione della cuffia dei rotatori che della rottura del tendine del bicipite. Nel 1972 Neer affermò che le differenze nella dimensione e nella forma della struttura dell’arco coraco acromiale erano importanti per comprendere lo sviluppo e la patologia della cuffia dei rotatori e identificò nella porzione inferiore del terzo inferiore dell’acromion, nel legamento coraco acromiale e nell’articolazione acromion claveare e le aree in cui i tendini della cuffia venivano principalmente compressi e danneggiati. Bigliani dimostrò che vi era una correlazione tra le modificazioni qualitative della forma dell’acromion e l’incidenza di lesioni a tutto spessore della cuffia dei rotatori e classificò in base ad uno studio radiografico con la proiezione dell’ “outlet del sovraspinoso” tre tipi di acromion: Piatto (17%), Curvo (43%) ad Uncino (40%).
Vi era un significativo aumento delle lesioni della cuffia dei rotatori nei pazienti con acromion di tipo 3, negli acromion con speroni anteriori e negli acromion con un angolo di curvatura anteriore.
Va aggiunto inoltre quanto dimostrato da Nischi ossia come una instabilità anche minore della glenoomerale, soprattutto quella anteriore. O come una alterazione della cinematica come nel caso di una SLAP, possa portare ad un aumento della tensione eccentrica della cuffia predisponendo quindi d un di quella lesioni definite dagli autori anglosassoni da “overuse”.
6
Per quanto riguarda la classificazione delle lesioni della cuffia dei rotatori non esiste una classificazione completamente esauriente che comprenda al meglio il tipo di lesione (parziale o totale), la taglia e la forma geometrica della lesione, il numero dei tendini coinvolti, il lato articolare o burdale, la retrazione e la qualità del tendine e del ventre muscolare. La prima classificazione delle lesini parziali risale a Codman nel 1934 che le divise in superficiali e intratendinee con una frequenza compresa tra il 13% ed il 35% con interessamento del tendine del sovra spinoso nel 95% dei casi. Classificazioni più recenti risalgono a Elmann (1990) che tiene conto della morfologia e della sede di lesione e quella di Patte (1990) che considera la topografia sul piano sagittale e frontale, il trofismo dei muscoli interessati e lo stato del CLB come elemento evolutivo. A tutt’oggi la classificazione che noi utilizziamo è quella di Snyder che riprendendo la classificazione di Elman suddivide ciascuno dei suoi tre gruppi in 4 categorie in base alle dimensioni della lesione.
IMAGING
Le tecniche di indagine strumentale attualmente disponibili per il chirurgo ortopedico sono le seguenti: radiografia, ecografia, TAC, TAC tridimensionale, RMN, Artro-RMN. Ciascuno di questi metodi è in grado di fornire l’immagine di diversi tessuti in diversi pini, e per ciascuna malattia della spalla è necessario mettere a confronto i mezzi di indagine migliori; infatti per la patologia della cuffia dei rotatori le indagini si usano preferenzialmente gli esami radiografici ecografici e RMN.
La radiografia è la modalità primaria di visualizzazione della spalla sia nella proiezione standard in AP (veduta in AP obliqua a 45°) sia nella
7
proiezione di Neer (veduta scapolare laterale con angolazione caudale di 10° che dirige il fascio di raggi direttamente fuori dal tunnel del sovra spinato). La prima ci permette di valutare in profili ossei della scapolo omerale e la presenza eventuale di lesioni degenerative osteoartrosi che sia del trochite omerale (piccoli osteofiti, irregolarità del margine, osteopenia, calcificazioni) sia dell’acromion (presenza del “segno del
sopracciglio” che dell’articolazione acromionclaveare (osteofiti
marginali), importante è inoltre la misurazione dello spazio acromionclaveare, che di norma misura tra i 9 ed i 15 mm, la cui diminuzione in altezza è segno indiretto di lesione della cuffia dei rotatori. La seconda è una proiezione più specifica, infatti mostra le strutture ossee dell’outlet del sopraspinoso e la presenza di eventuale patologia ossea sia
dell’acromion (osteofitosi del margine inferiore, osteofitosi
dell’inserzione del legamento coraco acromiale, es. Acromiale, acromion ad “uncino”). Sia dell’articolazione AC (osteofitosi del margine inferiore), cioè di tutte le patologie dell’arco acromion claveare che determinano una riduzione dello spazio dell’outlet del sovraspinoso e che portano all’impingement.
L’esame ecografico ci permette la visualizzazione della porzione inserzionale della cuffia dei rotatori; viene effettuato con sonde lineari da 7,5 MHz nelle proiezioni coronale obliqua e sagittale obliqua. E’ un esame economico, semplice ma estremamente operatore dipendente quindi la sua validità ai fini chirurgici è molto limitata.
Come la radiologia convenzionale ci permette una valutazione dei difetti puramente ossei così la RMN ci permette una accurata valutazione dei tessuti molli e per questo è da considerarsi l’esame principe per la diagnosi e per la valutazione preoperatoria della lesione della cuffia.
8
Le rotture a tutto spessore appaiono come una area di discontinuità focale del tendine e si osservano meglio nelle immagini coronali oblique T2 pesate in cui il liquido sinoviale appare come una caratteristica area bianca che si estende dall’articolazione scapolo omerale attraverso la rottura fino nella borsa sottoacromiale. Spesso nelle lesioni croniche a tutto spessore si reperta una ipomiotrofia da minor uso del ventre muscolare del sovra spinato con aumento del tessuto adiposo, consentendoci quindi, anche di valutare la qualità tendinea che
eventualmente andremo ad incontrare durante l’intervento
(classificazione di Goutalier in RMN), che risulta importantissimo per il planning pre-operatorio in particolare proprio nelle lesioni massive, specialmente se di vecchia data, per valutare la qualità tessutale.
RIGENERAZIONE TENDINEA
La rigenerazione tissutale è un processo peculiare e riscontra differenze tessuto specifiche. Nel caso dei tendini, la rigenerazione è un fenomeno temporalmente lungo e biologicamente assai complesso, in cui le biotecnologie appaiono di notevole importanza. G.i.o.t. 2010;36:211-222 Applicazioni cliniche sui tendini. L’utilizzo delle biotecnologie si è sviluppato negli anni con 2 scopi principali. In primis si sono cercate sostanze in grado di permettere un’accelerazione della guarigione al fine di ridurre l’immobilizzazione post-chirurgica e la seguente fase riabilitativa. Secondo, ma non meno importante scopo, è stato quello di ridurre le percentuali di rilesione, che in alcune situazioni quale quella della cuffia dei rotatori sono rilevanti. Il tasso di ri-lesione dei tendini della cuffia dei rotatori supera il 40% compromettendo il funzionamento
9
della spalla. Recentemente gli sforzi dei ricercatori si sono dunque rivolti allo studio dei meccanismi biologici di guarigione dei tessuti tendinei e alla possibilità di migliorare ed accelerare i meccanismi riparativi. Processo di guarigione del tessuto tendineo: i tendini sono costituiti da cellule altamente specializzate che sono immerse in una rete tridimensionale di matrice extracellulare. Il processo di guarigione del tessuto tendineo è molto articolato e necessita di separa descrizione. Subito dopo la lesione, il gap creatosi è colmato da un coagulo di sangue che funge da scaffold (impalcatura) per la riparazione e rilascia una varietà di fattori di crescita chemiotattici e mitogeni (fase emorragica). Le citosine rilasciate all’interno del coagulo attivano i leucociti polimorfonucleati e i linfociti che giungono al sito della lesione entro poche ore. Queste cellule rispondono ai segnali autocrini e paracrini espandendo la risposta infiammatoria e reclutando altri tipi di cellule. I macrofagi arrivano al sito della lesione entro 48 ore e predominano per diversi giorni (fase infiammatoria). Essi sono responsabili della fagocitosi del tessuto necrotico e assieme alle cellule dell’epitenone ed endotenone (cellule intrinseche) secernano molteplici fattori di crescita, che inducono la neovascolarizzazione e la formazione del tessuto di granulazione. Dopo tre giorni, al sito della lesione saranno presenti piastrine, macrofagi, leucociti polimorfonucleati, linfociti e le cellule staminali mesenchimali multipotenti. Le piastrine rilasciano i fattori Platet-Derived Growth Factor (PDGF), Transforming Growth Factor-Beta (TGF-b) e l’Epidermal Growth Factor (EGF); i macrofagi i fattori PDGF, Transforming Growth Factor-Alfa (TGF-a), TGF-b, e basic Fibroblast Growth Factor (bFGF). Questi fattori non soli sono chemiotattici per i fibroblasti e altre cellule ma stimolano anche la proliferazione dei fibroblasti e la sintesi del collagene di tipo I, III
10
e V e delle proteine non collagenose. Le ultime cellule ad arrivare sono i fibroblasti che sono reclutati dai tessuti vicini e dal circolo sistemico (fase proliferativa). I fibroblasti iniziano a produrre collagene ed altre proteine della matrice entro una settimana dalla lesione. Dopo due settimane, il coagulo di sangue è più organizzato ed iniziano a formarsi i primi capillari. Il contenuto totale di collagene è superiore a quello di un tendine normale, ma la densità è inferiore e la matrice extracellulare è disorganizzata. L’ultima fase è caratterizzata dalla riduzione della cellularità e un aumento della densità di collagene (fase di rimodellamento). I segnali biochimici e biomeccanici regolano l’espressione delle proteine strutturali ed enzimatiche incluse la collagenasi, l’attivazione del plasminogeno e la stromolisina. La guarigione continua per diversi mesi e la maturazione del tendine non è completa prima di un anno. Nonostante la fase di rimodellamento, il tendine guarito non raggiungerà le proprietà meccaniche e morfologiche di un tendine normale. La forza di tensione rimane inferiore del 30% rispetto a quella di un normale tendine anche dopo diversi mesi o anni. La riduzione delle proprietà meccaniche è associata a un inferiore diametro delle fibre di collagene e all’alterazione del profilo dei proteoglicani della matrice. La riduzione delle proprietà meccaniche del tendine renderà il tessuto più debole e più predisposto a rilesione.
SCAFFOLD
Diversi approcci possono essere adottati per migliorare il tasso di guarigione del tessuto tendineo. La medicina rigenerativa si suddivide in: terapia cellulare, che non utilizza scaffolds e, in ingegnerizzazione dei
11
tessuti, che usa gli scaffolds come supporto per la rigenerazione. La maggior parte dei tessuti richiede un supporto per la propria rigenerazione. Una cultura tridimensionale offre il vantaggio di ricreare l’organizzazione spaziale del tessuto originale. Gli scaffolds hanno funzioni simili a quelle della matrice extracellulare assistendo la proliferazione, la differenziazione e la biosintesi cellulare. Essi forniscono una superficie che facilita l’adesione, la sopravvivenza, la migrazione, la proliferazione e la differenziazione delle cellule progenitrici. Diversi scaffolds sono disponibili per gli usi clinici e si differenziano per: tipo di ateriale, architettura tridimensionale, porosità, caratteristiche di degradazione, proprietà meccaniche e superficiali.L’architettura della matrice definisce lo spazio a disposizione dei progenitori cellulari per formare nuovo tessuto. I micropori della matrice devono essere in grado di ospitare le cellule seminate sullo scaffold e quelle che migrano al suo interno, accrescere la loro numerosità, permettere la formazione dei canali vascolari e il trasporto delle sostanze nutritive. Una volta impiantati, le superfici dei materiali rapidamente vengono ricoperti da proteine e da lipidi che mediano la riposta cellulare. La proteina assorbita modifica la sua conformazione nascondendo o esponendo siti che interagiscono con i recettori della superficie cellulare. L’adesione, la sopravvivenza, la proliferazione e la differenziazione cellulare dipendono dalle molecole assorbite e possono essere modulate in vitro ricoprendo lo scaffold con proteine bioattive. Le proprietà meccaniche degli scaffolds dipendono dal tipo di materiale e dalla sua struttura. La guarigione del tessuto non può essere compromessa dal fallimento meccanico. Inoltre, poiché i segnali meccanici sono importanti mediatori della differenziazione cellulare, lo scaffold deve poter trasferire carico
12
meccanico al tessuto di nuova formazione. Gli scaffolds che non si degradano, conservano le proprietà meccaniche nel tempo, ma possono compromettere il funzionamento e la riparazione del tessuto. La presenza dell’impianto preclude formazione di nuovo tessuto nello spazio occupato e può modificare i segnali meccanici agenti sul tessuto adiacente determinandone una sua perdita. Gli scaffolds riassorbili sono stati sviluppati per superare le problematiche che derivano dagli impianti fissi. Essi si caratterizzano per: tasso di riassorbimento, degradazione delle proprietà meccaniche, natura e concentrazione dei prodotti rilasciati. La cinetica d’assorbimento varia dal tipo di tessuto che si vuole rigenerare. Nel caso del tessuto tendineo la degradazione deve essere relativamente lenta, per supportare il carico meccanico fino alla rigenerazione del nuovo tessuto. Nella prima fase del processo di riparazione, lo scaffold deve proteggere le cellule e il nuovo tessuto da forze elevate, ma permettere una graduale esposizione ai carichi nelle fasi successive. Idealmente, l’impianto dovrebbe degradarsi alla stessa velocità di rigenerazione del nuovo tessuto. I prodotti di degradazione non devono essere nocivi ai tessuti circostanti, indurre infiammazione cronica o altra risposta biologica dannosa. Diversi scaffolds biocompatibili e biodegradabili sono stati sviluppati in materiale sintetico e biologico per le applicazioni cliniche (pelle, submucosa intestinale, pericardio, polimeri ecc.). Essi presentano struttura tridimensionale e sono disponibili con diverse architetture e porosità della matrice e con un largo range di proprietà meccaniche e di degradazione. Gli scaffolds sintetici, tuttavia, presentano diversi svantaggi, poiché possono alterare le proprietà meccaniche del tendine riparato, perdere resistenza e integrità nel tempo, limitare la crescita del tendine, causare abrasione del tessuto circostante, provocare
13
una risposta infiammatoria e iperplasia della cicatrice e sono pertanto vivamente sconsigliati da numerosi autori.
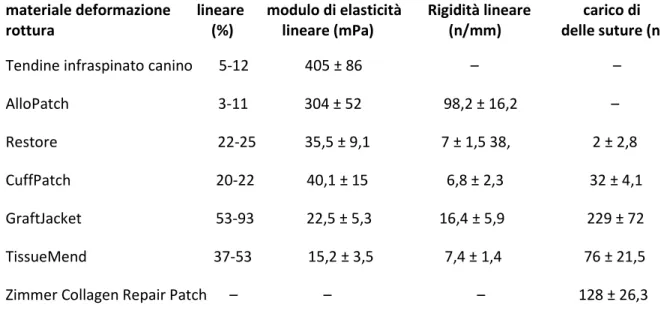
Scaffolds biologici
Gli scaffolds che derivano dalla matrice extracellulare dei tessuti viventi di diversa specie (umana, equina, bovina e porcina) costituiscono un appropriato substrato per indurre la formazione di tessuto funzionale. I bioscaffolds contengono fibre di collagene che forniscono il supporto meccanico e molecole biologicamente attive che stimolano la crescita e il rimodellamento tessutale. La presenza di collagene di tipo I, li rende particolarmente adatti per la riparazione della cuffia dei rotatori. Questi materiali forniscono un temporaneo supporto meccanico e presentano proprietà biologiche che possono influenzare l’adesione, la proliferazione e la differenziazione cellulare migliorando la guarigione del tessuto. Matrici biologiche provenienti da diversi tessuti sono commercialmente disponibili per il rinforzo della cuffia dei rotatori e comprendono: derma (GraftJacket, TissueMend e Zimmer Collagen Repair Patch), submucosa del piccolo intestino di suino (Restore e CuffPatch), pericardio (OrthADAPT Bioimplant) e fascia lata (AlloPatch) (Tab. III). I prodotti biologici che derivano da animale sono classificati come device e regolamentati (premarket approval 510(k)) dagli US Food and Drug Administration (FDA) che non richiede prova della loro efficacia in studi preclinici e clinici. Le matrici d’origine umana (GraftJacket, AlloPatch) sono classificate come tessuti umani per il trapianto e non sono regolamentate dalla FDA. Le matrici a disposizione per la riparazione della cuffia dei rotatori si differenziano per caratteristiche meccaniche e biologiche (Tab. IV). Le proprietà meccaniche descritte nella Tabella II, suggeriscono che le membrane bovine ed epidermiche possono non
14
essere adeguate come rinforzo della cuffia dei rotatori e che la fascia lata presenta caratteristiche meccaniche simili a quelle di un tendine. Inoltre, la Tabella II, mostra che le matrici epidermiche, hanno una capacità superiore di ritenere le suture rispetto alle matrici di submucosa intestinale (interfaccia grafttendine e graft-osso). L’utilizzo degli scaffolds è sempre più frequente, ma la loro efficacia nel trattamento della riparazione della cuffia dei rotatori va ancora dimostrata. Inoltre, pochi sono i dati della letteratura che descrivono le complicazioni o effetti collaterali associati a questi prodotti. Applicazioni cliniche sui tendini 218 Studi clinici Restore e GraftJacket sono al momento le uniche matrici extracellulari che sono state indagate clinicamente nella riparazione della cuffia dei rotatori. Restore Orthobiologic Implant Deriva dalla submucosa porcina del piccolo intestino e contiene collagene tipo I, fibronectina, eparina, eparina solfata, condroitina solfata, ialuronani, e numerosi fattori di crescita come FGF-2, TGF-b, VEGF. Le cellule ospiti aderiscono alla matrice e producono nuovo tessuto tendineo all’interno dello scaffold. Studi su animali hanno evidenziato che la submcosa intestinale è completamente riassorbita entro 6 settimane e perde la maggior parte delle sue proprietà meccaniche nelle prime 4 settimane lasciando sufficiente tempo per la produzione di matrice tessutale. La submucosa porcina del piccolo intestino è stata utilizzata per migliorare la guarigione del tendine d’Achille di cane e di coniglio. Il trattamento con la membrana si associava a formazione di nuovo tendine con modesta adesione o infiammazione cronica. I buoni risultati degli studi su animale hanno spinto gli ortopedici a utilizzare lo scaffold per la riparazione della cuffia dei rotatori. Sclamberg et al., hanno riportato, in uno studio retrospettivo, i risultati di 11 pazienti trattati con Restore per una lesione massiva della
15
cuffia dei rotatori. Dopo 6 mesi dall’intervento, la risonanza magnetica aveva mostrato il fallimento della riparazione in 10 pazienti su 11. Iannotti et al., hanno impiantato in aperto la membrana Restore in 15 pazienti con lesione a due tendini della cuffia dei rotatori (infraspinato e sorpaspinato) e hanno confrontato i risultati radiografici e clinici con un gruppo di controllo ad un anno dall’intervento. Gli autori hanno riscontrato che il tasso di guarigione nel gruppo di controllo era significativamente più alto del 7% (odds ratio = 1,07; p-value = 0,07) rispetto al gruppo trattato con Restore. Il punteggio clinico (PENN Shoulder Score) era di 91 punti nel gruppo di controllo, 83 punti nel gruppo trattato con Restore (p-value = 0,04). Questo studio ha evidenziato che la procedura di riparazione della lesione massiva della cuffia dei rotatori con Restore, non migliora il tasso di guarigione e l’outcome clinico ad un anno dall’intervento lasciando intravedere un trend sfavorevole dei risultati clinici. Inoltre, l’uso di Restore si associava ad una reazione infiammatoria riscontrata in tre pazienti impiantati. Altri autori, hanno riportato di reazioni infiammatorie in pazienti trattati con submucosa porcina.
Tab. II.
Valori della potenza (power) per diversi valori della deviazione standard (s.d.) a parità di tutti gli altri parametri.
S.d. 6 7 8 9 10
Power 96% 90% 80% 71% 63%
Tab. III
16 Restore Porcina Submucosa piccolo intestino DePuy Orthopedics, Warsaw,
IN, USA CuffPatch Arthrotek, Porcina Submucosa piccolo intestino Organogenesis, Canton,
MA, USA
GraftJacket Umana Derma LifeCell Corporation, Medical Branchburg, NJ, USA
TissueMend Bovina Derma TEI Biosciences, Boston, MA, USA Zimmer Collagen
Repair Patch Porcina Derma Tissue Sciences Lab, Andover, MA, USA OrthADAPT
Bioimplant Equina Pericardio Pegasus Biologics, Irvine, CA, USA
AlloPatch Umana Fascia lata Musculoskeletal Transplant Foundation, Edison, NJ, USA tab. IV. Proprietà meccaniche degli scaffolds biologici.
materiale deformazione lineare modulo di elasticità Rigidità lineare carico di rottura (%) lineare (mPa) (n/mm) delle suture (n)
Tendine infraspinato canino 5-12 405 ± 86 – – AlloPatch 3-11 304 ± 52 98,2 ± 16,2 – Restore 22-25 35,5 ± 9,1 7 ± 1,5 38, 2 ± 2,8 CuffPatch 20-22 40,1 ± 15 6,8 ± 2,3 32 ± 4,1 GraftJacket 53-93 22,5 ± 5,3 16,4 ± 5,9 229 ± 72 TissueMend 37-53 15,2 ± 3,5 7,4 ± 1,4 76 ± 21,5 Zimmer Collagen Repair Patch – – – 128 ± 26,3
17 CENNI DI TECNICA CHIRURGICA: ARTROSCOPICA + MINI-OPEN
Nel trattare questo argomento si ritiene opportuno seguire la seguente successione descrittiva: posizione del paziente, cenni sullo strumentario, ingressi artroscopici, caratteristiche anatomiche e varianti morfologiche normali.
Posizione del paziente – le sue posizioni utilizzate sono la beach
chair (o “sedia a sdraio”) e quella in decubito laterale. La prima è stata descritta per la prima volta da Skyhar, nel 1988, e prevede il paziente in posizione supina, con il busto flesso di almeno 60° e arto superiore interessato fuori dal margine del tavolo operatorio sostenuto e mobilizzato da un assistente.
La posizione in decubito laterale è stata proposta dapprima senza trazione dell’arto (Wiley e Older, 1980) poi con trazione del medesimo (Andrews, 1984), portando così al rischio di danni per le strutture vascolo-nervose se la trazione è eccessiva (Pitman, 1988: Burkart, 1990). Nel 1993 J. Esch ha descritto in maniera precisa “la posizione ideale” in decubito laterale: arto abdotto di 45° e flesso di 15°, con trazione di 10 libbre.
Strumentario standard – si utilizzano ottiche di 4 mm e 30° ed
eventualmente a 70°: per la distensione articolare si utilizza una normale soluzione fisiologica salina che affluisce in articolazione per gravità o mediante pompa la quale regola flusso di pressione di infusione. Alla soluzione fisiologica può essere aggiunta epinefrina per determinare
18
vasocostrizione, la quale insieme alla “ipotensione” arteriosa assicura una più agevole visualizzazione; si devono inoltre avere a disposizione: cannule, shaver e vari strumenti artroscopici manuali. L’uso di telecamere dell’ultima generazione migliorano la visualizzazione.
Gli ingressi artroscopici – i più comunemente usati sono quello
posteriore e quelli anteriori. I più comunemente usati sono quello posteriore e quelli anteriori. L’ingresso posteriore standard è situato 2 cm distalmente e 1 cm medialmente rispetto al margine postero-laterale dell’acromion.
Gli accessi anteriori principali descritti in letteratura sono: quello antero-superiore e l’antero-centrale che possono essere effettuati con tecnica out-in o in-out e servono a scopo diagnostico e chirurgico; gli altri accessi anteriori, l’antero-mediale e l’antero-inferiore sono possibili solo con tecnica in-out e servono per specifici atti chirurgici.
Esiste un’area di forma triangolare, definita dagli anglosassoni “soft-spot”, sicura per il posizionamento dell’ingresso anteriore ed è stimata tra i tendini del bicipite e del sottoscapolare, con base sul bordo della glena ed apice sulla testa omerale:
Anatomia artroscopia – Nel procedere ad in maniera corretta ad
una visualizzazione artroscopia della spalla bisogna seguire un preciso schema. Noi siamo d’accordo con quanto proposto da M. Getelman a San Diego nel 1999, secondo il quale bisogna avere la visualizzazione artroscopica di 15 punti: 10 dal portale posteriore e 5 dal portare anteriore.
19 Tendine del capo lungo del bicipite brachiale
Il tendine del capo lungo del bicipite brachiale origina dalla parte superiore della fossa glenoidea e mostra continuità con la porzione superiore del labbro glenoideo. Studi anatomici hanno mostrato come nella maggior parte degli individui esso si presenti unito al LGOS e come tuttavia possa essere in continuità con alcuni casi con il LGOM o raramente con tutti e tre i legamenti gleno-omerali. Durante l’esame artroscopico esso risulta essere la prima struttura identificata dall’accesso posteriore ed il più importante repere che consente l’orientamento all’interno dell’articolazione. Esso può essere seguito dall’inserzione glenoidea fino alla sua uscita dall’articolazione nel solco bicipitale tra i tendini del sottoscapolare e del sopraspinosi.
Per facilitare la visione artroscopia del tendine è utile extra ruotare il braccio del paziente o flettendone il gomito. Nonostante il tendine del capo lungo del bicipite sia una delle strutture più costanti della spalla recentemente è stata riportata una sua assenza congenita.
La cuffia dei rotatori
Il tendine del bicipite indica il margine posteriore dell’intervallo dei rotatori, posteriormente a questo troviamo il tendine del sovra spinoso; sempre dall’accesso posteriore è possibile individuare i tendini del sottospinoso e del piccolo rotondo, mentre la via anteriore è utile per visualizzare la regione posteriore della cuffia dei rotatori. La cuffia dei rotatori stabilizza dinamicamente l’articolazione gleno omerale. E’ formata dall’inserzione di quattro tendini: sottoscapolare, sovraspinoso,
20
sottospinoso e piccolo rotondo. Il muscolo sottoscapolare è distinguibile sia anatomicamente che funzionalmente dagli altri muscoli della cuffia; infatti è posizionato anteriormente e separato dagli altri muscoli della cuffia dall’intervallo dei rotatori. Le porzioni tendinee del sovraspinoso, sottospinoso e piccolo rotondo si uniscono a livello della glenoide, costituendo le pareti superiore e posteriore dell’articolazione gleno omerale, continuandosi in direzione laterale, fino all’inserzione sul trochite omerale. La disposizione anatomica delle inserzioni è la seguente: il sovraspinoso si inserisce sul margine superiore del trochite, il sottospinoso sul margine posteriore e il piccolo rotondo su quello inferiore.
Funzionalmente il sottoscapolare, che si inserisce invece sul trochine omerale, è un rotatore interno mentre tutti gli altri sono extrarotatori. La cuffia dei rotatori può essere completamente ispezionata artroscopicamente. La superficie inferiore della cuffia può essere visualizzata dall’articolazione gleno omerale, mentre la superficie superiore dallo spazio subacromiale. L’esame artroscopico del sovra spinoso, del sottospinoso e del piccolo rotondo necessita di un corretto orientamento nella cavità glenoidea. Dopo aver individuato il tendine del bicipite, il tendone del sovra spinato è posizionato subito al di sopra di questo dove penetra nel solco bici pitale. La superficie inferiore del sovra spinoso è ricoperta da un sottile strato di capsula e membrana sinoviale che normalmente appare liscia. Indirizzandosi con l’artroscopico posteriormente, possono essere visualizzati i tendini del sottospinoso e piccolo rotondo anch’essi ricoperti da un sottile strato di membrana sinoviale. La visualizzazione della parte più posteriore della cuffia dei rotatori può essere eseguita con maggiore facilità dall’accesso
21
artroscopico anteriore. Il margine superiore della cuffia è visibile dallo spazio subacromiale previa escissione della relativa borsa ed appare liscio e continuo, senza aree iperemiche; con la rotazione interna ed esterna del braccio è possibile la visualizzazione di una porzione più estesa della cuffia stessa.
Tendine del muscolo sottoscapolare
Il muscolo sottoscapolare origina dalla fossa omonima della scapola, decorre sulla parte anteriore della glena con la quale contrae solo aderenze fibrose. E’ proprio lo spazio tra faccia anteriore della glena e muscolo ad accogliere la testa omerale all’atto della lussazione antero inferiore determinando lo scollamento delle aderenze e la formazione di una tasca sinoviale. Artroscopicamente il tendine del sottoscapolare rappresenta un repere importante visibile solo per una parte della sua larghezza e costituito da fibre bianche e compatte che ben si distinguono dalla capsula. La porzione tendinea visualizzabile è solo quella superficie della lunghezza di 5-10 mm e rappresenta solo una piccola parte dell’intero tendine che misura dai 3 ai 5 cm. (Detrisal, 1986). Dall’ingresso posteriore è ben visualizzabile la sua parete laterale, mentre la parete mediale può essere vista dall’ingresso anteriore.
Esso è incrociato posteriormente dal LGOM con un’inclinazione di circa 60°-80°. Il recesso sottoscapolare è situato anteriormente alla spalla direttamente sotto il tendine omonimo nella zona del LGOM. Esso può essere individuato superiormente e/o inferiormente al LGOM.
22
Occasionalmente l’assenza o la scarsa rappresentazione del LGOM fa apparire tale recesso più ampio; questa normale variazione anatomica non deve essere confusa con una tasca capsulare patologica.
Il primo tempo artroscopico ci permette di eseguire un accurata valutazione delle strutture anatomiche della spalla, una valutazione di patologie di tali strutture; con una prima fase gleno omerale in cui vengono valutate eventuali lesioni associate (CLB tendinopatia spesso associata alla lesione massiva della cuffia, SLAP, Sinoviti, instabilità) e in cui si esegue una prima valutazione del lato articolare della cuffia (valutazione della estensione reale, della mobilità, della qualità tissutale tendinea).
La seconda fase è quella sul versante sottoacromiale o bursale in cui si può eseguire la bursectomia ed acromionplastica, in presenza di artrosi AC una mini-Mundford, e la completa valutazione della lesione per la sua riparazione (qualità del tessuto, mobilità, aderenze, retrazione, resistenza alla trazione).
Mini open
Dopo il tempo artroscopico si passa poi alla chirurgia a cielo aperto detta “mini-open repair”. Cioè l’estensione dell’accesso artroscopico laterale in senso distale per una lunghezza massima di 4 cm. La riparazione avviene con viti trans ossee o con punti trans ossei a seconda della qualità dell’osso e della sua tenuta, e rinforzo con patch che viene opportunamente imbastito con fili di sutura ed integrato a coprire la lesione nel caso di riparazioni incomplete (gap repair) o di integrazione (augmentension) nelle riparazioni complete ma con scarsa qualità tendinea. (vedi figure pag. 24).
23
24
TRATTAMENTO RIABILITATIVO
Il periodo post operatorio consiste nell’immobilizzazione in tutore in abduzione per un periodo che va da 3 a 4 settimane a seconda della lesione e del tipo di sutura.
Durante questo periodo viene eseguita una mobilizzazione passiva a partenza dal tutore su tutti piani fin dalla prima settimana questo per evitare aderenze negli spazi articolari e sul versante bursale.
Alla rimozione del tutore inizia la vera riabilitazione che è suddivisa in quattro fasi: la prima detta fase precoce (della durata di 2-3 settimane) ha lo scopo di recuperare la motilità completa su tutti i piani, è importante il mantenimento di una buona postura evitando già in questa fase eventuali compensazioni muscolari che possono viziare i movimenti.
In questa fase oltre la mobilizzazione passiva inizierà l’attiva e l’attiva coadiuvata con esercizi a pendolo l’uso di sbarre, pulegge e carrucole.
Attenzione in questi esercizi sarà data anche al rachide cervicale, al gomito ed al polso che coadiuveranno la spalla nell’arco dei movimenti.
Si potranno associare terapie fisiche (ionoforesi ed elettroterapie) ghiaccio locale esercizi di streching.
La seconda fase inizia intorno alla sesta settimana dopo l’intervento, il suo inizio è condizionato da una sufficiente particolarità in assenza di dolore e dura per circa 3 settimane ed è dedicata al rinforzo muscolare.
Gli esercizi saranno di tipo isometrico per l’extrarotazione, l’intrarotazione la flessione l’abduzione e l’estensione.
25
Saranno utilizzate tavole di Freeman, palleggio con racchette da tennis o da ping pong prima a gomito flesso fino al raggiungimento dell’estensione con esercizi sul piano sagittale e frontale.
Saranno introdotti esercizi con elastici che noi riteniamo molto utili mantenendo lo schema di Jobe modificato con il rinforzo dei depressori omerali (gran dorsale e gran dorsale) poi i glenohumeral protectors, degli scapular pivotors (trapezio, elevatore scapola e romboide) e infine il deltoide con rowing exercise, push up e press up (gran dentato piccolo pettorale elevatore della scapola).
La terza fase è detta di rinforzo avanzato e parte dalla decima dodicesima settimana e serve per preparare l’atleta al ritorno all’attività agonistica lavorando sulla forza, la resistenza e la potenza con esercizi isotonici e isocinetici.
Saranno utilizzati esercizi pliometrici che stimolano la porzione reattiva neuro muscolare. Alla sedicesima ventesima settimana inizia la fase finale con il recupero del gesto sportivo e con programmi personalizzati coadiuvati da test isocinetici.
Rimanendo sullo sportivo a circa 24-32 settimane a seconda dello sport praticato si torna in campo.
CASISTICA
Presso la II U.O. di Ortopedia e Traumatologia, abbiamo utilizzato lo Zimmer Collagen Repair Patch. Abbiamo rivalutato 18 lesioni massive di cuffia, trattate con questo tipo di scaffold con follow up minimo di 8 mesi
26
ed un massimo di 43 mesi, tutti sono stati valutati clinicamente del preoperatorio e nel post-operatorio con scheda di Constant e ASES; nei controlli a distanza sono state eseguite valutazioni strumentali con ecografie.
La valutazione dei risultati clinici è stata effettuata, come già detto, utilizzando la scheda di Constant che ci permette una valutazione specifica delle attività quotidiane (lavoro, sport, sonno), della possibilità di movimento dell’arto superiore ei tre piani dello spazio, nella posizione della mano, del dolore e della forza.
Abbiamo rivalutato in base a questa scheda 18 casi (11 femmine e 8 maschi), età media 67,2 anni (minima 49 , massima 80). Constant pre medio 45, ASES pre medio 38; Constant post medio 83,66, ASES 89,22.
Fig.1 Fig. 2
L’esame ecografico a mostrato in tutti i casi una continuità tendinea, uno spessore medio del tendine di circa 4,4 mm, (fig. 1 uomo di 63 aa., follow up di 9 mesi, score 92 C 98 A, spessore tendineo alla ecografia 4,5 mm; fig. 2 uomo 75 aa., follow up 5 mesi, score 80 C, 85 A, spessore tendineo alla ecografia di 4,2 mm), con buona omogeneità del tessuto
27
tendineo all’immagine ecografica, uno solo presentava disomogeneità ecografica.
CONCLUSIONI
L’approccio biologico rappresenta attualmente un campo di ricerca ed innovazione crescente nella chirurgia riparativa della cuffia dei rotatori, in particolare per quelle situazioni di scarsa qualità tessutale e lesioni massive. In questo studio si è posto attenzione all’analisi sistematica della letteratura esistente così come hanno mostrato i risultati dei lavori da svolti da numerosi autori, in prima persona. Da quanto riportato è possibile trarre alcune conclusioni. Gesti associati quali l’acromioplastica (e dunque la cruentazione ossea vicino al tessuto tendineo da riparare) hanno dimostrato di poter favorire la liberazione di fattori di crescita autologhi. È pertanto opportuno ridiscutere l’effettivo ambito di applicazione di questa metodica in aggiunta alla riparazione della cuffia dei rotatori. Ovviamente sono attesi nuovi studi al fine di chiarire i risultati preliminari da noi mostrati. Per quel che riguarda l’utilizzo degli scaffolds la letteratura mondiale, a tutt’oggi, è scarna di lavori prospettici, controllati e randomizzati. Pertanto non è opportuno trarre conclusioni tali da estendere le metodiche descritte alla gran parte dei casi trattati giornalmente nelle nostre strutture. Da rammentare inoltre la necessità di informare correttamente i pazienti oggetto di applicazione di queste biotecnologie che a oggi il campo è da definirsi ancora “sperimentale”. Al momento è possibile affermare che i fattori di crescita autologhi di derivazione piastrinica sono “sicuri” e che l’evidenza
28
scientifica supporta il loro utilizzo come “acceleratori” di guarigione. Gli scaffolds di provenienza umana, quali quelli derivati dal derma, hanno mostrato risultati preliminari promettenti. Sono attesi con interesse ulteriori studi tra cui quelli commissionati dall’FDA americana.
Dalla nostra esperienza maturata, e riportata precedentemente, possiamo affermare che il patch collagenico, da noi usato, possa rappresentare un’arma molto importante per il chirurgo della spalla per poter risolvere quelle situazioni dove la sola riparazione tendinea non garantisce una corretta ripresa della funzionalità gleno-omerale.
BIBLIOGRAFIA
1. CLARK JM, HARRYMAN DT II: “Tendons, Ligaments and capsule of the
rotator cuff: Gross and microscopic amnatomy” JBJS 74A: 713-725, 1992.
2. Connell DA, Ali KE, Ahmad M, et al. Ultrasound-guided autologous blood
injection for tennis elbow. Skeletal Radiol 2006;35:371-7.
3. Mishra A, Pavelko T. Treatment of chronic elbow tendinosis with buffered
platelet-rich plasma. Am J Sports Med 2006;34:1774-8.
4. Sánchez M, Anitua E, Azofra J, et al. Comparison of surgically repaired
Achilles tendon tears using platelet-rich fibrin matrices. Am J Sports Med 2007;35:245-51.
5. Neer CS II. Anterior acromioplasty for the chronic impingementsyndrome
in the shoulder: a preliminary report. J Bone Joint Surg 1972;54A:41-50.
29
7. Bigliani L, Morrison DV, April EW. The morphology of theacromion and its
relationship to rotator cuff tears. Orthop Trans 1986;10:216.
8. Sampson TG, Nisbet JK, Glick JM. Precision acromioplastyin arthroscopic
subacromial decompression of the shoulder. Arthroscopy 1991;7:301-7.
9. Derwin KA, Baker AR, Spragg RK, et al. Commercial extracellular matrix
scaffolds for rotator cuff tendon repair. Biomechanical, biochemical, and cellular properties. J Bone Joint Surg 2006;88A:2665-72.
10. Aurora A, McCarron J, Iannotti JP, et al. Commercially available
extracellular matrix materials for rotator cuff repairs: state of the art and future trends. J Shoulder Elbow Surg 2007;16(Suppl.5):S171-8.
11. Badylak SF, Tullius R, Kokini K, et al. The use of xenogeneic small intestinal
submucosa as a biomaterial for Achilles tendon repair in a dog model. J Biomed Mater Res 1995;29:977-85.
12. Dejardin LM, Arnoczky SP, Ewers BJ, et al. Tissue-engineered rotator cuff
tendon using porcine small intestine submucosa. Histologic and mechanical evaluation in dogs. Am J Sports Med 2001;29:175-84.
13. Sclamberg SG, Tibone JE, Itamura JM, et al. Six-month magnetic
resonance imaging follow-up of large and massiverotator cuff repairs reinforced with porcine small intestinal submucosa. J Shoulder Elbow Surg 2004;13:538-41.
14.Iannotti JP, Codsi MJ, Kwon YW, et al. Porcine small intestinesubmucosa
augmentation of surgical repair of chronic two-tendon rotator cuff tears. A randomized, controlled trial. J Bone Joint Surg 2006;88A:1238-44.
30
15. Malcarney HL, Bonar F, Murrell GA. Early inflammatory reaction after
rotator cuff repair with a porcine small intestine submucosal implant: a report of 4 cases. Am J Sports Med 2005;33:907-11.
16. Zheng MH, Chen J, Kirilak Y, et al. Porcine small intestine submucosa (SIS)
is not an acellular collagenous matrix and contains porcine DNA: possible implications in human implantation. J Biomed Mater Res B Appl Biomater 2005;73:61-7.
17. Dopirak R, Bond JL, Synder SJ. Arthroscopic total rotator cuff replacement
with an acellular human dermal allograft matrix. Int J Shoulder Surg 2007;1:7-15.
18. Burkhart SS, Nottage WM, Ogilvie-Harris DJ, et al. Partial repair of
irreparable rotator cuff tears. Arthroscopy 1994;10:363-70. 35 Bond JL,
19. Dopirak RM, Higgins J, et al. Arthroscopic replacement of massive,
irreparable rotator cuff tears using a GraftJacket allograft: technique and preliminary results. Arthroscopy 2008;24:403-9.
20. Fini M, Torricelli P, Giavaresi G, et al. In vitro study comparing two collageneous membranes in view of their clinical application for rotator cuff tendon regeneration. J Orthop Res 2007;25:98-107.
21. Rodeo SA, Potter HG, Kawamura S, et al. Biologic augmentation of rotator
cuff tendon healing using a mixture of osteoinductive growth factors: an experimental study in sheep. J Bone Joint Surg 2007;89A:2485-97.
22. Neuwirth J, Fuhrmann RA, Veit A, et al. Expression of bioactive bone
morphogenetic proteins in the subacromial bursa of patients with chronic degeneration of the rotator cuff. Arthritis Res Ther 2006;8:R92.
31
23. Kovacevic D, Rodeo SA. Biological augmentation of rotator cuff tendon
repair. Clin Orthop Relat Res 2008;466:622-33.
24. Gulotta LV, Kovacevic D, Ehteshami JR, et al. Application of bone
marrow-derived mesenchymal stem cells in a rotator cuff repair model. Am J Sports Med 2009;37:2126-33.
25. Mishra A, Tummala P, King A, et al. Buffered platelet-rich plasma
enhances mesenchymal stem cell proliferation and chondrogenic differentiation. Tissue Eng Part C Methods 2009;15:431-5.
26. Ouyang HW, Goh JC, Lee EH. Use of bone marrow stromal cells for tendon
graft-to-bone healing: histological and immunohistochemical studies in a rabbit model. Am J Sports Med 2004;32:321-7.