CAPITOLO 1
- 2 -
1.
INTRODUZIONE
La riparazione di una lesione nervosa periferica può verificarsi solo se le fibre a monte della sede danneggiata possono rigenerarsi lungo il moncone distale raggiungendo il loro target. Nella pratica clinica ciò si realizza attraverso una sutura microchirurgica. Tuttavia, nel caso in cui vi sia una perdita di sostanza nervosa e la neurorrafia termino-terminale non sia possibile, risulta necessario ricorrere a strategie alternative.
Oggi il gold-standard nel trattamento delle grosse perdite di sostanza nervosa rimane l’innesto nervoso autologo. Il motivo del suo impiego ed dei successi che determina, è attribuibile alla presenza delle cellule di Schwann presenti in esso. Queste cellule forniscono, oltre a fattori neurotrofici, un substrato d’adesione attraverso la lamina basale, in grado di supportare ed promuovere la crescita assonale.
I principali limiti di tale metodica sono rappresentati dall’inevitabile danno che si determina a livello del sito donatore, la necessità di un doppio accesso chirurgico e l’indisponibilità d’ingenti quantità d’innesti nervosi in alcune grosse lesioni del sistema nervoso periferico.
Sono state studiate delle alternative all’utilizzo degli innesti autologhi rappresentate da “tubuli”, biologici o sintetici, capaci di supportare e far crescere, per brevi distanze gli assoni rigeneranti. Sono da citare tra i biologici la vena, il muscolo predegenerato o fresco, il muscolo e la vena combinati ed i nervi alloplastici; fra quelli sintetici sono stati impiegati svariati biomateriali tra i quali il silicone, il politetrafuoroetilene (PTFE), il Collagene di tipo I, l’Acido Poliglicolico (PGA), polilactideCaprolattone (PLCL), l’Acido Poliglicolico cross-linked con il Collagene (PGA-c), il chitosano il Polivinil Alcol Idrogel (PVA), etc.
E’ proprio dagli anni ’90 che si susseguono e sono disponibili sul mercato questi “tubuli” alternativi alla tubulizzazione biologica. I diversi materiali, vuoti al loro interno e di norma bioriassorbibili, proteggono ed orientano il nervo durante la rigenerazione garantendo una buona qualità del
- 3 -
rigenerato solamente per gap nervosi non superiori ai 30mm e quindi non in grado di risolvere il problema delle grosse perdite di sostanza nervosa (> 50mm).
Per sviluppare delle guide neurali più efficienti sono stati effettuati un ampio spettro di studi nel campo della biochimica e bioingegneria, allo scopo di studiare la risposta delle cellule agli stimoli fisici e chimici provenienti dall’ambiente extracellulare.
Analogamente alla matrice extracellulare (ECM) che circonda le cellule in vivo, la superficie della guida artificiale dovrebbe essere in grado d’interagire con le cellule nervose e gliari orientandole verso il moncone distale e promuovendo la rigenerazione. I recenti progressi nei campi della scienza dei materiali, delle nano-scienze e delle tecniche di micro-fabbricazione possono offrire nuove opzioni per il trattamento delle lesioni nervose. L’ingegneria tissutale si è rivolta verso la rigenerazione nervosa periferica producendo scaffold (supporti bi/tridimensionali) con strutturazione superficiale di dimensioni subcellulari (nell’ordine dei micrometri e dei nanometri), in grado di produrre artificialmente la struttura e le caratteristiche della ECM.
I materiali così strutturati ed organizzati acquisiscono nuove funzionalità: come ad esempio una maggior area disponibile per l’interazione cellula-substrato, una maggior resistenza, leggerezza, una maggiore porosità, funzionalizzazioni chimiche, una migliore conduttività elettrica e/o magnetica ed una biocompatibilità superiore; tutto ciò in relazione alla morfologia ed al materiale scelti.
Gli obiettivi di questa ricerca sono stati due:
1 Studiare in vitro sulla motilità delle cellule di Schwann di ratto in risposta a superfici anisotrope nanostrutturate.
2 Valutare in vivo gli stadi precoci della rigenerazione nervosa del nervo mediano di ratto utilizzando scaffold con superfici a topografia anisotropa e nanostrutturata.
- 4 -
1.1. ANATOMIA ED ISTOLOGIA DEI NERVI
PERIFERICI
1.1.1 Anatomia dei nervi dell’arto superiore
In questo paragrafo verrà affrontata l’anatomia dei nervi dell’arto superiore originati dai tronchi secondari antero-mediale ed antero-laterale sia dell’uomo che del ratto, l’arto superiore dell’uomo è infatti la sede più frequentemente coinvolta dalle lesioni nervose.
Per rendere i futuri risultati sperimentali aderenti il più possibile alla realtà clinica, il modello di studio proposto utilizzerà l’arto superiore del ratto ed in particolare il nervo mediano.
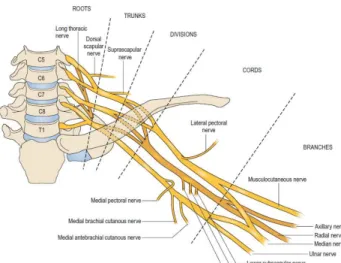
L’organizzazione anatomica dei rami terminali originati dai tronchi secondari antero-mediale ed antero-laterale è molto simile nell’uomo e nel ratto. In entrambe le specie i tronchi nervosi che innervano l’arto superiore originano dal plesso brachiale formato dai rami ventrali del 5°,6°, 7° ed 8° nervo cervicale e di parte del 1° toracico (Fig. 1, 2). La radice C5 (che riceve fibre da C4) si unisce con C6 formando il tronco primario superiore. La radice C7, da sola, forma il tronco primario medio. Le radice C8 e T1, unendosi, al di sopra della prima costa, formano il tronco primario inferiore. I tre tronchi primari sono posti dietro la clavicola e si dividono ciascuno in un ramo ventrale e in un ramo dorsale. I tre rami dorsali si uniscono e formano il tronco secondario posteriore. I rami ventrali dei tronchi superiore e medio, unendosi, formano il tronco secondario antero-laterale. Il ramo ventrale del tronco inferiore forma da solo il tronco secondario antero-mediale (Fig. 1, 2).
Dal tronco secondario posteriore originano il nervo ascellare e il nervo radiale. Il tronco secondario antero-laterale si divide in un ramo superiore e inferiore e così anche il tronco secondario antero-mediale. Dal ramo superiore del tronco secondario antero-laterale origina il nervo
- 5 -
muscolocutaneo. Il ramo inferiore del tronco secondario antero-laterale si unisce al ramo superiore del tronco secondario antero-mediale e formano il nervo mediano. Dal ramo inferiore del tronco secondario antero-mediale originano il nervo ulnare, il nervo cutaneo mediale del braccio e il nervo cutaneo mediale dell'avambraccio.
Figura 1. Rappresentazione schematica del plesso brachiale dell’uomo.
- 6 -
1.1.2 Anatomia del nervo mediano
Il nervo mediano è un nervo misto formato dall’unione di due radici, una che deriva dal ramo inferiore del tronco secondario antero-laterale, l’altra dal ramo superiore del tronco secondario antero-mediale. Anche se occasionalmente può avere fibre da C5, il nervo mediano riceve più frequentemente fibre motorie da C6- T1 e fibre sensitive da C6-C8.
Nel braccio decorre nella loggia anteriore lungo il margine mediale del muscolo bicipite. Al gomito passa sotto il lacerto fibroso, attraversa i due capi del muscolo pronatore rotondo e discende distalmente nell’avambraccio, lungo la linea mediana, fra il flessore superficiale ed il flessore profondo delle dita. Si impegna poi nel canale carpale, in rapporto con i tendini dei muscoli flessori delle dita e raggiunta la regione palmare si risolve nei rami terminali. Nell’avambraccio dell’uomo innerva tutti i muscoli della regione volare, ad eccezione del muscolo flessore ulnare del carpo ed il flessore profondo delle dita per il 4° e 5° dito (innervati dal nervo ulnare). Pertanto il nervo mediano innerva i muscoli: flessore radiale del carpo, pronatore rotondo, palmare lungo, flessore superficiale delle dita, i due fasci laterali (per l’indice e il medio) del flessore profondo delle dita, il flessore lungo del pollice e il pronatore quadrato.
I rami terminali sono nervi misti; si distinguono in ramo laterale e ramo mediale. Il primo si porta all’eminenza thenar distribuendosi con le fibre motrici ai muscoli abduttore breve del pollice, capo superficiale del flessore breve del pollice, opponente del pollice, innerva inoltre il primo lombricale; con le fibre sensitive, che formano i nervi digitali palmari, si distribuisce alla cute dell’eminenza thenar, del pollice e della metà laterale dell’indice. Il ramo mediale si risolve in nervi digitale palmari che innervano il secondo lombricale, la cute della metà mediale dell’indice, quella del dito medio e quella della metà laterale dell’anulare.
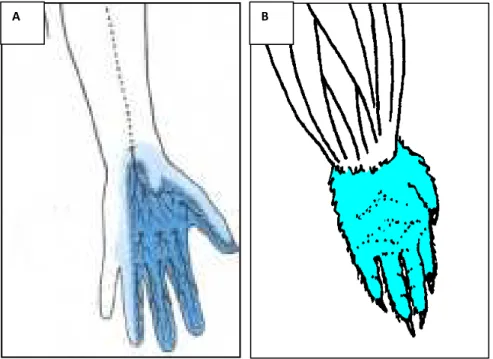
La differenza più rilevante tra uomo e ratto è rappresentata dall’innervazione dei muscoli flessori (profondi e superficiali) delle dita i quali, nell’uomo, sono innervati in parte dal nervo mediano ed in parte dal
- 7 -
nervo ulnare, mentre nel ratto sono tutti innervati esclusivamente dal nervo mediano (Fig. 3). Nel 1995 Bertelli e Mira dimostrarono infatti che tutti i muscoli flessori delle dita del ratto sono di pertinenza del nervo mediano, contrariamente a ciò che si pensava fino ad allora, cioè che tali muscoli fossero innervati come nell’uomo da mediano ed ulnare (Greene, 1963).Tale caratteristica rende il nervo mediano un modello sperimentale particolarmente efficace per lo studio del recupero funzionale in seguito a ricostruzione nervosa.
Figura 3. Il disegno mostra il territorio di innervazione del nervo
mediano nell’uomo (A) e nel ratto (B).
- 8 -
1.1.3 Macro e microstruttura del nervo periferico
Il sistema nervoso periferico è costituito da una complessa rete di fibre nervose che collega il nevrasse (encefalo e midollo spinale) alla periferia. La maggior parte dei nervi periferici sono nervi misti che portano informazioni sensitive in ingresso (fibre afferenti) ed impulsi motori ed autonomici in uscita (fibre efferenti).
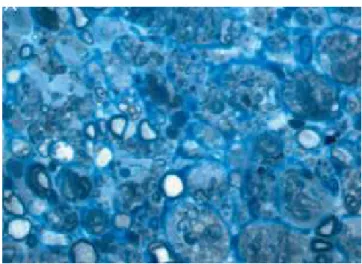
Le fibre nervose sono classicamente distinte in due tipi fondamentali, fibre mieliniche e fibre amieliniche e possono essere raggruppate in fasci di varie dimensione (Lundborg, 1988; Williams et al., 1995). Le fibre mieliniche sono distinte in fibre di moto e fibre di senso. Le fibre amieliniche sono quelle vegetative. Studi di microscopia elettronica hanno dimostrato che le fibre mieliniche presentano un assone circondato da una guaina costituita dalla cellula di Schwann che lo avvolgono, formando vari strati contrapposti e sovrapposti di membrana cellulare a formare un isolante elettrico lungo tutto l’assone.
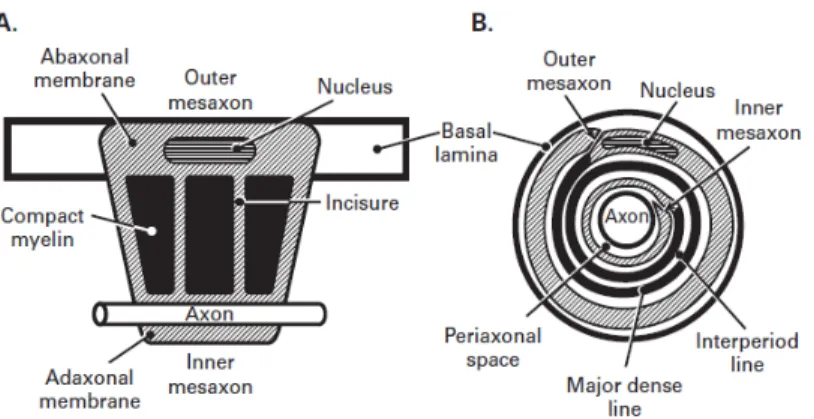
La mielinizzazione inizia con l’invaginazione della fibra nella cellula di Schwann che porta alla formazione del mesassone (sito di fusione della membrana cellulare) e procede con l’avvolgimento di quest’ultimo attorno all’assone. Si ha quindi la fusione degli strati interni della membrana plasmatica con lo spostamento del citoplasma nell’anello più esterno dell’avvolgimento (Fig. 4).
Figura 4. Rapporti topografici fra assone e cellula di Schwann durante le fasi
- 9 -
Il segmento di mielina prodotto da una singola cellula di Schwann è detto internodale poiché avvolge l’assone tra due nodi di Ranvier. Ogni cellula di Schwann, nelle fibre mieliniche, avvolge un solo assone.
Le fibre amieliniche sono invece avvolte da un semplice strato di citoplasma delle cellule di Schwann e, a differenza delle fibre mieliniche, una sola cellula di Schwann avvolge più assoni. Per una corretta funzionalità le cellule nervose hanno bisogno del trasporto assonale, un continuo apporto di metaboliti possibile grazie alla presenza di un delicato sistema microvascolare intraneurale (Fig. 5).
La correlazione tra le dimensioni e la velocità di conduzione delle fibre nervose, ha dimostrato che maggiore è il diametro della fibra, maggiore è la velocità di conduzione (Williams, 1995). La velocità di conduzione delle fibre mieliniche è inoltre aumentata dalla presenza dei nodi di Ranvier che permette la conduzione dell’impulso nervoso in modo saltatorio.
- 10 -
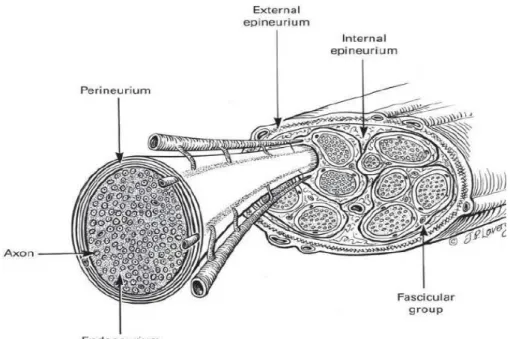
Il tessuto connettivo che avvolge le diverse parti del nervo è formato da varie componenti, ognuna con caratteristiche architettoniche e strutturali specifiche, che insieme concorrono ad isolare e tenere separate una parte dall’altra. Numerosi studi hanno dimostrato l’importante ruolo di questa componente connettivale. I vari involucri di tessuto connettivo, infatti, non solo hanno funzione protettiva e isolante, ma possiedono anche una funzione trofica nei confronti delle fibre nervose (Lundborg, 1988).
Le fibre nervose sono immerse nell’endonervio, costituito da un’esile trama di tessuto connettivo interposta tra le singole fibre nervose. La sua matrice fibrosa è formata da fibre di collagene tipo I poste parallelamente all’asse lungo delle fibre nevose, esternamente alla mielina. La componente cellulare dell’endonervio è data dalle cellule di Schwann, cellule endoteliali, fibroblasti, mastociti e macrofagi. Essa è immersa nel liquido endonevriale, il quale ha una pressione maggiore rispetto al perinervio probabilmente per la necessità di impedire l’accesso di sostanze tossiche esterne alle fibre nervose (Low, 1984; Powell, 1979). All’interno dell’endonervio, inoltre, sono presenti capillari sanguigni (Fig. 5). Il perinervio avvolge ciascun fascicolo, costituito da fasci di assoni “immersi” nell’endonervio, con una densa e robusta guaina. L’importanza funzionale di questa struttura tissutale è stata sostenuta da numerosi studi sperimentali che hanno dimostrato che essa si comporta come una barriera anatomo-funzionale per proteggere l’ambiente endoneurale e che lesioni a suo carico comportano una grave limitazione della conduzione nervosa (Thomas and Olsson, 1984; Kristensson and Olsson, 1971). Il perinervio è costituito da alcuni strati di cellule simil endoteliali che avvolgono i fascicoli e che continuano in periferia la barriera emato-encefalica del sistema nervoso centrale. Infine l’intero tronco nervoso è avvolto dall'epinervio formato da tessuto connettivo lasso (capace di produrre cicatrice) ricco di fibroblasti, cellule adipose e fibre collagene. È costituito da una parte più esterna, circonferenziale (epinervio esterno), e da una parte più interna che si trova fra i vari fascicoli (epinervio interno). L’epinervio ha principalmente una funzione protettiva (Lundborg, 1988) (Fig. 6).
- 11 -
Figura 6. Organizzazione macroscopica del sistema nervoso
- 12 -
1.2 LESIONI TRAUMATICHE DEI NERVI
PERIFERICI
Le lesioni nervose periferiche possono coinvolgere tutte le componenti del nervo: le fibre nervose, le cellule di Schwann, il tessuto connettivo ed i vasi, causando l’interruzione della conduzione.
La rigenerazione nervosa dipende da numerosi fattori sia intrinseci che estrinseci al nervo. A differenza del sistema nervoso centrale (SNC), nel quale la rigenerazione assonale è inibita da fattori presenti nell’ambiente circostante, nel sistema nervoso periferico (SNP) gli assoni lesionati mantengono la capacità di rigenerare anche nell’adulto (Hall, 2001).
Sono state proposte due principali classificazioni delle lesioni dei nervi periferici: Seddon (1943) considerava tre diversi gradi di danno nervoso (neuroaprassia, assonotmesi e neurotmesi), mentre Sunderland (1968) ne distinse cinque in base alle diverse alterazioni strutturali del tronco nervoso.
Lesione di primo grado: interruzione locale della conduzione nervosa con
preservazione della continuità assonale e delle altre strutture del nervo, corrispondente alla neuroaprassia di Seddon (Tab. 1). E’ in genere sostenuta da un’ischemia o da una demielinizzazione focale causata da compressione. Nel caso di un’ischemia di breve durata, al massimo 6 ore, generalmente non si hanno modificazioni strutturali del nervo ma si verifica un edema nei tessuti adiacenti. Quando invece la lesione è sostenuta da una demielinizzazione focale, si dimostrano alterazioni strutturali del nervo che colpiscono prevalentemente il rivestimento mielinico, ma che risparmiano l’assone. Nell’area di demielinizzazione focale, la conduzione dell’impulso nervoso da un nodo di Ranvier al successivo è più lenta e il tempo necessario perché l’impulso raggiunga la soglia di depolarizzazione al nodo successivo, è maggiore. Ne deriva una riduzione della velocità di
- 13 -
conduzione lungo il nervo. Queste lesioni sono comunque reversibili, con pieno recupero della funzione che solitamente si verifica entro settimane o alcuni mesi dall’iniziale lesione traumatica. Non necessitano di terapia chirurgica.
Lesione di secondo grado: interruzione dell'assone, senza perdita di
continuità dell'endonervio (corrisponde all'assonotmesi di Seddon). L'assoplasma è interrotto e si ha la degenerazione Walleriana distale e quella retrograda del moncone prossimale. La causa più comune è un modesto schiacciamento del nervo. Tutte le funzioni del nervo interessato sono abolite. Il recupero, per lo più completo, avviene progressivamente in senso prossimo-distale, man mano che le fibre rigeneranti raggiungono l'organo bersaglio. Non necessita di terapia chirurgica (Tab. 1).
Lesione di terzo grado: interruzione della fibra nervosa senza interruzione
del perinervio. La gravità maggiore della lesione è testimoniata da una degenerazione retrograda più estesa con emorragia, edema e ischemia che possono portare a fibrosi intra-fascicolare. Il recupero funzionale completo è impossibile per la dispersione di fibre all'interno del connettivo e la presenza di fibrosi che impedisce meccanicamente la crescita o la maturazione delle fibre. In alcuni di questi casi un intervento chirurgico di decompressione (neurolisi) può migliorare il risultato (Tab. 1).
Lesione di quarto grado: la continuità dell'epinervio è conservata, ma il
tronco nervoso diviene un ammasso disordinato di tessuto fibroso, cellule di Schwann e fibre rigeneranti, detto neuroma in continuità. Il recupero spontaneo di queste lesioni non è mai sufficiente a garantire una funzionalità accettabile, rendendo necessario un intervento di escissione del tessuto cicatriziale e riparazione del nervo (Tab. 1).
- 14 -
Lesione di quinto grado: perdita di continuità del tronco nervoso
(neurotmesi di Seddon). E’ caratterizzata da una distruzione dell’assone, della mielina e delle componenti circostanti del nervo. Si può osservare la formazione di un neuroma all’estremità del moncone prossimale. Queste lesioni richiedono una riparazione chirurgica del tronco nervoso, spesso con interposizione di trapianti di tessuto nervoso o altro (Tab. 1).
Lesione di sesto grado: è una lesione mista dove coesistono diversi tipi di
lesione nello stesso tronco nervoso. Questo è stato aggiunto successivamente alla classificazione di Sunderland da Mackinnon e Dellon nel 1988. Corrisponde, nei suoi esiti cicatriziali, al neuroma in continuità con funzione residua. Questo tipo di lesione rappresenta, una delle più importanti sfide nella riparazione del sistema nervoso periferico. Dal punto di vista tassonomico non andrebbe inserita in questa classificazione poiché la lesione mista prevede diversi gradi di lesione nello stesso punto del nervo (è più un concetto anatomo-patologico che chirurgico) (Mackinnon, Dellon, 1988).
- 15 -
Le lesioni nervose si possono classificare anche in relazione alla loro eziologia (Tab. 2).
Tabella 2: Classificazione di Dyck e Thomas delle lesioni del sistema nervoso
periferico (1993).
1.2.1 Cosa accade a monte della lesione
La resezione completa di un nervo determina modificazioni a carico degli assoni, delle cellule gliali e del connettivo. Per quanto riguarda gli assoni, si realizza un’interruzione di tutti i meccanismi di trasporto del materiale sintetizzato nel corpo cellulare verso le terminazioni e di conseguenza il tratto di assone a valle della lesione e le sue terminazioni sinaptiche degenerano. La privazione delle terminazioni sinaptiche e di parte dell’assone determina la riduzione transitoria del volume del corpo della
- 16 -
cellula nervosa di origine (atrofia neuronale), che può talora esitare anche nella degenerazione della cellula nervosa medesima (morte neuronale). Se la condizione di atrofia neuronale è transitoria il corpo cellulare va incontro a caratteristiche modificazioni morfologiche. Questo quadro patologico, che è stato descritto per la prima volta da Nissl nel 1892, è caratterizzato da un aumento del volume somatico, da uno spostamento del nucleo dal centro alla periferia e dall’apparente scomparsa delle zolle di Nissl, costituite da reticolo endoplasmatico (cromatolisi) (Williams, 1995). A questo cambiamento morfologico corrisponde la produzione di sostanze che servono per ricostruire il citoscheletro dell'assone e la membrana. Si osserva, infatti, un aumento della sintesi di tutte quelle proteine che sono necessarie per la rigenerazione delle varie componenti strutturali dell’assone: neurofilamenti, neurotubuli, etc. All’aumento di sintesi proteica è associato l’accumulo di ribonucleoproteine. Queste sostanze vengono inviate dalla cellula alla periferia e viaggiano con differenti velocità di flusso a seconda del peso molecolare. Esiste anche un flusso retrogrado che serve, in condizioni normali, per veicolare al corpo cellulare varie sostanze degradate a livello sinaptico (neurotrasmettitori) e/o assorbite a livello delle terminazioni assonali. L’interruzione di questo flusso retrogrado di sostanze verso il corpo cellulare potrebbe essere uno dei segnali che danno inizio al processo rigenerativo (Lundborg, 1988).
In seguito alla lesione, si realizzano modificazioni significative a livello dell’assone sia nella parte prossimale sia in quella distale rispetto al punto di lesione. Lungo il segmento dell’assone prossimale rispetto alla lesione i fenomeni degenerativi si diffondono solo per un breve tratto (degenerazione retrograda) estendendosi per uno o più segmenti internodali, in relazione all'entità della lesione.
1.2.2 Cosa accade a valle della lesione
Con la lesione di un assone, il segmento distale va incontro a degenerazione lungo tutta la sua estensione. Tale fenomeno degenerativo viene definito degenerazione Walleriana (Scherer and Salzer, 1996). Si caratterizza per la
- 17 -
rapida comparsa di variazioni metaboliche e strutturali che coinvolgono gli assoni, le guaine mieliniche, le cellule di Schwann ed il connettivo endo- e perineurale. Il cilindrasse scompare in poche ore con progressione distale (distruzione granulare di microtubuli e neurofilamenti assoplasmatici) digerito da vari enzimi. E’ stato dimostrato che la digestione enzimatica delle proteine è calcio-dipendente e che la demolizione dei neurofilamenti nel nervo periferico dei mammiferi è mediata da un enzima assoplasmatico attivato dal calcio (Schlaepfer and Bunge, 1973). La guaina mielinica si slamina, si frammenta e viene fagocitata dalle cellule di Schwann (a livello della lesione anche da polinucleati e fagociti). La denervazione del segmento distale causa un progressivo aumento nel contenuto di collagene e sono state osservate delle trasformazioni nella distribuzione dei tipi di collagene e di fibronectina nell'endonervio e nel perinervio. La produzione di collagene nell'endonervio può derivare dall'attività dei fibroblasti, ma si è anche pensato che esso sia il risultato dell'attività delle cellule di Schwann. Il nuovo collagene endoneurale si forma sulla superficie più esterna della membrana basale delle cellule di Schwann, causando un ispessimento della guaina.
Le cellule di Schwann, in seguito alla lesione del nervo, vanno incontro a modificazioni radicali nella morfologia, assumendo nuovamente un aspetto tondeggiante simile a quello che possedevano durante lo sviluppo embrionale. Le guaine mieliniche, laddove presenti, si disgregano separandosi in goccioline e vengono fagocitate da macrofagi (Stoll and Muller, 1986; Perry and Brown, 1992; Stoll et al., 1989), in gran parte provenienti dal sistema circolatorio, e dalle cellule di Schwann stesse che proliferano e si comportano come fagociti (Nathaniel and Pease, 1963; Bigbee et al., 1987). Le cellule di Schwann, quando sono private del contatto con l’assone, iniziano a proliferare (Salonen et al., 1988; Bryan et al., 1996). Tale proliferazione è stimolata sia dalla perdita del contatto assonale e dall’invasione dei macrofagi (Perry and Brown, 1992), sia, successivamente, dal contatto con gli assoni in via di rigenerazione (Pellegrino and Spencer, 1985).
- 18 -
L’intensa attività proliferativa delle cellule di Schwann in prossimità della sede di lesione e lungo tutto il moncone nervoso distale (Fawcett and Keynes, 1990), sede dei processi rigenerativi, porta alla formazione di quelle che vengono denominate colonne di Büngner.
Le cellule di Schwann si dispongono a formare lunghe colonne che fanno da guida per gli assoni rigeneranti. Le colonne di Büngner sono infatti considerate veri e propri “sentieri” lungo i quali gli assoni rigeneranti possono ritrovare la via per raggiungere la loro periferia originale (Thomas, 1964). Il substrato di adesione per la crescita assonale è fornito dalla lamina basale delle cellule di Schwann che contiene molecole di adesione quali la fibronectina e la laminina (Tohyama and Idè, 1984). La laminina trova la sua collocazione sul versante cellulare della lamina basale delle cellule di Schwann, mentre la fibronectina è localizzata sul lato interstiziale della lamina basale, a contatto con l’endonervio. Queste molecole coinvolte nell’adesione cellulare risultano essere fondamentali nella migrazione degli assoni durante la rigenerazione. La laminina, infatti, agisce nel vincolare la cellula di Schwann e l’assone alla lamina basale, mentre la fibronectina agisce nell’adesione tra la lamina basale ed il connettivo circostante (Tohyama and Ide, 1984).
Le cellule di Schwann, inoltre, assumono un ruolo fondamentale garantendo il supporto trofico necessario agli assoni in crescita durante la rigenerazione (Bunge, 1994; Tessier-Lavigne et Goodman, 1996). Solo in un secondo momento le cellule di Schwann riformeranno i normali avvolgimenti amielinici e, soprattutto, mielinici intorno agli assoni in modo tale da ristabilire la normale conduzione degli stimoli elettrici (Fig. 7, 8).
- 19 -
Figura 7: Dopo la sezione del nervo il segmento distale va incontro alla
degenerazione Walleriana. Dopo qualche giorno sono evidenziabili poche e nuove fibre circondate da una sottile guaina di mielina.
Figura 8: Rappresentazione del ruolo delle cellule di Schwann
- 20 -
1.2.3 Rigenerazione della fibra nervosa
La guarigione delle lesioni del tessuto nervoso periferico è unica se comparata con le modalità di riparazione degli altri tessuti. È un processo di riparazione cellulare anziché di riparazione tissutale. Un elevato numero di cellule devono raggiungere il proprio volume assoplasmatico precedente alla lesione producendo abbondante materiale che sarà utilizzato per rimpiazzare le parti lesionate. Per ottenere un recupero funzionale soddisfacente sono necessari ulteriori processi che coinvolgono, oltre all'assone, anche le terminazioni sensitive e motrici. Le tappe fondamentali di questo processo possono essere così riassunte:
(1) Recupero del neurone dagli effetti della degenerazione retrograda e inizio della rigenerazione assonale
(2) Crescita dell'assone fino alla sede della lesione
(3) Passaggio da parte dell'assone della zona della lesione
(4) Crescita dell'assone lungo i tubi endoneurali a valle della lesione (5) Ripristino di un corretto contatto con l'organo bersaglio
(6) Maturazione della fibra rigenerata e recupero delle caratteristiche anatomo-fisiologiche
(7) Rigenerazione di un numero di fibre adeguato e fenomeno dell’adozione.
La fase di recupero del corpo cellulare è caratterizzata dall'aumento della sintesi proteica, dall'accumulo di ribonucleoproteine e dalla loro riorganizzazione. Il corpo cellulare si riduce di volume e diventa più rotondeggiante. Inizialmente aumenta la sintesi di proteine di membrana "growth associated protein" (GAP), che sembrano avere un ruolo fondamentale nella crescita assonale. Nello stesso tempo, cambia il tipo di materiale trasportato lungo l'assone: si riducono molto le componenti necessarie alla trasmissione sinaptica, mentre aumentano quelle strutturali. La rigenerazione dell'assone parte da una struttura che si forma all'estremità, il cono di crescita.
- 21 -
Questa protrusione emana dei filopodi (sprouting) che esplorano l'ambiente circostante alla ricerca di un supporto di adesione adeguato. Al suo interno vi è una gran quantità di actina e microfilamenti responsabili della mobilità e della sua capacità di modificare la direzione di crescita dell’assone.
Particolare importanza hanno le caratteristiche chimico-fisiche del substrato: studi in vitro hanno dimostrato come gli assoni crescano più rapidamente sulle superfici su cui aderiscono meglio (laminina NPF). La velocità di accrescimento degli assoni è stata calcolata in 1-2 mm al giorno nell'uomo, anche se sono state osservate variazioni di questo ritmo a seconda della distanza dal corpo cellulare e col passare del tempo dal momento della lesione.
Durante la crescita all’interno delle colonne di Büngner, lo sprounting collaterale è molto limitato e solo la fibra principale rigenera e raggiunge la periferia. Se invece le colonne di Büngner sono state interrotte, la rigenerazione assonale avviene liberamente all’interno di un tessuto di riparazione costituito da cellule di derivazione ematica e macrofagi e le probabilità che gli assoni raggiungano la loro periferia sono molto ridotte (Williams, 1995).
Durante le prime fasi della rigenerazione si possono osservare all'interno del nervo delle unità di rigenerazione formate da tutti i collaterali di una fibra avvolte da una cellula di Schwann e dalla sua membrana basale. Dopo la prima settimana le unità di rigenerazione sono ancora presenti, ma le cellule di Schwann all'interno della membrana basale aumentano di numero (proliferazione delle cellule di Schwann). I segmenti nervosi a valle di una lesione sono molto ricchi di macrofagi che, oltre a svolgere un ruolo nel processo di fagocitosi dei detriti derivati dalla degenerazione degli assoni e delle guaine mieliniche (Stoll and Muller, 1986; Perry and Brown, 1992; Stoll et al., 1989), sono anche elementi importanti per la riparazione nervosa in quanto producono fattori che promuovono la rigenerazione assonale. In particolare vengono prodotti il PDGF (platelet-derived growth factor) che stimola, tra l’altro, la proliferazione delle cellule di Schwann
- 22 -
(Hardy et al., 1992) e IL-1β (interleukin-1β) che si pensa possa regolare la sintesi di NGF (nerve growth factor) da parte delle cellule di Schwann che è molto attiva, nel moncone nervoso distale, subito dopo la lesione (Heumann et al., 1987).
Nelle fasi successive le fibre nervose rigenerate cominciano il processo di mielinizzazione (Lundborg, 1988).
Un altro aspetto caratteristico dei nervi rigeneranti è la cosiddetta compartimentazione, che consiste nella formazione di mini-fascicoli all'interno del nervo. Questo fenomeno si realizza principalmente grazie all’attività delle cellule perineurali le quali, tramite lunghi prolungamenti citoplasmatici, circondano i fascicoli di fibre rigenerate che sono usualmente piuttosto piccoli (poche decine di assoni mielinici). Lo stimolo che induce la compartimentazione è probabilmente da ricercarsi nella necessità di ricreare un ambiente protetto nel quale possa correttamente realizzarsi la rigenerazione e la maturazione delle fibre nervose (Williams, 1995). La compartimentazione diviene sempre meno evidente sino a sparire a un anno circa dalla riparazione nervosa.
Dopo avere attraversato la cicatrice, l'assone ricomincia a crescere alla stessa velocità che aveva nel moncone prossimale. In questa fase, l'elemento che più si oppone all'avanzamento dell'assone, è l'integrità dei tubi endoneurali e il loro diametro, che tende a diminuire con il passare del tempo dalla lesione. Quando le fibre raggiungono l'organo bersaglio inizia la produzione da parte delle cellule di Schwann di mielina attraverso la stimolazione indotta da proteine trans-membrana e messaggeri intra-citoplasmatici.
Anche in condizioni ottimali, tuttavia, la maturazione delle fibre rigenerate conduce ad un recupero solo parziale delle caratteristiche anatomo-funzionali originali. Infatti il diametro delle fibre rigenerate è significativamente inferiore rispetto al normale e la mielina presenta nodi di Ranvier più ravvicinati; ciò si riflette sulla trasmissione dell’impulso che risulta significativamente più lenta.
- 23 -
Per quanto riguarda il tipo di fibre, si assiste ad una diminuzione del rapporto tra le fibre amieliniche e mieliniche. L’interpretazione più comunemente accettata per spiegare questa osservazione afferma che alcune diramazioni collaterali di fibre originariamente amieliniche divengono mieliniche in un secondo tempo, riducendo in tal modo il numero relativo delle fibre amieliniche all’interno del nervo. Il numero di fibre rigenerate aumenta fino alla 8a settimana per poi rimanere costante fino alla 26a.
Vi è progressivamente una “potatura” delle fibre che non raggiungono il bersaglio finale. A distanza di due anni il numero totale di assoni è di norma all'estremo inferiore dei valori normali.
Quando le fibre rigeneranti hanno raggiunto la periferia, viene ripristinato il contatto con l’organo bersaglio. L’ultima fase del processo rigenerativo è rappresentata dal fenomeno dell’adozione. Tale fenomeno consiste nel richiamo chemiotattico da parte delle fibre muscolari denervate (fibre orfane).
Questo richiamo attrae nuove branche dagli assoni rigenerati che vanno ad "adottare" le fibre muscolari orfane costituendo così delle "unità motorie giganti” nelle quali il numero di fibre muscolari innervate da un assone può essere anche 3 o 4 volte maggiore del normale. Le nuove branche possono originare da un nodo di Ranvier o da una placca motrice.
- 24 -
1.3 FATTORI CHE INFLUISCONO SULLA
RIGENERAZIONE NERVOSA
1.3.1 Paziente/tipo di lesione
Età del paziente: i migliori risultati raggiunti nella riparazione nervose nei
bambini hanno portato a pensare che la rigenerazione sarebbe avvenuta in maniera migliore nei soggetti più giovani. Sembrerebbe invece la maggior plasticità del SNC (miglior recupero dello schema motorio) in questi pazienti a garantire dei risultati funzionali migliori.
Sede della lesione: più la lesione è “alta”, “prossimale”, minore sarà la
possibilità di poter aver un buon risultato funzionale. La “commistione” delle fibre è maggiore a livello prossimale (via via andando verso le estremità il tronco nervoso si “semplifica” lasciando dietro di se branche sensitive e motorie); distalmente i tronchi nervosi sono più “semplici” e le lesioni a questo livello (polso-dita) danno i risultati più soddisfacenti ; (prognosi in base alla sede dalla peggiore alla migliore: plesso/grossi tronchi nervosi/nervi periferici/rami sensitivi terminali)
Perdita di sostanza nervosa: questa evenienza non consente di effettuare
una sutura diretta ma impone l’utilizzo di innesti. Questa procedura, come si è già detto, anche se eseguita correttamente, ha lo svantaggio di non poter garantire un corretto orientamento dei monconi nervosi. In pratica il chirurgo impone agli assoni rigeneranti una strada da percorrere (attraverso gli innesti) che magari non è quella corretta (in pochi millimetri il pattern fascicolare cambia considerevolmente). Anche la sutura diretta ha comunque lo stesso problema: da qui la storica proposta di Lundborg di lasciare uno spazio tra i due monconi nervosi di circa 5 mm e colmarlo con un condotto artificiale in silicone al quale vengono suturati i monconi
- 25 -
nervosi. Gli assoni rigeneranti poi dovranno cercarsi la strada verso il moncone distale attratti da fattori chemiotropici (neurotropismo).
Se la perdita di sostanza nervosa è superiore a 10 cm la prognosi è peggiore.
Condizioni dei tessuti circostanti: è ovvio come le condizioni dei tessuti
circostanti ad una riparazione nervosa possano condizionare la qualità della rigenerazione nervosa. È fondamentale un buon apporto di sangue; un buon “letto” dove poter appoggiare il nervo riparato è una condizione fondamentale in tutta la chirurgia del SNP.
Tempo intercorso fra lesione e riparazione: molti studi hanno dimostrato
come la riparazione primaria dia migliori risultati di quella in differita (Leclercq et al 1985; Merle et al 1986).
C’è tuttavia da sottolineare che sperimentalmente è stato visto che se una lesione nervosa è preceduta da una "lesione preparatoria" alcune settimane prima (1-3), le fibre rigeneranti crescono più velocemente.
Questo è il motivo per cui alcuni Autori considerano il tempo di 20-60 giorni come il periodo ideale per eseguire una riparazione di una lesione nervosa.
1.3.2 Fattori biomolecolari
Possono essere divisi in tre gruppi:
• Fattori NEUROTROFICI, • Fattori GLIOTROFICI • Fattori NEUROTROPICI
Essi promuovono l’adesione e la progressione delle gemme assonali (NPF). I fattori di crescita sono un ampio gruppo di proteine che giocano un ruolo cruciale nello sviluppo, nel differenziamento e in vari aspetti della biologia delle cellule di tutti gli organi e tessuti. Per quanto riguarda il sistema nervoso, tali fattori sono di fondamentale importanza per la regolazione di eventi cruciali nello sviluppo del SN, nella sopravvivenza e nel
- 26 -
differenziamento dei neuroni e delle cellule gliali (stimolano lo sviluppo e la maturazione delle cellule nervose). I fattori trofici sono prodotti in piccole quantità dalle cellule non nervose anche in condizioni normali, ma dopo una lesione la loro quantità aumenta enormemente con lo scopo di sostenere la crescita assonale.
FATTORI NEUROTROFICI: influenzano la direzione di crescita assonale
esercitando una attrazione a distanza con meccanismi diversi, per esempio attraverso la produzione di proteine diffusibili da parte del moncone distale. La più importante classe di fattori neurotrofici è rappresentata dalle
neurotrofine, una classe di piccole proteine basiche (circa 13 KDa) a cui
appartiene l’NGF (Nerve Growth Factor), il primo fattore ad azione trofica sul sistema nervoso identificato da Rita Levi Montalcini e Stanley Choen negli anni sessanta (Choen, 1960). Questa famiglia di fattori ha una struttura filogeneticamente conservata ed è suddivisibile in cinque sottomembri: NGF, BDNF (Brain Derived Neurotrophic Factor), NT-3 (Neurotrophin-3), NT-4/5 (Neurotrophin-4/5) (McDonald and Chao, 1995). Le neurotrofine legano due classi di recettori: i Trk, della famiglia dei recettori tirosin-chinasi e p75, della superfamiglia dei recettori del fattore di necrosi tumorale.
Le neurokine sono una famiglia di piccole molecole che includono il CNTF (Ciliary Neurotrophic Factor), che agisce sui neuroni del SNP, ed il LIF (Leukemia Inhibitory Factor) che esercita la sua azione solo sul SNC (Ip and Yancopoulos, 1996). Esse si legano a recettori che, non avendo una attività tirosin-kinasica intrinseca, reclutano una famiglia di proteine Jak-kinasi, che a loro volta attivano la trasduzione intracellulare dello stimolo.
Esistono poi una serie di fattori che non esercitano la loro funzione trofica prevalentemente sul sistema nervoso.
-TGFβ (Trasforming Growth Factors β): comprende numerose molecole tra
cui il TGFβ1, espresso principalmente dalle cellule gliali in situazioni di lesione a carico del SNC ed esercita la sua funzione favorendo l’attivazione della microglia e la risposta immunitaria;
- 27 -
-BMP (Bone Morphogenic Factor): ha funzione trofica sulle cellule del
sistema nervoso adulto;
-GDNF (Glial Derived Neurotrophic Factor): sintetizzato dalle cellule di
Schwann e dagli astrociti con funzione neuro protettiva;
-FGF (Fibroblast Growth Factor): oltre sull’azione proliferativa dei
fibroblasti, agisce anche su differenti popolazioni neuronali e su alcuni sottotipi di cellule gliali;.L’azione dell’FGF è particolarmente evidente in seguito a lesioni assonali nel SNP poiché stimola la rigenerazione degli assoni stessi verso il target originale (Baird, 1994; Eckenstein, 1994);
-EGF (Epidermal Growth Factor) e fattori ad esso correlati, tra cui il TFFα
(Transforming Growth Factor α) sono espressi da numerose popolazioni cellulari ed esercitano, tra l’altro, la loro azione nello sviluppo e nella rigenerazione del sistema nervoso (Carraway and Burden, 1995).
FATTORI GLIOTROFICI: per quanto riguarda i fattori gliotrofici, sicuramente
meno studiati rispetto ai fattori neurotrofici, la famiglia che ha destato maggior attenzione negli ultimi anni è quella delle neureguline. Dal momento che le neureguline svolgono un ruolo importante nella proliferazione delle cellule di Schwann durante la degenerazione Walleriana e nella successiva rigenerazione del nervo periferico (Carroll et al., 1997; Marchionni et al., 1993; Ben-Baruch and Yarden, 1994). Le neureguline (NRGs) svolgono la loro azione attraverso il legame con i recettori della famiglia degli EGFr (Epidhermal Growth Factor receptor) e la conseguente trasduzione del segnale. In particolare si è visto che l’espressione delle neureguline e dei loro recettori da parte delle cellule di Schwann aumenta durante la degenerazione Walleriana (Cohen et al., 1992; Carroll et al., 1997), consentendo, grazie ad una secrezione paracrina od autocrina, la sopravvivenza delle cellule di Schwann e del tessuto muscolare anche in assenza di uno stretto rapporto con l’assone (Garrat et al., 2000; Jessen,
- 28 -
Mirsky 1999, Geuna et al., 2003; Nicolino et al., 2003; Raimondo et al., 2005).
Neureguline e cellule di Schwann
All’interno della famiglia delle neureguline, la NRG1 regola diversi aspetti dello sviluppo delle cellule di Schwann: in vitro induce il differenziamento delle cellule della cresta neurale (Shah et al., 1994), favorisce la maturazione dei precursori cellulari (Dong et al., 1995) ed agisce positivamente sulla sopravvivenza, motilità, migrazione e proliferazione delle cellule mature (Syroid et al., 1996; Mahanthappa et al., 1996; Marchionni et al., 1993). In tutti questi processi è cruciale il segnale trasmesso dal recettore-ligando NRG1-ErbB (come dimostrato da Ronchi nel 2009 in vivo su animali geneticamente modificati) (Morris et al., 1999). Esistono dati in letteratura che indicano che la differenziazione delle cellule della linea neurale in direzione gliale avvenga sotto lo stimolo dell’isoforma NRG1β (Yessen and Mirsky, 2002). Anche la sopravvivenza dei precursori delle cellule di Schwann è regolata in modo paracrino dall’isoforma NRG1β che deriva dagli assoni limitrofi (Meintanis et al., 2001). Inoltre, durante lo sviluppo, le cellule di Schwann stabiliscono in modo progressivo un circuito autocrino di autostimolazione che agisce sommandosi ai segnali provenienti dagli assoni. Si pensa che proprio questo meccanismo sia alla base della sopravvivenza delle cellule di Schwann in assenza di assoni. In questo caso, però, oltre alla NRG1β, altri fattori, quali IGF2 (insulin-like growth factor 2), NT3 (neurotrophin 3), PDGF-BB (platelet-derived growth factor BB), giocano un ruolo importante (Yessen, Mirsky, 1999).
Gli studi di Ronchi et al., dimostrano che il segnale delle NRGs è fondamentale, sia durante lo sviluppo sia dopo la crescita del sistema nervoso, per promuovere e mantenere livelli adeguati di mielinizzazione delle cellule di Schwann.
Mentre, nell’embrione, le cellule destinate a diventare cellule di Schwann necessitano delle NRGs di derivazione assonale per la sopravvivenza, la proliferazione e il differenziamento nella vita adulta, durante i fenomeni di
- 29 -
rigenerazione dei nervi periferici, le NRGs possono servire come mitogeni per aumentare il numero di cellule di Schwann anche in assenza di assoni (Carroll et al., 1997). Inoltre, le NRGs attivano le proteine FAK (Focal Adhesion Kinase) che promuovono la motilità cellulare nelle cellule di Schwann. La NRG1 di tipo II (GGF) promuove la proliferazione e la sopravvivenza delle cellule di Schwann, attivando sia la PI3K sia la via delle MAPK. Mentre entrambe queste vie contribuiscono alla sopravvivenza delle cellule di Schwann, solo la via della PI3K è quella che consente la proliferazione, la sopravvivenza e la mielinizzazione delle cellule di Schwann (Maurel and Salzer, 2000).
In coincidenza con la degenerazione assonale, le cellule di Schwann vanno incontro a de-differenziamento e successiva proliferazione, promuovendo in tal modo l’eventuale rigenerazione assonale. Le NRGs, in particolare l’isoforma α della NRG1, sono anche prodotte dalle stesse cellule di Schwann e possono indurre proliferazione attraverso i recettori ErbB2 ed ErbB3. L’aumento delle NRGs per molti giorni dopo la lesione suggerisce che esse siano implicate nella promozione della proliferazione delle cellule di Schwann durante la degenerazione Walleriana (Carroll et al., 1997). Studi recenti sul muscolo-in-vena (Geuna et al., 2007) hanno permesso di spiegare il comportamento delle cellule di Schwann in condizioni fisiologiche e in condizione di denervazione.
In condizioni normali, le cellule di Schwann che circondano gli assoni esprimono i ricettori ErbB2/ErbB3 ed entrambe le isoforme solubili della NRG1, α e β. In seguito a denervazione, le cellule di Schwann adulte, non trovandosi più in contatto con gli assoni, cambiano la loro morfologia, cessano di esprimere l’isoforma β della NRG1 mentre aumentano l’espressione dell’isoforma α della NRG1 e dei recettori ErbB2/ErbB3, probabilmente per compensare la più bassa affinità di legame della NRG1 α rispetto alla NRG1 β (Ronchi G et al., 2013).
Talora tuttavia è difficile separare queste categorie di fattori e si tende piuttosto a parlare di sostanze ad attività neurotropica o neurotrofica. Alcune di queste sostanze in condizioni normali hanno attività trofica,
- 30 -
mentre durante la rigenerazione assumono una attività neurotropica. È comunque difficile distinguere tra sostanze neurotrofiche e neurotropica e alcuni autori preferiscono parlare di influenza trofica e tropica.
Il fenomeno del neurotropismo è stato studiato ampiamente negli anni: è definito come la crescita diretta delle fibre rigeneranti verso un gradiente di concentrazione composto da sostanze diffusibili prodotte dal segmento nervoso distale (attrazione a distanza); i primi studi su questo argomento sono stati effettuati da Ramón y Cajal (Ramon y Cajal 1928) che ha dimostrato per la prima volta il principio del neurotropismo in vivo. Lundborg nel 1982 attraverso lo studio della rigenerazione nervosa in una camera mesoteliale ha definitivamente confermato questa peculiare caratteristica. In questo contesto si inserisce il concetto di specificità nella rigenerazione nervosa che indica la precisione nella definitiva reinnervazione degli organi periferici.
Si distinguono tre tipi di specificità: • Specificità Tissutale
• Specificità D’organo • Specificità Topografica
La prima indica la crescita preferenziale degli assoni rigeneranti verso il tessuto nervoso distale rispetto ad altri tipi di tessuto. La seconda indica la reinnervazione preferenziale delle fibre sensitive e motrici verso i rispettivi organi d’origine. La terza indica la crescita delle fibre nervose di una certa regione topografica di un tronco nervoso verso le corrispondenti regioni distali. In pratica dando la possibilità alle fibre rigeneranti di crescere in una “camera”, un “tubulo”, queste, grazie allo stimolo fornito dai fattori
neuorotropici prodotti dal moncone distale, rigenereranno
preferenzialmente verso il tessuto nervoso anziché un altro tessuto (specificità tissutale), le fibre motrici e sensitive verranno indirizzate verso i corretti target distali (specificità d’organo) e le fibre che innervavano un
- 31 -
muscolo reinnerveranno preferenzialmente lo stesso muscolo anziché un altro (specificità topografica).
I neurite-promoting factors sono fattori o sostanze sulle quali gli assoni
crescono meglio e che stimolano la formazione del cono di crescita. Laminina e fibronectina sono esempi di sostanze componenti della matrice extra-cellulare, mentre N-CAM e LI sono esempi di molecole di superficie cellulare, entrambe le categorie forniscono un buon substrato di "adesione" per l'avanzamento dell'assone e forse anche codici molecolari specifici per il riconoscimento dei bersagli.
La glicoproteina laminina è il componente fondamentale delle lamine basali delle fibrocellule muscolari; questo spiega il perché dell’utilizzo del muscolo predegenerato o fresco utilizzato per “pontare” come innesto perdite di sostanza nervosa. I tubi di lamine basali (simili a quelli creati dalle cellule di Schwann nei cordoni di Büngner) guidano la rigenerazione nervosa fino al moncone distale.
1.3.3 Fattori tecnici
Anche la tecnica chirurgica e l’accuratezza della sua esecuzione possono ovviamente influenzare la qualità della rigenerazione e quindi il risultato finale. Sono diversi i punti importanti come ad esempio il trimming dei monconi nervosi : la preparazione dei monconi stessi prima dell’esecuzione della sutura è stata studiata a fondo tanto che sono stati ideati strumentari particolari (Meyer) o viene consigliata la sezione dei monconi dopo congelamento (DeMedinaceli) per poter meglio affrontare i monconi stessi. La tensione delle suture, il tipo di sutura (epineurale, funicolare, etc) sono altrettanto importanti ma verranno sottolineati in un'altra lezione.
- 32 -
1.4. TRATTAMENTO DELLE LESIONI
TRAUMATICHE DEI NERVI PERIFERICI
Al contrario del sistema nervoso centrale quello periferico è capace di rigenerazione post-traumatica. Negli ultimi anni la conoscenza dei fattori che influenzano la rigenerazione nervosa è aumentata parallelamente allo sviluppo di più sofisticate tecniche chirurgiche.
Inizialmente l’approccio chirurgico comunemente utilizzato per la riparazione nervosa è stato la sutura diretta dei due monconi, prossimale e distale. Nel caso in cui la lesione nervosa risultasse in una perdita di sostanza tra i due monconi, il trattamento chirurgico consisteva nel suturare i due monconi sotto tensione, una procedura che ha portato a pochi risultati clinici. La dimostrazione, negli anni ’70, che un segmento di nervo autologo che facesse da ponte tra i due monconi portasse a migliori risultati clinici rispetto alla sutura sotto tensione (Millesi, 1970; Millesi et al., 1976), aprì una nuova era nella chirurgia dei nervi periferici.
Questa procedura presenta però alcuni svantaggi, perciò negli ultimi anni si sono cercate soluzioni alternative. Tra le varie strategie utilizzate, la possibilità di utilizzare materiali non nervosi è stata ampiamente utilizzata, sia sperimentalmente che in pratica clinica.
La prima sutura termino-terminale dei nervi lesionati fu attuata da Hueter nel 1873 utilizzando suture nell’epinervio (Ijkema-Paassen et al., 2004) Questa metodica presenta il vantaggio di una minima manipolazione chirurgica lasciando la possibilità ai fattori neurotrofici di guidare la rigenerazione degli assoni verso gli organi bersaglio.
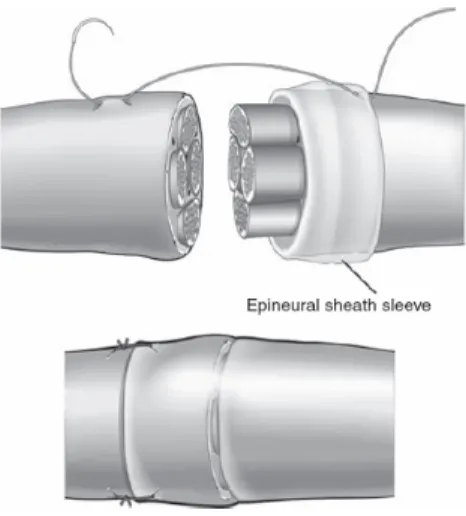
La tecnica originale è stata modificata da Snyder e successivamente da altri Autori con l’utilizzo di un lembo a manicotto di epinervio per spostare la sede di sutura lontano dall’area interessata dalla lesione (Snyder, 1968; Siemionow, 2002; Tetik, 2002; Lubiatowski, 2008) (Fig. 9).
- 33 -
Figura 9: Disegno schematico di una sutura epinevrale. In particolare
variante tecnica di Snyder con utilizzo di manicotto d’epinervio.
Tuttavia, il connettivo epinevriale, può essere sede di formazione di tessuto cicatriziale in grado di interferire con la progressione assonale. Esiste anche lo svantaggio di non poter allineare con precisione i fascicoli così che essi si orientino in maniera casuale all’interno del tronco nervoso. Per ovviare a questo inconveniente è stata messa a punto la tecnica di sutura perineurale. Questo tipo di neurorrafia descritta da Millesi permette la sutura dei singoli fascicoli attraverso il passaggio del filo nel perinervio. Tale tecnica richiede però una maggiore manipolazione chirurgica del nervo (Fig.10).
- 34 -
Nel caso di perdite di sostanza è tuttavia necessario colmare il gap con un innesto così che le fibre del moncone prossimale possano rigenerare verso il moncone distale. La tecnica ancora oggi ritenuta il gold-standard prevede l’utilizzo d’innesti autologhi, strip nervosi non vascolarizzati (Terzis et al., 1997), che guidano meccanicamente la ricrescita assonale. I primi innesti nervosi autologhi sono stati descritti da Philipeaux and Vulpian (1870) poi introdotti nella pratica clinica da Albert quindici anni più tardi.
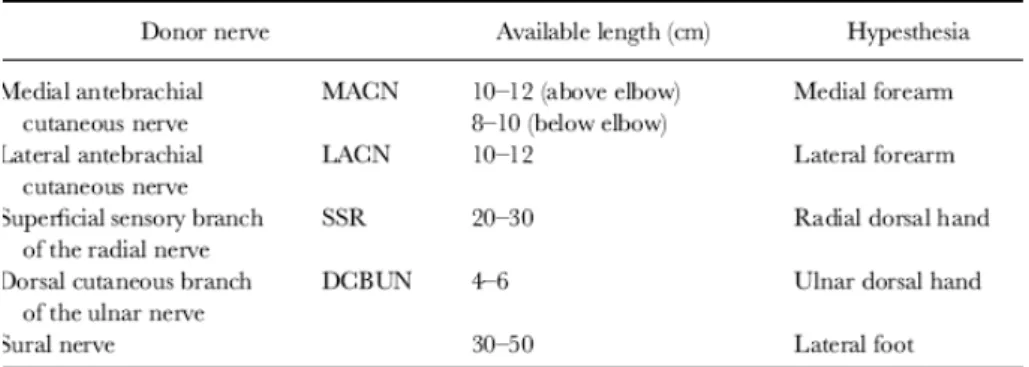
I nervi utilizzati a questo scopo sono nervi sensitivi, fra i più utilizzati: il nervo surale, il nervo safeno, il nervo cutaneo-mediale e laterale dell’avambraccio, il nervo radiale superficiale e l’interosseo posteriore (Fig.
11).
Figura 11: esempi di nervi utilizzati come innesti autologhi, lunghezza
massima disponibile ed esiti a carico del sito donatore.
L’innesto autologo dà buoni risultati in quanto è ricco di cellule di Schwann ovvero di fattori neurotrofici e neurotropici da esse prodotti. Inoltre, la membrana basale delle cellule di Schwann contiene fattori quali la laminina e la fibronectina in grado di promuovere la progressione assonale (Fu and Gordon, 1997; Rosen and Lundborg, 2000; Siemionow et al., 2009).
- 35 -
Anche questa tecnica presenta però alcuni svantaggi (Fig. 11):
1) Richiede un’ulteriore incisione chirurgica per il prelievo del graft
2) Prevede sacrificio di un nervo sensitivo con un inevitabilmente deficit residuo
3) L’indisponibilità d’ingenti quantità d’innesti nervosi nelle grosse lesioni del sistema nervoso periferico
4) La discrepanza fra il calibro del graft e quello del nervo leso.
Questi problemi hanno spinto le ricerche verso lo sviluppo di nuove soluzioni da applicare alla rigenerazione nervosa.
Gli innesti autologhi “freeze-killed”sono graft acellulari preparati attraverso processi di congelamento e scongelamento del nervo da utilizzare come innesto. Il congelamento elimina tutte le cellule ma lascia relativamente indenne la matrice extracellulare e la lamina basale componente di supporto fondamentale durante la rigenerazione degli assoni per brevi tratti (Anderson et al., 1983; Idé et al., 1983; Hall et al., 1986, Brooks et al., 2012).
Altre soluzioni hanno previsto l’utilizzo di innesti nervosi essiccati, tale procedimento riduce la proliferazione delle cellule non nervose, in particolare delle cellule di Schwann, ciò a permesso di dimostrare come esse siano importanti, ma non determinanti durante il processo si ricrescita assonale (Widerberg and Dahlin, 2000).
Numerose altre tecniche alternative sono state studiate per la riparazione chirurgica dei nervi negli ultimi anni.
Con il termine tubulizzazione ci si riferisce all’impiego di strutture di varia natura conformate a “tubo” da utilizzare come alternativa agli innesti nervosi autologhi.
La riparazione con tubuli porta alcuni vantaggi fra i quali:
1) La creazione di una camera biologica non aggredibile dai fibroblasti all’interno della quale il nervo può rigenerare mantenendo in situ fattori trofici e di crescita endogeni
- 36 -
2) La capacità di funzionare da guide direzionali durante l’allungamento degli assoni rigenerati.
1.4.1 Tubulizzazione biologica
I primi lavori sperimentali sono da attribuire a Gluck nel 1880 e da Vanlair nel 1882, entrambi furono condotti usando osso decalcificato. Büngner nel 1891 ottenne buoni risultati con tubi costituiti dalla parete delle arterie. L’utilizzo delle arterie è però limitato nella ricerca sperimentale perché è difficile reperire vasi di grandezza congrua senza incorrere in effetti collaterali. Gli studi successivi si sono perciò focalizzati sulle vene.
La prima applicazione clinica viene eseguita da Wrede nel 1909 in lesione di nervo mediano con un gap di 45 mm, riparato con segmento di vena safena. Swan nel 1941 riporta buoni risultati nella riparazione di nervo ulnare, sempre con l’uso di vena. Innesti di vasi sanguigni sono stati utilizzati con successo nella riparazione del nervo periferico in molti altri studi. Gli innesti costituiti da vene hanno infatti il vantaggio di fare da guida per gli assoni rigeneranti, ma studi sperimentali e clinici mostrano che essi non possono essere utilizzate per lunghe perdite di sostanza superiori ai 10 mm in quanto i vasi collassano, impedendo la progressione delle fibre rigeneranti (Marcoccio et al,. 2010).
Alcuni autori hanno utilizzato fibre muscolari scheletriche, sia fresche (Jimming et al., 1986) sia denervate (Dubov et al., 1994), con buoni risultati. Altri autori hanno però sostenuto che migliori risultati potessero essere ottenuti utilizzando fibre muscolari pre-degenerate, sostenendo che l'assenza di materiale cellulare potesse favorire la progressione assonale (Glasby et al., 1986; Jimming et al., 1986; Rath et al., 1991; Chen et al., 1994; Itoh et al., 1996; Liu et al., 2001).
Ciascuna fibra muscolare è avvolta da una membrana cellulare che è formata dalla membrana plasmatica della fibra e dalla lamina basale più esternamente. La lamina basale è costituita da collagene, fibronectina e laminina. Grazie alla sua composizione, la lamina basale è capace di
- 37 -
supportare, dirigere la crescita e la migrazione durante la morfogenesi, la rigenerazione e la riparazione dei tessuti.
Le fibre muscolari forniscono quindi un buon supporto per l’avanzamento degli assoni per mezzo delle molecole di adesione presenti nella loro lamina basale (Idè et al., 1984; Glasby et al., 1989), tuttavia anche gli innesti costituiti da solo muscolo non possono essere utilizzati per lunghe perdite di sostanza in quanto le fibre rigeneranti tendono a disperdersi all’esterno degli innesti e raramente raggiungono il moncone distale.
Negli ultimi anni la tubulizzazione biologica ha visto l’affermarsi dell’uso di innesti autologhi misti rappresentati da un condotto venoso riempito con fibre muscolari fresche (muscolo-in-vena), questa soluzione è supportata da solidi risultati sperimentali (Brunelli et al., 1993) e clinici (Brunelli et al., 1993; Battiston et al., 1997).
Le caratteristiche degli innesti di muscolo-in-vena sono attribuibili da un lato alle fibre muscolari, che fanno da guida per gli assoni rigeneranti e evitano il collasso della vena, e dall’altro alla parete venosa che impedisce la dispersione degli assoni.
Per quanto riguarda le fibre muscolari, è stato osservato che, oltre a prevenire il collasso della vena, esse sostengono l’avanzamento degli assoni grazie alla presenza delle molecole di adesione della lamina basale (Idé et al., 1984; Glasby et al., 1989). La lamina basale, infatti, contiene le glicoproteine, fibronectina e laminina. Quest’ultima, in particolare, fornisce un ottimo substrato di adesione per l’avanzamento dell’assone (Dubov et al., 1994).
Un innesto di muscolo-in-vena può supportare la rigenerazione nervosa nel ratto fino a 30mm di gap con risultati simili a quelli ottenuti con gli innesti tradizionali (Battiston et al., 2000).
Anche nel caso degli innesti di muscolo-in-vena possono essere utilizzate fibre muscolari predegenerate in modo che l’assenza di materiale cellulare favorisca la progressione assonale (Meek et al., 2001).
- 38 -
1.4.2 Tubulizzazione artificiale
Con lo sviluppo dell’ingegneria tissutale è stato possibile introdurre nella pratica sperimentale e clinica una serie materiali da utilizzare nella produzione di guide neurali per la riparazione dei difetti nervosi.
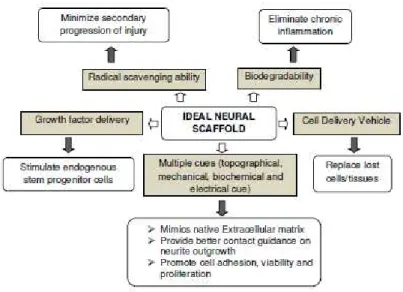
Le caratteristiche ideali dei tubuli artificiali sono (Fig. 12):
1) Essere costruiti in materiale duttile e flessibile 2) Essere suturabili con facilità con fili 8/9-0
3) Essere facilmente sterilizzabili con le comuni metodiche
4) Essere porosi alle sostanze in grado di facilitare la crescita assonale, ma al contempo impermeabili a quelle che possono rallentarla
5) Presentare una bassa antigenicità per limitare i fenomeni di rigetto 6) Essere biodegradabili una volta che il rigenerato ha raggiunto il moncone distale per limitare fenomeni di stenosi
7) Essere resistenti alla compressione senza che le pareti collabiscano 8) Funzionare come dispenser per fattori trofici in modo da supportare sia fisicamente che biochimicamente il tessuto rigenerato.
9) Essere facilmente reperibile e di basso costo.
- 39 -
Sono stati autorizzati dalla FDA soltanto sei tipi di materiali da utilizzare nell’uomo: due non sono bio-assorbibili (il silicone ed il politetrafuoroetilene-PTFE), mentre gli altri quattro sono condotti bio-assorbibili (acido poliglicolico (PGA), polilactide-Caprolattone (PLCL), acido poliglicolico cross-linked con il collagene (PGA-c) ed il collagene di tipo I) (Dahlin et al., 2009).
E’ dal 1984 che vengono studiati tubuli sintetici, il primo fu Seckel utilizzando nei ratti dei tubuli in polimeri sintetici bio-assorbibili. Nel 1988 Dellon e Mackinnon riportano studi sperimentali compiuti su scimmie, utilizzando tubuli e mesh bio-assorbibili di Acido Poliglicolico. Nel 1990 gli stessi Autori riportano i loro buoni risultati nell’utilizzo di tubo di Acido Poliglicolico in 15 pazienti con perdita di sostanza in lesione nervosa digitale.
Nel 1991 Lundborg espone i suoi risultati nel trattamento di lesione di nervo ulnare con tubo di silicone e nel 1994 utilizza la stessa tecnica per il trattamento di 2 lesioni di nervo mediano all’avambraccio. In letteratura vi sono pochi dati e spesso contraddittori sull’utilizzo dei condotti in PTFE. Numerosi ricercatori hanno utilizzato tubi sintetici vuoti (Lundborg et al., 1982; Mackinnon et al., 1990) oppure riempiti con fattori di crescita (Rich et al., 1989; Aebischer et al., 1989) o con cellule di Schwann (Ansselin et al., 1997).
Sperimentalmente questi tubi costituiscono un ottimo modello di ricerca per introdurre fattori di crescita o d’adesione da studiare, usando di volta in volta sostanze che promuovono o che inibiscono la rigenerazione nervosa (Fig. 13).
In definitiva, vi è consenso nel ritenere che le guide sintetiche non riassorbibili supportino validamente la fibre durante le fasi iniziali della rigenerazione, ma finiscono in un secondo tempo per dare una stenosi del rigenerato nelle fasi di maturazione (Merle et al., 1989; Lundborg et al., 1991).
A causa dei limiti emersi di questi dispositivi sono state proposte delle guide biodegradabili. Tali condotti si sono dimostrati un valido supporto alla
- 40 -
rigenerazione nervosa per gap inferiori ai 30mm con risultati funzionali paragonabili agli autoinnesti (Schlosshauer et al., 2006).
Nell’ambito delle grosse perdite di sostanza nervosa (>50mm) la ricerca sta lavorando per riuscire a costruire delle guide neurali artificiali migliorando: il disegno dell’interfaccia nervo-scaffold, la flessibilità, la biocompatibilità, la permeabilità, riducendo contestualmente l’immunogenicità dei materiali. Al fine di supportare la proliferazione delle cellule di Schwann e delle fibre nervose il condotto dovrebbe essere permeabile alle molecole di ossigeno ed ai metaboliti in grado di influenzare positivamente il rigenerato, ma allo stesso tempo impermeabile all’infiltrazione fibroblastica. (Dahlin et al., 2009) (Fig. 13).
I tubi sintetici maggiormente utilizzati nella pratica clinica sono quelli di Silicone, di Collagene di tipo I e di Acido Poliglicolico.
Chen et al. hanno utilizzato tubi di silicone riempiti con un gel di collagene, laminina e fibronectina. Questo tipo di innesto offre un mezzo di crescita adatto per la rigenerazione degli assoni (Chen et al., 2000).
Per quanto riguarda invece gli innesti di Acido Poliglicolico sono stati utilizzati nella pratica clinica (Neurotube©) con risultati incoraggianti per colmare gap lunghi fino a 25mm (Weber et al., 2000), tuttavia hanno però un diametro tale per cui non possono essere impiegati per i grossi tronchi nervosi.
Per ovviare al problema della scarsa funzionalità su lunghe distanze dei tubuli sopra citati, alcuni autori hanno sperimentato in laboratorio la tecnica di alternare a tubi biologici dei tratti di nervo. Questa tecnica, chiamata “a sandwich” o “stepping-stone” (Maeda et al., 1993), permetterebbe di aumentare la lunghezza dei tubuli fornendo un apporto di cellule di Schwann agli assoni rigeneranti (Fig. 13).
- 41 -
Figura 13: Trenta anni di studi sperimentali utilizzando condotti nervosi