37
CAPITOLO 2
RISULTATI E DISCUSSIONE
Separazione e identificazione dei composti
Le radici di Scorzonera judaica Eig. sono state essiccate e successivamente estratte attraverso macerazione statica a temperatura ambiente con solventi a polarità crescente: n-esano, cloroformio, cloroformio–metanolo (9:1) e metanolo, ottenendo, dopo opportuna evaporazione, i rispettivi residui: RE 34.40
g, RCM 15.77 g, RC 14.42 g e RMeOH
Gli estratti scelti come obiettivo di studio sono stati l’estratto cloroformio-metanolo, l’estratto cloroformico e l’estratto metanolico, dai quali sono stati isolati, attraverso diverse tecniche cromatografiche, 14 composti, 10 dei quali sono stati completamente caratterizzati mentre i 4 rimanenti sono ancora in corso di caratterizzazione.
73.71 g.
Tra i metaboliti secondari identificati troviamo: • 6 diidroisocumarine
• 2 lignani
• 2 composti fenolici semplici
Frazionamento del residuo cloroformio-metanolo
Dal residuo RCM, attraverso varie tecniche cromatografiche (vedi Fig. 2.1), sono
stati isolati 10 metaboliti secondari (1-7, 9, a-b). I composti 2, 3, 4 e 7 appartengono alla classe delle diidroisocumarine, i composti 1 e 9 sono lignani, i composti 5 e 6 sono composti fenolici semplici e i composti a e b sono ancora in fase di caratterizzazione, ma sembrano appartenere alla classe delle diidroisocumarine (composto a) e degli stilbeni (composto b).
38
39
Frazionamento del residuo cloroformico
L’estratto RC è stato cromatografato attraverso una colonna flash, utilizzando come fase stazionaria il gel di silice, da cui si sono ottenute delle frazioni molto complesse che a loro volta sono state sottoposte a cromatografia ad alta pressione su fase inversa (RP-HPLC). Attraverso queste tecniche cromatografiche, da RC sono stati isolati 4 composti (7-9, c), di cui uno già
ottenuto precedentemente anche dal residuo RCM (7); il composto 8 è una
diidroisocumarina, il composto 9 è un lignano e il composto c è ancora in fase di caratterizzazione, ma sembra anch’esso appartenere alla classe dei lignani.
40
Frazionamento del residuo metanolico Il residuo RMeOH
Dall’estratto R
è stato ripartito, per mezzo di un imbuto separatore, in una porzione n-butanolica e in una acquosa, in modo da eliminare la componente zuccherina presente nel materiale vegetale, la quale è risultata piuttosto abbondante trattandosi di radici.
BuOH, attraverso appropriate tecniche cromatografiche (vedi Fig. 2.3), sono stati isolati 5 metaboliti secondari (2-4, 10, d), 3 di questi ottenuti precedentemente anche dal residuo RCM (2-4). I composti 2-4 e 10 appartengono
alla classe delle diidroisocumarine, il composto d è ancora in fase di caratterizzazione.
41
Determinazione strutturale dei composti
La determinazione strutturale di tutti i composti è stata effettuata mediante spettri NMR mono e bidimensionali (1H, 13C, 13
L'analisi NMR è stata eseguita con due tipi di strumenti che operano a campi diversi: 250 e 600 MHz; quest’ultimo è stato utilizzato soprattutto per analizzare piccole quantità di campione ottenendo comunque segnali ben risolti e separati. Gli spettri
C DEPT, HSQC, HMBC, DQF-COSY, 1D-TOCSY) ed è stata confermata tramite spettrometria di massa ESIMS.
1
H e 13
L'esperimento 1D-TOCSY (TOtal Correlation SpectroscopY) è stato utile nell'analisi spettroscopica degli oligosaccaridi ed in tutti i casi in cui il segnale di un singolo protone si rivelava molto complicato nel semplice spettro
C NMR hanno fornito informazioni sul numero di protoni presenti, il loro accoppiamento ed il valore delle costanti nonché sul numero di atomi di carbonio. Mediante l'ausilio della tecnica multiimpulso DEPT (Distortionless Enhancement by Polarization Transfer) è stato determinato anche il numero di protoni legati a ciascun atomo di carbonio.
1
Di principale importanza si sono rivelati gli esperimenti di spettroscopia bidimensionale. Questi hanno permesso di ottenere un notevole incremento della risoluzione spettrale poiché i segnali sono dispersi in due dimensioni, fornendo ulteriori informazioni sulla correlazione degli stessi.
H-NMR: quest’esperimento permette di costruire un sistema di spin eccitando selettivamente un protone che, grazie al trasferimento di magnetizzazione, consente di evidenziare tutti gli altri protoni appartenenti allo stesso sistema.
Tutti gli spettri NMR bidimensionali sono stati acquisiti in CD3OD in fase
positiva con il trasmettitore regolato sulla risonanza del solvente e sul TPPI (Incremento di
42
Fase Proporzionale al Tempo) usati per raggiungere una distinzione delle frequenze nella dimensione ω1.
Per la corretta caratterizzazione di alcuni dei composti isolati sono stati effettuati i seguenti esperimenti:
DQF-COSY (Double Quantum Filtered-COrrelated SpectroscopY), che dà informazioni sui protoni accoppiati attraverso due o tre legami e permette di correlare i chemical shifts attraverso gli accoppiamenti scalari omonucleari. Vengono inoltre assegnati i vari sistemi di spin presenti nella molecola anche laddove si hanno costanti di accoppiamento molto piccole e quindi segnali non ben risolti. L'esperimento filtrato DQF invece permette di distinguere quei segnali, altrimenti coperti, in prossimità del solvente.
HSQC (Heteronuclear Single Quantum Coherence), l'analogo eteronucleare del COSY che, creando una coerenza eteronucleare ed impiegando il protone per la rivelazione del segnale, permette di ottenere l'assegnazione di uno spettro 13
HMBC (Heteronuclear Multiple Bond Coherence), esperimento di correlazione eteronucleare long range che permette di rivelare le correlazioni a più di un legame (
C dal corrispondente spettro protonico e viceversa, attraverso la correlazione diretta protone-carbonio.
2
J e 3
Altre metodiche impiegate sono state l'esperimento 2D-NOESY (Nuclear Overhauser Effect SpectroscopY), che consente di evidenziare le vicinanze spaziali fra i protoni sfruttando l'effetto Overhauser, ed una sua variante monodimensionale, l’1D-ROESY (Rotating frame nOESY), che utilizza un
J) fra un protone ed il carbonio non adiacente, con il vantaggio di
43
sistema di riferimento rotante per cui i fattori Overhauser risultano sempre positivi.
Ulteriori informazioni sui composti isolati sono state ottenute mediante analisi spettrometriche come ESI-MS che hanno confermato la struttura dei vari composti attraverso il loro peso molecolare e le frammentazioni, espresse come rapporto massa/carica elettrica (m/z).
44
DIIDROISOCUMARINE
L’estratto cloroformio-metanolo 9:1 (10.54 g di 14.42 g) è stato cromatografato su colonna Sephadex LH-20. In seguito a cromatografia su colonna HPLC eluendo con una miscela metanolo-acqua (4:6), è stato isolato dalla frazione R
Composto 2
CM 13+14 il composto 2, ottenuto anche dalla frazione RBuOH
Il composto 2 (Fig. 2.4), già precedentemente isolato dalla specie Hydrangea
macrophylla (Thunb.) Ser. subsp. serrata (Hashimoto et al., 1987), si presenta
come solido amorfo bruno, di formula molecolare C
11.
21H22O9
I dati NMR, confermati da quelli presenti in letteratura, sono riportati in Tab. 2.1.
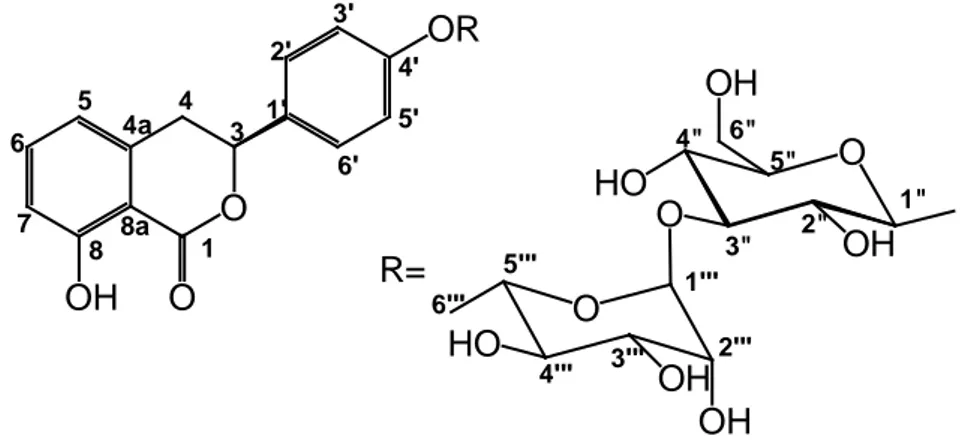
determinata attraverso spettrometria ESI-MS e confermata anche attraverso l’ausilio di esperimenti spettroscopici ¹H-NMR e HMQC, i cui spettri mostrano la presenza di segnali attribuibili all’unità dell’idrangenolo, tra cui il caratteristico segnale (doppio doppietto) a δ 5.42 (J = 12.0, 3.0 Hz) riconducibile al protone metinico in posizione C-3 del nucleo diidroisocumarinico, e quelli dei protoni della porzione glucosidica (tra cui il protone anomerico a δ 4.96, d, J = 8.0 Hz), rappresentata dal β-D-glucopiranosio, che risulta legato all’aglicone in
posizione 8. O O OH O HO HO OH O OH 1 3 4 5 6 4a 8a 7 8 1' 2' 3' 4' 5' 6' 1" 2" 3" 4" 5" 6"
45
Tab 2.1 Dati NMR (250 MHz in CD3OD) del composto 2a
a
I chemical shifts sono riportati in ppm; i valori delle J sono in parentesi e riportati in Hz; le assegnazioni sono state confermate da esperimenti HSQC e HMBC.
Durante la fase di isolamento attraverso cromatografia su colonna HPLC, il cromatogramma ha mostrato per il composto 2 la comparsa di due picchi vicini ma piuttosto distinti a tR simili, e su TLC una macchia non ben definita che
dimostrava una separazione del composto poco soddisfacente. Come confermato idrangenolo 8-O-β-D-glucopiranoside
posizione δH δC 1 172.1 3 5.42 dd (12.0, 3.0) 81.3 4 3.12 dd (16.0, 3.0); 3.39 dd (16.0, 12.0) 36.5 4a 141.6 5 7.41 d (7.5) 118.0 6 7.57 dd (7.0, 7.0) 136.3 7 7.11 d (7.5) 123.0 8 163.7 8a 109.6 1’ 128.7 2’/6’ 7.33 d (8.0) 128.8 3’/5’ 6.83 d (8.0) 116.2 4’ 159.3 Glc 1” 4.96 d (8.0) 102.7 2” 3.57 dd (9.0, 8.0) 74.6 3” 3.51 t (9.0) 78.4 4” 3.45 t (9.0) 70.9 5” 3.52 m 77.0 6” 3.74 dd (12.0, 4.5); 3.94 dd (12.0, 3.0) 62.3
46
dai dati presenti in letteratura (Yoshikawa et al., 1999), questo comportamento è attribuibile al fenomeno di tautomeria sul C-3 che caratterizza le diidroisocumarine glicosilate con un gruppo idrossilico in posizione 4’; in questo caso il composto 2 è quindi stato isolato sotto forma di racemo.
L’estratto cloroformio-metanolo 9:1 (10.54 g di 14.42 g) è stato cromatografato su colonna Sephadex LH-20. In seguito a cromatografia su colonna HPLC eluendo con una miscela metanolo-acqua (4:6), è stato isolato il composto 3 dalla frazione R
Composto 3
CM 13+14 e dalle frazioni RBuOH 10 e RBuOH
Il composto 3 (Fig. 2.5), già isolato dalla specie Hydrangea macrophylla (Thunb.) Ser. var. thunbergii (Yoshikawa et al., 1999), si presenta come solido amorfo bruno, di formula molecolare C
11.
26H30O13 determinata attraverso
spettrometria ESI-MS, la quale ha evidenziato i picchi a m/z 555 [M+Na−18]+, 423 [M+Na−18−132]+ e 261 [M+Na−18−132−162]+, che suggeriscono rispettivamente la perdita di una molecola di acqua, di una di un pentoso e successivamente di una di un esoso. Gli spettri ¹H -NMR e HMQC condotti ai fini della caratterizzazione, hanno nuovamente mostrato la presenza di segnali dei protoni e dei carboni dell’unità dell’idrangenolo,insieme ad altri segnali (tra cui due segnali ai tipici chemical shift dei protoni anomerici) che confermano la presenza di una porzione glicosidica, costituita da β-D-apiofuranosio e β-D
-glucopiranosio, legati in posizione 4’ all’aglicone e fra loro in posizione (1→6). I dati NMR, confermati da quelli presenti in letteratura, sono riportati in Tab. 2.2.
47 O O OR 1 3 4 5 6 4a 8a 7 8 OH R= O OH OH O O OH OH OH HO R 1'' 2'' 3'' 4'' 5'' 6'' 5''' 4''' 3''' 2''' 1''' 1' 2' 3' 4' 5' 6'
Fig. 2.5 Struttura del composto 3, idrangenolo 4’-O-β-D-apiofuranosil-(1→6)-β-D
-glucopiranoside
Tab 2.2 Dati NMR (250 MHz in CD3OD) del composto 3a
idrangenolo 4’-O-β-D-apiofuranosil-(1→6)-β-D-glucopiranoside
posizione δH δC 1 170.1 3 5.64 dd (12.1, 3.1) 81.9 4 3.16 dd (16.0, 3.0), 3.32 (16.0, 12.0) dd 35.3 4a 142.3 5 6.84 d (6.9) 119.2 6 7.47 dd (8.1, 6.9) 137.4 7 6.88 d (8.1) 116.7 8 163.8 8a 110.1 1’ 128.3 2’/6’ 7.46 d (8.6) 128.7 3’/5’ 7.16 d (8.6) 117.7 Glc 1” 4.84 d (7.5) 104.0 2” 3.45 dd (9.0, 7.5) 74.8 3” 3.45 t (9.0) 77.8 4” 3.41 t (9.0) 71.1 5” 3.61 m 76.7 6” 3.60 dd (12.0, 3.0), 4.03 dd (12.0, 4.5) 68.4 Api 1’’’ 4.98 d (3.0) 110.9 2’’’ 3.92 d (3.0) 77.8 3’’’ 80.5 4’’’ 3.75 d (10.0), 3.98 d (10.0) 74.9 5’’ 3.56 s 65.4 a
I chemical shifts sono riportati in ppm; i valori delle J sono in parentesi e riportati in Hz; le assegnazioni sono state confermate da esperimenti HSQC e HMBC.
48
L’estratto cloroformio-metanolo 9:1 (10.54 g di 14.42 g) è stato cromatografato su colonna Sephadex LH-20. In seguito a cromatografia su colonna HPLC eluendo con una miscela metanolo-acqua (4:6), è stato isolato il composto 4 dalla frazione R
Composto 4
CM 13+14, ottenuto anche dalla frazione RBuOH
Il composto 4 (Fig. 2.6), mai precedentemente isolato in natura, si presenta come solido incolore, otticamente attivo con [α]
10.
d = −46° ( c = 0.1, MeOH). Nello
spettro ESIMS è stato osservato il picco [M+Na]+ a m/z 587, in accordo con la formula molecolare C27H32O13. Altri picchi sono stati osservati a m/z 569
[M+Na−18]+ e 441 [M+Na−146]+, dovuti alla perdita rispettivamente di una molecola di acqua e di una di un deossiesoso. Gli spettri 1H e 13C-NMR del composto 4 (Tab. 2.3) hanno mostrato il caratteristico pattern di segnali di una diidroisocumarina costituita da idrangenolo come aglicone e quelli ascrivibili ad unità zuccherine. In particolare lo spettro 1H-NMR del composto 4 ha evidenziato i segnali attribuibili ad un anello benzenico 1,4-disostituito [δ 7.19 (2H, d, J = 8.5 Hz) e 7.48 (2H, d, J = 8.5 Hz)], ad un anello benzenico trisostituito [δ 6.87 (1H, d, J = 8.0 Hz), 6.92 (1H, d, J = 8.0 Hz) e 7.53 (1H, t, J = 8.5 Hz)], ad un δ-lattone [δ 3.18 (1H, dd, J = 16.0, 3.0 Hz), 3.34 (1H, d, segnale sotto il solvente) e 5.67 (1H, dd, J = 12.0, 3.0 Hz)], e a due residui zuccherini con protoni anomerici a δ 4.99 (1H, d, J = 7.8 Hz) e 5.24 (1H, d, J = 1.8 Hz), i quali correlano rispettivamente con i segnali a 101.6 e 102.1 ppm nello spettro HSQC. Tutti i valori dei chemical shifts assegnati ai protoni e ai carboni dell’aglicone e della porzione zuccherina sono stati comprovati da esperimenti combinati di 1D-TOCSY, DFQ-COSY, e HSQC, che hanno confermato la presenza dell’idrangenolo come aglicone, di un’unità di glucosio e di un’unità di ramnosio. Lo shift a campi più bassi del segnale del C-3
49
dell’unità glucosidica (83.0 ppm), suggerisce lo schema di sostituzione delle unità saccaridiche. La posizione del legame glicosidico è stata inequivocabilmente assegnata attraverso l’esperimento HMBC, che ha mostrato le correlazioni tra i picchi a δ 4.99 (H-1glc) e 159.1 (C-4’) e tra δ 5.24 (H-1rha) e
83.0 (C-3glc
Dai risultati ottenuti, il composto 4 è stato caratterizzato come idrangenolo 4’-O-α-L-ramnopiranosil-(1→3)-β-D-glucopiranoside. La configurazione assoluta
della posizione C-3 per il composto 4, assegnata attraverso lo spettro di dicroismo circolare (Yoshikawa et al., 1999), è 3S.
). 1 8a 4 3 5 6 6' 7 8 4a 2' 1' 3' 4' 5' O O OR OH O HO O OH OH R= O OH OH HO 1" 2" 3" 4" 5" 6" 1''' 2''' 3''' 4''' 5''' 6'''
Fig. 2.6 Struttura del composto 4, idrangenolo 4’-O-α-L-ramnopiranosil-(1→3)-β-D
-glucopiranoside O O OR OH O HO O OH OH R= O OH OH HO
50
Tab 2.3 Dati NMR (600 MHz in CD3OD) del composto 4a
idrangenolo 4’-O-α-L-ramnopiranosil-(1→3)-β-D-glucopiranoside
posizione δH δC 1 169.5 3 5.67 dd (12.0, 3.0) 81.6 4 3.18 dd (16.0, 3.0), 3.34b 35.4 4a 141.7 5 6.87 d (8.0) 118.3 6 7.53 t (8.5) 136.5 7 6.92 d (8.0) 116.9 8 163.5 8a 109.7 1’ 128.5 2’/6’ 7.48 d (8.5) 129.0 3’/5’ 7.19 d (8.5) 117.5 4’ 159.1 Glc 1” 4.99 d (7.8) 101.6 2” 3.60 dd (9.0, 7.8) 75.0 3” 3.64 t (9.0) 83.0 4” 3.50 t (9.0) 70.0 5” 3.50 m 77.0 6” 3.74 dd (12.0, 5.0), 3.93 dd (12.0, 3.0) 62.0 Rha 1’’’ 5.24 d (1.8) 102.1 2’’’ 4.01 dd (3.0, 1.8) 71.8 3’’’ 3.76 dd (9.5, 3.0) 71.7 4’’’ 3.43 t (9.5) 73.8 5’’’ 4.05 m 70.0 6’’’ 1.30 d (6.0) 17.4 a
I chemical shifts sono riportati in ppm; i valori delle J sono in parentesi e riportati in Hz; le assegnazioni sono state confermate da esperimenti DQF-COSY, 1D-TOCSY, HSQC e HMBC.
b
segnale sotto il solvente
L’estratto cloroformio-metanolo 9:1 (10.54 g di 14.42 g) è stato cromatografato su colonna Sephadex LH-20. In seguito a cromatografia su colonna HPLC eluendo con una miscela metanolo-acqua (5:5), è stato isolato il composto 7 dalla frazione R
Composto 7
CM 18, ottenuto anche dall’estratto cloroformico (frazioni RC 21 e RC 24). La determinazione della struttura del composto 7 (Fig. 2.8) è stata effettuata mediante esperimenti 1H-NMR, 13C-NMR, HMQC, e ESIMS.
51
Il composto 7, già precedentemente isolato dalla specie Hydrangea macrophylla (Thunb.) Ser. subsp. serrata (Hashimoto et al., 1987) si presenta come solido amorfo bruno, di formula molecolare C15H12O4
Gli spettri 1H-NMR mostrano 5 segnali dei protoni aromatici presenti sulla struttura del composto in esame, caratterizzata da due anelli aromatici, il tipico doppio doppietto a δ 5.55 (J = 13.0, 3.0 Hz) attribuibile al protone metinico in posizione 3 e i segnali a frequenze basse dei nuclei schermati dei due protoni alchilici sul C-4. Dallo spettro 13C-NMR sono stati identificati il numero e i valori dei chemical shift dei carboni dello scheletro dell’idrangenolo e attraverso lo spettro HMQC sono state attribuite le correlazioni con i protoni corrispondenti.
, determinata attraverso spettrometria ESI-MS.
Dal confronto dei dati riportati in letteratura è stato possibile confermare la struttura dell’idrangenolo per il composto 7 (Hashimoto et al., 1987). I dati ¹H-NMR e ¹³C-¹H-NMR sono riportati in Tab.2.4.
O O OH OH 1 3 4 5 4a 6 7 8 8a 1' 2' 3' 4' 5' 6'
52
Tab 2.4 Dati NMR (250 MHz in CD3OD) del composto 7a
idrangenolo posizione δH δC 1 171.8 3 5.55 dd (13.0, 3.0) 82.5 4 3.10 dd (16.0, 3.3), 3.35 dd (16.6, 12.2) 35.2 4a 141.7 5 6.83 d (8.4) 119.1 6 7.48 t (7.5) 137.3 7 6.89 d (8.4) 116.8 8 163.2 8a 109.5 1’ 128.9 2’/6’ 7.33 d (8.4) 128.8 3’/5’ 6.83 d (8.4) 116.2 4’ 159.2 a
I chemical shifts sono riportati in ppm; i valori delle J sono in parentesi e riportati in Hz; le assegnazioni sono state confermate da esperimenti HSQC e HMBC.
L’estratto cloroformico (10.26 di 15.77 g) è stato cromatografato su colonna flash a gradiente; dalla frazione R
Composto 8
C 26, eluita con CHCl3
Il composto 8, già isolato all’interno del genere da Scorzonera tomentosa L. (Sari et al., 2007), si presenta come solido amorfo brunastro, di formula molecolare C
-MeOH 99:1, e sottoposta a cromatografia su colonna HPLC eluendo con una miscela metanolo-acqua (5.5:4.5), è stato isolato il composto 8.
16H14O4, determinata attraverso ESI-MS e confermata anche
attraverso l’ausilio di spettroscopia ¹H-NMR. Il suo spettro ¹H-NMR risulta del tutto sovrapponibile a quello del composto 7 ad eccezione della presenza di un
53
segnale aggiuntivo (singoletto) a δ 3.93 per il composto 8, attribuibile ad un gruppo metossilico.
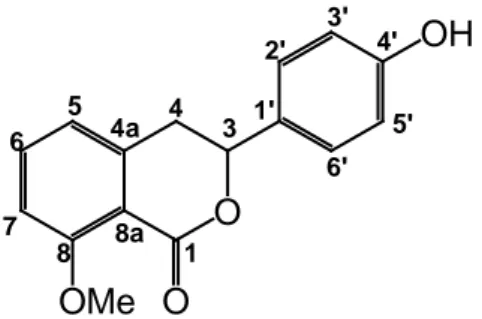
Dal confronto dei dati riportati in letteratura (Sari et al., 2007), è stata attribuita al composto 8 la struttura di 8-metossi-idrangenolo denominato anche scorzotomentosin (Fig. 2.9).
I dati ¹H-NMR sono riportati in Tab.2.5.
O O OH OMe 1 3 4 5 4a 6 7 8 8a 1' 2' 3' 4' 5' 6'
Fig. 2.9 Struttura del composto 8, scorzotomentosin
Tab 2.5 Dati NMR (250 MHz in CD3OD) del composto 8a
scorzotomentosin posizione δH 3 5.41 dd (12.0, 3.0) 4 3.05 dd (16.0, 3.0), 3.12 dd (16.0, 12.0) 5 6.95 d (8.0) 6 7.57 t (8.0) 7 7.09 d (8.0) OMe 3.93 s 2’ 7.32 d (8.5) 3’ 6.81 d (8.5) a
54
L’estratto butanolico (4.53 g) è stato cromatografato su colonna Sephadex LH-20. In seguito a cromatografia su colonna HPLC, eluendo con una miscela metanolo-acqua (4:6), è stato isolato il composto 10 dalla frazione R
Composto 10
BuOH
Il composto 10, già isolato dalla specie Hydrangea macrophyilla Seringe var.
thubergii MAKINO (Yoshikawa et al., 1992), si presenta come solido amorfo
bruno, di formula molecolare C
11. La determinazione della struttura dei composti è stata effettuata mediante spettroscopia 1H-NMR e HMQC e analisi spettrometrica ESI-MS.
21H22O9, determinata attraverso ESI-MS, i cui
spettri hanno suggerito per il composto 10 il medesimo peso molecolare del composto 2 ed evidenziato simili picchi corrispondenti alle frammentazioni delle molecole in esame, come ad esempio il picco quasi molecolare [M−H]− a
m/z 417 e il picco [M−H−162] − a m/z a 255 dovuto perdita dell’unità
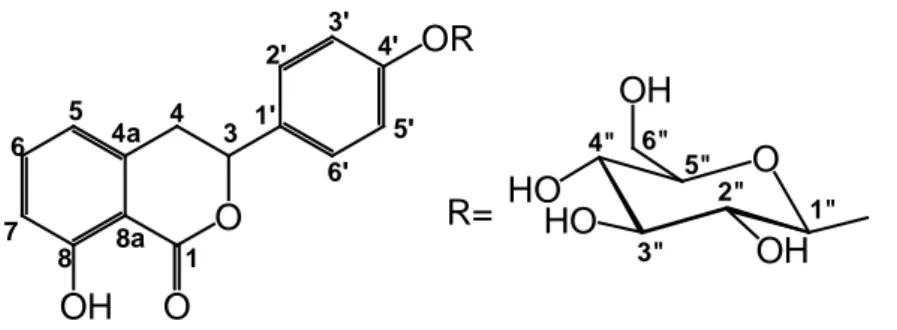
glucosidica. Anche i risultati ottenuti dalle analisi spettroscopiche 1H-NMR e HMQC (Tab.2.6) mostrano analogie con i segnali rilevati dagli esperimenti sul composto 2, e i dati riportati in letteratura (Yoshikawa et al., 1992) confermano per il composto 10 la struttura di idrangenolo 4’-O-β-D-glucopiranoside (Fig.
2.10). A differenza del composto 2, caratterizzato da un legame O-glucopiranosidico in posizione 8 dell’aglicone, il composto 10 presenta la porzione glucopiranosidica legata all’aglicone in posizione 4’, come confermano i valori di chemical shift del C-3’ e del protone con cui correla, i cui nuclei, che risultano maggiormente deschermati per la presenza del glucosio sul carbonio adiacente, risuonano a valori più alti, come accadeva per la posizione 7 del composto 2.
55 R= O O OR OH 1 3 4 5 4a 6 7 8 8a 1' 2' 3' 4' 5' 6' O HO HO OH OH 1" 2" 3" 4" 5" 6"
Fig. 2.10 Struttura del composto 10, idrangenolo 4’-O-β-D-glucopiranoside
Tab 2.6 Dati NMR (250 MHz in CD3OD) del composto 10a
idrangenolo 4’-O-β-D-glucopiranoside
Posizione δH δC 1 169.8 3 5.64 dd (12.0, 3.0) 82.0 4 3.18 dd (16.0, 3.0), 3.40 dd (16.0, 12.0) 35.5 4a 142.3 5 6.84 d (8.0) 119.2 6 7.47 dd (8.0, 8.0) 137.4 7 6.89 d (8.0) 116.7 8 163.8 8a 110.1 1’ 128.8 2’/6’ 7.45 d (8.5) 128.7 3’/5’ 7.15 d (8.5) 117.6 4’ 160.3 Glc 1” 4.97 d (8.0) 101.8 2” 3.49 dd (9.0, 8.0) 74.6 3” 3.52 t (9.0) 77.8 4” 3.45 t (9.0) 71.0 5” 3.46 m 77.8 6” 3.72 dd (12.0, 4.5), 3.91 dd (12.0, 3.0) 62.2 a
I chemical shifts sono riportati in ppm; i valori delle J sono in parentesi e riportati in Hz; le assegnazioni sono state confermate da esperimenti HSQC e HMQC.
56
COMPOSTI FENOLICI SEMPLICI
L’estratto cloroformio-metanolo 9:1 (10.54 g di 14.42 g) è stato cromatografato su colonna Sephadex LH-20. In seguito a cromatografia su colonna HPLC, eluendo con una miscela metanolo-acqua (4:6) sono stati isolati i composti 5 e 6 dalla frazione R
Composto 5 e 6
CM 17; il composto 6 è stato ottenuto anche dalla frazione RCM
Il composto 5 si presenta come solido amorfo bruno, di formula molecolare C
16.
7H6O4 . I dati 1
H-NMR ottenuti (Tab. 2.7), confermati da quelli riportati in letteratura (Xu et al., 1994), hanno permesso di identificare la struttura del composto 5 come l’acido 3,4 di-idrossibenzoico denominato acido protocatecuico (Fig. 2.11)
OH OH
COOH
Fig. 2.11 Struttura del composto 5,acido 3,4 di-idrossibenzoico oacido protocatecuico
Tab 2.7 Dati NMR (250 MHz in CD3OD) del composto 5a
acido protocatecuico Posizione δH 2 7.42 d (2.2) 5 6.79 d (8.4) 6 7.39 dd (8.4, 2.2) a
57
Il composto 6 (Fig. 2.12) si presenta come solido amorfo bruno, di formula molecolare C10H10O4
Secondo i dati ottenuti dall’analisi spettroscopica 1H-NMR (Tab 2.8), confermati da quelli riportati in letteratura (Pieters et al., 1999), il composto 6 è stato caratterizzato come acido caffeico metil estere, composto fenolico semplice derivato dell’acido caffeico, il più comune acido idrossicinnamico del regno vegetale e ubiquitario in tutte le piante superiori.
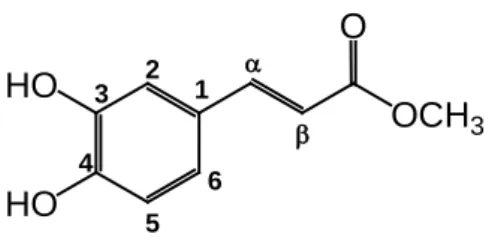
. HO HO OCH3 O 1 2 3 4 5 6 α β
Fig. 2.12 Struttura del composto 6, acido caffeico metil estere
Tab 2.8 Dati 1H-NMR (250 MHz in CD3OD) del composto 6a
acido caffeico metil estere
posizione δH 2 6.95 dd (8.0, 2.0) 3 6.75 d (8.0) 4 7.04 d (2.0) α 6.23 d (16.0) β 7.55 d (16.0) OMe 3.76 s a
58
LIGNANI
L’estratto cloroformio-metanolo 9:1 (10.54 g di 14.42 g) è stato cromatografato su colonna Sephadex LH-20. In seguito a cromatografia su colonna HPLC eluendo con una miscela metanolo-acqua (4:6), è stato isolato dalla frazione R
Composto 1
CM 11 il composto 1, ottenuto anche dalla frazione RCM
Il composto 1 (Fig. 2.13), mai precedendemente isolato in natura, si presenta come solido amorfo, otticamente attivo con [α]
13+14.
d = +26° (c = 0.1, MeOH). Lo
spettro ESIMS del composto mostra il picco [M+Na]+ a m/z 559, in accordo con la formula molecolare C26H32O12. Lo spettro 13C-NMR del composto 1 mostra
la presenza di due gruppi metossilici, di un residuo zuccherino, insieme ai segnali delle risonanze attribuibili ai 18 carboni che costituiscono lo scheletro principale della molecola (Tab. 2.9). Lo spettro ¹H-NMR (Tab. 2.9) rivela la presenza di due anelli aromatici trisostituiti [δ 6.76 (1H, d, J = 8.0 Hz), 6.78 (1H, d, J = 8.0 Hz), 6.85 (1H, dd, J = 8.0, 2.0 Hz), 6.86 (1H, dd, J = 8.0, 2.0 Hz), 6.96 (1H, d, J = 2.0 Hz), e 6.98 (1H, d, J = 2.0 Hz)] e di due gruppi metossilici a δ 3.85 (6H, s), suggerendo la presenza di una struttura del lignano tipo-pinoresinolo costituito da due unità benziliche con due gruppi metossilici. I risultati ottenuti dagli esperimenti 1D TOCSY, DQF-COSY e HSQC hanno permesso di assegnare le correlazioni tra i valori di risonanza dei carboni e dei protoni, confermando lo scheletro proposto per l’aglicone. La struttura dell’unità zuccherina è stata dedotta attraverso gli esperimenti 1D TOCSY e 2D NMR, che hanno indicato la presenza di un β-glucopiranosio. I segnali dello spettro 13
C-NMR sono stati assegnati sulla base dell’esperimento HSQC. La posizione del gruppo idrossilico e dell’unità glucosidica è stata confermata dallo spettro ottenuto dall’esperimento HMBC. Il segnale a δ 5.54 (H-6) correla con i valori di risonanza dei carboni a 59.4 (C-5), 71.1 (C-8), 106.1 (C-4), e 135.1 (C-1’)
59
ppm, permettendo di localizzare il gruppo idrossilico sul C-4, mentre il segnale a
δ 4.56 (H-1glc) correlando con la risonanza del carbonio a 106.1 (C-4) ppm, ha
suggerito la localizzazione dell’unità zuccherina sul C-4. La configurazione relativa di 1 è stata determinata in base all’esperimento 2D NOESY, che ha mostrato le correlazioni tra H-6−H-4 e H-2−H-8b, e sulla base del confronto dei valori dei chemical shifts, delle molteplicità dei segnali e dei valori assoluti delle costanti di accoppiamento con quelli presenti in letteratura (Li e Shi, 2006; Abe e Yamauchi, 1988; Khan e Shoeb, 1985; Pelter et al., 1976). Dai dati ottenuti, il composto è stato caratterizzato come 4β -[(β-D
-glucopiranosil)-idrossi]pinoresinolo. Uno stereoisomero del composto 1 era stato precedentemente isolato da Ligularia virgaurea Maxim. ssp. oligocephala, specie appartenente alla famiglia delle Asteraceae, sottofamiglia Senecioineae.
60 O O H H RO OCH3 OCH3 HO OH R= HO O HO OH OH 1 2 3 4 5 6 7 8 1' 2' 3' 4' 5' 6' 1'' 2'' 3'' 4'' 5'' 6''
Fig. 2.13 Struttura del composto 1, 4β-[β-D-glucopiranosil)idrossi]pinoresinolo
O O H H RO OCH3 OCH3 HO OH O HO HO OH OH 106.1
61
Tab. 2.9 Dati NMR (250 MHz in CD3OD) del composto 1a
4β-[β-D-glucopiranosil)idrossi]pinoresinolo posizione δH δC 1 3.11 m 55.2 2 4.99 d (7.5) 85.7 4 5.71 d (6.0) 106.1 5 3.45 m 59.4 6 5.54 d (3.0) 81.0 8 3.95 dd (9.0, 2.0), 4.08 dd (9.0, 5.5) 71.1 1’ 133.2 2’ 6.98 d (2.0) 111.0 3’ 148.0 4’ 146.4 5’ 6.78 d (8.0) 115.8 6’ 6.86 dd (8.0, 2.0) 120.5 1’’ 135.1 2’’ 6.96 d (2.0) 110.7 3’’ 148.0 4’’ 146.4 5’’ 6.76 d (8.0) 115.4 6’’ 6.85 dd (8.0, 2.0) 119.7 OMe 3.85 s 56.4 Glc 1’’’ 4.56 d (8.0) 104.2 2’’’ 3.38 dd (9.0, 8.0) 75.2 3’’’ 3.28 t (9.0) 78.2 4’’’ 3.36 t (9.0) 71.1 5’’’ 3.39 m 78.0 6’’’ 3.67 dd (12.0, 4.5), 3.83 dd (12.0, 2.5) 62.4 a
I chemical shifts sono riportati in ppm; i valori delle J sono in parentesi e riportati in Hz; le assegnazioni sono state confermate da esperimenti DQF-COSY, 1D-TOCSY, HSQC e HMBC.
62
L’estratto cloroformico (10.26 di 15.77 g) è stato cromatografato su colonna flash a gradiente; dalla frazione R
Composto 9
C 28, eluita con CHCl3-MeOH 97:3, e
sottoposta a cromatografia su colonna HPLC eluendo con una miscela metanolo-acqua (5:5), è stato isolato il composto 9, ottenuto anche dall’estratto cloroformio-metanolo (frazione RCM
Il composto 9 si presenta come solido amorfo brunastro, di formula molecolare C
16).
20H22O7 , determinata attraverso ESI-MS, i cui spettri registrati in modalità
negativa hanno evidenziato un picco quasimolecolare [M− H]− a 373 m/z. La struttura del composto 9 (Fig. 2.15) è stata caratterizzata anche attraverso l’ausilio di esperimenti spettroscopici ¹H-NMR e HMQC. Gli spettri ottenuti hanno mostrato la presenza dei segnali attribuibili ai due anelli benzilici e di quelli riconducibili a due gruppi metossilici (singoletto a δ 3.87 con cui correla il C a δ 56.2). Nell’identificazione della struttura del composto 9, è stato inoltre fondamentale il segnale dello spettro HMQC del protone acetalico a δ 5.48 e del C-4 ad esso correlato a δ 102.5, che suggerisce la presenza di un gruppo idrossilico in posizione C-4. E’ stato possibile inoltre stabilire l’orientamento di tale gruppo –OH come α, grazie ai valori della costante di accoppiamento del protone sul C-4 (J=1 Hz), per accoppiamento con il protone sul C-5. I dati NMR, confermati da quelli presenti in letteratura (Abe e Yamauchi, 1988; Khan e Shoeb, 1985), sono riportati in Tab.2.10.
63 O O H H HO OCH3 OCH3 HO OH
Fig. 2.15 Struttura del composto 9, 4α-idrossipinoresinolo o 9α idrossipinoresinolo Tab 2.10 Dati NMR (250 MHz in CD3OD) del composto 9a
4α idrossipinoresinolo posizione δH δC 1 3.12 m 54.8 2 4.75 d (5.0) 86.1 4 5.48 d (1.0) 102.5 5 2.89 m 63.1 6 4.77 d (5.0) 81.4 8 4.01 dd (9.0, 2.0); 4.21 dd (9.0, 6.0) 72.9 1’ 133.6 2’ 7.17 d (2.0) 111.0 3’ 147.8 4’ 145.2 5’ 6.80 d (8.0) 115.9 6’ 6.87 dd (8.0, 2.0) 120.1 1’’ 135.3 2’’ 6.95 d (2.0) 110.5 3’’ 147.8 4’’ 145.2 5’’ 6.75 d (8.0) 115.8 6’’ 6.80 dd (8.0, 2.0) 119.7 OMe 3.87 s 56.2 a
I chemical shifts sono riportati in ppm; i valori delle J sono in parentesi e riportati in Hz; le assegnazioni sono state confermate da esperimento HMBC.