DOTTORATO DI RICERCA
TECNOLOGIE BIOMEDICHE IN MEDICINA CLINICA
(XXXIII° CICLO)
IPOSSIA ED INFIAMMAZIONE NELLA PROGRESSIONE
DEL CARCINOMA VESCICALE
DOTTORANDA Dott.ssa MILENA POLESE
TUTOR Prof. ALESSANDRO SCIARRA
2
Ai miei Angeli custodi
3 Indice/Contenuto
1- Introduzione 6
1.1- Generalità epidemiologiche, patogenetiche e cliniche su carcinoma vescicale 6
1.2- Eziologia e Patogenesi del carcinoma vescicale 8
1.2.1- Fattori di rischio 8
1.2.2- Storia naturale del carcinoma vescicale: dalla trasformazione alle metastasi. 14
1.3- Ruolo dell’ipossia nella progressione maligna 15
1.4- Caratteristiche della malignità 19
1.4.1- Aumento del potere proliferativo 19
1.4.2 - Ampliamento del compartimento staminale 19
1.4.3 – Ulteriore impulso all’immortalità 20
1.4.4 – Formazione del tessuto tumorale 20
1.4.5 – Ulteriore aumento della sopravvivenza mediata dall’inibizione dell’apoptosi 20
1.4.6 – Alterazioni del metabolismo energetico 20
1.4.7 – Capacità di invasione 23
1.4.8 – Motilità e capacità di migrazione polarizzata 25
1.4.9 - Microambiente e controllo immunitario 30
1.4.10 – Progressione verso la malignità: Risposta biologica integrata 32
2-Scopi della tesi e protocolli sperimentali 33
2.1 – Obiettivi generali 33
2.2 – Protocolli di studio per i singoli obiettivi 33
3-Materiali e Metodi 34
3.1-Arruolamento e studio clinico dei pazienti 34
3.2-Campioni biologici prelevati, storage e analisi 34
3.3-Metodiche di laboratorio 36
4
3.3.2 – LCMD 36
3.3.3 – Analisi molecolari effettuate sulle frazioni tissutali ottenute con LCMD 37
3.3.4 - Estrazione nucleo/citoplasma 38
3.4- Metodiche di biologia molecolare 39
3.4.1- Elettroforesi e western blotting 40
3.4.2- Estrazione di RNA totale dal tessuto intero e PCR 41
3.4.3- Estrazione delle proteine e WB 42
3.4.5- PCR trascrittomica mediante arrays a bassa densità (cards microfluide) 44
3.4.6- Statistica 46
4-Risultati 47
4.1- Morfologia 47
4.2- Espressione di HIF1α e sua attivazione 47
4.3- Espressione di geni dipendenti da HIF1α 49
4.3.1 - Recettori per le allarmine e VEGFs 49
4.3.2 – Geni proinfiammatori 52
4.3.3 - Geni per l’invasione: Metalloproteasi MMP6, MMP9 – Inibitori metalloproteasi TIMP-2 53
4.3.4 - Recettori di sopravvivenza: ERα, EGFR 53
4.4- Espressione e attivazione di NFkB 53
4.5- Espressione di geni proinfiammatori dipendenti da NFkB 55
4.5.1- Enzimi inducibili: COX2, NOS2 55
4.5.2 - Proteine di fase acuta: PTX3, SAA 56
4.5.3 - Proteine antinfiammatorie: Metalloproteasi MMP9 e proteina antinfiammatoria SOCS-1 57
4.5.4 - Fattori di riparazione: EGFR, ERα 58
4.6- Valutazione globale dell’asse HIF/NFkB 59
4.7 - Arrays a bassa densità per 48 geni dipendenti da HIF e da NFkB su cellule staminali di carcinoma vescicale 60
5
5-Discussione 63
5.1- Formazione del microambiente ipossico 63
5.2- Ruolo dei geni HIF1α-dipendenti nella progressione 63
5.3- Attivazione di NFkB associata agli effetti dell’ipossia 64
5.4- Ruolo dei geni NFkB-dipendenti nella progressione 64
5.5- Le cellule staminali isolate da carcinoma vescicale rispondono all’ipossia attivando l’asse HIF/NFkB 65 5.6- Valutazione globale dell’asse HIF/NFkB nella progressione maligna: risposta integrata all’ipossia 66
5.7- Implicazioni diagnostiche e prognostiche 66
5.7.1- Biomarcatori diagnostici 67
5.7.2- Biomarcatori prognostici e predittivi di recidiva 68
5.7.3- Quadro immuno-infiammatorio associato alla formazione delle metastasi 68
5.8- Identificazione di possibili bersagli terapeutici 69
5.8.1- Inibitori e modulatori di HIF1α 70
5.8.2- Inibitori e modulatori di NFkB 71
5.8.3- Modulazione della risposta immune e controllo di altri fattori del microambiente 73
6- Conclusioni 74
6
1.-INTRODUZIONE
1.1- Generalità epidemiologiche, patogenetiche e cliniche del carcinoma vescicale
Il carcinoma della vescica occupa il nono posto per incidenza tra le neoplasie maligne dell’uomo ed il tredicesimo posto nella mortalità per tumore.
I maschi sono più colpiti delle donne nella proporzione di 3,2/0,9 e l’incidenza, come la maggior parte dei tumori, aumenta con l’età. (Figura 1) [4][28]
Figura 1– Differente incidenza dei tumori maligni nei maschi rispetto alle femmine [4]
Il sintomo più comune del carcinoma vescicale è l’ematuria macroscopica o microscopica; la prima è presente nel 78% dei pazienti, mentre la seconda si manifesta nel 13,7% dei pazienti. Nonostante questo, l’ematuria viene frequentemente sottovalutata dal medico che non dà seguito a un adeguato approfondimento diagnostico, anche perché per il carcinoma vescicale non vi sono screenings dedicati come esistono invece per altri tumori. Fino a pochi anni fa sono stati registrati scarsi progressi nella conoscenza e nella terapia del tumore vescicale come è dimostrato dal fatto che sostanzialmente in 30 anni la curva di sopravvivenza a 5 anni non si è modificata (Figura 2). Inoltre, è importante notare che, dopo l’asportazione del carcinoma uroteliale della vescica non muscolo invasivo, il tasso di recidiva si presentava molto alto (60-70%) [4] (Figura 2).
7 Figura 2 – Curve di sopravvivenza e recidiva nel carcinoma vescicale [4]
In questi ultimi anni, tuttavia, il panorama è cambiato e vi sono le premesse per importanti progressi sia nella conoscenza che nella terapia, per un aumento della sopravvivenza o per la guarigione. Per esempio, grazie all’introduzione di nuove strategie terapeutiche (es. farmaci inibitori del checkpoint e varie strategie di immunoterapia) e, soprattutto, grazie alla migliore conoscenza della patogenesi della trasformazione dell’epitelio vescicale (con l’identificazione di numerosi oncogeni e geni oncosoppressori come possibili bersagli terapeutici) e della progressione verso la malignità (ruolo dell’infiammazione cronica e delle alterazioni del microbioma, ruolo delle infezioni) si stanno delineando nuove strategie terapeutiche per un più efficace controllo non solo dell’incidenza ma anche della progressione, per un sostanziale aumento della sopravvivenza.
Attualmente l’uretrocistoscopia (una procedura invasiva per il paziente e costosa per le strutture sanitarie) in associazione all’oncocitologia urinaria su tre campioni, rappresenta il gold standard diagnostico; anche se, di recente, si stanno registrando dei progressi nella evidenziazione di marcatori molecolari urinari che potrebbero definire meglio il grado progressione verso la malignità, senza invasività per il paziente. Inoltre, come sarà dimostrato in questa tesi, i campioni biologici vescicali ottenuti mediante la procedura endoscopica sono una fonte preziosa di informazioni molecolari, non solo per la diagnosi ma anche per una stadiazione molecolare ed una prognosi più attendibile.
Gli scopi di questa tesi sono: a) evidenziare il ruolo del microambiente ipossico ed infiammatorio nella progressione verso la malignità del tumore della vescica come recentemente definito in molti tumori umani; b) riassumere gli ultimi progressi sulla conoscenza della neoplasia vescicale; c) presentare possibili marcatori diagnostici e prognostici, per facilitare la diagnosi precoce e per prevenire le recidive dopo TURB (Resezione Trans-Uretrale della Vescica); infine, d) suggerire nuove strategie terapeutiche per bloccare/rallentare la progressione del carcinoma vescicale mediante la modulazione negativa dell’adattamento all’ipossia e dell’attività infiammatoria cronica.
8
1.2-Eziologia e Patogenesi del carcinoma vescicale
1.2.1-Fattori di rischio
I fattori di rischio del carcinoma della vescica sono comuni ad altri tumori maligni solidi, come il tumore della prostata, del polmone, della mammella e dei tumori testa/collo. Solo alcuni fattori hanno un grado di specificità di tessuto.
Si distinguono fattori esogeni (fumo, stili di vita, vivere in aree urbane e/o inquinate, dieta povera di frutta, verdura e di cibi freschi, fattori occupazionali e ambienti di lavoro inquinati, infezioni e parassitosi, ecc.) [4] (Figura 3) e fattori endogeni (associazione con diverse condizioni patologiche, specialmente di carattere infiammatorio cronico oppure di natura endocrina ed un substrato genetico con mutazioni e polimorfismi che favoriscono la nascita del tumore).
Figura 3 – Principali agenti esogeni coinvolti nella patogenesi del carcinoma vescicale [4]
a) Il fumo di sigaretta è il fattore di rischio più comune e si ritiene responsabile di oltre la metà dei casi. Tuttavia, tra l’esposizione al fumo e la diagnosi clinica decorrono almeno 20 anni, rendendo più difficile per il paziente avvertire questa stretta associazione. Nel fumo del tabacco carbonizzato (sigaretta) sono contenuti anche precursori precancerogeni, come le amine aromatiche, che a livello vescicale vengono attivati in cancerogeni da una α-glucuronidasi vescicale. Pertanto, è necessario che i fumatori siano coscienti della necessità di un attento monitoraggio preventivo anche per il carcinoma vescicale, oltre che per quello polmonare. Al fumo si correla anche la maggiore incidenza che si osservava fino a qualche anno fa nei paesi più sviluppati, per esempio, dell’Europa occidentale, come Spagna e Italia. Parallelamente alle recenti politiche fortemente mirate a disincentivare il fumo, l’incidenza del carcinoma vescicale è diminuita, soprattutto nei maschi, mentre nelle donne tale dato è meno evidente per il progressivo aumento delle fumatrici. Purtroppo, nello stesso periodo l’aumento dei fumatori nei paesi meno sviluppati (Africa, Sud-Est asiatico, Cina e nazioni dell’Est europeo) ha fatto aumentare sostanzialmente l’incidenza di tale patologia.
b) Altri fattori esogeni comprendono lo stile di vita, come la dieta povera di frutta e vegetali, abitare in aree inquinate e urbane, il contatto e l’utilizzo di acque contaminate da arsenico, ambienti rurali
9 infestati da parassiti e, infine, alcune occupazioni lavorative. Tra queste ultime vanno ricordate le industrie dei coloranti che usano le aniline; queste sostanze sono precursori di cancerogeni che a livello vescicale, per la presenza di alcuni complessi enzimatici, vengono attivate in cancerogeni attivi capaci di indurre mutazioni nel DNA.
c) Il tumore della vescica si associa anche a fattori endogeni (fattori endocrini come gli androgeni) e ad altre patologie come infezioni, infiammazione cronica, obesità e malattia metabolica.
È nota e storicamente accertata (in papiri del 1500 a.C.) la schistosomiasi vescicale da Schistosoma haematobium (o bilharziosi) tipicamente prevalente in Egitto, dove il parassita vive nelle acque del fiume Nilo e contamina le acque urbane attraverso i prodotti dell’agricoltura ed i liquidi biologici provenienti da pazienti infetti. Il parassita si riproduce nella parete della vescica provocando una forte infiammazione cronica e danni alla mucosa con abbondante ematuria. Addirittura, nel 1800 un medico francese descrisse tale patologia, affermando che l’Egitto era il solo paese al mondo dove anche gli uomini avevano le perdite mestruali. Il dato fondamentale della schistosomiasi vescicale è la persistenza di una forte infiammazione cronica della mucosa vescicale che determina un potente stimolo cancerogeno, sia per la fase di trasformazione (liberazione di radicali liberi mutageni e un continuo stimolo proliferativo per la riparazione della parete), sia per la fase di progressione dei piccoli tumori iniziali con l’adattamento all’ipossia ed attivazione di NFkB. I dati storici riportano che in Egitto, nel 1920, il carcinoma vescicale era il primo dei tumori maligni per frequenza con il 70% degli Egiziani affetti da infezione da schistosoma. Forti azioni sanitarie di prevenzione e l’uso del farmaco Praziquantel (efficace contro lo schistosoma) hanno ridotto drasticamente l’infezione al 7% e, di conseguenza, anche l’incidenza del carcinoma vescicale uroteliale. Purtroppo, recentemente, il forte aumento dell’abitudine al tabagismo, insieme all’industrializzazione e all’inquinamento urbano, hanno dato un nuovo impulso alla crescita dell’incidenza del tumore, seppure di diverso istotipo (carcinoma vescicale squamoso. [46].
- HPV o Human Papilloma Virus. È stata evidenziata anche l’associazione della trasformazione tumorale dell’epitelio vescicale ad infezioni vescicali persistenti da HPV. È noto che questo virus è capace di inattivare mediante alcune sue proteine (E6/E7) la p53, il più frequente gene oncosoppressore, con perdita di funzione nei tumori umani. L’inattivazione della p53 da parte di E6/E7 avviene solo nel caso SNP (polimorfismo da singolo nucleotide) in cui la prolina in posizione 72 viene sostituita da arginina, acquistando la capacità di formare il legame inattivante con la proteina virale [3].
- La malattia metabolica e l’obesità costituiscono un rischio indipendente per il carcinoma vescicale squamoso anche se non se ne conoscono esattamente i meccanismi [9]. È probabile che
10 l’infiammazione cronica di basso grado, notoriamente presente in queste condizioni, costituisca il fattore di rischio aggiuntivo anche per il tumore della vescica.
- La netta differenza di incidenza tra maschi e femmine, pur depurata dagli altri fattori di rischio (fumo, stile di vita, ambiente, ecc.), ha suggerito che esiste un ruolo degli androgeni nella patogenesi della patologia vescicale. I recettori androgenici sono abbondanti in tutta l’area urogenitale con funzioni di mantenimento dei tessuti attraverso la proliferazione e la differenziazione distrettuale. Questo suggerisce il contributo alla genesi del tumore come promotori della crescita di cellule già trasformate ed eventuale blocco della differenziazione in caso di perdita di funzione [44] [25].
- Come per tutti i tumori, l’età avanzata costituisce un rischio aggiuntivo per tutti i tumori, incluso quello vescicale, per due motivi principali: a) la progressiva inefficienza dei meccanismi di riparazione del DNA e la cumulativa esposizione al rischio cancerogeno ambientale hanno favorito l’accumulo di mutazioni che portano alla trasformazione; b) caratteristica dell’età avanzata è la costante presenza di un’infiammazione di basso grado che, oltre all’azione mutagena dei radicali prodotti nella flogosi, insieme con l’ipossia rappresenta uno dei due fattori scatenanti la progressione verso la malignità.
- Negli ultimi anni è stato evidenziato il ruolo del microbioma vescicale nel trofismo dell’epitelio vescicale [2]. È stato anche dimostrato che l’alterazione del microbioma rappresenta un importante fattore di rischio per il carcinoma vescicale, attraverso processi infiammatori cronici di basso grado persistenti nel tempo. All’origine delle alterazioni del microbioma vescicale vi possono essere anche cause iatrogene, soprattutto l’uso improprio, prolungato e non specifico di antibiotici ed antisettici urinari [2].
d) Base genetica: i notevoli progressi dell’Oncologia molecolare e delle tecniche massive di sequenziamento del genoma (Next Generation Sequencing) hanno permesso di individuare la maggior parte delle migliaia di mutazioni dei numerosi geni coinvolti nella genesi del carcinoma vescicale. Una prima distinzione è tra le mutazioni acquisite nel corso della vita e quelle ereditate dai genitori attraverso le cellule germinali. Le prime sono causate dai fattori esogeni/endogeni di cui si è parlato sopra, le seconde sono quelle che si riscontrano nei clusters familiari di predisposizione ai tumori della vescica e/o di altri tumori (sindromi tumorali familiari e nella maggior parte dei tumori pediatrici e giovanili) e riguardano specifici geni ampiamente descritti in letteratura [12].
Una seconda distinzione si basa sull’effetto funzionale della mutazione. Quando la mutazione oncogena porta ad un guadagno di funzione della/e molecole codificate si parla di oncogeni [45] (TABELLA 1). Per gli oncogeni la mutazione è funzionalmente dominante. Se invece la mutazione oncogena provoca una perdita o assenza di funzione del prodotto codificato si parla di geni oncosoppressori [45] (TABELLA 2). In questi casi la mutazione si comporta da carattere recessivo e,
11 pertanto, il potenziale oncogeno si esplica in condizioni di omozigosi, quando anche la seconda copia del gene subisce una mutazione inattivante.
TABELLA 1 – Oncogeni identificati nel carcinoma vescicale, attivati da diverse mutazioni e la loro frequenza [45]
Infine, una terza distinzione può essere fatta su base del meccanismo a seconda della via metabolica/biologica colpita dalla mutazione. La maggior parte degli oncogeni e dei geni oncosoppressori mutati identificati sono responsabili della trasformazione, ossia della prima tappa della cancerogenesi e riguardano tre grandi classi di geni: a) Geni dei meccanismi di riparazione del DNA e dei cromosomi che portano all’instabilità genetica responsabile dell’accumulo delle mutazioni per la trasformazione. La maggior parte sono geni oncosoppressori; b) Geni per il controllo della proliferazione cellulare che comprendono numerosi oncogeni che stimolano la proliferazione
12 attraverso vari meccanismi (TABELLA 1) e numerosi geni oncosoppressori che inibiscono o bloccano la proliferazione a diversi livelli del ciclo cellulare, attraverso complesse vie metaboliche (TABELLA 2). Pertanto, l’attivazione di questi oncogeni e/o l’inattivazione di questi geni oncosoppressori porta a un aumento sostanziale della massa cellulare in un tessuto; c) Infine, geni coinvolti nel controllo dell’apoptosi. La morte cellulare programmata è il principale meccanismo, insieme con la regolazione del ciclo cellulare, per il mantenimento del numero delle cellule in un tessuto/organo. Vi sono geni che inibiscono l’apoptosi o geni antiapoptosici che con mutazioni attivanti si comportano da oncogeni e geni che favoriscono l’apoptosi o geni proapoptosici che in seguito a mutazioni inattivanti si comportano da geni oncosoppressori. Pertanto, l’inattivazione di questi ultimi e/o l’attivazione di quelli antiapoptosici contribuiscono in maniera sostanziale all’aumento della massa cellulare e alla crescita iniziale del tumore.
In conclusione, per la fase di trasformazione, così da ottenere il tumore iniziale (di piccole dimensioni, non superiore a 200-330 micron e non ancora con le tipiche proprietà della malignità), è necessaria la mutazione di pochi (a volte solo due) geni appartenenti alle classi funzionali sopra elencate.
13 TABELLA 2 – Geni oncosoppressori mutati con perdita di funzione nel carcinoma vescicale [45]
14 1.2.2-Storia naturale del carcinoma vescicale: dalla trasformazione alle metastasi (Figura 4).
Il carcinoma vescicale origina dall’epitelio stratificato che ricopre la superficie interna della vescica (o urotelio). Ma quali siano le cellule coinvolte di questo tessuto complesso a diversa differenziazione è ancora incerto. Oggi si pensa che la primitiva trasformazione neoplastica si verifichi nel compartimento delle cellule staminali, che risiedono principalmente nello strato basale e meno ossigenato dell’epitelio. La cellula staminale va incontro a trasformazione tumorale avendo accumulato mutazioni di geni coinvolti nel controllo della proliferazione e dell’apoptosi. In questo modo la cellula mutata dà luogo al tumore iniziale, in assenza di angiogenesi. Questo suggerisce l’origine monoclonale del singolo tumore primitivo. Ciò non toglie che nello stesso tempo altre cellule staminali possano andare incontro a trasformazione in altre regioni dell’epitelio, dando luogo a tumori multipli nello stesso tessuto (origine policlonale), i quali non necessariamente presentano le stesse mutazioni, pur con risultati simili sul controllo della crescita e dell’apoptosi. Tipicamente questi piccoli tumori iniziali risultano “relativamente benigni”, non avendo ancora acquisito nessuna delle tipiche caratteristiche della malignità; crescono nell’ambito del tessuto (epitelio) senza oltrepassare i confini biologici dello stesso (ossia la membrana basale) e per questo vengono definiti tumori non muscolo invasivi. Rientrano in questa categoria i carcinomi vescicali in situ (Tis); i tumori papillari non invasivi (Ta) la cui crescita avviene all’interno del lume vescicale senza invadere i componenti sottostanti la membrana basale ed il grado T1 che invade la lamina propria (Figura 4). La successiva crescita, associata a progressione maligna, dà luogo a tumori invasivi che potenzialmente possono dare metastasi di vario grado a seconda delle strutture invase: il grado T2 indica l’invasione della parete muscolare (T2a a livello superficiale e T2b a livello profondo); il grado T3 infiltra il tessuto perivescicale (T3a microscopicamente e T3b macroscopicamente); il grado T4a coinvolge la prostata, le vescicole seminali, l’utero o la vagina mentre il grado T4b invade la parete pelvica o la parete addominale. I tumori dal T2 al T4 vengono classificati come muscolo-invasivi [45] (Figura 4) (TABELLA 8)
15
1.3-Ruolo dell’ipossia nella progressione maligna
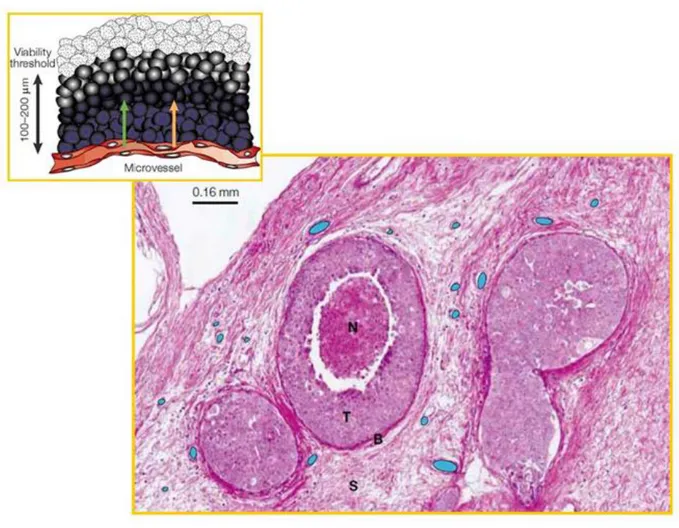
La crescita del tumore iniziale oltre le capacità di diffusione dell’ossigeno dai vasi (200-250 µm) produce un microambiente ipossico (Figura 5) e, successivamente, innesca un processo infiammatorio riparativo; queste due condizioni permettono alle cellule trasformate di acquisire tutte le proprietà della malignità e, in particolare, la capacità invasiva e di migrazione. Il tumore invade progressivamente i tessuti sottostanti, superando la membrana basale, la lamina propria dello strato muscolare, il grasso perivescicale e, infine il peritoneo (Figura 4). Questi sono i tumori di basso e alto grado che culminano nell’acquisizione della capacità di dare metastasi.
Figura 5 – Crescita del tumore iniziale in assenza di neoangiogenesi e formazione del microambiente ipossico, ingravescente in ragione della distanza dai vasi. N=necrosi. In azzurro i vasi sanguigni.
Questo avviene per adattamento all’ipossia. Le cellule trasformate crescono inizialmente per formare piccoli tumori in assenza di neoangiogenesi (Figura 5). Quando il diametro del tumore iniziale raggiunge il diametro di 300-400 µm, al suo centro, lontano dai vasi del tessuto ospite, si stabilisce un microambiente ipossico con
16 l’attivazione di un importante fattore di trascrizione, l’HIF o Fattore Inducibile dall’Ipossia, dal quale dipende l’espressione di centinaia di geni finalizzati all'adattamento all'ipossia, alla sopravvivenza delle cellule interessate ed alla riparazione di eventuali danni (Figure 6 e 7). Questa fase di adattamento, ampiamente studiata per le profonde modificazioni che avvengono nella cellula trasformata, è anche conosciuta come “transizione epitelio-mesenchimale” in cui è evidenziabile l’acquisizione delle diverse proprietà tipiche dalla malignità.
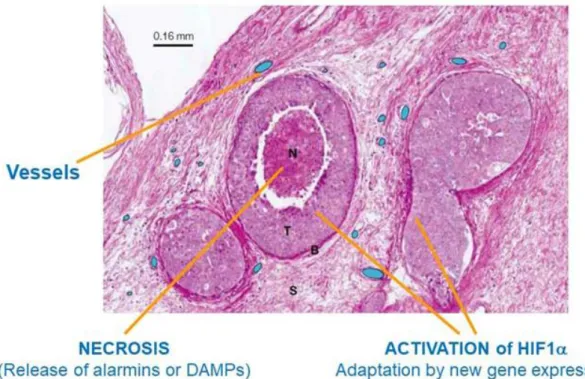
L’ipossia ha importanti conseguenze nelle cellule che resistono alla diminuzione dell’ossigeno; infatti, con l’attivazione di HIF1α, si ha l'espressione di tutti quei geni che con varie funzioni contribuiscono alla progressione maligna (Figura 7). Tra quelli più importanti, vi sono i fattori per la neoangiogenesi (VEGFs ed i loro recettori) che permettono al piccolo tumore iniziale di crescere oltre i 400 µm ed i recettori per le allarmine (come RAGE, P2X7, vari TLRs, ecc.) che stimolati dalle allarmine stesse permettono la piena attivazione dell’asse HIF/NFkB e la completa progressione verso la malignità. Le allarmine sono riconosciute come segnali di danno (o DAMPs [Damage Associated Molecular Patterns], come HMGB1, ATP/ADP, ac. nucleici, frammenti di membrana con fosfatidil-serina, ecc.) che vengono rilasciati dalle cellule danneggiate più distanti dai vasi, che non hanno resistito all’ipossia e sono andate incontro a morte (necrosi o apoptosi). Le allarmine stimolano i recettori indotti da HIF1α, attivando un forte pathway infiammatorio-riparativo controllato da NFkB. I geni trascritti sotto il controllo di NFkB forniscono un ulteriore contributo alla transizione epitelio-mesenchimale e quindi alla progressione maligna.
17 Figura 6 – Principali conseguenze dell’ipossia: necrosi lontano dai vasi e adattamento da attivazione di
HIF1αdelle cellule più distanti dai vasi.
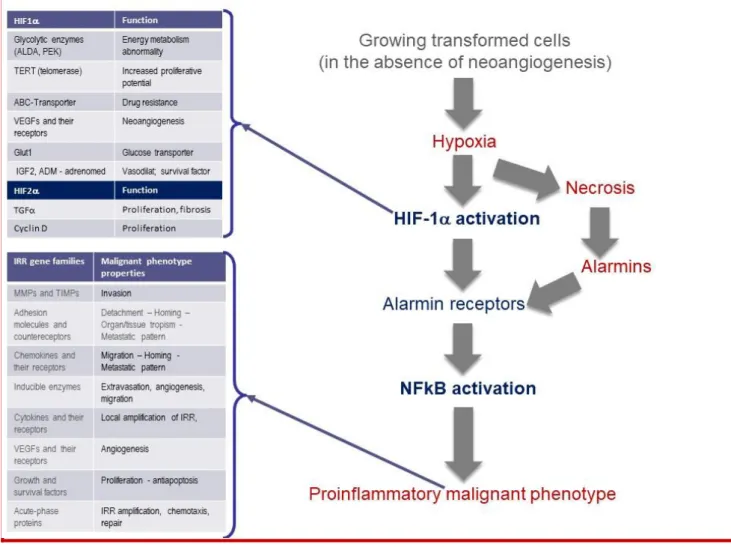
18 Esaminando le diverse famiglie dei geni dipendenti dall’asse HIF/NFkB (Figura 8) e la loro funzione biologica, si evidenzia che con l’attivazione di questo asse metabolico si ha una risposta integrata della cellula trasformata e del microambiente tumorale che spiega la nascita del fenotipo maligno con tutte le proprietà di capacità invasiva, migratoria, di homing, di metastasi a distanza ed indipendenza della crescita (Figura 8).
Figura 8 – Trascrittoma parziale dell’asse HIF/NFkB i cui geni spiegano le diverse proprietà del fenotipo maligno acquisito nel corso della progressione innescata dall’ipossia.
19
1.4-Caratteristiche della malignità e geni dipendenti dall’asse HIF/NFkB
L’esame accurato del trascrittoma (pattern dei geni trascritti) grazie all’attivazione dell’asse HIF/NFkB (Figura 8) mostra il coinvolgimento di centinaia di geni alla cui funzione in varia maniera possono essere specificamente correlate le Hallmarks descritte da Hannhan e Weinberg [20] (Figura 9).
Figura 9 – Caratteristiche del fenotipo maligno secondo Hannhan e Weinberg [21]
1.4.1-Aumento del potere proliferativo
L’attivazione di HIF1α produce una sovraespressione sostanziale di c-MYC e ciclina-D1 due oncogeni spesso attivati nelle cellule trasformate con la perdita del controllo della proliferazione. Perciò l’aumentata sintesi di queste due proteine nella fase di progressione dà un ulteriore vantaggio proliferativo al tumore iniziale [53]. 1.4.2-Ampliamento del compartimento staminale.
È interessante notare che HIF1α controlla l’espressione di cruciali geni della staminalità e della riprogrammazione, come SOX2, OCT4, FKL-4, NOTCH, TERT. Pertanto, il compartimento delle cellule staminali del tumore viene mantenuto e ampliato, grazie all’attivazione/sovraespressione, anzitutto, della telomerasi e, possibilmente, anche alla riprogrammazione di cellule tumorali già differenziate che possono
20 ritornare allo stato staminale, sotto l’azione di geni essenziali della staminalità (c-MYC, SOX-2, OCT-4, FLK-4) identificati da Yamanaka.
1.4.3- Ulteriore impulso all’immortalità.
HIF1α è responsabile di una sostanziale sovraespressione di TERT. Questo gene codifica la telomerasi per il mantenimento e l’allungamento dei telomeri e questo rappresenta un ulteriore contributo all’immortalità delle cellule trasformate [41].
1.4.4-Formazione del tessuto tumorale.
La crescita del tumore oltre i 400 µm di diametro porta alla formazione del tessuto tumorale. Nonostante l’attiva ed autonoma proliferazione, il tumore iniziale, in assenza di neoangiogenesi, non riesce a superare il diametro di 350-400 µm a causa della necrosi delle cellule distanti dal rifornimento di ossigeno e substrati forniti dai vasi sanguigni. Nelle cellule che sopravvivono, l’ipossia attiva i fattori di trascrizione HIF1α, HIF2α e HIF3α. In condizioni di ipossia si modifica lo stato redox del citosol per la formazione di grandi quantità di radicali e questo attiva sia HIF1α che NFkB [22][53]. HIF1α trascrive i geni per la neoangiogenesi e in particolare VEGFs ed i loro recettori che forniscono al tumore un sistema vascolare con una perfusione che supera i limiti imposti dalla diffusione per gradiente (200 µm) [41]. L’aumento della massa tumorale può essere causa di importanti segni clinici legati ai fenomeni compressivi generati su strutture adiacenti/vicine e, quindi, ai sintomi che così vengono diventano clinicamente rilevabili.
È interessante notare che parallelamente HIF1α attiva anche altri fattori di crescita, come TGF-β, FGFs e i loro recettori, oltre geni di varie proteine della matrice extracellulare, permettendo così la formazione dello scaffold stromale e, in definitiva, del tessuto tumorale capace di conservare in parte l’architettura e la differenziazione (grazie alle influenze del microambiente) del tessuto di origine [35].
1.4.5-Ulteriore aumento della sopravvivenza mediata dall’inibizione dell’apoptosi.
HIF1α attiva la trascrizione di numerosi fattori di sopravvivenza antiapoptotici, come le adrenomedulline e l’IGF1 (Insulin-like Growth Factor). Questo dà un ulteriore contributo all’aumento della massa tumorale, soprattutto attraverso l’inibizione dell’apoptosi, un meccanismo che può essere già presente nelle cellule trasformate, sostenuto da oncogeni antiapoptotici mutati [53][56].
1.4.6- Alterazioni del metabolismo energetico.
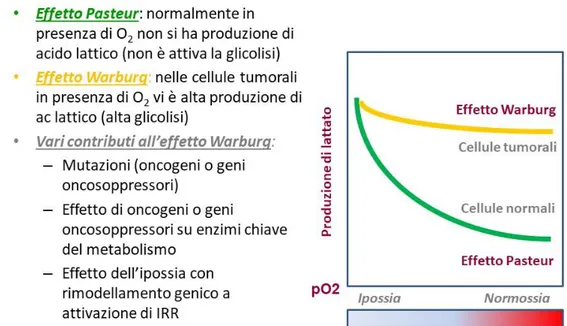
È noto che una caratteristica metabolica dei tumori maligni è l’alta glicolisi, nonostante la presenza ottimale di ossigeno (effetto Warburg). In genere, in presenza di normale pO2, la glicolisi è bassa e l’acido lattico viene trasformato rapidamente in acido piruvico e avviato al ciclo di Krebs. Solo in condizioni di ipossia si ha abbondante produzione di acido lattico con blocco/rallentamento della sua trasformazione in acido piruvico e, quindi, acidificazione del citoplasma; tale processo è detto “effetto Pasteur”. Questo effetto non è presente nei tumori progrediti, nei quali, pur in presenza di pO2 ottimale vi è sempre alta glicolisi con produzione di acido
21 lattico, costante acidificazione del citoplasma e secrezione di protoni con acidificazione del microambiente tumorale; questo è detto “effetto Warburg” (Figura 10). Da notare che le cellule del tessuto ospite possono andare incontro, come reazione alla necessità di smaltire i protoni in eccesso, a modificazioni del fenotipo, aumentando il contenuto di mitocondri (oncociti) e diventando simili alle cellule ossifile o oxintiche dei vari tessuti (tiroide, mucosa dello stomaco, epitelio del tubulo renale, ecc.).
Figura 10 – Effetto Pasteur ed Effetto Warburg.
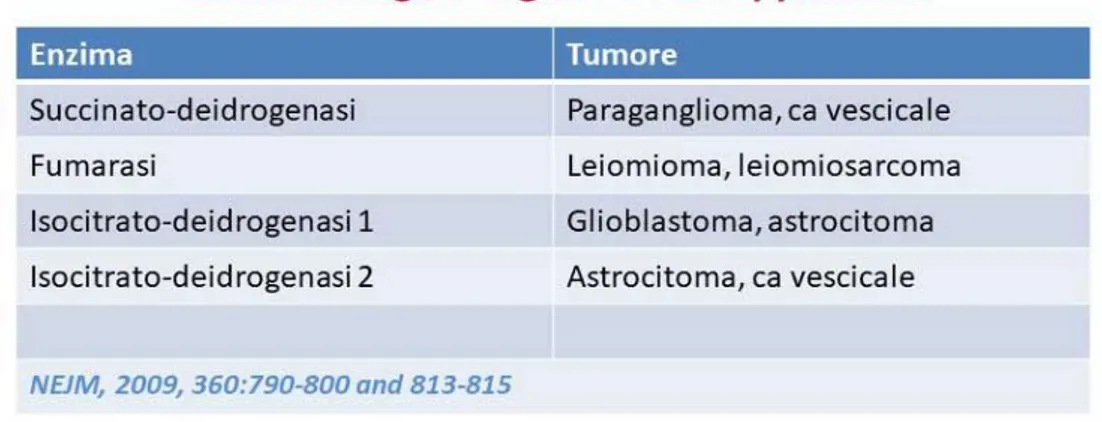
Queste modificazioni possono presentarsi in alcuni tumori già nella fase di trasformazione per due ragioni: a) alcuni enzimi del metabolismo energetico possono andare incontro a mutazioni (oncogeni o geni oncosoppressori), come dimostrato per la succinato-deidrogenasi, la fumarasi e le due isocitrato-deidrogenasi, anche nel carcinoma vescicale (TABELLA 3). b) alcuni enzimi-chiave del metabolismo energetico (es. lattato-deidrogenasi) possono essere impropriamente attivati da prodotti oncogenici dotati di attività tirosin-chinasica (come c-myc, src, e altri), mantenendo così alta la produzione di acido lattico (TABELLA 4).
22 TABELLA 3 – Enzimi del metabolismo energetico mutati nei tumori maligni.
TABELLA 4 – Enzimi come bersaglio di oncogeni o geni oncosoppressori.
Tuttavia, queste modificazioni metaboliche sono più evidenti nei tumori maligni progrediti, dopo attivazione dell’asse HIF/NFkB. Infatti, l’attivazione di HIF1α rimodella profondamente il metabolismo energetico con l’espressione di vari geni collegati (TABELLA 5), come trasportatori del glucosio che rendono ampiamente disponibile il glucosio per la glicolisi (GLUT1 e GLUT3), enzimi glicolitici (esochinasi, aldolasi, P-fruttochinasi, P-glicerochinasi e lattato-deidrogenasi), e proteine per il controllo del contenuto di protoni (MTC4 o trasportatore extracellulare di lattato, scambiatore Na+/H+ e anidrasi carbonica che catalizza CO2+H+→ HCO3-) [16].
23
Funzione Espressione di geni HIF1α-dipendenti
Aumentata disponibilità di glucosio Sovraespressione dei trasportatori del glucosio: Glut1 e Glut3
Alta glicolisi Sovraespressione di Esochinasi, Aldolasi, Fosfofruttochinasi, Fosfoglicerochinasi, Lattatodeidrogenasi
Controllo del contenuto di protoni Sovraespressione di:
- MTC4 (Canale trasportatore extracellulare di lattato - Scambiatore Na+/H+
- Anidrasi carbonica: CO2+H+→HCO3 -Attivazione della risposta
infiammatoria riparativa
Aumentata espressione di NFkB e sua attivazione Espressione di recettori per allarmine
Espressione dei geni per la staminalità
Espressione recettori per chemiochine e MMPs
TABELLA 5 – Metabolismo energetico dei tumori maligni: attivazione di HIF1α, trascrizione genica e funzioni coinvolte (proprietà della malignità).
1.4.7- Capacità invasiva (Figura 11)
È la capacità del tumore di crescere al di là dei confini naturali del tessuto da cui deriva. Nel caso specifico del carcinoma vescicale, si intende la membrana basale su cui poggia lo strato basale e gli altri strati dell’epitelio vescicale (urotelio). L’invasività è una proprietà importante dei tumori maligni che necessita dell’azione combinata e coordinata di numerosi geni dipendenti in varia maniera dall’asse HIF/NFkB. Alcuni si possono anche trovare mutati con guadagno (oncogeni) o perdita (geni oncosoppressori) di funzione, accelerando la progressione verso la malignità.
24 Figura 11 – Schema semplificato della cascata per la genesi dell’invasione e delle metastasi.
I geni coinvolti nell’acquisizione della capacità invasiva appartengono a diverse classi funzionali:
1) Rimodellamento dalla ECM (matrice extracellulare) con alterazioni della sua composizione (soprattutto delle isoforme del collagene, fibronectine, elastine, e altre);
2) Rimodellamento delle molecole di adesione sia tra le cellule che alla ECM;
3) Guadagno di funzione delle metalloproteasi (MMPs). La ECM e le membrane basali vanno incontro a un fisiologico ricambio delle loro molecole affidato soprattutto alle MMPs. Questi enzimi sono deputati alla demolizione di queste molecole e ai loro inibitori o TIMPs (tissue inhibitors of metalloproteases), per cui il guadagno della funzione proteasica può avvenire sia per mutazioni attivanti le MMPs (oncogeni), sia per sovraespressione delle stesse sotto il controllo dell’asse HIF/NFkB, sia, infine, per perdita di funzione dei TIMPs (geni oncosoppressori) in seguito a mutazioni inattivanti.
4) La direzione dell’invasione viene determinata dalle modificazioni del citoscheletro (microtubuli e microfilamenti), dagli pseudopodi o lamellopodi a un polo della cellula tumorale (verso il gradiente chemiotattico, come vedremo in seguito) e dal guadagno di motilità per l’interazione con la ECM modificata (Figura 12) [7][61]. La cellula trasformata che va incontro alla EMT (transizione epitelio-mesenchimale) perde la tipica architettura polarizzata (polo secretivo, polo basale, polo laterale) e si comporta come un fibroblasto e derivati (es. leucociti). Vi sono vari tipi di movimento come quello diretto da stimoli chemiotattici o come i
25 movimenti ameboidi che comunque necessitano di una riorganizzazione del citoscheletro molto diversa e più dinamica rispetto a quella posseduta dalle cellule epiteliali (Figura 12).
Figura 12 – Meccanismi dei movimenti cellulari. Modificazioni del citoscheletro e polarizzazione (direzione) del movimento.
1.4.8-Motilità e capacità di migrazione polarizzata.
La formazione delle metastasi è la caratteristica più saliente della malignità di un tumore. La formazione delle metastasi è stata paragonata ad una difficile corsa ad ostacoli: affinché un tumore possa dar luogo a metastasi si devono verificare numerose condizioni favorenti, alle quali partecipano in maniera coordinata un grande numero di geni (Figura 13). Tali geni sono direttamente o indirettamente trascritti e coordinati sotto il controllo dell’asse HIF/NFkB; più raramente alcuni di essi possono presentare mutazioni attivanti che comunque accelerano la formazione della metastasi. Qui di seguito verranno esaminate le condizioni necessarie all’evento metastatico e la descrizione dei principali geni coinvolti, sottolineando la loro attivazione da parte dell’asse HIF/NFkB.
26 La cellula tumorale progredita deve:
1-distaccarsi dal tessuto del tumore primitivo;
2-superare una barriera per raggiungere un vaso o un’altra via (grazie ai meccanismi invasivi descritti sopra); 3-entrare nel lume di un vaso (intravasazione), di un canalicolo o altra cavità, superando delle barriere stromali e la parete specifica di quella cavità (parete vasale, parete epiteliale, mesoteliale, ecc.), grazie a un movimento di migrazione orientato da un gradiente chemiotattico;
4-migrare, senza danni, nel nuovo ambiente, sia per le interazioni con le cellule presenti (piastrine, leucociti, ecc,), sia per attivazione impropria dei fattori dell’emostasi (trombosi da metastasi) e formazione di aggregati (emboli metastatici);
5-fermarsi (homing) in un sito distante dal tumore primitivo;
6-superare una nuova barriera (extravasazione) per lasciare il lume e trovare un microambiente favorevole alla proliferazione e formazione di un nuovo tumore.
Queste tappe richiedono il verificarsi di condizioni favorenti e l’azione coordinata di numerosi geni mutati, più spesso sovraespressi sotto il controllo dell’asse HIF/NFkB.
27 1.-Il Distacco dal tumore primitivo avviene grazie ad alterazioni delle giunzioni cellula-cellula e cellula-ECM. Le alterazioni conseguono anzitutto all’azione abnorme di alcuni oncogeni con azione tirosinchinasica (src, ecc.) su alcune molecole dei complessi giunzionali (giunzioni strette, desmosomi, giunzioni comunicanti o gap junctions) e della placca di adesione (o emidesmosoma).
Le connessine iperfosforilate portano alla disorganizzazione delle gap junctions e alla crescita in vitro non regolata per assenza dell’inibizione da contatto operata da queste giunzioni.
Ai fini del distacco vengono disorganizzate le giunzioni strette, i desmosomi e gli emidesmosomi o placche di adesione (cellula-ECM), che normalmente costituiscono, con il citoscheletro associato, i maggiori responsabili della stabilità del tessuto. L’iperfosforilazione o l’espressione impropria di vari componenti delle giunzioni strette (es. e-caderine) in un tumore implica il distacco facilitato delle cellule tumorali dal tumore primitivo. Anche l’attività dell’asse HIF/NFkB è responsabile della disorganizzazione dei complessi giunzionali (anche nel corso di risposte fisiologiche) con due meccanismi: a) rimodellamento delle molecole di adesione (es. e-caderine) e dei loro controrecettori sotto il controllo di NFkB, come avviene per la migrazione dei leucociti attivati e delle cellule staminali e b) disorganizzazione delle giunzioni strette delle cellule endoteliali per aumento di nucleotidi ciclici sotto l’azione di enzimi proinfiammatori (prostaglandine, COX-2, i-NOS, inducibili da NFkB) con aumento della permeabilità e rottura della barriera endoteliale.
Il distacco dalla matrice stromale (ECM) si verifica sia per alterazioni delle placche di adesione, soprattutto ad opera di alcune tirosinchinasi oncogeniche, sia per alterata espressione delle isoforme delle molecole della ECM [61]. La dinamica e gli equilibri della tirosin-fosforilazione sono regolati da vari enzimi sotto il controllo dell’asse HIF/NFkB [29][19].
2.-Il superamento delle barriere per raggiungere la via di migrazione (vasi, canalicoli, cavità). Le barriere sono costituite dalle membrane basali dei tessuti, dalla matrice stromale ECM, dalla parete di un vaso sanguigno, epiteliale o mesoteliale (Figura 14).
Figura 14 – Schema delle barriere che la cellula tumorale deve superare per dare metastasi a distanza dal tumore primario.
28
Invasività e motilità sono necessari per raggiungere e superare la parete di un vaso (parete vasale ematica o linfatica), di un canalicolo (epiteli delle vie respiratorie o digestive, canalicoli vari, canale ependimale, ecc.) o di un’altra cavità (pleura, peritoneo, altre barriere mesoteliali).
L’alterazione della composizione della ECM può favorire la migrazione grazie all’azione pathfinders (determinano la direzione della migrazione) di alcune proteine ECM e dei controrecettori espressi sotto il controllo di HIF/NFkB sulla cellula tumorale. Anche questo fenomeno è simile alla fisiologica migrazione polarizzata di leucociti e cellule staminali diretta dall’asse HIF/NFkB.
3.-Migrazione. Raggiunto il lume di un vaso, canalicolare o cavitario, la migrazione della cellula tumorale viene condizionata dal flusso locale dei liquidi eventualmente presenti e dall’anatomia delle vie stesse, oppure da un gradiente chemiotattico che guida attivamente la cellula tumorale verso l’origine del gradiente. L’attivazione dell’asse HIF/NFkB permette l’espressione, nelle cellule tumorali, dei geni necessari alla migrazione, come i recettori per chemochine e altri fattori chemiotattici e le opportune modificazioni del citoscheletro. Per esempio, l’espressione del CXCR4, il recettore per alcune chemochine, rappresenta un sicuro marcatore prognostico negativo per il verificarsi di metastasi in molti tumori epiteliali [7]. È stato identificato un gene oncosoppressore, nm23 (non-metastatic 23), la cui funzione è legata a una normale e ben regolata organizzazione del citoscheletro negli pseudopodi per la migrazione (lamellopodi). La perdita di funzione o la mancata espressione in omozigosi di nm-23 è altamente predittiva della formazione di metastasi. L’importanza del gene oncosoppressore nm-23 nella formazione delle metastasi è anche dimostrata dal diverso tasso di sopravvivenza che è stato osservato nel carcinoma mammario e in altri tumori. Infatti, la bassa o assente espressione di nm-23 riduce drasticamente la sopravvivenza, mentre questa è alta quando i livelli di nm-23 sono alti o normali. Nel tumore vescicale questo gene ancora non è stato dimostrato. (Figura 15).
29 Figura 15 – L’importanza del gene oncosoppressore nm-23 nella formazione delle metastasi
Nel corso della migrazione è fondamentale la sopravvivenza. Nel nuovo microambiente la cellula tumorale può interagire con le cellule ivi presenti, come piastrine, leucociti vari e macrofagi, ed ottenere diversi effetti opposti tra loro: protezione (emboli metastatici cellule tumorali /piastrine/granulociti) o inibizione/citolisi da immunità naturale o specifica (linfociti e macrofagi), come si vedrà più avanti.
4.-Homing. La migrazione di una cellula tumorale può essere fermata da una forte interazione delle sue molecole di adesione con i controrecettori presenti sulle cellule della parete della via di migrazione, come cellule endoteliali, epiteliali o mesoteliali. Questi controrecettori possono essere presenti costitutivamente oppure indotti da un’attivazione del sistema HIF/NFkB. Quest’ultimo evento si realizza in parallelo con la produzione del gradiente chemiotattico per una eventuale infiammazione distrettuale, lontana dal tumore primitivo e suggerisce che la sede di homing (e di metastasi) può essere condizionata da fattori contingenti (un processo infiammatorio distante dal tumore primitivo) o da fattori costitutivi come l’espressione fondamentale in un tessuto di controrecettori per le cellule che esprimono quella molecola di adesione/ligando (organotropismo). Non sono ancora ben noti i meccanismi e i tipi di infiammazione che regolano questi fenomeni.
5.-Superamento di barriere per raggiungere un altro tessuto ed attecchimento con formazione di un nuovo tumore (Figura 14 e Figura 16). Per questa tappa sono necessari gli stessi geni di cui sopra al punto 1 e 3. Il
30 processo infiammatorio distrettuale, attraverso gli stessi meccanismi della migrazione leucocitaria, disorganizza le giunzioni delle barriere (endoteliale, epiteliale, mesoteliale, ecc.) e permette alla cellula tumorale fermata dall’homing di extravasare ed interagire con il nuovo tessuto. Il microambiente favorevole (presenza di fattori di crescita e assenza di una risposta immune contro il tumore), permette una rapida crescita e organizzazione del nuovo tessuto tumorale a formare la metastasi. Inizialmente, questa risulta monoclonale, per almeno quattro aspetti: a) cariotipo omogeneo; b) popolazioni cellulari a scarsa/simile differenziazione; c) omogeneità metabolica; d) omogeneo grado di malignità. Tuttavia, con il tempo questa uniformità tende a scomparire sia per l’instabilità genetica che per le influenze del microambiente che possono far progredire ulteriormente la malignità nelle diverse regioni tumorali.
Figura 16 – Meccanismi di Homing, organotropismo e barriere.
1.4.9-Microambiente e controllo immunitario.
La progressione di un tumore verso la malignità è un fenomeno molto più complesso rispetto al rimodellamento dell’espressione genica da parte dell’asse HIF/NFkB fin qui prospettato.
Negli ultimi anni, infatti, hanno acquistato importanza anche alcuni aspetti del microambiente tumorale, in particolare, la composizione e le modificazioni del tessuto ospite e adiacente al tumore e le cellule che infiltrano il tumore o che formano il suo stroma. Tutte le cellule che qui risiedono o vengono richiamate dalla presenza del tumore vanno incontro a risposte di attivazione i cui componenti possono facilitare sia la crescita del tumore che l’acquisizione delle varie caratteristiche della malignità [35].
31 La Figura 17 schematizza i vari componenti cellulari che possono condizionare in questo senso il tumore. Da una parte le cellule residenti (cellule stromali, fibroblasti, cellule muscolari, cellule immunitarie, macrofagi e altri leucociti, cellule staminali varie, ecc.) e cellule richiamate dalla presenza del tumore che libera sostanze chemiotattiche o segnali di danno (allarmine) che le richiamano e/o le attivano.
Figura 17 – Microambiente tumorale [35]
La Figura 18 schematizza il ruolo che altre componenti ambientali, con cui interagisce una cellula tumorale migrante, possono avere nella progressione maligna. In particolare, da parte di cellule endoteliali, macrofagi residenti, leucociti circolanti e piastrine [35].
32 Infine, è noto che uno stato di immunosoppressione o comunque una deficienza della risposta immune favorisce sia la crescita che la progressione di un tumore. Oggi è chiaro che il sistema immunitario esercita un importante controllo sia sulla crescita che sulla progressione ed evidenziazione clinica di un tumore.
In particolare, i linfociti citotossici (CD8+) e i Natural Killer sono in grado di limitare la crescita del tumore mediante la loro specifica azione citotossica e l’infiltrazione di un tumore da parte di queste cellule rappresenta un fattore prognostico positivo.
Purtroppo, una delle caratteristiche della malignità è la capacità da parte del tumore di evadere il controllo normalmente esercitato dal sistema immunitario attraverso due meccanismi principali. Il controllo immune sul tumore si esercita attraverso una risposta cellulare di tipo T (rigetto) contro gruppi antigenici di proteine mutate e quindi riconosciute estranee nelle sottopopolazioni cellulari che le contengono. Col tempo avviene una selezione delle sottopopolazioni che non presentano questi antigeni forti per cui la risposta di rigetto si spegne. Un secondo meccanismo è rappresentato dalla produzione di numerose sostanze che inibiscono o sopprimono la risposta immune rendendo il tumore tollerabile dal sistema. Tra queste sostanze vanno ricordati alcuni mediatori proinfiammatori, citochine e alcuni interferon [22].
La migliore conoscenza di questi meccanismi ha recentemente suggerito terapie immunitarie tese a rafforzare la risposta e a facilitare il riconoscimento degli antigeni tumore-specifici [11].
1.4.10 – Progressione verso la malignità: Risposta biologica integrata.
Da quanto esposto sopra, va sottolineato che la progressione maligna può essere considerata prevalentemente una risposta biologica integrata di adattamento all’ipossia e di riparazione del danno mediante la “fisiologica” attivazione di un pathway infiammatorio-riparativo (asse HIF/NFkB), altamente conservato nel corso dell’evoluzione. Va, tuttavia, notato che le caratteristiche e gli effetti di questa risposta sono quasi sovrapponibili alla “transizione epitelio-mesenchimale” spesso associata a mutazioni di geni connessi all’invasione e metastasi. Questo vuol dire che, nel panorama di alta instabilità genetica del tumore, i geni mutati (la cui espressione normale è tipicamente dipendente da HIF e/o da NFkB) possono dare un ulteriore e più forte contributo alla progressione verso la malignità.
Questi aspetti molecolari della progressione maligna sono stati dimostrati in numerosi tumori solidi, come nel carcinoma prostatico [41], carcinoma mammario [54], glioblastoma [55], carcinoma tiroideo [57], carcinoma pancreatico, mesotelioma [39] e in modelli cellulari derivati da tumori umani. Mentre non vi sono studi relativi al carcinoma vescicale nei vari stadi della progressione.
Questa tesi si prefigge di portare un contributo a questo quadro generale di patogenesi della malignità anche per il carcinoma della vescica, presentando dati molecolari che confermano come l’ipossia e la successiva attivazione di una forte risposta infiammatoria riparativa siano la driving force per comprendere la progressione del carcinoma vescicale in situ verso la malignità con invasione e metastasi.
33
2-Scopi della tesi e Protocolli sperimentali
2.1 – Obiettivi generali
1 - Definire il ruolo dell'ipossia e dell’espressione genica di adattamento all’ipossia (HIF) e proinfiammatoria (NFkB) nella progressione del carcinoma vescicale.
2 - Stabilire una relazione di causa/effetto tra le condizioni ipossiche, l'attivazione dell'espressione genica proinfiammatoria e la genesi del fenotipo maligno in opportuni modelli cellulari.
3 –Rivedere la letteratura sugli effetti di inibitori di HIF1α (inibitori del rimodellamento ipossico) e di NFkB (inibitori della risposta proinfiammatoria) nel bloccare o rallentare la genesi del fenotipo maligno in vitro. 4 - In pazienti selezionati proporre come terapia off-label l'uso di inibitori di HIF1α (es. digossina) e di NFkB (es. vari antinfiammatori) come terapia coadiuvante del carcinoma vescicale.
2.2-Protocolli di studio per i singoli obiettivi
Obiettivo 1: I pazienti selezionati (Dipartimento di Urologia, Università di Roma Sapienza) affetti da tumore vescicale verranno sottoposti a TURB (Resezione Vescicale Trans-Uretrale). I campioni vescicali ottenuti saranno studiati sotto il profilo istopatologico ma anche della biologia molecolare (espressione genica-mRNA e proteine), dopo processazione con la tecnica della Laser Capture Microdissection (LCMD). L'espressione genica dipendente da HIF1α e quella dipendente da NFkB verranno analizzate mediante cards microfluide (arrays a bassa densità) progettate per contenere i geni più rappresentativi delle famiglie controllate dai due fattori di trascrizione. L'attivazione di HIF1α e NFkB verrà analizzata mediante la valutazione della loro traslocazione nel nucleo dopo frazionamento nucleo/citoplasma delle frazioni tissutali ottenute per LCMD. Obiettivo 2: Come modelli cellulari verranno utilizzate cellule staminali di tumore vescicale fornite dal Prof. Giorgio Stassi del Dipartimento di Oncologia dell’Università degli studi di Palermo. Verrà anche analizzata la loro capacità invasiva (saggi di invasione), la capacità di migrazione (saggi di migrazione stimolata da chemochine) dopo attivazione da trattamento ipossico.
Obiettivo 3: il controllo di alcune proprietà del fenotipo maligno verrà studiato mediante due strategie: a) Mediante silenziamento o KO di uno dei due fattori di trascrizione o di geni coinvolti nelle proprietà del fenotipo maligno, in particolare di RAGE, P2X7 o TLRs; b) mediante l'uso di inibitori o modulatori di HIF1α (digossina, chetomin) e di NFkB (Partenolide, CR3294, aspirina, ecc.).
Obiettivo 4: Verrà proposto l'uso off-label di farmaci già utilizzati per altre patologie, come l'aspirina, altri NSAIDs, la digossina e l'acriflavina in pazienti selezionati con end-points primari di aumento del survival e di diminuzione delle recidive.
34
3.-MATERIALI E METODI
3.1- Arruolamento e studio clinico dei pazienti
Nel Dipartimento di Urologia del Policlinico Umberto I dell’Università la Sapienza di Roma, sono stati selezionati 18 pazienti di cui 14 maschi e 4 femmine di età compresa fra 50 e 80 anni, ai quali era stata fatta diagnosi di carcinoma della vescica secondo gli standard diagnostici attuali. (TABELLA 6). L’88,8% dei pazienti avevano tra i fattori di rischio il fumo di sigaretta mentre il 55,5% erano affetti da Ipertensione arteriosa. La diagnosi è stata espressa tramite l’uretrocistoscopia in 7 pazienti; con l’ecografia dell’apparato urinario in 9 pazienti e con TC addome in 2 pazienti. La sintomatologia più frequentemente riscontrata è stata l’ematuria (50% dei casi). Nel 50% dei casi si è trattato di un tumore primitivo mentre nei restanti pazienti è stata una recidiva dello stesso tumore.
Tutti i pazienti sono stati sottoposti a TURB (Trans-Uretral Resection of Bladder), procedura chirurgica endoscopica di resezione ed asportazione della lesione vescicale.
3.2- Campioni biologici prelevati, storage e analisi
Nel corso della TURB da ogni paziente sono stati prelevati tre campioni di tessuto vescicale: due campioni dalla lesione tumorale ed un campione di tessuto ospite adiacente (presumibilmente normale). I reperti sono stati conservati per lo studio e le varie analisi come di seguito:
a) un campione di tumore fissato in formalina per l’istopatologia standard e la diagnosi anatomo-patologica.
b) un campione di tumore, rapidamente congelato in azoto liquido e conservato in freezer a -80°C per la LCMD (Laser Capture Micro-Dissection) e le successive analisi molecolari.
c) Un campione di tessuto “sano” ospite adiacente del tumore, presumibilmente normale, rapidamente congelato in azoto liquido e conservato a -80°C per la LCMD e le successive analisi molecolari da paragonare come controllo al tessuto tumorale di cui al campione b).
35 TABELLA 6 – Caratteristiche cliniche dei pazienti arruolati per questo studio.
Caratteristica N° % SESSO 4 F/14 M ETA’ 50-60 aa 60-70 aa 70-80 aa >80 aa 2 6 6 4 66,6% TRA I 60 ED 80 ANNI COMORBIDITA’ Fumo Ipertensione arteriosa Cardiovascolari Dislipidemia Patologie autoimmuni Altre neoplasie Diabete Tipo 2
Insufficienza renale cronica BPCO
Patologie infettive (Vaiolo)
16 10 7 7 3 2 2 2 2 1 88,8% 55,5% 38,8% 38,8% 27,7% SINTOMI Ematuria disuria 9 2 50 % STADIAZIONE pT0 pTa pT1 pT2 2 11 2 3 11,11% 61,11% 11,11% 16,6% FOLLOW-UP RECIDIVA STESSO GRADO GRADO INFERIORE GRADO SUPERIORE DECESSI 6 4 1 1 4 33,33% 66,66 %
36
3.3- Metodiche di laboratorio
Qui vengono brevemente descritte le metodiche che sono state utilizzate per l’analisi dei campioni prelevati dai pazienti descritti nella TABELLA 6.
3.3.1- Morfologia.
Per la diagnosi istopatologica i campioni, dopo opportuna fissazione in formalina 4% in tampone, venivano disidratati in una serie crescente di etanolo, passati in xilolo quindi inclusi in paraffina secondo le schedule standard. Sezioni fini venivano chiarificate in xilolo e colorate con ematossilina/eosina e sottoposti all’osservazione dell’anatomo Patologo per la diagnosi morfologica, la stadiazione e il grado citologico. 3.3.2 -LCMD: la tecnica della Laser Capture Micro-Dissection (Figura 19) permette di isolare mediante microdissezione con laser UV le cellule di interesse (es. cellule tumorali, cellule normali, infiltrati leucocitari, microvasi, cellule stromali, ecc.), prelevarle e riporle in microprovette per procedere all’estrazione di acidi nucleici (DNA, RNA) o proteine per le successive analisi (amplificazione, sequenziamento, rt-PCR, WB [Western Blot] e proteomica).
Figura 19 – Tappe della LCMD. 1.-Sezione tissutale al criostato di circa 6-7 mm. 2.-Taglio con il laser che identifica un’area omogenea di cellule tumorali con assenza di vasi. 3.-Tessuto ospite rimasto dopo
il prelievo della frazione dissezionata nella figura precedente. 4.-Frazione tissutale recuperata mediante il cap della microprovetta dove avverrà l’estrazione degli acidi nucleici o delle proteine.
37 Il grande vantaggio di questa procedura è di conferire cellulo-specificità alle analisi da eseguire e di potenziare la significatività dei dati ottenuti (per l’omogeneità del tipo cellulare esaminato) e la loro validità statistica, potendo in tal modo ridurre il numero dei campioni e dei pazienti da studiare.
L’apparato di LCMD è costituito da un microscopio ottico che permette di individuare facilmente le cellule di interesse e da un dispositivo laser UV finemente controllato da un software che permette di tagliare la sezione di tessuto e la membrana di PEN sottostante. Il laser UV consente velocità e precisione notevoli e crea una maggiore risoluzione consentendo così la cattura di singole cellule di ridotte dimensioni oppure di piccoli gruppi di cellule. La LCMD permette di selezionare ed ottenere popolazioni cellulari pure da un tessuto eterogeneo con un minimo di contaminazione. Lo strumento è dotato di un efficace sistema di posizionamento per ottenere una migliore accuratezza e stabilità. [1][33]
Il software, inoltre, possiede numerose routine per a) la selezione dei diversi tipi di tessuto nello stesso campione, utilizzando marcatori laser di diverso colore con la raccolta differenziata in varie microprovette; b) il calcolo dell’area selezionata in µm2 e, alla fine, del numero di cellule contenute nelle frazioni dissezionate; c) recentemente è stata aggiunta una routine per il calcolo dello spessore della sezione e, quindi, della massa cellulare media (in µm3). Tutti questi valori sono utili per determinare, per esempio, la concentrazione/cellula delle molecole di interesse (DNA, RNA o proteina).
Tappe della Laser Capture Micro-Dissection: Dai campioni congelati a -80°C si preparano al criostato sezioni relativamente spesse (7-8 µm), poste su dei vetrini ricoperti di una membrana di PEN (polietilene naftalato) e quindi colorate con coloranti contenenti reagenti di protezione degli acidi nucleici e, in particolare, dell’RNA (inibitore delle RNA-asi). In seguito, si procede al taglio delle sezioni con il laser UV per isolare i gruppi di cellule; sia quelli tumorali che quelli del tessuto ospite del tumore.
L’area sezionata con le cellule viene, infine, trasferita sul cap di una microprovetta contenente la soluzione di estrazione (Figura 19). Chiudendo il cap e agitando/incubando opportunamente la microprovetta, si procede all’estrazione.
3.3.3- Analisi molecolari effettuate sulle frazioni tissutali ottenute mediante LCMD
Per dimostrare la reale attivazione dei due fattori di trascrizione (HIF1a e NFkB) abbiamo cercato due evidenze: 1) la traslocazione nel nucleo dal citoplasma dei due fattori di trascrizione nelle frazioni nucleari e citoplasmatiche dei diversi tessuti microdissezionati (tumorale e tessuto ospite) e 2) la valutazione della trascrizione di geni tipicamente dipendenti da HIF1α o da NFkB che presentano le specifiche sequenze di consenso. (Obiettivo 1)
38 3.3.4- Estrazione nucleo/citoplasma.
L’estrazione delle frazioni nucleo/citoplasma è stata ottenuta mediante l’uso di un kit (The Nuclear Extract Kit, TransAM, Active Motif). Tali frazioni sono state utilizzate nei saggi Western Blot. Per l’estrazione nucleo/citoplasma, da un pool di frazioni microdissezionate si è proceduto come segue. I pools di tessuto microdissezionato sono stati lavate con 5 ml di una soluzione fredda di PBS contenente un Inibitore delle Fosfatasi (PBS, Acqua distillata, Inibitore delle Fosfatasi). Questa soluzione previene modificazioni delle proteine (come la defosforilazione) bloccando l’attività delle fosfatasi, in modo da mantenere inalterate le condizioni dei tessuti. I campioni vengono trasferiti in provette coniche a freddo, centrifugati per 5 min a 500 rpm a 4°C. Il surnatante viene scartato e il sedimento trasferito in ghiaccio.
- Preparazione della frazione citoplasmatica:
Il sedimento è stato risospeso gentilmente in 500 µl di tampone Ipotonico (tampone Ipotonico 10X e acqua distillata) pipettando diverse volte e trasferito in tubi da microcentrifuga a freddo. Il tampone Ipotonico rigonfia le membrane cellulari rendendole più fragili. Sono stati aggiunti 25 µl di detergente e agitati vigorosamente per 10 sec ad alta velocità; in questo modo si favorisce il distacco delle proteine citoplasmatiche nel surnatante. La sospensione è stata centrifugata per 30 sec a 14.000 g a 4°C. Il surnatante (frazione citoplasmatica) è stato trasferito in un tubo freddo da microcentrifuga e poi conservato a –80°C. Il sedimento invece, è stato utilizzato per l’estrazione della frazione nucleare.
- Preparazione della frazione nucleare:
Il sedimento è stato sospeso in 50 µl di tampone completo di Lisi (DTT 10 mM, Tampone di Lisi AM1, miscela di Inibitori delle Proteasi) favorendo la solubilizzazione delle proteine nucleari. La sospensione è stata incubata in ghiaccio per 30 min a lenta agitazione e poi centrifugata per 10 min a 14.000 g a 4°C. Il surnatante (la frazione nucleare) è stato trasferito in una provetta da microcentrifuga e conservato a –80°C.
Le frazioni così ottenute, sono state quantificate mediante il saggio Bradford. Questo è un saggio colorimetrico che si basa sul legame del Blue di Coomassie alle proteine. È stato preparato un set standards da una proteina a concentrazione nota come la BSA (1mg/ml). I valori degli standards letti e ottenuti allo spettrofotometro, sono stati utilizzati per costruire una curva di riferimento con l’asse delle x=mg/ml e l’asse delle y=A (assorbanza), alla quale sono stati paragonati i valori di assorbanza dei campioni a concentrazione non nota per determinare le rispettive concentrazioni.
39
3.4 –Metodiche di biologia molecolare.
L’estrazione degli acidi nucleici avviene seguendo le schedule standard, seguita da retrotrascrizione per l’RNA ed amplificazione del cDNA mediante diversi cicli di PCR (Polymerase Chain Reaction) in 50 µl di una PCR Master Mix. Il prodotto ottenuto viene analizzato con array a bassa densità (card microfluide da noi disegnate contenenti i primers dei geni di interesse, vedi TABELLA 7) mediante l’apparato di rt-PCR Applied 7600. Negli arrays a bassa densità sono contenuti 48 geni di diverse famiglie associate alla progressione e all’attivazione dell’asse HIF/NFkB, oltre ai geni housekeeper di controllo per la quantizzazione (Figura 20).
Figura 20–Utilizzazione delle frazioni tissutali ottenute per LCMD per la trascrittomica con arrays a bassa densità (cards microfluide) opportunamente definite da 48 geni che rappresentano le principali
40 3.4.1- Elettroforesi su gel di Poliacrilammide (SDS-PAGE) e Western Blotting
Questa tecnica viene utilizzata per la separazione di proteine con carica elettrostatica. I campioni vengono sottoposti all’azione di un campo elettrico (80-100V per 2 ore). La separazione si basa esclusivamente sulle dimensioni delle proteine. L’analisi dimensionale si ottiene utilizzando un detergente anionico, il sodio dodecilsolfato (SDS) che si lega alle catene polipeptidiche ogni due residui amminoacidici. L’interazione provoca la destabilizzazione della struttura terziaria delle proteine denaturandole e conferendo loro una carica netta negativa che rende trascurabile la carica della proteina nativa. La separazione dei complessi proteina-SDS si ottiene permettendo la migrazione dei campioni lungo il gel discontinuo di poliacrilamide, composto dal gel di impacchettamento al 4%, nel quale vengono formati i pozzetti in cui si depositano i campioni da analizzare, e un gel di risoluzione, la cui percentuale dipende dalle dimensioni della proteina, che rappresenta la matrice in cui è avvenuta la separazione delle proteine.
I campioni vengono preventivamente condizionati nel tampone di caricamento. Questo contiene: TRIS-HCL 0.5M pH 6.8, 0.1% sodio dodecilsolfato (SDS), l’agente riducente Ditiotreitolo (DTT) 1X per la riduzione dei ponti di-solfuro, un addensante (glicerolo) ed un tracciante colorato (0.05% blu di bromofenolo) che permette di seguire l’andamento della corsa elettroforetica. Dopo bollitura (2 min), una quantità simile (in μg) dei campioni viene caricata su ogni pozzetto del gel. Al termine della corsa elettroforetica, applicando un campo elettrico trasversale, le proteine vengono trasferite dal gel alla membrana di fluoropolivinilidene (PVDF) secondo la metodica Western Blotting. Nel processo di trasferimento rimangono dei siti liberi sulla membrana, che vengono bloccati (blocking) ricoprendo la membrana con una miscela di proteine non specifiche del latte magro, liofilizzato, al 5%, in una soluzione di Tris 0.05M, NaCl e HCl 0.15M con 0.05% Tween-20 (TBS-T) a pH 7.4 per 1 ora a temperatura ambiente. Questo evita il legame non specifico dell’anticorpo primario su tali siti. La membrana viene quindi immersa in una soluzione contenente l’anticorpo primario per tutta la notte a 4°C (poiché tutti i siti della membrana sono stati bloccati, l’anticorpo aderisce alla membrana solo se si lega con il suo antigene specifico). Gli anticorpi primari nel nostro caso erano diretti contro le proteine e alle concentrazioni ottimizzate. Per esempio: per HIF-1α 1:200, per NF-kB 1:500, per COX-2 1:1000, per P2X7 1:500, per RAGE 1:500.
Seguono 4 lavaggi nel TBS-T da 5 min ognuno e poi si procede all’incubazione della membrana con gli anticorpi secondari accoppiati covalentemente alla Perossidasi di Rafano (HRP), per 1 ora, a temperatura ambiente e sotto lenta agitazione.
Le concentrazioni degli anticorpi sono state ottimizzate: IgG Mouse (GE Healthcare) 1:5000, IgG Anti-Rabbit (GE Healthcare) 1:5000, IgG Anti-Goat (S.Cruz Biotecnology) 1:10000.
Dopo i lavaggi (6 da 5 min ognuno), la membrana viene trattata con un agente che emette chemioluminescenza (ECL detection system Amersham, Buckinghamshire, UK). La rivelazione delle bande d’interesse si ottiene mediante autoradiografia, mettendo a contatto il filtro di nitrocellulosa con una pellicola fotografica, in seguito opportunamente sviluppata, e le bande evidenziate vengono quantificate mediante densitometria.
41 3.4.2- Estrazione dell’RNA totale dal tessuto intero e PCR
Al fine di caratterizzare l’espressione genica delle diverse proteine in cellule di tessuto normale, di tessuto di lesioni proliferative intermedie e di tessuto estratto da carcinoma, abbiamo proceduto all’estrazione dell’RNA e all’amplificazione delle sequenze codificanti per iNOS, COX-2 e NADPH ossidasi (gp91phox) mediante RT-PCR (reverse trascriptase-PCR). Questa tecnica accoppia la retrotrascrizione dell’RNA, per ottenere cDNA, all’amplificazione per PCR.
I campioni di tessuto vescicale di circa 50-100 mg di peso sono stati omogeneizzati utilizzando un buffer di lisi contenente DNA-asi, che eliminano il DNA, e un forte detergente, capace di denaturare proteine e in particolare di distruggere le RNA-asi. La fase di deproteinizzazione è particolarmente vigorosa in quanto l’RNA è spesso associato fortemente a proteine. A seguire il trattamento con una soluzione monobasica di fenolo cloroformio e istiocianato di guanidina (TRIzol, Life Technologies). Quest’ultimo reagente viene utilizzato nelle estrazioni di RNA in quanto è un forte inibitore di RNA-asi, nonché un potente denaturante proteico (Wilson et al., 2001). Il fenolo cloroformio è invece utilizzato come liquido organico per le estrazioni. Si è proceduto poi alla separazione delle fasi centrifugando a 12000 x g per 15 min a 4°C. Viene dunque recuperata la fase acquosa, nella quale sono disciolti gli acidi nucleici (RNA), scartando l’interfaccia, dove si accumulano le proteine denaturate.
La fase acquosa è stata, dunque, trattata con isopropanolo per precipitare l’RNA, che viene recuperato dopo successiva centrifugazione a 12000x g per 10 min a 4°C. A seguire un’ulteriore fase di lavaggio con etanolo 70%, al fine di ottenere una completa precipitazione, e una successiva centrifugazione a 8000x g per 5 min a 4°C. Il pellet è stato risospeso in H2O-DEPC.
L’RNA totale così ottenuto, 3 µg, è stato retrotrascritto in DNA complementare.
La retrotrascrizione avviene nella stessa macchina per la PCR impostando dapprima, per 5 min, la temperatura a 70°C, in modo da consentire il completo srotolamento dell’RNA e, successivamente, a 42°C, per 1 ora, fase durante la quale avviene la retrotrascrizione. Nel mix utilizzato sono contenute la transcrittasi inversa Superscript II (Gibco-BRL), dNTP, RNA-asi, H2O.
Circa 150 ng di cDNA di ogni campione sono stati amplificati con Taq polimerasi utilizzando primers specifici per i diversi geni, utilizzando l’apparato Termal Cycler della Perkin Elmer.
Le amplificazioni del cDNA relativo ai diversi trascritti sono svolte in provette differenti, ciascuna contenente uno specifico tipo di primer.
La macchina da PCR è impostata in modo che vari la temperatura nel tempo, facendola rimanere costante per determinati intervalli di tempo. In generale alla temperatura di 95-96°C avviene la denaturazione del duplex, a 56-60°C avviene l’appaiamento con i primer, a 72°C avviene la polimerizzazione (Figura 21).
![Figura 3 – Principali agenti esogeni coinvolti nella patogenesi del carcinoma vescicale [4]](https://thumb-eu.123doks.com/thumbv2/123dokorg/2885006.10754/8.892.89.809.493.604/figura-principali-agenti-esogeni-coinvolti-patogenesi-carcinoma-vescicale.webp)
![TABELLA 1 – Oncogeni identificati nel carcinoma vescicale, attivati da diverse mutazioni e la loro frequenza [45]](https://thumb-eu.123doks.com/thumbv2/123dokorg/2885006.10754/11.892.213.732.209.840/tabella-oncogeni-identificati-carcinoma-vescicale-attivati-mutazioni-frequenza.webp)
![Figura 4 – Storia naturale del tumore vescicale: stadiazione [45]](https://thumb-eu.123doks.com/thumbv2/123dokorg/2885006.10754/14.892.94.764.765.1011/figura-storia-naturale-tumore-vescicale-stadiazione.webp)
![Figura 9 – Caratteristiche del fenotipo maligno secondo Hannhan e Weinberg [21]](https://thumb-eu.123doks.com/thumbv2/123dokorg/2885006.10754/19.892.218.674.295.729/figura-caratteristiche-fenotipo-maligno-secondo-hannhan-weinberg.webp)