POLITECNICO DI MILANO
Scuola di Ingegneria Industriale e dell'Informazione
Corso di Laurea Magistrale in Ingegneria Biomedica
3D Bioprinting per la vascolarizzazione di scaffold
in idrogelo mediante network sacrificali
Relatore: Prof.ssa Sara Mantero
Correlatore: Dr.ssa Beatrice Belgio
Tesi di Laurea Magistrale di:
Clara Lavinia Abbiati
Matr. 900228
Indice
Indice delle figure ... i
Indice delle tabelle ... v
Glossario ... vi
Sommario ... vii
Abstract ... xvii
Introduzione ... 1
1.1 Medicina rigenerativa ed ingegneria dei tessuti ... 1
1.1.1 Cellule per l’ingegneria dei tessuti ... 2
1.1.2 Scaffold ... 3
1.1.3 Bioreattori ... 4
1.1.4 Problematiche dell’ingegneria dei tessuti: la vascolarizzazione dei tessuti .... 4
1.2 Il sistema vascolare ... 6
1.2.1 Struttura e composizione dei vasi sanguigni ... 6
1.2.2 Vasculogenesi ed angiogenesi ... 7
1.3 Bioprinting per la fabbricazione di costrutti vascolarizzati ... 9
1.3.1 Tecnologie di Bioprinting ... 9
1.3.2 Biomateriali per 3D Bioprinting ... 12
1.3.3 Strategie per l’ingegneria dei tessuti ... 16
1.3.4 Cellule per la vascolarizzazione degli scaffold ... 18
1.3.5 Tecniche di bioprinting per la prevascolarizzazione in vitro degli scaffold.. 19
1.4 Obiettivo ... 23
Materiali e Metodi ... 24
2.1 Preparazione dell’idrogelo ... 24
2.1.1 Crosslinking esterno dell’idrogelo ... 25
2.1.2 Crosslinking interno dell’idrogelo ... 26
2.2 Caratterizzazione dell’idrogelo ... 27
2.3 3D printing dello scaffold in idrogelo ... 28
2.3.1 Ottimizzazione dei parametri di stampa ... 31
2.3.2 Strategia di reticolazione dell’idrogelo ... 33
2.4 3D printing del materiale sacrificale ... 35
2.5 Strategia per la creazione di network vascolari ... 36
2.5.1 Design e fabbricazione dello scaffold ... 36
Risultati ... 39
3.1 Ottimizzazione della composizione dell’idrogelo ... 39
3.1.1 Crosslinking esterno dell’idrogelo ... 41
3.1.2 Crosslinking interno dell’idrogelo ... 42
3.2 Caratterizzazione dell’idrogelo ... 43
3.2.1 Prove di swelling e stabilità ... 43
3.3 Fabbricazione dello scaffold di idrogelo ... 44
3.3.1 Ottimizzazione dei parametri di stampa ... 44
3.3.2 Strategia di reticolazione dell’idrogelo ... 48
3.4 Sintesi dei network vascolari ... 49
Discussioni ... 51
4.1 Scelta dell’idrogelo ... 51
4.2 3D printing dello scaffold in idrogelo ... 54
4.3 Strategia per la creazione di network sacrificali ... 57
Conclusioni e sviluppi futuri ... 59
Appendice A ... 62
Bibliografia ... 72
i
Indice delle figure
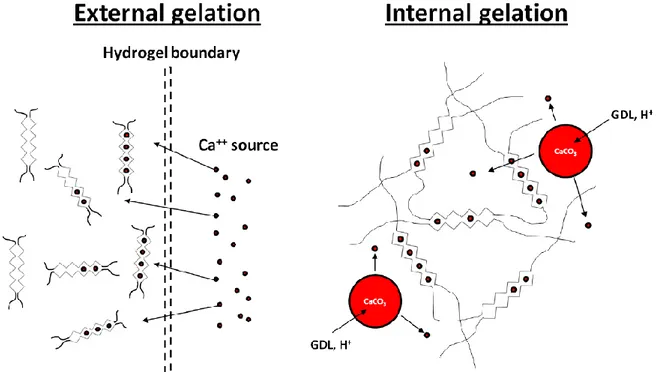
Figura 1.1: Tipico ciclo terapeutico dell’ingegnerizzazione tissutale (Tarun et al. [6]). ... 2 Figura 1.2: Composizione, diametro (D) e spessore (S) medi dei vasi sanguigni. ... 7 Figura 1.3: Fasi del ciclo di Rapid Prototyping: modellizzazione tramite CAD dell’oggetto e generazione del file STL; suddivisione in sezioni dell’oggetto (slicing); fabbricazione layer su layer e operazioni di post processing (rimozione dei supporti, pulizia, finitura); realizzazione finale del prototipo (Minev et al. [36]). ... 17 Figura 1.4: Tecnologie di inkjet, laser-assisted e microextrusion bioprinting. (a) inkjet bioprinting: sistema di estrusione di piccoli volumi di bioink tramite un attuatore piezoelettrico o un elemento riscaldante; (b) microextrusion bioprinting: sistema di estrusione di filamenti continui di materiale tramite sistemi pneumatici, a pistone o a vite; (c) Laser-assisted bioprintig: un fascio laser incide su un substrato assorbente, generando una pressione che incide sullo strato sottostante contenente il bioink e spingendolo verso il collettore (Murphy et al. [21]). ... 10 Figura 1.5: Classificazione dei materiali usati per la fabbricazione di scaffold nell’ingegneria dei network vascolarizzati: (a) numero di pubblicazioni all’anno relative all’uso di scaffold naturali, sintetici e in Matrigel (pubblicazioni disponibili sul database MEDLINE). (b) percentuale degli studi per tipologia di scaffold nel periodo 2013-2018 (Wang et al [27]). ... 13 Figura 1.6: meccanismo di gelazione dell’alginato. A sinistra, processo di gelazione esterna: gli ioni Ca++, dissociati in soluzione, diffondono poco oltre la superficie dell’alginato e si
legano al primo gruppo carbossilico con cui vengono in contatto; a destra, processo di gelazione interna: CaCO3 viene mescolato in maniera omogena con l’alginato; l’aggiunta
del GDL abbassa il pH della soluzione e libera ioni Ca++, che si legano al gruppo carbossilico
più vicino ( Roberts, 2014, [30] ). ... 14 Figura 1.7: (b) struttura del Pluronic; (a) meccanismo di gelazione del Pluronic: al di sotto della CMC il Pluronic è disposto in singole catene, che si aggregano all’aumentare della concentrazione. Quando viene raggiunta la CMC, si ha la formazione delle micelle; (c) il cambiamento in temperatura porta all’aggregazione di micelle (Suntornnond et al. [34]). 16 Figura 1.8: Elementi base per la creazione di network vascolarizzati in ingegneria dei tessuti: scaffold, cellule endoteliali e cellule perivascolari (Wang et al. [27]). ... 19
ii
Figura 1.9: Bioprinting di network vascolare tramite un sistema di ugelli coassiali per la deposizione combinata di idrogelo e agente reticolante (Zhang et al. [45])... 20 Figura 1.10: Bioprinting indiretto di un network vascolare: stampa 3D del materiale sacrificale; incapsulamento della struttura sacrificale all’interno di un biomateriale contenente cellule; dopo la gelazione del biomateriale, il costrutto è perfuso dal mezzo di coltura che porta allo scioglimento della struttura sacrificale con formazione dei canali vascolari (Miller et al. [15]). ... 21 Figura 1.11 schema del costrutto vascolarizzato: in blu è esemplificata l’architettura in cui sono caricate le MSCs; in rosso è schematizzata la struttura vascolare creata tramite materiale sacrificale; in verde è indicata la matrice contente i fibroblasti che riempie gli spazi interstiziali (Kolesky et al. [47]). ... 22 Figura 2.1: Schema delle fasi per la generazione del g-code. ... 28 Figura 2.2: Design preliminare dello scaffold: a sinistra file .stl del parallelepipedo generato tramite SolidWorks (scale bar = 1 cm); a destra visualizzazione del g-code generato tramite il software Cellink HeartWare (scale bar = 1 cm). ... 29 Figura 2.3: Principali componenti della 3D Bioprinter (INKREDIBLE+, Cellink), utilizzata per la realizzazione degli scaffold. ... 29 Figura 2.4: Visualizzazione del g-code per la stampa di un layer. Fill pattern è stato impostato “rectilinear” e fill density è pari al 100% (scale bar = 5 mm). ... 33 Figura 2.5: Parametri di stampa forniti dall’azienda Cellink per la stampa di Pluronic F-127. ... 35 Figura 2.6: A sinistra visualizzazione CAD delle dimensioni dello scaffold modellizzato (20×20×1 mm3); a destra vista della multi-parte, costituita da tre parallelepipedi sovrapposti, ognuno dei quali è stato assegnato ad un estrusore della 3D Bioprinter. ... 36 Figura 2.7: Visualizzazione g-code dello scaffold (20×20×1 mm3). In alto, vista tridimensionale del modello; in basso, vista laterale del modello. ... 37 Figura 3.1: Confronto tra il g-code generato e il risultato di stampa ottenuto utilizzando un idrogelo di alginato (2% w/v) e gelatina (10% w/v), secondo il protocollo di Chung et al. (2013). ... 39 Figura 3.2 Idrogeli caricati in siringhe: a sinistra il gel A80G20 (80% alginato, 20% gelatina), al centro il gel A50G50 (50% alginato, 50% gelatina), a destra il gel A20G80 (20% alginato, 80% gelatina). ... 40
iii
Figura 3.3 Aspetto dei tre gel estrusi tramite siringa a temperatura ambiente in piastra di Petri: a sinistra il gel A80G20, al centro il gel A50G50, a destra il gel A20G80. ... 40 Figura 3.4: Gel reticolato esternamente con CaCl2: a sinistra gel A80G20, al centro gel
A50G50, a destra gel A20G80. I gel A80G20 e A50G50 possono sostenere stress meccanici, come mostrato nella prova di sollevamento. Al contrario, non è stato possibile sollevare il gel A20G80 a causa dell’eccessiva fragilità. ... 41 Figura 3.5: Gel A50G50 estruso tramite ugello di 410 μm e reticolato in CaCl2. ... 42
Figura 3.6: Gel A50G50 reticolato internamente. A sinistra gel caricato in siringa; a destra gel estruso in una piastra di Petri. ... 42 Figura 3.7: Prova di swelling: andamento della variazione di peso [%] nel tempo dell’idrogelo A50G50. ... 43 Figura 3.8: Due layer sovrapposti di idrogelo A50G50 a differenti temperature. Per ogni scaffold è indicata in basso a sinistra la temperatura di stampa. ... 44 Figura 3.9: Grafico dell’andamento del diametro dei filamenti in funzione della velocità di stampa: a) dati ottenuti ad una pressione di 95kPa, utilizzando un puntale di diametro 410 μm; b) dati ottenuti ad una pressione di stampa di 200kPa, utilizzando un puntale di diametro 250 μm. ... 46 Figura 3.10: Grafico dell’andamento della distanza tra i filamenti (df) (mm) in funzione della
fill density [%]. Il grafico è riferito ad una pressione di stampa di 43 kP, una velocità di 10 mm/s e una temperatura di 27°C. ... 47 Figura 3.11: Deposizione di un layer (0,5×0,5 cm) a diversi fill density [%], riportati in ogni immagine in basso a sinistra. ... 47 Figura 3.12: Reticolazione del costrutto: a) scaffold stampato in un bagnetto di CaCl2; b)
scaffold reticolato dopo la stampa, tramite CaCl2 gocciolato sopra il costrutto; c) idrogelo
reticolato internamente tramite calcio carbonato... 48 Figura 3.13: Scaffold (2×2 cm) costituito da layer di A50G50 e Pluronic. a) deposizione di 4 layer di A50G50 e 2 layer di Pluronic (scale bar = 5 mm); b) deposizione di 4 layer di A50G50, 2 layer di Pluronic e altri 4 layer di A50G50 (scale bar = 5 mm). ... 49 Figura 3.14: a) costrutto ottenuto in seguito alla gelazione a 4°C: in trasparenza si osserva il reticolo in Pluronic (scale bar = 5 mm); b) costrutto vascolarizzato ottenuto in seguito alla rimozione del Pluronic per aspirazione tramite microsiringa ed iniezione di inchiostro
iv
all’interno dei canali. In alto a destra, la freccia bianca indica il punto di inserimento della siringa (scale bar = 5 mm). ... 50 Figura 4.1: Comparazione dei test di temperature sweep effettuati a caratterizzazione della gelatina e di un blend di alginato e gelatina (2% Alg-10% Gel). La temperatura di gelazione è indicata da una freccia nel punto in cui si incrociano la curva blu (G’’) e la curva rossa (G’): la temperatura di gelazione della gelatina è circa 25 °C; la temperatura di gelazione del blend è circa 11°C (Chung et al., 2013, [1]). ... 52 Figura 4.2: Schema riassuntivo dei parametri chiave di stampa (velocità testina, diametro del puntale, distanza del puntale dal piatto di stampa, temperatura e pressione di stampa) (He et al., 2016, [52]). ... 54 Figura 4.3: Fasi successive della strategia utilizzata per la stampa dello scaffold in idrogelo. La testina di stampa è caricata con l’idrogelo; la deposizione avviene layer su layer e dopo la fabbricazione il costrutto viene immerso nella soluzione reticolante gocciolata tramite siringa (adattato da He et al., 2016, [52]). ... 56 Figura 4.4 Confronto tra modello e scaffold realizzato. A destra, visualizzazione in g-code del modello di scaffold vascolarizzato; a sinistra, scaffold vascolarizzato ottenuto (scale bar = 5 mm). ... 57
v
Indice delle tabelle
Tabella 1.1 Caratteristiche delle principali tecniche di Bioprinting ... 11 Tabella 2.1 Tabella di conversione Gauge-diametro interno del puntale. ... 30 Tabella 2.2 Parametri utilizzati per la stampa dell’idrogelo a diverse temperature. ... 31 Tabella 2.3 Combinazione di parametri utilizzati per la stampa di un singolo filamento di idrogelo. ... 32 Tabella 2.4 Prove effettuate a differenti fill density [%]. ... 32 Tabella 3.1 Combinazioni di parametri utilizzati per le prove di stampa a diverse
temperature. ... 45 Tabella 3.2 Valori dei diametri dei filamenti ottenuti tramite analisi con il software imageJ. ... 45 Tabella 3.3 Parametri utilizzati per la stampa di A50G50 e Pluronic. ... 49
vi
Glossario
3D Three-dimentional
3DP Three-dimentional printing AM Additive manufacturing AMF Additive manufacturing file CAD Computer aided design
CMC Concentrazione critica micellare DMEM Dulbecco's Modified Eagle Medium ECM Matrice extra-cellulare
ECs Cellule endoteliali
ES Cellule staminali embrionali FDM Fused deposition modeling GDL Acido gluconico-δ-lattone
HUVECs Cellule endoteliali della vena ombelicale umana iPS Cellule staminali pluripotenti indotte
iPSC-CMs Cardiomiociti derivati da cellule staminali pluripotenti indotte LCGT Low critical gelation temperature
MMA Metacrilato di metile
MSCs Cellule staminali mesenchimali PBS Phosphate-buffered saline PEO/(PEG) Ossido di polietilene PGA Acido poliglicolico
PGLA Acido poli(lattico-co-glicolico) PHEMA Poliidrossietilmetacrilato PLA Acido polilattico
PPO Ossido di polipropilene PVP Polivinilpirrolidone
RGD Acido arginilglicilaspartico RP Rapid prototyping
SLS Selective laser sintering SMCs Cellule muscolari lisce STL Stereolithography TE Ingegneria dei tessuti
vii
Sommario
IntroduzioneL’ingegneria dei tessuti è una disciplina emergente dell’ingegneria biomedica finalizzata allo sviluppo di terapie in grado di rigenerare, migliorare e sostituire tessuti o organi. Una delle problematiche principali dell’ingegneria dei tessuti è la vascolarizzazione dei costrutti: i tessuti necessitano di un network vascolare per rifornire le cellule di nutrienti ed ossigeno e rimuovere i cataboliti dopo l’impianto.
L’attività delle cellule nei tessuti in vivo è resa possibile dalla presenza di una fitta rete di vasi sanguigni capillari; la distanza massima tra i capillari è circa 200 μm, correlata al limite di diffusione dell’ossigeno, oltre il quale non sarebbe possibile un efficace scambio di nutrienti e prodotti di scarto.
Per questo motivo, tessuti o organi aventi spessore maggiore di 400 μm necessitano di vascolarizzazione. Successi dell’ingegneria dei tessuti sono limitati a tessuti avascolari (come la cartilagine) o tessuti a basso spessore (come la pelle, la cornea e la vescica). Tra le strategie mirate alla promozione dell’angiogenesi nei costrutti, una tecnica emergente è la prevascolarizzazione in vitro, che mira alla creazione di un network vascolare nei costrutti ingegnerizzati prima dell’impianto. In questo contesto,le strategie bottom-up come il 3D Bioprinting, sono particolarmente interessanti perché permettono la deposizione controllata di biomateriale e cellule per l’ingegnerizzazione di tessuti dall’architettura e composizione complessa. I biomateriali utilizzati sono perlopiù idrogeli, materiali in grado di mimare l’ambiente della matrice extra-cellulare e di favorire l’adesione e la proliferazione cellulare.
L’obiettivo del presente lavoro di tesi è la prevascolarizzazione di uno scaffold utilizzando una tecnica di 3D Bioprinting a microestrusione. Questa tecnologia sarà utilizzata per la fabbricazione di un costrutto in idrogelo e la contemporanea inglobazione di un network sacrificale idrosolubile per la creazione di microcanali all’interno dello scaffold.
viii
Materiali e metodi Sintesi dell’idrogelo
Per la sintesi dell’idrogelo necessario alla fabbricazione dello scaffold è stata inizialmente seguita la procedura descritta in Chung et al.[1] per la preparazione di un blend di alginato e gelatina; tale protocollo è stato modificato per ottenere una composizione di idrogelo maggiormente viscoso. Sono stati sintetizzati i seguenti idrogeli per la scelta finale della composizione:
A. Idrogelo di alginato (4% w/v) e gelatina (10% w/v) in rapporto 4:1 (etichettato A80G20);
B. Idrogelo di alginato (4% w/v) e gelatina (10% w/v) in rapporto 1:1 (etichettato A50G50);
C. Idrogelo di alginato (4% w/v) e gelatina (10% w/v) in rapporto 1:4 (etichettato A20G80).
La reticolazione chimica dell’alginato è stata utilizzata come tecnica per aumentare le proprietà meccaniche dell’idrogelo. A tal fine, sono state sperimentate due tecniche differenti:
- Crosslinking esterno: la reticolazione esterna dell’idrogelo è stata effettuata
utilizzando una soluzione di CaCl2 (2% w/v) gocciolata sopra l’idrogelo tramite
siringa;
- Crosslinking interno: la reticolazione interna è stata eseguita utilizzando come agente
reticolante il calcio carbonato (CaCO3) combinato con il GDL.
L’idrogelo è stato caratterizzato tramite prove di swelling e stabilità per valutare il rigonfiamento e la degradazione dell’idrogelo nel tempo.
Design e fabbricazione dello scaffold in idrogelo
Lo scaffold è stato dimensionato tramite software CAD (Solidworks) ed il file .stl è stato processato tramite il software Cellink HeartWare per ottenere il file g-code. Il codice è stato
ix
poi ottimizzato manualmente tramite l’editor di testo, ottenendo il g-code leggibile dalla 3D Bioprinter.
La stampa del costrutto è stata effettuata tramite una 3D Bioprinter (INKREDIBLE+, Cellink) dotata di un sistema pneumatico di estrusione. Sono stati analizzati i seguenti parametri al fine di ottimizzare il processo di stampa:
- Temperatura [°C]: sono state effettuate osservazioni qualitative sulla stampa dell’idrogelo a temperature comprese tra i 19°C e 27°C;
- Velocità [mm/s]: è stata valutata l’influenza della velocità di spostamento della testina sul diametro dei filamenti estrusi (per velocità comprese tra i 5 mm/s e i 20 mm/s);
- Diametro del puntale [μm]: è stato valutato il diametro del filamento estruso in funzione del puntale utilizzato;
- Pressione [kPa]: sono state effettuate considerazioni sul rapporto pressione-temperatura e pressione-diametro del puntale.
Per valutare la variazione del diametro dei filamenti in funzione dei parametri considerati è stato utilizzato il software di analisi di immagine ImageJ.
Sintesi dei network vascolari
La tecnologia per la fabbricazione dello scaffold vascolarizzato prevede l’utilizzo dell’azione combinata di due testine di stampa della 3D Bioprinter per la deposizione dell’idrogelo (A50G50) e del network sacrificale al suo interno. Il materiale sacrificale utilizzato è il Pluronic F-127 (Cellink) che, grazie alla proprietà di gelazione inversa, si scioglie rapidamente a 4 °C.
Lo scaffold (20×20×1 mm3) è stato modellizzato in modo da ottenere la deposizione di
quattro layer di idrogelo sovrapposti, seguiti dalla deposizione di due layer in Pluronic, ricoperto da altri quattro strati di idrogelo (Figura 1).
x
La strategia finale per la realizzazione dei canali all’interno dello scaffold di idrogelo può essere riassunta nei seguenti step:
- Generazione del g-code per la stampa tramite due estrusori;
- Stampa dei due materiali tramite 3D Bioprinter: nella prima testina è caricato l’idrogelo A50G50; nella seconda testina è caricato il Pluronic;
- Reticolazione esterna dell’idrogelo tramite CaCl2 (2% w/v) per 5 minuti;
- Conservazione dello scaffold a 4°C per 15 minuti per ottenere lo scioglimento del Pluronic;
- Evacuazione del Pluronic mediante applicazione di un leggero vuoto tramite microsiringa.
La visualizzazione dei canali è stata effettuata tramite iniezione di inchiostro con una microsiringa.
Figura 1: Visualizzazione g-code dello scaffold modellizzato tramite il software HeartWare (20×20×1 mm3). La geometria visibile in blu corrisponde all’azione della prima testina di stampa; la geometria in giallo, indica i movimenti della seconda testina di stampa.
xi
Risultati
Sintesi dell’idrogelo
Le tre composizioni di idrogelo estruse tramite siringa in una piastra di Petri, hanno le caratteristiche mostrate in figura 2. L’idrogelo A80G20 risulta viscoso e si spande nella piastra di Petri, a causa dell’alta quantità di alginato; l’idrogelo A20G80 è troppo fragile e tende a frammentarsi a causa dell’elevata percentuale di gelatina; l’idrogelo A50G50, presenta caratteristiche intermedie che ne permettono l’estrusione tramite siringa e la deposizione nella forma di filamento.
Le tecniche di reticolazione esterna e interna effettuate sull’idrogelo A50G50 hanno portato alle seguenti considerazioni:
- La reticolazione esterna (CaCl2, 2%w/v) permette la rapida reticolazione
dell’alginato. L’idrogelo, una volta reticolato, mostra un aumento delle proprietà meccaniche;
- La reticolazione interna (CaCO3 (20 mM), GDL (40 mM)) porta ad una reticolazione
più lenta ed omogenea, ma l’idrogelo appare più fragile.
La composizione A50G50 viene selezionata per le promettenti caratteristiche di stampabilità e sarà utilizzato negli step successivi della tesi.
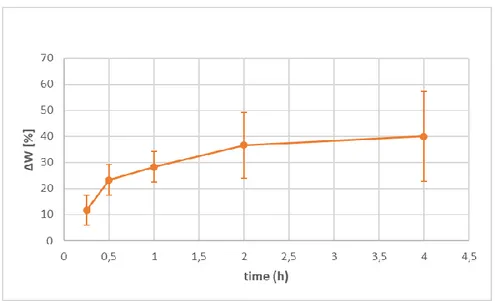
Il test di swelling effettuato sull’idrogelo A50G50 è riportato in figura 3: l’aumento di peso avviene rapidamente nelle prime due ore di incubazione (+28% dopo un’ora, +37% dopo 2 ore), per poi stabilizzarsi (plateau) nell’intorno del + 40% in peso tra le tre e quattro ore post incubazione.
A80G20 A50G50 A20G80
Figura 2: Caratteristiche dei tre gel estrusi tramite siringa a temperatura ambiente in piastra di Petri: a sinistra il gel A80G20, al centro il gel A50G50, a destra il gel A20G80.
xii
Il test di stabilità ha riportato la degradazione dell’idrogelo in 24h. Design e fabbricazione dello scaffold in idrogelo
Temperatura di stampa
Le prove di stampa a differenti temperature sono riportate in figura 4. È possibile notare differenze visibili nel diametro e nella regolarità del filamento estruso in base alla temperatura di estrusione.
Figura 3: Prova di swelling: andamento della variazione di peso [%] nel tempo dell’idrogelo A50G50.
19 °C 27°C °C 25 °C 25°C 22° C
Figura 4: Due layer sovrapposti di idrogelo A50G50 a differenti temperature. Per ogni scaffold è indicata in basso a sinistra la temperatura di stampa.
xiii
Velocità di spostamento della testina e diametro del puntale
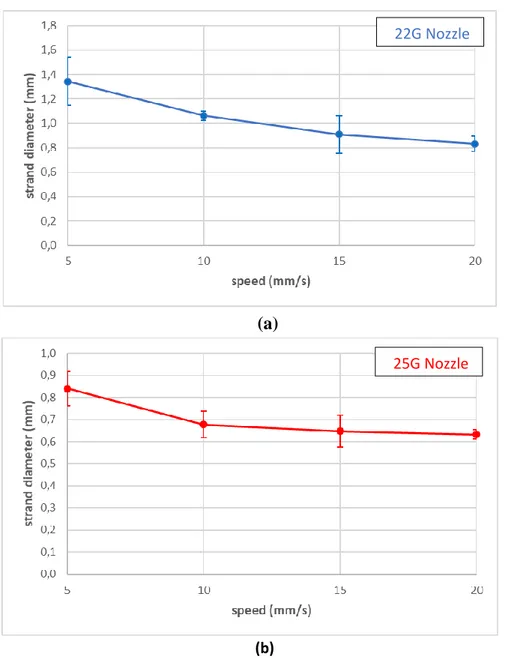
Nei grafici in figura 5 è possibile apprezzare l’andamento del diametro dei filamenti in funzione della velocità di stampa. Il grafico in figura 5a si riferisce alla stampa effettuata con puntale di diametro 410 μm ad una pressione di 95 kPa; il grafico figura 5b, alla stampa con puntale di diametro di 250 μm ad una pressione di 200 kPa. In entrambi i grafici è possibile notare l’andamento decrescente dei diametri all’aumentare della velocità di stampa.
(a)
Puntale 22G
Puntale 25G
Figura 5: Grafico dell’andamento del diametro dei filamenti in funzione della velocità di stampa: a) dati ottenuti ad una pressione di 95kPa e temperatura di 23°C, utilizzando un puntale 22G (ø = 410 μm); b) dati ottenuti ad una pressione di stampa di 200kPa e temperatura 23°C, utilizzando un puntale 25G (ø=250 μm).
xiv
Sintesi dei network vascolari
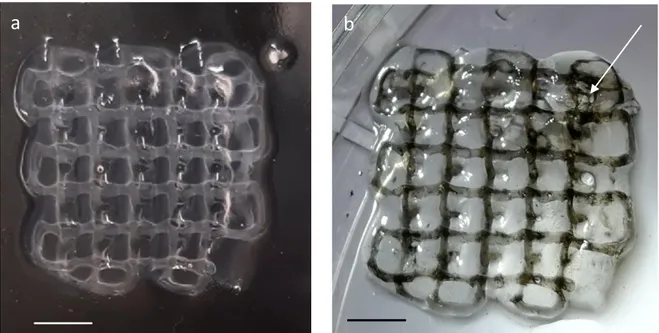
La tecnica presentata ha portato alla creazione di canali micrometrici all’interno dello scaffold. In figura 6a è possibile osservare il costrutto stampato in seguito alla gelazione in frigorifero a 4°C: il materiale A50G50 è apprezzabilein trasparenza; all’interno, di un colore più biancastro, si può notare il reticolo in Pluronic, sciolto per la bassa temperatura. I canali creatisi dopo la rimozione del Pluronic sono stati iniettati con un inchiostro nero, in modo tale da facilitarne la visibilità e verificare l’assenza di ostruzioni lungo i canali. La freccia bianca in figura 6b indica il punto dal quale è stato aspirato il Pluronic ed, in seguito, iniettato l’inchiostro, causando una frattura nello scaffold. Il diametro dei canali misurato è pari a 0,77± 0,11 mm.
Figura 6: a) costrutto ottenuto in seguito alla gelazione a 4°C: in trasparenza si osserva il reticolo in Pluronic (scale bar = 5 mm); b) costrutto vascolarizzato ottenuto in seguito alla rimozione del Pluronic per aspirazione tramite microsiringa ed iniezione di inchiostro all’interno dei canali. In alto a destra, la freccia bianca indica il punto di inserimento della siringa (scale bar = 5 mm).
xv
Discussioni
La fabbricazione di uno scaffold vascolarizzato tramite tecnologia di 3D bioprinting ha richiesto, prima di tutto, la selezione di una composizione di idrogelo stampabile, ovvero con una viscosità tale da permettere l’estrusione in forma di filamento e il mantenimento della geometria desiderata una volta depositato. Dal momento che la deposizione tramite stampa 3D avviene strato su strato, è altrettanto importante che il costrutto possa mantenere la forma progettata senza collassare in seguito alla stampa. Per l’ottenimento di queste caratteristiche è stata individuata una composizione denominata A50G50 (alginato (4%w/v), gelatina 10% (w/v), miscelati in rapporto 1:1), la cui reticolazione tramite CaCl2 (2%w/v)
gocciolato sopra il costrutto, ne permette la rapida gelazione nella forma desiderata. Tale composizione di idrogelo ha presentato come principale limitazione la veloce degradazione, misurata in un tempo di 24 ore dall’incubazione. La veloce cinetica di degradazione potrebbe essere legata all’alta quantità di gelatina presente nel blend e a scelte sperimentali, come l’utilizzo del PBS, il quale facilita il rilascio di ioni Ca++ da parte
dell’alginato.
La realizzazione dello scaffold richiede, inoltre, l’individuazione e l’impostazione dei parametri di processo per l’ottimizzazione della stampa del biomateriale scelto: pressione di estrusione, velocità di spostamento della testina di stampa, temperatura e diametro del puntale sono alcuni dei parametri che influenzano la deposizione del filamento. Per la stampa del biomateriale A50G50 è stata individuata una finestra di temperature tra i 22°C e i 27°C alle quali è possibile la deposizione di un filamento dalla forma definita. La velocità di stampa selezionata è compresa tra i 10 mm/s e i 15 mm/s: a parità di pressione, velocità inferiori causano un aumento del diametro del filamento, velocità superiori possono provocare la frammentazione del filamento. L’idrogelo A50G50 ha una viscosità tale da poter essere stampato con un puntale 22G producendo un filamento dal diametro regolare; l’utilizzo di un puntale di diametro minore (25G), oltre a necessitare pressioni di estrusione maggiori, fornisce un filamento irregolare.
Lo scaffold vascolarizzato (20×20×1 mm3) è stato realizzato tramite tecnologia di 3D bioprinting a due testine di stampa. Con una testina è stato stampato l’idrogelo A50G50, con
xvi
la seconda testina il materiale sacrificale (Pluronic F-127, Cellink). Il g-code, leggibile dalla 3D bioprinter, è stato generato con il software Cellink HeartWare (fig. 7a).
Questa tecnica ha permesso la realizzazione di uno scaffold provvisto di canali micrometrici (ø ~ 0,77 mm) interconnessi (fig. 7b). Il diametro ottenuto è molto maggiore rispetto al diametro dei capillari (ø ~ 10 µm), tuttavia un primo passo verso la realizzazione di canali di diametro inferiore, potrebbe essere quello di variare i parametri di pressione e velocità di deposizione del Pluronic o di utilizzare un puntale di diametro inferiore, come un puntale 27G (ø = 200 μm).
Conclusioni e sviluppi futuri
La tecnica di bioprinting per la vascolarizzazione di scaffold tramite l’utilizzo di un materiale sacrificale, si è dimostrata efficace nell’obbiettivo preliminare di creazione di canali all’interno dello scaffold.
Sviluppi futuri potrebbero essere incentrati sulla modifica del blend di alginato e gelatina, in modo tale da consentire una più lenta degradazione dello scaffold. Per quanto riguarda la tecnica presentata, ulteriori sviluppi potrebbero essere indirizzati verso la fabbricazione di un’appropriata camera in cui stampare il costrutto e rimuovere direttamente il materiale sacrificale, evitando il processo poco efficiente di aspirazione manuale tramite microsiringa. La camera dovrebbe garantire, inoltre, la successiva perfusione dello scaffold. Infine, la geometria dei canali dovrebbe essere ottimizzata per garantire una perfusione adeguata nell’eventualità di una futura applicazione cellulare.
Figura 7: Confronto tra modello e scaffold realizzato: a) visualizzazione in g-code del modello di scaffold vascolarizzato; b) scaffold vascolarizzato ottenuto tramite 3D bioprinting (scale bar = 5 mm).
xvii
Abstract
IntroductionTissue engineering is an emerging discipline of biomedical engineering aimed at developing therapies to regenerate, improve or substitute tissues and organs. One of the main challenges of tissue engineering is the lack of vascularization in the engineered tissues: a vascularization network is necessary to supply cells with nutrients and oxygen and to remove catabolite after the implant. Cells survival and activity in living tissues are enabled by the capillaries network (ø ~10 μm); the maximum distance between capillaries is approximately 200 μm, which corresponds to the diffusion limit of oxygen; beyond this distance, the exchange of nutrients and waste can hardly occur. For this reason, tissues and organs with thickness over 400 μm need a vascularization system. Successes of tissue engineering are limited to avascular tissues (cartilage) or tissue with a low thickness (skin, cornea and bladder).
Among the existing strategies applied to promote tissues angiogenesis, in vitro pre-vascularization is an emerging technique targeted to the creation of a vascular network before the implant. In this contest, bottom-up strategies like 3D bioprinting, are particularly interesting because of the controlled deposition of biomaterial and cells and the possibility to fabricate tissues with complex composition and architecture.
The biomaterials used by this technology are mainly hydrogels, because of the ability to mimic the extra cellular matrix environment and to promote cellular adhesion and proliferation.
The object of the present work of thesis is to obtain the pre-vascularization of a scaffold using a technology of 3D micro-extrusion Bioprinting. This technique will be used to fabricate a hydrogel construct and, at the same time, to incorporate a sacrifical hydrosoluble network for the creation of microchannels inside the scaffold.
xviii
Material and Methods Hydrogel synthesis
For the synthesis of the hydrogel necessary for the fabrication of the scaffold, it was followed the procedure described in Chung et al [1], describing the preparation of an alginate-gelatin blend; however, this protocol was modified to obtain an increased hydrogel viscosity. For the final choice of the composition the following hydrogels were synthetized:
A. 4% (w/v) alginate, 10%(w/v) gelatin blended at 4:1 ratio (labelled A80G20); B. 4% (w/v) alginate, 10%(w/v) gelatin blended at 1:1 ratio (labelled A50G50); C. 4% (w/v) alginate, 10%(w/v) gelatin blended at 1:1 ratio (labelled A20G80). Alginate chemical reticulation was performed to increase the mechanical properties of the hydrogel. For this purpose, two different techniques were experimented:
- External crosslinking: this reticulation was carried out using calcium chloride (CaCl2, 2% (w/v)); the solution was dripped upon the hydrogel using a syringe;
- Internal crosslinking: this reticulation was performed using calcium carbonate (CaCO3) combined with GDL.
The hydrogel was characterized by performing a swelling and a degradation test to evaluate the swelling capacity and the stability of the hydrogel over time.
Design and fabrication of the hydrogel
The scaffold was dimensioned using CAD software (Solidworks); the stl. file was processed using Cellink HeartWare software (Cellink) to generate the g-code file. This code was further edited to obtain the code to be executed by the 3D bioprinter.
The printing was executed using a pneumatic-based extrusion 3D Bioprinter (INKREDIBLE+, Cellink). The following parameters were analysed in order to optimize the printing process:
- Temperature [°C]: observations on the deposition of the hydrogel at temperature ranging between 19°C and 27°C;
- Velocity [mm/s]: evaluation of the relationship between velocity of the printhead and diameter of the strand extruded (velocity ranging between 5 mm/s and 20 mm/s);
xix
- Nozzle diameter [μm]: evaluation of the influence of the nozzle diameter on the printed strand.
- Pressure [kPa]: considerations on the pressure-temperature and pressure-nozzle diameter relationship.
To analyse the variation of the diameter of the strands, the software ImageJ was applied to measure the diameter.
Synthesis of vascular network
The fabrication of the vascularized scaffold was achieved using the combined action of two printhead of the 3D Bioprinter for the deposition of the hydrogel (A50G50) and the incorporation of the sacrificial network. Pluronic F127 (Cellink) was used as a sacrificial material due to its property of reverse thermal gelation, which allows the dissolution at a temperature of 4°C.
The scaffold (20×20×1 mm3) was modelled to obtain the deposition of four layers of A50G50 hydrogel, followed by two layers of Pluronic and four additional layers of A50G50 (Figure 1).
The final experimental protocol used to achieve the formation of the channels inside the hydrogel construct can be summarised in the steps below:
- Generation of the g-code for two-nozzle bioprinting;
Figure 1: g-code visualization of the scaffold (20×20×1 mm3) generated with the HeartWare software. The blue geometry corresponds to the movement performed by the first printhead; the yellow one, visible in the middle of the volume, shows the movement of the second printhead.
xx
- Bioprinting of the two materials: the first cartridge was loaded with A50G50 hydrogel; the second one was loaded with Pluronic F127;
- External reticulation of the hydrogels by means of CaCl2 (2% w/v) for 5 minute;
- Storing of the scaffold in the fridge at 4°C for 15 minutes to obtain the dissolution of Pluronic F127;
- Evacuation of Pluronic applying light vacuum through the use of a microsyringe. Once completed, black ink was injected into the channels in order to visualize the microchannel array.
xxi
Results
Hydrogels synthesis
The three hydrogels were extruded in a Petri dish (Figure 2). Hydrogel A80G20 appeared having low viscosity and collapsed in the Petri dish, this is likely due to the high percentage of alginate; hydrogel A20G80 is fragile and is prone to fragmentation, with this being due to the elevate quantity of gelatin; hydrogel A50G50 shows features in-between the two gels described above: it can be extruded through a syringe and, once deposited, it maintains the shape of a strand.
The internal and external reticulation performed on A50G50 hydrogel lead to the following considerations:
- The external reticulation (CaCl2 (2%w/v)) allows for the rapid crosslinking of the
alginate. Once reticulated, the hydrogel shows improved mechanical properties; - The internal reticulation (CaCO3 (20 mM), GDL (40 mM)) induces a slower and
more homogenous crosslinking, but the hydrogel appears to be more fragile.
A50G50 composition was selected due to the promising properties of printability and will be used in the subsequent paragraphs.
The swelling test carried out on A50G50 is pointed out in figure 3: the weight rapidly increases in the first two hours of incubation (+28% after one hour, +37% after two hours), to stabilize (plateau) around the +40% in three/four hours post-incubation.
A80G20 A50G50 A20G80
Figure 2: Characteristics of the three gels extruded by syringe at room temperature. The percentual composition is showed top right in the picture.
xxii
The stability test showed the fast degradation of the hydrogel in 24 hours. Design and fabrication of the hydrogel
Printing temperature
The printing tests at different temperature are shown in figure 4. It is possible to observe differences in the diameter and regularity of the printed strand as a function of the printing temperature. 19 °C 27°C °C 25 °C 25°C 22° C
Figure 4: Hydrogel A50G50 printed on two layers at different temperature. The printing temperature is showed lower left.
xxiii Printhead velocity and nozzle diameter
The graphs in figure 5 show the diameter of the printed strand as function of the printhead velocity. Graph 5a refers to the printing test executed with a 22G nozzle, at a pressure of 95kPa; Graph 5b refers to the printing test executed with a 25G, at a pressure of 200 kPa. Both graphs show a decrease of the diameter size with the increasing of the printhead velocity.
Figure 5: Strand diameters in function of the printhead velocity: a) data obtained at a pressure of 95 kPa, at 23°C temperature, using a 22G nozzle (ø = 410 μm); b) data obtained at a pressure of 200 kPa, at 23°C temperature, using a 25G nozzle (ø = 250 μm).
22G Nozzle
25G Nozzle
(a)
xxiv
Synthesis of vascular network
The method discussed above, lead to the successful synthesis of micrometric channels inside the scaffold. In figure 6a, is shown the printed construct after the period of gelation in the refrigerator at 4°C: A50G50 hydrogel can be appreciated in transparency; inside, with a whitish colour, is visible the network of liquefied Pluronic due to the low temperature. After the removal of Pluronic, the channels were injected with a black ink to allow for the vision of the micro channel network and to verify the absence of obstructions along the channels. The white arrow in figure 6b, shows the point from which the Pluronic was evacuated and subsequently the black ink was injected causing a fracture in the scaffold. The diameter of the channels measured is approximately 0,77±0,11 mm.
Figure 6: a) construct obtained following the gelation at 4°C: the Pluronic network has a pale white colour (scale bar=5mm); b) vascularized construct obtained following to the removal of Pluronic. The material was removed with a micro-syringe and the channels were subsequently injected with a black ink. At the top right, the arrow shows the point where the micro-syringe was inserted.
xxv
Discussion
The fabrication of the vascularized scaffold through 3D bioprinting technology required the selection of a hydrogel composition compatible with the process of printing, meaning a viscosity level allowing hydrogel extrusion in the shape of a strand and maintaining of the desired geometry. Because bioprinting is a layer by layer process, it is important that following to the printing process, the construct can preserve its own structure without collapsing. To obtain these critical characteristics, hydrogel A50G50 (4% w/v alginate, 10% w/v gelatin blended at 1:1 ratio) was selected due to the promising properties of printability, while the technique of external reticulation (CaCl2, (2%w/v)) was chosen because it allowed
the fast gelation of alginate, with the maintenance of the desired shape.
This hydrogel composition, while being suitable for printing, showed a rapid degradation, as demonstrated from a 24 hours degradation study under incubation at 37°C. The fast degradation kinetic could be explained by to the high quantity of gelatin in the blend; or by the experimental choice of using the PBS as a medium in which the samples were soaked: this kind of buffer solution is known to facilitate the release of Ca++ ions from the alginate. The fabrication of the scaffold required the identification and the tuning of the operating parameters to optimize the printing of the selected biomaterial: pressure, printhead velocity, temperature and nozzle diameter are the key variables that control the deposition of the strand. For the bioprinting of A50G50 was identified a temperature window in between 22°C and 27°C at which it is possible to obtain the deposition of the strand in a defined shape. The printhead velocity was selected is between 10 mm/s and 15 mm/s; for a given pressure, lower velocities typically cause an increase of the strand diameter, while higher velocities may provoke the fragmentation of the strand. A50G50 has a viscosity appropriate for the printing with a 22G nozzle producing a homogenous strand; the use of a nozzle with smaller diameter (25G) requires higher extrusion pressures and generates an irregular fibre.
The vascularized scaffold (20×20×1 mm3) was achieved through a multi-nozzle 3D
bioprinting technology. The first printhead was used to print A50G50 hydrogel, while the second one was used to extrude the sacrificial material (Pluronic F127, Cellink). The g-code, readable by the 3D bioprinter, was generated with the Cellink HeartWare software (fig. 7a).
xxvi
This method allowed the fabrication of a scaffold with a network of interconnected micrometric channels (ø ~ 0,77 mm). It should be noted that the diameter obtained was significantly higher than the capillaries ones (ø ~ 10 µm), however, this could be improved by modulating the pressure and velocity parameters for the extrusion of Pluronic or by using a much smaller nozzle diameter, for example a 27G (ø = 200 μm).
Conclusions and future developments
The 3D Bioprinting technique for scaffold vascularization using a sacrificial material demonstrated to be effective for the creation of microchannels inside the scaffold.
Future developments should focus on the modification of the alginate-gelatin blend in order to obtain a slower degradation of the scaffold.
In terms of experimental settings, future work could be addressed to the production of an custom chamber for the printing of the construct and for the direct removal of the sacrificial ink, eliminating the process of manual removal through micro-syringe. The chamber should also allow for the subsequent perfusion of the scaffold.
Finally, the channels geometry should be optimized to ensure an adequate perfusion in the future eventuality of a cellular application.
Figura 7: Comparison between the g.code model and the obtained scaffold. a) g.code visualization of the model generated with the Cellink HeartWare software; b) vascularized scaffold obtained through 3D bioprinting (scale bar = 5 mm).
1
Introduzione
1.1 Medicina rigenerativa ed ingegneria dei tessuti
La medicina rigenerativa è una branca della medicina che racchiude una serie di terapie innovative finalizzate ad ottenere la sostituzione e la rigenerazione di cellule, tessuti o organi danneggiati. Questo disciplina è stata inizialmente concepita per far fronte alla cosiddetta “crisi dei trapianti”, cioè il progressivo ampliamento del gap tra il numero di pazienti in lista d’attesa per trapianto d’organo e il numero limitato di donatori disponibili [2], [3]. Gli svantaggi delle attuali terapie di trapianto sono legati, non solo al progressivo allungamento delle liste d’attesa, ma anche alle complicanze del rigetto immunologico. Per questo, recenti sviluppi ottenuti nel campo della medicina rigenerativa, mirano a concretizzare nuove alternative alla donazione e trapianto d’organo.
Le strategie di medicina rigenerativa hanno lo scopo di attivare e accelerare il processo di guarigione intrinseco del corpo, utilizzando tre fondamentali componenti [4] :
- Cellule; - Scaffold;
- Biosegnali (chimici e/o fisici).
Per scaffold si intende genericamente un biomateriale destinato a fare da struttura di supporto per la semina di cellule e occasionalmente addizionato di biomolecole; inoltre, tale costrutto, può essere sottoposto a stimoli fisici tramite dispositivi chiamati bioreattori [5].
A causa delle diverse capacità rigenerative degli organi, alcuni tessuti possono richiedere solo biomateriali e biosegnali, altri, con capacità limitate di rigenerazione, necessitano di cellule, biomateriali e biomolecole [2]. In quest’ultimo caso, la disciplina è identificata con il termine “ingegneria dei tessuti”, che si basa sul ciclo preparatorio rappresentato in Figura 1.1 [6]. Le cellule sono rimosse dal paziente, espanse in vitro, seminate nello scaffold,
2
coltivate e sottoposte a stimoli chimici e fisici ed infine reimpiantate nel paziente come tessuto ingegnerizzato.
1.1.1 Cellule per l’ingegneria dei tessuti
Le fonti cellulari utilizzate in medicina rigenerativa possono essere classificate in base alla loro immunogenicità, ovvero alla capacità di provocare una risposta immunitaria nel paziente. Si distinguono in:
- cellule autologhe: sono cellule che derivano dal paziente stesso e pertanto al loro utilizzo è genericamente associata una bassa risposta immunogenica;
- cellule allogeniche: sono cellule che derivano da un donatore umano, in grado di provocare risposta immunitaria nel paziente. Il loro utilizzo spesso comporta l’uso di immunosoppressori;
- cellule xenogeniche: sono cellule che derivano da una specie diversa e pertanto in genere altamente immunogeniche.
Se da una parte l’utilizzo di cellule autologhe evita l’utilizzo di immunosoppressori, dall’altro alcune fonti cellulari non possono essere prelevate direttamente dal paziente, ad esempio tramite biopsia. Diversamente, le cellule allogeniche sono di più facile reperibilità
3
perché possono essere fornite da banche di cellule, ma il loro uso può indurre una risposta immunogenica nel paziente.
Nuove fonti cellulari per la medicina rigenerativa sono ricercate tra le cellule staminali, che possiedono due fondamentali caratteristiche: l’autorinnovamento, ovvero la capacità di riprodursi a lungo senza differenziarsi e la potenza, cioè la capacità di dare origine a linee cellulari specializzate.
Le cellule staminali utilizzate dall’ingegneria dei tessuti possono essere a loro volta suddivise in sottogruppi:
- cellule staminali embrionali (ES): cellule isolate dal blastocista, cioè l’embrione umano ai primi stadi di sviluppo;
- cellule staminali pluripotenti indotte (iPs): cellule ottenute tramite riprogrammazione genetica di cellule somatiche adulte;
- cellule staminali adulte: cellule staminali presenti in tutti i tessuti del corpo [2], [3].
1.1.2 Scaffold
Inizialmente pensato come supporto strutturale per le cellule, lo scaffold serve anche per incorporare fattori biochimici che promuovono la funzionalità cellulare e la rigenerazione del tessuto [4]. Gli scaffold per l’ingegneria dei tessuti devono soddisfare diversi requisiti fondamentali:
- Biocompatibilità e biodegradabilità: il biomateriale non deve evocare una reazione infiammatoria non fisiologica o effetti tossici successivi all’impianto; la velocità di degradazione e di riassorbimento devono essere tali da ricombinarsi con la rigenerazione del tessuto;
- Proprietà meccaniche corrispondenti a quelle dei tessuti presenti nel luogo di impianto;
- Architettura dello scaffold: lo scaffold deve possedere alta porosità con pori interconnessi per permettere la crescita cellulare, la diffusione dei nutrienti e l’eliminazione dei cataboliti.
- Bioattività: le proprietà di superficie devono favorire l’adesione, la differenziazione e la proliferazione cellulare [7].
4
I criteri di selezione del biomateriale utilizzato nella preparazione di uno scaffold dipendono dall’applicazione finale e dai criteri di design. I biomateriali naturali (collagene, chitosano, acido ialuronico ecc.) hanno il vantaggio di essere biocompatibili, non tossici e di promuovere l’adesione e la proliferazione cellulare; di contro hanno una limitata stabilità meccanica e problemi di reperibilità in grandi volumi; al contrario, i biomateriali sintetici (PGA, PLA, PGLA, ecc.), sono riproducibili su larga scala con proprietà controllate, mentre la bassa biocompatibilità può essere compensata da modifiche di superficie [8].
1.1.3 Bioreattori
Dopo aver cellularizzato lo scaffold, è necessario un periodo di sviluppo cellulare in vitro prima dell’impianto in vivo. Le tradizionali condizioni di coltura statica sono caratterizzate da bassa efficienza e basso trasporto di nutrienti, ossigeno e sostanze di scarto. I bioreattori mirano a superare tali limitazioni ed hanno un ruolo chiave nell’implementazione di colture dinamiche per l’ingegneria dei tessuti [2].
I bioreattori sono dispositivi che consentono lo svolgimento di processi biochimici e biologici in condizioni ambientali ed operative monitorate e controllate, in termini di pH, temperatura, pressione, flusso di nutrienti, concentrazione di metaboliti e cataboliti.
Le caratteristiche dei bioreattori sfruttabili nell’ambito dell’ingegneria dei tessuti sono: - L’applicazione di stimoli biofisici controllati e riproducibili al costrutto durante lo
sviluppo;
- Monitoraggio on-line dei parametri chimico-fisici della coltura; - Semina dinamica efficiente ed omogenea all’interno del costrutto;
- Aumento del trasporto di massa dal terreno di coltura ai costrutti ingegnerizzati [9].
1.1.4 Problematiche dell’ingegneria dei tessuti: la vascolarizzazione dei
tessuti
Uno dei principali ostacoli dell’ingegneria dei tessuti risiede nel riprodurre in vitro la complessità fisiologica di un tessuto vascolarizzato[10]. La maggior parte dei tessuti sono vascolarizzati e il loro funzionamento dipende dalla diffusione di nutrienti ed ossigeno, e dalla rimozione dei prodotti di scarto [11]. Mentre in vitro è possibile fornire nutrienti alle cellule mediante tecniche di perfusione artificiale, in vivo il tessuto impiantato dovrà
5
dipendere da una rete vascolare. In seguito all’impianto, la vascolarizzazione inizia, in parte come conseguenza di una risposta infiammatoria generata dall’introduzione di un corpo estraneo, in parte in seguito alla secrezione di fattori angiogenici da parte di cellule sottoposte ad un ambiente povero di ossigeno. Questo processo spontaneo dura giorni o settimane, lasciando il tessuto privo di nutrienti ed ossigeno per un tempo considerevole. Al fine di diminuire il tempo necessario alla vascolarizzazione, gli sforzi dei ricercatori si sono concentrati sulla creazione di tessuti prevascolarizzati. Tali network vascolari devono assicurare la distribuzione di nutrienti a tutte le cellule, tenendo conto che fisiologicamente la massima distanza tra i capillari corrisponde a 200 μm, che è correlata al limite di diffusione dell’ossigeno [11], [12]. Per questo motivo, i successi nel campo dell’ingegneria dei tessuti sono limitati a tessuti avascolari (cartilagine) o tessuti a basso spessore (pelle, vescica), mentre tessuti più complessi e metabolicamente attivi, come cuore, fegato e reni, necessitano di un sistema di vasi sanguigni ramificato che permetta la sopravvivenza cellulare [10], [13]. Ad esempio, gli epatociti, le cellule del fegato, sono particolarmente sensibili all’ipossia e alla mancanza di nutrienti. Sono, infatti, irrorati da capillari sinusoidi, dotati di ampie aperture nell’endotelio, che espongono maggiormente gli epatociti al flusso di sangue [14]. In un approccio descritto da Miller et al. [15], è stato dimostrato che la fabbricazione di canali vascolari all’interno del costrutto ingegnerizzato è in grado di supportare la vitalità e la funzione metabolica di epatociti primari di ratto, impedendo la necrosi delle cellule poste all’interno [15].
Allo stesso modo, per l’ingegnerizzazione del tessuto muscolare, la mancanza di un’adeguata vascolarizzazione risulta uno dei principali fattori limitanti. È stato dimostrato che i mioblasti, le cellule muscolari, necessitano di essere ad una distanza non inferiore a 150 μm dai capillari per ottenere un adeguato rifornimento di ossigeno e nutrienti; un’insufficiente vascolarizzazione porta, infatti, alla perdita di funzionalità del tessuto [16]. In uno studio di Yao et al. [17] viene proposta una tecnica per la vascolarizzazione del tessuto adiposo. Si ritiene, infatti, che il principale motivo di necrosi nei graft di tessuto adiposo sia legato alla mancanza di angiogenesi, cruciale per i lipociti.
6
1.2 Il sistema vascolare
Il sistema vascolare (o sistema circolatorio) umano è composto da un grande numero di vasi sanguigni ed è responsabile del trasporto di sangue alle cellule. La primaria funzione di questo sistema è il trasporto di nutrienti e la rimozione dei prodotti di scarto metabolici, permettendo il mantenimento dell’omeostasi cellulare.
1.2.1 Struttura e composizione dei vasi sanguigni
I vasi sanguigni sono organizzati in tre strati concentrici o tuniche. Lo strato più interno, o
tunica intima, è costituito da uno strato di cellule endoteliali (ECs) circondate dal tessuto
connettivo della membrana basale e da fibre elastiche; lo strato intermedio è la tunica media, che contiene soprattutto cellule della muscolatura liscia e fibre elastiche; lo strato più esterno, o tunica adventitia, è costituita da fibroblasti immersi in tessuto connettivo. Il numero di strati e lo spessore dipendono dalla funzione svolta dai vasi (Figura 1.2) [11], [18].
Il sangue ossigenato è espulso da ventricolo sinistro per essere immesso nelle arterie, che si possono classificare in elastiche e muscolari. Le arterie elastiche si trovano vicino al cuore o altri organi e sono ricche di fibre elastiche perché adibite ad accogliere grandi volumi di sangue; le arterie muscolari, ricche di cellule muscolari, permettono la distribuzione di sangue verso la periferia del sistema circolatorio. Le arteriole costituiscono il luogo di maggiore regolazione del flusso sanguigno grazie alla presenza di fibre muscolari che ne permettono la variazione del diametro. La riduzione del flusso evita il danneggiamento dei
capillari, ovvero i vasi che connettono il sistema arterioso al sistema venoso. I capillari (ø ~
4-10 μm) sono formati da un sottile layer di cellule endoteliali ed hanno come funzione primaria lo scambio di sostanze tra il sangue ed i tessuti. I capillari possono essere classificati in continui, fenestrati e sinusoidi.
I capillari continui sono costituiti da uno strato continuo di cellule endoteliali che permettono il passaggio di acqua e ioni e sono trovati in molti organi come muscoli, polmoni, pelle. I capillari fenestrati presentano pori (ø ~ 20-120 nm) che permettono la diffusione di piccole molecole e di alcuni tipi di proteine. Si trovano comunemente nei reni, nell’intestino nelle ghiandole endocrine. Infine, i capillari sinusoidi, sono un particolare tipo di capillari fenestrati con larghe aperture nell’endotelio (ø ~ 30-40 μm) che permettono il passaggio
7
delle cellule del sangue e di proteine. Sono trovati nel fegato, nel midollo osseo, nelle ghiandole endocrine.
Il sangue deossigenato ritorna al cuore transitando dai capillari alle venule caratterizzate dalla presenza della muscolatura liscia e da uno strato di collagene e fibre elastiche.
Infine, le vene, esposte a bassa pressione, sono caratterizzate da pareti sottili e da valvole “a nido di rondine”, che permettono di evitare il reflusso del sangue in direzione opposta [11], [18], [19].
1.2.2 Vasculogenesi ed angiogenesi
I due principali meccanismi coinvolti nella formazione dei vasi sanguigni sono la
vasculogenesi e l’angiogenesi. La vasculogenesi avviene durante lo sviluppo embrionale e
consiste nell’assemblamento de novo di vasi sanguigni; allo stesso modo, si ritrova nell’età adulta relativamente al processo di guarigione di un tessuto e alla crescita tumorale. Durante la vasculogenesi, gli angioblasti (precursori delle ECs) differenziano in cellule endoteliali e proliferano in un tessuto precedentemente non vascolarizzato per formare un network di capillari. L’angiogenesi consiste nella formazione di vasi da un network vascolare
8
preesistente; i nuovi vasi possono germogliare da capillari preesistenti (sprouting
angiogenesis) o possono generarsi in seguito ad un processo di divisione in cui gli elementi
interstiziali del tessuto invadono un vaso duplicandolo (intussusceptive angiogenesis) [11], [12]. Nel secondo caso, l’angiogenesi risulta in una più rapida modifica del network vascolare precedente, tramite la riorganizzazione di ECs e la mobilizzazione di precursori delle cellule endoteliali [20]. L’angiogenesi è innescata principalmente dai livelli di pressione parziale dell’ossigeno: tessuti in ipossia secernono fattori di crescita che attivano lo sviluppo e il rimodellamento vascolare [12].
9
1.3 Bioprinting per la fabbricazione di costrutti vascolarizzati
Una delle maggiori problematiche che si incontrano nel processo di ingegnerizzazione di tessuti funzionali è la difficoltà di creare una sufficiente vascolarizzazione del costrutto, che consenta la sopravvivenza delle cellule introdotte all’interno di scaffold 3D tramite un’adeguata ossigenazione, rilascio di nutrienti ed eliminazione di cataboliti.La prevascolarizzazione in vitro nasce con l’obiettivo di integrare all’interno del costrutto un network vascolare precedente all’impianto, così da promuovere la sopravvivenza del tessuto e accelerarne la rigenerazione [10].
In questo capitolo, è presentata una panoramica generale delle tecniche utilizzate per la fabbricazione di costrutti ingegnerizzati con particolare riguardo per l’innovativa tecnica di 3D Bioprinting. La prevascolarizzazione tramite 3D Bioprinting è una strategia emergente che ancora richiede l’ottimizzazione di diverse componenti: le tecniche di Bioprinting, i biomateriali, le fonti cellulari e le strategie di prevascolarizzazione giocano un ruolo cruciale nel determinare il successo del costrutto.
1.3.1 Tecnologie di Bioprinting
Il 3D Bioprinting è una tecnica di 3DP in grado di produrre strutture costituite da cellule, biomateriale e biomolecole. Obiettivo centrale di questa tecnica è fornire alle cellule un ambiente in grado di riprodurre la complessa microarchitettura dell’ECM per lo svolgimento delle funzioni biologiche. Inoltre, il processo controlla la distribuzione spaziale delle cellule, posizionate in maniera omogenea, così come la struttura dello scaffold, mantenendo in questo modo la vitalità e la funzionalità cellulare tramite l’utilizzo di materiali biocompatibili. I biomateriali utilizzati sono fondamentalmente idrogeli che, dato l’alto contenuto di acqua, risultano candidati attraenti per l’incapsulamento di cellule e molecole bioattive.
Il 3D Bioprinting utilizza tre principali tecnologie per il deposito e design dello scaffold: inkjet, microextrusion e laser-assisted bioprinting (Figura 1.3)[21], [22].
1.3.1.1 Inkjet bioprinting
L’inkjet bioprinting è la tecnologia più comunemente usata, in cui volumi controllati (nell’ordine dei picolitri) di bioink vengono rilasciati su un substrato in una posizione
10
predefinita. Questa tecnica utilizza diversi principi per rilasciare microgocce di liquido, come mostrato in Figura 1.3a: nell’inkjet printing piezoelettrico l’attuatore, costituito da un cristallo piezoelettrico, trasferisce un impulso meccanico all’idrogelo che viene forzato attraverso un ugello; l’inkjet termico, invece, usa un elemento riscaldante che crea delle bolle di vapore nell’idrogelo la cui rapida espansione fornisce la pressione necessaria per l’espulsione delle gocce [21], [23].
L’inkjet bioprinting è caratterizzato da un’alta risoluzione, alta velocità di stampa e basso costo; di contro, per permettere la deposizione in gocce, il limite superiore di viscosità dei biomateriali utilizzabili risulta basso.
1.3.1.2 Laser-assisted bioprinting
L’apparato di base è costituito da tre parti principali: un fascio laser, una piattaforma “donatrice” e una piattaforma “ricevente” (Figura 1.3c).
Il fascio laser incide sulla piattaforma “donatrice”, solitamente in vetro, coperta da uno strato di oro o titanio assorbente la radiazione. Il fascio laser determina l’evaporazione locale dello strato assorbente, che genera, a sua volta, una pressione sullo strato sottostante, contenente il bioink carico di cellule, e ne provoca la spinta verso il collettore (substrato ricevente). Laser bioprinting fornisce una deposizione precisa di un’alta densità di cellule, senza effetti negativi sulla vitalità cellulare; l’alta risoluzione, d’altra parte, richiede una rapida gelazione per il mantenimento della forma [21].
Figura 1.3: Tecnologie di inkjet, laser-assisted e microextrusion bioprinting. (a) inkjet bioprinting: sistema di estrusione di piccoli volumi di bioink tramite un attuatore piezoelettrico o un elemento riscaldante; (b) microextrusion bioprinting: sistema di estrusione di filamenti continui di materiale tramite sistemi pneumatici, a pistone o a vite; (c) Laser-assisted bioprintig: un fascio laser incide su un substrato assorbente, generando una pressione che incide sullo strato sottostante contenente il bioink e spingendolo verso il collettore (Murphy et al. [21]).
11
1.3.1.3 Microextrusion Bioprinting
La tecnica di microextrusion bioprinting consiste nell’estrusione di biomateriale carico di cellule per la fabbricazione di scaffold strato su strato. Nel dettaglio, il dispositivo è costituito da un sistema di estrusione controllato in temperatura ed una piattaforma in grado muoversi sul piano xy e/o sull’asse z; alcuni sistemi utilizzano più testine di stampa per il rilascio di diversi bioink. In base alla forza applicata nella testina di stampa, l’erogazione può avvenire tramite un sistema pneumatico o meccanico (pistone o vite), come mostrato in Figura 1.3b.
Il sistema di micro-estrusione è compatibile con un’ampia gamma di biomateriali con viscosità comprese tra i 30 mPa/s e i 6×107 mPa/s ed è in grado di depositare un’alta
concentrazione di cellule, garantendo l’integrità strutturale del costrutto grazie ad una deposizione continua di bioink. La risoluzione, invece, risulta inferiore rispetto alle tecnologie di bioprinting descritte in precedenza, così come la vitalità cellulare, probabilmente a causa dello sforzo di taglio a cui sono sottoposte le cellule durante il passaggio attraverso l’ugello.
Le caratteristiche delle tecniche di bioprinting descritte sono riassunte più dettagliatamente in Tabella 1.1 [24].
12
1.3.2 Biomateriali per 3D Bioprinting
Le tecniche di Bioprinting utilizzano primariamente gli idrogeli, materiali in grado di fornire alle cellule un ambiente bioattivo similare all’ECM. Gli idrogeli sono network polimerici in grado di rigonfiarsi e trattenere una significativa quantità di acqua all’interno della loro struttura (90-95% del volume) senza essere dissolti. Tale proprietà è dovuta ai gruppi funzionali idrofilici legati alla catena principale, mentre la resistenza alla dissoluzione è fornita dal crosslink, ovvero dalle interazioni tra le catene del network polimerico [25]. Gli idrogeli sono in grado di rispondere ad una grande varietà di stimoli (temperatura, pressione, pH, campo elettrico e magnetico ecc.) mostrando variabilità delle loro caratteristiche chimiche e fisiche; possono, infatti, passare da proprietà “solid-like”, cioè tipiche dei solidi (rigidità, elasticità, forma propria), a “liquid like”, tipiche dei liquidi (diffusività, tensione di vapore, ecc.). Gli idrogeli possono essere divisi in due diverse classi in base al meccanismo di crosslinking:
- Idrogeli chimici o permanenti generati dal comportamento reattivo di molecole che formano legami covalenti tra le catene polimeriche;
- Idrogeli fisici il cui crosslink è caratterizzato da interazioni deboli come legami idrogeno, legami ionici, interazioni idrofobiche; questo tipo di gelazione conferisce agli idrogeli proprietà reversibili [26].
Tra gli idrogeli più utilizzati come bioinks troviamo idrogeli naturali (alginato, gelatina, acido ialuronico, collagene, fibrina), che conferiscono alta vitalità cellulare e velocità di proliferazione, ma bassa riproducibilità dei costrutti e idrogeli sintetici (PHEMA, PVP, PAM, PEO ecc.) che forniscono alle cellule un ambiente inerte, a cui possono essere aggiunti elementi bioattivi [7], [23].
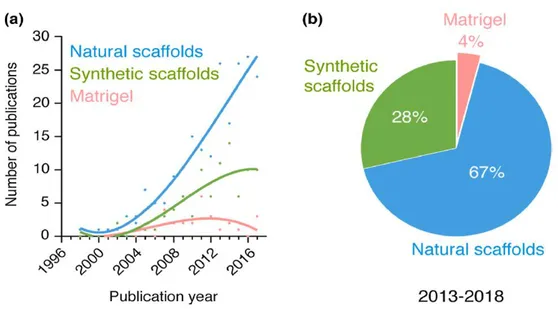
Secondo uno studio di Wang et al. [27], gli scaffold scelti come supporto alla formazione di network vascolari sono principalmente quelli naturali e sintetici, affiancati da costrutti in Matrigel (miscela proteica gelatinosa secreta dalle cellule tumorali di topo) (Figura 1.4). Nel presente lavoro di tesi, per la fabbricazione di scaffold, saranno utilizzati idrogeli naturali di alginato e gelatina, così come idrogeli sintetici in Pluronic. Di seguito ne sono riportate le caratteristiche principali.
13
1.3.2.1 Alginato
L’alginato è un polisaccaride estratto dalla parete cellulare delle alghe brune o da batteri, costituito da due blocchi alternati: l’acido α-L-glucuronico (G) e l’acido β-D-mannuronico (M) tra i quali si formano legami β-1→4-glicosidici [7]. In base alla lunghezza della catena e al rapporto G/M, le caratteristiche fisiche dell’alginato possono essere diversificate: mentre un contenuto maggiore di blocchi M conferisce flessibilità alla struttura, la presenza di unità G aumenta le proprietà meccaniche, oltre che conferire le proprietà di gelazione [28]. L’alginato, infatti, è reticolato chimicamente grazie all’interazione tra i residui G e i cationi divalenti (Ca++, Ba++, Sr++), formando la cosiddetta struttura a “egg-box”, in cui un catione divalente interagisce con quattro gruppi carbossilici, appartenenti due a due a catene di alginato adiacenti [29]. Questa gelazione, detta ionotropica, può avvenire tramite due diversi meccanismi: la reticolazione “esterna” o “interna” (Figura 1.5). Nel primo caso, una soluzione di alginato è fatta gelificare per diffusione di cationi bivalenti da una soluzione esterna (es. soluzione di CaCl2), messa in contatto con la prima; tale gelazione è
caratterizzata da una cinetica veloce e da una reticolazione poco omogenea. Nel secondo caso, un sale di calcio poco solubile in acqua (ad es. CaCO3) è sospeso in una soluzione di
alginato; la gelazione può avvenire solo in seguito alla liberazione di ioni Ca++ in ambiente acido, motivo per cui viene spesso utilizzato un agente acidificante come l’acido
gluconico-Figura 1.4: Classificazione dei materiali usati per la fabbricazione di scaffold nell’ingegneria dei network vascolarizzati: (a) numero di pubblicazioni all’anno relative all’uso di scaffold naturali, sintetici e in Matrigel (pubblicazioni disponibili sul database MEDLINE). (b) percentuale degli studi per tipologia di scaffold nel periodo 2013-2018 (Wang et al. [27]).


![Figura 3: Prova di swelling: andamento della variazione di peso [%] nel tempo dell’idrogelo A50G50](https://thumb-eu.123doks.com/thumbv2/123dokorg/7495612.104116/15.892.209.682.120.427/figura-prova-swelling-andamento-variazione-peso-tempo-idrogelo.webp)