UNIVERSITA’ DI PISA
Corso di Laurea Magistrale in Medicina Veterinaria
Candidato: Delogu Valentina Relatori: Prof. Modenato Mario
Dott. Borghetti Luciano
S
S
o
o
m
m
m
m
a
a
r
r
i
i
o
o
S Soommmmaarriio...2 o R Riiaassssuunntto...3 o I Innttrroodduuzziioonnee::DDiissppllaassiiaaddeellll’’aanncca...4 a C Caappiittoolloo11::RRiicchhiiaammiiddiiaannaattoommiia...5 a 1.1 SUPERFICI ARTICOLARI...5 1.2 FORMAZIONI COMPLEMENTARI...9 1.3 MEZZI DI UNIONE...10 1.4 MOVIMENTI...10 C CaappiittoollooIIII::PPaattooggeenneessiiddeellllaaddiissppllaassiiaaddeellll’’aanncca ...12 a 2.1 FATTORI GENETICI ...14 2.2 FATTORI AMBIENTALI...15 C CaappiittoollooIIIIII::DDiiaaggnnoossiiddeellllaaddiissppllaassiiaaddeellll’’aannccaa ...17 3.1 RILIEVI CLINICI...183.2 ESAME ORTOPEDICO CON PAZIENTE SVEGLIO ...21
3.3 ESAME ORTOPEDICO CON PAZIENTE IN ANESTESIA ...22
3.4 ESAME RADIOGRAFICO...26 3.5 CHD E GENETICA...37 3.6 DIAGNOSI DIFFERENZIALE ...39 C CaappiittoollooIIVV::TTrraattttaammeenntto ...40 o 4.1 TRATTAMENTO CONSERVATIVO...40 4.2 TRATTAMENTO FARMACOLOGICO ...41 4.3 TRATTAMENTO CHIRURGICO...42 C CaappiittoollooVV::LLeepprrootteessiidd’’aanncca...45 a 5.1 PROTESI CEMENTATE ...46
5.2 PROTESI NON CEMENTATE “MODELLO PRESS-FIT”...58
5.3 PROTESI NON CEMENTATA “MODELLO ZURIGO”...67
C CaappiittoollooVVII::MMaatteerriiaalliieemmeettooddi ...82 i R Riissuullttaatti...108 i D Diissccuussssiioonne...110 e C Coonncclluussiioonni ...112 i B Biibblliiooggrraaffiia...114 a R Riinnggrraazziiaammeenntti...122 i
R
R
i
i
a
a
s
s
s
s
u
u
n
n
t
t
o
o
La displasia dell’anca del cane (CHD: Canine Hip Dysplasia) è una patologia degenerativa dell’articolazione coxo-femorale. Essendo una delle più importanti malattie dello sviluppo osseo e delle articolazioni, la CHD è stata ampiamente studiata così come sono stati studiati i vari approcci terapeutici, tra i quali annoveriamo quelli di tipo conservativo, farmacologico e chirurgico.
Il nostro studio prende in esame una particolare tecnica chirurgica: la protesi totale d’anca non cementata “Modello Zurigo”. La tecnica può essere applicata a soggetti a partire da 8-10 mesi d’età, affetti da grave sublussazione della testa femorale e da grave coxartrosi, ormai refrattari al trattamento conservativo e non più idonei ad altri interventi chirurgici preventivi.
Obiettivo del presente lavoro è stato dimostrare come la protesi totale d’anca ripristini la normale funzionalità dell’arto, eliminando il dolore e determinando un deciso miglioramento del benessere del cane.
Parole chiave: displasia dell’anca, protesi dell’anca, protesi cementate, protesi non cementate.
S
S
u
u
m
m
m
m
a
a
r
r
y
y
Canine Hip Dysplasia (CHD) is a degenerative disease of hip joints. Being one of the most important joint and skeletal disease, CHD has been widely studied, together with several therapeutic approaches, either conservative, medical or surgical ones.
The present study examines a special surgical technique: “Zurich cementless” total hip prosthesis. This technique may be performed in patients from 8-10 months old, suffering from severe hip subluxation of the femoral head and coxarthrosis and non-responsive to conservative or medical therapies, or to other preventive surgical techniques.
Aim of the present study was to demonstrate the capacity of “Zurich cementless” prosthesis in restoring the physiological joint function, eliminating pain and improving dog’s quality of life.
I
I
n
n
t
t
r
r
o
o
d
d
u
u
z
z
i
i
o
o
n
n
e
e
:
:
D
D
i
i
s
s
p
p
l
l
a
a
s
s
i
i
a
a
d
d
e
e
l
l
l
l
’
’
a
a
n
n
c
c
a
a
La displasia dell’anca del cane (CHD: Canine Hip Dysplasia) è una patologia degenerativa dell’articolazione coxo-femorale. Il termine displasia significa letteralmente sviluppo imperfetto, dal greco “dys” che significa anormale e “plassein” che significa forma.
La sua incidenza è variabile nelle diverse razze ed è prevalentemente riscontrabile nei soggetti di taglia grande e gigante. E’ ormai accertata l’esistenza di una predisposizione genetica di tipo poligenico. I soggetti predisposti alla nascita hanno articolazioni normali e solo successivamente si sviluppa l’instabilità articolare. In questi soggetti altri fattori, come ad esempio l’attività fisica eccessiva e il rapido incremento ponderale, giocano un ruolo importante nello sviluppo della patologia.
La sintomatologia è caratterizzata principalmente dalle manifestazioni algiche quali: riluttanza ai movimenti, zoppia di grado variabile, riduzione dell’ampiezza di movimento delle articolazioni (ROM) e dolore alla palpazione.
Mentre nel giovane il dolore è imputabile soprattutto ai movimenti anomali del femore rispetto all’acetabolo e al conseguente stato flogistico, nei soggetti adulti e anziani il dolore è dato soprattutto dai processi degenerativi che seguono l’osteoartrite.
La diagnosi viene eseguita in base ai rilievi clinici, all’esame ortopedico e soprattutto all’esame radiografico.
La CHD, essendo una delle più importanti malattie dello sviluppo osseo e delle articolazioni, è stata ampiamente studiata così come sono stati studiati i vari approcci terapeutici, tra i quali annoveriamo quelli di tipo conservativo, farmacologico e chirurgico. Il nostro studio prende in esame una particolare tecnica chirurgica: la protesi totale d’anca non cementata “Modello Zurigo”. La tecnica può essere applicata a soggetti a partire da 8-10 mesi d’età, soggetti affetti da coxartrosi che non rispondono più al trattamento conservativo e non sono più idonei ad altri interventi chirurgici preventivi.
Obiettivo del presente lavoro è dimostrare come la protesi totale d’anca ripristini la normale funzionalità dell’arto, eliminando il dolore e determinando un deciso miglioramento del benessere del cane.
C
C
a
a
p
p
i
i
t
t
o
o
l
l
o
o
1
1
:
:
R
R
i
i
c
c
h
h
i
i
a
a
m
m
i
i
d
d
i
i
a
a
n
n
a
a
t
t
o
o
m
m
i
i
a
a
L’articolazione dell’anca è una enartrosi che unisce il femore al coxale. Questi due segmenti ossei formano un angolo aperto in senso ventro-craniale.
1.1 SUPERFICI ARTICOLARI
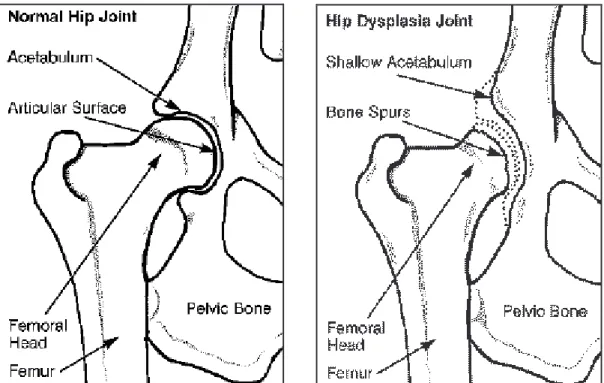
La parte articolare di pertinenza del coxale è l’acetabolo, o cavità cotiloidea, alla cui formazione concorrono le tre ossa della cintura pelvica: ileo, ischio e pube, ed ha la forma di un segmento di sfera rivolto ventro-lateralmente (fig. 1). L’acetabolo è contornato da un ciglio rilevato e circolare, rugoso sul suo versante esterno e liscio su quello interno, il quale appartiene alla superficie articolare; questo rilievo è interrotto ventralmente e caudalmente dall’incisura acetabolare (Incisura acetaboli). Situata al centro dell’acetabolo si trova la fossa acetabolare (Fossa acetabuli), incavata, rugosa e aperta ventralmente dall’incisura acetabolare. La fossa acetabolare è la parte più mediale dell’incavo; è priva di cartilagine articolare ed è l’origine del legamento della testa femorale.
La superficie articolare o semilunare (Facies lunata) è liscia e rivestita di cartilagine ialina e contorna la fossa acetabolare a mo’ di semiluna le cui corna hanno uno sviluppo ineguale: il corno craniale infatti è meno largo. La superficie lunata si articola con la testa femorale. Le due superfici ventrali della superficie lunata non si connettono, ma sono unite dal legamento acetabolare trasverso.
Il femore oppone all’acetabolo la sua testa articolare sferoidale (Caput ossis femoris) che è ricoperta da cartilagine ialina ed è appiattita sulla superficie caudo-mediale da una fossetta (Fovea capitis ossis femoris), che è la sede inserzionale del legamento della testa femorale
Figura 1. Aspetto ventrolaterale dell’emipelvi del cane (Schulz e Dejardin, 2005, modificato).
Figura 2. Superficie caudale della testa, del collo e della diafisi femorale. (Schulz e Dejardin, 2005,
modificato).
La testa è sostenuta da una parte più o meno ristretta, il collo del femore (Collum ossis
femoris) che unisce la testa del femore alla diafisi sulla sua superficie craniale. La
localizzazione craniale del collo rispetto alla diafisi è importante per capire il posizionamento e in particolare come posizionare lo stelo di un’eventuale protesi. L’angolazione tra il collo e la diafisi è descritto dall’angolo di torsione o di versione e dall’angolo di inclinazione.
L’angolo di versione è quello tra il piano dei condili femorali e l’asse del collo femorale (fig. 4) (Remedios et Fries, 1995). Ad un angolo positivo di torsione, con la testa e il collo diretti cranialmente, ci si riferisce come anteroversione; ad un angolo negativo, con la testa e il collo diretti caudalmente, ci si riferisce come retroversione. Ad un angolo zero ci si riferisce come normoversione. L’angolo normale di torsione varia da +12° a +40°, con una media di +27°.
Figura 4 Il disegno rappresenta la misurazione
dell’angolo di torsione in un’anca normale (b) e in un’anca displasica (a) (Remedios et Fries, 1995).
L’angolo di inclinazione è quello formato dalla testa del femore quando si congiunge con la diafisi del femore in un piano trasverso (Remedios et Fries, 1995). Quest’angolo, che è anche stato chiamato angolo cervicofemorale, è di solito di 140°-150° (fig. 5).
L’anatomia interna del femore ha una grande importanza per il posizionamento degli impianti femorali nell’artroplastica totale dell’anca. Nel cane la diafisi femorale è incurvata leggermente in senso cranio-caudale e ha un effetto minimo sul
Figura 5 L’immagine
rappresenta il calcolo dell’angolo di inclinazione in un’anca normale (b) e in un’anca displasica (a) (Remedios et Fries, 1995).
Figura 6 Radiogramma di
una articolazione dell’anca sublussata che mostra un angolo di inclinazione del collo femorale aumentato di 160°. L’apparente coxa valga è determinata dall’errato posizionamento del femore piuttosto che dall’anteroversione in atto. Notare la prominenza del piccolo trocantere (freccia dritta), che riflette la rotazione esterna del femore (freccia curva) (Schulz e Dejardin, 2005, modificato).
dell’osso spongioso all’interno della diafisi (fig.7). La maggior parte della diafisi femorale è priva di osso spongioso e quindi ha scarsi effetti sul posizionamento di uno stelo protesico, mentre la regione più importante di osso spongioso nel femore prossimale è il blocco osseo sottotrocanterico che è una regione ampia dell’osso spongioso appena al di sotto del grande trocantere (Schulz e Dejardin, 2005).
Figura 7. Veduta craniale di un femore di cane con
asportazione prossimale dopo una preparazione per il riposizionamento totale dell’anca. Notare l’entità dell’osso spongioso nella superficie prossimale del femore (Schulz e Dejardin, 2005, modificato).
1.2 FORMAZIONI COMPLEMENTARI
L’acetabolo è completato da un cercine periferico fibro-cartilagineo assai robusto, il cercine o labbro acetabolare (Labrum acetabolare), il quale costituisce un anello completo a sezione triangolare, inserito su tutta l’estensione del ciglio acetabolare. La sua faccia interna, liscia e bagnata dalla sinovia, prende rapporto con la faccetta semilunare dell’acetabolo. La sua faccia esterna più larga dà attacco, in prossimità della sua base, alla capsula articolare; altrove rimane libera e corrisponde alla sinoviale. Il cercine acetabolare amplia la cavità cotiloidea e livella ed elimina tutte le ineguaglianze del ciglio acetabolare, in particolare scavalca l’incisura acetabolare e costituisce a
questo livello il legamento trasverso dell’acetabolo (Ligamentum trasversum acetabuli). Quest’ultimo molto spesso e robusto forma una specie di ponte che completa, da questo lato, la cavità articolare del coxale; presenta tuttavia nel fondo dell’incisura ossea un orificio occupato da tessuto connettivo lasso e adiposo. Questa apertura dà passaggio a rami arteriosi e venosi destinati al legamento della testa femorale o legamento rotondo coxo-femorale (Ligamentum capitis femoris). Il legamento longitudinale trasverso e il labbro acetabolare aumentano la profondità dell’acetabolo contribuendo così alla stabilità dell’articolazione dell’anca.
1.3 MEZZI DI UNIONE
L’unione coxo-femorale è assicurata da una capsula articolare, da un legamento intra-articolare (legamento rotondo) e da legamenti accessori.
La capsula articolare inguaina completamente ciglio e cercine acetabolari, la testa del femore e una parte del collo. Prende origine sul versante esterno, sulla base del cercine acetabolare e sul legamento trasverso e termina sul collo del femore. E’ formata da fibre bianche incrociate ed il suo spessore non è uniforme, la parte craniale infatti si ispessisce in prossimità dell’acetabolo.
Il legamento della testa del femore (Ligamentum capitis femoris) è chiamato anche legamento rotondo; è un breve e potente cordone intra-articolare che prende attacco da una parte nella fossetta legamentosa della testa femorale e, dall’altra parte, nella fossa acetabolare. Si presenta a sezione quasi circolare vicino al femore, mentre diventa più o meno appiattito nella fossa acetabolare. Il legamento si espande verso l’incisura acetabolare e i suoi fasci arrivano al bordo dell’orificio limitato da quest’ultima e dal legamento trasverso. Il legamento della testa del femore, completamente contenuto nell’articolazione, è rivestito dalla sinoviale, svolge probabilmente funzioni di ammortizzamento delle pressioni trasmesse dalla testa del femore al fondo dell’acetabolo, e di limitazione dei movimenti, in particolare movimenti di flessione e di abduzione del femore rispetto al bacino.
1.4 MOVIMENTI
si ha una specializzazione più o meno marcata per i movimenti di flessione e di estensione.
Nella flessione, la testa del femore ruota nella cavità cotiloidea, in modo tale che l’estremità distale del femore è portata in direzione craniale e dorsale; in questo movimento la testa del femore tende a uscire dall’acetabolo in direzione caudale, ma è mantenuta in sito dalla trazione esercitata dai muscoli glutei; anche il legamento della testa del femore si oppone alla flessione quando questa ha raggiunto un certo grado. L’estensione mette in funzione i meccanismi inversi: la testa del femore tende a lussare in direzione craniale e questo movimento è impedito dai rinforzi che la capsula presenta da questo lato, dal legamento rotondo e dall’azione del capo lungo del quadricipite femorale (retto craniale della coscia).
La flessione dell’anca è permessa dai muscoli sartorio, tensore della fascia lata, articolare dell’anca, retto femorale e ileopsoas.
I muscoli estensori dell’anca invece sono i muscoli glutei, il quadricipite femorale, il bicipite femorale, il semitendinoso, il piriforme, il semimembranoso, il gracile e gli adduttori.
Oltre alla flessione ed all’estensione, i muscoli glutei e il tensore della fascia lata ruotano l’anca internamente. I muscoli rotatori esterni dell’anca sono i muscoli otturatore interno ed esterno, i gemelli, il quadrato femorale e l’ileopsoas.
C
C
a
a
p
p
i
i
t
t
o
o
l
l
o
o
I
I
I
I
:
:
P
P
a
a
t
t
o
o
g
g
e
e
n
n
e
e
s
s
i
i
d
d
e
e
l
l
l
l
a
a
d
d
i
i
s
s
p
p
l
l
a
a
s
s
i
i
a
a
d
d
e
e
l
l
l
l
’
’
a
a
n
n
c
c
a
a
La displasia dell’anca CHD (Canine Hip Dysplasia) interessa i cani di tutte le razze, ma è più comune nelle razze di taglia grande (Cardinet et al, 1983; Hedhammar et al, 1979; Kaneene et al. 1997), e in particolare in pastore tedesco, rottweiler, Labrador retriever, golden retriever, alaskan malamute, bull mastiff, bobtail, San Bernardo, bulldog, collie, boxer e altre. Inoltre è presente anche in razze di taglia più piccola come il cocker spaniel e lo springer spaniel. E’ necessario precisare però che, poiché molte segnalazioni sulla prevalenza di razza si basano sui registri che fanno affidamento sulla presentazione volontaria dei radiogrammi pelvici, probabilmente non viene rappresentata una vera predisposizione di razza (Dassier, 2005; Smith, 1997).
L’alterazione, essendo legata allo sviluppo, non è presente alla nascita e si può manifestare in forme differenti e con aspetti evolutivi diversi secondo l’età e il momento dell’esame. Per il corretto sviluppo articolare è necessario che il contatto tra la testa del femore e l’acetabolo avvenga su un piano perpendicolare alle forze femorali assiali. Se la forza esercitata dalla testa del femore sull’acetabolo è insufficiente o agisce lungo una direzione errata la cavità acetabolare risulta poco profonda e la capsula articolare viene stirata o, peggio, il labbro cartilagineo va incontro a microfratture. In presenza di uno scarso supporto dorsale della testa del femore, la stabilità articolare è garantita dalla componente muscolare che partecipa alla spinta del femore all’interno dell’acetabolo, ma nel momento in cui i muscoli si affaticano o il loro sviluppo non è sufficiente, la testa del femore può sublussare o comunque stirare la capsula articolare e il legamento rotondo, mentre il bordo acetabolare dorsale viene danneggiato; a questo punto inizia un circolo vizioso che porta all’osteoartrosi (Slocum e Slocum, 1998). Ne derivano dolore articolare, degenerazione della cartilagine e rimodellamento osseo.
Il continuo portare il peso in modo anomalo determina un eccesso di usura della cartilagine articolare e danneggia l’osso sottostante, provocando possibili microfratture e sclerosi reattive dolorose. La lassità dell’anca, infine, diminuisce appena si manifesta la fibrosi della capsula e si risolve il versamento sinoviale. L’osteoartrite finale è una condizione debilitante caratterizzata dalla perdita della cartilagine articolare, dalla
fibrosi, dal rimodellamento osseo e dalla perdita della funzione (Todhunder e Lust, 2005; Sheryl, 1997).
La lesione iniziale a carico della testa femorale si attua perifovealmente (fig.8), e questo suggerisce che la direzione anomala del carico determina una pressione focale in aumento in quest’area (Burton-Wurster et al, 1999; Farese et al, 1998).
Figura 8 Disegno di un femore prossimale canino che illustra la sede della lesione osteoartritica alla
cartilagine articolare perifoveale adiacente al legamento rotondo della testa femorale (Schulz e Dejardin, 2005, modificato).
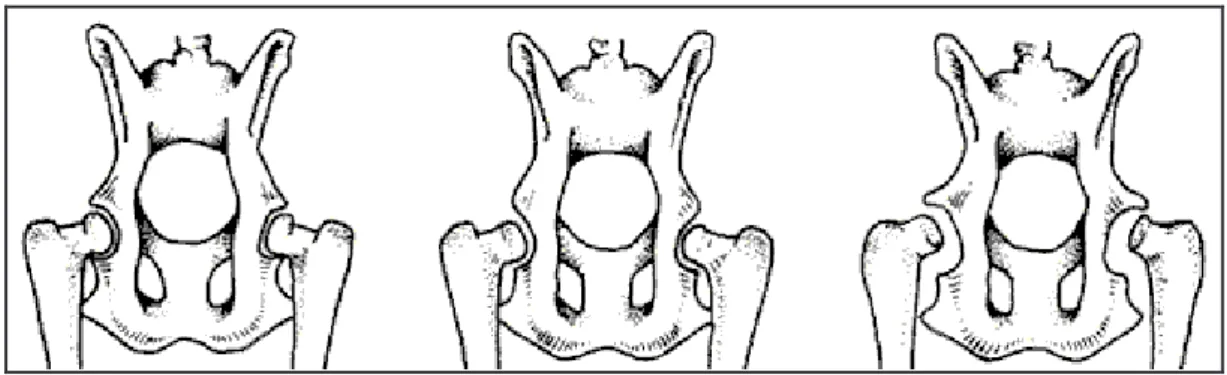
Figura 9: le immagini raffigurano tre pelvi in proiezione ventro dorsale con le articolazioni normali,
Figura 10 Le immagini raffigurano le alterazioni che compaiono a carico delle superfici articolari:
perdita della normale conformazione a carico della testa del femore, erosione cartilaginea, appiattimento dell’acetabolo e sublussazione.
Le alterazioni anatomiche causate dalla CHD sono rappresentate da un maggior angolo di curvatura, un appiattimento della cavità acetabolare (fig. 8-10), il rilasciamento o la lacerazione del legamento rotondo, la sublussazione coxofemorale, l’erosione delle cartilagini ialine, il progressivo rimodellamento degli acetaboli, delle teste e dei colli femorali (Morgan, 1992) e le osteofitosi periarticolari (fig. 11) La CHD può essere mono o bilaterale (Keller e Corley, 1989; Riser, 1973)
2.1 FATTORI GENETICI
I cani malati spesso hanno anomalie in altre articolazioni, e questo indica che il difetto primario è sistemico piuttosto che ristretto all’anca. La displasia dell’anca canina è un tratto complesso (Hedhammar et al,1979) i cui modelli di eredità indicano che è controllato da diversi geni interagenti con i fattori ambientali (Todhunder e Lust, 2005). La displasia ha un’ereditabilità compresa tra lo 0.25 e lo 0.48 (e talvolta anche più alta). Questo significa che il 25-48% della variabilità nel fenotipo della CHD è dovuto a fattori genetici, ma l’influenza ambientale e di altri fattori non ancora identificati giocano un ruolo importante nell’espressione del tratto.
I geni agiscono prevalentemente sulla cartilagine, sul tessuto connettivale e sulla muscolatura della regione dell’anca. I soggetti affetti da questa patologia presentano uno squilibrio tra lo sviluppo delle masse muscolari, che è insufficiente, e la crescita scheletrica. Ne deriva un’incompetenza da parte della componente muscolare al mantenimento della congruità coxo-femorale con conseguente sviluppo di problematiche legate alla lassità articolare e alla alterata distribuzione dei carichi ponderali, tra cui: modificazioni ossee e cartilaginee a carico della testa del femore (fig. 9-11) e del margine acetabolare, flogosi e ispessimento della capsula articolare e del legamento rotondo, a causa dei movimenti di sublussazione della testa femorale.
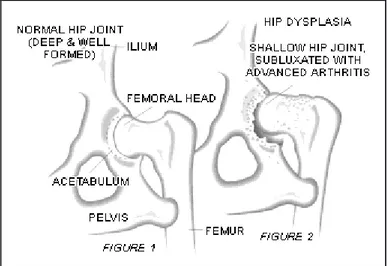
Figura 11 Nell’articolazione normale l’acetabolo è profondo e ben conformato (fig.1). Nell’anca
displasica l’acetabolo non è più in grado di accogliere la testa del femore che risulterà sublussata. Notare la neoformazione ossea (osteofitosi) sia a livello del coxale che del femore(fig.2).
2.2 FATTORI AMBIENTALI
Il consumo abbondante di cibo abbrevia il tempo della prima manifestazione e aumenta la gravità della displasia dell’anca (Lust et al, 1973). Un’alimentazione ad libitum degli alani induceva l’espressione di diversi tratti ortopedici non voluti, compresa la displasia dell’anca, in confronto a soggetti sottoposti a restrizione dietetica (Hedhammar et al, 1974). La sovralimentazione di per sé non causa la displasia, ma massimizza l’espressione del tratto negli individui geneticamente sensibili (Todhunder e Lust, 2005). Per i cani tra le 6 settimane e l’anno di età la frequenza e la gravità della displasia dell’anca e della concomitante osteoartrite erano ridotte marcatamente in
cucciolate di controllo alimentate ad libitum (Kealy et al, 1992, 1997, 2000). Il meccanismo di questi effetti nutrizionali rimane sconosciuto. Si può spiegare semplicemente con la meccanica: massimizzando la crescita si permette al carico massimo di essere collocato su delle anche geneticamente sensibili (Todhunder e Lust, 2005).
Sempre fra i fattori ambientali possono essere enunciati i fattori legati alla madre, e nello specifico i fattori di natura lattea. Alcuni ormoni e peptidi presenti nel latte (insulina, cortisolo, fattore di crescita epidermico, i fattori di crescita insulino-simili, il peptide correlato all’ormone paratiroideo, la relaxina, ecc… ) sono assorbiti nel tratto gastroenterico nel periodo subito dopo la nascita e possono influenzare il metabolismo del tessuto connettivo, specialmente dei tessuti pelvici geneticamente sensibili. Ad esempio, la relaxina può contribuire alla lassità della capsula e dei legamenti dell’articolazione coxo-femorale in quanto è un potente induttore dell’espressione delle metalloproteinasi 1 (collagenasi) e 3 (stromelisina) e dell’attivatore del plasminogeno. Questi enzimi attivati degradano la matrice extracellulare alterando la struttura della capsula articolare e dei legamenti provocandone una lassità (Samuel, 1996).
C
C
a
a
p
p
i
i
t
t
o
o
l
l
o
o
I
I
I
I
I
I
:
:
D
D
i
i
a
a
g
g
n
n
o
o
s
s
i
i
d
d
e
e
l
l
l
l
a
a
d
d
i
i
s
s
p
p
l
l
a
a
s
s
i
i
a
a
d
d
e
e
l
l
l
l
’
’
a
a
n
n
c
c
a
a
Quando si valuta un cane con una zoppia all’arto pelvico è imperativo eseguire un attento esame ortopedico e neurologico per delimitare il problema all’articolazione dell’anca e escludere così patologie che possono manifestarsi con una sintomatologia simile.
La diagnosi della displasia dell’anca viene eseguita in base a
Rilievi clinici
Anche squadrate (boxy hips).
Andatura a coniglio (bunny hopping). Anche schioccanti (clunking hips).
Prova di sollevamento sui posteriori (stand test).
Esame ortopedico con il paziente sveglio Test di abduzione e rotazione esterna. Test di estensione dell’anca.
Test di sublussazione dell’anca. Test del muscolo ileo-psoas.
Esame ortopedico con il paziente in anestesia Test di Ortolani.
Test di Barlow. Test di Bardens.
Test di compressione assiale dell’anca.
Esame radiografico
3.1 RILIEVI CLINICI
La displasia dell’anca si può manifestare con molti aspetti clinici. Può capitare che soggetti con una patologia marcata mostrino pochi segni clinici e che soggetti con una patologia più moderata abbiano una sintomatologia più imponente. I segni clinici della displasia includono zoppia, riluttanza al movimento e atrofia dei muscoli dell’arto pelvico con una ipertrofia compensatoria dei muscoli della spalla. Poiché questi segni clinici non sono patognomonici della displasia, sono necessari un esame ortopedico e neurologico completo per tutti i pazienti con un sospetto di CHD. Manualità specifiche come il test di Barlow, di Ortolani e di Bardens sono utili per determinare il grado di lassità coxofemorale e per perfezionare la diagnosi. Nessuno di questi test è patognomonico di CHD, ma tutti devono essere eseguiti in corso di sospetto di CHD per contribuire alla diagnosi (Fry e Clark, 1992).
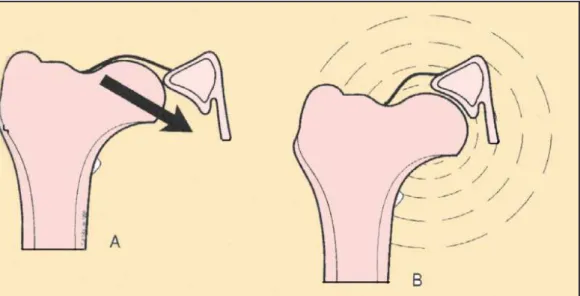
ANCHE SQUADRATE
Con questo termine viene definita una modificazione morfologica della groppa, il cui profilo, da armonioso e arrotondato, diventa spigoloso e squadrato. La differenza che intercorre tra le anche normali e quelle a scatola è la stessa che differenzia una testa femorale correttamente accolta nella cavità acetabolare rispetto a una testa femorale lussata. In quest’ultimo caso la testa femorale risulta dislocata in direzione dorsale e laterale. Conseguentemente il grande trocantere assume una posizione dorsale e laterale conferendo alla groppa un profilo squadrato (fig. 12). Nell’anca lussata la testa del femore viene sostenuta principalmente dalla capsula articolare, già stirata e infiammata, anziché dall’acetabolo, quindi per evitare un ulteriore stimolazione meccanica sulla capsula il soggetto tende a limitare il movimento di abduzione della testa femorale, mantenendo così una base d’appoggio stretta. Al contrario un soggetto displasico ma con le anche ridotte utilizza una base d’appoggio larga in modo da orientare la forza assiale del femore verso l’acetabolo e agevolare così la riduzione dell’anca (fig. 13). Alcuni cani alternano posizione passando da una base d’appoggio stretta ad una larga e viceversa, in quanto la base d’appoggio più ampia riduce il disagio derivante dalla lussazione (Slocum e Slocum, 1998).
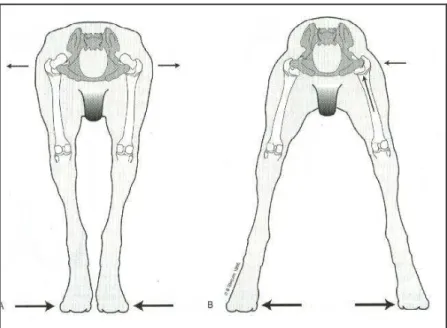
Figura 12. In un soggetto normale il profilo della groppa è armoniosamente arrotondato (A). Mentre, in
figura B notare il profilo della groppa squadrato in un soggetto con anche lussate (B) (Slocum e Slocum, 1998; modificato).
Figura 13. Generalmente un soggetto displasico con le anche lussate mantiene i piedi vicini tra loro
utilizzando una base d’appoggio stretta (A). Un soggetto displasico con le anche ridotte mantiene i piedi lontani tra loro in modo da orientare la forza assiale del femore verso l’acetabolo per agevolare la riduzione dell’anca (B) (Slocum e Slocum, 1998; modificato).
ANDATURA A CONIGLIO
In questo tipo di andatura il paziente corre utilizzando contemporaneamente gli arti del bipede posteriore con i piedi in posizione addotta; questo permette di ridurre gli stimoli meccanici a livello delle anche displasiche, anche perché la maggior parte
ANCHE SCHIOCCANTI
Le anche schioccanti sono il risultato della riduzione spontanea delle anche lussate durante la deambulazione. Per affermare che un cane presenta le anche schioccanti è necessario percepire mediante palpazione il “clunk” e udirne il caratteristico rumore (fig. 14). La presenza dello schiocco indica che l’acetabolo è ancora sufficientemente profondo da permettere il reinserimento della testa femorale (Slocum e Slocum, 1998).
Figura 14 Il rumore di “clunk” prodotto dall’anca durante la deambulazione è causato dalla riduzione del
femore (A). Quando la testa del femore raggiunge il fondo dell’acetabolo si avverte il rumore di “clunk” che corrisponde alla vibrazione prodotta dalla testa nell’impatto con il cavo acetabolare (Slocum e Slocum, 1998; modificato).
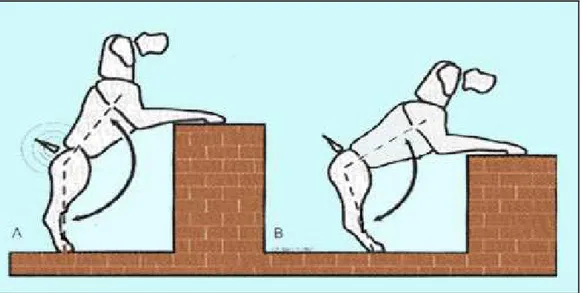
PROVA DI SOLLEVAMENTO SUI POSTERIORI
L’esecuzione di questa prova comporta l’estensione dell’anca e la lordosi del tratto lombosacrale del rachide. Un soggetto normale accetta di sollevare il bipede anteriore e di stare di fronte al proprietario, se abituato a fare questo gioco. Un soggetto patologico non accetta la posizione e mantiene la groppa sporgente (fig. 15). Questa prova non è patognomonica della CHD, ma permette la localizzazione anatomica della patologia alle anche o al rachide lombosacrale (Slocum e Slocum, 1998).
Figura 15 Un soggetto normale durante la prova di sollevamento in piedi estende completamente le
anche ed il rachide (A), mentre un soggetto displasico mantiene la groppa sporgente e tenta di riassumere la stazione quadrupedale (B) (Slocum e Slocum, 1998; modificato).
3.2 ESAME ORTOPEDICO CON PAZIENTE SVEGLIO
TEST DI ABDUZIONE E ROTAZIONE ESTERNA
Per effettuare questo test il clinico si pone dietro al paziente, afferra il ginocchio ed effettua il movimento di flessione e rotazione esterna dell’anca. Il test è negativo quando il soggetto è indifferente alla manovra. Questo test non è specifico per la displasia dell’anca, ma indica un’infiammazione del settore dorsale della capsula articolare.
TEST DI ESTENSIONE DELL’ANCA
Per effettuare questo test il clinico si pone dietro al paziente, appoggiando le dita attorno alla coscia e il pollice sulla faccia dorsale della tavola ischiatica. Movendo le dita in direzione del pollice si ottiene l’estensione dell’anca. Quando il paziente non reagisce il test viene giudicato negativo. Questo test non è specifico per la displasia dell’anca, ma risulta positivo in caso di infiammazione della capsula articolare, in caso di contrattura del muscolo ileo-psoas e di infiammazione della colonna lombare caudale.
TEST DI SUBLUSSAZIONE DELL’ANCA
Il clinico si pone sullo stesso lato dell’anca da esaminare e appoggia le dita della mano, passando cranialmente, sul versante mediale del femore prossimale, mentre il pollice viene posizionato sull’ileo corrispondente. Si retrae quindi il femore in direzione
laterale, mentre contemporaneamente si esercita con il pollice una pressione mediale sull’ileo. Quando il paziente non reagisce il test viene giudicato negativo. Questo test è specifico per la displasia dell’anca in quanto sollecita la capsula articolare a livello della sua inserzione sul DAR.
TEST DEL MUSCOLO ILEO-PSOAS
Il clinico si pone di lato al paziente, appoggia le dita attorno alla parte craniale della coscia ed esercita una pressione sul muscolo ileo-psoas. Quando il paziente non reagisce il test viene giudicato negativo. Questo test è specifico per il muscolo ileo-psoas.
3.3 ESAME ORTOPEDICO CON PAZIENTE IN ANESTESIA
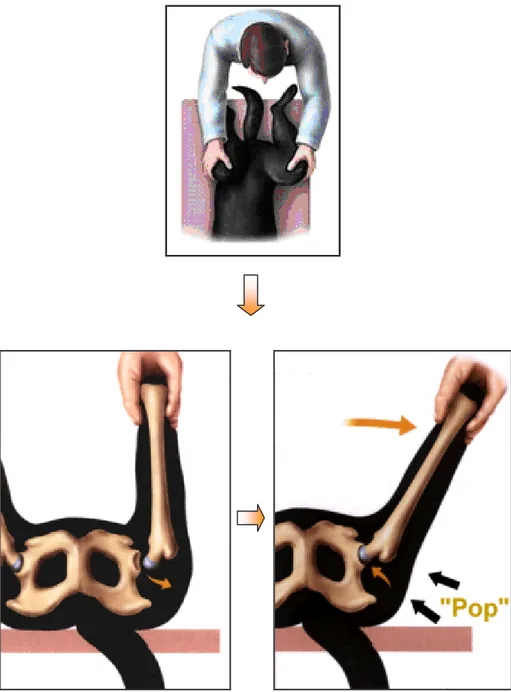
TEST DI ORTOLANI
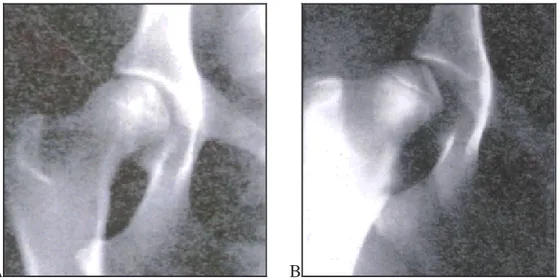
Per effettuare questo test il soggetto deve essere anestetizzato e posto in decubito dorsale con gli arti posteriori posizionati come in figura (fig. 16). Il test viene considerato positivo quando, abducendo l’anca, si avverte uno scivolamento o un rumore di “clunk” (segno di Ortolani), dovuto alla riduzione della testa femorale lussata all’interno dell’acetabolo. Attraverso l’utilizzo di un goniometro elettronico canino (fig. 17) posizionato caudalmente all’eminenza ileo-pettinea è possibile misurare l’angolo di riduzione, che corrisponde all’angolo di abduzione compreso tra il piano sagittale mediano e la posizione del femore al momento della riduzione. Questo test non è patognomonico di displasia dell’anca ma indica uno stiramento capsulare, condizione spesso associata alla displasia.
Figura 16 Il test viene considerato positivo quando, abducendo l’anca, si avverte uno scivolamento o un
rumore di “clunk” (segno di Ortolani), dovuto alla riduzione della testa femorale lussata all’interno dell’acetabolo.
Figura 17 Figura a lato: il goniometro
elettronico canino misura gli angoli in rapporto alla forza di gravità. Pertanto la misurazione del piano sagittale ottenuto con il paziente in decubito dorsale è uguale a zero. La sonda viene applicata appena caudalmente all’eminenza ileo-pettinea ; lo strumento viene appoggiato al condilo mediale del femore e la misurazione dell’angolo appare sul display digitale. Figura in alto: la riduzione dell’anca ottenuta mediante l’abduzione inizia (angolo inferiore al
rid) con la testa femorale stabilmente
posizionata nella porzione dorsale della capsula articolare (linea punteggiata, anca lussata) e con l’acetabolo che prende contatto medialmente rispetto all’asse femorale che passa attraverso le due articolazioni (linea tratteggiata) (A). Con la progressiva abduzione dell’anca la porzione di capsula articolare che sostiene la testa femorale determina il contatto lungo l’asse femorale tra testa del femore e bordo acetabolare dorsale, formando l’angolo rid ,che rende l’anca
instabile (B). Un ulteriore abduzione, superiore a rid, determina un punto di contatto, tra testa
del femore e bordo acetabolare dorsale, laterale rispetto all’asse femorale con conseguente scivolamento della testa femorale nell’acetabolo. Con un angolo superiore a rid la
testa del femorale risulta stabilmente inserita nell’acetabolo (Slocum e Slocum, 1998; modificato).
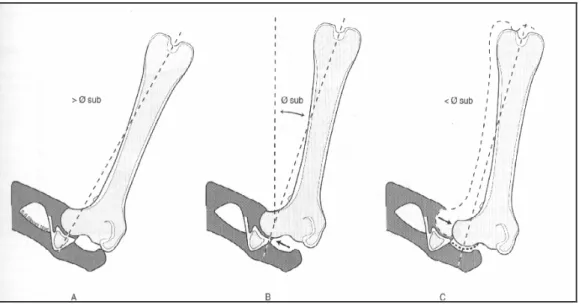
TEST DI BARLOW
Per effettuare questo test si posiziona il cane come sopra ma con il femore in posizione abdotta. Il segno di Barlow si ottiene quando, adducendo l’anca, si avverte lo scivolamento della testa femorale dall’acetabolo ad una posizione lussata; in questo caso il test viene considerato positivo (fig. 18). Sempre mediante il goniometro
l’angolo viene considerato positivo se all’atto della sublussazione il femore è in posizione laterale rispetto al piano sagittale mediano, viceversa viene considerato negativo quando il femore è in posizione mediale. Questo test non è patognomonico di displasia dell’anca ma indica uno stiramento capsulare, condizione spesso associata alla displasia.
Figura 18 La lussazione dell’anca ottenuta mediante l’adduzione inizia (superiore a sub) con la testa
femorale posizionata all’interno dell’acetabolo e a contatto con il bordo acetabolare dorsale, lateralmente rispetto all’asse femorale che passa attraverso le due articolazioni (linea tratteggiata) (A). Con la progressiva adduzione dell’anca la testa del femore prende contatto con il bordo acetabolare dorsale a livello del sub (B). Un ulteriore adduzione (inferiore a sub)determina un punto di contatto mediale
rispetto all’asse femorale con conseguente lussazione della testa femorale contro la capsula articolare (linea punteggiata) (C) (Slocum e Slocum, 1998; modificato).
TEST DI BARDENS
Per effettuare questo test il paziente viene anestetizzato e posto in decubito laterale con l’anca da esaminare posta verso l’alto. Con una mano si effettua una trazione in direzione medio-laterale sul femore prossimale e con l’altra mano si valuta l’entità dello spostamento e quindi il grado di lassità articolare (fig. 19).
Figura 19 Per eseguire la palpazione di Bardens sull’anca
sinistra il paziente viene posto in decubito laterale destro. Con la mano sinistra si applica una trazione in direzione medio-laterale sul femore prossimale che determina lo spostamento laterale (linea tratteggiata) del trocantere sinistro. Con la mano destra si rileva l’entità dello spostamento (freccia) (Slocum e Slocum, 1998; modificato).
TEST DI COMPRESSIONE ASSIALE DELL’ANCA
Per effettuare questo test il paziente viene posizionato in decubito laterale e viene esercitata una compressione assiale del femore lungo il piano sagittale. Con questo test si valuta la stabilità dell’anca, soprattutto durante un intervento chirurgico. L’anca viene giudicata stabile quando in seguito alla compressione la testa del femore resta in posizione ridotta.
3.4 ESAME RADIOGRAFICO
L’esame radiografico permette di confermare il sospetto di CHD, tuttavia non può rappresentare il primo passo verso la diagnosi in quanto, così facendo, si corre il rischio di non individuare altre patologie che possono coesistere con la displasia. Tuttavia la diagnosi definitiva scaturisce solo quando sono ben visibili i segni radiografici della patologia (Smith, 1997).
L’indagine clinica deve perciò essere completata da uno studio radiografico in sei proiezioni:
ventro-dorsale con arti estesi latero-laterale
DAR a rana
ventro-dorsale con compressione ventro-dorsale con distrazione
Le proiezioni ventro-dorsale, latero-laterale e DAR sono fra loro ortogonali e consentono così una visione “tridimensionale” dell’articolazione. Il corretto posizionamento è essenziale per la valutazione delle radiografie, per questo è preferibile eseguirle con il paziente in anestesia.
L’esame radiografico ufficiale viene eseguito a 18 mesi per le razze Bullmastiff, Cane da montagna dei pirenei, San Bernardo, Dogue de Bordeaux, Alano, Leonberger, Pastore Maremmano, Mastiff, Mastino napoletano, Terranova, Landseer; a 15 mesi per le razze Bovaro del bernese, Grande bovaro svizzero, Briard e Rottweiler; a 12 mesi per le restanti razze.
radiografia ventrodorsale ad arti estesi si può diagnosticare la CHD all’età di 6 mesi, ma è necessario ricordare che un esame eseguito troppo precocemente può portare al rischio di avere dei falsi negativi (Lust, 1997).
PROIEZIONE VENTRO-DORSALE CON ARTI ESTESI
Il paziente viene posto in decubito dorsale con il torace accolto in una culla, gli arti posteriori estesi, paralleli tra loro e lievemente intraruotati in modo da ottenere la proiezione delle rotule al centro delle rispettive troclee femorali. Il fascio radiogeno deve essere centrato fra le articolazioni coxofemorali e il radiogramma deve contenere interamente la pelvi, i femori e le rotule. Prima di valutare l’articolazione è necessario verificare se il radiogramma è stato eseguito correttamente. Occorre quindi accertarsi che le due emipelvi siano speculari, con le ali dell’ileo e i fori otturati simmetrici, i femori siano paralleli tra loro e che le loro diafisi intersechino le tuberosità ischiatiche disegnando un area di uguali dimensioni, che le rotule siano al centro delle troclee femorali e che sia ben visibile il ciglio cotiloideo dorsale.
In un’anca normale questa proiezione evidenzia che la testa del femore è profondamente accolta nell’acetabolo, coperta per almeno il 50% dal margine acetabolare dorsale (fig. 20).
Il primo segno radiografico di displasia è rappresentato dalla lassità articolare che appare come una modesta sublussazione legata al versamento articolare (fig. 21).
Figura 20
1 Bordo cranio laterale 2 Margine acetabolare 3 Giunzione collo-testa 4 Bordo caudale 5 Fovea capitis 6 Margine craniale 7 Cavità acetabolare
A B
Figura 21 notare la sublussazione dovuta al versamento articolare dell’articolazione in figura B.
Successivamente compariranno i segni di una malattia articolare degenerativa: formazione di entesiofiti capsulari su collo e testa femorali (segno di Morgan e segno della medusa), rimodellamento della testa e del collo femorali, rimodellamento dell’acetabolo, sclerosi dell’osso subcondrale della testa femorale e dell’acetabolo. Il segno di Morgan è dato dalla formazione di osteofiti a livello della faccia posteriore del collo femorale che, nella proiezione ventro-dorsale, si evidenziano come una linea sottile e radiopaca sul collo del femore, a decorso prossimo distale.
Con il termine segno della medusa si intende invece la caratteristica forma della testa femorale, non più sferica ma appiattita, con un collo tozzo e dai margini irregolari per la formazione di osteofiti pericondrali.
A carico dell’acetabolo invece si noterà un appiattimento con sclerosi subcondrale e l’orientamento dei capi articolari assumerà un andamento valgizzato (coxa valga), con sublussazione più o meno marcata (fig. 22)
A
Figura 22 In entrambi i radiogrammi sono ben visibili i segni della malattia articolare degenerativa:
formazione di entesiofiti capsulari sul collo e testa femorali, rimodellamento della testa e del collo femorali, rimodellamento dell’acetabolo, sclerosi dell’osso subcondrale della testa femorale e dell’acetabolo.
Il grado di sublussazione può essere stimato misurando l’angolo di Norberg e Ollson, che si calcola tracciando una linea che congiunga il centro delle teste femorali, dal centro di ciascuna delle quali si traccerà una seconda linea tangente al Bordo Acetabolare Craniale e misurando l’angolo che questa forma con la prima (fig. 23).
Figura 23 Esempio di misurazione dell’angolo di Norberg e Ollson.
La valutazione di questo angolo è importante per la classificazione della displasia (Citi et al., 2005):
AA (eccellente) angolo di Norberg superiore a 105°, testa del femore e acetabolo congruenti con bordo acetabolare craniale netto e arrotondato e spazio articolare uniforme.
A (normale) come sopra ma il bordo acetabolare craniale non abbraccia la testa. B (quasi normale) articolazione leggermente incongruente con angolo di Norberg di 105° oppure articolazione congruente con angolo di Norberg minore di 105°.
C (displasia leggera) articolazione incongruente con angolo di Norberg compreso tra 105° e 100° e bordo acetabolare craniale leggermente appiattito. Lievi segni di malattia articolare degenerativa.
D (displasia media) sublussazione o lussazione della testa del femore con angolo di Norberg compreso tra 100° e 90°, appiattimento del bordo acetabolare craniale e deformazione della testa del femore.
E (displasia grave) l’angolo di Norberg è minore di 90° con lussazione e segni di artropatia degenerativa molto marcati con grave deformità articolare.
PROIEZIONE LATERO-LATERALE
La radiografia in proiezione laterale del bacino e del tratto lombo-sacrale della colonna vertebrale è utile per la diagnosi differenziale tra displasia e spondilosi dello spazio L7-S1, condizione spesso associata alla cosiddetta sindrome della cauda equina. Nell’anca normale la testa del femore si presenta concentrica rispetto all’acetabolo, per cui si ha un’immagine caratterizzata da tre linee concentriche: una radiopaca che corrisponde all’osso subcondrale della testa del femore, una radiotrasparente che corrisponde alla cartilagine articolare e infine un’altra radiopaca che corrisponde all’osso subcondrale acetabolare. Nell’anca displasica la concentricità di queste strutture diventa meno visibile e al posto dell’immagine nera-bianca” si ha un’immagine “bianca-grigia-bianca”, conseguente all’assottigliamento e all’erosione della cartilagine (Slocum e Slocum,1998).
PROIEZIONE DAR
La proiezione DAR (Dorsal Acetabular Rim) fornisce molte informazioni, ma come già accennato in precedenza è molto importante il corretto posizionamento del paziente. Il cane viene posto in decubito sternale, con gli arti posteriori estesi cranialmente lungo il torace e con i garretti sollevati di qualche centimetro.
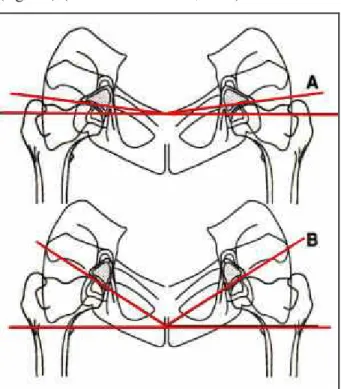
Tale proiezione consente la visualizzazione del settore acetabolare che sopporta la maggior parte del carico, e quindi dove sono più precoci le alterazioni, il cosiddetto “DAR point”. Su questa radiografia si valuta l’inclinazione del bordo acetabolare dorsale, che corrisponde all’angolo compreso tra l’asse orizzontale e la linea tangente all’acetabolo nel punto di contatto laterale alla testa del femore. Questo è definito angolo DAR (fig. 24).
In un soggetto normale si evidenzia un margine dorsale appuntito, con una testa del femore ben inserita e che presenta una adeguata copertura acetabolare. L’angolo DAR è inferiore o uguale a 7,5°. Pertanto in un soggetto normale la somma dei valori dell’angolo DAR destro e sinistro è minore o uguale a 15°.
La proiezione DAR di un’anca displasica mette in evidenza la sclerosi del margine acetabolare. La forma del labbro passa da leggermente arrotondata a smussata e consumata e contemporaneamente aumenta l’inclinazione del labbro acetabolare. Con questa proiezione si evidenziano meglio gli osteofiti sul margine acetabolare dorsale e il riempimento dell’acetabolo. Nei cani displasici la somma degli angoli DAR è uguale o
maggiore di 20° per l’eccessiva inclinazione del profilo del bordo acetabolare dorsale (fig. 25) (Slocum e Slocum,1998).
Figura 24 schema della proiezione del margine acetabolare dorsale che illustra la differenza della
pendenza in un’anca normale (A) e in un’anca displasica (B). L’angolo del margine acetabolare dorsale è ottenuto dall’incontro tra la tangente all’acetabolo sul punto di contatto laterale con la testa del femore e la perpendicolare al piano sagittale (Slocum e Slocum, 1990; modificato).
Figura 25 Esempio di una radiografia eseguita con il metodo DAR che mostra un’eccessiva inclinazione
del bordo acetabolare dorsale e una scarsa copertura delle teste femorali da parte dell’acetabolo
PROIEZIONE A RANA
Il paziente viene posto in decubito dorsale con gli arti posteriori divaricati, le ginocchia flesse e i garretti vicino all’addome. Con questa proiezione si valuta il riempimento della cavità acetabolare da parte della proliferazione osteofitosica. In condizioni normali la testa del femore è ben contenuta all’interno dell’acetabolo, mentre ciò non si verifica
in un soggetto displasico a causa del riempimento dell’acetabolo e dell’ipertrofia del legamento rotondo.
PROIEZIONE VENTRO-DORSALE CON COMPRESSIONE E CON DISTRAZIONE
Si tratta di una tecnica radiografica studiata in America dalla University of Pennsylvania che ha portato allo sviluppo del metodo radiografico denominato Penn Hip Improvement Program, da cui il nome “Penn-Hip”.
Per effettuare questa proiezione i pazienti sono anestetizzati e posizionati in decubito dorsale. Successivamente vengono eseguite tre radiogrammi: una proiezione ventro-dorsale con le anche estese (standard), una proiezione con compressione (per valutare la congruità articolare) e una proiezione con distrazione (per valutare la lassità articolare). In quest’ultimo radiogramma le teste femorali sono forzate lateralmente mediante l’utilizzo di uno strumento a fulcro posizionato tra i femori (fig. 26, 28).
Con queste proiezioni si calcola l’indice di distrazione (DI) (fig. 27) che è un indicatore di lassità articolare passiva e quindi un indicatore secondario di displasia dell’anca.
Figura 26 Nella figura a lato è mostrato lo
strumento utilizzato per ottenere le radiografie con compressione.
Figura 27 Le tre radiografie sono dello
stesso soggetto. Notare la lassità legamentosa ben visibile nella radiografia eseguita con distrazione rispetto alle altre radiografie.
Figura 28 Figura a destra: la distrazione laterale del femore (freccia bianca) causa la distrazione laterale
della testa del femore. Il cerchio corrispondente all’osso subcondrale acetabolare (C) è più grande del cerchio corrispondente all’osso subcondrale della testa del femore (A). I centri dei due cerchi sono separati dalla distanza d (vedi figura a sinistra). L’indice di dislocazione in distrazione (DDI) è uguale al rapporto tra d e il raggio del cerchio A, indicato con r.
La compressione mediale del grande trocantere (freccia nera in figura a destra) fa in modo che i cerchi corrispondenti all’acetabolo alla testa del femore siano concentrici e che i loro centri si trovino sovrapposti (D) il che è indice di un’anca normale. In un’anca normale d è uguale a zero e quindi anche l’indice di dislocazione da compressione (CDI=d/r) è uguale a zero. Riassumendo, la proiezione con distrazione si usa per calcolare l’indice di distrazione, il cui valore varia da zero a uno, con zero che rappresenta la congruità perfetta e uno che rappresenta la lussazione completa (Slocum e Slocum, 1998; modificato).
Esiste una correlazione positiva tra il valore del DI e il conseguente sviluppo di un osteoartrite. E’ stato visto che i Labrador Retrievers con un indice di distrazione inferiore a 0,3 a 8 mesi di età hanno circa il 90% di probabilità di non sviluppare la patologia. Viceversa i soggetti con un indice di distrazione superiore a 0,8 hanno circa il 90% di probabilità di sviluppare la patologia e la conseguente osteoartrite. I cani con un DI pari a 0,5 hanno circa il 50% di probabilità di sviluppare la patologia.
In generale possiamo affermare che un indice di distrazione pari a 0,30 è il confine tra anche normali e anche predisposte alla displasia (Smith et al, 1990; Smith, 1997). Tuttavia alcune anche displasiche hanno un indice di distrazione inferiore a 0,30, mentre altre con indice di distrazione superiore a 0,30 non mostrano i segni della malattia. Come già accennato in precedenza questa tecnica radiografica fornisce una stima del fattore di rischio per lo sviluppo della displasia dell’anca, motivo per cui è importante eseguirla in soggetti giovani, che abbiano almeno 16 settimane d’età. L’utilità di questa tecnica dipende dal fatto che rende possibile una selezione dei riproduttori al fine di diminuire la prevalenza della malattia (Dassier, 2005).
E’ stata segnalata una modifica di questa tecnica che non prevede l’utilizzo di un distrattore, ma viene eseguita una manovra simile alla prima parte del test di Ortolani (fig. 29). Si calcola così un indice di distrazione che è identico al DI ottenuto col metodo “Penn-Hip” (Fluckiger, et al, 1999).
Figura 29 I femori vengono angolati a 60° rispetto al piano del tavolo e spinti manualmente in direzione
craniodorsale (Fluckiger, 1999).
PROIEZIONE DORSO-VENTRALE
un fattore di rischio per lo sviluppo della malattia articolare degenerativa (Dassier, 2005).
Il paziente viene posizionato su uno stampo di gommapiuma (fig. 30) con le ginocchia addotte e legate con un nastro, così come la parte distale delle tibie. L’epicondilo laterale del femore deve essere leggermente spostato caudalmente rispetto al grande trocantere per evitare di avere la sovrapposizione, nel radiogramma, del ginocchio sull’anca (Farese et al, 1998).
Figura 30 Posizionamento del paziente per eseguire la proiezione dorso-ventrale.
Il punteggio di sublussazione dorsolaterale (fig. 31) è la misura della percentuale della testa del femore mediale alla parte laterale del bordo acetabolare craniale. Di conseguenza più è alto il punteggio presunto più è basso il rischio della malattia articolare degenerativa secondaria (Dassier, 2005).
Figura 31 Una linea retta unisce il margine acetabolare craniale. Da questa linea si traccia una linea
perpendicolare e passante dall’estremità più mediale della testa del femore e un’altra linea sempre perpendicolare alla prima e passante dal margine laterale dell’acetabolo craniale. La distanza tra queste due linee: d viene misurata in millimetri. Il punto di sublussazione dorsolaterale si determina dividendo d
Figura 32 radiografia dorsoventrale di un cane con anche normali (senza segni di sublussazione) (A).
Radiografia dorsoventrale di un cane affetto da CHD, notare la sublussazione: la testa del femore non è ben inserita nell’acetabolo, ma è dislocata lateralmente lasciando uno spazio medialmente tra acetabolo e testa femorale (B).
3.5 CHD E GENETICA
La CHD nel cane è una patologia ereditaria, presumibilmente poligenica, in cui incorrono mutazioni a carico di numerosi geni implicati nell’espressione dei caratteri quantitativi (in inglese quantitative trait loci o QTLs); si parla di carattere quantitativo della patologia poiché essa è in grado di manifestarsi con molti gradi di intensità, dalle forme praticamente asintomatiche a quelle marcatamente gravi. Inoltre, la manifestazione clinica della CHD è influenzata anche da fattori ambientali o comunque non genetici; tra essi si annoverano la dieta e l’esercizio fisico, cosi come altri eventi sconosciuti.
La ricerca genetica e la selezione si prefiggono lo scopo di ridurre la prevalenza della malattia fino ad una sua teorica eradicazione.
L’esatta correlazione tra i geni e le alterazioni cliniche non è ad oggi conosciuta, ma lo sforzo della ricerca si è indirizzato all’identificazione di determinati markers genetici (microsatelliti), allo scopo di determinare le mutazioni che causano la displasia.
L’approccio molecolare costituisce probabilmente l’unico presidio realmente capace di eradicare la patologia. Molti dei soggetti risultati negativi all’esame radiografico per lo screening della CHD contengono alcuni dei tratti genomici associati con la patologia, ma evidentemente essi non sono sufficienti alla sua manifestazione fenotipica.
L’ereditabilità, come già detto nel capitolo 2, si colloca tra 0.25 e 0.48; questo significa che la variabilità fenotipica è dovuta a fattori genetici in ragione del 25-48%.
Gli strumenti della biologia molecolare e le strategie di incrocio possono essere usate per spiegare le basi genetiche della CHD, senza una conoscenza a priori dei geni coinvolti; finchè non saranno stati consolidati opportuni test genetici per la CHD, la migliore opzione per ridurre la prevalenza della malattia nella popolazione canina è rappresentata dall’analisi del pedigree, ossia dal fenotipo degli antenati, della progenie e dei fratelli, oltre – ovviamente - dalla valutazione clinica del soggetto. Tuttavia, negli ultimi anni sono stati compiuti interessanti passi in avanti nel campo della ricerca; studi condotti da Todhunter et al. (2005) su una popolazione di Greyhound, Labrador e loro incroci, si sono rivolti all’individuazione dei principali markers atti ad individuare i QTLs implicati nella patogenesi della displasia e, eventualmente, a stabilire quali siano le mutazioni in tali geni responsabili dello stato patologico.
In ambito umano si sta effettuando una ricerca simile per identificare i fattori genetici che causano l’artrite reumatoide e l’osteoartrite. Il metodo utilizzato fino a oggi per l’identificazione dei geni responsabili di queste patologie è il cosiddetto RFLP
Restriction Fragment Length Polymorphism linkage analysis).
Sono stati così individuate sequenze probabili candidate al ruolo di QTLs sui cromosomi 4, 9, 10, 11, 16, 20, 22, 25, 29, 30, 35, 37.
L’identificazione di questi markers pone le basi per individuare precocemente i soggetti portatori della CHD; questo permetterebbe, da un lato, l’adozione precoce di un adeguato protocollo terapeutico, e dall’altro, una scelta oculata dei riproduttori (Todhunter et al., 2005).
3.6 DIAGNOSI DIFFERENZIALE
Come già accennato nel capitolo 2 per poter emettere una diagnosi di displasia dell’anca è imperativo eseguire innanzitutto un attento esame ortopedico e neurologico in modo da escludere altre patologie causa di zoppia agli arti posteriori.
Nei soggetti giovani è necessario tenere presente l’OCD dei condili femorali e del garretto, la panosteite, l’osteodistrofia ipertrofica e la rottura del legamento crociato anteriore; nei soggetti più anziani le poliartriti, le neoplasie, la rottura del legamento crociato anteriore, sono comuni problemi di tipo ortopedico, mentre la sindrome della cauda equina è una frequente compresenza di tipo neurologico.
C
C
a
a
p
p
i
i
t
t
o
o
l
l
o
o
I
I
V
V
:
:
T
T
r
r
a
a
t
t
t
t
a
a
m
m
e
e
n
n
t
t
o
o
La scelta del trattamento per la CHD dipende da numerosi fattori: l’età dell’animale, i segni clinici, gli esiti dell’esame fisico e radiografico, la presenza o l’assenza di altre malattie, le prestazioni che ci si attendono dal paziente ed infine la disponibilità del proprietario, intesa anche in termini economici.
In generale, la terapia è finalizzata a contenere il dolore, oltre che a migliorare la qualità della vita e rallentare la progressione della malattia.
Possiamo suddividere gli approcci terapeutici in tre grandi gruppi: Trattamento conservativo
Trattamento farmacologico Trattamento chirurgico
4.1 TRATTAMENTO CONSERVATIVO
Molti soggetti rispondono bene a un trattamento conservativo che prevede la modificazione dell’esercizio fisico, la riduzione del peso e la modifica ambientale. Tuttavia, il trattamento conservativo in pazienti gravemente displasici non apporta notevoli miglioramenti; ciò nonostante è bene precisare che la terapia chirurgica è imprescindibile dalla terapia conservativa.
Il controllo del peso, essenziale per la riduzione della zoppia (Impellizeri et al, 2000), si attua sia mediante la restrizione dietetica sia attraverso l’esercizio fisico, finalizzato al mantenimento della massa muscolare. L’attività fisica intensa (corse, salti e gioco con altri cani) è sconsigliata in quanto l’uso eccessivo di un’articolazione danneggiata provoca l’esacerbazione dello stato infiammatorio. Al contrario, un’attività fisica controllata, oltre a mantenere un buon tono muscolare e una buona funzionalità cardiaca (Minor et al, 1989), permette un’adeguata nutrizione delle cartilagini. Pertanto, sono l’ideale il nuoto e le passeggiate controllate (l’intensità di esercizio fisico deve essere pari al livello massimo che il cane sopporta senza manifestare dolore).
Per ciò che concerne le modifiche ambientali, è opportuno che la cuccia sia ubicata in un luogo caldo e asciutto e che il cane non si trovi a camminare su superfici scivolose o
4.2 TRATTAMENTO FARMACOLOGICO
La terapia medica comprende la somministrazione di FANS come il Carprofen (Rymadil) o il Firocoxib (Previcox). A causa dei loro effetti indesiderati a carico
dell’apparato gastroenterico e urinario (Forsyth et al, 1998; Fox e Johnston, 1997; Ko et al, 2000) è necessario ridurre la dose del farmaco alla quantità più piccola sufficiente a controllare i segni clinici e limitare il loro utilizzo nel tempo.
Tuttavia, i FANS non esercitano alcun effetto positivo sulla progressione del processo degenerativo della cartilagine (van den Berg, 1991) e i condrociti lesi continuano a produrre enzimi proteolitici; alcuni Autori (Clark, 1991; Johnston, 1992), suggeriscono persino che questi farmaci accelerino i processi degenerativi.
Studi in vitro hanno mostrato che alcuni FANS come il salicilato di sodio e l’indometacina inibiscono la sintesi della matrice cartilaginea, mentre altre molecole come aceclofenac, meloxicam e nimesulide, carprofen aumentano la sintesi della matrice e proteggono i condrociti dall’apoptosi, mentre altre molecole come il piroxicam non hanno effetti (Ding, 2002). Oggi la ricerca ha portato alla produzione di molecole sempre più sicure, agenti soprattutto sull’enzima COX 2.
La popolazione dei condrociti di una cartilagine danneggiata produce un eccesso di cataboliti come metalloproteinasi e prodotti della per-ossidazione, altamente reattivi. Questi fattori costituiscono un potenziale obiettivo terapeutico e sono state proposte molte nuove molecole per promuovere il ritorno all’omeostasi della cartilagine.
Fino ad ora la gestione terapeutica dell’osteoartrite è stata basata sui FANS, ma recentemente sono state utilizzate in ambito umano nuove molecole, come diacerhein, un ottimo candidato per la terapia dell’osteoartrite anche nel cane (Henrotin et al 2005). Questa nuova molecola sembra vantare diversi meccanismi d’azione: in primis, l’inibizione dell’inter-leukina-1 (IL-1), principale citochina responsabile della degradazione cartilaginea, ed inoltre la stimolazione della sintesi dei proteoglicani e dell’acido jaluronico, principale componente della cartilagine (Solignac, 2004; Pujol et al, 2000).
Altri farmaci antinfiammatori potenzialmente utilizzabili in corso di CHD sono i corticosteroidi. Questa famiglia di molecole, tuttavia, è in grado di promuovere una significativa inibizione sull’asse ipotalamo-ipofisario, e pertanto è controindicata nelle terapie prolungate, quali devono essere quelle in corso di CHD.
Inoltre i corticosteroidi aumentano il grado di degenerazione cartilaginea inibendo la sintesi di proteoglicani (Moskovitz, 1970); ancora, studi sperimentali eseguiti su condrociti di cavallo hanno mostrato che i corticosteroidi possono aumentare il danno cartilagineo inibendo la proliferazione dei condrociti (Fubini et al, 2001).
Al contrario, i condroprotettori (glucosamina e condroitin solfato) sono importanti per il controllo a lungo termine della CHD, in quanto queste molecole, oltre a non avere effetti indesiderati, inducono la sintesi di nuova matrice cartilaginea, inibiscono la produzione di enzimi quali proteasi, ialuronidasi, collagenasi, ecc. che portano alla distruzione della cartilagine. Esistono inoltre studi che sottolineerebbero le loro proprietà antinfiammatorie (Chan, 2006; Matsuo et al 2003; McNamara et al, 1997). Sempre per quanto riguarda l’attività condroprotettrice, sono oggetto di studi le tetracicline, le quali sembrano inibire numerosi enzimi, tra i quali metalloproteinasi, collagenasi e la gelatinasi, offrendo così un mezzo per trattare l’osteoartrite indipendente dai meccanismi d’azione dei FANS (McNamara et al, 1997; Cylwik et al 2004 (a,b); Patel et al, 1999). Tuttavia esistono ancora controversie riguardo la loro efficacia.
Per il controllo a lungo termine dell’infiammazione possono essere utilizzati anche gli acidi grassi poli-insaturi (omega-3 e omega-6) permettendo così la riduzione di altri farmaci che presentano maggiori effetti collaterali (Wohlers et al, 2003; Lee et al, 2006). Gli acidi grassi poli-insaturi sono inibitori della conversione dell’acido arachidonico in eicosanoidi pro-infiammatori (Arita et al, 2005).
4.3 TRATTAMENTO CHIRURGICO
Sono molte le tecniche chirurgiche che esistono oggi per la displasia. La scelta del trattamento chirurgico più appropriato viene effettuata sulla base di una molteplicità di fattori: l’età dell’animale, il grado di displasia, la presenza o meno di una sintomatologia algica e la comparsa di alterazioni morfologiche a carico dell’acetabolo e della testa femorale (Degenerative Joint Disease, DJD), l’abilità del chirurgo e le disponibilità economiche del proprietario.
In generale le tecniche chirurgiche esistenti possono essere suddivise in tre gruppi (Vezzoni A, 1999):