Università degli studi di Pisa
Tesi di dottorato in
Neuroscienze di base e dello sviluppo
Effetti pro-apoptotici e pro-differenziativi di Ceramide, Sfingosina e
Sfingosina-1-P in neuroblasti ippocampali immortalizzati HN9.10e
Candidato Vladimir Voccoli
Indice analitico
Riassunto pag 1 Abstract pag 2 Capitolo 1 introduzione pag 3 Proliferazione commitment e migrazione pag 5 Elementi della matrice extracellulare pag 10 Differenziamento neuronale pag 15 Rho GTPasi pag 19 Neurotrofine e differenziamento pag 23 Apoptosi pag 27 Gli sfingolipidi pag 32 Metabolismo degli sfingolipidi pag 33 Sfingolipidi come secondi messaggeri pag 38 Sfingolipidi e Ca2+ intracellulare pag 42 Sfingolipidi ed apoptosi pag 45 Ruolo dei metaboliti sfingolipidici nel controllo
della proliferazione e della sopravvivenza pag 47 Sfingolipidi e differenziamento pag 48 Scopo della tesi pag 51 Capitolo 2 Meteriali e metodi pag 52 Sostanze chimiche pag 52 Linea cellulare e condizioni di coltura pag 52 Trattamenti pag 53 Procedura di congelamento e di scongelamento pag 53
Colorazione della cromatina con Hoechst 33258 pag 54 Colorazione cellulare pag 55 Time lapse in luce trasmessa pag 55 Valutazione del contenuto di Ca2+ intracellulare pag 56
Microscopia confocale pag 58
Analisi statistica pag 59 Cameleon: nuovi probes Ca2+ sensibili pag 59 Preparazione del DNA plasmidico pag 62 Estrazione del DNA plasmidico con la Midiprep della Sigma pag 63 Precipitazione del DNA pag 65 Trasfezione con lipofectamina pag 65 Misurazione del Ca2+ nel reticolo utilizzando l’equorinometro pag 66 Capitolo 3 Risultati pag 70 Capitolo 4 Discussione pag 108
Omeostasi del Ca2+ intracellulare in trattamenti
con alte dosi di C2Cer, SP ed S1P pag 109 Basse concentrazioni di C2Cer e di S1P inducono differenziamento pag 112 Omeostasi del Ca2+ nel reticolo endoplasmatico durante il differenziamento pag 115 Conclusioni pag 118 Bibliografia pag 120
Riassunto
Per molti anni gli sfingolipidi sono stati considerati esclusivamente elementi strutturali delle membrane cellulari, oggi invece si sa che sono implicati nel controllo di diversi processi cellulari come la proliferazione, la crescita, la migrazione, il differenziamento e l’apoptosi e costituiscono una classe di molecole bioattive coinvolte, insieme agli enzimi del loro metabolismo, nella trasduzione di diversi tipi di segnale e nella regolazione di alcuni meccanismi cellulari fondamentali: per esempio, mentre la ceramide può mediare ed indurre la morte cellulare, la S1P è risultata essere un secondo messaggero di proliferazione e sopravvivenza oltre che di protezione contro l’apoptosi mediata dalla ceramide. Inoltre Il gruppo di Antony Futherman in un lavoro del 1999 ha descritto un importante ruolo della ceramide nel differenziamento di colture primarie di ippocampo. Lo scopo del presente lavoro di ricerca è stato quello di valutare il ruolo pro-differenziativo e pro-apoptotico di Ceramide, Sfingosina e Sfingosina-1-P sulla linea cellulare HN9.10e prodotta tramite fusione somatica di cellule ippocampali di topo con un neuroblastoma murino ed inoltre poiché questi metaboliti sfingolipidici sono in grado di mobilitare il Ca2+ intracellulare, in questo lavoro abbiamo monitorato le variazioni dell’omeostasi del Ca2+ nel citoplasma, nel reticolo endoplasmatico e nei mitocondri utilizzando diverse tecniche di indagine.
I nostri esperimenti hanno mostrato che alte concentrazioni di questi metaboliti hanno un effetto pro-apoptotico inducendo perdita di Ca2+ dal reticolo endoplasmatico mentre basse concentrazioni hanno un effetto pro-differenziativo e al contrario inducono aumento del Ca2+ nel reticolo endoplasmatico
ABSTRACT
The sphingolipid metabolites are not only structural elements of cellular membranes, today we know that they are involved in the regulation of different cellular processes like proliferation, growth, migration, differentiation and apoptosis and they are a class of bioactive molecules involved with the enzymes of their metabolism, in the transduction of different signals and in the regulation of main cellular mechanism: for instance if ceramide can mediate and induce cell death, S1P appear a second messenger of proliferation and survival other then of protection from apoptosis ceramide mediate. Morover Antony Futerman in 1999 described an important role of ceramide in the differentiation of primary hippocampal culture.
The goal of this research work was to evaluate the pro-differentiative end pro-apoptotic role of Ceramide, Sphingosine and Sphingosine-1-P in the embryonic hippocampal cells HN9.10e and moreover as these sphingolipids metabolites are able to mobilize intracellular Ca2+, in this work we have supervise the variations on the calcium homeostasis in the cytoplasm, in the endoplasmic reticulum and in mitochondria with different metods.
Our experiments have shown that high concentrations of these metabolites are pro-apoptotic and trigger Ca2+ loss from endoplasmic reticulum, while low concentrations are pro-differentiative and on the contrary induce Ca2+ increase in the endoplasmic reticulum.
Capitolo 1
Introduzione
“…quella che forse è la domanda più stimolante di tutte è se il cervello umano sia abbastanza intelligente da risolvere il problema della sua creazione”.
Gregor Eichele; (1992)
La formazione del sistema nervoso ed il suo corretto sviluppo, dipendono dal succedersi di eventi di proliferazione, migrazione, differenziamento e morte cellulare ognuno dei quali deve essere finemente regolato dal punto di vista genetico, biochimico e temporale.
Nei vertebrati la gastrulazione dà origine ad un embrione che possiede un foglietto interno endodermico, un foglietto intermedio mesodermico ed un foglietto esterno ectodermico. L’interazione tra il mesoderma dorsale ed il sovrastante ectoderma è una delle interazioni più importanti di tutto lo sviluppo in quanto dà inizio all’organogenesi; nel corso di questa interazione il cordomesoderma induce nell’ectoderma soprastante la formazione del tubo neurale, una struttura cava che si differenzierà nel cervello e nel midollo spinale.
L’ectoderma originale si dividerà in tre strati di cellule:
1. il tubo neurale che come detto sopra originerà il cervello ed il midollo spinale 2. l’epidermide della cute
3. le cellule della cresta neurale che daranno origine ai neuroni periferici, alla glia, ai melanociti cutanei e ad altri tipi cellulari
Nei mammiferi il tubo neurale è inizialmente una struttura rettilinea, tuttavia, prima che la sua parte posteriore si sia formata, la parte più craniale va incontro a notevoli modifiche morfologiche che più tardi porteranno alla formazione del telencefalo (da cui origineranno gli emisferi cerebrali), del diencefalo (che formerà le regioni talamica ed ipotalamica), del mesencefalo, e del rombencefalo. Mentre l’estremità posteriore del tubo neurale completa la sua chiusura, da ciascun lato del prosencefalo, si estendono delle protuberanze secondarie, le vescicole ottiche.
Il mesencefalo non si divide e ed il suo lume diventa alla fine l’acquedotto cerebrale. Il romboencefalo si suddivide in mielencefalo disposto caudalmente e il mesencefalo disposto più cranialmente. Il mielencefalo diventerà il bulbo mentre il mesencefalo darà origine al cervelletto.
Il tubo Neurale è formato da un neuroepitelio germinativo monostratificato, le cellule si dispongono senza soluzione di continuità dal lume del tubo ai bordi esterni con i nuclei posizionati a differenti altezze assumendo un aspetto pseudostratificato.
La sintesi del DNA (fase S della mitosi) avviene quando il nucleo delle cellule in divisione si trova in prossimità del margine esterno del tubo e si completa sul lato luminale dello strato cellulare. Una volta che la mitosi è terminata, i neuroblasti iniziano a migrare verso la loro localizzazione definitiva guidati da segnali chemiotattici; il successivo differenziamento dipende dalla posizione che queste cellule finiscono per occupare una volta uscite dal ciclo mitotico ed è soggetto all’ambiente biochimico che andranno a trovare. Mentre le cellule adiacenti al lume continuano a dividersi, quelle che iniziano a migrare, formano un secondo strato attorno al tubo neurale originario ispessendosi progressivamente: il nuovo strato prende il nome di zona del mantello mentre l’epitelio germinativo viene chiamato zona ventricolare (Gilbert: Biologia dello sviluppo, Zanichelli)
Proliferazione, commitment e migrazione
Il sistema nervoso è composto dai neuroni ma soprattutto da cellule gliali (più del 90% delle cellule nel cervello umano): astrociti, microglia ed oligodendrociti; quasi tutte le cellule sistema nervoso, vengono prodotte essenzialmente da due zone germinative in prossimità delle pareti del ventricolo: la Zona Ventricolare (VZ) e la Zona Sub-Ventricolare (SVZ) (Guillemot F ; 2005).
La VZ è un epitelio pseudostratificato costituito da cellule neuronali staminali e, nella visione classica, una volta cessata l’attività germinativa, questa regione verrà persa per essere sostituita dal tessuto ependimale, privo d’attività mitotica. Una seconda regione germinativa è la SVZ, adiacente alla VZ, lungo la parete ventricolare laterale nella quale, a differenza della VZ, la neurogenesi continua anche nell’adulto. E’ stato dimostrato che pur scomparendo la zona ventricolare,: alcune cellule della parete ventricolare laterale continuano a mantenere la natura staminale (Morshead CM at al, 1994)
Durante lo sviluppo del telencefalo dei mammiferi i neuroni e la glia vengono generati a partire da tre distinte popolazioni cellulari: neuroni precoci della corteccia, cellule gliali radiali ed infine i progenitori basali (Gots et al, 2005)
Autorevoli lavori di microscopia in time lapse hanno dimostrato che le cellule gliali radiali ed i progenitori basali producono neuroni con meccanismi diversi; le cellule gliali radiali si dividono perlopiù in maniera asimmetrica e la mitosi può produrre o una cellula gliale radiale ed un neurone postmitotico oppure una cellula gliale radiale ed un progenitore basale; i progenitori basali al contrario si dividono sempre simmetricamente producendo due neuroni postmitotici (Noctor et al, 2004).
Figura 1 (a) All’inizio della neurogenesi (nel topo tre E11 ed E12), le cellule neuroepiteliali localizzate nella zona ventricolare (VZ) vanno incontro a migrazioni nucleari; queste cellule possono dividersi o simmetricamente e generare due nuove cellule neuroepiteliali, oppure dividersi in maniera asimmetrica e generare o una cellula neuroepiteliale ed un neurone postmitotico, oppure una cellula neuroepiteliale e un progenitore basale che a sua volta si divide in maniera simmetrica e produce due neuroni postmitotici. (b) Con il procedere della neurogenesi (nel topo tra E13 ed E17), diversi segnali inducono nelle cellule neuroepiteliali, l’espressione di marker gliali; queste cellule diventano cellule gliali radiali e possono dividersi o simmetricamente e generare altre due cellule gliali radiali, oppure dividersi asimmetricamente e generare o una cellula gliale radiale ed un neurone postmitotico, oppure generare un progenitore basale che a sua volta si divide simmetricamente e produrre due neuroni (Guillemot, 2005)
Oltre al tipo di divisione le cellule progenitrici si distinguono anche per una fase G2 più lunga per le cellule della zona subventricolare e per l’espressione di differenti marker. In particolare, solo i progenitori basali esprimeranno marker neuronali indicando che essi sono già “committed” cioè indirizzati, ad un destino neuronale. Esiste una forte correlazione tra la posizione occupata dai progenitori durante la mitosi (apicale o basale), il loro modo di dividersi (simmetrica o asimmetrica) ed il loro sviluppo (pluripotenti o
strettamente neuronali) suggerendo che l’ambiente extracellulare possa influenzare la maniera in cui si divideranno i progenitori (Campbell et al, 2005).
Sono stati descritte diverse vie di segnale e fattori nucleari implicati nella proliferazione, nel mantenimento dello stato indifferenziato o implicati nel commitment neuronale come mostrato in figura 2 e riassunto in seguito.
Figura 2 Alcuni stimoli che si sono rivelati indurre rigenerazione di cellule staminali telencefaliche, commitment neuronale, differenziamento in neuroni maturi o in astrociti (Guillemot, 2005).
La via di segnale che coinvolge Notch fa in modo da mantenere le cellule nello stato indifferenziato isolandole dagli stimoli di specificazione provenienti dall’esterno: cosicché i progenitori che sfuggiranno da questo effetto inibitorio di Notch in tempi diversi saranno indirizzati verso destini differenti (Hatakeyama et al, 2004; Mizutani et al, 2005). Recentemente è stato descritto che l’attivazione di Notch1 in alcune cellule le fa differenziare in cellule radiali gliali (Yoon et al, 2004; Ever et al, 2005). L’attività di Notch è
richiesta solo durante la neurogenesi quando i progenitori si dividono asimmetricamente; in questa fase differenti combinazioni dei recettori per la proteina Notch stabiliranno se il neurone che si formerà sarà di tipo precoce o tardivo (Mason et al, 2005).
L’FGF2 sembra avere gli stessi effetti di Notch (mantenimento dello stato indifferenziato) e induce un fenotipo gliale radiale facendo ipotizzare un’attività coordinata di queste due proteine (Yoon et al, 2004).
Un’altra proteina coinvolta nel signaling neurogenico è Numb, un inibitore intracellulare di Notch, la quale induce la cellula che la esprime ad uscire dal ciclo mitotico (Petersen et al, 2004) .
Anche la via di segnale che coinvolge Wnt ha un ruolo importante sull’attività delle cellule staminali nervose. Durante lo sviluppo corticale le forme stabilizzate di β-catenina promuovono sia il mantenimento dello stato indifferenziato (Chenn et al, 2002) sia il differenziamento (Hirabayashi et al, 2004), in relazione al momento in cui esse vengono espresse suggerendo che un meccanismo temporale modifichi la risposta dei progenitori corticali a Wnt; il responsabile sembra essere l’FGF2 il quale modifica la risposta delle cellule progenitrici alla β−catenina. In presenza dell’FGF2 si ha un aumento dell’attività proliferativa mentre in sua assenza aumentano le cellule che iniziano a differenziarsi.( Israsena et al, 2004).
L’azione proliferativa di Wnt è mediata dall’espressione di Emx2 (Viti et al, 2003) mentre i complessi di β-catenina attivano direttamente la trascrizione di geni pro-neurali bHLH tra cui Neurogenina 1 e 2 (Hirabayashi et al, 2004; Israsena et al, 2004). Il commitment neuronale ed il successivo differenziamento, oltre all’attivazione di induttori pro-neurali come bHLH, necessita anche di repressori di tali geni nelle cellule non neurali: REST/NRSF è un noto repressore di geni neurali; infatti la progressiva transizione da cellula totipotente a staminale neuronale ed infine a neurone, coinvolge la riduzione della
capacità di REST di legarsi ai promotori dei geni neuronali, processo nel quale è coinvolta l’espressione del gene pro-neurale Mash1 (Ballas et al, 2005).
Gli astrociti si differenziano dopo i neuroni ed il loro differenziamento non è semplice; in questa fase viene indotta l’espressione di marker astrocitari e di repressori di geni pro-neurali, un processo che coinvolge la multipla attivazione di diverse vie di segnale incluse BMP/Smad, JAK/STAT and Notch pathways (Hirabayashi et al, 2004; He et al, 2005; Kamakura et al, 2004)
Dopo che i precursori post-mitotici sono stati specificati ad un particolare destino neuronale, le cellule migrano verso la loro destinazione definitiva, acquistano la morfologia assonica e dendritica matura e creano connessioni sinaptiche.
La migrazione delle cellule nervose è un processo critico per il corretto sviluppo e funzionamento del sistema nervoso;nel cervello e nel cervelletto, sono stati descritti due tipi di migrazione:
la migrazione radiale, nella quale i neuroni migrano lungo cellule gliali radiali guida, perpendicolari allo strato germinativo (Sobeih and Corfas , 2002)
la migrazione tangenziale che riguarda i neuroni generati in fasi precoci, nella quale le cellule che migrano, sembrano essere attaccate una all’altra formando delle file di neuroni in migrazione (Lois et al.,1996; Sobeih and Corfas , 2002).
Recenti studi hanno dimostrato che differenti popolazioni di neuroni utilizzano differenti tipi di migrazione; per esempio, nella corteccia, i precursori dei neuroni eccitatori, migrano dalle zone germinative corticali agli strati corticali, con migrazione radiale, mentre,i precursori degli interneuroni inibitori migrano, dallo strato germinativo alla corteccia con migrazione tangenziale (Marin end Rubenstein, 2001; Parnavellas, 2000)
Quindi la glia radiale oltre ad essere un precursore neuronale è anche essenziale per la migrazione delle altre cellule nervose; è stato dimostrato che il fattore di crescita NRG1 ed
il suo recettore erbB inducono la formazione di cellule gliali radiali mentre il blocco del recettore ne impedisce la formazione (Rio et al., 1997). Trattamenti con NRG1 inducono allungamento delle fibre radiali, accelerazione dei movimenti cellulari ed espressione di BLBP una proteina gliale critica per la migrazione (Anton et al., 1997).
La migrazione, che sia radiale o tangenziale, attiva le cellule in uno stato mobile nel quale diventano sensibili agli stimoli guida che ne dirigeranno i movimenti; una volta raggiunta la propria destinazione la cellula dovrà interrompere la migrazione e prendere la sua posizione definitiva in modo da stabilire le corrette connessioni sinaptiche. Ognuno di questi passaggi dipende da fattori extracellulari che la cellula incontra durante il proprio cammino e che contribuiscono a cambiarne il comportamento, regolandone i movimenti (segnali induttori o inibitori), modulando la velocità (intensificando o silenziando i segnali) e influenzando la direzione di migrazione (con sostanze chemioattrattive o chemiorepellenti). Questi agiscono intracellularmente attraverso vie di segnale a cascata che in ultimo regolano i rimodellamenti del citoscheletro necessari per il movimento mediati dalle GTPasi della famiglia di Rho (Sobeih and Corfas , 2002).
Questi stimoli possono essere di diversa natura: elementi della matrice extracellulare che includono la reelina, le integrine, le HSPG e le laminine; molecole di adesione cellulare, proteine di membrana come le CAMs capaci di legare molecole presenti nella matrice; fattori solubili prodotti dalle cellule target come per esempio le neurotrofine ed altri fattori solubili non neurotrofici tra cui le semaforine e le netrine (Sobeih and Corfas; 2002).
Elementi della matrice extracellulare (ECM)
Il meglior esempio e la meglio studiata è la reelina, una grande proteina extracellulare che quando è mutata causa assenza di migrazione come osservato nei topi mutanti reeler (D’Arcangelo et al, 1995 ) e negli esseri umani malati di lissencefalia con ipoplasia del
cervelletto (LCH)(Hong et al., 2000). I topi reeler presentano diversi difetti neuroanatomici tra cui la corteccia invertita e anormali morfologie delle cellule del Purkinjee . Nel cervello la reelina è espressa dalle cellule di Cajal-Retzius (un tipo di cellula gliale) ed è stato proposto che questa proteina, sia necessaria al distacco, una volta raggiunta la sua destinazione finale, della cellula che sta migrando dalla glia radiale che la guida. Il mancato distacco delle cellule più vecchie, non permette ai neuroni più giovani di oltrepassarle per raggiungere la loro posizione oltre di esse; ne risulta così una distribuzione degli strati corticali invertita. Ci sono forti evidenze che la reelina agisca attraverso ApoER2 , VLDLR (D’Arcangelo et al, 1995; Hiesberger et al., 1999), Dab (Howell et al., 1997) e i cadherin-related neuronal receptors (CNR) (Senzaki et al., 1999) e che la migrazione sia mediata dall’interazione con i recettori α3β1 per l’integrina (Dulabon et al., 2000).
Le integrine sono molecole di membrana responsabili dell’interazione delle cellule con la matrice extracellulare ed è stato dimostrato che bloccando l’integrina α6β1, le cellule non sono più in grado di formare le colonne di neuroblasti migranti, tipici della migrazione tangenziale; al contrario usando agonisti si ha un aumento delle file di cellule migranti (Jaques et al., 1998)..
Le HSPG e le laminine sono altri componenti della matrice che influenzano la migrazione delle cellule nervose: proteine con una forte carica negativa le quali interagiscono con diversi altri elementi della matrice e con la membrana delle cellule; sembra che queste proteine agiscano mediando gli effetti di Slit-2 (un chemiorepellente) mentre è stato dimostrato che in vitro le laminine siano richieste per la migrazione dei granuli del cervelletto (Mecham, 1991). Anche i proteoglicani hanno azione sulla migrazione con effetto chemiorepellente (Porcionatto 2006).
Concludendo, la matrice extracellulare non solo contiene molecole che hanno azione diretta sulla motilità ma è anche il sito in cui vengono deposti fattori solubili che regolano i movimenti dei neuroni.quindi:
¾ contribuisce alla formazione di gradienti attrattivi o repulsivi ¾ regola la formazione di strutture necessarie alla migrazione
¾ modula o potenzia i segnali dei recettori coinvolti nella migrazione ¾ presenta alle cellule combinazioni di stimoli inducendo azioni differenti
Anche le molecole di adesione cellulare (CAMs) sono importanti per la migrazione neuronale: DM-GRASP è una proteina transmembrana implicata nella migrazione cellulare, nella crescita degli assoni e nella fascicolazione (Bowen et al 1995, Tanaka 1991); in base ai loro studi sull’embrione di pollo, Heffron e Golden nel 2000 hanno suggerito che questa proteina sia implicata nella migrazione tangenziale: bloccandola gli autori hanno osservato una specifica inibizione della migrazione tangenziale ma non di quella radiale che causa un diencefalo ridotto di dimensione e morfologicamente disorganizzato, dimostrando l’importanza di DM-GRASP nello sviluppo del cervello (Heffron and Golden, 2000).
I fattori solubili regolano diversi aspetti dello sviluppo del sistema nervoso dei vertebrati a partire dalle prime fasi dell’induzione neurale fino alla regolazione della plasticità sinaptica; questi fattori agiscono promuovendo la sopravvivenza dei neuroni ed il loro differenziamento morfologico e funzionale. In virtù della loro capacità di diffondere, i fattori solubili, possono creare gradienti nelle regioni del cervello che si stanno sviluppando fornendo alle cellule informazioni sulla loro posizione, la direzione di migrazione e quella nella quale emettere i prolungamenti (Sobeih and Corfas; 2002). Possono avere diversi effetti in relazione al tipo cellulare, alla fase dello sviluppo in cui si trovano le cellule ed alla posizione occupata: così, ad esempio, un fattore può promuovere la migrazione di un determinato tipo cellulare e poi promuoverne la sopravvivenza come fa il BDNF con i
granuli del cervelletto. Molti fattori, indicati in principio come promotori di sopravvivenza, si sono poi dimostrati induttori di migrazione (Sobeih and Corfas; 2002).
Tutte le neurotrofine conosciute (il Nerve Growth Factor, NGF, il Brain Derived Neurotrophic Factor, BDNF e le neurotrofine 3 e 4, NT 3/4), oltre a regolare la sopravvivenza, regolano anche la migrazione cellulare e la formazione dei prolungamenti (assoni e dendriti). Il BDNF per esempio regola l’espressione della reelina da parte delle cellule gliali radiali di Cajal-Retzius ed ha azione chemioattrattiva per le cellule neuronali (Ringstedt et al., 1998)
Le chemochina SDF-1 è espressa nella pia madre cerebellare e il suo solo recettore CXCR4 è espresso nei precursori delle cellule dei granuli; delezioni di ognuno di questi geni provoca migrazione prematura delle cellule dei granuli (Ma et al 1998; Zou et al 1998), suggerendo che SDF-1 sia un segnale che impedisce, alle cellule granulari del cervelletto, di lasciare lo stato germinativo; è stato dimostrato che SDF-1 è chemioattrattivo per le cellule granulari (Klein et al. 1998). Studi sui meccanismi di segnale hanno rivelato che l’azione chemioattrattiva di SDF-1 è bloccata dall’ efrina B e l’ultima parte della via di segnale coinvolge il BDNF che è fortemente espresso durante lo sviluppo del cervelletto con una elevata espressione nello strato granulare interno. E’ stato dimostrato che nei topi BDNF -/- ci sono difetti che impediscono l’inizio della migrazione lungo le fibre delle cellule gliari ed in vitro il difetto è recuperato dalla somministrazione esogena della neurotrofina; è interessante notare che il BDNF funzioni anche da chemioattrattivo per questi neuroni. Una possibile via di segnale prevede che SDF-1 trattenga i precursori delle cellule dei granuli nello strato germinativo dove sono esposti all’azione dei mitogeni che continuano a farli proliferare; in una fase successiva l’efrina B rende i neuroni via via meno sensibili all’SDF-1 rendendoli capaci di rispondere agli stimoli attrattivi del BDNF e migrare verso lo strato granulare interno (Borghesani et al., 2002)
Oltre alle neurotrofine, anche una serie di fattori non trofici provvedono a guidare le cellule nervose durante la migrazione; le semaforine, proteine secrete, agiscono tramite recettori di membrana noti come neurofilina e plexina e risultano essere potenti chemiorepellenti per i coni di crescita e gli assoni; come altri fattori guida per gli assoni sono anche coinvolte nella migrazione neuronale.
I neuroni generati nell’eminenza gangliare mediana (MGE) producono due distinte popolazioni che migrano anche in differenti aree della corteccia e dello striato: le cellule che migrano per prime evitano lo striato e raggiungono la corteccia; Marin e Rubenstain (2001) hanno dimostrato che lo striato in via di sviluppo esprime la semaforina mentre le neurofiline sono espresse dalle cellule dell’MGE e queste molecole mediano la repulsione verso lo striato in modo da evitarlo per raggiungere la corteccia (Marin and Rubenstain, 2001). Un altro chemiorepellente nella migrazione neuronale è la proteina Slit, identificata in Drosophila: in vitro è un segnale repulsivo per le cellule della zona sub-venticolare anteriore (SVZa) inibendone la migrazione; Slit agisce in maniera dose dipendente con un effetto più forte sulle cellule vicine al punto di produzione della proteina ed un effetto minore allontanandosi da esso (Mason et al.,2001).
Un fattore non trofico che invece ha funzione chemioattrattiva è la netrina-1: i topi mutanti per la proteina o il suo recettore DCC perdono i nuclei pontini. Usando saggi in vitro è stato dimostrato che la netrina-1 è un chemioattrattivo per i primi processi delle cellule che migrano dal neuroepitelio romboencefalico dorsale; nei topi knock out queste cellule non riescono a raggiungere la loro destinazione, facendo ipotizzare che per dirigere le cellule sia sufficiente un gradiente di netrina-1 (Yee et al 1999).
Differenziamento neuronale
Subito dopo il commitment neuronale, stimoli extracellulari inducono nei neuroblasti il processo noto come neuritogenesi che cambierà radicalmente la morfologia e le funzioni delle cellule. Durante questo processo, dal corpo cellulare inizialmente tondeggiante vengono emesse una serie di protrusioni (coni di crescita) le quali, in seguito, si differenzieranno nell’ assone e nei dendriti. Notoriamente una cellula nervosa è costituita dal corpo cellulare (soma) e da diversi tipi di prolungamenti: i dendriti che serviranno per ricevere le informazioni dai neuroni presinaptici e l’assone il quale ha invece la funzione di dirigere l’informazione sui neuroni postsinaptici. Esiste un’ampia varietà di cellule nervose e di cellule gliali, ognuna delle quali presenta una diversa morfologia dei prolungamenti come riassunto nelle figura 3.
Figura 3 Morfologie di cellule nervose (Kandel)
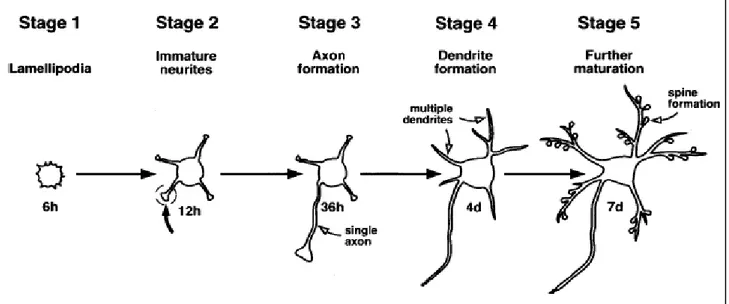
Il processo di emissione dei prolungamenti cellulari è stato studiato estesamente in colture primarie di ippocampo e lo sviluppo di cellule nervose mature è stato riassunto in cinque tappe fondamentali (Figura 4).
Figura 4 Stadi di sviluppo di cellule ippocampali. Dopo 6 ore i neuroni di colture primarie di ippocampo aderiscono al substrato formando lamellipodi (stage 1), le cellule iniziano a emettere coni di crescita e piccoli neuriti (stage 2). Dopo 36 ore le cellule acquistano la polarità e allungano l’assone (stage 3), dopo 4 giorni si sviluppano i dendriti (stage 4) e dopo una settimana presentano sinapsi e spine dendritiche (stage 5) (Dotti et al, 1988).
Dopo essere state piastrate, le cellule hanno un aspetto rotondeggiante e sono debolmente aderenti al substrato (stage1); dopo circa 6 ore le cellule aumentano la loro aderenza al substrato ed iniziano ad emettere i primi lamellipodi alla cui estremità è possibile osservare la rapida emissione ed altrettanto rapida retrazione di più piccoli prolungamenti digitiformi noti come filopodi (stage 2) i quali risultano essere delle vere e proprie strutture sensoriali, fornite di un ricco corredo recettoriale. I filopodi sono in grado di percepire gli stimoli provenienti dal mezzo extracellulare e guidare il cono di crescita nel suo sviluppo. Dopo 24h uno dei neuriti si allunga senza più ritrarsi formando quello che sarà poi l’assone (stage 3).
Quando un prolungamento si differenzia in un assone, il neurone si dice polarizzato; recenti esperimenti hanno dimostrato l’importanza della PI 3-chinasi e del PI(3,4,5)P3 nell’indurre e mantenere la polarità del neurone: l’enzima si localizza all’apice dei coni di crescita, stimolato dal contatto delle CAMs con elementi della matrice extracellulare come la laminina e le integrine e stimola la produzione di PIP3. A dare forza a questa ipotesi c’è la dimostrazione che l’utilizzo di inibitori della PI 3-chinasi impediscono anche la
formazione dell’assone (Animura and Kalbuki, 2005) . Da Silva et al. nel 2003 hanno dimostrato che anche il ganglioside-converting enzime (PMGS) è necessario per l’emissione dell’assone. Gli autori hanno dimostrato che il PMGS si accumula in maniera asimmetrica all’estremità del futuro assone e ne promuove l’allungamento accelerando l’attività dei recettori TrkA (il recettore per l’NGF); la sua assenza impedisce invece la formazione dell’assone (Da Silva et al. 2003).
Una volta formato l’abbozzo dell’assone, questo cresce ad una velocità maggiore rispetto agli altri prolungamenti (stage 4) e una volta che il neurone avrà raggiunto la sua posizione definitiva, la cellula inizierà a formare le sinapsi che le permetteranno di entrare in relazione con le cellule vicine (stage 5) (Dotti et al., 1988; Higgins et al., 1997; Da Silva and Dotti, 2002; Arimura et al., 2004 ).
Come detto in precedenza, sia le molecole di adesione cellulare che alcune molecole implicate nella migrazione dalle cellule nervose sono anche implicate nella formazione dell’assone e dei dendriti.
Le Semaforine sono dei potenti fattori chemiotattici per i coni di crescita e gli assoni; in meno di 10 anni ne sono state clonate 30 varianti raggruppate in 7 sottogruppi: i primi 2 gruppi raccolgono le semaforine degli invertebrati, le sottoclassi 3,4,6 e 7 raccolgono le semaforine dei vertebrati mentre quelle di classe 5 sono state ritrovate sia nei vertebrati che negli invertebrati comunque tutte le semaforine presentano una regione di 500 amminoacidi altamente conservata e presente anche in altre proteine (Winberg et al.,1998).
Le semaforine, conosciute anche come collassine, sono proteine secrete capaci di legarsi alle membrane e promuovere sia attrazione che repulsione, ma generalmente funzionano come chemiorepellenti ed allontanano gli assoni dal tessuto che le esprime. Gli effetti di queste proteine sono mediati da diversi complessi recettoriali che comprendono i membri delle neuropiline e delle plexine così come altre proteine che fanno parte della
superfamiglia delle immunoglobuline (Raper 2000, Huber et al. 2003). Semaforina 3A, 3D e 4D causano collasso del cono di crescita ed inibizione dell’allungamento dell’assone (Swierez et al., 2002). Nel pollo la semaforina 3D induce collasso del cono di crescita mediato dalla GTPasi Rac1 (che interagisce direttamente col recettore plexina-B1). In Drosophila è stato dimostrato che l’azione inibitoria sui coni di crescita esercitata dalla plexina-B1 e dovuta ad un’azione inibitoria del recettore sulla stessa Rac sequestrandola alla proteina PAK e contemporaneamente attivando RhoA, un’altra GTPasi implicata nel differenziamento neuronale (Hu et al.,2001); recentemente è stato dimostrato che il meccanismo di attivazione di RhoA da parte della plexina-B1 coinvolge la tirosin chinasi ErbB-2 ed il legame della semaforina 4D con Plexina B1 stimola l’attività chinasica di ErbB-2 che si autofosforila e causa la fosforilazione del recettore. Nel complesso questi dati suggeriscono che l’attivazione della plexina regoli in maniera coordinata sia l’attività di Rac che di RhoA, fattori essenziali per il differenziamento cellulare in quanto agiscono sul citoscheletro rimodellandolo (Swierez et al.,2004).
Le Efrine sono molecole legate al glicosilfosfatidilinositolo e ligandi dei recettori Eph ad attività tirosin-chinasica; anche queste proteine, come le semaforine causano collasso del cono di crescita regolando l’attività di Rho; trattando colture di neuroni dei gangli delle radici dorsali (DRG) di pollo con Efrina A5 è stata dimostrata attivazione di RhoA ed inibizione dell’attività di Rac (Wahl et al. 2000), mentre Efrina A2 richiede l’attivazione di Rac per indurre collasso del cono di crescita causando depolimerizzazione e riorganizzazione dei filamenti di F-actina, una specifica actina presente nelle zone altamente mobili della cellula (Govek et al., 2006).
Le Netrine sono una famiglia di proteine secrete altamente conservata che possono agire sia da chemioattrattori che da chemiorepellenti per i coni di crescita. I recettori delle Netrine includono i membri della famiglia delle DCC, come Unc40, Frazzled, DCC e Neogenina. Il corredo dei complessi recettoriali stabilisce se l’effetto debba essere di
attrazione o repulsione: per esempio il legame delle netrine con gli omodimeri DCC causa effetto attrattivo mentre il legame con gli eterodimeri UNC-5/DCC causa chemiorepulsione (Chisholm and Tessier-Lavigne, 1999; Huber et al, 2003). Evidenze in cellule nervose e non nervose suggeriscono che il signalling innescato dal legame della netrina-1 con i DCC, tramite la proteina adattatrice Nck, induca riarrangiamenti del citoscheletro mediati dalle GTPasi Rac e Cdc-42 (X.Li et al 2002a).
Rho GTPasi
I membri della famiglia delle Rho GTPasi includono Rho (RhoA, RhoB, RhoC, RhoD, RhoT), Rac (Rac1, Rac2 e Rac3), Cdc-42, TC10, TCL, Wrch1, Chp/Wrc2, Rhog, RhoH/TTF e Rnd (Rnd1, Rnd2 e Rnd3/RhoE (Van Aelst e D’Souz-Schorey, 1997; Burridge e Wennerberg 2004). Sono delle proteine a basso peso molecolare che legano i nucleotidi guanidinici ed agiscono come molecole binarie cambiando ciclicamente da uno stato attivo capace di legare il GTP ad uno inattivo che lega il GDP. La loro attività nella cellula è determinata dal rapporto intracellulare tra GTP e GDP e può essere influenzata da un gran numero di diverse molecole regolatrici.
Di questa famiglia di GTPasi le meglio caratterizzate sono RhoA, Rac1 e Cdc-42 per i loro effetti sul citoscheletro; in studi classici su fibroblasti, l’attivazione di RhoA, Rac1 e Cdc-42 porta alla riorganizzazione del citoscheletro di actina in strutture distinte: stress fibers e adesione focale, formazione di lamellipodi e di filopodi. Oltre all’azione sul citoscheletro sono state anche descritte azioni sull’attivazione trascrizionale, sul traffico delle membrane e sulle dinamiche dei microtubuli. Queste azioni contribuiscono nel regolare la crescita cellulare, la citodieresi, la motilità cellulare, l’adesione tra cellule e tra cellule e matrice extracellulare, la trasformazione cellulare e l’invasività e recentemente lo sviluppo
neuronale: in particolare queste molecole hanno azione in tutti i processi di differenziamento nervoso: dall’induzione della polarità, allo sviluppo di lamellipodi e filopodi, dalla retrazione neuritica alla ricerca chemiotattica del target, dallo sviluppo dell’albero dendritico alla plasticità sinaptica ( Govek et al, 2006)
Gli effettori meglio conosciuti attivati da Rac1 e Cdc-42 sono la famiglia delle p21-activated kinase (PAK) delle quali sono stati identificati 6 membri(PAK1-6). E’ stato descritto un ruolo di queste proteine nel regolare le dinamiche citoscheletriche e l’espressione genica (Jaffer and Chernoff 2002, Bokoch 2003). Un altro meccanismo attraverso il quale Rac e Cdc-42 trasferiscono segnali al citoscheletro è quello attraverso le Wiskottt-Aldrich-sindrome protein (WASP) delle quali esiste un membro neuronale (N-WASP) anch’esso regolato da Cdc-42 (Rohatgi et al., 1999). Altri tre membri di questa famiglia di proteine (Wave 1-3) mediano i processi sull’actina indotti da Rac1; entrambe queste famiglie di proteine agiscono sul citoscheletro attraverso l’interazione con il complesso Arp2/3 e mediano le azioni di Rac1 senza che lo leghino (Machesky et al., 1999)
Un’altra molecola, l’IRSp53, si è rivelata legare sia Rac e Cdc-42 a WAve2 e l’Ena dei mammiferi (Mena) rispettivamente (Miki et al. 2000).
Si sa che anche le Diaphanous-releted formin hanno la capacità di legare le GTPasi della famiglia di Rho, tra queste ricordiamo mDia1 che lega RhoA-C, mDia2 che si lega a RhoA e Cdc-42 e dinfine mDia3 che è in grado di legarsi a Cdc-42, RhoA, Rac1 e RhoD (Olsen, 2003). Prese nel complesso questi studi mostrano come le Rho GTPasi esplichino le loro azioni sul citoscheletro attraverso un gran numero di effettori.
Studi su linee cellulari neuronali hanno stabilito il coinvolgimento delle Rho GTPasi nella formazione dei neuriti suggerendo che agiscano antagonisticamente l’una a l’altra.
Nelle PC12 la formazione di neuriti NGF-mediata dipende dall’attività di Rac1 e Cdc-42. Nelle PC12, subito dopo la somministrazione di NGF, si osserva l’attivazione transiente di
Rac1 e Cdc-42 in ampie zone alla periferia della cellula con successivi cicli di attivazione e disattivazione di queste GTPasi all’apice dei processi cellulari mobili (es filopodi) (Aoki et al 2004). Al contrario l’attivazione di RhoA è generalmente associata con l’inibizione della crescita neuritica e con la loro retrazione sia nelle PC12 che in cellule di neuroblastoma NIE-115.(Yamaguchi et al 2001). Riassumendo, quindi, l’attivazione di Rac1 e di Cdc-42 è associata alla formazione di lamellipodi, filopodi ed al processo di formazione dei neuriti mentre l’attivazione di RhoA previene la formazione dei neuriti e ne induce la retrazione; la sovrespressione di RhoA inibisce inoltre la formazione di neuriti indotta dalle neurotrofine. Questi studi indicano che la regolazione dell’attività di queste GTPasi è indispensabile per il normale sviluppo dei neuriti ed il loro allungamento.
E’ noto che l’induzione neuritica promossa dall’NGF richieda la modulazione dell’attività delle Rho GTPasi. In particolare i recettori per l’NGF, i TrkA mediano l’attivazione di Rac1 da parte dell’NGF e la simultanea inibizione di RhoA; la PI3-chinasi è richiesta sia nell’attivazione di Rac1 e di Cdc-42 che nell’inattivazione di RhoA da parte dell’NGF (Nusser et al, 2002) proponendo questo meccanismo di segnale nell’induzione neuritica da parte dell’NGF: L’NGF si lega a TrkA che attiva Ras il quale lega e attiva sia Rac1 che Cdc-42 con una concomitante riduzione dell’attività di RhoA e della RhoA chinasi. Inoltre è stato scoperto che Rac e Cdc-42 medino gli effetti pro-differenziativi di un’altra piccola GTPasi simile a Ras: Rin la quale è espressa solo nei neuroni adulti ed è in grado di legare la calmodulina. L’espressione di Rin nelle PC12 aumenta l’attività di Rac e Cdc-42 ed induce la formazione di neuriti in maniera MAP-Kinasi indipendente (Lee et al., 1996). Una volta attivate Rac e Cdc-42 si legano e attivano molecole effettrici a valle del processo tra cui le PAK chinasi coinvolte anch’esse nel processo di formazione dei neuriti (Daniels et al., 1998).
Mentre l’attivazione di Rac e Cdc-42 accoppiata all’inattivazione di RhoA induce neuritogenesi, l’attivazione di RhoA antagonizza questi effetti causando la retrazione dei
neuriti; un processo fondamentale nel guidare gli assoni in formazione e nella plasticità sinaptica. L’attivazione di Rho e la retrazione neuritica sono state associate all’attivazione di recettori accoppiati a proteine G da parte dell’LPA (acido lisofosfatidico), al peptide attivatore dei recettori per la trombina, all’attivazione dei recettori per la prostaglandina E ed infine più importanti per il nostro lavoro, l’attivazione dei recettori per la S1P (Jalink et al., 1994; Katoh et al 1996, 1998; Postma et al 1996).
Altre Rho GTPasi che giocano un importante ruolo nella formazione e nella retrazione dei neuriti sono: RhoG, Rnd1/2, TC10 e RhoT. RhoG promuove la formazione di neuriti oltre che essere coinvolta in molti altri processi; a valle di Ras, RhoG attiva Rac e Cdc-42 ed è in grado di indurre la formazione di neuriti nelle PC12 indipendentemente dalla stimolazione dell’NGF, ma ne amplifica la capacità di indurre sprouting in sua presenza (Govek et al., 2006).
Le semaforine inducono collasso del cono di crescita in maniera Rho-mediata: in particolare in Drosophila il recettore delle semaforine, la plexina-B, è associata a Rac inibendone l’azione pro-differenziativa sequestrandola da PAK ed aumentando l’attività di RhoA e regolando così in maniera coordinata la migrazione repulsiva. Nello stesso modo trattamenti con efrina-A5 in colture di cellule gangliari di retina (RCG) di pollo stimolano l’attività di RhoA mentre riducono quella di Rac (Wahl et al., 2000).
Inoltre, sempre in colture di RCG di pollo, l’inattivazione di Rho permette l’allungamento dei dendriti mentre la sua attivazione ne causa retrazione , in questo modo non solo le Rho GTPasi hanno un ruolo nella formazione dei dendriti ma anche nel loro rimodellamento durante i processi di plasticità (Wong et al., 2000; Nakayama et al., 2000). Risulta così evidente che i membri delle Rho-GTPasi giochino un ruolo importante nella formazione del sistema nervoso, principalmente per il loro ruolo nel rimodellamento citoscheletrico, ma, in più, risultano indispensabili nella neuritogenesi, nella formazione
dell’albero dendritico e nella plasticità sinaptica che è alla base dei processi cognitivi e mnemonici.
Neurotrofine e differenziamento
La famiglia delle neurotrofine comprende 4 proteine strutturalmente correlate: l’NGF (nerve growth factor), il BDNF (brain derived neurotrophic factor) e le neurotrofine (NT)-3/4 che svolgono la loro azione attraverso il legame col recettore a bassa affinità p75NTR e attraverso i recettori tirosin chinasi ad alta affinità (Trk) (Chao, 1992; Lindsay et al 1994). L’NGF attiva TrkA, il BDNF e la neurotrofina 4, TrkB mentre TrkC viene attivato dalla neurotrofina3 la quale può legare più debolmente anche Trka e TrkB; sia le neurotrofine che i loro recettori sono altamente espressi nel sistema nervoso in sviluppo nel quale promuovono crescita, differenziamento e sopravvivenza (McAllister et al.,1999).
Figura 8 Schema riassuntivo dei segnali indotti dal legame delle neurotrofine con i loro recettori: l’NGF induce l’emissione dei neuriti attraverso l’attivazione della PLC- mentre la crescita neuritica indotta dalla NT-3 e dal BDNF, è mediata dalla PKA. l’aumento di sprouting neuritico, indotto dall’NGF richiede inoltre l’attivazione della PI3K
Le neurotrofine sono potenti regolatori della crescita neuronale sia nel sistema nervoso periferico sia in quello centrale promuovendo l’induzione e lo sviluppo degli assoni in specifiche popolazioni di neuroni (Levi-Montalcini et al., 1954; Thoenen, 1991; Snider, 1994). Esperimenti in vitro hanno dimostrato che tutte le neurotrofine possono mediare la guida chemiotattica degli assoni in sviluppo così come quella dei coni di crescita e lo sviluppo dell’arborizzazione assonica (Campenot, 1982; Gunderson and Barret, 1979; Ming et al 1997).
Queste importanti molecole possono anche agire in maniera bifunzionale cioè sia da chemioattrattori che da chemiorepellenti (Paves and Saarma, 1997); per esempio nella corteccia visiva, la NT3 si è dimostrata essere chemioattrattiva per gli assoni dei neuroni dello strato numero 6 mentre repulsiva per quelli degli strati 2 e 3 (Castellani and Bolz, 1999); per capire meglio come si esplichi quest’azione bifunzionale, l’attenzione dei ricercatori si è focalizzata sul tipo di recettore con cui la trofina si lega e la particolare cascata enzimatica che da questo legame ne consegue.
In una serie di eleganti esperimenti Poo e colleghi hanno dimostrato chiaramente che i livelli di nucleotidi ciclici (cAMP o cGMP) durante la crescita assonica condiziona la risposta attrattiva o repulsiva ad una specifica neurotrofina (Song et al., 1997); è stato inoltre dimostrato che quest’effetto bifunzionale sulla guida assonica possa essere mediato da piccole GTPasi della famiglia di Rho infatti recentemente è stata dimostrata un’interazione diretta tra il recettore p75NTR e la GTPasi RhoA implicata nella riorganizzazione del citoscheletro (Yamashita et al.,1999).
Il legame della trofina con il suo recettore Trk porta alla dimerizzazione del recettore ed alla sua autofosforilazione che poi induce la cascata intracellulare. Tre enzimi in particolare sono stati implicati nei rimaneggiamenti del citoscheletro dell’assone e nella mobilità neuronale; questi sono la protein chinasi A (PKA), il fosfatidil inositolo 3 chinasi (PI3-K) e la fosfolipasi C (PLC-γ) (Gallo et al., 2002; Jackson et al., 1996; Lavie et al
1997). In particolare l’NGF induce l’emissione dei neuriti attraverso l’attivazione della PLC-γ ( Inagaki et al., 1995) mentre la localizzazione degli mRNA per la β-actina nei coni di crescita e negli assoni indotta dalla NT-3, è mediata dalla PKA (Bassel et al.,1998). La PKA è anche implicata negli effetti mediati dal BDNF. Inoltre è stato dimostrato che una fonte localizzata di neurotrofina può attivare direttamente la motilità actina-dipendente lungo gli assoni attraverso una via dipendente dalla PI3K che causa branching collaterale ed estensione dei filopodi. In particolare nei neuroni del ganglio dorsale (DRG) l’aumento di sprouting assonico, indotto dall’NGF richiede l’attivazione della PI3K mentre il suo blocco con la wortmannina blocca la risposta delle cellule nervose all’NGF (Gallo et al., 2002).
E’ stato dimostrato che il signalling a valle del legame delle neurotrofine con gli specifici recettori che induce sprouting neuritico regola la fosforilazione del complesso ADF/cofilina diminuendo i livelli del complesso fosforilato e stimolando in questo modo lo sviluppo di neuriti (Meberg et al., 1998). Sono molti i fattori che entrano in gioco durante il differenziamento neuronale indotto dalle neurotrofine e sicuramente una parte importante la compiono le GTPasi appartenenti alla famiglia di Rho tra cui Rac1, Cdc-42 e RhoA le quali inducono i rimodellamenti del citoscheletro necessari per il differenziamento. Quest’azione di riorganizzazione citoscheletrica nel cono di crescita e nell’assone indotta dai membri della famiglia di Rho è mediata dall’attivazione delle LIM chinasi che, fosforilate, regolano l’attività del complesso ADF/cofilina; in particolare la fosforilazione della cofilina inibisce la crescita assonica (Kuhn et al.,2000). Nello stesso modo il legame delle diverse neurotrofine agli specifici recettori induce un aumento del cAMP che aumenta i livelli di PKA; è stato dimostrato che l’aumento dell’attivazione della PKA porta alla fosforilazione di RhoA che determina una diminuzione dell’attività di LIMK1, una diminuzione della fosforilazione della cofilina ed aumento della crescita assonica (Kao et al., 2002; Faucheux and Nagel, 2002).
Anche il legame col recettore p75 è coinvolto nel signalling differenziativo indotto dalle neurotrofine come dimostrato dal fatto che i motoneuroni spinali e la maggior parte dei neuroni simpatici del sistema nervoso periferico presentano alti livelli di questo recettore durante l’allungamento assonico (Yamashita et al., 1999). Molti studi hanno dimostrato inoltre come l’attività di RhoA diminuisca dopo il legame della neurotrofina con il recettore p75 inducendo allungamento del neurite mentre l’assenza del legame col recettore induce un aumento dell’attività di RhoA e collasso del cono di crescita (Yamashita et al., 1999). E’ stato suggerito che anche il legame del recettore p75 con altre molecole possa influenzare la crescita e la rigenerazione assonica come per esempio avviene col legame di p75 col recettore Nogo-66 (NgR) (Wang et al., 2002; Wong et al 2002) un recettore ad alta affinità per le glicoproteine associate alla mielina (MAG) e con altri fattori mielinici noti per inibire la formazione dei neuriti e la loro rigenerazione processo mediato da RhoA visto che le MAG ne inducono attivazione.
Recenti studi hanno dimostrato come l’inibizione sulla crescita neuritica indotta dalle MAG sia ridotta in colture neuronali primarie da topi knock out per p75 o quando viene bloccata l’interazione tra p75 e NgR (Wang et al., 2002).
Anche la crescita dendritica è regolata dalle neurotrofine come dimostrato dagli esperimenti di Snider e collaboratori: un drammatico aumento della complessità dell’albero dendritico dei gangli simpatici è stato prodotto in ratti adulti e neonati, dal trattamento sistematico per 1-2 settimane con l’NGF (Nja and Purves, 1978; Purves et al.,1988; Snider, 1998; Ruit et al., 1990; Ruit and Snider, 1991). Oggi si sa che i neuroni di ognuno dei 6 strati della corteccia rispondono alle specifiche neurotrofine con effetti distinti sui dendriti apicali o su quelli basali. Inoltre, ed all’interno di uno stesso strato, ogni neurotrofina induce un unico pattern di cambiamento nella morfologia dendritica; questo processo è essenziale per comprendere l’alta motilità delle spine dendritiche che sta alla base del fenomeno della plasticità sinaptica (McAllister et al., 1995).
Le neurotrofine hanno importanti funzioni nella sopravvivenza e nello stabilizzare la morfologia dendritica nei neuroni piramidali maturi: topi transgenici TrKB -/- presentano un’elevata perdita neuronale nella corteccia e una drammatica retrazione dendritica nei neuroni piramidali (Xu et al., 2000). Oltre alla morfologia dell’albero dendritico, le neurotrofine regolano anche il numero di sinapsi modulando la loro formazione e la loro stabilizzazione; in topi che sovraesprimono il BDNF è stata trovata una densità sinaptica 2,5 volte maggiore che in quelli WT mentre il knock out per la neurotrofina presenta invece una diminuzione della densità delle sinapsi (Causing et al., 1997); anche topi privi di TrkB e TrkC presentano minore densità sinaptica oltre che ridotte arborizzazioni assoniche (Martinez et al., 1998). Inoltre trattamenti con BDNF, NT-3 e NT-4 aumentano l’espressione della neuregulina la quale è implicata nella maturazione delle sinapsi neuromuscolari (Loeb et al., 1997); anche il complesso delle vescicole sinaptiche risulta alterato nei topi knock out per le neurotrofine i quali presentano un minor numero di vescicole e una ridotta espressione delle proteine presenti nelle vescicole come la sinaptofisina e la sinaptobrevina (Pozzo-Miller et al., 1999).
Apoptosi
Nel 1965 John Kerr, studiando i diversi quadri di morte cellulare che si verificavano negli epatociti, descrisse un nuovo tipo di morte con caratteristiche diverse da quelle della necrosi (Kerr, 1965). Nel 1972 lo stesso Kerr e Searle proposero per esso il nome di apoptosi (Kerr et al., 1972), dal termine greco col quale si indica la caduta delle foglie dagli alberi o dei petali dai fiori.
L'apoptosi detta anche "morte cellulare programmata" (PCD, Programmed Cell Death), è un fenomeno fondamentale per il mantenimento della morfologia dei tessuti durante lo sviluppo degli organismi. Si tratta di un processo fisiologico presente in tutti gli eucarioti
multicellulari (Ellis et al., 1991, Raff, 1992) e nell’uomo interviene durante lo sviluppo embrionale (Kerr et al., 1991), nello sviluppo del sistema nervoso centrale (Naruse et al., 1995) e nell’uccisione del bersaglio nelle reazioni di citotossicità (Cohen et al., 1992). L'apoptosi è responsabile della formazione dei dotti di Müller nelle femmine e dei dotti di Wolfe nei maschi (Jacobson et al., 1997), ed è inoltre implicata nella regolazione omeostatica dei tessuti, bilanciando il rapporto vita/morte di cellule danneggiate nell’adulto (Granville et al., 1998).
Un ruolo importante dell’apoptosi è stato riscontrato in numerose patologie, nelle quali il processo di morte cellulare appare essere deregolato, ad esempio nei tumori (Wright et al., 1994), in patologie neurodegenerative quali il morbo di Parkinson e quello di Alzheimer (Thompson, 1995) ed in malattie virali come l'AIDS (Rudin e Thompson, 1997).
Negli studi che riguardano la morte cellulare un aspetto distintivo è la morfologia che le cellule assumono quando muoiono; come è stato detto in precedenza, esistono principalmente due tipi di morte cellulare, l’apoptosi e la necrosi, le quali si distinguono sia per aspetti morfologici nella struttura cellulare, sia per alterazioni biochimiche e molecolari. Le principali caratteristiche distintive tra le due forme di morte cellulare sono riassunte nella tabella 1.1.
Tabella 1.1
Differenze morfologiche tra apoptosi e necrosi (da Granville et al.,1998 modificata).
A differenza della cellula necrotica, quella apoptotica riduce velocemente il suo volume citosolico condensandosi, perde le sue specializzazioni di membrana (come i microvilli e le regioni specifiche di contatto con le altre cellule) staccandosi dalle cellule vicine. La struttura interna viene mantenuta almeno nelle fasi precoci del processo. Al contrario, a livello nucleare, avviene la disgregazione del/i nucleolo/i, la condensazione e la frammentazione della cromatina in porzioni di 180-200 paia di basi o multipli. La lunghezza di tali frammenti corrisponde a quella dei tratti di DNA internucleosomale (Granville et al., 1998). Il taglio della cromatina avviene ad opera di endonucleasi, CAD (deossiribonucleasi attivata dalle caspasi), attivata solo durante il processo apoptotico (Enari et al., 1998), ad opera dell’endonucleasi G (Ricci et al., 2003) e del fattore di induzione all’apoptosi “AIF” (Bidere e Senik, 2001).
La cromatina degradata si compatta in granuli che si spostano verso la periferia del nucleo, evidenziabili per la loro caratteristica forma a mezzaluna.
Altri frammenti di materiale nucleare raggiungono poi la membrana plasmatica, dove vengono circondati da evaginazioni della membrana stessa, fornendo alla cellula un aspetto simile a bolle (blebbing). Successivamente queste bolle, contenenti porzioni di citoplasma, organuli e frammenti di cromatina, si staccano dalla cellula e vengono fagocitate dai macrofagi o da cellule vicine.
Nel processo apoptotico non si ha una risposta flogistica perché, a differenza della necrosi, non avviene rilascio del contenuto citosolico nei tessuti circostanti.
Una molecola chiave del processo apoptotico è l’ATP, necessario per l’attivazione delle caspasi e per la gran parte dei processi attuati durante l’apoptosi.
Per questi motivi la differenza fondamentale tra la necrosi e l'apoptosi è che quest'ultima è un processo attivo compiuto dalla cellula; un processo che inizia prima che la cellula muoia e durante il quale la cellula trascrive geni specifici, sintetizza nuovi enzimi e consuma energia. Tutto questo non avviene in una cellula necrotica e per questo la necrosi viene considerata un processo passivo.
I meccanismi genetici e molecolari dell’apoptosi furono identificati per la prima volta nel Nematode Caenorabditis elegans; durante lo sviluppo dell’animale, alcuni specifici geni si attivano, portando alla morte 131 cellule e lasciandone 959 nell’animale adulto. Basandosi sugli studi eseguiti su questo animale, si è stabilito di suddividere il processo apoptotico in 4 fasi:
1) induzione 2) esecuzione
3) riconoscimento e fagocitosi del corpo cellulare
4) degradazione dello stesso da parte della cellula fagocitica
Questi passaggi, e i geni che li governano, sono ampiamente conservati lungo la scala evolutiva, dal nematode fino all’uomo.
Nel C. elegans questi geni sono stati chiamati ced (cell death). Le proteine codificate dai geni ced-3 e ced-4 sono necessarie alla fase esecutiva del processo apoptotico (Hengartner et al., 1992 ). CED-3 infatti è risultata essere una proteasi in grado di tagliare le proteine tra i residui di cisteina e aspartato.
Altre proteasi con una specificità analoga sono state scoperte nell’uomo e sono state chiamate caspasi
Durante lo sviluppo del sistema nervoso circa la metà dei neuroni vanno incontro a fasi di regressione che terminano con la morte delle cellule stesse; questa grande perdita di cellule nervose è comune in molti tipi di neuroni di tutti gli invertebrati e sembra essersi evoluta come meccanismo adattativo durante lo sviluppo del sistema nervoso (Oppenheim, 1991).
La sopravvivenza e lo sviluppo dei neuroni dei vertebrati dipende dalla produzione e dalla captazione di specifiche neurotrofine, tra le quali l’NGF, il BDNF e le neurotrofine (NT)-3/4 le quali promuovono la sopravvivenza e lo sviluppo specifico dei neuroni (Aloyz et al., 1998). Inoltre, lo sviluppo delle cellule nervose richiede che queste ricevano segnali da altri neuroni con i quali instaurano appropriati contatti sinaptici (Raff et al., 1993).
La mancanza di fattori di sopravvivenza può condurre alla morte; il senso di questo processo è che, tra il gran numero di neuroni prodotti durante la neurogenesi, soltanto la porzione di cellule che riceverà un adeguato supporto neurotrofico e che instaurerà corretti contatti, sopravvivrà e continuerà lo sviluppo mentre tutte le altre cellule moriranno (Sastry e Rao, 2000). D’altra parte, Blaschke et al. (1998) ritengono che l’apoptosi dei neuroblasti delle zone proliferative ventricolari rappresenti un fenomeno universale caratteristico dello sviluppo del sistema nervoso e che sia una forma diversa da quella associata con la competizione sinaptica poiché tali neuroblasti non hanno ancora instaurato connessioni sinaptiche.
L’apoptosi sembra inoltre essere coinvolta in numerose malattie neurodegenerative caratterizzate dalla perdita graduale di specifici gruppi di neuroni, tra le quali il morbo di Parkinson, la sclerosi laterale amiotrofica, la retinite pigmentosa, l’atrofia muscolare spinale ed il morbo di Alzheimer (Thompson, 1995).
Anche l’invecchiamento, che può essere considerato la fase finale dello sviluppo di un organismo, è caratterizzato da perdita neuronale causata da morte cellulare (Sastry e Rao, 2000).
Gli sfingolipidi
Chiamati così per il mistero che circondava le loro funzioni quando furono scoperti e quindi associati al mito della Sfinge, sono dei lipidi complessi ubiquitari nelle membrane cellulari ed il primo ad identificarli fu Johann Ludwig Wilhelm Thudichum alla fine del XIX secolo nel suo trattato sulla costituzione chimica del cervello nel quale egli spiega come poter caratterizzare i lipidi presenti nel cervello umano e bovino in base al loro punto di fusione ed alla loro composizione.
Tutti gli sfingolipidi sono costituiti da uno scheletro idrocarbonioso di base, formato da una lunga catena sfingoide di 18-, 20- atomi di carbonio (la più comune è la 4-trans-sfinghenina), legata ad una molecola di acido grasso di lunghezza variabile (i più comuni in natura sono l’acido palmitico, a 16 atomi di carbonio, e l’acido stearico a 18) tramite un legame ammidico; l’unità lipidica che ne risulta prende il nome di ceramide e possiede una lunga catena idrocarboniosa asimmetrica. Esiste un’enorme varietà di ceramidi e quindi di sfingolipidi in base dell’acido grasso legato e al diverso gruppo della testa polare che può essere la fosfocolina nella sfingomielina (SM), una o più unità glucidiche nei cerebrosidi e nei glicosfingolipidi rispettivamente o catene di carboidrati lineari o ramificati nei
gangliosidi( per una generale revisione sul ruolo degli sfingolipidi nel sistema nervoso: Colombaioni and Garcia-Gil, 2004) .
Metabolismo degli sfingolipidi
La ceramide è l’unità di base di tutti gli sfingolipidi: è costituita da una lunga catena sfingoide, unita con un legame ammidico ad una catena di acido grasso. La sintesi delle ceramidi può avvenire sia attraverso la biosintesi de novo che attraverso la degradazione degli altri sfingolipidi più complessi da parte di glicosidasi ma soprattutto dalla degradazione della SM tramite alcuni tipi di sfingomielinasi (SMasi). Sono note tre principali classi di SMasi classificate in base al loro pH ottimale o alla dipendenza cationica; la meglio caratterizzata è la sfingomielinasi lisosomiale acida (A-SMase), la cui deficienza è responsabile della sindrome di Niemann-Pick A e B. La A-SMase è ubiquitaria in tutti i tessuti ed i suoi livelli di espressione non variano durante lo sviluppo; al contrario la sfingomielinasi neutra (N-SMase) è stata trovata in altissimi livelli nel cervello e la sua espressione aumenta durante lo sviluppo del sistema nervoso (Luberto et al 2002).
Diversi fattori come citochine, fattori di crescita, ormoni, stress e radiazioni sono noti attivare le SMasi in tessuti diversi da quello nervoso. Da Dobrovsky ed il suo gruppo è stato dimostrato che tutte e quattro le neurotrofine di mammifero, l’NGF, il BDNF e le NT-3,-4, inducono idrolisi della sfingomielina tramite il recettore dell’NGF p75 (p75 NGFR) e che il suo effetto può essere modificato dalla presenza di recettori tirosin-chinasi appartenenti alla famiglia dei Trk (Bilderback et al. 2001).
.La sintesi de novo avviene sulla faccia citosolica del reticolo endoplasmatico ed inizia con la condensazione della serina con il palmitoil-CoA per formare la 3-ketodiidrosfingosina o ketosfinganina, una reazione catalizzata dalla serina palmitoil transferasi. La 3-ketodiidrosfingosina è poi ridotta da una reduttasi NADPH-dipendente ad una
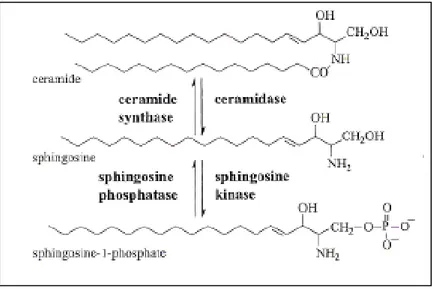
diidrosfingosina (sfinganina) e segue un’acilazione con un acido grasso e CoA reazione che produce diidroceramide. Tramite l’introduzione di doppio legame trans-4,5, la diidroceramide è convertita in ceramide. Infine, il trasferimento della testa polare fosfocolinica dalla fosfatitilcolina (PC) alla ceramide, veicolato dalla sfingomielina sintasi (SM-sintasi) porta alla formazione di sfingomielina (Levade et al. 2002). La ceramide può essere fosforilata ad opera della ceramide chinasi per produrre ceramide1P, deacilata ad opera di una ceramidasi per formare sfingosina che, a sua volta può essere fosforilata da una sfingosina chinasi a sfingosina 1- fosfato (S1P); glicosilata porta alla formazione della glucosilceramide e così avviata verso la formazione dei glicosfingolipidi cerebrosidi e gangliosidi.
Figura 9 Il metabolismo degli sfingolipidi.
La sintesi de novo degli sfingolipidi comincia con la condensazione della serina con il palmitoil CoA, a cui segue la riduzione a diidrosfingosina. La ceramide viene prodotta con l’acilazione della diidrosfingosina e poi può essere incorporata sia nella sfingomielina (SM) che nei cerebrosidi all’interno dell’apparato del Golgi. I cerebrosidi sono i precursori di molti glicolipidi e gangliosidi. La degradazione di sfingolipidi complessi coinvolge l’azione di molte idrolasi lisosomiali e porta alla formazione di ceramide e poi di sfingosina (SP). Quest’ultima può essere fosforilata a sfingosina-1-fosfato (S1P) o ritornare a ceramide. Le reazioni catalizzate dalla serina palmitoil transferasi e dalla ceramide sintasi costituiscono i passaggi regolatori di maggiore importanza lungo la via della biosintesi de novo. Crescente attenzione è rivolta verso gli enzimi che regolano l’ equilibrio di ceramide-sfingosina (le ceramidasi), ceramide-sfingolmielina (SMasi, SM-sintasi) e ceramide-cerebrosidi (glucosilceramide-sintasi). Abbreviazioni: DAG, diacilglicerolo; SMasi, sfingomielinasi; PdtCho, fosfatidilcolina (da Hannun e Luberto, 2000).
Per molti anni gli sfingolipidi sono stati considerati esclusivamente elementi strutturali delle membrane cellulari, oggi invece si sa che sono implicati nel controllo di diversi processi cellulari come la proliferazione, la crescita, la migrazione, il differenziamento, l’invecchiamento e l’apoptosi (Cuvillier, 2002; Hannun e Luberto, 2000; Hannun et al., 2002; Kolesnick and Kronke 1998; Spiegel and Milstien 2003; Spiegel et al.,1998) . Recenti ricerche hanno indicato un probabile ruolo degli sfingolipidi nel signalling neuronale, ma il loro ruolo è ancora oggetto di dibattito e si è ancora lontani dal comprendere come controllino la biologia delle cellule nervose (; Buccoliero et al, 2002; Buccoliero and Futerman, 2003; Levade et al, 2002; Luberto et al., 2002; Riboni et al.,1997; Toman and Spiegel, 2002; Toman et al., 2000) è stato inoltre dimostrato che l’azione intracellulare di un metabolita sfingolipidico dipende da più variabili:dal tipo cellulare, dallo stato di sviluppo della cellula stessa, dal bilancio tra le quantità relative dei diversi metaboliti ed anche dal comparto nel quale essi vengono prodotti (Birbes et al.,2001;Brann et al., 2002; Casaccia-Bonnefil 1996; Luberto et al., 2002; Mitoma et al., 1998; Schwarz and Futerman, 1997). Le strutture della ceramide, della sfingosina e della sfingosina-1-fosfato sono mostrate in figura
Figura 10 Struttura della Ceramide, sfingosina e sfingosina-1-fosfato. Vengono indicati gli enzimi responsabili dell’interconversione dei diversi metaboliti sfingolipidici.
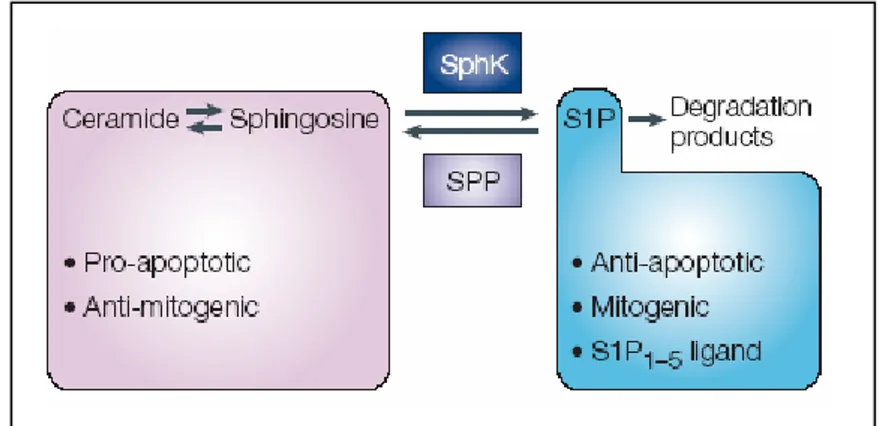
I metaboliti degli sfingolipidi costituiscono una classe di molecole bioattive coinvolte, insieme agli enzimi del loro metabolismo, nella trasduzione di diversi tipi di segnale e nella regolazione di alcuni meccanismi cellulari fondamentali: per esempio, mentre la ceramide può mediare ed indurre la morte cellulare, la S1P è risultata essere un secondo messaggero di proliferazione e sopravvivenza oltre che di protezione contro l’apoptosi mediata dalla ceramide. Poiché i metaboliti sfingolipidici sono interconvertibili, si ritiene che non sia tanto il quantitativo assoluto presente nella cellula, ma piuttosto i loro livelli relativi a determinare il destino cellulare. Questo fatto ha spinto alcuni ricercatori a proporre il cosiddetto modello del “reostato ceramide/S1P” (schematizzato in fig.11) per suggerire come il mantenimento dell’equilibrio fra la ceramide e la S1P possa essere cruciale nel determinare se una cellula sopravvive o muore. In accordo con tale modello, la modulazione dei livelli di questi metaboliti, operata da specifici enzimi, può giocare un ruolo importante nella regolazione del destino cellulare (Spiegel and Milstien 2003).
Figura 11 Modello del reostato degli sfingolipidi per il quale il destino cellulare dipende dal rapporto induttori pro-apoptotici quali la ceramide e la sfingosina e S1P che ha invece azione opposta favorendo la sopravvivenza
Negli ultimi anni, il modello di Singer-Nicholson per la membrana plasmatica, intesa come un mosaico fluido, è stata reinterpretata (alla luce delle nuove nozioni che si posseggono) come entità eterogenea contenente vari domini lipidici che possono assumere diversi stati funzionali. Fra i vari sfingolipidi, la ceramide possiede singolari proprietà biofisiche: essa può essere sia accettore che donatore di legami idrogeno ed è quindi in grado di formare estesi legami a idrogeno nel doppio strato lipidico creando così microdomini ricchi di ceramide detti “rafts” cioè zattere.
Le membrane plasmatiche di molti tipi cellulari, contengono rafts lipidici, specifici microdomini implicati in diversi processi cellulari tra cui traduzione dei segnali, il riciclo delle membrane e l’organizzazione del citoscheletro (Brown and London, 1998; Hasegawa et al, 2004; Paratcha et al.,2002; Tsui-Pierchala et al., 2002); i rafts sono importanti inoltre per l’adesione neuronale, l’estensione dell’assone e la trasmissione sinaptica, sono zone relativamente povere di fosfolipidi ma ricche di sfingomielina, colesterolo, ceramide e glicosfingolipidi (Masserini et al., 1999); ogni tipo cellulare sembra avere rafts propri che lo contraddistinguono (Eckert et al., 2003): per esempio, i rafts presenti negli oligodendrociti differiscono da quelli presenti nei neuroni in quanto contengono galactocerebrosidi, solfatidi e proteine proteolipidiche. In più la composizione lipidica e proteica dei rafts cambia durante il differenziamento nervoso; infatti nei rafts di neuroni invecchiati sono stati trovati livelli più alti di ceramide e la presenza di alcuni membri della famiglia delle Src, delle proteintirosin chinasi che partecipano nel processo di differenziamento nervoso (Prinetti et al., 2001; Prioni et al., 2002). Ci sono sempre più evidenze di come i rafts e le caveolae siano siti specifici di produzione della ceramide; è stato proposto che le proprietà biofisiche della ceramide possa mediare la riorganizzazione dei rafts in larghe piattaforme all’interno delle quali i recettori possono clusterizzare. Molti studi hanno evidenziato che queste zone della membrana possono essere siti specifici per mediare il raggruppamento dei recettori attivati (Cremesti et al., 2002). Tale fenomeno è noto come “capping” e
costituisce un prerequisito fondamentale per l’inizio e per la regolazione di alcuni segnali extracellulari (Gulbins, 2003). In particolare, è stato suggerito un modello per spiegare il “capping” dei recettori di Fas, che conduce all’induzione dell’apoptosi nei linfociti T e B (Cremesti et al., 2002).
Sfingolipidi come secondi messaggeri
E’ stato suggerito che la ceramide medi l’attività di differenti chinasi come JNK, MAPK,PKC, AKT, PI3K e TAK-1 (Blazquez et al., 2000; Lu and Wang, 2004; Ruvolo, 2003; Shirakabe et al., 1997; Stoica et al., 2003; Zhou et al 1998). Bersaglio della ceramide è la protein-chinasi Ca2+ calmodulina-dipendente (DAPK). La sua espressione è regolata durante lo sviluppo: aumenta nelle fasi dello sviluppo del cervello nelle quali è alta l’apoptosi e rimane espressa solo in certe regioni dopo la nascita come nell’ippocampo e nelle cellule del Purkinje (Sakagami and Kondo, 1997). In cellule ippocampali in coltura ed in PC12 indifferenziate, l’attività di DAPK aumenta l’azione pro-apoptotica indotta dalla C6Cer (Pelled et al., 2002; Yamamoto et al 2002); i topi deficienti di DAPK risultano invece meno sensibili alla C6Cer. Un’aumentata attività di DAPK non sempre è correlata con un avanzamento del processo apoptotico e può anche essere implicata nel differenziamento o nella sopravvivenza dei neuroni maturi come per esempio avviene nel cervello postischemico, quando si sono attivati i processi di riparazione, oppure come nelle PC12 indotte al differenziamento dall’NGF (Schumacher et al., 2002). Altre due chinasi sono regolate dalla ceramide : la PKCζ e la PKR (Bourbon et al., 2000;Galve-Roperh et al., 2002; Muller et al., 1995; Ruvolo et al.,2001). La prima è in grado di regolare lo splicing alternativo attraverso la fosforilazione e la traslocazione nucleare (Municio et al., 1995) mentre la seconda regola la sintesi proteica attraverso la fosforilazione della proteina eIF2a (Ruvolo et al., 2001).