CAPITOLO 1
LE MICOTOSSINE
Un ridotto gruppo di funghi microscopici e filamentosi, meglio conosciuti con il termine di muffe, in particolari condizioni ambientali, soprattutto di temperatura ed umidità, attivano vie biosintetiche che portano alla produzione di metaboliti secondari: le micotossine. Tali funghi prediligono per il loro accrescimento le derrate alimentari ed i mangimi per gli animali (Newberne P.M., 1972). Tutte le micotossine sono composti a basso peso molecolare anche se diverse dal punto di vista chimico, e presentano un’ampia gamma di effetti biologici dovuta alla loro capacità di interagire con DNA, RNA, proteine funzionali, enzimatici e elementi membranali in organi bersaglio diversi; in base a ciò si possono classificare in immunotossine, epatotossine, nefrotossine neurotossine, dermatotossine (Krogh, 1974). Questi metaboliti secondari possono provocare effetti acuti o cronici, anche se è soprattutto quest’ultimo ad avere effetti irreversibili come mutageni, teratogeni e cancerogeni (James, R.C. 1985) dovuti ad una prolungata esposizione. Dal metabolismo secondario derivano vari composti; attualmente si conoscono ben 300 tipi di micotossine (Betina, 1984) tra i quali troviamo Tricoteceni, Zearalolenone, Fumonisine, anche se la maggior parte delle ricerche è concentrata sulle Aflatossine ed Ocratossine poiché considerate pericolose per la salute umana; ognuna di queste ha un organo bersaglio primario, come il fegato per le Aflatossine (che sembrano inibire il p53, gene soppressore dei tumori che è importante per lo sviluppo del carcinoma epatocellulare primario) (Bressac B.,et al. 1991) o il rene per le
Ocratossine. Negli esseri umani possono avere un’azione diretta, in seguito ad esposizione da contaminanti, oppure indiretta, dovuta a contaminazione di vettori quali le derrate alimentari. Le micotossine causano seri danni alla salute umana e possono provocare notevoli danni economici negli allevamenti e negli impianti zootecnici dovuti ad un calo nelle fasi produttive e riproduttive. L’isolamento di tali metaboliti è avvenuto proprio dai cereali, fichi, noci, olio di semi ed altri prodotti naturali che vengono contaminati nei campi prima della raccolta, spesso associato a stress idrico, oppure durante la conservazione in condizioni ambientali che favoriscono la crescita delle muffe ( Diener, U. L.,R. J., et al. 1987).
CAPITOLO 2
L’OCRATOSSINA
A
Fig 1. 5-cloro-8-idrossi-3,4-diidro-3-metilisocumarinico (anello lattonico), legato tramite un gruppo ammidico ad una L-fenilalanina.
Le Ocratossine sono micotossine prodotte dalla crescita di Aspergillus
ochraceus e Aspergillus ostianius così come dal Penicillium verrucosum che si
formano durante la conservazione del grano in condizioni di 15-19% di umidità e temperature > di 15°C (Abramson, D., et al. 1980). La produzione di tali
tossine da parte delle muffe è massimale a pH 5.5 in presenza di ferro, rame e zinco (Aziz and Moussa, 1997). Nelle regioni dai climi temperati il Penicillium è la principale fonte di Ocratossina A (OTA). Oltre che al grano, orzo, cereali, frumento, avena (Bauer, J. and Gareis, M..1987), le ocratossine sono state trovate, sia occasionalmente che frequentemente nei prodotti di altre piante come fave, fichi, olive, noci, chicchi di caffé e spezie (El Kady ,I.A., et al. 1995). Tracce di Ocratossina A sono state anche rilevate in prodotti fermentanti come la birra (Scott, P.M. and Kanhere,S.R. 1995), nel vino rosso (Pietri,A et al, 2001) ma anche nel caffè (Patel, S., et al. 1997) ed in vari prodotti animali (Jorgensen,K. 1998). L’OTA ha proprietà immunotossiche, epatotossiche, teratogeniche neurotossiche e cancerogeniche ed è stata classificata dall’IARC (Agenzia Internazionale per la Ricerca sul Cancro,1993) come un possibile cancerogeno umano di tipo 2 B. Sembrerebbe che l’organo bersaglio su cui agisce l’ OTA sia comunque il rene, ed è stata proposta come agente causale nello sviluppo delle nefropatie quali BEN= Nefropatia Endemica dei Balcani e CIN= Nefropatia Cronica Interstiziale (O’Brien E., Dietrich D.R. 2005). Da studi cronici in vivo condotti su ratti Wistar sono stati osservati, da un punto di vista istologico, nefrosi tubulari, caratterizzati da lesioni degenerative dei tubuli consistenti in gonfiori cellulari e decadenze di materiale proteico nei confini citoplasmatici, e necrosi tubulare acuta, caratterizzata da una sottile parete dei tubuli e distacco delle cellule epiteliali dal lume tubulare (Alvarez L., et al. 2004), comunque l’azione che l’OTA ha sulla funzionalità renale è sia tempo che dose dipendente (Gekle M., Silhernagal S. 1996). I meccanismi di tossicità dell’ OTA sono stati sperimentalmente attribuiti all’apertura dell’anello lattonico che è
strutturalmente analogo ai siti attivi degli enzimatici mitocondriali e competitivamente legato al substrato (Xiao H., et al. 1996). L’OTA competitivamente inibisce l’attività della succinato deidrogenasi e la citocromo C ossidasi nei mitocondri dei ratti (Wei Y.H., et al. 1985), altera il sistema di trasportato a livello di membrana mitocondriale ed inibisce l’attività ATPasica della membrana interna (Meisner H., and Chan S., 1974), oltre ad inibire competitivamente l’attività degli enzimi coinvolti nel metabolismo della fenilalanina (Creppy E.E., Roschentaler R., and Dirheimer G. 1984). Sono stati proposti diverse ipotesi sui meccanismi di azione dell’OTA:
• Chu et al. (1972) proposero che l’OTA risultasse essere tossica in seguito alla dissociazione del gruppo fenolico idrossilico
• Creppy et al. (1983) osservarono che l’OTA inibiva la sintesi proteica attraverso l’inibizione competitiva dell’attività della fenilalanina tRNA sintetasi
• Rahimtula et al. (1988) proposero che l’OTA potesse esercitare l’effetto tossico attraverso la perossidazione lipidica di membrana.
Questi modelli enfatizzavano il ruolo del gruppo fenolico idrossilico dell’OTA nella formazione di un legame OTA-Fe³+; si riteneva che questi complessi
facilitassero il trasporto elettronico da un substrato all’ossigeno, con formazione di specie reattive dell’ossigeno, inoltre si sosteneva che la dissociazione del gruppo fenolico idrossilico fosse fondamentale per la tossicità dell’OTA che esercitava tale effetto inibendo competitivamente gli enzimi coinvolti nel metabolismo della fenilalanina (Omar R.F., Rahimtula A.D. and Bartsch H. 1991). Successivi studi hanno dimostrato che la reattività biologica dell’OTA
può in parte essere associata al gruppo carbonilico del lattone dell’anello isocumarilico e che non ci sono strette relazioni tra la tossicità dell’OTA e la chelazione del ferro, mentre la dissociazione del gruppo fenolico e la presenza della catena laterale della fenilalanina possono invece aumentare la tossicità dell’OTA (Xiao H., et al. 1996). Il principale meccanismo cellulare mediante il quale l’OTA esplica la sua tossicità è mediato dalla formazione dei radicali liberi e dalla conseguente perossidazione lipidica (Omar R.F. et al. 1990). L’OTA viene metabolizzata da varie isoforme del Citocromo P 450, tra le quali CYP450IA1/IA2, IIB1/IIC9, IIIA1/IIIA2/III4, che determinano la formazione di metaboliti che scatenano l’attività tossica della micotossina; tali enzimi idrossilano l’OTA a vari livelli, anche se il più frequente risulta essere il C4 con la formazione dei due enantiomeri 4R- OH-OTA e 4S-OH-OTA che non sono tossici. In seguito alla metabolizzazione dell’ OTA da parte del CYP450, si formano composti che causano alcune delle attività tossiche associate all’assunzione di tale micotossina; tali metaboliti possono formare complessi con il DNA e risultare genotossici. ( Omar R.F., Rahimtula A.D. and Bartsch H. 1991). La formazione dell’addotto del DNA è inibito da antiossidanti come l’α-tocoferolo (Vitamina E), l’acido ascorbico e da enzimi quali la catalasi e la superossido dismutasi (SOD) (Baudrimont I., et al. 1994). Il CYP450 è presente in modo predominante nel fegato, ma è stato anche rilevato in molti altri tessuti extraepatici come anche nel rene. La distribuzione dei vari enzimi CYP è differente a seconda dell’età, genere, tessuto e specie. L’equilibrio tra l’attivazione metabolica e detossificazione dei farmaci, con le varie forme di CYP nei differenti tessuti, è un fattore importante per spiegare la tossicità
organo-specifica (Imaoka S., Yamaguchi Y., Funae Y., 1990). Il CYP catalizza le reazioni utilizzando l’ossigeno come substrato e viene descritto come generatore dell’anione superossido, uno delle specie reattive dell’ossigeno coinvolte nella generazione dello stress ossidativo.
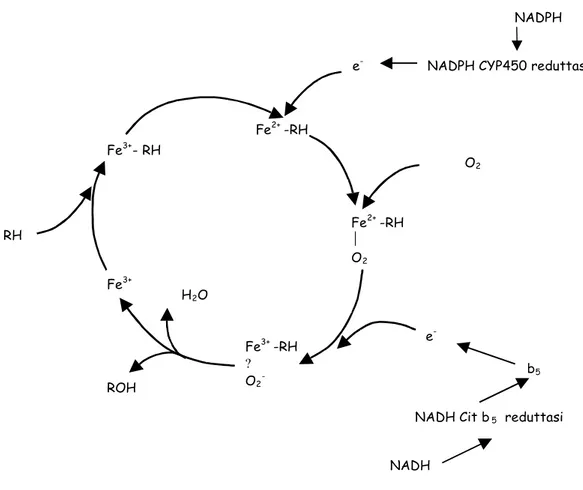
Fig 2. Ciclo catalitico del citocromo P450. RH rappresenta il substrato e ROH il corrispondente
metabolita idrossilato. (Adattato da White e Conn, Ann. Biochem., 49:315-356, 1980).
Le forme reattive dell’OTA che determinano la produzione dei ROS sono le forme chinoniche, costituite da un complesso ferro-porfirina che imita il sistema CYP450 e funzionano da donatori di elettroni (Dai J., et al. 2002). L’abilità dell’OTA di indurre un danneggiamento del DNA accoppiato alla implicazione della cancerogenicità nel rene umano (Malaveille C., Brun G. and Bartsch H. 1994), ha stimolato l’interesse di molti nello stabilire il meccanismo ossidativo che coinvolge l’OTA: sembrerebbe che l’OTA formi un complesso con il Fe(III) ed il risultante Fe(III)∙OTA chelato sia ridotto dal NADPH-citocromo P450
RH e -O2 Fe3+ Fe2+ -RH Fe2+ -RH O2 Fe3+ -RH ? O2- Fe3+- RH H2O ROH e
-NADPH CYP450 reduttasi NADPH
NADH Cit b5 reduttasi
b5
reduttasi ad un complesso Fe(II)∙OTA che attiva l’ossigeno molecolare che inizia il danno ossidativi (Omar R.F., et al. 1990). Successivi studi hanno messo in evidenza che il fenossi-O-metilato derivante dall’OTA, non chelato dal ferro(III), facilita la produzione degli OH negli epatociti e mitocondri (Hoehler D., et al. 1997) e che l’OTA facilita lo sfaldamento del DNA dovuto al Cu(II) complessato al 1,10-fenantrolina, una nucleasi Cu- mediata che richiede un agente riducente esterno per l’attivazione. Questi risultati implicano che il danno ossidativo dovuto all’OTA può essere attribuito alle sue proprietà riduttive invece che alle sue capacità di coordinare il passaggio riduttivo dei metalli (Ardus J.A., Gillman I.G. and Manderville. R.A. 1998). Comunque, è stato osservato che i sistemi ferro-porfirina causano il danneggiamento del DNA in presenza di O2 e di un agente riducente con produzione di OH∙attraverso la
reazione di Fenton: H2O2 +Fe2+ → Fe3+ +OH• + OH- in presenza di Fe(II) e
H2O2; la capacità del sistema ferro-porfirina nel facilitare il danneggiamento del
DNA in presenza di OTA, suggerisce che l’OTA provvede alla riduzione del Fe(III)-porfirina a Fe(II)-porfirina; allo stesso tempo l’OTA verrebbe ossidata dal complesso ferro-porfirina/ H2O2 determinando la formazione di un chinone
(Meunier B., 1992). Il modello dell’attivazione enzimatica dell’OTA prevede da una parte la reazione dell’OTA con il sistema ferro-porfirina e dall’altra con il CYP450; entrambe hanno due meccanismi:
1. la via “CH- oxidation” che porta alla formazione di metaboliti idrossilati con conseguente detossificazione, con effetto meno tossico da parte dell’OTA;
2. la via “phenol-oxidation” che converte l’OTA in un chinone generando specie reattive dell’ossigeno (ROS) che possono determinare sfaldamento del DNA e perossidazione lipidica (Gillman I.G., Clark T.N. and Manderville R.A. 1999).
Il CYP 2E1, coinvolto nel metabolismo dell’etanolo, è descritto come l’enzima che contribuisce ad una maggiore produzione delle Specie Reattive dell’Ossigeno (ROS) (Lieber C.S., 1997). E’ stato proposto che i ROS possono coinvolgere il danno renale in seguito a somministrazione cronica di etanolo generando perossidazione lipidica nelle strutture membranali di cellule con conseguente distruzione della loro integrità sia strutturale che funzionale (Fryer M.J., 1997). OTA CH-oxidation Phenol-oxidation 2-4 hydroxylated metabolites OTQ,6 DNA Adducts H2O2 HO • DNA ascorbat OTHQ,5 DNA cleavage lipid peroxidation Fe(II) detoxification 2 x O2 2 x O2-•
Fig 3. Modello di attivazione enzimatica dell’OTA(Gillman I.G., Clark T.N. and Manderville R.A.
1999).
E’ stato osservato nei ratti che l’OTA ha un’emivita diversa nei vari distretti: simile nel fegato, nel rene e nel cuore (da 48 a 60 ore) mentre nei muscoli è di circa 97 ore per poi raggiungere 103 ore nel sangue(Li S., et al. 1997), mentre raggiunge circa 840 ore negli umani (Schlatter C., Studer-Rohr J. and Rasonyi T. 1996). I risultati di numerosi studi sulla differente rapidità di eliminazione della tossina nei vari tessuti suggerirono che l’emivita può dipendere da una diversa affinità dell’OTA verso le diverse proteine (Chang C.F.and Chu F.S. 1977) e nel caso del sangue sembrerebbe essere direttamente correlata alla capacità delle proteine plasmatiche che hanno un’altissima affinità verso l’OTA. L’OTA, andando a contaminare gli alimenti, viene assunta per via orale e non viene eliminata tramite la filtrazione glomerulare ma con l’urina attraverso il tubulo, grazie al sistema di trasporto dell’acido para-amminoippurico localizzato sulla membrana basolaterale delle cellule del tubulo prossimale (Sokol P.P., et al. 1988), anche se può essere riassorbita in tutte le porzioni del nefrone (Dahlmann A., et al. 1998), provocando l’accumulo della tossina nel rene.
2.1 Azione Nefrotossica dell’Ocratossina A
Numerosi studi, effettuati su campioni umani, hanno rilevato la presenza dell’OTA nel siero e nel rene umano e ciò è una conferma all’implicazione
dell’OTA in alcune patogenesi quali la Nefropatia Endemica dei Balcani, le Nefriti Croniche Interstiziali in Africa e le Nefriti Cariomegaliche Interstiziali (Vrabcheva T., et al. 2004). In generale tutte le malattie renali progressive sono caratterizzate da morte cellulare, infiammazione e fibrosi (Klahr S., Morrissey J.,2002). La Nefropatia Endemica dei Balcani, che venne definita dalla WHO (World Health Organization) come “…danno renale sviluppato progressivamente con attacco insidioso…l’ultima tappa mostra fibrosi marcata…” è caratterizzata da degenerazione tubulare, fibrosi interstiziale e danneggiamento della funzione renale accompagnata da atrofia del tubulo prossimale (Vrabcheva T., et al. 2004). Esperimenti in vivo hanno rivelato che l’esposizione dell’OTA provoca un deterioramento della funzionalità renale come ad esempio l’inattivazione degli enzimi del tubulo prossimale (Kane A., et al. 1986), la poliuria con riduzione dell’osmolalità, oltre a causare cambiamenti morfologici come necrosi renale. I sintomi fisiopatologici come la glucosuria, la riduzione dell’acido para-amminoippurico e la proteinuria fecero pensare che l’OTA potesse agire primariamente a livello del tubulo prossimale (Krogh P.,et al. 1976), ma studi più recenti hanno messo in evidenza che anche altre strutture renali, soprattutto le cellule del dotto collettore, fungono da target dell’OTA e il danneggiamento delle funzioni renali è sia tempo che dose dipendente (Gekle M. and Silbernagk S. 1994). L’OTA influenza le componenti tubulo-prossimali in termini di alterazione elettrolitica ed escrezione protonica, oltre ai disturbi a livello della concentrazione urinaria (Krogh P., et al. 1976), ed è anche coinvolta nell’emodinamica renale, in particolare:
• nell’esposizione acuta all’ OTA è stato osservato un danneggiamento della funzione postprossimale del nefrone, prevalentemente nel dotto collettore, con conseguente alterazione dell’escrezione degli elettroliti (Gekle M. and Silbernagk S. 1996), probabilmente per un blocco della conduttanza anionica che si verifica a concentrazioni nanomolari e che è capace di alterare l’equilibrio acido-base cellulare;
• nell’esposizione cronica all’OTA si osserva in aggiunta una riduzione nella capacità concentrante dell’urina; in questo caso l’azione dell’OTA interessa la porzione glomerulare, in particolare le arteriole afferenti la cui resistenza aumenta, seguito da un decremento dell’afflusso renale e quindi della filtrazione glomerulare (Schaaf J.G., et al. .2002).
Nonostante ciò, la porzione del nefrone coinvolta principalmente nei danni indotti da OTA rimane il tubulo prossimale con alterazione delle funzioni di secrezione in caso di esposizione prolungata, infatti le cellule del tubulo prossimale riducono drasticamente la loro capacità di riassorbire gli anioni organici e l’”uptake” dell’albumina, mentre la capacità riassorbitivi per le piccole molecole come gli aminoacidi è solo parzialmente influenzata, inoltre si osserva glucosuria, enzimuria ed una diminuzione nell’efficacia del trasporto anionico (Gekle M. and Silbernagk S. 1993).
A causa degli alti livelli di contaminazione da OTA riscontrati nelle regioni balcaniche, si pensa che questa micotossina possa essere coinvolta nello sviluppo della Nefropatia Endemica dei Balcani (BEN) (Petkova-Bocharova T. and Castagnaro M. 1985) che è caratterizzata da nefropatia tubulo interstiziale ad andamento cronico. Questa malattia colpisce generalmente soggetti in giovane età anche se può comparire nella prima infanzia e nell’età avanzata; le manifestazioni cliniche predominanti sono caratterizzati da ematuria intermittente, proteinuria di origine tubulare ed insufficienza renale cronica progressiva. Le alterazioni istologiche sono quelle di una nefropatia tubulo-interstiziale cronica con severa atrofia tubulare e fibrosi tubulo-interstiziale. La Nefropatia Endemica dei Balcani è associata ad una elevata incidenza di tumori dell’apparato urogenitale. Le nefropatie tubulo-interstiziali rappresentano un gruppo eterogeneo di malattie renali a diversa eziopatogenesi le cui alterazioni istologiche sono documentabili primitivamente ed in maniera elettiva nell’interstizio e nei tubuli renali. Le forme acute sono caratterizzate prevalentemente da edema interstiziale, associato ad infiltrazione di polimorfonucleati con frequente riscontro di necrosi focale delle cellule tubulari. Nelle forme croniche predomina la fibrosi dell’interstizio con infiltrati di cellule mononucleate. Sebbene le principali alterazioni siano riscontrabili nei tubuli e nell’interstizio, una progressiva riduzione del filtrato glomerulare è caratteristica di quasi tutte le forme di danno tubulo-interstiziale. La riduzione del filtrato glomerulare riflette un danno secondario dei glomeruli e dei vasi della microcircolazione renale. Negli stadi più avanzati assieme ad una marcata fibrosi dell’interstizio, compaiono formazioni sclerotiche a carico dei glomeruli; a
questo stadio l’insufficienza renale diventa cronica, progressiva ed irreversibile (Albertazzi A. and Porena M. 2003). Sono state osservate alte escrezioni urinarie degli enzimi lisosomiali, come ad esempio l’N-acetil-β-D-glucosamidasi (NAG), non solo nelle nefriti tubulo-interstiziali ma anche nelle fasi acute e croniche di varie forme morfologiche di granulonefriti, probabilmente in seguito alla degranulazione dei leucociti (Kutzniar J.,et al. 2004).
2.2 Ocratossina A, Cancerogenesi e Citotossicità
Tra le diverse proprietà dell’OTA c’è anche quella cancerogenica, infatti svariati studi, condotti dall’Agenzia Internazionale per la Ricerca sul Cancro (IARC,1993) e dall’Istituto Nazionale della Salute (NIH) all’interno del Programma Nazionale del Tumore (Boorman, 1989), hanno classificato questa micotossina come un agente cancerogeno di tipo 2B, cioè un possibile cancerogeno per gli esseri umani. Questi risultati indicano che l’OTA, presente in basse concentrazioni all’interno di alimenti consumati dall’uomo, non viene considerata rischiosa per la salute dell’uomo mentre una esposizione protratta nel tempo, soprattutto ad alte concentrazioni, potrebbe risultare un potenziale cancerogeno. La ricerca oncologica sull’OTA non ha avuto gli esiti sperati e per questo motivo si sta ancora cercando di comprendere come questa sostanza danneggi il DNA provocando possibili formazioni tumorali. Da esperimenti effettuati sui ratti esposti all’assunzione cronica di OTA (6 mesi) sono state messe in evidenza dei lievi ma significativi danni genetici a tessuti ed organi: si
sono osservate delle lesioni primarie nelle cellule epatiche e del midollo osseo anche se è ancora oscura la provenienza di tali danni che potrebbero essere sia il risultato dello stress ossidativo sia la formazione di addotti di DNA con metaboliti dell’OTA, con modalità tempo e dose dipendenti (Pfohl-Leszkowicz A., et al. 1993).
Fig 4. Modello di formazione degli addotti tra OTA e DNA (Dai J., Wright M.W., Manderville
R.A. 2003).
Studi condotti su culture cellulari sul fegato e sui reni di ratto dimostrarono che l’OTA può provocare la rottura del singolo filamento di DNA (Kane A.,et al. 1986) ed esercitare un effetto citotossico sulla sintesi di macromolecole e sulla proliferazione cellulare (Fink-Gremmels J.,Jahn M. and Blom M.J., 1995), altri invece dimostrarono che tali effetti tossicologici sono legati alla metabolizzazione dell’OTA (Obrech-Pflumio S. and Dirheimer G., 2000), infatti l’ocratossina è un potente inibitore della fenilalanina-tRNA sintetasi poiché compete con la fenilalanina nella sintesi proteica durante la reazione di aminoacetilazione della fenilalanina-tRNA (Dirheimer G. and Creppy E.E., 1991). A livello mitocondriale i meccanismi della tossicità dell’OTA sono stati attribuiti sperimentalmente all’apertura dell’anello lattonico poiché così formato risulterebbe strutturalmente analogo ai siti attivi di alcuni enzimi mitocondriali e quindi si avrebbe un blocco di una o più vie metaboliche in seguito alla competizione per il substrato di questi enzimi (Xiao H., et al. 1996); il target principale dell’OTA risulta essere la respirazione cellulare dove inibisce competitivamente l’ATPasi, la succinato deidrogenasi e la citocromo C ossidasi (Maisner H and Chan S., 1974), oltre a determinare un significativo decremento nell’attività dei complessi I e IV della catena respiratoria (Di Monte D.A., et al. 1997) con conseguente alterazione nella produzione dell’ATP. E’ stato quindi dimostrato l’effetto dell’OTA sia sulla diminuzione dell’attività mitocondriale sia sull’aumento del danno al DNA mitocondriale. Come hanno rilevato diversi studi, l’OTA ed i suoi metaboliti possono formare addotti con il DNA inducendo
la cancerogenicità; tuttavia il pretrattamento con antiossidanti riduce la formazione di tali composti (Pfohl-Leszkowicz A., et al. 1993).
2.3 Immunotossicità e Apoptosi Indotte dall’Ocratossina A
L’attività immunotossica dell’OTA porta alla riduzione delle dimensioni degli organi coinvolti nel sistema immunitario quali il timo, la borsa di Fabrizio, le “patches” di Peyer e la milza, oltre ad una ipocellularità del midollo osseo, linfocitopenia (Singh G.S., et al. 1990), calo dell’attività delle cellule Natural Killer, riduzione delle immunoglobuline e della risposta anticorpale (Alvarez L., et al. 2004).
Da studi effettuati sui ratti, è stato osservato che l’OTA è l’unica micotossina ad indurre il rilascio del TNF-α e della interleuchina 6 (IL-6) sia direttamente che attraverso gli effetti di fattori che ne promuovono il rilascio come alcuni metaboliti dell’acido arachidonico, gli eicosanoidi (Petzinger E. and Weidenbach A., 2002).
Il TNF-α è una citochina pro-apoptotica prodotta da un’ampia varietà di tipi cellulari in risposta ai diversi stimoli infiammatori come i lipopolisaccaridi (LPS), TNF-α stesso, luce ultravioletta, alcune interleuchine (IL-1 e IL-2), interferoni ed infine l’OTA.
Eccessi di TNF-α nel sangue potrebbero essere la causa della patogenesi di diversi disordini della salute umana come setticemia accompagnata a cirrosi
epatica, infiammazioni croniche e artriti reumatoidi (Liz-Grana M. and Gomez-Reino Carnota J.J., 2001).
Un altro meccanismo cellulare innescato dall’esposizione all’OTA è la morte cellulare che può avvenire o per necrosi o per apoptosi; mentre la necrosi è caratterizzata dalla formazione di lesioni tubulari (pori) nella membrana plasmatica oltre ad essere accompagnata dal processo infiammatorio e dalla riparazione, l’apoptosi è la morte programmata delle cellule che viene ad essere innescata da diversi meccanismi morfologici e biochimici diversi dalla necrosi. Il processo di apoptosi è stato riscontrato anche nell’eziologia della Nefropatia Endemica dei Balcani (Mantle P.G., et al., 1998).
Sembra che gli sfingolipidi di membrana giochino un ruolo fondamentale nella trasduzione del segnale apoptotico (Furuya S., et al. 1998). L’apoptosi può essere generata secondo due vie:
• attraverso sostanze chimiche tossiche o danni legati al DNA o ad altri importanti bersagli cellulari
• attraverso l’attivazione o l’inattivazione di segnali di regolazione della crescita e interazioni ligando-recettori (Sculte-Hermann R., et al. 1999). L’innesco dei processi che portano all’apoptosi può avvenire mediante stimoli multipli come tossine, radicali liberi, mancanza di fattori di crescita, radiazioni, TGF-β, glucocorticoidi, ossido nitrico (Thompson C.B. 1995): tutti questi segnali lavorano in compartecipazione con fattori intrinseci.
La morte cellulare programmata è stata studiata in colture di cellule renali umane (Schwerdt G., Freudinger R. Mildenberger S., Silbernagk S. and Gekle 1999): in seguito alla somministrazione di OTA a diverse concentrazioni,
soprattutto nelle cellule del tubulo prossimale si osservava riduzione della sintesi di fattori proteici, attivazione della caspasi 3, condensazione della cromatina e frammentazione del DNA, tutto in funzione sia dose che tempo dipendente.
CAPITOLO 3
LO STRESS OSSIDATIVO
Considerevoli evidenze sperimentali supportano la tesi che le specie reattive dell’ossigeno (ROS) giocano un ruolo chiave nell’eziologia delle malattie renali, come conseguenza della perdita dell’equilibrio fisiologico tra specie radicaliche ed agenti antiossidanti, con aumento dei ROS. L’abbondanza degli acidi grassi polinsaturi nel rene fa di questo organo un bersaglio particolarmente vulnerabile all’attacco dei ROS (Kubo K., et al. 1997). Il coinvolgimento dei ROS è sostenuto da due linee di evidenze sperimentali:
• la scoperta di prodotti del danno ossidativo nei tessuto renale e nelle urine
• dimostrazioni sperimentali di un effetto protettivo degli inibitori metabolici dei ROS (Ishikawa I., et al. 1998).
La lipoperossidazione compromette il metabolismo renale; evidenze sperimentali suggeriscono che i danni più significativi si verificano a livello delle cellule tubulari renali che sono più sensibili all’ossidazione (Bonventre J.V. 1988). Oltre alle cellule del tubulo prossimale altre cellule renali, soprattutto le cellule dell’epitelio glomerulare, fungono da bersaglio per l’azione dei ROS che possono alterare a questo livello la funzione di barriera della membrana basale glomerulare. I ROS sono stati riconosciuti essere nocivi per le cellule poiché danneggiano lipidi, proteine ed acidi nucleici, provocando danni strutturali e funzionali, soprattutto quando sono prodotti in quantità eccessiva causando uno squilibrio con formazione dello stato di stress ossidativo, dovuto anche ad una
diminuzione delle capacità del sistema di difesa dato dagli antiossidanti (Freeman B.A. and Crapo J.D. 1982). I ROS, prima che venga raggiunto il valore soglia che innesca la degenerazione cellulare, possono avere un effetto citotossico determinando la produzione di lipidi biattivi e nucleotidi ciclici: l’aumento di H2O2 incrementa infatti la biodisponibilità dell’acido arachidonico
con conseguente aumento degli eicosanoidi. Questo aspetto è importante nella nella fisiopatologia del danno renale dato che gli eicosanoidi sono in grado di modificare drasticamente l’emodinamica renale, data la loro azione vasocostrittrice che porta sia alla riduzione della resistenza arteriolare che alla diminuzione del coefficiente di ultrafiltrazione glomerulare; in questi casi si può verificare una riduzione dell’ultrafiltrato conseguentemente al fatto che l’accumulo intracellulare di cAMP nelle cellule glomerulari può stimolare la sintesi di renina e la formazione di angiotensina (Shah S.V. 1984). Sono stati condotti numerosi esperimenti sul contenimento degli effetti dei ROS rinforzando il sistema di difesa antiossidante e si osservò che diete supplementari ricche di antiossidanti come la vitamina E diminuivano il grado di progressione del deterioramento renale attenuando la nefrotossicità (Fryer M.J. 1997). Esistono naturali fonti nutrizionali di antiossidanti come la frutta, la verdura, il te o il vino che sembrano attenuare il danno renale causato dallo stress ossidativo e soprattutto i polifenoli contenuti nel vino rosso aumentano il sistema antiossidante oltre a comportarsi come “spazzini” dei ROS, chelatori dei metalli e modulatori enzimatici (Pietta P., et al. 1998). E’ stato inoltre rilevato che la quercitina, polifenoli del vino, esercita un’azione citoprotettiva sulle cellule mesengiali del glomerulo (Ishikawa Y. and Kitamura M. 2000) ed il
resveratrolo, polifenolo trovato nel chicco d’uva e nel vino rosso, sopprime la proteinuria (Nihei T., et al. 2001).
Diversi studi hanno proposto il coinvolgimento dello stress ossidativo nella tossicità dell’OTA (Baudrimont I., et al. 1994): inizialmente (Rahimtula A.D., et al. 1988) fu dimostrato che l’OTA induceva perossidazione lipidica nelle frazioni subcellulari e poi si vide che il rene è il principale sito degli intensi processi ossidativi, soprattutto a livello delle cellule del tubulo prossimale che subivano una perdita della vitalità in seguito all’azione dei ROS prodotti in presenza di OTA, con modalità dose e tempo dipendente. Alcuni autori hanno avanzato l’ipotesi che la generazione di specie reattive dell’ossigeno sia la conseguenza della formazione di un complesso Fe3+-OTA, cioè le forme chinoniche dell’OTA,
(Omar R.F., et al. 1990) capaci di produrre specie radicaliche successivamente alla riduzione di Fe3+ a Fe2+. Successivi studi hanno rilevato che l’OTA inibisce i
complessi I e II della respirazione mitocondriale, con conseguente alterazione nella produzione dell’ATP e danno ossidativo per compromissione delle catene respiratorie a livello di questi organelli (Schaaf G.J., et al. 2002). E’ stato infatti riportato che l’ocratossina incrementa la formazione della malondialdeide (MDA), biomarker della perossidazione lipidica, in vitro dopo incubazione di microsomi di fegato di ratto in presenza di NADPH (Rahimtula A.Det al. 1988).
3.1 I Radicali Liberi
I radicali liberi sono specie chimiche che hanno un singolo elettrone spaiato sul loro orbitale più esterno; possono essere sia molecole molto piccole, come
l’anione superossido, che molecole piuttosto grosse, come gli idrocarburi, e sono caratterizzati da una elevata instabilità chimica che li porta a legarsi con un gran numero di molecole, organiche ed inorganiche, e quindi presentano un’alta reattività. Molto importanti da un punto di vista biologico sono le specie radicaliche dell’ossigeno e dell’azoto come l’anione superossido (O2•-
), il
radicale idrossilico (OH•-), l’ossido di azoto (NO•) ed altri che possono reagire tra
loro o con altre molecole disponibili all’interno della cellula per formare ulteriori tipi di molecole reattive, come il perossido di idrogeno (H2O2), a partire
dall’anione superossido. I radicali liberi vengono prodotti anche in condizioni fisiologiche ma non causano nessun tipo di danno poiché le cellule hanno sviluppato numerosi meccanismi, per rimuovere e minimizzare gli effetti dannosi di queste specie che possono anche decadere spontaneamente poiché intrinsecamente instabili. In un unico caso i radicali liberi possono essere fondamentalmente utili: nell’infiammazione acuta i neutrofili innalzano l’andamento respiratorio producendo radicali liberi che uccidono i microrganismi fagocitati. L’azione dei radicali liberi può aumentare la permeabilità di membrana, inibire la pompa protonica, aumentare il calcio libero citosolico ed esaurire l’ATP.
La produzione dei radicali liberi può essere innescata nella cellula da diverse fattori:
• assorbimento di energia radiante (p.e. luce ultravioletta, raggi X)
• metabolismo enzimatico di sostanze chimiche esogene o farmaci (p.e. il CCl4 che può dare origine al CCl3•)
• le reazioni di ossido-riduzione che si verificano durante i normali processi metabolici
• metalli di transizione, come il ferro e il rame che donano o accettano elettroni liberi durante le reazioni intracellulari.
• ischemia-riperfusione
• conservazione degli organi per il trapianto • droghe, inquinanti, etc.
Gli enzimi maggiormente coinvolti nella produzione dei ROS sono:
- enzimi mitocondriali della catena di trasporto degli elettroni successivamente a fenomeni di ischemia e riperfusione
- xantina ossidasi, i cui livelli nel tessuto privo di ossigeno aumentano per la conversione della xantina deidrogenasi ad opera di una proteasi calcio-dipendente
- enzimi coinvolti nel metabolismo dell’acido arachidonico
- enzimi ossidativi del reticolo endoplasmatico e dei perossisomi.
Queste reazioni hanno molti effetti ma tre possono risultare particolarmente importanti:
1) lesioni del DNA: reazioni con la timida a livello di DNA nucleare e
mitocondriale producono rotture nel filamento singolo del DNA. Sembra che questo danno sia implicato nell’invecchiamento cellulare e nella trasformazione maligna delle cellule
2) modificazioni ossidative delle proteine: i radicali liberi promuovono
l’ossidazione delle catene laterali dei residui aminoacidici, con frammentazione della catena proteica, e formazione di legami crociati fra proteine
3) perossidazione dei lipidi di membrana, sia plasmatica che degli orfanelli, con
conseguente perdita della fluidità della membrana (Contran R.S., et al 1999). Nonostante ci siano molte sedi di formazione dei radicali liberi all’interno della cellula, sembra che i mitocondri siano la sorgente principale (De Jong A.M.P. and Albracht S.P.J. 1994).
3.2 Lipoperossidazione
In presenza di ossigeno i radicali liberi possono causare perossidazione dei lipidi della membrana plasmatica e delle membrane degli organelli. Il danno ossidativo inizia quando i doppi legami degli acidi grassi insaturi dei lipidi di membrana vengono attaccati dai radicali liberi derivati dall’ossigeno, in particolare dall’ OH•- . L’interazione radicali-lipidi porta alla formazione di
perossidi che a loro volta sono instabili e reattivi, e fanno sì che si instauri una reazione a catena autocatalitica, definita propagazione, che può dare origine ad un danno esteso a livello della membrana, degli organelli e della cellula. L’interruzione di questa serie di reazioni si può verificare quando il radicale libero è catturato da uno “spazzino”(scavenger) presente all’interno della membrana cellulare (Contran R.S., et al 1999); qualora questa non si verifichi, le conseguenze più devastanti della perossidazione lipidica sono l’aumentata permeabilità delle membrane (Kappus H. 1985), il danneggiamento dei processi enzimatici e delle pompe protoniche (Kako H., et al. 1988) e il danneggiamento del DNA (Brawn M.K., and Fridovich I., 1985).
La lipoperossidazione può causare anche l’aumento della permeabilità lisosomiale con conseguente rilascio degli enzimi idrolitici ed ulteriore danno cellulare (Thomas C.E. and Reed D.J., 1990); comunque, tutti i danni letali legati alla perossidazione lipidica sono dovuti alla rottura dell’integrità strutturale del doppio strato lipidico ed all’aumento della permeabilità membranale.
3.3 Sistemi Antiossidanti
In condizioni fisiologiche la cellula combatte l’azione nociva dei ROS grazie ai sistemi enzimatici, perlopiù presenti dentro la cellula, ed agli agenti antiossidanti già presenti nel nostro organismo, intra- ed extra-cellularmente, o che vengono introdotti con una dieta alimentare. Questi meccanismi lavorano con un rapporto di cooperazione.
3.3.1. Gli antiossidanti endogeni
L’azione dei radicali liberi può essere impedita da:
1) Antiossidanti che bloccano la formazione dei radicali liberi dall’inizio o inattivano i radicali bloccando il danno; un esempio è dato dalle vitamine liposolubili E ed A così come l’acido ascorbico e il glutatione presenti nel citosol. 2) Il legame del ferro e del rame a proteine di trasporto e deposito (p.e. transferrina, ferritina e ceruloplasmina) minimizza la formazione di OH•.
3) Diversi enzimi agiscono come sistemi di disinnesco dei radicali liberi inattivando gli anioni superossido e il perossido di idrogeno; questi enzimi sono localizzati vicino ai siti di produzione di questi ossidanti e comprendono:
• la Catalasi, presente nei perossisomi che scompone H2O2 (2 H2O2 → O2
+ 2 H2O)
• le Superossido Dismutasi che convertono il superossido ad H2O2 ( 2 O2•-
+ 2 H → H2O2 + O2); questo enzima si trova presente in diverse
isoforme all’interno delle cellule, la manganese-superossido dismutasi, localizzata nei mitocondri, e la rame-zinco-superossido dismutasi, localizzata nel citosol
• la Glutatione Perossidasi che catalizza la rottura dei radicali liberi (H2O2 +
2GSH → GSSG +2 H2O) (Contran R.S., et al 1999).
3.3.2. Gli antiossidanti esogeni: i Polifenoli
Il sistema antiossidante di difesa può essere rinforzato da una dieta alimentare ricca di antiossidanti. Queste sostanze appartengono a composti di natura vegetale tra cui hanno una certa rilevanza i polifenoli contenuti nel vino, soprattutto nel vino rosso. Tra le azioni biologiche dei polifenoli c’è la riduzione dell’ossidazione delle lipoproteine a bassa densità (LDL), effetto probabilmente dovuto alle proprietà antiossidanti verso i radicali liberi (Dugas A.J., et al. 2000). I polifenoli, inoltre, agiscono da antiossidanti sia interrompendo la reazioni di lipoperossidazione che inibendo alcune reazioni, come quella di Haber-Weiss/Fenton, grazie alle loro proprietà chelanti gli ioni metallici capaci di
cambiare lo stato di ossidazione (Cu, Fe,…) (Ferrali M., et al. 1997) I polifenoli contenuti nel vino possono essere distinti in Flavonoidi e Non Flavonoidi.
FLAVONOIDI:
- Catechine (nel seme del chicco dell’uva) - Antocianidoli (nella buccia d’uva)
- Polimeri di Flavonoidi (detti Tannine) costituiti dall’incatenamento di due fino a dieci molecole elementari di Flavonoli
NON FLAVONOIDI:
- derivati dell’Acido Benzoico e Acidi Idrossicinnamici, come derivati dello stilbene (Resveratrolo, nella polpa del frutto).
E’ stato suggerito che i flavonoidi esercitano degli effetti benefici in una moltitudine di malattie tra le quali il cancro, malattie cardiovascolari e malattie neurodegenerative, poiché hanno un’azione biologica che è stata attribuita alle loro proprietà antiossidanti (Rice-Evans C., 2001). E’ stato osservato che le forme dei flavonoidi in vivo non sono le stesse forme che si trovano nelle piante ma si tratta di metaboliti che si originano da queste nell’assorbimento intestinale (Spencer J.P.E., et al. 2001), che avviene attraverso il trasporto di glucosio Na+
-dipendente (Middleton E.J., et al. 2000). La captazione dei flavonoidi e dei loro metaboliti in vivo dipende dal tipo di cellula (Spencer J.P.E., et al. 2003). Generalmente i flavonoidi possono subire tre forme di metabolismo intracellulere:
1) coniugazione con i tioli, particolarmente con l GSH; 2) metabolismo ossidativo;
Le modificazioni metaboliche dei flavonoidi potrebbero alterare la loro “classica” natura antiossidante poiché capaci donare prontamente l’elettrone e stabilire una specie radicalica (Rice-Evans C.A., et al. 1996), ma questa capacità non è presentata dai metaboliti circolanti dei flavonoidi (Spencer J.P.E., et al. 2001). Dopo evidenze sperimentali è stato proposto che gli effetti cellulari dei flavonoidi possono essere mediati dalle interazioni con specifiche proteine nella cascata del segnale, in particolare possono interagire selettivamente con le MAP-kinasi (Schroeter H., et al. 2002). Uno dei flavonoidi più studiati è la quercitina che sembra avere la proprietà antiproliferativa (Kuo S.M., 1996) e di indurre morte cellulare, un meccanismo apoptotico importante in presenza di cellule tumorali (Rzymowska Jet al. 1999), oltre a svolgere altre funzioni finalizzate a migliorare lo stato cellulare, come inibire l’attività dei fattori di trascrizione che danno lesioni infiammatorie del rene (Rangan G.K., et al. 1999).
Anche il resveratrolo può avere degli effetti benefici, per cui si ritiene che un consumo moderato di vino possa prevenire le malattie cardiovascolari (Constant J., 1997); questi effetti protettivi sono stati attribuiti alle sue proprietà antiossidanti ed anticoagulanti (Fauconneau B., et al. 1997), oltre al fatto che il resveratrolo è un modulatore della sintesi dei lipidi e delle apolipoproteine epatiche (Frankel E.N., et al. 1993), un inibitore dell’aggregazione piastrinica e della produzione degli eicosanoidi nelle piastrine e nei neutrofili (Bertelli A.A.E., et al. 1996) oltre ad inibire gli eventi associati all’iniziazione, promozione e progressione dei tumori (Jang M., et al. 1997); inoltre inibisce l’espressione delle molecole di adesione endoteliali (Ferrero M.E., et al. 1998) e l’attività delle
COX-2 (Subbaramaiah K., et al. 1998). Infine studi successivi sul resveratrolo hanno dimostrato che è un inibitore di alcune isoforme di citocromo, agendo da inibitore sia competitivo che non del CYP1A1 e CYP1A2 ed un inibitore non competitivo del CYP2E1, come anche altri componenti non volatili del vino (Bertrand Pet al. 2001).
CAPITOLO 4
SOMMINISTRAZIONE ACUTA DI OCRATOSSINA A
Uno studio condotto dal nostro gruppo di lavoro ha valutato gli effetti patologici della somministrazione sub-acuta di OTA in ratti Wistar maschi in associazione con vino rosso ed etanolo (Bertelli A.A.E., et al., 2005).
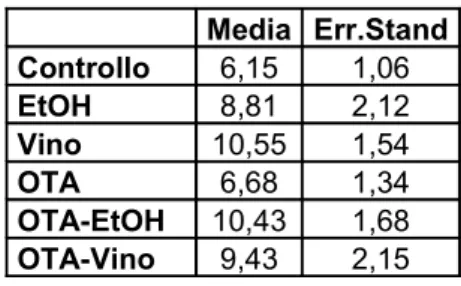
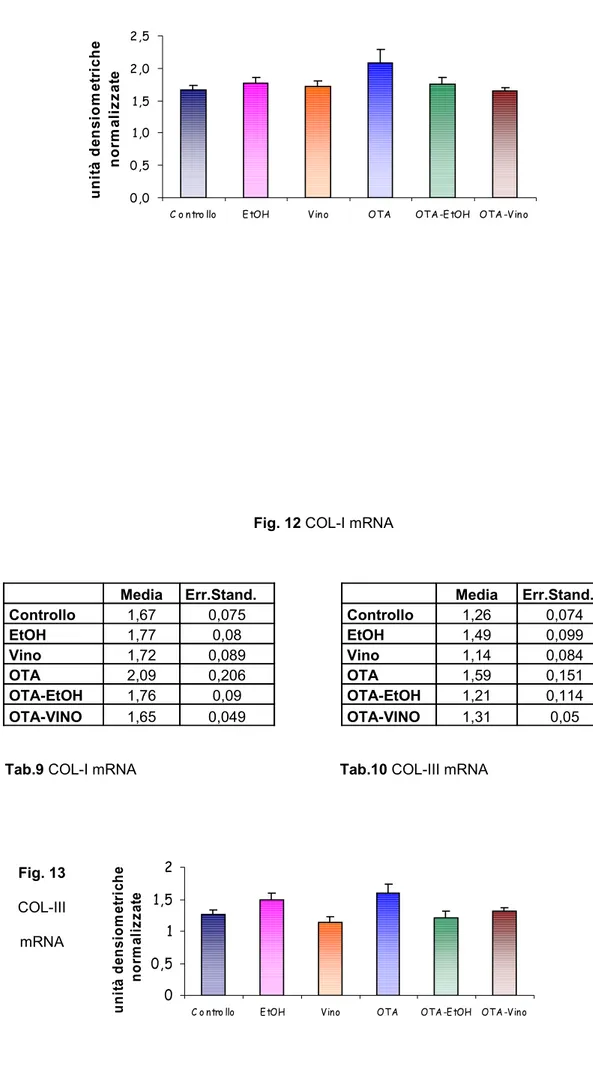
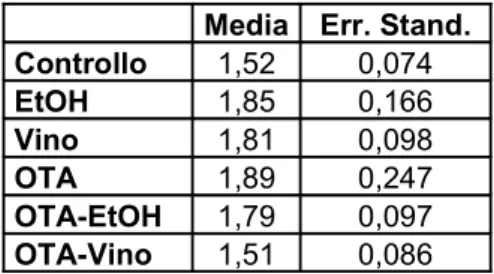
Per quanto riguarda le caratteristiche istopatologiche della BEN, cioè la deposizione del collagene interstiziale, il trattamento di 15 giorni con OTA non è stato sufficiente per mettere in luce queste alterazioni di tipo fibrotico, né è stato possibile osservare variazioni nell’espressione degli mRNA dei geni correlati allo sviluppo della fibrosi, quali il TGF-β-1 ed il collagene I e III.
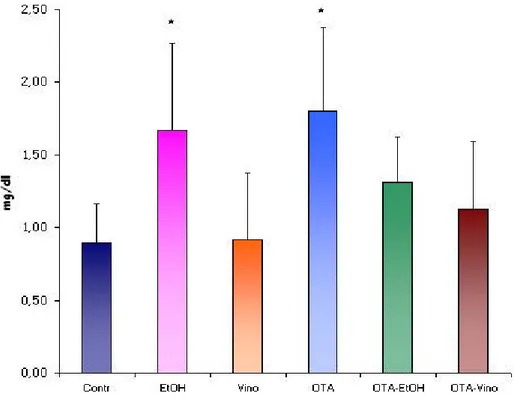
Tuttavia al termine dei 15gg di trattamento il gruppo trattato con OTA presentava alti livelli di enzimuria ed un’alterazione della funzionalità renale, con riduzione della clearance per la creatinina; tali risultati sono stati confermati dall’analisi al microscopio elettronico, che ha evidenziato alterazioni tissutali, in particolare un aumento degli spazi intercellulari ed una disorganizzazione a livello del “brush border, a conferma del fatto che il principale target dell’OTA è il tubulo prossimale (Gekle M. and Silbernagi S. 1996).
L’analisi dei parametri legati allo stress ossidativo ha rilevato inoltre un aumento dei livelli di lipoperossidazione associata ad una riduzione, anche se non significativa, dei livelli degli enzimi antiossidanti, determinando uno sbilanciamento dell’equilibrio fisiologico tra ROS prodotti e ROS neutralizzati a favore dei ROS prodotti.
Quando l’OTA è disciolta nel vino e nell’etanolo le variazioni della clearence della creatinina sono significativamente ridotte rispetto al gruppo con solo OTA, anche se sono più alti rispetto al gruppo OTA; analogamente la variazione dell’enzimuria e nella valutazione microscopica dove non si osservano alterazioni del “brush border” a livello tubulare. Anche i parametri legati allo stress ossidativo mostrano una riduzione dei livelli di lipoperossidazione rispetto al gruppo OTA, in presenza di Etanolo e vino.
CAPITOLO 5
SCOPO DEL LAVORO
Sulla base delle notizie circa la contaminazione da parte di OTA di prodotti alimentari, specialmente cereali e derivati del grano, oltre che di alcune bevande come la birra ed il caffè, un numero crescente di tossicologi e nutrizionisti si sta interessando di questa micotossina, anche in seguito alla crescente sensibilizzazione dell’opinione pubblica e delle alte autorità circa il ruolo principe di questa micotossina nell’eziopatogenesi della Nefropatia Endemica dei Balcani (BEN). Poiché la contaminazione dell’OTA coinvolge anche un altro prodotto a largo consumo, quale il succo d’uva fermentato e non, il Ministero Italiano delle Politiche Agricole e Forestali (MIPAF) ci ha assegnato uno studio che valutasse gli effetti dell’OTA, presente nel vino, sulla salute umana. Lo scopo di questo lavoro è stato quello di valutare, sulla base dei dati ottenuti dal precedente studio svolto nel nostro laboratorio, le alterazioni patologiche a livello renale dopo somministrazione sub-cronica di OTA e l’eventuale protezione da parte dei numerosi antiossidanti presenti nella matrice vino (come il resveratrolo, la quercitina, l’acido caffeico ed altri polifenoli) poiché il meccanismo citotossico principale dell’OTA è mediato dalla produzione dei ROS. Sono stati presi in considerazione:
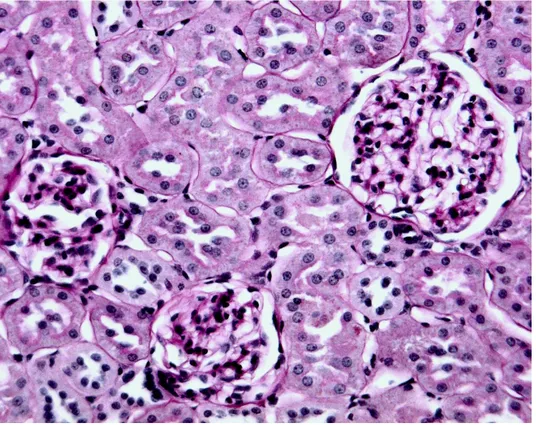
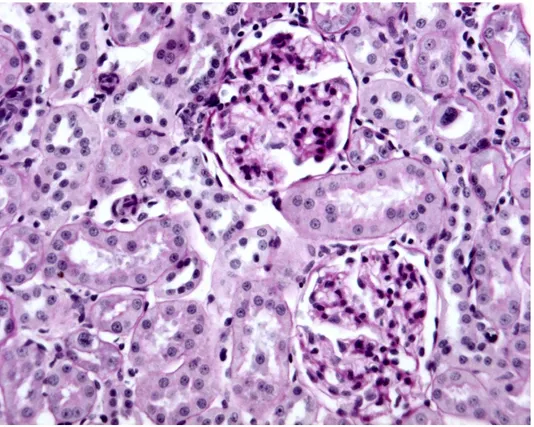
• valutazione istopatologica del tessuto renale e della cellularità glomerulare (con colorazione PAS )
• parametri legati alla funzionalità renale (creatinina sierica, proteinuria, enzimuria)
• parametri legati all’atrofia (pesi dei reni)
• parametri legati allo sviluppo della fibrosi ed alla deposizione di collagene interstiziale (con colorazione Rosso Sirius per l’analisi morfologica; valutazione dell’espressione dei livelli degli mRNA del collagene I e II, e degli mRNA del TGF β-1 )
CAPITOLO 6
MATERIALI E METODI
6.1 Modello Sperimentale
Sessanta ratti Wistar, maschi del peso di 180-200 gr, stabulati presso il Dipartimento di Neuroscienze dell’Università di Pisa, sono stati suddivisi in 6 gruppi diversi:
1) Gruppo Controllo (CT), a cui è stata somministrata acqua
2) Gruppo OTA, in cui i ratti hanno ricevuto una dose di OTA (Sigma Aldrich Missouri USA) pari a 289μg/Kg/48 ore
3) Gruppo Vino a cui è stato somministrato vino rosso (Barbera d’Asti con gradazione alcolica pari al 13.5%)
4) Gruppo EtOH in cui i ratti hanno ricevuto etanolo al 13.5% in acqua 5) Gruppo OTA-Vino in cui ratti hanno ricevuto una dose di OTA pari a
289μg/Kg/48 ore disciolta nel vino con una gradazione alcolica pari al 13.5%
6) Gruppo OTA-EtOH in cui i ratti hanno ricevuto una dose di OTA pari a 289μg/Kg/48 ore disciolta in etanolo al 13.5% (soluzione acquosa)
Il trattamento è stato condotto per 3 mesi. Gli animali hanno ricevuto una dose di OTA pari a 289μg/Kg/48 ore per indurre un sicuro effetto lesivo a livello renale. L’OTA è stata disciolta in NaHCO3 0.1 M (pH 7.4), quindi diluita
13.5%) ed etanolo al 13.5%. I ratti hanno ricevuto 0.5ml delle rispettive soluzioni mediante sonda gastrica, ogni 48 ore, e le urine sono state raccolte al 15°, 30°, 60° e 90° giorno di trattamento dopo aver alloggiato i ratti nelle gabbie da metabolismo.
Al 90° giorno gli animali sono stati sacrificati e sono stati raccolti campioni di sangue e gli organi sono stati perfusi con PBS contenente eparina 0.16mg/ml per rimuovere la cellule rosse per evitare che l’emoglobina interferisse con alcuni dosaggi; dopo la perfusione sono stati espiantati i reni che sono stati omogeneizzati con diversi buffer e centrifugati secondo le modalità richieste dai kit per effettuare i vari dosaggi. La sperimentazione è stata suddivisa in diverse sezioni a seconda dei parametri ricercati:
SEZIONE A = pesi corporei e renali
SEZIONE B = valutazione degli indici di funzionalità renale: sono stati presi in considerazione i livelli di enzimuria, proteinuria e della creatinina sierica.
SEZIONE C = analisi morfologica: sezioni istologiche di reni sono state allestite e colorate con Rosso Sirius , un colorante istologico specifico per il collagene e la quantificazione del collagene presente (come indice di fibrosi) è stata effettuata mediante analisi computerizzata dell’immagine utilizzando un software adatto; altre sezioni istologiche di reni sono state allestite e colorate con colorazione PAS per valutare l’aspetto morfologico renale e quindi un possibile danno; questa colorazione ha anche permesso di calcolare la cellularità glomerulare attraverso il conteggio dei nuclei delle cellule mesangiali, delle cellule endoteliali e dei podociti. SEZIONE D = indagine molecolare, tramite analisi del mRNA, è stata studiata l’espressione di alcuni geni coinvolti nella patogenesi della fibrosi renale, quali i
geni per il collagene interstiziale, di tipo I e III, e per il TGFβ-1 in quanto è un fattore coinvolto nei processi di fibrogenesi.
SEZIONE E = valutazione degli indici di flogosi (IL-6) e di stress ossidativi: sono stati presi in considerazione i livelli dell’attività della SOD tissutale ed il contenuto renale di lipoperossidi (LPO).
Gli esperimenti sono stati condotti seguendo i criteri suggeriti dalla Direttiva CEE n°609/86 e dal DL n° 116 del 27/01/1992.
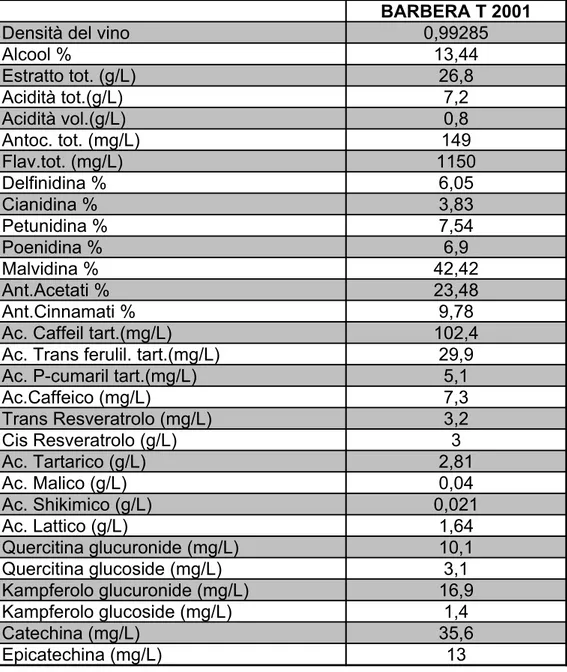
tab. 1-Analisi del vino “Barbera d’Asti”
BARBERA T 2001
Densità del vino 0,99285
Alcool % 13,44 Estratto tot. (g/L) 26,8 Acidità tot.(g/L) 7,2 Acidità vol.(g/L) 0,8 Antoc. tot. (mg/L) 149 Flav.tot. (mg/L) 1150 Delfinidina % 6,05 Cianidina % 3,83 Petunidina % 7,54 Poenidina % 6,9 Malvidina % 42,42 Ant.Acetati % 23,48 Ant.Cinnamati % 9,78
Ac. Caffeil tart.(mg/L) 102,4
Ac. Trans ferulil. tart.(mg/L) 29,9
Ac. P-cumaril tart.(mg/L) 5,1
Ac.Caffeico (mg/L) 7,3 Trans Resveratrolo (mg/L) 3,2 Cis Resveratrolo (g/L) 3 Ac. Tartarico (g/L) 2,81 Ac. Malico (g/L) 0,04 Ac. Shikimico (g/L) 0,021 Ac. Lattico (g/L) 1,64 Quercitina glucuronide (mg/L) 10,1 Quercitina glucoside (mg/L) 3,1 Kampferolo glucuronide (mg/L) 16,9 Kampferolo glucoside (mg/L) 1,4 Catechina (mg/L) 35,6 Epicatechina (mg/L) 13
6.2 SEZIONE A: Pesi Corporei e Renali
I ratti sono stati pesati prima e durante il trattamento nel 30°, 45°, 55°, 65° e 80° giorno, inoltre dopo il sacrificio sono stati anche pesati i reni, sia il sinistro che il destro.
6.3 SEZIONE B: Valutazione degli Indici di Funzionalità Renale
• Valutazione dei Livelli dell’Attività Enzimatica del NAG
L’ N-acetil-beta-glucosaminidasi (NAG) è l’enzima che catalizza l’idrolisi del p-nitro-fenil-N-acetil-beta-D-glucosaminide a p-nitrofenolo e N-acetilglucosamina. Il p-nitrofenolo liberato è proporzionale all’attività enzimatica e viene determinato colorimetricamente in ambiente alcalino.
Il protocollo (FAAR) seguito per determinare l’attività del NAG in (U/L) nelle urine dei ratti trattati, prevede l’utilizzo dei seguenti reagenti:
-reagente1 la nitrofenilacetilglucosaminide 22mmol/L tampone pH 5.2 80mmol/L
-reagente 2 tampone pH 5.2 80mmol/L - reagente 3 alcalinizzante 0.6 mol/L.
1. si ricostituisce il contenuto di un flaconcino di reagente 1 con 5.2 ml di acqua distillata e si agita fino a completa solubilizzazione
2. nelle eppendorff contraddistinte con C (campione) e con B/R (bianco reagente) viene messo 0.5 ml di reagente 1 ricostituito
3. nelle eppendorff contraddistinte con B/C (bianco campione) viene messo 0.5 ml del reagente 2 e si porta a 37° C
4. si aggiunge mescolando con cura 0.1ml di campione nelle eppendorff C e B/C e 0.1ml di soluzione fisiologica nelle eppendorff B/R
5. si incuba per 15 minuti esatti a 37° C
6. si aggiunge 0.4ml di reagente 3 a tutte le eppendorff
7. leggere entro 30 minuti a una lunghezza d’onda di 405nm l’assorbanza del campione (Ac), del bianco campione (Ab) e del bianco del reagente (Ar) contro acqua distillata.
• Valutazione dei Livelli della Proteinuria
Sono stati utilizzati campioni di urine per poter calcolare la concentrazione delle proteine.
Per la lettura dell’assorbanza è stato usato il BIO-RAD PROTEIN ASSAY, il quale si basa sull’osservazione che il massimo dell’assorbanza per una soluzione acida di Blue Brillante di Comassie G-250 si sposta da 465 nm a 595 nm quando si lega a proteine.
- Caricare 5 µl di campione nei pozzetti
- Aggiungere colorante BIO-RAD diluito 1:4 (250 µl per ogni pozzetto)
- Fare il bianco con BIO-RAD senza campione (quindi 255 µl nel primo pozzetto) - Aspettare 2 min per far avvenire il viraggio del BIO-RAD dal bruno al blue - Leggere a 595 nm
La concentrazione proteica (mg/ml) è determinata utilizzando una curva con concentrazioni note di albumina.
6.4 SEZIONE C: Analisi Morfologica
• Microscopia Elettronica
Per l’esame ultrastrutturale i campioni, prelevati durante il sacrificio, sono stati fissati per 2 ore in una soluzione di gluteraldeide 3% in tampone fosfato 0.12M ; alla fine delle 2 ore è stato fatto un lavaggio in tampone fosfato 0.12M da un minimo di 30 min ad un massimo di 24 ore; successivamente i campioni sono stati postfissati in una soluzione di tetrossido di osmio 1% in tampone fosfati 0.18M per 2 ore a 4° C.
Le sezioni anatomiche vengono quindi lavate in tampone fosfato 0.18M per 30 min e disidratate in acetone a concentrazioni crescenti ( 50%, 75%, 95%) per 20 minuti ciascuno,infine per un’ora in acetone assoluto.
I campioni sono stati inclusi nella resina Durcupan Fluka con i seguenti passaggi:
- miscela 3:1 (3 parti di acetone + 1 di Durcupan) per 1 ora - miscela 1:1 (1 di acetone +1 di Durcupan) per 1 ora
- “over night” miscela 1:3 (1 di acetone + 3 parti di Durcupan)
Il giorno successivo è stata fatta l’inclusione dei campioni in resina pura (Durcupan) per 4 ore, e la polimerizzazione di tale resina a 60° per 24 ore. Mediante la preparazione di semifini si determina il punto di interesse del preparato che verrà poi sottoposto al taglio mediante ultramicrotomo. La qualità maggiore deriva dal minore spessore delle sezioni e principalmente dalla scelta di un mezzo di inclusione, la resina, che è in grado di preservare i tessuti più efficacemente rispetto alla paraffina. Il taglio con ultramicrotomo è seguito dal
posizionamento su retini di rame e dalla colorazione con Sali di metalli pesanti. A causa del basso potere di penetrazione del fascio di elettroni le sezioni devono essere estremamente sottili. L’acetato di uranile o citrato di piombo, utilizzati in questa occasione, si legano selettivamente a specifiche regioni e strutture del preparato aumentandone il contrasto.
• Microscopio Elettronico
Nel microscopio elettronico a trasmissione (TEM) la sorgente d’onda è un filamento di tungsteno che funge da catodo e da cui parte il fascio di elettroni. Questi sono accelerati dalla differenza di potenziale presente tra catodo ed anodo, e sono orientati e condensati medianti lenti magnetiche. L’immagine finale è osservabile su uno schermo fluorescente che converte la radiazione elettrica, invisibile, in radiazione fotonica, da cui si ottiene una stampa che la riproduce ulteriormente ingrandita. Il TEM lavora esclusivamente sotto vuoto per garantire la propagazione del fascio di elettroni, e per questo motivo il campione è inserito in una piccola camera che è prima posta al livello di vuoto richiesto e, solo successivamente, messa in comunicazione con la camera vera e propria. Il fascio di elettroni ha uno scarso potere di penetrazione che rende impraticabile l’analisi del materiale vivente. Inoltre, date le ridottissime dimensioni richieste per i campioni diventa indispensabile adottare una tecnica specifica nell’allestimento dei preparati che devono essere prelevati, fissati e disidratati.
Microscopia Ottica
Dagli animali sacrificati sono stati prelevati campioni di rene, contenente sia la midollare che la corticale, delle dimensioni di un millimetro quadrato.
Sono stati inclusi con il seguente protocollo:
1. in formalina neutra tamponata al 10% per 12-48 ore 2. alcool 95% tutta la notte
3. alcool assoluto due cambi (8 ore) 4. xilolo tutta la notte
5. xilolo più parafina (1:1) per 1 ora in stufa a 58°C 6. paraffina in stufa a 58°C per 2-3 ore
7. passaggi in stufa a vuoto 2-3 ore
8. Inclusione: i pezzi sono stati messi manualmente in vaschette di metallo precedentemente riscaldate, ponendo attenzione al fatto che la superficie di taglio fosse rivolta verso la base di queste e ricoperte con supporti in plastica. E’ stata colata poi la paraffina all’interno delle vaschette in modo da formare la caratteristica forma del blocchetto da tagliare. Dopo un breve raffreddamento a temperatura ambiente, i blocchetti sono stati posti in frigorifero per accelerare il processo.
Una volta raffreddati, è stato possibile eliminare il supporto metallico per ottenere il blocchetto pronto da tagliare al microtomo.
Prima di procedere al taglio, si è effettuata la xilanizzazione dei vetrini; questa prevede:
1. immersione dei vetrini in soluzione contrad 5% (un sapone) in acqua distillata per 1 ora
2. risciacquo sotto acqua corrente per 3-4 ore 3. passaggio in acqua distillata
4. asciugatura in stufa a 37°C
5. passaggio dei vetrini in alcool assoluto 6. asciugatura in stufa a 37°C
7. preparazione di una soluzione al 2% di 3-amminopropyltriethoxisilane in acetone
8. immersione nella soluzione precedente di ogni gruppo di vetrini per 2 min 9. lavaggio continuo con acqua distillata fino a lavare via la soluzione in
eccesso sulla superficie del vetrino
10. asciugatura dei vetrini in stufa a 37°C da 2 ore a tutta la notte 11. osservazione a temperatura ambiente
E’ stato effettuato per ciascun campione di rene di ratto un taglio seriale: per ognuno di essi sono state raccolte 5 fettine seriate, cioè una in successione all’altra, di 5 µm l’una raccolte sui vetrini xilanizzati. Successivamente sono stati tagliati 100 µm di tessuto a vuoto, corrispondenti a 20 fette dello spessore già impostato, e quindi si è ripartiti a raccogliere le 5 fettine in serie. Il tutto è stato eseguito per 5 volte per ognuno dei campioni in modo da ottenere un totale di 25 fette da 5 µm.
• Sparaffinatura e Colorazione
Passaggio fondamentale prima della colorazione è l’eliminazione del paraffina uperflua mediante la sparaffinatura. Abbiamo fatto 2 passaggi in xilolo da 10 min e successivamente passaggi in alcool a concentrazioni decrescenti (100%,
96%, 70%, 50%) da 5 min ciascuno ed infine un lavaggio in acqua sempre per 5 min. Si può quindi procedere alla colorazione vera e propria.
• Colorazione “Rosso Sirius”
Il Rosso Sirius è un tipo di colorante, basato sul principio dell’impregnazione del tessuto. E’ utilizzato principalmente per l’individuazione delle fibre del collagene ed è quindi particolarmente indicato nella quantificazione del processo di fibrosi all’interno di un tessuto. Questo colorante si ottiene sciogliendo il rosso sirius sotto forma di polvere (Sirius Red F3BA) in una soluzione satura di acido pitrico. Il colorante è presente in soluzione finale alla concentrazione dello 0.1%. Con questa colorazione le fibre di collagene assumono una colorazione rossa che ne permette la distinzione all’interno del tessuto colorato con colorazioni istologiche di routine (es.: ematossilina).
• Analisi quantitativa della deposizione di collagene interstiziale
I vetrini colorati con rosso sirius sono stati sottoposti ad analisi quantitativa presso l’Istituto Clinico “Humanitas” di Rozzano. Mediante una telecamera digitale molto avanzata, collegata ad un microscopio ottico, sono state acquisite le immagine dei tessuti bioptici dopo la messa a fuoco e la taratura automatica del bianco. Grazie ad un programma appositamente ideato, abbiamo poi effettuato la misura dell’area totale della sezione bioptica e calcolato l’area colorata dal rosso sirius, corrispondente al collagene presente nel tessuto. E’ stato considerato il rapporto percentuale tra area “marcata” e area totale, definito come indice di fibrosi. L’analisi statistica è stata effettuata calcolando la
varianza ed utilizzando il test per confronti multipli di Student-Newman-Keuls. Le differenze sono state considerate significative per valori di p<0.05.
• Colorazione PAS
Dopo la sparaffinatura si procede alla colorazione con l’Acido Periodico ed il reattivo di Shiff (PAS). Precisamente si immergono i vetrini con adese le fettine in una soluzione di acido periodico, allo 0.2% o all’1% per 10 min. Dopo si effettua un lavaggio mediante acqua di fonte per 10 min, dopo i quali si applica il reattivo di Shiff , che colora i citoplasmi, per 40 min. Successivamente si aggiunge, 3 volte per 2 min, una soluzione solforosa di lavaggio che si ottiene sciogliendo 1 g di metabisolfito di sodio in 10 ml di HCl 1 N e 200 ml di acqua distillata. A questo punto si immergono i vetrini in Ematossilina Carazzi per 15 min, si lavano con acqua distillata e poi si fanno dei passaggi veloci in alcool assoluto, alcool 95% e xilolo.
L’Ematossilina Carazzi, che colora i nuclei, è stata preparata sciogliendo a caldo 25 g di allume potassico in 350 ml di acqua distillata; quando il sale è tutto disciolto si sospende il riscaldamento e si aggiungono 0.5 g di ematossilina. In un altro recipiente si sciolgono a freddo 0.1 g di iodato potassico in 50 ml di acqua distillata. Una volta raffreddatasi la soluzione di ematossilina, vi si aggiunge quella di iodato e 100 ml di glicerina pura distillata, oltre ad un cristallo di timolo per evitare lo sviluppo di muffe. Questa soluzione così preparata è subito pronta per essere utilizzata.
6.5 SEZIONE D: Indagine Molecolare
Analisi degli Acidi Nucleici
• Estrazione e Purificazione dell’RNA
Al fine di ottenere una buona preparazione di RNA, vengono inattivate le ribonucleasi presenti nel campione biologico da cui deve essere estratto l’RNA.Il protocollo seguito per l’estrazione dell’RNA prevede l’utilizzo di reagenti quali guanidina, fenolo e cloroformio: Un frammento di tessuto conservato a -80°C viene omogenato in una soluzione di Tris-reagente (Sigma) (1ml per 50-100 mg di tessuto), mantenendo le provette in ghiaccio. Si aggiungono all’omogenato 200 µl di cloroformio per ogni ml di Tris-reagente;
• Si centrifuga a 13.000 x g per 30’ a 4°C; si recupera il surnatante che contiene l’RNA
• Si aggiungono 500 µl di isopropanolo freddo, si agita e si pone a precipitare a -20°C per almeno un’ora.
• Si centrifuga a 13.000 x g per 30’ a 4 °C e, rimosso il surnatante, si lava il pellet per due volte con etanolo al 100% e due volte con etanolo al 75%, al fine di rimuovere residui di sali.
• Si risospende il pellet in acqua distillata sterile in volume opportuno (50-100 µl).
• Elettroforesi degli Acidi Nucleici
L’RNA totale viene quantificato mediante lettura allo spettrofotometro alla lunghezza d’onda di 260 nm e successivamente identificato con elettroforesi su gel di agarosio (Maniatis).
Il gel per il controllo dell’integrità dell’RNA estratto, viene preparato utilizzando agarosio all’1% in un tampone PO4 0.01 M (NaH2PO4 x 7H2O dibasico, NaHPO4
x H2O monobasico).
Si caricano 3 µg di RNA totale estratto da ciascun campione, addizionati di 1/10 del volume di stop buffer (glicerolo, NaPO4, blu di bromofenolo).
La visualizzazione dell’acido nucleico è possibile grazie al bromuro d’etidio, una sostanza intercalante, che si inserisce tra le basi degli acidi nucleici; quindi una volta sottoposto alla luce ultravioletta emette una fluorescenza rosa/arancione che consente la visualizzazione dell’RNA stesso.
Il gel viene quindi fotografato in modo da poter analizzare il pattern di migrazione e l’integrità dell’RNA stesso.
• Analisi dell’Espressione Genica: RT-PCR e PCR
La reazione di polimerizzazione a catena (Polymerase Chain Reaction o PCR) é una metodica che permette, con elevata precisione, di amplificare sequenze di DNA presenti anche in un ridotto numero di copie.
La reverse transcription PCR (RT-PCR) è una particolare versione del metodo che permette di analizzare l’espressione genica, e utilizza pertanto come matrice di partenza l’RNA.
• PCR
La reazione della polimerizzazione a catena (Polymerase Chain Reaction o PCR) è un'applicazione che permette di sintetizzare un elevatissimo numero di copie di qualsiasi segmento specifico di DNA mediante l’impiego di una DNA polimerasi, la Taq polimerasi, enzima di origine batterica, stabile anche alle elevate temperature (95°C) alle quali viene condotta la reazione di PCR.
La specificità della reazione di PCR è garantita dall’uso di oligonucleotidi di sintesi (primers) complementari alle estremità 5' e 3' dei due filamenti stampo, specifici per la sequenza che si vuole amplificare.
La reazione di PCR utilizza la ripetizione di tre fasi che si svolgono in diverse condizioni di temperatura:
-nella prima fase, detta denaturazione, la sequenza di DNA viene denaturata al calore mediante incubazione ad alta temperatura
-nella seconda fase, detta di ibridazione, che si svolge ad una temperatura sensibilmente più bassa, i primers ibridano con i filamentistampo ai quali sono complementari
-nella terza fase, detta di estensione, che avviene alla temperatura ottimale per l’attività enzimatica (generalmente 72°C), la DNA polimerasi sintetizza una catena complementare a quella di origine, in direzione 5’→ 3' a partire da ciascun primer ibridato alla sequenza stampo complementare, che funge da innesco per la sintesi.
Il processo di amplificazione che si ottiene mediante la ripetizione dei cicli di denaturazione, ibridizzazione dei pimers ed estensione (o allungamento) ad
opera della DNA polimerasi è esponenziale rispetto alla sequenza di DNA bersaglio originariamente presente nel campione
• RT-PCR
La tecnica di RT-PCR consta di due fasi:
a) retrotrascrizione: l’RNA a singolo filamento viene copiato in cDNA ad opera dell’enzima transcrittasi inversa.
b) amplificazione: la sequenza bersaglio viene amplificata mediante l’uso di una DNA polimerasi termoresistente e di primers specifici.
Analisi Statistica
Tutti gli esperimenti sono stati eseguiti in triplicato.
I dati ottenuti dalle tre ripetizioni sono stati espressi come media ± errore standard (EMS) sono stati confrontati mediante analisi della varianza ad una via (ANOVA), seguita dal test Student-Newman-Reulus. Si sono considerati statisticamente significativi i valori di P inferiori a 0.05.