FACOLTÀ DI MEDICINA VETERINARIA Corso di Laurea Magistrale in Medicina Veterinaria
Valutazione citologica, batteriologica e con PCR
di BALF di puledri con ascessi polmonari
diagnosticati mediante ecografia
Candidato: Relatore:
Alberto Caschetto Prof. Michele Corazza
Correlatore:
Dott. Micaela Sgorbini
PARTE GENERALE
Riassunto Pag. 5
1. Procedure diagnostiche utili alla diagnosi delle malattie
dell’apparato respiratorio “ 6
1.1. Valutazione generale del paziente con problemi respiratori “ 6
1.1.1. Esame fisico “ 9
1.1.2. Percussione “ 11
1.1.3. Auscultazione “ 12
1.2. Esami strumentali per la valutazione dell'apparato respiratorio
1.2.1. Radiografia toracica “ 13
1.2.1.1. Patterns polmonari “ 13
1.2.2. Ecografia toracica “ 15
1.2.3. Endoscopia “ 16
1.2.4. Aspirato trans-Tracheale (ATT) e lavaggio tracheale (LT) “ 17
1.2.5. Lavaggio broncoalveolare (BAL) “ 21
1.2.5.1. Come si esegue il BAL “ 21
1.2.5.2. Citologia del BALF “ 24
2. Polmoniti “ 26
2.1.Polmoniti nel puledro “ 26
2.1.1.2. Arterite virale Pag. 30
2.1.1.3. Rinopolmonite equina “ 32
2.1.2. Eziologia batterica “ 36
2.1.2.1. Streptococcus equi var. equi “ 36
2.1.2.2. Streptococcus equi var. zooepidemicus “ 38
2.1.2.3. Rhodococcus equi “ 40 2.1.2.3.1 Diagnostica di laboratorio “ 49 2.1.2.4. Miscellanea “ 58 2.1.3. Eziologia fungina “ 60 2.1.4. Eziologia parassitaria “ 62 PARTE SPERIMENTALE 1. Materiali e metodi “ 64 1.1. Animali “ 65 1.2. Materiali “ 67 1.3. Metodi “ 68 2. Risultati “ 72 3. Discussione e conclusioni “ 74 Bibliografia “ 76 Ringraziamenti “ 86
Riassunto
Parole chiave: puledro, BALF, ecografia pleurica, esami di laboratorio
Introduzione e scopo. Le malattie respiratorie nel puledro sono molto frequenti e sono una delle più comuni cause di perdita economica negli allevamenti. Per questo è importante eseguire una diagnosi precoce per identificare l’agente eziologico e provvedere a un’adeguata terapia. Scopo del seguente lavoro è quello di valutare l’utilità della citologia, della coltura batteriologica e della PCR eseguite sul liquido broncoalveolare (BALF), oltre all’ecografia toracica, nell’esecuzione di una diagnosi precoce di malattie respiratorie di puledri che presentano ascessi polmonari periferici.
Materiali e metodi. Nello studio sono stati inclusi 18 puledri, 10 maschi e 8 femmine, tra 1 e 4,5 mesi di età, con ascessi polmonari periferici rilevati attraverso ecografia toracica e sintomi clinici riconducibili a patologia respiratoria (tosse, tachipnea, rumori respiratori, scolo nasale). Il BAL è stato eseguito su tutti i soggetti e i campioni sono stati conservati in provette con EDTA per la citologia e in provette sterili per la coltura batterica e la PCR.
Risultati e conclusioni. In 7/18 puledri è stata diagnosticata la Rodococcosi, mentre 11/18 risultavano infetti da altri agenti patogeni. È stata calcolata la media e la deviazione standard sul totale delle cellule/µl e sulla percentuale di macrofagi, linfociti, neutrofili ed eosinofili sui due gruppi (positivi a R. equi e positivi ad altro). I risultati sono stati rispettivamente 1457,1±946,6; 47,8±16,9%; 6,8±3,2%; 45±17,8%; 0,7±0,7% per i puledri infetti da R. equi e 477,2±173,7; 64,4±10,5%; 14,9±6,9%; 19,8±10,6%; 1,09±1,6% per i puledri infetti da altri patogeni. I nostri risultati mostrano che l’ecografia è solo un buon mezzo di screening per la rapida identificazioni di ascessi polmonari, la citologia eseguita sul BALF è in grado di distinguere, seppur grossolanamente, un’infiammazione data da R. equi o da altro batterio, mentre la coltura batterica e la PCR risultano necessarie per l’identificazione dell’agente eziologico e il conseguente antibiogramma.
Abstract
Key words: foal, BALF, thoracic ultrasound, laboratory exams.
Introduction and aim. Respiratory diseases are frequent in foals and can be considered the most common reason of financial losses in breeding farms. For this reason an early aetiological diagnosis is very important. The aim of the present work was to study the usefulness of cytology, bacteriological culture and PCR of the broncoalveolar fluid (BALF) in foals with abscesses of peripheral lung revealed by a thoracic ultrasound.
Material and methods. 18 Standardbred foals, aged 1-4,5 months, with abscessation of peripheral lung diagnosed by thoracic ultrasound were included in the present study. BAL was performed in all the subjects and samples were collected in EDTA tubes for cytology and in sterile tubes for microbiology and PCR.
Results and conclusions. 7/18 foals were infected by R. equi, while 11/18 were infected by other bacteria. In foals with R. equi, X±SD for total cell/µl, macrophages, lymphocytes, neutrophils and eosinophils percentages were: 1457,1±946,6 cell/ul; 47,8±16,9%; 6,8±3,2%; 45±17,8%; 0,7±0,7%, respectively. In foals with bacterial pneumonia not caused by R. equi, X±SD for total cell/µl, macrophages, lymphocytes, neutrophils and eosinophils percentages were 477,2±173,7 cell/ul; 64,4±10,5%; 14,9±6,9%; 19,8±10,6%; 1,09±1,6%, respectively.
Our results suggest that thoracic ultrasound may be considered only a good screening test to rapidly identify pulmonary abscessations, BALF total cell count and cytology seems to be able to grossly differentiate the inflammatory pattern of R. equi infection from other bacterial infections, but bacteriology and PCR are required to identify the aetiological agents and to make the antibiotic sensitivity test.
1. Procedure diagnostiche utili alla diagnosi delle malattie dell’apparato respiratorio
1.1. Valutazione generale del paziente con problemi respiratori
La respirazione è un’attività cellulare che permette il trasferimento dell’ossigeno dall’aria inspirata al sangue arterioso e la rimozione dell’anidride carbonica dal sangue venoso.
Le vie respiratorie del cavallo sono predisposte per consentire questi scambi gassosi in maniera rapida e in grande quantità soprattutto durante l’esercizio fisico (Rush e Mair, 2004).
Le eccezionali capacità del cavallo atleta dipendono comunque dall’interazione dell’apparato respiratorio con gli apparati muscolo-scheletrico, nervoso e cardiovascolare (Rush e Mair, 2004).
La normale respirazione in cavalli a riposo è formata da due fasi: l’inspirazione, che è un processo attivo con partecipazione dei muscoli intercostali e del diaframma, e l’espirazione, che è un processo normalmente passivo, anche se nella fase finale vengono coinvolti i muscoli addominali (Rush e Mair, 2004).
Le malattie del tratto respiratorio sono molto comuni in cavalli di tutte le età e di tutte le razze ed eventuali disfunzioni respiratorie possono causare un calo di ventilazione e di scambi gassosi, risultando quindi la principale causa di intolleranza all'esercizio e scarse prestazioni (Rush e Mair, 2004). Anomalie a carico delle basse vie respiratorie sono riscontrabili attraverso l’esame fisico e si manifestano con sintomi diversi, dalla presenza di tosse, allo scolo nasale, rumori patologici all'auscultazione, tachipnea, dispnea, epistassi, emottisi e cianosi (Ainsworth D. M., Hackett R. P., 2004).
Tosse
E’ un riflesso fisiologico che serve a espellere aria dai polmoni in modo acuto e violento, dato dalla stimolazione di recettori specifici, per protezione delle vie respiratorie da parte di sostanze irritanti, particolato o per liberare l’albero tracheobronchiale da muco o altro materiale. Consiste in un'energica contrazione inspiratoria, cui segue una rapida espirazione, con chiusura e riapertura della rima della glottide e sollevamento del palato molle che va a chiudere il nasofaringe. (Wilson e Lofstedt, 1996).
Scolo nasale
Lo scolo nasale è causato da un’infiammazione delle cavità nasali, che comporta un aumento delle secrezioni ghiandolari. Viene classificato a seconda delle sue caratteristiche fisiche in sieroso, mucoso, purulento, emorragico, o in una combinazione di queste forme. In genere lo scolo nasale si presenta inizialmente di natura sierosa, poi progredisce in mucoso e, secondariamente a infezione batterica, si trasforma in purulento con l’afflusso di neutrofili. (Wilson e Lofstedt, 1996).
Rumori patologici all’auscultazione
La respirazioni in soggetti adulti, sani, a riposo, non genera suoni udibili. Deformità delle pareti o masse che determinano un restringimento del lume delle vie respiratorie provocano, però, un’alterazione del flusso laminare dell’aria e della pressione con conseguenti rumori respiratori. (Wilson e Lofstedt, 1996).
Tachipnea
puledro appena nato la FR è di 60-80 atti al minuto nei primi 30 minuti di vita per poi decrescere a 20-40 atti al minuto.
La tachipnea può essere causata da dolore, febbre, caldo o esercizio, o da condizioni patologiche tra cui scarsa ossigenazione del sangue e acidosi metabolica. (Wilson e Lofstedt, 1996).
Dispnea
E' una respirazione difficoltosa e faticosa che comporta un impegno muscolare non spontaneo nei normali atti di inspirazione ed espirazione. Può essere dovuta: a) malattie polmonari ostruttive, b) fibrosi polmonare, c) incapacità di espansione polmonare, come in corso di versamento pleurico o lo pneumotorace, d) patologie dei muscoli inspiratori e/o espiratori. (Wilson e Lofstedt, 1996).
Epistassi ed emottisi
E' una fuoriuscita di sangue dalle narici. Le cause sono molteplici ed anche la sede primaria di lesione. La volume di sangue può variare da una piccola quantità inclusa nella secrezione nasale sierosa a grandi volumi derivanti da entrambe le narici. La tosse con fuoriuscita di sangue è definita emottisi. (Wilson e Lofstedt, 1996).
Cianosi
E' una colorazione bluastra delle mucose. Può essere osservata in corso di patologie respiratorie dove si hanno alterazioni degli scambi gassosi tra sangue e alveolo, come nelle polmoniti e bronco-polmoniti. È il risultato, quindi, di un aumento della quantità di emoglobina ridotta nel sangue. (Wilson e Lofstedt, 1996).
1.1.1. Esame fisico (Messieri e Moretti, 1982; Rush e Mair, 2004).
L’apparato respiratorio è relativamente accessibile all’esame fisico e una valutazione approfondita rivela in genere informazioni che potranno poi essere approfondite con test diagnostici. Il segnalamento dell’animale è importante in quanto alcune malattie respiratorie sono tipiche di alcune età, o possono essere correlate alla razza, alle condizioni o all’ambiente in cui l’animale vive. Essenziale è l’anamnesi per determinare il momento esatto della comparsa dei primi sintomi. La durata dei sintomi può differenziare malattie infettive, con decorso acuto o subacuto, o non infettive, con decorso cronico. Traumatismi del tratto respiratorio (frattura di costole, rottura della trachea) solitamente producono grave distress respiratorio e i segnali appaiono evidenti. L’incidenza stagionale di alcune malattie aumenta il sospetto di eziologia allergica o ambientale. Le mancate vaccinazioni e i trasporti possono esporre gli animali a infezioni, sebbene le vaccinazioni non precludono completamente la possibilità di infezione virale o batterica nei cavalli.
L’esame fisico viene effettuato in maniera sistematica, a cominciare con l'osservazione a riposo. La prima cosa che si nota è la frequenza e lo sforzo compiuto durante la respirazione. La tachipnea non indica però necessariamente una patologia primaria dell’apparato respiratorio: acidosi, febbre, ansietà e dolore sono causa di aumento della frequenza respiratoria. All’esame fisico bisogna quindi prendere in considerazione: a) il tipo, b) la frequenza, c) l’ampiezza, d) la celerità e e) il ritmo del respiro.
a) Per “tipo” si intende la compartecipazione delle pareti toraco-addominali all’atto respiratorio (fisiologico: costo-addominale, prevalentemente addominale).
b) La frequenza è il numero di atti respiratori compiuti nell’unità di tempo. In un cavallo adulto la frequenza respiratoria a riposo è di 8-15 atti al minuto; nel puledro è di 60-80 atti al minuto nei primi 30 minuti dopo il parto e si stabilizza intorno ai 30 atti/minuto al primo mese di vita.
c)L’ampiezza è l’espansione toraco-addominale durante l’atto respiratorio. d) La celerità è la durata o la velocità con cui si compie ogni singolo atto respiratorio.
e) Il ritmo è il regolare succedersi nel tempo degli atti respiratori e della loro durata, il regolare rapporto tra inspirazione ed espirazione.
1.1.2. Percussione (Messieri e Moretti, 1982)
Con la percussione del torace ci proponiamo di stabilire le condizioni fisiche del polmone in relazione al suo contenuto d’aria, alla sua espansione, alle condizioni intratoraciche che possono ostacolarne la funzione come ad esempio versamenti pleurici o pericardici.
Per eseguire la percussione del torace è indicato porsi di fianco al soggetto ed iniziare in un primo tempo l’esame dall’alto verso il basso su linee parallele, distanti pochi centimetri l’una dall’altra, a colpi staccati ritmicamente ripetuti.
Usando plessimetro e martelletto è consigliabile mantenere il martelletto perpendicolare all’asse del plessimetro.
Eseguendo l’esame di percussione di proponiamo di stabilire la sonorità del torace e di delimitare i bordi del polmone per mettere in evidenza eventuali aumenti o diminuzioni di volume. La risonanza toracica è legata alla quantità di aria contenuta nel polmone, alla tensione delle pareti alveolari, alla eventuale presenza nel cavo pleurico o nel sacco pericardico di raccolte liquide o gassose, di neoformazioni o di prodotti infiammatori solidificati. Con l’aumentare del contenuto d’aria nel polmone aumenta la sonorità toracica.
1.1.3. Auscultazione (Messieri e Moretti, 1982)
L’auscultazione del torace permette di percepire il murmure vescicolare, che rappresenta il rumore funzionale del polmone determinato dall’attrito che l’aria incontra per arrivare all’alveolo polmonare e dalle vibrazioni determinate dalla distensione delle pareti alveolari.
Nel cavallo adulto il murmure vescicolare è di massima esclusivamente inspiratorio. Nella fase espiratoria il murmure vescicolare può essere lievemente sensibile principalmente nel puledro.
Significato patologico assume il murmure vescicolare aspro o impuro che ha una tonalità più alta e meno dolce del rumore funzionale. Denota in genere irregolarità della mucosa bronchiale o riduzione del lume dei bronchi.
Elemento patologico frequente è il rantolo, espressione di abnormi secrezione o di essudazione bronchiale o alveolare con o senza alterazioni anatomiche della mucosa e riduzione del lume bronchiale. Possiamo riscontrare rantoli umidi e rantoli secchi; i primi a grosse, medie e piccole bolle e crepitanti, a seconda della loro sede di origine (grossi, medi o piccoli bronchi), sono legati alla presenza di catarro fluido mosso dall’aria respiratoria. I rantoli secchi si determinano nei processi cronici bronchiali ed in quelli nei quali la mucosa bronchiale è ispessita o edematosa e sono rappresentati da fischi o sibili, ispiratori, espiratori o continui.
All’auscultazione possiamo anche riscontrare anche dei rumori di provenienza pleurica come sfregamenti o gorgogliamenti. Nel primo caso si tratta di processi pleurici iniziali senza versamento; nel secondo caso di processi pleurici con versamento ed aderenze.
1.2. Tecniche diagnostiche speciali per valutare l’apparato respiratorio
1.2.1. Radiografia
La radiografia è uno strumento di grande aiuto per l’identificazione di masse nel tessuto molle, quali ascessi, granulomi, neoplasie, consolidamenti ed ematomi, o la raccolta di fluidi.
La valutazione radiografica del torace equino rimane preferibile all’ecografia per l’identificazione di malattie polmonari diffuse come polmonite interstiziali, edema polmonare o ascessi non superficiali.
1.2.1.1 Pattern polmonari
Quattro tipi di pattern radiografici sono descritti (Ainsworth e Hackett, 2004):
- Pattern alveolare: aree opache si uniscono, obliterano i bronchi e nascondono il normale disegno vascolare. E’ possibile notare sullo sfondo del tessuto polmonare opacizzato i bronchi contenti aria (broncografia gassosa). E’ conseguente a edema polmonare, emorragie, epatizzazione, consolidamento o neoplasia.
- Pattern interstiziale: associato a diverse condizioni, denota una sfumatura dei margini dei vasi polmonari e un diffuso aumento dell’opacità polmonare. Si distingue un’opacità reticolare, lineare o nodulare.
a) Il pattern reticolare è evidente in caso di polmonite virale, batterica o dovuta a parassiti;
b) un irregolare pattern lineare si evidenzia in caso di risoluzione di una broncopolmonite;
c) il pattern nodulare invece è indice della presenza di ascessi, granulomi o neoplasie.
- Pattern bronchiale: in genere associato con il pattern interstiziale è caratterizzato da irregolarità e ispessimento delle immagini dei bronchi, dovuto a bronchiti e bronchiectasia.
- Pattern vascolare: è caratterizzato da un’alterazione della forma e della dimensione dei vasi e può essere riscontrabile in cavalli in seguito a esercizio fisico o che presentano shunt cardiaco sinistra/destra.
1.2.2. Ecografia (Ainsworth e Hackett, 2004)
L’ecografia toracica è molto utile per la valutazione diagnostica, terapeutica e prognostica del parenchima polmonare periferico e dei foglietti pleurici.
L'esame ecografico è considerato migliore rispetto al radiografico per evidenziare versamenti pleurici, consolidamenti polmonari, ascessi, tumori e granulomi.
Il normale tessuto polmonare, essendo pieno d'aria, non è visualizzabile all'esame ecografico in quanto riflette totalmente gli ultrasuoni. Quindi l'immagine ecografica di un torace sano evidenzia i muscoli parietali, la pleura viscerale (linea iperecogena che si muove con gli atti respiratori) e delle linee iperecogene parallele tra loro e alla pleura parietale che sono artefatti creati dagli ultrasuoni che vengono riflessi totalmente dal polmone e ritornano alla sonda.
Fisiologicamente il liquido pleurico appare come una linea anecogena che separa la pleura parietale dalla viscerale. In seguito a patologie polmonari è possibile avere una maggiore produzione di liquido pleurico infiammatorio (essudato) e non (trasudato) che si traduce in un aumento in dimensioni dello spazio pleurico. Il liquido può avere ecogenicità diversa in relazione al tipo di trasudato (normale o modificato) o di essudato. Mediante l'esame ultrasonografico è possibile quindi valutare non solo le dimensioni dello spazio pleurico, ma anche di valutare le caratteristiche del liquido pleurico, quindi la presenza di fibrina, sangue, pus, gas o di aderenze tra la pleura viscerale e quella parietale.
Gli ascessi appaiono ecograficamente come aree cave incapsulate ripiene di liquido o materiale di ecogenicità diversa in relazione all'organizzazione
Le aree di consolidamento polmonare appaiono come zone a margini irregolari e di ecogenicità non omogenea a causa del diverso accumulo di essudato e all'intrappolamento di aria all'interno dell'area consolidata. L'epatizzazione polmonare si manifesta come una zona di ecogenicità simile al fegato ed è possibile visualizzare completamente il lobo epatizzato.
Mediante l'esame ecografico è possibile diagnosticare emorragie pleuriche e/o polmonari e fratture delle coste.
A livello diagnostico i limiti dell'esame ecografico sono l'impossibilità di visualizzare lesioni nelle porzioni lobari del polmone in quanto troppo profonde per le sonde normalmente disponibili in commercio. Questi limiti sono meno evidenti nel puledro in quanto il torace è più piccolo e le frequenze utilizzate permettono una visualizzazione più profonda rispetto ai soggetti adulti.
1.2.3. Endoscopia (Ainsworth e Hackett, 2004)
Nella specie equina l’esame endoscopico rappresenta un ottimo metodo per valutare l'albero respiratorio, sia per quanto riguarda le vie superiori (patologie dinamiche e non del faringe-laringe, delle coane e turbinati, delle tasche gutturali) che per quelle inferiori (patologie dei grossi e medi bronchi).
L’endoscopia, inoltre, è un mezzo attraverso cui è possibile effettuare un lavaggio tracheale o broncoalveolare.
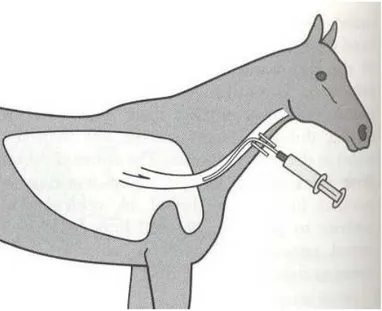
1.2.4. Aspirato Trans-Tracheale (ATT) e lavaggio tracheale (LT)
(fig.1)(Taylor e Hillyer, 1997; Hoffman e Viel, 1997; Hodgson e Hodgson, 2003; Roy e Lavoie, 2003; Rush e Mair, 2004).
L'ATT e il LT forniscono un campione rappresentativo della popolazione batterica delle prime vie respiratorie e rappresenta la più appropriata procedura da eseguire per ottenere colture batteriche dalle secrezioni bronchiali di cavalli con malattie infettive respiratorie.
Sia l'ATT che il LT vengono eseguiti con il soggetto sedato e contenuto mediante torcinaso. La sedazione può essere ottenuta mediante somministrazione di α2-agonisti come xilazina idrocloridrato (0,3-0,5 mg/kg pc, IV), detomidina (0,03-0,05 mg/kg pc, IV). Quest’ultima è preferita alle altre perché provoca una minore pesantezza della testa. La concomitante somministrazione di butorfanolo tartrato (0,01-0,03 mg/kg pc, IV) è consigliata in soggetti con iperreattività delle vie aeree perché evita o riduce gli accessi di tosse.
Il punto di repere per l'esecuzione dell'ATT tra il primo terzo prossimale e il secondo terzo distale della trachea cervicale. Si prepara il campo chirurgico per un’area di circa 10x10 cm, si infonde nel sottocute 1 ml di anestetico locale (lidocaina) e si pratica un’incisione di 3-5 mm, quindi si inserisce un’agocannula 16-14 G tra gli anelli tracheali, inizialmente perpendicolare all’incisione. Quindi, una volta in trachea, si ritrae leggermente il mandrino dell'agocannula per evitare traumi sulla mucosa tracheale e ci direzioniamo caudo-ventralmente fino all'inserimento completo dell'agocannula. Dopo il suo posizionamento, ritiriamo completamente il mandrino di metallo e facciamo passare attraverso la cannula in PCV un catetere urinario da cane (5-8 French e 50 cm di
fisiologica isotonica e riscaldata a circa 37 °C che verrà immediatamente riaspirata.
I campioni tracheali possono essere ottenuti anche attraverso il canale di servizio dell'endoscopio. In questo caso si parla di LT, procedura sicuramente meno invasiva dell'ATT (Darien et al., 1990; Christley et al., 1999).
L'endoscopio viene fatto passare nel meato ventrale delle narici, indifferentemente destra o sinistra, quindi in faringe-laringe e trachea. Il passaggio in trachea può stimolare il riflesso tussigeno, in questo caso è necessario insufflare soluzione fisiologica riscaldata a 37 °C e lidocaina in rapporto 1:1. Questo permette di avere una anestesia della superficie mucosale ed evitare quindi i colpi di tosse. Al fine di avere campioni sterili è necessario utilizzare un “guarded catheter” fatto passare nel canale di servizio dell'endoscopio.
Il vantaggio della tecnica endoscopica è quello di visualizzare l'albero tracheo-bronchiale e quindi verificare lo stato della mucosa, la presenza e il tipo di essudato, la presenza di broncocostrizione.
I campioni raccolti per la batteriologia devono essere conservati in provette sterili senza anticoagulante, mentre quelli per la citologia verranno raccolti in provette con EDTA. Entrambi i tipi di campione devono essere trasportati refrigerati e processati entro poche ore dalla raccolta.
Complicazioni
Le complicazioni possibili dell'ATT sono rappresentate da lesione degli anelli tracheali con flogosi cronica secondaria, da infezione/cellulite nel sito di penetrazione dell’ago a causa di batteri provenienti dalle basse vie, da rottura del catetere nel sottocute che necessita di una rimozione
chirurgica, e da enfisema sottocutaneo (Mansmann e Knight, 1972; Beech, 1981; Taylor e Hillyer, 1997).
E’ possibile anche che si verifichi la rottura del catetere all’interno della trachea, fortunatamente la tosse in pochi minuti permette l’espulsione della porzione persa o una retroversione del catetere stesso verso l’orofaringe con una conseguente contaminazione del campione tracheale raccolto o addirittura un campionamento errato dell’orofaringe (Hewson e Viel, 2002).
Le complicazioni del LT potrebbero essere la contaminazione del campione da parte di batteri provenienti dall’orofaringe e dalle prime vie aeree perché trasportati verso la trachea durante il passaggio dell’endoscopio (Viel et al., 1999). Come abbiamo già detto, questa complicanza è eliminata con l'utilizzo di un catetere a doppia protezione (guarded catheter). Alcuni Autori (Darien et al., 1990; Christley et al., 1999; Viel et al., 1999; Viel et al., 2000) affermano però che, anche per i campioni ottenuti con aspirato tracheale o con endoscopio e catetere a doppia protezione, è sempre necessario interpretare con cautela la presenza di batteri nel citologico in quanto una flora batterica fisiologica è sempre presente nella parte più rostrale della trachea.
Figura 1 – Tecnica per aspirato tracheale nel cavallo (Taylor e Hillyer, 1997, modificato).
1.2.5. Lavaggio Broncoalveolare (Bronco-Alveolar Lavage, BAL)
(Fogarty, 1990; McKane e Rose, 1993; Taylor e Hillyer, 1997; Hoffman e Viel, 1997; Hodgson e Hodgson, 2003; Roy e Lavoie, 2003; Viel e Hewson, 2003; Rush e Mair, 2004)
Il lavaggio broncoalveolare viene eseguito per diagnosticare le malattie polmonari diffuse. E’indicato principalmente per la determinazione di malattie polmonari non infettive, ma può essere usato anche nella diagnosi di patologie polmonari ad eziologia infettiva.
La valutazione citologica del fluido refluo del lavaggio broncoalveolare (Bronco-Alveolar Lavage Fluid, BALF) è più attendibile dei campioni ottenuti con l'ATT o il LT, sia per diagnosi e per una indicazione terapeutica in patologie diffuse dell'albero bronchiale e del parenchima polmonare.
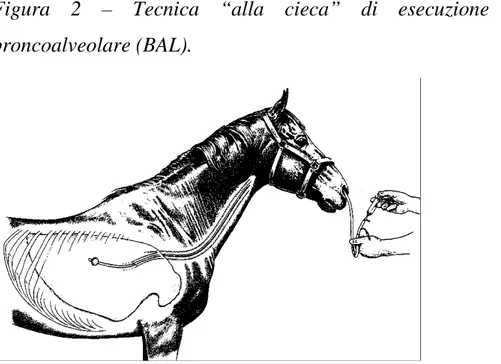
1.2.5.1. Come si esegue il BAL (fig. 2)
Il BAL viene eseguito con l’animale in stazione quadrupedale, sedato e contenuto con torcinaso. La sedazione può essere ottenuta mediante somministrazione di α2-agonisti come xilazina idrocloridrato (0,3-0,5 mg/kg pc, IV), detomidina (0,03-0,05 mg/kg pc, IV). Quest’ultima è preferita alle altre perché provoca una minore pesantezza della testa. La concomitante somministrazione di butorfanolo tartrato (0,01-0,03 mg/kg pc, IV) è consigliata in soggetti con iperreattività delle vie aeree perché evita o riduce gli accessi di tosse. Nel caso in cui il BAL debba essere seguito su un puledro, in questo caso è sufficiente il contenimento manuale. Il BAL può essere eseguito con tecnica “alla cieca” o mediante endoscopio.
La tecnica alla cieca prevede l'utilizzo di un catetere Bivona, (Cook, USA). Il catetere ha una lunghezza di 3 metri, un diametro di 10 mm ed è cuffiabile; questo permette di rimanere in situ una volta raggiunta la sede di prelievo.
Il catetere viene fatto passare nel meato ventrale delle narici, indifferentemente destra o sinistra. L'arrivo del catetere nell'adito laringeo è apprezzabile perchè si manifesta una resistenza al passaggio del catetere stesso. E' necessario quindi estendere la testa del cavallo in modo da allineare l'adito laringeo con la trachea la laringe. Il passaggio in trachea di solito è sottolineato dalla stimolazione del riflesso tussigeno, tanto che è quasi sempre necessario insufflare soluzione fisiologica riscaldata a 37 °C e lidocaina in rapporto 1:1. Questo permette di avere una anestesia della superficie mucosale ed evitare quindi i colpi di tosse. Il catetere viene inserito fino a che non si riesce più a procedere. Ciò significa che il diametro del catetere è uguale a quello del bronco in cui si trova, di solito un bronco di III o IV grado. A questo punto di cuffia il palloncino, si insufflano 300 ml di soluzione fisiologica sterile riscaldata a 37 °C che vengono immediatamente riaspirati, di solito in quantità di circa 60-70 ml. La tecnica endoscopia è migliore della tecnica alla cieca perchè permette di visualizzare l'albero bronchiale. L'endoscopio viene inserito come il catetere Bivona, ma l'entrata in trachea è più semplice perchè controllabile direttamente. L'insufflazione e la successiva aspirazione della soluzione fisiologica avviene attraverso un catetere in PVC fatto passare attraverso il canale di servizio dell’endoscopio. Se fosse necessario ottenere campioni per l'esame batteriologico, è possibile utilizzare un “guarded catheter”, come per il LT. Anche in questo caso si insufflano 300 ml di soluzione fisiologica isotonica, sterile e riscaldata a 37 °C e si riaspirano immediatamente.
Come per l'ATT e il LT, anche i campioni di BALF vengono raccolti in provette sterili senza anticoagulante per l'esame batteriologico e con EDTA per la citologia. Entrambi i tipi di campione devono essere trasportati refrigerati e processati entro poche ore dalla raccolta.
Figura 2 – Tecnica “alla cieca” di esecuzione del lavaggio broncoalveolare (BAL).
1.2.5.2. Citologia del BALF
L’analisi citologica del BAL include la conta totale cellulare e la conta differenziale. La conta totale viene eseguita mediante un contaglobuli che dà il valore totale dei WBC presenti nel campione stesso. Il valore considerato normale è una conta cellulare totale inferiore a 300 cell/µL. Quindi si procede alla preparazione dei preparati citologici, ottenuti direttamente mediante citocentrifugazione (CYTOFUGE2, USA). Nel caso in cui non si abbia a disposizione una citocentrifuga, i campione devono essere centrifugati a bassi giri (600-800 minuto), quindi il surnatante viene eliminato, il materiale raccolto sul fondo della provetta viene risospeso e da questo vengono allestiti i preparati citologici (Lapointe et al., 1994).
I vetrini, quindi, vengono fatti asciugare all'aria e colorati con una colorazione Romanowski modificata (Diff-Quick®, DADA Milano).
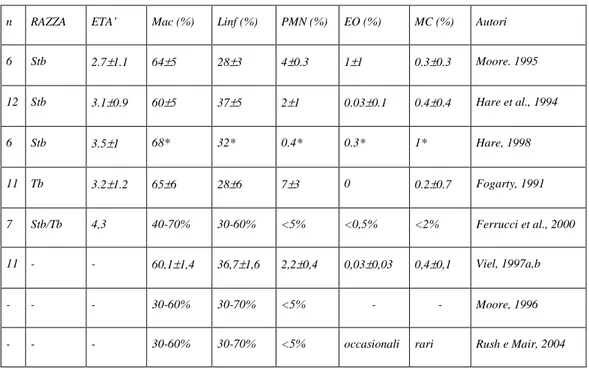
Le cellule rappresentate normalmente nel BALF sono macrofagi, linfociti ed in minor misura neutrofili, eosinofili e mastociti. I limiti di riferimento approssimativi sono stati identificati da vari Autori (tab. 1). Gli altri elementi cellulari sono le epiteliali ciliate e non, le cellule globose, i batteri in posizione intracellulare o liberi e le spore fungine inalate. L’elemento non cellulare di interesse è la qualità, la quantità di muco e le spirali Curschmann che sono formate da muco denso che ha assunto la forma del bronchiolo terminale.
Tabella 1 – Valori ottenuti in soggetti sani.
Legenda – Mac: Macrofagi; Linf: Linfociti; PMN: Neutrofili; EO: Eosinofili; MC: Mast-cell; Stb: Standardbred; TB: Thoroughbred; DS: deviazione standard; *: dati espressi come valori medi.
n RAZZA ETA’ Mac (%) Linf (%) PMN (%) EO (%) MC (%) Autori
6 Stb 2.7±1.1 64±5 28±3 4±0.3 1±1 0.3±0.3 Moore. 1995 12 Stb 3.1±0.9 60±5 37±5 2±1 0.03±0.1 0.4±0.4 Hare et al., 1994 6 Stb 3.5±1 68* 32* 0.4* 0.3* 1* Hare, 1998 11 Tb 3.2±1.2 65±6 28±6 7±3 0 0.2±0.7 Fogarty, 1991 7 Stb/Tb 4,3 40-70% 30-60% <5% <0,5% <2% Ferrucci et al., 2000 11 - - 60,1±1,4 36,7±1,6 2,2±0,4 0,03±0,03 0,4±0,1 Viel, 1997a,b - - - 30-60% 30-70% <5% - - Moore, 1996
- - - 30-60% 30-70% <5% occasionali rari Rush e Mair, 2004
2. Polmoniti (Messieri e Moretti, 1982)
Il termine polmonite si riferisce al processo infiammatorio diffuso o circoscritto del parenchima polmonare. Le cause di polmonite possono essere varie:
- cause fisiche: traumi, materiale eterogeneo inspirato (polmonite “ab ingestis”, raffreddamenti (polmonite “a frigore”), ipostasi, disturbi di circolo;
- cause chimiche: inalazioni di fumo, vapori o gas irritanti; - cause infettive: virali, batteriche, fungine, parassitarie.
2.1. Polmoniti nei puledri
Uno studio condotto in Texas ha rilevato che la polmonite è la principale causa di morte in puledri tra i 32 e i 180 giorni di vita (Cohen, 1994).
Un altro studio eseguito in Ontario ha evidenziato che la morbilità attribuita alle infezioni delle basse vie respiratorie tra i puledri è stimata intorno al 71% negli allevamenti con malattie a carattere endemico (Hoffman et al., 1993).
Da questo si può capire come le infezioni delle basse vie respiratorie nei puledri siano un problema molto importante e costituiscono una grossa perdita economica in termini di mortalità, costo dei trattamenti e profilassi, ritardi nella crescita, scarse performance e perdita di valore dei soggetti (Wilson, 1992).
I fattori predisponenti nei puledri sono il mancato trasferimento parziale o totale dell'immunità passiva, il calo degli anticorpi materni intorno ai 2 mesi di età, le condizioni ambientali quali affollamento e igiene dell'allevamento (Barr, 2003).
2.1.1. Eziologia virale (Sellon e Long, 2007)
2.1.1.1. Influenza equina
E’ una malattia respiratoria altamente contagiosa e a decorso solitamente acuto, caratterizzata da ipertermia, tosse persistente e depressione del sensorio
Eziologia
La malattia è sostenuta da virus influenzali di tipo A appartenenti alla famiglia Orthomyxoviridae. Nel cavallo è nota l’esistenza di due sottotipi: H7N7 (A equi 1) e H3N8 (A equi 2), entrambi responsabili di una malattia clinicamente simile anche se il virus 2 è spesso causa di forme più gravi e diffusibili. Come gli altri virus influenzali anche questi sono sensibili al calore, ai raggi UV e ai comuni disinfettanti.
Epidemiologia e patogenesi
Il virus è ubiquitario e la malattia ha andamento tipicamente stagionale (autunno-inverno). La principale via di diffusione è quella aerogena con inalazione di aerosol contaminati da muco di soggetti con malattia in atto. Non è esclusa però la trasmissione attraverso l’accoppiamento: in alcuni stalloni, infatti, è stato isolato il virus dal seme anche a distanza di alcuni mesi dalla guarigione clinica. Una volta penetrato nell’organismo, il virus si lega ai recettori di natura mucoproteica presenti sulla superficie esterna delle cellule di rivestimento delle mucose nasale, faringea, tracheale e bronchiale nelle quali poi penetra per endocitosi. La conseguente replicazione è responsabile di degenerazione e necrosi cellulare, desquamazione e occlusione di entità variabile dei passaggi aerei. Ciò
di pirogeni endogeni. A carico degli alveoli si osservano: iperemia, ispessimento della parete, infiltrazione leucocitaria interstiziale, trombosi capillare, edema ed essudazione. La replicazione virale è particolarmente intensa a livello delle cellule epiteliali della trachea e dei bronchi e provoca il distacco delle ciglia, esponendo così la mucosa alle infezioni batteriche secondarie. In assenza di complicazioni, la rigenerazione dell’epitelio ciliato inizia dopo 4 giorni dalla comparsa dei sintomi e si completa entro qualche settimana.
Segni clinici
L’esordio della malattia è improvviso con comparsa di febbre (38,5-41°C) che persiste per tre giorni, rinite catarrale associata ad abbondante scolo nasale sieroso che diventa poi mucoso, tosse e dispnea, laringotracheite e lieve bronchite. Si nota uno stato depressivo con difficoltà di movimento, dolori muscolari, capo e orecchie abbassati e scarso interesse per l’ambiente circostante. Si osserva aumento di volume dei linfonodi della testa, fotofobia, lacrimazione e protrusione della congiuntiva. Il sintomo più frequente è, comunque, rappresentato dalla tosse che compare subito dopo la febbre e persiste per 1-3 settimane, dapprima secca, a colpi isolati, poi diventa umida e produttiva. Occasionalmente compare polmonite che, in presenza di infezioni batteriche secondarie, può esitare nella morte. Non è raro il riscontro di lieve ittero, enterite catarrale e talvolta emorragica e alterazioni della funzionalità renale. Nei puledri la malattia è più grave rispetto agli adulti, associandosi spesso a broncopolmonite rapidamente letale.
Nei casi non complicati la malattia decorre per 2-10 giorni ed è seguita da un periodo di convalescenza di 1-3 settimane. La mortalità è generalmente bassa e non supera il 5%.
Diagnosi
Il sospetto di malattia può essere formulato sulla base dell’insorgenza improvvisa dei sintomi respiratori. Tra le diagnosi differenziali è necessario prendere in considerazione: l’adenite equina da Streptococcus equi var.
equi, l’arterite virale, la rinopolmonite e le infezioni da Adenovirus e Rhinovirus. L’adenite e l’arterite virale sono in genere malattie più gravi
rispetto all’influenza. L’adenite è caratterizzata da flogosi linfonodale purulenta con abbondante scolo nasale anch’esso purulento. Nell’arterite virale, oltre la sintomatologia polmonare, si evidenziano anche congiuntivite, edema palpebrale, petecchie emorragiche su mucosa nasale e congiuntivale, aborto.
La diagnosi eziologica può essere eseguita mediante isolamento del virus dal secreto nasale o faringeo nella fase di eliminazione del virus da parte dell'animale malato.
Profilassi
La profilassi sanitaria si basa sul mantenimento di standard elevati di igiene dei ricoveri e dei mezzi di trasporto e sull’adozione di misure volte ad evitare stress agli animali.
La profilassi immunizzante tramite vaccinazione costituisce un metodo valido per proteggere gli animali dall’infezione e ridurre l’entità dei sintomi e l’escrezione del virus. Titoli inibenti l’emoagglutinazione 1:32 - 1:40, conseguenti a infezione o a vaccinazione, sono indicativi di protezione nei confronti del virus omotipico. Per la profilassi immunizzante del cavallo nei confronti dell’influenza sono impiegati vaccini inattivati, attenuati, ricombinanti.
2.1.1.2. Arterite virale equina (Equine Viral Arteritis, EVA)
E' una malattia virale contagiosa del cavallo, febbrile e a decorso subclinico, caratterizzata da vasculite generalizzata, sintomi respiratori, edemi sottocutanei, petecchie emorragiche e aborto.
Eziologia
Il virus appartiene alla famiglia Arteriviridae, genere Arterivirus. E' provvisto di envelope e presenta simmetria icosaedrica. E’ abbastanza labile, sensibile a all’azione di etere e cloroformio, ai raggi UV e a Ph acidi. E’ stato identificato un solo sierotipo ma i diversi ceppi isolati mostrano però differenti gradi di virulenza.
Epidemiologia e patogenesi
Il virus è ubiquitario e l’infezione avviene per aerosol dalle secrezioni delle vie respiratorie o dall’urina, o attraverso l’accoppiamento tramite il liquido seminale di stalloni eliminatori. Dopo la penetrazione per via inalatoria il virus replica nei macrofagi alveolari, passa ai linfonodi e si dissemina in tutto l’organismo tramite il torrente circolatorio, tranne che nel SNC. I siti principali di replicazione sono rappresentati da macrofagi e cellule endoteliali e in secondo luogo da cellule epiteliali e mesoteliali di vari organi, per cui vengono colpiti polmoni, intestino, fegato, ghiandole surrenali, tiroide e tubuli seminiferi. In seguito a successiva localizzazione renale si ha glomerulo nefrite da immucomplessi accompagnata da escrezione del virus per circa tre settimane dopo l’infezione.
Segni clinici
La sintomatologia è molto variabile in funzione del ceppo virale, della dose infettante, delle condizioni dell’animale e della gestione dell’allevamento. La forma acuta prevede febbre fino a 41°C, leucopenia, anoressia, depressione del sensorio, edemi diffusi, scolo oculare-nasale, congiuntivite e talvolta opacità corneale, tosse e diarrea. Nel puledro determina gravi polmoniti interstiziali che possono avere esito letale. Nelle fattrici gravide si può verificare aborto senza segni premonitori a qualsiasi stadio della gestazione.
Diagnosi
La diagnosi clinica è piuttosto difficile in quanto non esistono segni patognomonici e la sintomatologia è riconducibile ad altre malattie virali. Per diagnosi certa è necessario l’isolamento del virus da tamponi nasali e/o congiuntivali oppure è possibile la diagnosi indiretta tramite test sierologici come la prova di neutralizzazione e l’ELISA che però non sono in grado di distinguere animali infetti da animali vaccinati.
In uno studio recente è stato sviluppato un metodo di diagnosi sierologica che valuta la risposta anticorpale umorale equina alle proteine non-strutturali del virus espresse nelle cellule infette da EAV. (Go et al. 2011).
2.1.1.2. Rinopolmonite equina/Aborto virale
Malattia altamente contagiosa caratterizzata da quadri riferibili a infezione respiratoria, aborto ed encefalite.
Eziologia
La malattia è sostenuta da un virus appartenente alla famiglia Herpesviridae. Sono stati identificati due sierotipi distinti indicati come EHV-1, prevalentemente implicato nel determinismo di aborto, e EHV-4, non abortigeno e prevalentemente implicato nella malattia respiratoria. I due sierotipi presentano analogie e differenze di struttura antigene determinate dagli epitopi delle glicoproteine dell’envelope. L’esistenza di correlazioni antigeni determina la possibilità che all’infezione da EHV-1 consegua uno stato di resistenza nei confronti di EHV-4.
Epidemiologia e patogenesi
La forma respiratoria è ampiamente diffusa soprattutto tra i puledri che, nei primi mesi dopo lo svezzamento, vengono colpiti in misura molto elevata. In questi casi, in genere, l’infezione è data da EHV-4 e dal punto di vista clinico i sintomi sono così modesti che passano inosservati nelle maggior parte dei casi. La trasmissione del virus avviene prevalentemente per via aerogena e viene accentuata da fattori come il numero elevato di individui recettivi e lo stretto contatto tra loro.
La patogenesi varia a secondo del sierotipo pur essendo entrambi responsabili di localizzazione primaria alle prime vie respiratorie. In alcuni casi si può avere localizzazione alle vie respiratorie profonde, soprattutto nel puledro, con conseguente polmonite grave e spesso morte. In presenza del sierotipo 4 l’infezione è destinata a limitarsi all’apparato respiratorio
coinvolgendo soltanto i linfonodi regionali. Con il sierotipo 1, invece, l’infezione si estende anche agli endoteli vasali del nasofaringe e del polmone, nonché ai leucociti circolanti. La presenza del virus nel torrente circolatorio giustifica l’attitudine abortigena di EHV-1. Tuttavia, il meccanismo della viremia cellulomediata, pur essendo il solo responsabile dell’aborto, non rende questo inevitabile in quanto la migrazione di leucociti infetti attraverso la placenta è un evento accidentale e per questo l’incidenza di infezione fetali in corso di focolai di rinopolmonite risulta scarsa. La comparsa dell’aborto può comunque derivare da un’infezione primaria dell’apparato respiratorio, o dalla riattivazione di EHV-1 presente nei leucociti di animali che hanno superato l’infezione respiratoria e quindi immuni.
L’assenza di replicazione virale all’interno dei neuroni fa ritenere che i sintomi encefalici siano dovuti a uno stato di ischemia e flogosi per vasculite cerebro-spinale.
Segni clinici
La forma polmonare si manifesta con febbre associata a segni specifici di rinofaringite e tracheobronchite. La temperatura rettale può raggiungere i 40-40,5°C, è presente tosse, scolo nasale sieroso che poi diventa mucoso o mucopurulento, anoressia, depressione del sensorio, tumefazione dei linfonodi intermandibolari. Tali sintomi si risolvono nel giro di una settimana circa. Si ritiene in generale che i sintomi respiratori siano meno gravi in presenza di EHV-4 rispetto a EHV-1, ma ciò non consente la differenziazione clinica delle rispettive infezioni.
L'aborto nell'ultimo trimestre di gravidanza e la mortalità perinatale è causata dall'EHV-1. L’aborto si verifica nell'ultimo trimestre di gravidanza
La forma neurologica è sporadica e sempre preceduta dai sintomi della malattia respiratoria. Si presenta con la comparsa di debolezza del treno posteriore, ritenzione urinaria e fecale. La prognosi è infausta se sopraggiunge paralisi.
Diagnosi
La forma respiratoria non risulta differenziabile dal punto di vista clinico dalle altre infezioni virali dell'apparato respiratorio. E' necessario quindi ricorrere all'isolamento del virus da tamponi nasali, la titolazione anticorpale che però non differenzia gli animali infetti dai vaccinati e comunque andrebbero fatte due determinazioni a distanza di 15-20 giorni per verificare la sieroconversione. La diagnosi eziologica è possibile con l'esame di tamponi nasali e del buffy coat mediante PCR. (Perkins et al. 2008; Pusterla et al. 2009). È stato inoltre sviluppato un metodo di PCR per la differenziazione di ceppi neuropatogeni e non-neuropatogeni di EHV-1. (Malik et al. 2010).
La diagnosi diretta è possibile anche tramite LAMP (Loop-Mediated Isothermal Amplification) su tamponi nasali. (Nemoto et al. 2011).
Profilassi
La profilassi sanitaria prevede la limitazione delle dimensioni dei branchi di puledri in svezzamento per evitare la diffusione del virus.
Per quanto riguarda la profilassi vaccinale esistono vaccini costituiti da virus attenuato o inattivato.
È raccomandata la vaccinazione dei puledri per EHV1 e EHV4 all’età di 180, 210 e 330 giorni. I meccanismi di protezione immunitaria consistono probabilmente in generazione di anticorpi locali, anticorpi sierici e in produzione di cellule della memoria. La risposta immunitaria dopo la
vaccinazione è di breve durata. (Barr, 2003). Anche se la vaccinazione non previene l’infezione, riduce comunque la gravità dei segni clinici. (Ainsworth e Hackett, 2004).
2.1.2. Eziologia batterica (Sellon e Long, 2007)
I batteri più frequentemente coinvolti nelle patologie polmonari del puledro sono:
- Streptococcus equi var. equi e var. zooepidemicus
2.1.2.1. Streptococcus equi var. equi
Gram-positivo, di forma coccoide, beta-emolitico, responsabile di una malattia infettiva contagiosa, acuta, a diffusione universale, conosciuta come adenite equina, che colpisce puledri e cavalli adulti, caratterizzata da processi infiammatori catarrali a carico delle prime vie respiratorie e da fenomeni suppurativi dei linfonodi.
Epidemiologia
Isolato soltanto dagli equidi, vive allo stato saprofitico sulla mucosa del faringe e del tratto superiore dell’apparato respiratorio. Si trova nell’ambiente (suolo, lettiera, foraggi). La trasmissione avviene per contatto diretto, per inalazione o per ingestione di acqua o alimenti contaminati.
Patogenesi
Il periodo di incubazione varia da 3 a 14 giorni. Il batterio aderisce alle cellule epiteliali della mucosa nasale e buccale, penetra nella mucosa e, attraverso il circolo linfatico, arriva ai linfonodi retrofaringei e sottomascellari. L'acido ialuronico presente nella capsula batterica impedisce la fagocitosi del batterio stesso che è in grado quindi di moltiplicarsi nei tessuti e provocare suppurazione.
Segni clinici
La malattia si manifesta solitamente in forma acuta nei puledri con febbre (40-41,5°C), depressione, anoressia, scolo nasale sieroso che diventa presto purulento, pelo irto e poco lucente, ingrossamento dei linfonodi sottomandibolari e retrofaringei. L’aumento di volume di questi linfonodi può causare difficoltà respiratoria per compressione della trachea e/o del laringe, oltre a emiplegia laringea per la pressione esercitata sul nervo laringeo ricorrente dall’ascessualizzazione del linfonodo cervicale anteriore. La rottura degli ascessi retrofaringei può portare a empiema delle tasche gutturali. Il drenaggio di questi ascessi o delle tasche gutturali contribuisce a disseminare il batterio con conseguente localizzazione polmonare o batteriemia che porta spesso a morte i puledri di età inferiore ai 3 mesi (oltre il 30%).
La fistolizzazione degli ascessi avviene 1-2 settimane dopo la comparsa dei primi sintomi e la maggior parte dei soggetti guarisce in seguito al drenaggio del materiale purulento.
Una broncopolmonite può derivare dall’aspirazione del pus o dalla diffusione metastatica del microrganismo ai polmoni.
Nei soggetti adulti la malattia assume spesso andamento cronico. Questi possono presentare emiparesi laringea come conseguenza degli ascessi linfonodali cervicali, ed empiema delle tasche gutturali.
Diagnosi
I sintomi clinici e l’elevata morbilità della malattia sono elementi sufficienti a orientare la diagnosi, ma la conferma si ha solo dopo isolamento e identificazione del microrganismo dallo scolo nasale e/o dal materiale purulento.
Indagini non specifiche quali l'esame emocromocitometrico rivelano una leucocitosi neutrofilia marcata, inoltre si può avere un aumento del fibrinogeno.
La valutazione endoscopica delle alte vie respiratorie può aiutare nel costatare l’ingrossamento dei linfonodi e consente anche un lavaggio delle tasche gutturali.
Le diagnosi differenziali che vanno prese in considerazioni comprendono le faringiti virali, le infezioni da Corynebacterium equi e da Rhinovirus spp. La diagnosi eziologica viene eseguita mediante coltura batterica di materiale prelevato dagli ascessi (Sweeney, 1996).
L’associazione di diversi esami diagnostici quali endoscopia, citologia, batteriologia e PCR eseguiti sullo scolo nasale e sul materiale purulento prelevato dalle tasche gutturali rappresenta un buon metodo per fare diagnosi di infezione da S. equi. (Laus et al. 2007).
2.1.2.2. Streptococcus equi var. zooepidemicus (Scatozza e Farina, 1998;
Barr, 2003; Sellon e Long, 2007)
La sottospecie zooepidemicus è la più comune causa di malattia delle basse vie respiratorie nei puledri. Questo microrganismo è implicato in forme di broncopolmoniti, pleuriti e pleuropolmoniti in soggetti di tutte le età. Nel puledro penetra attraverso il cordone ombelicale dove provoca un processo infiammatorio e può poi guadagnare il torrente circolatorio con conseguente setticemia, spesso letale. Questa forma si manifesta dopo la prima settimana di vita con sintomi quali: febbre, poliartrite, diarrea, meningite, faringite, complicazioni polmonari. I segni clinici dell’infezione delle basse vie respiratorie includono scolo nasale muco-purulento, tosse,
febbre, tachipnea, aumentato sforzo respiratorio e linfadenopatia in assenza di ascessi. La mancanza di processi purulenti nei linfonodi sottomandibolari rappresenta un elemento diagnostico differenziale rispetto all’adenite equina. L’auscultazione del torace rivela dei rumori respiratori che vanno da crepitii diffusi e sibili per diminuire nella parte ventrale del polmone fino all’assenza di suoni. Poiché S. zooepidemicus non è in grado di penetrare le membrane delle mucose intatte, è necessario un preesistente danno per l’infezione: infezioni virali, stress ambientali come il sovraffollamento, la scarsa alimentazione, il trasporto, lo svezzamento, possono portare alla compromissione del normale meccanismo di difesa delle vie respiratorie e consentire la malattia.
In uno studio condotto da Hoffman et al. S. equi zooepidemicus fu isolato nell’87% dei casi di infezioni non complicate delle basse vie respiratorie. Nel 44% di questi casi fu isolato insieme ad altre specie batteriche. (Hoffman et al. 1993). In un altro studio è stato individuato come l’agente eziologico più comune in casi di ascessi polmonari nei puledri e risulta frequente tanto quanto R. equi. (Lavoie et al., 1994).
Gli esami ematologici generalmente rivelano una leucocitosi neutrofilica e iperfibrinogenemia. La radiografia toracica è importante per determinare il grado di coinvolgimento polmonare e la presenza o meno di ascessi. L’ecografia è utile per identificare la presenza di versamento pleurico o ascessi nel parenchima polmonare periferico. La colorazione di Gram del materiale ottenuto tramite aspirato trans-tracheale rivela la presenza di cocchi Gram + e può aiutare nello stabilire una presumibile diagnosi di infezione da S. zooepidemicus. La coltura batterica permette una diagnosi definitiva e, con l’antibiogramma, di stabilire un trattamento adeguato.
2.1.2.3. Rhodococcus equi
Uno degli agenti eziologici più diffusi come causa di polmonite nei puledri al di sotto dei 4 mesi è il Rhodococcus equi, batterio aerofilo ed intracellulare. La Rodococcosi è una patologia importante nel contesto di gestione di allevamento, sia per l'impatto economico (terapie, ritardo di accrescimento, igiene) che per l'elevata mortalità (Takai et al., 1995).
Anche se probabilmente in tutti gli allevamenti equini è presente il R. equi, la malattia non si presenta in tutti i puledri. Questo sembra essere dovuto alla risposta immunitaria diversa tra soggetti.
L'incidenza annuale della malattia è legata anche alle condizioni ambientali, quali temperatura, polvere, Ph del terreno, alla gestione dell’allevamento (sovraffollamento, poca aerazione dei boxes) e alla virulenza dei ceppi patogeni (Takai et al., 1991).
Eziologia
Fino a qualche anno denominato Corynebacterium equi, segnalato per la prima volta nel 1923 da Magnusson in puledri con puledri con polmonite. Il Rhodococcus equi è un batterio coccoide, asporigeno, non emolitico, Gram-positivo, aerobio obbligatorio e intracellulare che si moltiplica all’interno dei macrofagi e inibisce la fusione fagosomi-lisosomi. Ha diffusione mondiale ed è endemico in alcuni allevamenti. (Codazza et al., 2007).
Non tutti i ceppi di R. equi sono patogeni in quanto la loro virulenza è legata alla presenza del plasmide Vap A (virulence associated protein).
Epidemiologia ed ecologia
E’ un germe ubiquitario, acido-resistente e Ziel-Nilsen positivo si trova soprattutto nel terreno dove è in grado di moltiplicarsi nei primi 30 cm di profondità poiché è aerobio obbligato. Lo sviluppo ottimale è in terreni ricchi di feci equine che contengono i substrati ed hanno il Ph ideale per la crescita del batterio.
I principali responsabili della contaminazione ambientale sono i cavalli dove il germe si replica nel piccolo intestino, ambiente aerobio, e viene eliminato con le feci. I soggetti adulti che i puledri eliminano il R. equi con le feci, ma i puledri sono i maggiori responsabili della contaminazione ambientale. Infatti, mentre i soggetti adulti eliminano da 100 a 1000 CFU/gr di batteri con una presenza del ceppo virulento inferiore al 10%, i puledri ne eliminano una concentrazione nettamente superiore, pari a 1000-10000 CFU/gr con un 10-40% di ceppo virulento. In puledri con polmonite conclamata la concentrazione può salire fino a 108 CFU/gr con l’80% di ceppo virulento (Muscatello et al., 2007).
Patogenesi (Sellon e Long, 2007)
La malattia si manifesta soprattutto nei puledri e molto più raramente negli adulti. I puledri si infettano nei primi giorni di vita tramite inalazione del R.
equi eliminato con le feci dalla fattrice. Non tutti i soggetti svilupperanno la
malattia e questo dipende dalla carica batterica inalata, dal decremento della concentrazione di immunoglobuline materne soprattutto in puledri di 3-4 mesi.
L'infezione è limitata alla linea monociti/macrofagi e la patogenicità dell'organismo è legata alla sua abilità a replicarsi all'interno di queste cellule ed eventualmente a distruggerle. La virulenza del batterio è legata
membrana dei macrofagi, viene fagocitato formando un fagosoma intracellulare. Il meccanismo di captazione e fagocitosi del batterio non sembra essere influenzato dalla presenza del plasmide Vap A. Infatti, sia i ceppi virulenti che non, vengono fagocitati dai magrofagi con il medesimo meccanismo. Il fagosoma si fonde con i lisosomi andando a formare il fagolisosoma dove i ceppi virulenti continuano a moltiplicarsi evitando di essere distrutti dagli enzimi lisosomiali del macrofago. Sembra che la capacità di resistenza dei ceppi virulenti sia legata al Ph all'interno del fagolisosoma stesso. La replicazione all'interno dei macrofagi provoca la morte delle cellule ospiti. Cellule della linea monocitaria-macrofagica continuano a migrare nel sito di infezione e vengono esse stesse distrutte, andando cos' a formare dei granulomi.
Sintomatologia (Giguère, 2001; Sellon e Long, 2007)
La sintomatologia si manifesta in puledri di età compresa tra settimane e 6 mesi, di solito con incidenza massima pria dei 4 mesi di età.
Il tratto respiratorio è il più colpito, seguito da una forma enterica e polisinovite.
In alcuni casi è possibile che l'infezione rimanga in forma sub-clinica. Nel caso in cui si manifesti la malattia, la lenta diffusione dell’infezione e la capacità di compensazione dei puledri rende difficile una diagnosi clinica precoce. Il leggero aumento del ritmo respiratorio può passare inosservato alla visita clinica per una tachipnea fisiologica dovuta alle manipolazioni. Nel momento in cui la polmonite progredisce sopraggiungono letargia, dispnea, riduzione dell’appetito. Una minore percentuale di puledri infetti può presentare una forma iperacuta-acuta della malattia con effetti più gravi. Questi puledri possono morire senza presentare segni clinici oppure
presentare una sintomatologia respiratoria acuta a decorso veloce e con prognosi infausta nonostante un’adeguata terapia.
L'infezione da R. equi può presentarsi anche con localizzazione extrapolmonari. In uno studio retrospettivo su 131 casi di Rodococcosi sono riportate lesioni intestinali nel 50% dei puledri con polmonite sottoposti ad autopsia, mentre solo nel 4% dei soggetti la localizzazione primaria era intestinale in assenza di polmonite (Zink et al., 1986).
La forma intestinale è una enterocolite multifocale ulcerativa e tiflite con localizzazione del batterio nelle placche di Peyer e formazione di piogranulomi nei linfonodi mesenterici e/o del colon. Occasionalmente, si può formare un singolo grosso ascesso addominale. La sintomatologia caratteristica del quadro addominale è la perdita di peso, anoressia, perdita di peso, coliche, diarrea.
L'ostruzione dei vasi linfatici associata a un aumento della concentrazione delle proteine nel fluido peritoneale e ipoproteinemia può causare ascite dando l’aspetto di un addome gonfio. Questi puledri hanno una prognosi infausta a causa di una grave infiammazione granulomatosa della mucosa e sottomucosa del colon e dei noduli linfatici mesenterici.
La deposizione di immunocomplessi all’interno delle strutture sinoviali può provocare sinoviti approssimativamente in un terzo dei casi. Le articolazioni più frequentemente colpite sono la grassella e la tibio-tarsica, raramente si presenta una polisinovite. Nella maggior parte dei dei soggetti con interessamento articolare, la zoppia non è evidente o si limita ad un’andatura rigida.
L’esame citologico del fluido sinoviale solitamente rivela una leucocitosi mononucleare non settica e la coltura batteriologica risulta negativa.
Una terapia intrarticolare non è indicata dato che il versamento solitamente si risolve senza evidenti conseguenze, è necessario però risolvere l’infezione primaria.
La deposizione di immunocomplessi può provocare anche uveite, anemia e trombocitopenia.
L'infezione nell'adulto è rara perchè di solito risulta immune all'infezione, comunque sono stati riportati casi sporadici. Come nei puledri, anche negli adulti la forma più frequente è la polmonite suppurativa con o senza pleurite. Segni clinici segnalati sono anche malattia intestinale, linfadenite e osteomielite.
Anatomo-patologia (Sellon e Long, 2007)
I segni anatomopatologi tipici della forma polmonare equivalgono a una broncopolmonite a focolai multipli, con interessamento soprattutto delle porzioni anteriori del polmone. Istologicamente si nota una notevole infiltrazione di macrofagi e cellule giganti negli alveoli, con focolai di necrosi alveolare. Tali fenomeni sono espressione di una iniziale reazione di tipo granulomatoso, alla quale segue una massiva migrazione di neutrofili, che conferisce alle lesioni il caratteristico aspetto purulento.
Immunità (Giguère, 2000; Sellon e Long, 2007)
Sebbene la progressione e la gravità dell'infezione dipenda dalla dose e dalla virulenza del batterio inalato, anche il sistema immunitario dell'ospite gioca un ruolo fondamentale.
Tutti i puledri vengono esposti al R. equi nel periodo perinatale, ma pochi manifestano in seguito la malattia. Gli adulti poi sono pressochè resistenti a questo batterio.
Poiché il R. equi è un patogeno intracellulare facoltativo, è stata ipotizzata una maggiore influenza del sistema cellulo-mediato rispetto all'umorale. L'inattivazione del batterio viene esplicata da macrofagi attivati, mentre gli inattivati sono la sede di replicazione del patogeno. Anche i neutrofili giocano un ruolo importante nel controllo dell'infezione da R. equi. Studi effettuati sui topi, infatti, hanno evidenziato una gravità maggiore della malattia e un incremento nella concentrazione tissutale del batterio in topi privati dei neutrofili. Inoltre, i linfociti T funzionali sono assolutamente necessari per la clearance di R. equi virulento nei topi.
L’età di sviluppo dell’infezione da R. equi nei puledri coincide con e può in parte essere riferita al declino degli anticorpi materni. Comunque l’evidenza maggiore del ruolo dell’anticorpo nella protezione contro R.
equi è l’effetto protettivo del plasma equino iperimmune anti-R. equi
trasferito passivamente.
Diagnosi clinica (Giguère e Prescott, 1997; Giguere et al., 2003; Rush e
Mair, 2004)
E’ importante eseguire una diagnosi precoce dell’infezione basandosi su segni clinici e anamnesi, in particolare se la storia dell’allevamento rivela casi pregressi di polmonite da R. equi, e confermando poi la diagnosi con ulteriori esami specifici. La precocità della diagnosi incide notevolmente sull’efficacia terapeutica, oltre che ridurre la diffusione ambientale del microrganismo.
Gli esami di laboratorio come l’emogramma e la chimica liquida denotano un quadro di alterazione non specifica riconducibile a infezione e infiammazione. Uno studio condotto su puledri sintomatici, però, ha fornito dei valori di screening per quanto riguarda i globuli bianchi e il
concentrazione dei globuli bianchi e e del fibrinogeno è risultata statisticamente superiore al valore ottenuto in soggetti con patologia polmonare non da rodococcosi. La gravità della leucocitosi neutrofilica e dell’iperfibrinogenemia appaiono correlati con la prognosi. La trombocitosi (piastrine >250000/ul) è un rilievo comune in puledri affetti da R. equi. L’ecografia può identificare consolidamenti e ascessi periferici polmonari, ma non può individuare lesioni parenchimali più profonde. L'esame ultrasonografico delle pleure e dei polmoni può essere utilizzato sicuramente nella valutazione dell'andamento della terapia, dovrebbe essere invece associato all'esame radiografico nell'iter diagnostico per la visualizzazione di ascessi profondi (Ramirez et al., 2004).
Terapia
In vitro R. equi appare sensibile ad un ampio spettro di antibiotici. Tuttavia all’interno dell’ospite il batterio ha sede intracellulare con una inefficacia di molti antibiotici.
La combinazione di eritromicina e rifampicina ha notevolmente migliorato la sopravvivenza dei puledri affetti da polmonite data da R. equi tanto da diventare il trattamento di scelta. Altre associazioni utilizzato sono: 1) claritromicina e rifampicina; 2) azitromicina e rifampicina; 3) eritromicina e azitromicina. Ad oggi l'associazione migliore sembra essere la claritromicina e rifampicina (Giguere et al., 2004).
Tutti questi antibiotici sono macrolidi liposolubili, quindi in grado di penetrare le cellule macrofagiche. Effetti collaterali sono l'ipertermia, la diarrea ed epatopatie transitorie (eritromicina).
Condizioni necessarie per migliorare lo stato dei puledri affetti sono un ambiente pulito e confortevole, e cibo appetibile e privo di polvere. Terapie di supporto sono costituite da fluidoterapia e somministrazione di farmaci