Capitolo 3
Studio retrospettivo del ruolo di B-RAF e di
amphiregulin nel trattamento del paziente con
cetuximab ed irinotecano
3.1 INTRODUZIONE
Amphiregulin (AR) è uno dei ligandi endogeni di EGFR e risulta iperespressa in diverse patologie neoplastiche tra cui il CRC. È infatti presente sulla membrana basolaterale delle cellule di CRC ed è coinvolta nella stimolazione della proliferazione cellulare. Studi in vitro hanno evidenziato come anticorpi diretti contro AR riducano significativamente la replicazione del DNA, mentre l’aggiunta di AR esogena incrementi il tasso di crescita cellulare157,158. Come altri ligandi di EGFR, ad esempio TGF-α, AR viene sintetizzata in forma di precursore e successivamente clivata, grazie all’azione di specifiche metalloproteasi (TACE/ADAM-17), per raggiungere il circolo sanguigno. Agisce pertanto sia a livello tissutale, per via autocrina, iuxtacrina e paracrina, che a livello sistemico attraverso la quota liberata in circolo. L’enzima TACE è iperespresso nei CRC rispetto alla mucosa normale e l’intensità della sua immunoreattività appare inversamente proporzionale a quella di AR159.
L’implicazione prognostica/predittiva dei livelli di espressione dei ligandi di EGFR, in relazione al trattamento con cetuximab, è stata valutata per la prima volta nei CRC nell’esperienza retrospettiva di Khambata-Ford e coll. Elevati livelli d’espressione dei geni codificanti AR ed epiregulin (ER), misurati in termini di m-RNA specifici espressi a livello tissutale nelle lesioni secondarie epatiche, sono risultati correlati a migliori tassi di controllo di malattia in una serie di 110 pazienti con mCRC, trattati con cetuximab in monoterapia (p=0.000015 e p=0.000025, rispettivamente per ER ed AR). Pazienti con alti livelli di espressione di AR ed ER hanno presentato inoltre una migliore PFS rispetto ai pazienti con bassi livelli di espressione (AR: PFS mediana: 115.5 vs 57.0 giorni; HR=0.44; p<0.0001; ER: PFS mediana: 103.5 vs 57.0 giorni; HR=0.47; p=0.0002)160.
Tali risultati sono stati successivamente confermati nella casistica di Tejpar e coll.161, comprendente 95 pazienti con mCRC trattati con cetuximab ed irinotecano. Elevati
livelli d’espressione dell’m-RNA specifico di AR, estratto da campioni paraffinati di tumori primitivi, sono risultati associati ad un migliore outcome in termini di OS (OS mediana: 43 settimane nei pazienti AR high vs 22.9 settimane negli AR low; p=0.008). Anche tra i pazienti con tumori K-RAS WT, la maggiore espressione di AR si è rivelata associata a miglior OS (OS mediana: 49.4 nei pazienti AR high vs 30.6 settimane negli AR low; p=0.01). Nessuna differenza in OS è stata invece riscontrata tra i pazienti K-RAS MUT rispetto ai livelli d’espressione di AR (OS mediana: 15.8 settimane sia nei pazienti AR high che negli AR low; p=0.405). I dati riportati per ER sono apparsi del tutto sovrapponibili a quelli di AR. Inoltre, i tumori K-RAS WT hanno mostrato livelli significativamente più alti di AR ed ER, rispetto a quelli
K-RAS mutati (χ2; AR: p<0.0001; ER: p=0.036).
Più recentemente, dati analoghi sono emersi dalla casistica di 220 pazienti con mCRC, refrattari ai trattamenti chemioterapici convenzionali e trattati con cetuximab, presentata da Prenen e coll.162. Tra i pazienti K-RAS WT, l’espressione dei ligandi AR ed ER è apparsa significativamente correlata al tasso di risposte obiettive (AR-high vs AR-low: Odds Ratio for Response=1.82, p=0.0017; ER-high vs ER-low: Odds Ratio for Response=1.90, p=0.0005), alla PFS (AR: HR=0.60; ER: HR=0.41, p<0.001); ed alla OS (AR: HR=0.65, p<0.001; ER: HR=0.42, p<0.001). L’analisi post-hoc dei risultati dello studio di fase III CO.17 (Cetuximab vs BSC in terza linea di trattamento)163 alla luce della determinazione quantitativa dell’espressione del gene codificante ER, ha messo in evidenza come nel sottogruppo di pazienti K-RAS WT, solo coloro che esprimono alti livelli di ER (HR=0.43; p<0.0001) ottengono una migliore OS nel braccio trattato con cetuximab rispetto a quello di BSC. Nessuna differenza statisticamente significativa si è riscontrata nei pazienti con bassi livelli di ER (HR=0.77; p=0.28). Tuttavia, il test di interazione non ha evidenziato un vantaggio statisticamente significativo legato al trattamento con anti-EGFR nel gruppo ad elevata espressione di ER (p=0.13).
Pertanto, il ruolo dei ligandi endogeni, ed in particolare di AR, quali potenziali marker di efficacia del trattamento con anti-EGFR, è ad oggi tutt’altro che definito. Inoltre, se da una parte è accertato il potere predittivo negativo delle mutazioni dei codoni 12 e 13 di K-RAS e dall’altra è fortemente suggerito il ruolo prognostico/predittivo della mutazione V600E di B-RAF (vedi paragrafo: 2.2c La via
cui almeno la metà dei pazienti K-RAS e B-RAF WT non tragga alcun beneficio dalla somministrazione degli anti-EGFR.
Partendo da queste premesse, il nostro studio ha retrospettivamente valutato lo stato mutazionale di K-RAS, di B-RAF ed i livelli di espressione immunoistochimica di AR, in una coorte di pazienti con mCRC irinotecano-refrattario, trattati con cetuximab ed irinotecano. Nell’analisi dei risultati, l’attenzione è stata focalizzata sul gruppo di pazienti con tumore K-RAS WT (“sottogruppo K-RAS WT”), allo scopo di confermare il valore predittivo dello stato mutazionale di B-RAF e di stabilire l’esistenza o meno di un ruolo predittivo e/o prognostico dei livelli di espressione immunoistochimica di AR, nella popolazione di pazienti effettivamente candidati a ricevere un trattamento comprendente anticorpi monoclonali anti-EGFR.
3.2
PAZIENTI E METODI3.2a Selezione dei pazienti e valutazione dei principali parametri di
outcame
I pazienti inclusi nello studio sono stati arruolati presso 4 U.O. di Oncologia Medica del territorio nazionale.
Per la selezione dei pazienti sono stati osservati i seguenti criteri di eleggibilità: • Diagnosi istologica di mCRC
• Pazienti irinotecano-refrattari, trattati con cetuximab ed irinotecano • Positività dell’espressione di EGFR all’immunoistochimica (IHC)
• Malattia misurabile secondo i criteri RECIST (Response Evaluation Criteria In Solid Tumors)
• Disponibilità di un campione paraffinato del tumore primitivo • Consenso informato scritto del paziente
Lo studio è stato approvato dai Comitati Etici Locali.
L’attività del trattamento è stata valutata ogni 8 settimane attraverso l’esecuzione di un esame TC e classificata, in accordo ai criteri RECIST, come risposta completa (RC), risposta parziale (RP), malattia stabile (SD) o malattia in progressione (PD). La sopravvivenza libera da progressione (PFS) è definita come il tempo trascorso tra la prima somministrazione del trattamento e la progressione di malattia o la morte del paziente; la sopravvivenza complessiva (OS) è definita come il tempo trascorso tra la prima somministrazione del trattamento e la morte del paziente.
Le analisi immunoistochimiche e genetiche sono state eseguite da patologi e biologi molecolari non a conoscenza dei dati clinici dei pazienti.
3.2b Analisi mutazionale di K-RAS e di B-RAF
Le analisi dello stato mutazionale di K-RAS e B-RAF sono state effettuate presso il dipartimento di biologia molecolare dell’Università di Pisa.
In ogni campione tumorale è stata ricercata la presenza delle mutazioni attivanti dei codoni 12 e 13 (esone 2) di K-RAS e del codone 600 (esone 15) di B-RAF.
• Amplificazione del DNA tramite PCR (Polymerase Chain Reaction)
Il DNA è stato estratto dal campione tumorale utilizzando il Qiamp DNA tissue Kit (Qiagen, Hilden Germany).
I primer complementari agli estremi 5’ e 3’ dell’esone 2 di K-RAS erano: 5’ - GGCCTGCTGAAAATGACTGAA- 3’ (forward)
5’ - TTCGTCCACAAAATGATTCTGA- 3’ (reverse)
I primer complementari agli estremi 5’ e 3’ dell’esone 15 di B-RAF erano: 5’ - ATGCTTGCTCTGATAGGAA- 3’ (forward)
5’ - GCATCTCAGGGCCAAA - 3’ (reverse)
• Sequenziamento del DNA
I prodotti della PCR sono stati purificati con il MinElute PCR Purification Kit (Qiagen). La stima delle concentrazioni è stata ottenuta dall’ND-1000 Spettrofotometro (NanoDrop Technologies Wilmington, Delaware USA). Per ogni campione tumorale, una quantità di 10-15 ng di prodotto di PCR purificato è stata utilizzata come stampo per il ciclo di sequenziamento con BigDye Terminator v.1.1 CycleSequencing Kit (Applied Biosystems, Foster City, CA).
Per ogni stampo sono state eseguite due reazioni di sequenziamento utilizzando il primer: 5’- TATAAACTTGTGGTAGTTGG - 3’ per le mutazioni di K-RAS
ed il primer: 5’- GGTGATTTTGGTCTAGCTAC - 3’ per le mutazioni di B-RAF. Il prodotto del sequenziamento è stato purificato utilizzando il DyeEx 96 Kit (Qiagen) e fatto correre su ABI PRISM 310 Genetic Analyser (Applied Biosystems). I filamenti senso ed antisenso allineati sono stati analizzati con il Sequence Navigator Software (Applied Biosystem).
3.2c Analisi immunoistochimica di AR
La valutazione immunoistochimica di AR è stata effettuata presso l’istituto di Anatomia Patologica dell’Università Campus Bio-Medico di Roma.
L’analisi è stata realizzata su fettine dello spessore di 3-4 µm, ottenute da blocchetti conservati in paraffina, utilizzando il metodo streptavidina-biotina. È stato impiegato l’anticorpo monoclonale murino diretto contro la proteina AR (Clone 31221, R&D Systems, Inc.). La 3-30-diaminobenzidina è stata utilizzata per lo sviluppo della colorazione mentre l’ematossilina per il contrasto. La reazione di immunocolorazione veniva considerata positiva se il citoplasma della cellula tumorale si colorava di marrone.
Poiché non è disponibile ad oggi un sistema validato per l’interpretazione dell’immunoistochimica di AR, nel nostro studio è stato adottato un indice di score basato sulla valutazione dell’intensità della colorazione (0, assenza di colorazione; 1, colorazione debole; 2, colorazione moderata; 3, colorazione intensa) e della
percentuale delle cellule colorate (0-100%). Il punteggio, ottenuto moltiplicando il valore corrispondente dei due parametri in esame, era pertanto compreso tra 0 e 300.
3.2d Analisi statistica
La distribuzione delle sopravvivenze è stata studiata secondo il metodo delle curve di Kaplan-Meier. Il modello proporzionale di Cox è stato utilizzato per valutare l’associazione dei parametri biologici con la PFS e l’OS in analisi uni- e multivariata. I risultati sono stati espressi come hazard ratios (HR) e relativi intervalli di confidenza al 95% (95%CI).
Un modello di regressione logistica è stato applicato per valutare l’implicazione dello stato dei parametri biologici sulla risposta al trattamento. I risultati ottenuti sono stati espressi come odds ratios (OR) e relativo 95%CI.
L’espressione IHC di AR è stata interpretata come variabile continua ed i risultati sono stati espressi prendendo in considerazione intervalli di 10 unità di score. Il T-test è stato impiegato per la valutazione dell’associazione dei livelli di AR con lo stato mutazionale di K-RAS e B-RAF.
Il Software SAS, versione 9.1 (SAS Institute, Cary, NC), è stato utilizzato per tutte le analisi.
3.
3 RISULTATI3.3a Caratteristiche dei pazienti ed attività del trattamento
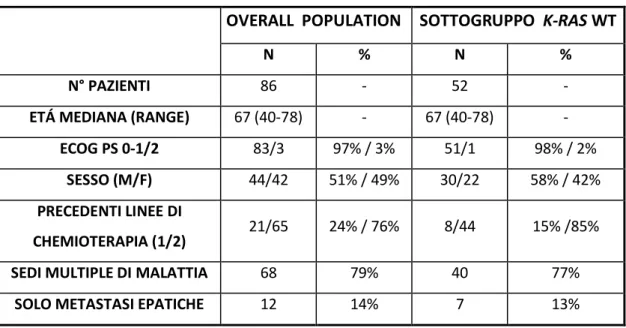
Ottantasei pazienti, 42 maschi (49%) e 44 femmine (51%), le cui caratteristiche sono riassunte nella TABELLA 3.1, sono risultati eleggibili per lo studio. Tutti i pazienti sono stati trattati con cetuximab ed irinotecano secondo il seguente schema:
- Cetuximab: dose iniziale di 400 mg/sqm i.v. g1 seguito da 250 mg/sqm i.v. settimanale o 500 mg/sqm i.v. g1 ogni 2 settimane*
- Irinotecano: 130-180 mg/sqm i.v. g1 ogni 2 settimane* * dosi variabili a discrezione del medico oncologo curante
Ventuno pazienti (24%) hanno ricevuto la terapia contenente cetuximab come seconda linea di trattamento, mentre i restanti 65 (76%) avevano in precedenza già ricevuto almeno 2 linee di chemioterapia.
La quasi totalità della popolazione esaminata presentava buone condizioni generali: 47 pazienti (55%) avevano un ECOG performance status (PS) di 0, 36 pazienti (42%) di 1 e 3 pazienti (3%) di 2.
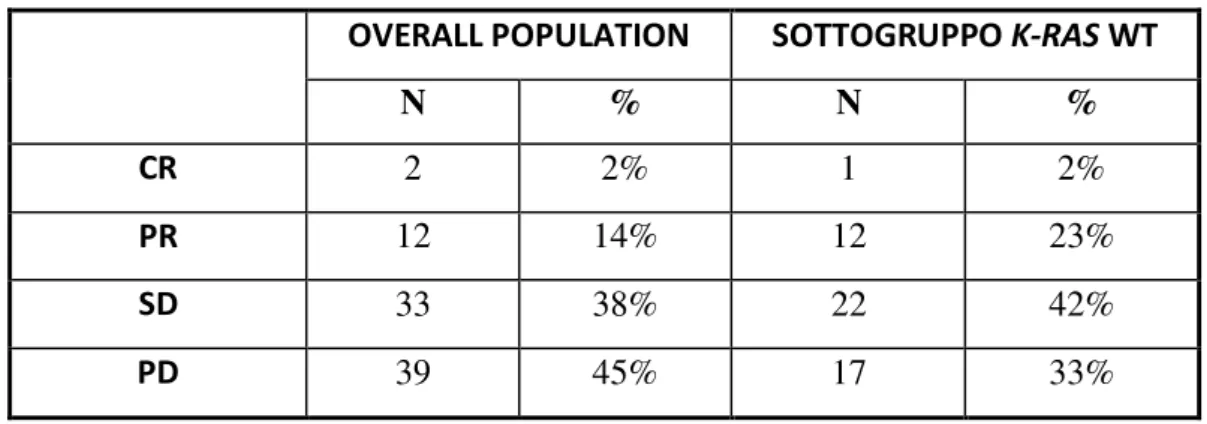
Per quanto riguarda l’attività del trattamento, in 2 pazienti si è registrata una RC ed in 12 una RP, per un complessivo tasso di risposta (RR) del 16%. Trentatre (38%) pazienti hanno ottenuto una SD. (TABELLA 3.2)
Ad un follow up mediano di 23.2 mesi, la PFS mediana della popolazione è risultata di 3.4 mesi mentre la durata mediana dell’OS è stata di 9.6 mesi.
Tabella 3.1 Caratteristiche dei pazienti
OVERALL POPULATION SOTTOGRUPPO K-RAS WT
N % N %
N° PAZIENTI 86 - 52 -
ETÁ MEDIANA (RANGE) 67 (40-78) - 67 (40-78) -
ECOG PS 0-1/2 83/3 97% / 3% 51/1 98% / 2%
SESSO (M/F) 44/42 51% / 49% 30/22 58% / 42%
PRECEDENTI LINEE DI
CHEMIOTERAPIA (1/2) 21/65 24% / 76% 8/44 15% /85% SEDI MULTIPLE DI MALATTIA 68 79% 40 77%
Tabella 3.2 Attività del trattamento
OVERALL POPULATION SOTTOGRUPPO K-RAS WT
N % N %
CR 2 2% 1 2%
PR 12 14% 12 23%
SD 33 38% 22 42%
PD 39 45% 17 33%
3.3b Analisi dello stato mutazionale di K-RAS e B-RAF
La valutazione dello stato mutazionale di K-RAS è stata effettuata su 85 degli 86 pazienti della popolazione complessiva. In 52 casi (61%) K-RAS è risultato WT, mentre in 33 (39%) MUT. I pazienti K-RAS WT, rispetto a quelli K-RAS MUT hanno mostrato un più elevato RR (13/52, 25% vs 1/34, 3%; OR=10.6; 95%CI: 1.32-85.91, p=0.026) e migliori PFS (HR=1.87; 95%CI: 1.17-2.97; p=0.009) ed OS (HR=1.95; 95%CI: 1.20-3.18; p=0.007).
La valutazione dello stato mutazionale di B-RAF è stata possibile in 83 pazienti degli 86 inclusi. In 72 casi (84%) B-RAF è risultato WT, mentre in 11 (13%) MUT.
In un solo campione tumorale sono state riscontrate entrambe le mutazioni.
Nel sottogruppo K-RAS WT, i pazienti B-RAF WT hanno presentato un tasso di risposte superiore (RR: 12/42, 29% vs 1/10, 10%; OR=3.86; 95%CI: 0.44-33.88; p=0.224) e sopravvivenze significativamente più lunghe (PFS mediana: 4.4 vs 3.3 mesi; HR=2.33; 95%CI: 1.12-4.84; p=0.023; OS mediana: 13 vs 6.0 mesi, HR=3.51 95%CI: 1.55-7.98; p=0.003), rispetto ai B-RAF WT. (TABELLA 3.3 e FIGURE 3.1 e 3.2).
Tabella 3.3 Attività del trattamento nel sottogruppo K-RAS WT, rispetto allo stato mutazionale di B-RAF (52 pazienti di cui 2 non valutabili per B-RAF).
B-RAF WT (N=40) B-RAF MUT (N=10)
RESPONDERS 12 (30%) 1 (10%)
Figura 3.1 Sottogruppo K-RAS WT. Rappresentazione grafica della PFS nei pazienti B-RAF WT e B-RAF MUT.
Figura 3.2 Sottogruppo K-RAS WT. Rappresentazione grafica della OS nei pazienti B-RAF WT e B-RAF MUT.
Nel sottogruppo di 40 pazienti (47%) K-RAS e B-RAF WT, il tasso di risposte è risultato significativamente più alto (RR: 12/40, 30% vs 2/46, 4%; OR=8.786; 95%CI: 1.82-42.32; p=0.007) rispetto a tutti gli altri pazienti, così come si sono registrate più lunghe PFS (HR=2.15; 95%CI: 1.35-3.41; p=0.001) ed OS (HR=2.65; 95%CI: 1.60-4.41; p<0.0001).
BRAF mut (N=10) Median PFS : 3.3 mesi
BRAF wt (N=40) Median PFS : 4.4 mesi
Logrank Test: p=0.023 HR=2.33 95%CI: 1.12-4.84
BRAF mut (N=10) Median OS: 6.0 mesi
BRAF wt (N=40) Median OS: 13.0 mesi
Logrank Test: p=0.003 HR=3.51 95%CI: 1.55-7.98
3.3c Analisi dell’espressione IHC di AR
L’immunocolorazione specifica per AR è stata osservata nel citoplasma cellulare di 57 tumori su 86 studiati. I punteggi calcolati in relazione al sistema di scoring precedentemente descritto sono risultati compresi nel range 0-290, con un punteggio mediano di 30. In 51 casi su 86 (59.3%) il campione è stato rappresentativo anche della mucosa colica normale adiacente al carcinoma, dove nel 13.7% dei casi (7/51) si è riscontrato un debole livello di espressione della proteina.
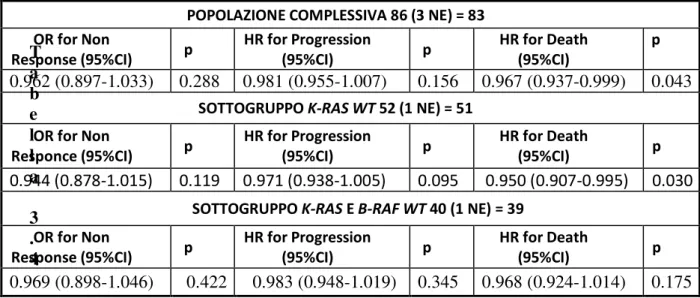
Nella popolazione complessiva, i pazienti con più alti livelli di espressione di AR hanno mostrato un miglior RR (OR=0.962; 95%CI: 0.897-1.033; p=0.288) ed una più lunga PFS (HR=0.981; 95%CI: 0.955-1.007; p=0.156), sebbene il vantaggio non sia risultato statisticamente significativo. L’OS è risultata invece significativamente più lunga (HR=0.97; 95%CI: 0.937-0.999; p=0.043).
Allo stesso modo, nel sottogruppo K-RAS WT, i pazienti con maggiori livelli di espressione di AR hanno mostrato un tasso di risposte più elevato (OR=0.944; 95%CI: 0.878-1.015; p=0.119), PFS più lunga (HR=0.971; 95%CI: 0.938-1.005; p=0.095) ed un significativo allungamento dell’OS (HR=0.95; 95%CI: 0.907-0.995; p=0.030).
Nel sottogruppo dei 40 pazienti (47%) K-RAS e B-RAF WT, i livelli di espressione di AR non sono risultati predittivi né in termini di RR (OR=0.969; 95%CI: 0.898-1.046; p=0.422) né di PFS (HR=0.983; 95%CI: 0.948-1.019; p=0.345) nè di OS (HR=0.96; 95%CI: 0.924-1.014; p=0.175).
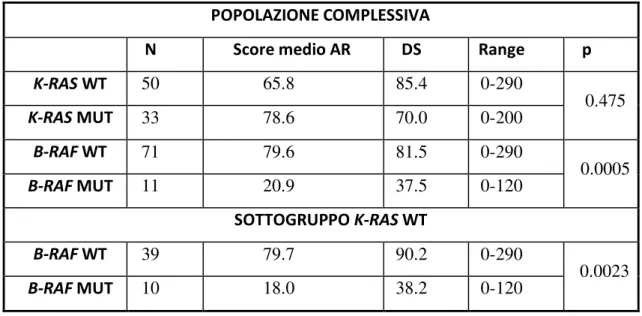
Non si è evidenziata alcuna associazione tra i livelli d’espressione di AR e lo stato mutazionale di RAS (score medio in RAS WT: 66, [SD: 85]; score medio in
K-RAS MUT: 79, [SD: 70]; T-test=0.72; p=0.475). (TABELLA 3.4)
Tabella 3.4 Correlazione tra i livelli di espressione immunoistochimica di AR e lo stato mutazionale di K-RAS e di B-RAF.
T a b e l l a 3 . 4
POPOLAZIONE COMPLESSIVA 86 (3 NE) = 83 OR for Non Response (95%CI) p HR for Progression (95%CI) p HR for Death (95%CI) p 0.962 (0.897-1.033) 0.288 0.981 (0.955-1.007) 0.156 0.967 (0.937-0.999) 0.043
SOTTOGRUPPO K-RAS WT 52 (1 NE) = 51 OR for Non Responce (95%CI) p HR for Progression (95%CI) p HR for Death (95%CI) p 0.944 (0.878-1.015) 0.119 0.971 (0.938-1.005) 0.095 0.950 (0.907-0.995) 0.030
SOTTOGRUPPO K-RAS E B-RAF WT 40 (1 NE) = 39 OR for Non Response (95%CI) p HR for Progression (95%CI) p HR for Death (95%CI) p 0.969 (0.898-1.046) 0.422 0.983 (0.948-1.019) 0.345 0.968 (0.924-1.014) 0.175
D’altra parte, i tumori B-RAF MUT hanno espresso livelli di AR più bassi rispetto a quelli dei tumori B-RAF WT (score medio in B-RAF MUT: 21, [SD: 38]; score medio in B-RAF WT: 80, [SD: 82]; T-test=3.94; p=0.0005). Risultati analoghi si sono riscontrati nel sottogruppo K-RAS WT: nei tumori K-RAS WT e B-RAF MUT i livelli di espressione di AR sono risultati più bassi rispetto a quelli dei tumori K-RAS e B-RAF WT (score medio in K-RAS WT/B-RAF MUT: 18, [SD: 38]; score medio in
K-RAS WT/B-RAF WT: 80, [SD: 90]; T-test=3.28; p=0.0023) (TABELLA 3.5).
Tabella 3.5 Correlazione tra i livelli di espressione di AR e lo stato mutazionale di K-RAS e di B-RAF
POPOLAZIONE COMPLESSIVA
N Score medio AR DS Range p
K-RAS WT 50 65.8 85.4 0-290 0.475 K-RAS MUT 33 78.6 70.0 0-200 B-RAF WT 71 79.6 81.5 0-290 0.0005 B-RAF MUT 11 20.9 37.5 0-120 SOTTOGRUPPO K-RAS WT B-RAF WT 39 79.7 90.2 0-290 0.0023 B-RAF MUT 10 18.0 38.2 0-120
3.3d Analisi multivariata
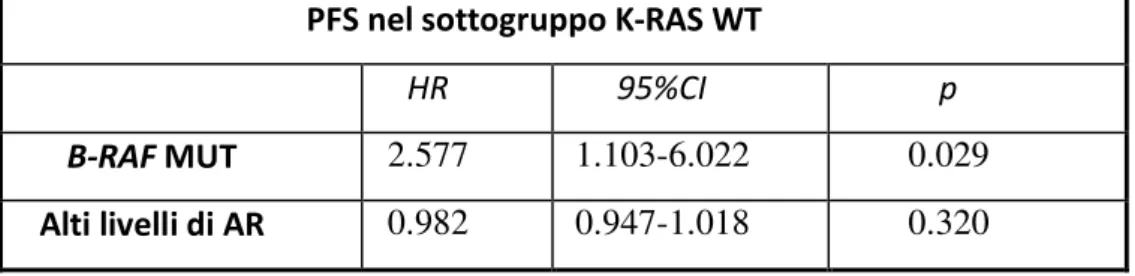
All’analisi multivariata, realizzata nel sottogruppo K-RAS WT e comprendente sia lo stato mutazionale di B-RAF che i livelli di espressione di AR come covariate, si è confermato il valore prognostico di B-RAF sia in termini di PFS (HR=2.58; 95%CI: 1.10-6.02; p=0.029) che di OS (HR=3.47; 95% CI: 1.42-8.51; p=0.007). I livelli di espressione di AR non hanno influenzato, invece, né la PFS (HR=0.982; 95% CI: 0.947-1.018; p=0.320) né l’OS (HR=0.968; 95%CI: 0.924-1.014; p=0.170). (TABELLE 3.6 e 3.7)
Tabella 3.6 Risultati in termini di PFS all’analisi multivariata
PFS nel sottogruppo K-RAS WT
HR 95%CI p
B-RAF MUT 2.577 1.103-6.022 0.029
Alti livelli di AR 0.982 0.947-1.018 0.320
Tabella 3.7 Risultati in termini di OS all’analisi multivariata
OS nel sottogruppo K-RAS WT
HR 95%CI p
B-RAF MUT 3.472 1.417-8.506 0.007
Alti livelli di AR 0.968 0.924-1.014 0.170
3.
4 CONCLUSIONIIl ruolo delle mutazioni di K-RAS, quali fattori predittivi di resistenza agli anticorpi anti-EGFR, si è progressivamente affermato sulla base dei risultati di numerose casistiche retrospettive e delle analisi post-hoc dei principali studi di fase III randomizzati, fino ad entrare a far parte della pratica clinica quotidiana. D’altra parte, nonostante i promettenti risultati dell’esperienza retrospettiva di Di Nicolantonio e coll., suggestivi di un analogo impatto delle mutazioni di B-RAF, e la successiva conferma in uno studio retrospettivo condotto dal nostro centro, le evidenze relative all’effettiva implicazione predittiva di tale alterazione genetica, restano ad oggi meno conclusive.
Nella presente casistica, le mutazioni di B-RAF si associano ad un outcome significativamente peggiore sia in termini di PFS che di OS. Sebbene non si osservi una differenza significativa tra il tasso di risposte nei pazienti con tumori B-RAF WT e MUT, tale conclusione sembrerebbe viziata dalle ridotte dimensioni del campione analizzato. La relativa bassa frequenza di tale alterazione genetica nei tumori colorettali rende piuttosto difficile trarre conclusioni assolute anche sulla base dell’analisi post-hoc dei ben più ampi studi di fase III. Nello stesso trial CRYSTAL164, che pure ha riscontrato una migliore attività ed efficacia del trattamento con FOLFIRI + cetuximab tra i pazienti con malattia K-RAS e B-RAF WT, ma non tra quelli K-RAS WT e B-RAF MUT, la bassa incidenza di mutazioni di
B-RAF (28/348, 8% dei tumori K-RAS WT) impone una doverosa cautela
nell’interpretazione dei risultati. Ad oggi, pertanto, il potere predittivo negativo delle mutazioni di B-RAF è fortemente suggerito dalle evidenze raccolte143,165, mentre ne è ormai accertato il rilevante peso prognostico negativo166.
Per quanto riguarda l’espressione di AR, nella nostra esperienza elevati livelli tissutali del ligando di EGFR sono risultati correlati, nel sottogruppo K-RAS WT, ad un più elevato, ma non significativamente, tasso di risposte, ad un trend verso una miglior PFS e ad un OS significativamente più lunga. Numerosi interrogativi restano da chiarire in relazione alle caratteristiche biologiche ed all’importanza prognostica dei ligandi endogeni di EGFR, per poter interpretare adeguatamente i risultati ottenuti.
In primo luogo, il ruolo prognostico di AR, fortemente suggerito in diverse patologie167,168, non è ad oggi chiarito nei tumori colorettali.
Inoltre, diversi studi in altre patologie hanno riportato una correlazione inversa tra bassi livelli sierici dei ligandi endogeni ed una migliore attività ed efficacia di
farmaci inibitori del pathway di EGFR169,170. A tal proposito, saranno necessari ulteriori chiarimenti in relazione alla funzione della metalloproteasi TACE/ADAM, responsabile del clivaggio proteolitico di AR e, dunque, della sua liberazione in circolo. Alterazioni della funzione di TACE/ADAM potrebbero infatti giustificare una discrepanza tra i livelli tissutali e plasmatici di AR.
In ogni caso, il meccanismo d’azione di AR attraverso circuiti di signalling autocrini, paracrini e iuxtacrini, lascia supporre che la sua attività si esplichi prevalentemente a livello locale, rendendone pertanto particolarmente interessante lo studio tissutale. Infine, secondo la nostra esperienza, la mutazione di B-RAF sembrerebbe associata a bassi livelli d’espressione di AR. Sebbene tale risultato non abbia una precisa spiegazione biologica, è d’altra parte noto che i tumori colorettali B-RAF MUT mostrano caratteristiche patologiche e cliniche peculiari, trattandosi di neoplasie particolarmente aggressive, spesso localizzate al colon destro e che frequentemente presentano il fenomeno dell’instabilità dei microsatelliti ed un elevato grado di metilazione delle isole CpG del genoma171,172. La possibile associazione di aspetti genotipici e fenotipici non può pertanto essere trascurata nel tentativo di identificare potenziali markers predittivi di efficacia di specifici trattamenti. Nella nostra esperienza, infatti, l’analisi multivariata rivela come solo il potere predittivo delle mutazioni di B-RAF venga confermato sia in termini di PFS che di OS, mentre l’espressione IHC di AR non risulti correlata né alla PFS né all’OS. Tale risultato è ulteriormente supportato dall’analisi nel sottogruppo dei pazienti K-RAS e B-RAF WT, in cui i livelli d’espressione di AR non sono correlati né al tasso di risposta, né alla sopravvivenza.
In conclusione, lo studio dei potenziali markers di attività ed efficacia del trattamento con anti-EGFR non può fare a meno della valutazione combinata di tali markers candidati con i fattori molecolari, il cui peso predittivo/prognostico è già noto. Solo così, il reale impatto del marker analizzato come fattore indipendente in grado di influenzare l’outcome clinico, potrà essere dapprima valutato retrospettivamente e, in una seconda fase, studiato prospetticamente.
Questo per stabilire in maniera più accurata possibile quale sia la popolazione di pazienti realmente responsiva al trattamento con farmaci inibitori di EGFR, al fine di ottimizzarne la somministrazione ed il rapporto costi/benefici.
Per il prossimo futuro si auspica che le conoscenze acquisite nel setting metastatico possano essere trasferite anche a fasi più precoci di trattamento con progressivo aumento della sopravvivenza globale e finanche del tasso di guarigione dalle neoplasie colorettali.