Aldeidi e chetoni
C O R H C O R R2-eptanone
(feromone di allarme nelle api)
O
trans-2-esenale
(feromone di allarme nelle formiche)
Molte aldeidi e chetoni sono diffusi in natura
O
citrale (dal limone)
Molte aldeidi e chetoni sono diffusi in natura
O
Nomenclatura delle aldeidi cicliche N H CH O 3-pirrolcarbaldeide
COOH
C
O
H
Acido 4-formilbenzoico
OH
O
H
O
Acido-4-ossobutanoico
Quando l’aldeide è un sostituente C O H Formile o metanoile
Nomenclatura dei chetoni
Prefisso-Radice-Desinenza
Nomenclatura dei chetoni
Struttura del gruppo carbonilico
planare
Angoli di legame: prossimi a 120° C=O lunghezza di legame: 122 pm
Il Carbonio e l’ossigeno sono ibridizzati sp2 Legami nella formaldeide
Gli orbitali p semipieni del carbonio e dell’ossigeno si sovrappongono per formare il legame p
Carbonio elettrofilo Ossigeno nucleofilo
Strutture di risonanza del gruppo carbonilico
C O •• • • C O + – •• • • • •
• dagli alcheni ozonolisi
• dagli alchini
idroboraz.-ossidaz. (via enolo)
• dagli alcoli
ossidazione degli alcoli 1° con PCC dagli esteri
riduzione con DIBAH
(diisobutilalluminio idruro) Sintesi delle Aldeidi
H H H 1) O3 2) Zn, CH3COOH 1) Sia2BH 2) H2O2,OH -OH PCC O OCH3 DIBAL
dagli alcheni ozonolisi dagli alchini
idratazione (via enolo) dagli areni
acilazione di Friedel-Crafts dagli alcoli
ossidazione
Sintesi dei Chetoni
1) O3 2) Zn, CH3COOH 1) H2O, HgSO4 2) H2SO4 H2CrO4 OH CH3 O Cl AlCl3
Sintesi dei Chetoni
Dai cloruri degli acidi
con R2CuLi oppure con R2Cd
C O CH3 Cl + (CH3-CH2)2CuLi CH3 C CH2-CH3 O
Le due vie generali di reazione che un nucleofilo segue sommandosi ad una aldeide o ad un chetone.
Il meccanismo superiore porta ad un alcol;
quello inferiore ad un prodotto con un doppio legame C=Nu.
a)L’addizione nucleofila ad un’aldeide è stericamente meno impedita perché c’è solo un sostituente
relativamente ingombrante legato al carbonio carbonilico. (b) Un chetone, invece, ha due sostituenti voluminosi
quindi è più ingombrato.
Principi della Addizione Nucleofila a Gruppi Carbonilici:
Idratazione di Aldeidi e Chetoni
H2O
Idratazione di Aldeidi e Chetoni
C •• O • • HO C O •• H •• •• •• Gem-diolo
in paragone con H
elettronico: I gruppi alchilici stabilizzano
i reagenti
sterico: I gruppi alchilici affollano i prodotti (destabilizzazione) OH OH R R' + H2O C C R R' O
Equilibri di idratazione Tali equilibri sono molto influenzati dalla struttura del composto carbonilico
C=O specie idrata K %
CH2=O CH2(OH)2 41 99.96 CH3CH=O CH3CH(OH)2 0.018 50 (CH3)3CCH=O (CH3)3CCH(OH)2 0.0041 19 (CH3)2C=O (CH3)2C(OH)2 0.000025 0.14
Quando il gruppo carbonile è destabilizzato •I gruppi alchilici stabilizzano C=O
•I gruppi elettron-attrattori destabilizzano C=O Quando l’equilibrio favorisce la specie idrata?
R = CH3: K = 0.000025 R = CF3: K = 22,000 OH OH R R + H2O C C R R O
Dal punto di vista cinetico la reazione di idratazione è lenta ma può essere resa più veloce
Meccanismo dell’idratazione (in base) C •• O • • • • O • • H •• – Step 1: + HO C O •• •• •• •• • • –
Meccanismo dell’idratazione (in base) • • O H H •• Step 2: + •• • • O H • • – •• HO C O •• •• •• • • – •• HO C OH •• •• ••
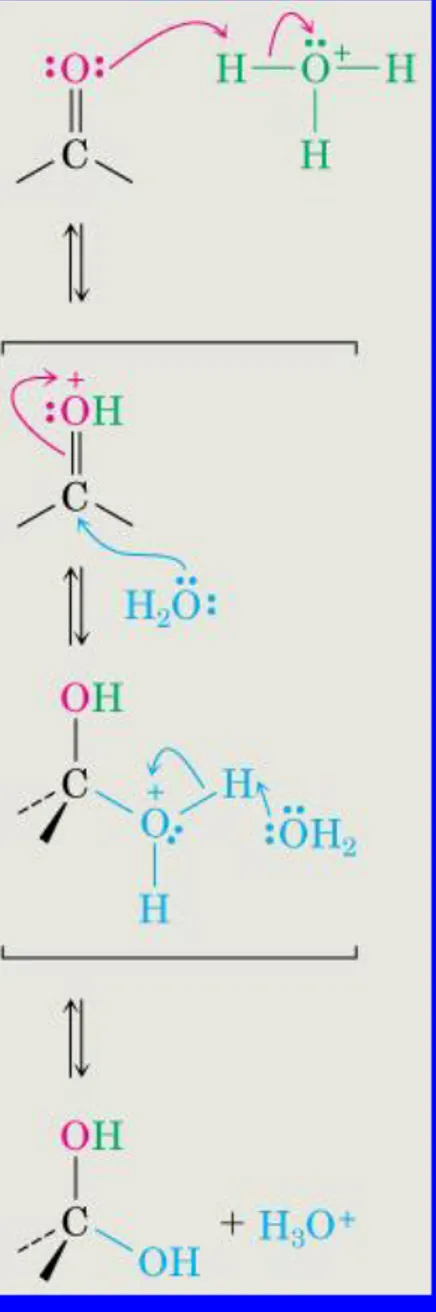
Meccanismo dell’idratazione (in acido) C •• O • • + Step 1: + • • H O H H + C •• OH + • • • • H O H
Meccanismo dell’idratazione (in acido) + Step 2: C •• OH + • • H O H •• C OH •• • • H O H • • +
Meccanismo dell’idratazione (in acido) Step 3: + • • H O H •• C OH •• H O H •• •• • • O H •• C OH •• •• + H H O H •• +
MECCANISMO: Idratazione base-catalizzata di un’aldeide o di un chetone. Lo ione idrossido è un nucleofilo più reattivo dell’acqua neutra.
Figura 19.5 MECCANISMO:
Figura 19.1 MECCANISMO:
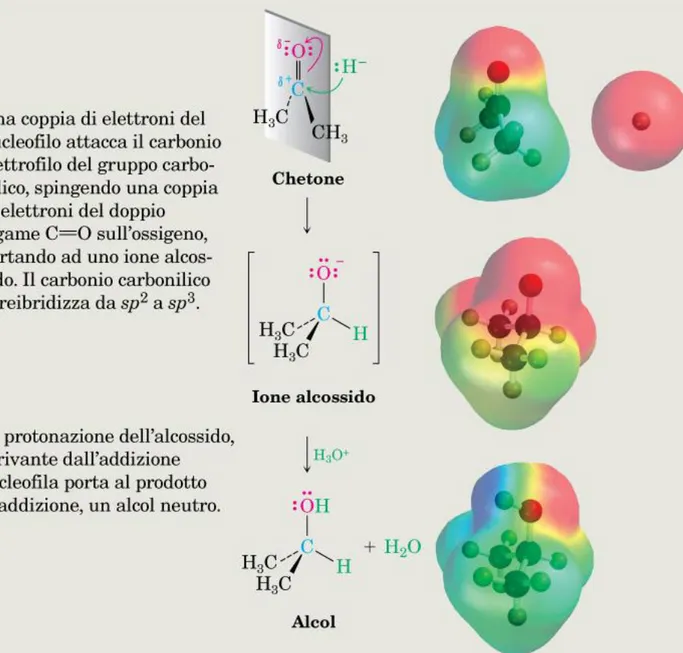
Una reazione di addizione nucleofila ad un’aldeide o ad un chetone. Il nucleofilo, per esempio qui lo ione idruro, si avvicina al gruppo carbonilico con un angolo di circa 45° rispetto al piano dell’orbitale sp2, il carbonio carbonilico si reibridizza da sp2 a sp3 e si forma lo ione alcossido. Sulla destra, le mappe di potenziale elettrostatico mostrano come la densità elettronica si trasferisce dal nucleofilo all’ossigeno.
-Meccanismo della riduzione del gruppo carbonilico attraverso l’addizione nucleofila di “ione idruro”
Addizione di HCN
+
Formazione delle cianidrine
•• • •
C O HCN •• N C C O H
•• ••
Formazione delle cianidrine
•• • • C O C – N • • ••
Formazione delle cianidrine
– O N C C •• •• • • • •
H
Formazione delle cianidrine
– O N C C •• •• •• • • H H + O • •
H
Formazione delle cianidrine
– O N C C •• •• •• • • H H + O • • H H O • • • • O N C C •• •• • • H
Cianidrina della 2,4-diclorobenzaldeide (100%) Esempio Cl Cl CH O Cl Cl CHCN OH NaCN, H2O poi H2SO4
Esempio CH3CCH3 O NaCN, H2O poi H2SO4 CH3CCH3 OH CN (77-78%)
La Cianidrina dell’acetone è usata nella sintesi del metacrilonitrile, a sua volta impiegato per la
preparazione di polimeri plastici trasparenti, quali il Plexiglass®
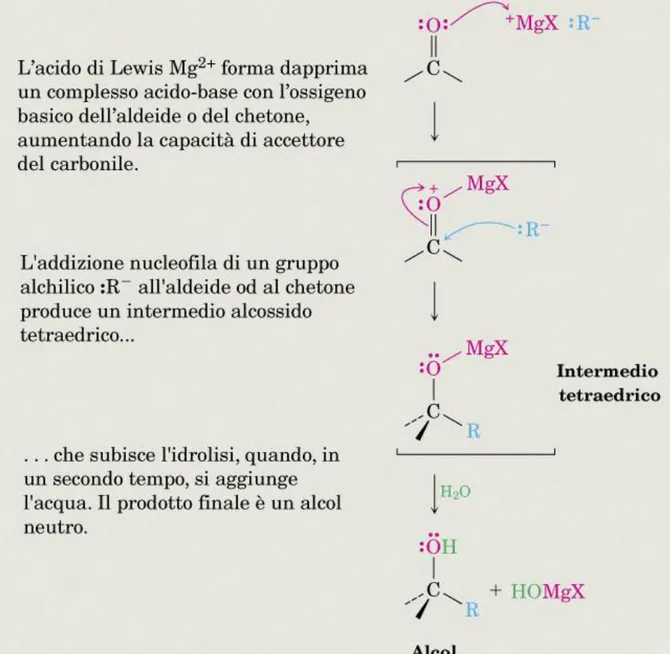
Figura 19.6 MECCANISMO:
La reazione di Grignard: L’addizione nucleofila di un carbanione ad un aldeide o ad un chetone, seguita dalla protonazione dell’intermedio alcossido, porta alla formazione di un alcol.
Alcune reazioni di aldeidi e chetoni progrediscono oltre lo stadio di Addizione Nucleofila
Formazione di acetali
Formazione di Immine ed Enammine
Formazione di composti relazionati alle Immine
Formazione di Alcheni (reazione di Wittig)
Ricorda l’idratazione di Aldeidi e Chetoni HOH C •• O • • HO C O •• H •• •• •• R R' R R'
Gli alcooli in analoghe condizioni reagiscono con Aldeidi e Chetoni
R"OH C •• O • • R R' R"O C O •• H •• •• •• R R' il prodotto è denominato un emiacetale.
O H HO H HO H OH OH H H OH CH OH H H HO OH H OH H CH2OH O
All’equilibrio è farorita la forma carbonilica
Acetale ROH, H+
L’emiacetale reagisce ulteriormente con una altra molecola di alcol,in acido per fornire un acetale
R"O C O •• R’’ •• •• •• R R' R"O C O •• H •• •• •• R R' Emiacetale
HCl 2CH3CH2OH +
+ H2O
Benzaldeide dietil acetale (66%) Esempio
CH
O
CH(OCH2CH3)2
In genere gli acetali non sono molto favoriti
HOCH2CH2OH + CH3(CH2)5CH O acido p-toluenesulfonico benzene + H2O (81%) H (CH2)5CH3 H2C CH2 O O C
I dioli formano acetali ciclici …tranne che nel caso di acetali ciclici
In generale:
La posizione dell’equilibrio è generalmente sfavorevole alla formazione di acetali a partire da chetoni.
Eccezione importante : Acetali ciclici.
HOCH2CH2OH + O acido p-toluenesulfonico benzene + H2O H2C CH2 O O C (78%) C6H5CH2CCH3 CH3 C6H5CH2 Esempio
Il primo stadio è analogo all’idratazione e porta alla formazione di emiacetali:
addizione nucleofila
acido-catalizzatadi un alcool ad un C=O
Meccanismo della formazione degli acetali
Meccanismo C O •• • • H H R + O • • R H O • • • •
Meccanismo C O •• H R O • • H + • • R H O • • • •
Meccanismo C O •• R H O • • • • H +
Meccanismo C O •• O • • H + •• R H
Meccanismo C O •• O • • H + •• R H O R H •• ••
Meccanismo + H O R •• H C O •• O • • H •• R ••
Il secondo stadio è la conversione emiacetale—acetale
coinvolge la chimica dei carbocationi
Stadio di conversione emiacetale-acetale C O •• O • • H •• R •• H H H + O • •
Stadio di conversione emiacetale-acetale C O •• O H •• R •• H H H O • • • • +
Stadio di conversione emiacetale-acetale C O •• O H •• R •• + H
Stadio di conversione emiacetale-acetale C O •• R •• + O •• H H • •
Stadio di conversione emiacetale-acetale
C O ••
R
•• +
Il carbocatione è stabilizzato dalla delocalizzazione della coppia solitaria dell’atomo di ossigeno.
C O
R
••
Stadio di conversione emiacetale-acetale C O •• R •• + O •• H R • •
Stadio di conversione emiacetale-acetale C O •• R •• O + •• H R
Stadio di conversione emiacetale-acetale C O •• R •• O + •• H R O •• H H • •
Stadio di conversione emiacetale-acetale + H O •• H H C O •• R •• O •• R ••
C R R' O 2R"OH + OR" R C R' OR" + H2O mecccanismo:
L’inverso della formazione di acetali; l’emiacetale è l’intermedio
applicazione:
Le aldeidi e i chetoni possono essere "protetti" come acetali.
Idrolisi degli Acetali