31
Fattori genetici connessi con la funzione mitocondriale e rischio
di diabete mellito
(3)I mitocondri sono organuli intracellulari responsabili della generazione di ATP attraverso il processo della fosforilazione ossidativa (OXPHOS) e hanno un proprio DNA che contiene geni per le subunità essenziali per la OXPHOS e il loro apparato per la sintesi delle proteine.
Il mitocondrio si presentò come un endosimbionte della cellula protoeucariotica circa 1,5-2 bilioni di anni fa e successivamente trasferì la maggior parte dei suoi geni nel nucleo. Ad oggi, il DNA mitocondriale (mtDNA) codifica solo 13 subunità delle circa 100 subunità strutturali delle proteine respiratorie e sintetizza ATP nei mitocondri dell’uomo. Dato che l’mtDNA ha una limitata capacità codificante, i geni del nucleo forniscono un contributo maggiore all’architettura mitocondriale, al sistema metabolico e alla biogenesi. E’ evidente che la disfunzione mitocondriale gioca un ruolo cruciale nella patogenesi del diabete di tipo 2. In questo review, ci focalizzeremo sul numero delle copie di mtDNA e sui fattori genetici del genoma mitocondriale e nucleare connessi al rischio del diabete di tipo 2.
32
Numero di copie dell’mtDNA nel sangue periferico e il diabete di tipo 2
mellito
L’mtDNA umano è costituito da una molecola circolare a doppia elica di 16.5 kb che codifica 13 geni per l’OXPHOS, 2 rRNA e 22 tRNA. E’ noto che il numero di copie di mtDNA per mitocondrio è considerato generalmente costante in tutti i tipi di cellule dei mammiferi. Tuttavia, il numero di copie dell’mtDNA rappresenta il numero o la massa del mitocondrio cellulare e può essere un possibile surrogato del marker della funzione mitocondriale.
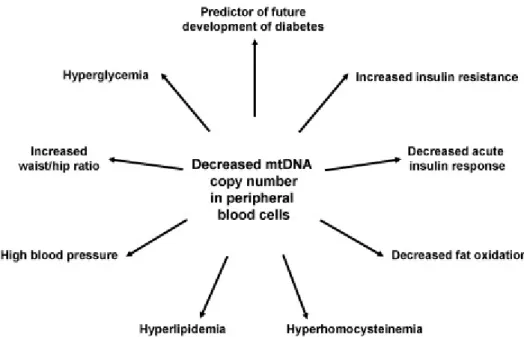
In uno studio di coorte prospettico basato su una popolazione, è stato trovato che il numero di copie dell’mtDNA nel sangue periferico era circa il 25% più basso nel gruppo convertitore che è stato recentemente diagnosticato con il diabete di tipo 2 nei due anni dello studio rispetto al gruppo non convertitore che è rimasto non diabetico (102.8 ± 41.5 vs. 137.8 ± 67.7 copie/pg template DNA). Questa scoperta suggerisce che la diminuzione del numero di copie di mtDNA nel sangue periferico delle cellule sia un fattore predittivo del futuro sviluppo del diabete di tipo 2. In più, è stato trovato che la diminuzione del numero di copie delll’mtDNA era ben correlato con il rapporto di circonferenza waist/hip, con l’ipergliecemia e con l’alta pressione del sangue.
In un altro studio di coorte basato su una popolazione, abbiamo confrontato il numero di copie di mtDNA nel sangue periferico delle cellule della progenie dei pazienti diabetici e non diabetici. Nonostante tutti i soggetti abbiano mostrato una normale tolleranza al glucosio, il numero di copie dell’mtDNA era diminuito nella progenie dei pazienti diabetici rispetto a quella dei non diabetici. Questi dati implicano che i fattori ereditari ignoti possono controllare il numero di copie dell’mtDNA. Abbiamo anche scoperto, molto interessante, che il numero di copie di mtDNA era correlato sia con la resistenza all’insulina sia con la funzione secretoria dell’insulina, il che ha suggerito che la diminuzione del numero di copie dell’mtDNA può essere responsabile delle due maggiori imperfezioni nel diabete di tipo 2: la resistenza all’insulina nei tessuti periferici e la secrezione dell’insulina danneggiata delle cellule ß del pancreas.
Inoltre, in uno studio di giovani volontari, abbiamo trovato che il numero di copie dell’mtDNA nel sangue periferico delle cellule era correlato in modo positivo con il tasso di ossidazione, la sensibilità all’insulina e la secrezione dell’insulina. In più, la diminuzione del numero di copie dell’mtDNA era associato con l’aumento del livello
33
dell’omocisteina del plasma, che è non è un tipico fattore di rischio tradizionale per le malattie cardiovascolari.
Un’ipotesi per la patogenesi del diabete di tipo 2 è che la diminuzione della funzione mitocondriale possa essere attribuita alla secrezione ridotta dell’insulina e alla diminuzione della sensibilità all’insulina. La Fig.1 riassume la relazione tra la diminuzione del numero di copie dell’mtDNA e le varie componenti patofisiologiche del diabete di tipo 2, il che implica che la diminuzione del numero di copie dell’mtDNA è un marker della cosiddetta sindrome metabolica, un cluster di anormalità come l’obesità, l’iperglicemia, ipertrigliceridemia, e l’alta e bassa densità della lipoproteina della colesterolemia.
Recentemente è stato riportato che la funzione mitocondriale danneggiata, che viene misurata direttamente in vivo tramite la risonanza magnetica nucleare, è associata alla resistenza all’insulina travata negli anziani. Inoltre, la resistenza all’insulina nei muscoli scheletrici della progenie insulina-resistente dei pazienti con diabete di tipo 2 è associata con la non regolamentazione del metabolismo dell’acido grasso intramiocellulare probabilmente a causa di un difetto ereditato dalla fosforilazione ossidativa nel mitocondrio. Questi dati sono straordinariamente simili alle nostre precedenti osservazioni e supportano l’evidenza che il numero di copie nelle cellule del sangue periferico è un surrogato della funzione mitocondriale dell’intero corpo.
34
Fig. 11. Association of decreased mtDNA copy number in peripheral blood cells with various pathophysiological abnormalities of type 2 diabetes
Mutazione di mtDNA e diabete mellito
E’ stato riportato che mutazioni puntuali o eliminazioni di parti di mtDNA sono associate a diabeti ereditati dalla madre. La maggior parte delle mutazioni puntuali sono state trovate nei geni del tRNA. Tra di loro, la sostituzione leucyl-tRNAUUR di A per G alla posizione nucleotidica 3243 (3243>G) è la mutazione più nota. Questa è di solito associata alla miopatia mitocondriale, all’encelopatia, all’acidosi lattica, a episodi di arresto cardiaco (MELAS) e associata anche a diabeti e sordità ereditati dal corredo della madre (MIDD). Abbiamo riportato che in Corea, circa lo 0,5% dei pazienti diabetici selezionati in modo casuale hanno una mutazione 3243>G. Dal momento che la mutazione 3243>G nei pazienti diabetici è molto rara, può spiegare solo una piccola parte della patogenesi del diabete.
A parte l’iperglicemia, la mutazione di mtDNA può portare ad altre anomalie metaboliche comunemente trovate nel diabete di tipo 2. Wilson2 e colleghi hanno riportato che un’ampia famiglia che mostra un cluster di ipertensione, di ipercolesterloemia, e ipomagnesemia hanno una mutazione nel tRNA mitocondriale che porta isoleucina.
1
Tratto da (3)
2
F.H.WILSON,A.HARIRI,A.FARHI,H.ZHAO,K.F.PETERSEN,H.R.TOKA, et al., A cluster of metabolic defects by mutation in a mitochondrial tRNA, Science 306 (2004) 1190-1194
35
Il fenotipo è stato ereditato dal corredo della madre e la completa scansione del genoma del nucleo non ha rivelato alcuna regione responsabile. Successive analisi sull’mtDNA mostrano una nuova mutazione alla posizione 4291 (4291T>C) ed è critica per la sua funzione tRNA.
Questi dati suggeriscono che l’mtDNA potrebbe contribuire alla patogenesi di altri componenti di sindromi metaboliche connesse all’iperglicemia.
Polimorfismo comune dell’mtDNA e il diabete di tipo 2mellito
Come il diabete di tipo 2 è una malattia molto comune, è improbabile che possa essere spiegato che la maggior parte del diabete di tipo 2 sia causato da una rara mutazione in un singolo gene. Esiste l’ipotesi della comune malattia/comune variante che afferma che il rischio genetico per le malattie comuni può essere spesso dovuto agli alleli produttori di malattie trovati con frequenze relativamente alte. Se la variazione di mtDNA è responsabile per una porzione considerevole del diabete di tipo 2, ci deve essere un polimorfismo comune di mtDNA associato al rischio di diabete di tipo 2. Comunque, recentemente è stato riportato che non c’è evidenza di un’associazione tra il polimorfismo di mtDNA comune e il diabete di tipo 2 negli europei. Al contrario, è stato dimostrato che la variante 16189T > C, un comune polimorfismo di mtDNA risultante in un polimorfismo intorno al tratto di lunghezza poli-C, è associato alla resistenza all’insulina, all’obesità e al diabete in alcune popolazioni. Una metanalisi di studi europei, comunque, ha indicato che è improbabile che la variazione genetica del tratto poli-C 16184-16193 abbia un ruolo principale nella causa del diabete di tipo 2. Dato che il diabete di tipo 2 è il risultato di una complessa interazione tra fattori genetici ed ambientali, il risultato della metanalisi europea non può essere esteso alla popolazione asiatica fino a quando questo non sarà dimostrato nel modo corretto. In uno studio multinazionale condotto in Asia, è stato recentemente trovato che il polimorfismo 16189T > C è associato alla suscettibilità al diabete di tipo 2. Dal punto di vista dell’ipotesi malattia comune/variante comune, l’aplo gruppo mtDNA è un altro buon candidato responsabile del diabete di tipo 2. L’aplo gruppo mtDNA è un gruppo di aplotipi di mtDNA che mostrano varianti comuni e si sa essere distribuito seguendo regioni geografiche specifiche. L’mtDNA umano mostra un aplo gruppo regione specifico nelle popolazioni indigene. Nonostante questo sia stato precedentemente
36
considerato come un risultato di un’alterazione genetica o un effetto promotore, una recente analisi della sequenza umana completa di mtDNA da diverse aree nel mondo ha suggerito che la distribuzione geografica regione-specifica degli aplo gruppi di mtDNA dipende anche dall’influenza della latitudine o ambienti termali, che possono aver permesso ai nostri antenati di adattarsi a climi più caldi o più freddi. Stranamente, è stato suggerito che i polimorfismi di mtDNA selezionati contro ogni ambiente termale giocano un ruolo nocivo nelle moderne malattie umane connesse a disfunzioni bioenergetiche o mitocondriali.
Polimorfismi nei geni del nucleo che regolano la funzione mitocondriale e
il diabete di tipo 2 mellito.
Utilizzando dati microarray, Patti3 et al. e Mootha4 et al. osservarono in modo indipendente l’uno dall’altro che i geni del metabolismo ossidativo regolati dalle proteine del nucleo non codificate sono ridotte in modo coordinato nel muscolo scheletrico dei soggetti umani con resistenza all’insulina o con diabete, il che è in linea con il fatto che il metabolismo mitocondriale ossidativo è cruciale nel mantenere una normale sensibilità all’insulina e un normale metabolismo del glucosio. Curiosamente, questi geni down-regolated nella resistenza all’insulina o nel diabete sono sotto il controllo del peroxisome
proliferator-activated receptor gamma coactivator 1 (PGC1α) e dal fattore 1 della
respirazione nucleare (NRF1). PGC1α è un “coattivatore trascrizionale” coinvolto nella regolazione di alcuni processi metabolici chiave connessi al diabete di tipo 2 includendo la biogenesi mitocondriale, la termogenesi adattativa, l’ossidazione dell’acido grasso, la gluconeogenesi epatica e l’utilizzo del glucosio nei tessuti periferici. E’ stato dimostrato che il polimorfismo in PGC1α è associato al diabete di tipo 2 in alcune popolazioni. Per esaminare se il polimorfismo comune PGC1α è associato con il diabete di tipo 2 nei coreani, è stato risequenziato il gene di PGC1α e sono state confrontate le frequenze allele/genotipo nei soggetti diabetici e in quelli non diabetici.
3
M.E.PATTI,A.J.BUTTE,S.CRUNKHORN,K.CUSI,R.BERRIA,S.KASHYAP, et al., Coordinated reduction of genes of oxidative metabolism in humans whit insulin resistance and diabetes: potential role of PGC1 and NRF1, Proc. Natl. Acad. Sci. U.S.A. 100 (2003) 8466-8471
4
V.K.MOOTHA,C.M.LINDGREN,K.F.ERIKSSON,A.SUBRAMANIAN,S.SIHAG,J.LEHAR, et al., PGC-lalpha-responsive genes involved in oxidative phospholylation are coordinately downregulated in human diabetes, Nat. Genet. 34 (2003) 267-273
37
Anche se non si può trovare un’associazione significativa tra i polimorfismi in PGC1α e i rischi di diabete in generale nei coreani, è stato trovato che due polimorfismi promotori sono connessi con la manifestazione precoce del diabete, per età minori di 40 anni.
NRF1 è un fattore di trascrizione che agisce sui geni del nucleo codificando le sub unità respiratorie e le componenti del sistema di trascrizione e replicazione mitocondriale. NRF1 si lega e attiva i promotori di molti geni del sistema di trasporto degli elettroni mitocondriali come il citocromo c, la subunità 8 della NADH deidrogenasi, alcune sub unità del citocromo ossidasi, alcune sub unità della ATP sintetasi, il fattore A della trascrizione mitocondriale (TFAM), e così via.
C’è una crescente evidenza che lega NRF1 fisiologicamente al metabolismo del glucosio. L’esercizio aerobico fa aumentare l’espressione di NRF1 nel muscolo scheletrico e una sovra espressione muscolo-specifica di NRF1 umano nei topi transgenici aumenta la capacità di trasporto nel muscolo scheletrico aumentando l’espressione del trasportatore 4. Sono stati scoperti polimorfismi di 12 nucleotidi singoli e un polimorfismo inserzione/cancellamento nel gene di NRF1 e sono state confrontate le frequenze del genotipo e dell’aplotipo tra soggetti coreani diabetici e non. Come risultato, g.141G > T e g.54529 > G mostrarono un aumento del rischio del diabete di tipo 2 e un aplotipo chiamato H4 era associato con un aumento del rischio di diabete di tipo 2.
Da questi risultati si può dire che il comune polimorfismo in PGC1α e in NRF1, che regola la biogenesi e la funzione mitocondriale, può essere responsabile del rischio di diabete di tipo 2.
E’ chiaro che la disfunzione mitocondriale svolge un ruolo fondamentale nella
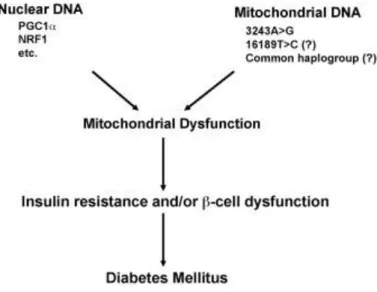
patogenesi del diabete di tipo 2. Abbiamo mostrato che il numero di copie dell’mtDNA nel sangue periferico delle cellule è associato con varie caratteristiche patofisiologiche del diabete di tipo 2. La standardizzazione della misurazione del numero di copie di mtDNA e un’ampia gamma di studi clinici sono necessari prima della loro applicazione clinica. I fattori genetici associati con il diabete di tipo 2 sono stati discussi anche in questo review (riassunti in Fig. 2).
Scoprire i polimorfismi comuni nell’mtDNA e i geni nucleari che regolano la funzione mitocondriale, che sono responsabili del diabete di tipo 2, potrebbe essere d’aiuto nel capire come la disfunzione mitocondriale sia connessa alla patogenesi del diabete di tipo 2.
38
Fig. 25. Genetic factors possibly related to mitochondrial dysfunction and development of diabetes mellitus.
5