1.
I
NTRODUZIONE
1.1 La planaria – Dugesia japonica
La planaria d’acqua dolce Dugesia appartiene alla classe dei Turbellari, l’unica classe dei Platelminti conducenti vita libera.
I Platelminti sono animali acelomati privi di qualunque elemento scheletrico rigido. Sono sostenuti da uno scheletro idrostatico, assicurato dai liquidi cellulari presenti nel tessuto connettivo e che circonda i loro organi interni, e da uno strato di fibre, sotto il rivestimento del corpo, che assicura un sostegno aggiuntivo e permette l’inserzione dei muscoli sottostanti.
Non possiedono un apparato circolatorio, né uno deputato agli scambi gassosi; la loro forma appiattita permette ai gas di diffondere, attraversando solo un breve tratto, nelle e dalle cellule più interne.
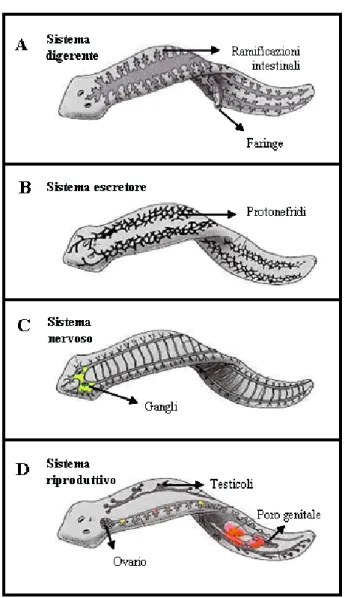
Il canale alimentare (Fig. 1.1 A) è costituito da un unico foro ventrale con funzioni sia di bocca che di ano (animali protostomi), da un faringe muscoloso e da tre sacche intestinali interne ramificate; da quest’ultima caratteristica, le
planarie, insieme ad altri turbellari, sono detti collettivamente Tricladi. Si nutrono di piccoli invertebrati e di sostanza animale morta.
Per quanto riguarda il sistema escretore (Fig. 1.1 B), le planarie sono dotate di protonefridi con tubuli di interconnessione, strutture che funzionano principalmente per l’osmoregolazione, eliminando l’acqua in eccesso e, secondariamente, per eliminare alcuni prodotti di rifiuto.
I Turbellari hanno un’epidermide costituita da un singolo strato di cellule, la maggior parte delle quali, soprattutto quelle ventrali, possiede ciglia che, assieme ad una pista mucosa secreta dalle ghiandole epidermiche, consentono loro di muoversi per scivolamento; le planarie sono anche capaci di torcersi e di voltarsi, avendo nella parete del corpo tre diversi strati di muscolatura liscia: circolari, longitudinali e diagonali. In tutta l’epidermide, oltre alle ghiandole secernenti muco, vi sono altre strutture particolari di forma bastoncellare, i rabditi, che vengono scaricati quando l’animale viene disturbato e la guaina mucosa che viene prodotta serve per proteggerlo.
In associazione alla loro simmetria bilaterale, i Platelminti hanno un sistema nervoso cefalizzato e la maggior parte di essi possiede una coppia di gangli fusi dorsali, a cui spesso ci si riferisce come “cervello”, da cui si dipartono longitudinalmente due cordoni nervosi ventrali (Fig. 1.1 C); così come le altre planarie, Dugesia ha alcune delle cellule sensoriali nella testa, localizzate in strutture dette auricole.
Infine, ponendo l’attenzione sul sistema riproduttivo, alcune planarie si riproducono sessualmente, altre, invece, per via asessuata: nel primo caso si osserva la presenza di gonadi, un paio di ovari e numerosi vitellari, entrambi ventrali, numerosi follicoli testicolari dorsali e, posteriormente al faringe, l’apparato copulatore che si apre all’esterno mediante il poro genitale (Fig. 1.1
D). Le planarie asessuate, invece, si riproducono per fissione trasversale, ma possono sviluppare gonadi e apparato riproduttore se cibate con specifiche sostanze sessualizzanti (Kobayashi et al., 1999; 2002).
Fig. 1.1: anatomia di planaria (Sanchez A et al., 2004): sistema digerente
1.2 Rigenerazione e cellule staminali adulte
La caratteristica principale di questi animali risiede nelle loro capacità rigenerative: a differenza degli animali più evoluti, le planarie, in seguito ad un trauma, non vanno incontro a processi di cicatrizzazione, ma rigenerano le parti mancanti grazie ad una popolazione di cellule staminali adulte pluripotenti, i neoblasti, che, da uno stato indifferenziato, si differenziano in cellule tipiche della struttura da riparare. Le planarie sono capaci di rigenerare lungo tutti gli assi del corpo e di ricreare l’intero organismo a partire da minuscoli frammenti, pari a 1/279 del loro corpo.
Grazie a questa peculiarità, le planarie sono un organismo modello per lo studio in vivo sulle cellule staminali adulte: negli organismi più complessi, infatti, questo tipo di cellule sono generalmente rare nell’adulto, poiché disperse a livello dei tessuti differenziati dove rappresentano una fondamentale risorsa per garantire il corretto turnover cellulare e l’omeostasi tissutale.
I neoblasti sono le uniche cellule proliferanti in planaria, capaci di autorinnovarsi illimitatamente e di dare origine a tutti i tipi cellulari differenziati, sia della linea somatica sia di quella germinale.
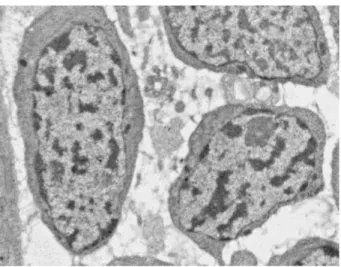
I neoblasti sono piccole cellule rotondeggianti, dal diametro medio di 8-10 µm, con ampio nucleo e scarso citoplasma indifferenziato ricco di ribosomi (Fig. 1.2), in cui sono riscontrabili accumuli di ribonucleoparticelle - mRNA associato a proteine -, detti corpi cromatoidi, che, si pensa, servano alla cellula come pronta risorsa di mRNA per una rapida risposta ad induzioni al differenziamento (Fig. 1.3).
Fig. 1.2: immagine al microscopio elettronico a trasmissione (TEM) di
neoblasti
Fig. 1.3: immagine al microscopio elettronico a trasmissione (TEM): le
frecce indicano la presenza di corpi cromatoidi all’interno del citoplasma di un neoblasto
La distribuzione dei neoblasti è stata analizzata mediante tre principali metodiche sperimentali:
⋅ analisi dell’espressione di marcatori molecolari di proliferazione (come ad esempio DjMCM2 – Mini Chromosome Manteinance - Salvetti et al., 2000; DjPCNA – Proliferating Cell Nuclear Antigen - Orii et al., 2005) mediante esperimenti di ibridazione in situ;
⋅ saggi di incorporazione di BrdU (Newmark e Sanchez, 2000
);
⋅ analisi di distribuzione delle mitosi (Baguñà, 1974; Newmark e Sanchez, 2000
).
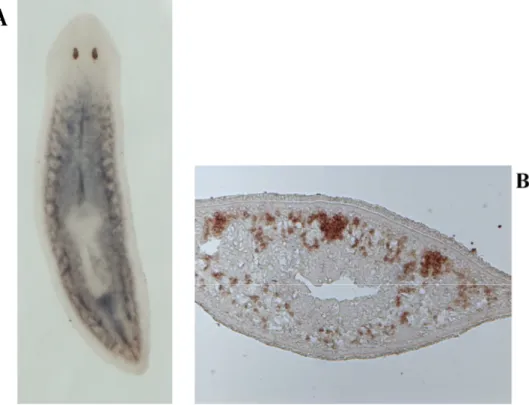
Dall’utilizzo di queste tre metodiche si evince che i neoblasti si ritrovano sparsi all’interno di tutto il parenchima, ad eccezione del faringe e della regione anteriore agli occhi, e accumulati in clusters disposti lungo due cordoni laterali dorsali. In Dugesia japonica i neoblasti si ritrovano anche accumulati lungo la linea mediana dorsale del corpo (Fig. 1.4 A-B).
Fig. 1.4: analisi dell’espressione mediante ibridazione in situ whole mount
(visione dorsale) (A) e su sezione (B) con il marcatore molecolare di proliferazione DjMCM2
Per quanto riguarda la funzione dei neoblasti, queste cellule sono implicate nel turnover cellulare che garantisce una corretta omeostasi di tutto l’organismo, nei processi di crescita e decrescita corporea in risposta a stimoli esterni favorevoli o meno ed, infine, nella rigenerazione.
In seguito ad un trauma, come risposta immediata si ha una contrazione muscolare che permette l’avvicinamento dei lembi della ferita; la chiusura è quindi determinata da una migrazione delle cellule epiteliali ai margini del taglio e, successivamente, dal ripristino di una lamina basale sottostante l’epitelio. I neoblasti vanno a proliferare nel cosiddetto postblastema e la loro progenie, in via di differenziamento, migra andando a formare il blastema.
1.3 Cellule eterogenee: suddivisione in sottopopolazioni
I neoblasti sono una popolazione di cellule eterogenee perché, sebbene condividano tutti quanti le caratteristiche descritte in precedenza, è possibile suddividerli in almeno tre sottopopolazioni: la sottopopolazione accumulata lungo la linea mediana del corpo, quella presente nelle due file di clusters laterali e quella dei neoblasti dispersi.
Esse si differenziano non solo per la loro differente distribuzione, ma anche per una diversa radiosensibilità (oltre all’espressione di diversi marcatori molecolari).
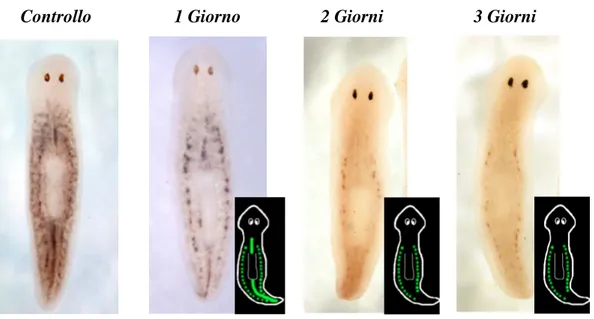
Somministrando a planarie una singola dose sub-letale (5 Gy) di raggi X (RX) e fissandole a tempi diversi dall’irraggiamento, è osservabile una progressiva perdita di neoblasti che segue un ordine ben preciso e costante: dopo un giorno scompare la sottopopolazione dei neoblasti dispersi e a due-tre giorni anche quella della linea mediana (Fig. 1.5). Questo esperimento
permette di dimostrare l’esistenza di una diversa radiosensibilità delle tre sottopopolazioni: i neoblasti dispersi sono i più radiosensibili, i neoblasti accumulati lungo la linea mediana si trovano ad un livello intermedio, mentre i neoblasti accumulati in clusters laterali sono i più radiotolleranti.
Fig. 1.5: analisi dell’espressione mediante ibridazione in situ whole mount
(visione dorsale) con marcatore DjMCM2 in planarie di controllo e trattate con 5 Gy, ai vari tempi
La radiosensibilità è collegata alla capacità proliferativa di una cellula: tanto maggiore è la sua capacità proliferativa, quanto minore è la sua radiotolleranza. Conseguentemente è stato ipotizzato che la capacità di proliferare delle tre sottopopolazioni segua una scala decrescente che va dai neoblasti dispersi alla sottopopolazione dei clusters laterali (Salvetti et al., 2009).
L’altra evidenza, che dimostra l’esistenza di sottopopolazioni distinte di neoblasti, si ha mediante l’impiego di marcatori molecolari specifici:
2 Giorni
1 Giorno 3 Giorni
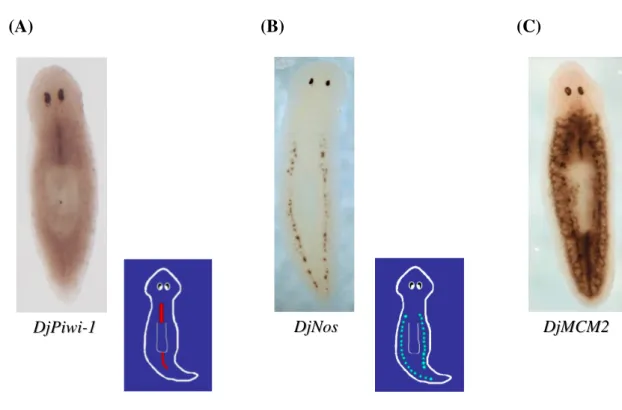
⋅ DjPiwi-1 - omologo del gene Piwi di Drosophila melanogaster -, per esempio, è espresso solo lungo la linea mediana (Fig. 1.6): queste cellule sono da considerarsi neoblasti per aspetto e sensibilità ai RX, ma non partecipano direttamente alla rigenerazione; studi di espressione non fanno notare un accumulo di cellule Piwi+ nella zona del sito di taglio (Rossi et al., 2007); ⋅ DjNos - omologo del gene Nanos, di D. melanogaster -, invece, è espresso
nelle cellule accumulate lungo le due linee laterali dorsali: anche queste cellule sono da considerarsi neoblasti sia per forma che per sensibilità ai RX, ma, più precisamente, sono state identificate come cellule staminali germinali che in planarie asessuate sono distribuite nei territori presuntivi di ovari e testicoli e che, se viene indotta una sessualizzazione dell’animale, portano alla formazione, effettivamente, delle cellule germinali (Sato et al., 2006).
(A) (B) (C)
Fig. 1.6: analisi dell’espressione mediante ibridazione in situ whole mount
(visione dorsale) di tre diversi marcatori molecolari per neoblasti: DjPiwi-1 che identifica la sottopopolazione della linea mediana (A), DjNos che identifica quella dei neoblasti clusterizzati lungo le due linee laterali dorsali (B), DjMCM2 marcatore generale di neoblasti (C)
D
1.4 Trattamento con RX per l’eliminazione selettiva dei neoblasti
Essendo i neoblasti le uniche cellule proliferanti in planaria, si ha la possibilità di eliminarli selettivamente, rispetto alle cellule differenziate, mediante l’impiego di dosi sterilizzanti di raggi X (Baguñà et al., 1989). Sono state individuate per ogni specie dosi e tempi di irraggiamento specifici che permettono questa sterilizzazione mirata e per D. japonica viene utilizzata la dose di 30 Gy (Salvetti et al., 2000).
In seguito ad irraggiamento si ottiene un animale del tutto uguale al wild type, tranne che per la perdita dei neoblasti. A causa di questa assenza, ciò che ne consegue è che le planarie perdono la capacità di rigenerare e di rinnovare le vecchie cellule differenziate, che porterà in breve tempo, circa due settimane, alla morte dell’animale (Baguñà et al., 1989; Guo et al., 2006; Lange, 1968a; Lange, 1968b; Lange, 1968c; Orii et al., 2005; Reddien et al., 2005b; Salvetti et al., 2000; Salvetti et al., 2005).
La possibilità di eliminare selettivamente i neoblasti rispetto alle cellule differenziate è stata utilizzata per analizzare il profilo genetico dei neoblasti, utilizzando la metodica dei microarrays. L’ipotesi alla base di questo studio è che in animali trattati con dose letale di 30 Gy si verificasse una down-regolazione dei geni espressi nei neoblasti. I risultati ottenuti hanno permesso l’identificazione di 44 geni specificamente down-regolati in planarie irradiate con 30 Gy (Rossi et al., 2007). La maggior parte di questi fattori sono probabilmente coinvolti nel rimodellamento della cromatina, come, ad esempio, proteine che regolano l’accesso alla cromatina ed omologhi di fattori trascrizionali, suggerendo che modificazioni epigenetiche possono dimostrarsi uno step cruciale per la regolazione trascrizionale dei neoblasti (Rossi et al.,
1.5 Il gene proibitina
Uno dei 44 geni individuati dall’analisi con i microarrays, è risultato essere omologo a geni della famiglia delle proibitine (PHBs). Questa famiglia comprende due omologhi, PHB1 e PHB2, entrambi ritrovati in tutti gli organismi studiati, dagli eucarioti più semplici quali i lieviti, passando attraverso piante, vermi, insetti, fino ai mammiferi. Questa alta conservazione attraverso l’evoluzione ha fatto ritenere che le proibitine svolgano un ruolo funzionale importante nelle cellule, sebbene a tutt’oggi non si abbiano certezze su quale esso sia effettivamente.
Il sito preferenziale in cui vanno a collocarsi le PHBs è la membrana interna mitocondriale (Merkwirth e Langer, 2008), dove, assemblandosi in dimeri, formano complessi multimerici ad anello, costituenti un’unità funzionale (Fig. 1.7).
Fig. 1.7: disposizione funzionale del dimero PHB1-PHB2 (A); posizione
dell’anello nella membrana interna mitocondriale: IMS = spazio intermembrana, IM = membrana interna mitocondriale, MATRIX = matrice mitocondriale (B)
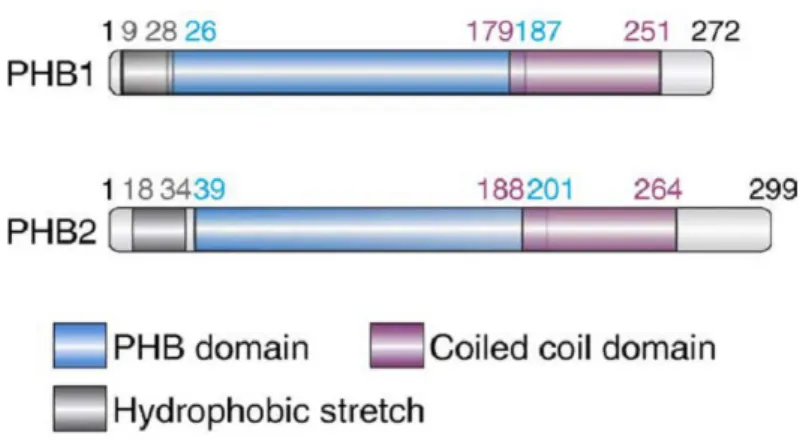
Studi funzionali di queste proteine in mammifero hanno evidenziato tre porzioni importanti all’interno della struttura amminoacidica (Fig. 1.8):
⋅ alcuni amminoacidi idrofobici, localizzati nella porzione amminoterminale, permettono l’ancoraggio delle proteine alla membrana interna mitocondriale;
⋅ il dominio PHB, localizzato nella regione centrale, anche noto come dominio SPFH - acronimo per Stomatin, Prohibitin, Flotillin and HflKC - di cui non è ancora stata chiarita l’esatta funzione;
⋅ un dominio coiled-coil, nella porzione carbossiterminale, che, assieme al resto della proteina, sporge nello spazio intermembrana, e sembra essere cruciale per l’assemblaggio dei complessi PHB.
Fig. 1.8: struttura amminoacidica delle due PHBs, in cui sono evidenziati i
I diversi ruoli attribuiti alle proteine PHBs hanno creato non poche difficoltà nel costituire un’immagine coerente della effettiva funzione delle proibitine.
Innanzitutto, il nome assegnato a questa famiglia di geni deriva da studi iniziali effettuati sull’omologo umano PHB1, secondo cui la proteina da esso codificata aveva un ruolo nella regolazione del ciclo cellulare. Successivamente, è stato dimostrato che non è, di fatto, la proteina derivante da PHB1 ad avere un ruolo come tumor suppressor, ma il trascritto PHB1: la 3’UTR blocca, infatti, la transizione G1 – S, determinando l’arresto del ciclo cellulare in diverse linee cancerose umane, inclusa MCF7 (Manjeshwar et al., 2003).
Per utilizzare la nomenclatura che ormai si era diffusa, è stato proposto un nuovo significato per “PHB”, alla luce dei nuovi risultati ottenuti: “proteins that hold badly folded subunits” (Nijtmans et al., 2002).
PHB2 è, inoltre, noto con l’acronimo REA (repressor of estrogen receptor activity): a seguito di uno screening mediante la metodica del doppio ibrido, era stata identificata una proteina che non solo era capace di legare i recettori degli estrogeni, ma anche di reprimere l’attivazione trascrizionale mediata da questi ligandi. In seguito, il gene codificante tale proteina è stato identificato in PHB2. La proteina PHB2 appare essere coinvolta in funzioni di recettore steroideo (Montano et al., 1999).
Tuttavia, ad oggi, non sono disponibili informazioni certe e definitive sul ruolo di PHB1 e PHB2, seppur vi siano, da più linee di ricerca, interessanti evidenze che mostrano loro implicazioni su più fronti, non solo a livello mitocondriale, come farebbe supporre la loro collocazione.
1.5.1 Attività nella membrana interna mitocondriale di PHB1 e PHB2
L’appartenenza alla famiglia proteica SPFH e la similarità di sequenza di PHB1 e PHB2 con le proteine batteriche HflC e HflK, rispettivamente, è stato un punto di inizio per investigare su quale fosse il ruolo del complesso PHB nel processing degli enzimi mitocondriali (Steglich et al., 1999). In batterio, HflC e HflK formano un complesso ancorato alla membrana plasmatica ed orientato verso lo spazio periplasmatico; questo complesso è associato con la proteasi AAA FtsH e ne inibisce l’attività (Kihara et al., 1996). Similmente, è stato mostrato che il complesso PHB è associato, in lievito, con la proteasi mitocondriale m-AAA (Steglich et al., 1999). È stato proposto che i complessi PHB vadano a stabilizzare le proteine mitocondriali di nuova sintesi, inibendo l’attività della proteasi m-AAA (Steglich et al., 1999).
Tuttavia, la diretta interazione del complesso PHB con le subunità II e III della citocromo c ossidasi (COX2 e COX3), appartenente alla catena respiratoria mitocondriale, suggerisce una funzione di chaperone più che quella di inibitore delle proteasi. Vi sono anche argomentazioni su base genetica che supportano il fatto che la stabilizzazione delle proteine di nuova sintesi, derivanti da geni mitocondriali, da parte del complesso PHB, sia il risultato di una sua attività di chaperone, piuttosto che di inibitore della proteasi m-AAA. Quando PHB1 e PHB2 sono silenziati in mutanti non aventi il gene codificante per la proteasi m-AAA, ciò che si ottiene è un forte difetto nella crescita, assente nei mutanti singoli (Steglich et al., 1999). Dato che la delezione di un inibitore non dovrebbe dare effetti in assenza della proteasi, questa osservazione è più facilmente spiegata da un’attività di chaperone.
polipeptidi non nativi o con intermedi di assemblaggio, rende plausibili anche funzioni alternative. Le dimensioni e la forma ad anello del complesso PHB, così come la similarità di sequenza di PHB1 e PHB2 con le proteine della famiglia SPFH, fanno pensare ad una possibile azione delle PHBs come scaffold, capaci, quindi, di definire subcompartimenti funzionali per specifici processi nella membrana interna mitocondriale (Browman et al.,2006; 2007; Huber et al., 2006; Salzer e Prohaska, 2001).
Non è da escludere che le PHBs non si comportino solo come scaffold per le proteine, ma che influenzino anche la ripartizione dei lipidi nella membrana interna mitocondriale (Birner et al., 2003; Osman et al., 2007). Grazie ad un recente lavoro di Osman e colleghi (2009) è stata dimostrata una effettiva relazione funzionale del complesso PHB con la composizione lipidica delle membrane mitocondriali: la struttura ad anello del complesso sembra, effettivamente, servire come organizzatore della membrana e determina la distribuzione di cardiolipina (CL) e di fosfatidiletanolammina (PE) nel doppio strato della membrana.
1.5.2 Regolazione trascrizionale di PHB2 mediata da recettori per gli estrogeni
Come detto precedentemente PHB2 è anche noto con il nome di “REA”, poiché capace di legare i recettori degli estrogeni e di reprimere l’attivazione trascrizionale mediata da questi. Kurtev e colleghi (2004) hanno confermato, innanzitutto, l’effettiva interazione tra PHB2 e i recettori degli estrogeni ed andando, inoltre, a valutare come avvenisse la repressione trascrizionale. La funzione proposta è che PHB2 si comporti come mediatore della repressione trascrizionale, determinata da recettori nucleari per ormoni, attraverso il reclutamento della istone deacetilasi.
Acetilazione e deacetilazione dei residui di lisina nelle code N-terminali degli istoni sembrano essere necessarie per una serie di eventi nucleari cruciali quali silenziamento, replicazione e corretta riparazione del DNA; HDAC1, in particolare, è implicato nella regolazione della progressione del ciclo cellulare, nel differenziamento e nello sviluppo (Ng e Bird, 2000); una serie di studi ha rivelato anche un suo potenziale ruolo nella carcinogenesi (Cress and Seto, 2000).
PHB2 interagisce con HDAC1 tramite due domini: uno all’N-terminale ed uno al C-terminale ed è capace di interagire anche con altri membri della famiglia HDAC, per esempio HDAC5, appartenente, però, ad un’altra classe di deacetilasi.
PHB2 inizialmente è stata identificata come inibitore antagonista-dipendente dell’attività trascrizionale del recettore degli estrogeni, capace di eseguire la sua funzione attraverso una competizione con co-attivatori per il legame ai recettori degli estrogeni, in particolare il recettore per gli estrogeni α
(ERα). Studi successivi hanno, inoltre, rilevato un effetto repressivo di PHB2 sui ligandi collegati ai recettori degli estrogeni.
Da queste evidenze e dalla dimostrazione che PHB2 interagisce effettivamente sia con ERα che con HDAC1, è stato proposto che PHB2 agisca come co-regolatore di ERα attraverso il reclutamento di HDACs nei geni target dei recettori nucleari (Kurtev et al. 2004).
Da notare che il legame PHB2-ER avviene soltanto in presenza di estrogeni. Le interazioni di PHB2 non si limitano ai soli ERα: essa si lega anche con altri membri della famiglia di recettori nucleari, quali COUP-TFI e COUP-TFII (Pereira et al., 2000), proteine che, legandosi al DNA, fungono da regolatori negativi per la funzione di attivazione di altri recettori ormonali nucleari. In accordo con la funzione di repressori, i COUP-TFs vanno ad associarsi direttamente o meno con le deacetilasi, incluse HDAC1 (Smirnov et al., 2000) e HDAC5 (Kurtev et al., 2004), verificando, così, l’esistenza non solo di un’interazione fisica, ma anche funzionale tra PHB2 e i COUP-TFs.
Alla luce di questi risultati è stato proposto, infine, che PHB2 agisca come una più generale proteina con funzione di co-repressore capace di interagire con una serie di recettori nucleari per ormoni e che esegue la sua funzione reclutando le deacetilasi.
Sorge a questo punto una domanda: come è possibile che PHB2, proteina di transmembrana, localizzata nella membrana interna mitocondriale, possa avere una funzione così rilevante come proteina solubile e all’interno del nucleo?
Una possibile risposta è stata data dal lavoro di Kasashima e colleghi (2006): essi hanno inizialmente ipotizzato che la presenza di PHB2 nel solo mitocondrio delle cellule HeLa, a differenza delle cellule MCF7 nelle quali è possibile osservare la presenza di PHB2 anche nel nucleo, fosse imputabile al
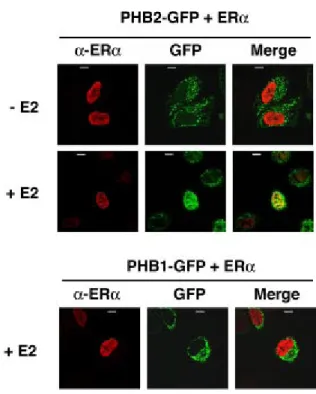
fatto che queste ultime esprimevano ERα nel mitocondrio, avente funzione di traslocatore nucleare per PHB2. Gli studi hanno effettivamente dimostrato che in cellule HeLa, ingegnerizzate ad esprimere ERα e in presenza di estradiolo (E2), PHB2 (ingegnerizzata con GFP) traslocava effettivamente nel nucleo, interagendo con il recettore per gli estrogeni grazie ad un dominio di legame presente al C-terminale, risultato non ottenuto, invece, per PHB1 (Fig. 1.9).
Fig. 1.9: PHB2, fusa con proteina GFP, passa nel nucleo solo in presenza di
estrogeni (in questo esempio di E2): ERα si trova nel nucleo a prescindere dal fatto che vi sia o meno E2(prima colonna); PHB2 trasloca nel nucleo solo in presenza di E2 (seconda colonna); immagini sovrapposte: solo con E2 si ha sovrapposizione dei siti in cui si trovano ERα e PHB2 (terza colonna). La traslocazione al nucleo in presenza di E2 non avviene per PHB1 (settore inferiore)
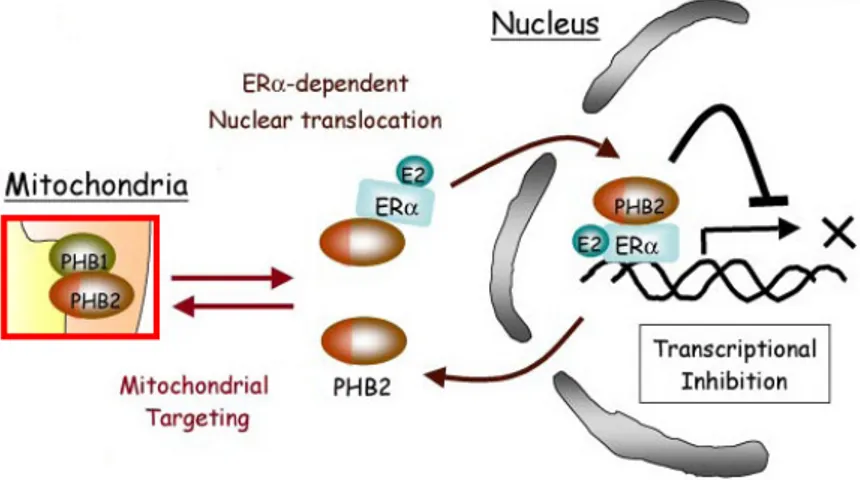
La traslocazione della PHB2 mitocondriale nel nucleo avviene anche in presenza della cycloheximide, un inibitore traduzionale: a traslocare nel nucleo non sono le proteine di nuova sintesi che si trovano ancora nel citoplasma, ma effettivamente quelle che già hanno raggiunto la sede mitocondriale, grazie alla presenza di una sequenza target per il mitocondrio (MTS) all’N-terminale (Kasashima et al., 2006). Questa sequenza segnale non è eliminata all’interno del mitocondrio e probabilmente consente alla proteina di ritornare a questo organello una volta eseguita la sua funzione di inibitore trascrizionale ERα-dipendente all’interno del nucleo (Fig. 1.10).
Fig. 1.10: in presenza di ERα e di E2, la PHB2 mitocondriale trasloca nel
nucleo, dove permette la repressione della trascrizione ERα-dipendente. PHB2 possiede una MTS all’N-terminale non eliminabile, che indica la possibilità di traslocare tra i due organelli (Kasashima et al., 2006)
1.5.3 Protezione della coesione tra cromatidi fratelli mediata da PHB2
La coesione tra cromatidi fratelli è essenziale per una corretta segregazione alla mitosi. Takata e colleghi (2007), conducendo uno studio su cellule umane HeLa, hanno dimostrato il coinvolgimento di PHB2 nella regolazione della coesione dei cromatidi fratelli durante la mitosi.
L’eliminazione selettiva mediante RNAi del gene PHB2 determina una prematura separazione dei cromatidi fratelli e difetti nell’aggregazione dei cromosomi, accompagnata dall’arresto della mitosi, causata dall’attivazione del checkpoint del fuso: in assenza di PHB2, le coesine si trovano ad essere dissociate dai centromeri durante l’inizio della mitosi (Kitajima et al., 2005).
In questo contesto, la funzione di PHB2 sembra essere quella di impedire la fosforilazione delle coesine e la loro conseguente rimozione dal centromero (Takata et al. 2007).
Con un’analisi più nel dettaglio - mediante trattamento delle cellule con colcemide per 3 ore - è possibile osservare che i cromosomi in metafase trattati possiedono cromatidi fratelli separati lungo tutta la lunghezza del cromosoma, a differenza dei controlli che rimangono legati a livello del centromero (Fig. 1.11).
Fig. 1.11: schematizzazione di cromosomi di cellule in metafase: nei controlli le
coesine centromeriche (pallino rosso) mantengono la coesione tra i cromatidi fratelli;in cellule che hanno subito trattamento con RNAi per PHB2, la coesione tra i cromatidi fratelli è impedita, sebbene altri fattori centromerici permangano nel centromero (pallini blu) (Takata et al., 2007)
1.5.4 PHB2 e le cellule staminali
Studi effettuati utilizzando metodiche di proteomica (elettroforesi bidimensionale ed analisi di spettroscopia di massa MALDI-TOF) hanno permesso di ipotizzare in vitro una correlazione tra l’espressione di PHBs e il mantenimento dello stato indifferenziato e proliferante di cellule epatiche staminali (HSL) (Saheki et al., 2008). Cellule HSL proliferano nel medium di Eagle modificato da Dulbecco (DMEM) con il 10% di siero bovino fetale (FCS) senza andare incontro a differenziamento o tumurogenesi e non mostrano cambiamenti morfologici spontanei anche in colture a lungo termine.
Aggiungendo al terreno di coltura butirrato di sodio (NaB), esso determina un effetto antiproliferativo nelle cellule HSL che vanno incontro a cambiamenti morfologici, convertendosi in cellule appiattite dall’ampio citoplasma.
NaB agisce come inibitore delle istone deacetilasi in un’ampia varietà di tipi cellulari e la sua capacità di induzione al differenziamento cellulare è ampiamente studiata. Scarse informazioni si hanno, invece, per gli effetti antiproliferativi osservati nelle cellule HSL.
Per mezzo degli studi di proteomica citati e valutando le concentrazioni proteiche presenti nelle cellule HSL prima e dopo i trattamenti con NaB, sono state individuate sei proteine implicate nella proliferazione delle cellule HSL in vitro, tra cui anche la proteina PHB2. È stato ipotizzato che questa proteina sia implicata nell’attivazione della cascata classica della chinasi mitogen-activated protein (MAP) convertendo cellule HSL in cellule proliferanti. Analisi di RT-PCR, per valutare un cambiamento a livello trascrizionale, non hanno evidenziato un cambiamento nei livelli dell’espressione degli mRNA di queste proteine. Sono stati ipotizzati, perciò, altri meccanismi con cui avvenga il
proteine già sintetizzate, una regolazione traduzionale oppure modificazioni post-traduzionali. Informazioni sul ruolo in vivo di fattori PHBs nella biologia delle cellule staminali adulte non sono, invece, ancora disponibili.