1
Capitolo 1
Introduzione
2
1.1 L’Echinacea
1.1.1 Classificazione
Con il termine “Echinacea” vengono indicate varie specie di piante erbacee perenni, originarie del Nord America, dove il genere è assai diffuso nelle Grandi Pianure (Great Plains), fra le montagne Rocciose ad Ovest e la catena degli Appalachi ad Est, interessando numerosi stati.
L’Echinacea appartiene alla famiglia delle Asteraceae o Compositae e la sua corrente classificazione si basa su uno studio comparativo morfologico e anatomico di Mc Gregor (1968).
Tabella 1: Classificazione dell’Echinacea
3
soltanto gli estratti di E. pallida, di E. angustifolia e di E. purpurea, a cui sono state attribuite diverse attività terapeutiche, in particolare legate alle seguenti proprietà farmacologiche:
Azione immunostimolante per prevenire e curare patologie respiratorie (l’uso più comune in campo farmaceutico)
Azione antinfiammatoria
Azione cicatrizzante
Azione battericida e fungicida
Azione antivirale
Azione antiossidante
I prodotti a base di Echinacea costituiscono uno dei settori più ampi del mercato delle erbe medicinali: è stato stimato che le vendite del 1998, solo negli USA, hanno prodotto un giro d’affari di circa 300 milioni di dollari (Brevoort et all,1998).
Centinaia di preparazioni commerciali, comprendenti succo puro pressato, estratti secchi totali alcolici o acquosi, foglie e fiori secchi in polvere, pomate o tinture sono disponibili in drogherie, farmacie e negozi di cibi naturali. L’utilizzo delle tre specie medicinali di Echinacea è ampio e diffuso; in Germania, più di 300 preparazioni farmaceutiche contengono tali specie, spesso presenti in associazione tra loro o con altre sostanze.
La specie che abbiamo utilizzato in laboratorio è l’Echinacea pallida, più precisamente il suo estratto totale di radice, che ha destato interesse, recentemente, per le sue differenze chimiche rispetto alle altre due specie.
4 1.1.2. Echinacea pallida
Dal punto di vista morfologico, le specie d’Echinacea si assomigliano, essendo tutte piante erbacee perenni a radice fittonante più o meno ramificata.
L’E. pallida ha le foglie basali lunghe circa 30 cm e larghe 4 cm, lineari lanceolate più o meno ampie e hanno peli ispidi e duri sulla lamina, per lo più sulla faccia inferiore; le foglie caulinari sono simili a quelle basali, ma sono di dimensioni inferiori. In alcuni casi, le foglie si distinguono, inoltre, grazie alla presenza di una profonda dentellatura. Sia le foglie basali che quelle del caule hanno tre nervature principali nella pagina inferiore. I fiori sono di colore rosa-viola chiaro (Fig.1)
5
La droga è rappresentata dalla radice i cui componenti principali sono:
Chetoalcheni e chetoalchini e derivati idrossilati che differenziano gli estratti di E. pallida da quelli di E. angustifolía, in cui essi sono
assenti.
Olio essenziale dallo 0,2 al 2% Derivati poliacetilenici
Derivati dell'acido caffeico tra i quali l'echinacoside (fino all’11%), la cinarina è assente.
Glicoproteine Polisaccaridi
La radice dell’E. pallida non contiene alcammidi a differenza della radice dell’E. angustifolia.
È stato dimostrato che le preparazioni a base di Echinacea possono avere influenza sui meccanismi immuni (Goel V et al., 2002). L’azione immunostimolante appare comune alle tre specie di Echinacea.
La capacità di aumentare le risposte del sistema immunitario attualmente è stata spiegata ipotizzando l’azione su diverse componenti cellulari del sistema immunitario stesso. Non ci sono, tuttavia, ancora studi che diano una visione chiara dei meccanismi coinvolti e dei principi attivi responsabili. Fra le cellule che possono rivestire un ruolo nell’azione dell’Echinacea vi sono le cellule dendritiche (DC) su cui è stato recentemente descritto un ruolo modulatorio di un estratto totale da radici delle tre specie di Echinacea (Compagnino M, 2007).
6
Capitolo 2
7
2.1. Caratteristiche generali del Sistema Immunitario
Il Sistema Immunitario è costituito da un insieme di cellule e componenti solubili, la cui funzione è quella di riconoscere le entità presenti all’interno dell’organismo come proprie (self) o estranee (non-self) e di eliminare quest’ultime.
Può essere funzionalmente diviso in due componenti:
Il Sistema Immunitario naturale o innato, che agisce come prima linea di difesa, interna ed esterna, contro gli agenti infettivi che vengono eliminati prima di poter determinare un’infezione clinicamente manifesta.
Il Sistema Immunitario specifico, che agisce nel caso in cui gli agenti infettivi superino le prime linee di difesa, generando una reazione immune selettiva verso ogni agente infettivo, attraverso l’espansione clonale del linfocita che ha riconosciuto l’antigene.
In una prima fase, intervengono le cellule che presentano l’antigene (APC), ossia cellule in grado di internalizzare l’antigene, processarlo e ri-esprimerlo sulla membrana cellulare modificato, in modo tale da renderlo riconoscibile alle cellule immunocompetenti deputate a innescare la risposta immunitaria specifica.
Tra le cellule in grado di presentare l’antigene, le cellule dendritiche (DC) esplicano una funzione chiave nel fornire informazioni sugli agenti patogeni alle cellule effettrici del sistema immunitario. Esse sono ritenute, infatti, le
8
APC maggiormente coinvolte nell’induzione della risposta immunitaria (Young JW, 2001).
In particolare, le DC immature sono meno potenti come attivatori dell’immunità, ma specializzate nella cattura e processazione dell’antigene; le DC mature, invece, sono in grado di attivare le cellule T, le quali, in seguito a tale induzione, possono completare la risposta immunitaria interagendo con altre cellule, tra cui le cellule B per la produzione di anticorpi, i macrofagi per il rilascio di citochine, e i bersagli per la lisi.
2.2. Le cellule dendritiche
Le cellule dendritiche (DC) sono le più potenti cellule professionali presentanti l’antigene (APC) deputate all’immunosorveglianza, in grado di indurre e modulare l’immunità cellulo-mediata contro patogeni, antigeni tumorali e proteine non-self, e di mantenere la tolleranza immunologica (Steinman RM, 2003).
Fig 2: Cellule dendritiche
9
Le DC si trovano in elevata quantità in tutte le zone di interfaccia tra il corpo e l’ambiente esterno, come la pelle, la faringe, la parte superiore dell’esofago, la vagina e l’ano, e alle superfici interne o mucosali dei sistemi respiratorio e gastrointestinale (Niess JH e Reinecker HC, 2005).
In base alla loro funzione e localizzazione, le DC sono classificate in:
cellule dendritiche del sangue;
cellule dendritiche dei tessuti, che includono le cellule di Langerhans cutanee (LC);
cellule dendritiche delle vie respiratorie;
cellule dendritiche della mucosa del tratto digestivo;
cellule dendritiche della lamina propria della mucosa e della sottomucosa;
cellule dendritiche interdigitate dei linfonodi regionali e delle strutture linfoidi attorno alle mucose;
cellule dendritiche interstiziali degli organi come rene, intestino, polmone, tiroide.
La forma e la motilità (che danno origine al termine “cellula dendritica”) sono peculiari di questo tipo cellulare.
Le DC presentano un aspetto stellato: al microscopio elettronico, quando isolate e centrifugate su vetrini, esse mostrano molti dendriti sottili.
10 2.2.1. Origine e generazione
I progenitori delle DC, presenti nel midollo osseo giungono nel sangue e si distribuiscono nei vari organi, localizzandosi negli epiteli e negli spazi interstiziali. In queste sedi i progenitori acquisiscono le caratteristiche tipiche delle DC che le rendono particolarmente adatte a svolgere il ruolo di sorveglianza immunitaria.
Alcuni studi hanno dimostrato che monociti maturi, isolati da sangue periferico, coltivati in presenza di GM-CSF e IL-4, sono in grado di differenziarsi in DC (Sallusto F, Lanzavecchia A, 1994; Sallusto F, Lanzavecchia A, 1995).
Dopo 7 giorni di coltura, infatti, si ottengono cellule assimilabili dal punto di vista fenotipico a cellule dendritiche interstiziali, che esprimono gli antigeni CD1a, CD11b, CD68 e il fattore XIIIa della coagulazione. Tuttavia, per raggiungere il pieno stadio maturativo e diventare cellule dendritiche altamente stimolatorie, tali cellule necessitano di un’ulteriore stimolazione con CD40L, con endotossina batterica (LPS), o con TNF-α (Sallusto F, Lanzavecchia A, 1994).
Le DC allo stato immaturo sono inoltre caratterizzate da una bassa espressione di molecole del complesso maggiore di istocompatibilità (MHC)-I e II, e di molecole costimolatorie CD40, CD80, CD86. Risulta ridotta anche l’espressione della subunità p55 del CD83 e di altri recettori quali la molecola di adesione CD54 (ICAM-1). Si riscontra, invece, un’elevata presenza di molecole necessarie al processo di fagocitosi, quali le lectine di tipo C
(DEC-11
205 e recettore del mannosio), la Langherina (DEC-207), il recettore CD36 e il recettore del complemento CR1.
La maturazione delle DC è un evento fondamentale per l’inizio della risposta immunitaria. Essa può essere indotta da batteri o da componenti della loro parete come l’LPS (lipolisaccaride), da stimoli infiammatori, da citochine quali TNF-α, IL-1β, IFN-α e -β e prostaglandine; viene inibita, invece, dal Vascular
Endothelial Growth Factor (VEGF) e da IL-10. Una volta attivate, le DC
diventano altamente mobili e migrano nei linfonodi locali, dove perdono la capacità di fagocitare gli antigeni, ma allo stesso tempo diventano efficienti nell’indurre una risposta immune antigene-specifica, mediata dai linfociti T. In questo stadio maturativo il fenotipo delle DC è caratterizzato da un’elevata espressione di molecole MHC di classe II, delle molecole costimolatorie, quali CD40, CD80 e CD86 (che consentono l’attivazione dei linfociti T naïve) e del CD83 (Steinman RM et al., 2003).
2.2.2. La presentazione dell’antigene
Le DC immature possiedono diverse caratteristiche che consentono loro di catturare l’antigene. Innanzitutto, esse possono introitare particelle e microbi tramite fagocitosi. Inoltre, esse possono formare grandi vescicole pinocitotiche in cui vengono raccolti il fluido extracellulare e i relativi soluti, in un processo denominato macropinocitosi (Sallusto F e Lanzavecchia A, 1995). Infine, esse possono realizzare anche l’endocitosi recettore-mediata.
12
L’antigene, una volta catturato, fornisce, inoltre, un segnale per la maturazione: questo evento provoca il rapido declino della capacità di cattura degli antigeni da parte delle DC e dà inizio all’assemblaggio dei complessi peptide-MHC.
2.2.3. Migrazione ai tessuti linfoidi
Dopo l’esposizione a stimoli antigenici o infiammatori, le DC interstiziali presenti negli organi solidi, migrano nei linfonodi regionali o nella milza, rispettivamente attraverso la via linfatica o ematica, mentre le DC presenti negli epiteli migrano nei linfonodi regionali, attraverso i vasi linfatici afferenti. In questa fase, le DC acquisiscono la loro peculiare morfologia e modificano il loro metabolismo esprimendo sulla membrana le molecole costimolatorie necessarie per l’attivazione dei linfociti T.
Una volta giunte negli organi linfatici, le DC possono localizzarsi nell’area parafollicolare, dove si differenziano in cellule interdigitate in grado di attivare i linfociti T naïve, oppure nel centro germinativo, dove presentano l’antigene a linfociti T della memoria, avviando risposte immunitarie di tipo secondario. La migrazione delle DC dai siti periferici agli organi linfatici è un fenomeno ancora non completamente conosciuto, strettamente correlato sia al loro differenziamento, che alla loro maturazione funzionale.
Le DC immature esprimono una serie di recettori per le chemochine che assicura il loro reclutamento al sito d'infezione o infiammazione, tra cui CCR1, CCR2, CCR5, CCR6 e CXCR1 (Sallusto F et al., 1999; Yanagihara S
13
Le DC mature perdono la responsività alle chemochine infiammatorie e anche l’espressione del CCR1, CCR5 e CCR6, down-regolano l’espressione di CXCR1 e up-regolano quella di CXCR4 e CCR7 (Sallusto F et al., 1999; Yanagihara S et al., 1998).
2.2.4. Effetti dell’Echinacea sulle cellule dendritiche
Wang e coll. hanno caratterizzato l’espressione genica delle cellule dendritiche (DC) ed hanno mostrato la loro capacità di processare segnali ambientali ed attivare diversi programmi di trascrizione in risposta a stimoli differenti.
Le DC giocano un ruolo importante nella promozione e nella regolazione sia dell’immunità innata che di quella acquisita (Steinmüller C et al., 1993). In condizioni normali queste cellule si trovano in uno stato immaturo ma, indotte da segnali opportuni come infiammazione o antigeni ambientali, vanno in contro ad un rapido cambiamento ed iniziano una cascata di attività rivolte alla difesa dell’organismo. Inoltre le caratteristiche fenotipiche e funzionali delle DCs sono intimamente e dinamicamente correlate al loro stato di differenziazione e maturazione.
Con queste premesse, Compagnino M. (2007) ha analizzato l’espressione del CD83, un marker di crescita presente sulle cellule dendritiche immature (iDCs), in risposta al trattamento con estratti totali di radice delle tre specie di
Echinacea : i suoi studi hanno evidenziato che l’Echinacea determina nelle
14
dell'espressione del CD83 e dalla riduzione o assenza dell'espressione delle molecole costimolatorie (CD40 e CD80) e dell'antigene HLA-DR. Questo effetto appariva più significativo per la specie E. pallida.
Inoltre, in un esperimento preliminare, ha mostrato che l'aggiunta di
Echinacea riduce l’attivazione delle DC indotta da LPS, come mostrato da
una diminuita produzione di TNF-α, IL-6, IL-12 e da un blocco di produzione di IL-10.
15
Capitolo 3
16 3.1 La P-glicoproteina
La P-glicoproteina (P-gp), codificata dal gene umano multi-drug resitance-1 (MDR-1), rappresenta una proteina integrale di membrana di dimensioni pari a 170 KDa. Essa appartiene alla superfamiglia denominata ATP-binding cassette (ABC), che comprende circa 30 proteine, tra cui trasportatori, canali ionici e recettori, caratterizzate da un’alta omologia nelle sequenze e nell’organizzazione dei domini (Chan LMS et al., 2004). Tali proteine utilizzano l’idrolisi dell’ATP per traslocare un’ampia gamma di substrati contro gradiente attraverso una varietà di membrane cellulari (Mizutani T, 2008). Nel nome P-glicoproteina, P sta per permeabilità, in quanto fin dall’inizio risultò essere associata ad un’alterata permeabilità della membrana ai farmaci.
La P-gp è stata vista essere in grado di espellere attivamente fuori dalla cellula una grande varietà di sostanze citotossiche con struttura e dimensioni diverse. La P-gp è presente normalmente nelle cellule sane, dove svolge molte funzioni fisiologiche. Risulta, inoltre, sovraespressa in cellule tumorali di individui con un’aumentata resistenza alla cura chemioterapica (resistenza multifarmacologica).
L’azione fisiologica delle proteine trasportatrici come la P-gp non é certo quella di determinare una resistenza ai farmaci, bensì di regolare l’escrezione o l’assorbimento di particolari sostanze attraverso le membrane cellulari. Quest’ultime sembrano essere una sorta di cancello intelligente attraverso il quale le cellule del nostro organismo possono regolare l’entrata
17
o l’uscita dal citoplasma di particolari sostanze. Queste possono essere non solo fattori indispensabili per la vita della cellula che per diversi motivi non attraverserebbero la membrana cellulare (macromolecole o sostanze idrofobiche), ma anche gli stessi prodotti del metabolismo della cellula che se non eliminati potrebbero compromettere la vitalità stessa del cellula e la funzionalità dell’organo corrispondente.
Oltre alla sua funzione di pompa transmembrana, sono state riscontrate altre funzioni fisiologiche della P-gp , fra cui un ruolo nella traslocazione dei
fosfolipidi, nel metabolismo del colesterolo e nell’inibizione della morte cellulare programmata (apoptosi) (Mizutani, 2008).
Robinson et al hanno mostrato che una overespressione della proteina ritarda la cascata apoptotica nelle cellule ovariche di cavia, indicando che l’attività della P-gp è necessaria per proteggere le cellule dalla morte indotta dall’assenza di fattori di crescita.
18
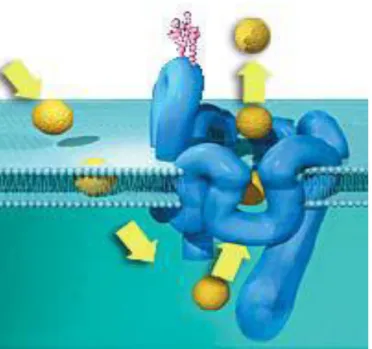
Figura 3.1: In figura è riportata una rappresentazione schematica di come la P-gp espelle al di fuori della cellula farmaci e xenobiotici
3.2. Struttura e meccanismo d’azione
Tridimensionalmente, la P-gp presenta una struttura cilindrica di circa 10 nm di diametro. I dodici domini transmembranali si dispongono a formare all’interno della membrana un poro centrale di forma tiroidale, di circa 5 nm di diametro: si forma, così, nella membrana, un’area acquosa con un’apertura verso il lato lipidico, che permette il passaggio dei substrati. È visibile, inoltre, un’ulteriore apertura verso la fase lipidica sul piano della membrana (Rosenberg MF et al., 1997).
19
Fig.3.2: Struttura tridimensionale della P-glicoproteina
Sono state proposte varie configurazioni per la P-gp. L’ipotesi più accreditata sembra essere quella secondo cui la molecola presenta due porzioni identiche, unite da un tratto, detto linker, formato da 60 amminoacidi.
20
Ogni costituente del tandem, composto da 610 amminoacidi (Loo TW e Clarke DM, 1999; Jones PM e George AM, 1998), è costituto da due unità funzionali:
1) l’una costituita da sei TMD (domini transmembranali), formati da una corta ripetizione di segmenti idrofobici alloggiati all’interno della membrana cellulare e composti da 6 catene polipeptidiche con struttura ad -elica. Affinché la proteina di trasporto sia attiva, occorrono almeno 2 TMD, che si leghino ad altri 2 TMD di un’altra proteina ABC. Durante il trasporto di substrati, avviene una cooperazione tra le due proteine ABC e uno stretto accoppiamento molecolare dei TMD delle proteine stesse.
La posizione dei TMD determina la formazione di tre piccoli loop esterni e di un largo dominio citoplasmatico, chiamato NBD (dominio ATP-binding);
2) l’altra formata da due NBD, idrofobici, situati intracellularmente verso la superficie citoplasmatica, ognuno costituito da 200-250 amminoacidi idrofilici e contenenti un sito legante i nucleotidi avente la funzione di accoppiare l’idrolisi dell’ATP al processo di trasporto (Loo TW e Clarke DM, 1999).
Nella sequenza primaria, gli NBD sono definiti da tre walker (Walker A, Walker B e Walker C), conservati, tutti coinvolti nel legame con l’ATP, nella sua idrolisi e nel trasferimento dell’energia, e dall’ABC signature, anch’essa conservata (Hrycyna CA et al., 1999).
21
Per la funzione della glicoproteina è richiesta la presenza contemporanea di entrambi gli NDB (Ueda K et al., 1999), anche se è cataliticamente attivo solo un sito alla volta (Sun J et al., 2004).
Il riconoscimento del substrato e il legame dell’ATP sono indipendenti l’un l’altro. L’ATP non è necessaria per il legame del substrato alla P-gp, ma solo per il suo trasporto.
Il linker tra i due costituenti del tandem è fosforilato da una proteinchinasi permettendo così il collegamento delle due metà della glicoproteina in un’intima struttura funzionale
La sequenza transmembranaria della P-gp (in particolare, i domini transmembranari TM 4-6 e TM 11-12) mostra un alto grado di donatori di legami a H. Questo fa pensare che essa possa interagire con accettori di legami a H posti sui composti substrato (Seelig A et al., 2000). L’affinità del legame alla P-gp, infatti, aumenta con la forza e il numero di siti accettori di legame ad idrogeno del substrato (Teodori E et al., 2002).
La P-gp trasporta una notevole varietà di substrati, ma non è ancora stato identificato un comune sito di interazione.
Esperimenti di marcatura della P-gp attraverso l’uso di analoghi dei substrati hanno permesso di identificare due regioni, una più vicina all’estremità N-terminale, l’altra all’estremità C-N-terminale, che potrebbero essere coinvolti nel legame con i substrati (Ueda K et al., 1999):
- TMD4-6 e la regione citoplasmatica adiacente (immediatamente seguente) - TMD11-12 e la regione intracellulare immediatamente seguente
22
La presenza di due siti di legame può giustificare la capacità di legare sostanze non correlate tra di loro. Il substrato potrebbe legarsi ad uno solo o ad entrambi questi siti. Altri dati suggeriscono che i due siti mostrano una cooperazione positiva per il legame del substrato e per il suo trasporto (Garrigos M et al., 1997).
3.3 Ruolo della P-gp nel sistema immunitario
Negli ultimi 20 anni, l’attenzione di molti gruppi di ricerca si è focalizzata sul ruolo della P-gp nell’immunologia. La sua espressione è stata, infatti, riscontrata in molteplici cellule immunitarie.
Nelle cellule natural killer e nei linfociti T CD8+ risulta costitutivamente espressa a livelli abbastanza elevati. Tali cellule hanno la funzione di legare le proprie cellule bersaglio e di indurre morte cellulare attraverso il sistema Fas/Fas ligando o, nella maggior parte dei casi, attraverso il rilascio di granuli citotossici, come la perforina e il granzima. L’espressione della P-gp potrebbe promuovere l’attività citotossica di tali cellule (Gupta S., 1992), anche se non è ancora noto se essa sia necessaria per il legame con la cellula target e/o induca il processo citolitico (Johnstone RW, 2000). La P-gp, inoltre, potrebbe avere la funzione di proteggere tali cellule immunitarie da una lisi diretta o indiretta causata dall’ambiente ostile in cui avviene la risposta immunitaria (Johnstone RW, 2000). La presenza della P-gp non sembra essere correlata, invece, con il trasporto di IL-6.
23
Per quanto riguarda le cellule dendritiche, Schroeijers AB e coll. (2002) rivelano una debole espressione della P-gp allo stadio immaturo, che incrementa moderatamente in seguito a maturazione. Attraverso studi funzionali, tuttavia, essi assumono che la tale proteina non funziona a questo livello come trasportatore transmembranario, bensì la sua attività sarebbe correlata ad un processo differente, ancora non noto.
Recentemente, alcuni lavori hanno proposto un coinvolgimento della P-gp nella migrazione delle DC attraverso i vasi verso i linfonodi linfatici (Randolph GJ et al, 1998; Van de Ven R et al., 2008). Il suo ruolo non è ancora esattamente conosciuto, ma si ipotizza che esso coinvolga il trasporto di glico- e lisofosfolipidi, incluso il fattore attivante le piastrine, già noto come substrato della P-gp. Anche in questo caso, la P-glicoproteina sembra modulare la migrazione attraverso la regolazione del trasporto di citochine, quali IL-1β, IL-2, IL-4, TNF e IFNγ (Mizutani T et al., 2008). Inoltre gli Autori propongono un ruolo importante della proteina nella migrazione transendoteliale delle DC e dei linfociti durante la risposta immunitaria.
Secondo alcuni studi (Van de Ven R et al., 2006; Bebawy M e Sze DM, 2008), la P-gp partecipa anche alla differenziazione delle cellule dendritiche. In particolare, Pendse SS e coll. (2006) hanno dimostrato che essa esplica la sua azione attraverso una via IL-12-dipendente. Poiché le DC esprimono il recettore per l’IL-12 e poiché l’IL-12 agisce sulle DC promuovendo l’attivazione del fattore nucleare NF-kB, evento cruciale per l’inizio della maturazione delle DC, la P-gp determinerebbe la differenziazione dei
24
monociti in DC, favorendo lo sviluppo della capacità di queste APC di stimolare la risposta delle cellule T alloimmuni di tipo Th1. Gli stessi autori sottolineano, inoltre, come un blocco della P-gp induca una riduzione della capacità stimolatoria dei linfociti da parte delle DC a causa di una diminuita secrezione di IFN-γ; al contrario, la capacità di attivare la produzione di IL-5 non è influenzata da tale blocco. Questo effetto potrebbe spostare la risposta immunitaria verso una risposta di tipo Th2.
3.4. La Localizzazione
In condizioni fisiologiche, la P-gp è espressa in numerosi organi e distretti tissutali, sia nell’uomo che in varie specie animali. In particolare questa proteina è localizzata a vari livelli:
Epatico: sulla superficie biliare degli epatociti e su quella apicale delle cellule epiteliali dei canali biliari; qui gioca un ruolo significativo nei processi di secrezione di endo e xenobiotici attraverso la membrana canalicolare della bile.
Intestinale: sulla superficie luminale delle cellule epiteliali della mucosa del colon e del digiuno, dove svolge un ruolo cruciale nella regolazione dei processi di assorbimento di una serie di sostanze chimiche, inclusi certi farmaci.
Renale: sull’orletto a spazzola del tubulo contorto prossimale dove è coinvolta nell’attività di secrezione di molti farmaci e neurotossine.
25
Surrenale: sulla superficie delle cellule sia della corticale che della midollare.
Pancreatico: sul versante apicale delle cellule dei piccoli dotti escretori.
BEE: nelle membrane luminali delle cellule del rivestimento endoteliale dei capillari cerebrali, che limitano l’accesso dei farmaci nel SNC. A livello cerebrale, la glicoproteina sembra essere attiva anche nel rilascio di neurotrasmettitori o neuromodulatori (oppioidi, endorfine) direttamente dal cervello al sangue. Questa capacità di pompare sostanze attive dal cervello verso la periferia, potrebbe essere un importante meccanismo attraverso il quale il SNC modula il SNP.
Cellule della placenta: la sua espressione a questo livello potrebbe essere importante ai fini della protezione del feto contro agenti potenzialmente teratogeni; quindi l’uso di inibitori della P-gp durante la gravidanza deve essere attentamente valutato.
Cellule staminali ematopoietiche: se questo tipo di cellule la sovraesprimono, proliferano maggiormente (probabilmente influenza le decisioni di autorinnovo nelle cellule staminali che si ripopolano)
Cellule NK: se a questo livello la proteina viene inibita, cala l’attività citolitica di queste cellule.
Cellule dendritiche: qui hanno un ruolo importante nella migrazione delle cellule dendritiche presentanti l’antigene.
26
Linfociti T e B: ricopre un ruolo importante soprattutto nei linfociti T durante la risposta immunitaria, probabilmente perché regola il trasporto di alcune citochine (in particolare IL-1β e TNF).
3.5. Substrati
ll substrato tipico della P-gp è rappresentato da una molecola altamente idrofobica, anfipatica, con un anello planare, di peso molecolare maggiore di 400 Da e una carica positiva netta a pH 7.4 (Huls M et al., 2008).
Tuttavia, la P-gp può trasportare anche composti neutri, composti con gruppi carbossilici caricati negativamente, composti idrofilici e composti con peso molecolare minore di 400 Da.
Alcuni autori (Teodori E et al., 2002) hanno suggerito che i minimi requisiti che deve avere un substrato della P-gp sono un atomo di azoto basico (protonato a pH fisiologico) e due domini planari aromatici, uniti ad un gruppo amminico secondario o terziario tramite un unico ponte alchilico.
Di fatto la P-gp è in grado di interagire con un’ampia gamma di composti strutturalmente non correlati, fra cui i seguenti farmaci:
Neurolettici Fenotiazina, tioxantene, flupentixol Bloccanti dei
canali del
27
calcio
Antitumorali Daunorubicina, doxorubicina, tamoxifene, etoposide, topotecan vincristina, vinblastina Ciclosporine Ciclosporina A Antimalarici chinacrina Glucoside cardiaco Digossina Ormoni steroidei
Progesterone, testosterone, desossicorticosterone Agenti antimicotici Itraconazolo, ketoconazolo Inibitori delle proteasi HIV Indinavir
Molti di questi substrati in realtà sono definiti modulatori MDR, in quanto sono in grado di legarsi alla P-gp, occuparne il sito allosterico e inibirla (Avendano C et al., 2002).
Sono stati sviluppati anche inibitori selettivi e potenti della P-gp (detti modulatori di seconda generazione), quali tariquidar, valspodar, zosuquidar, ONT-093 (Thomas H e Coley H M, 2003).
Tra i substrati della P-glicoproteina, è stata posta l’attenzione anche su dei principi attivi di origine naturale.
28
Lo studio dell’influenza delle sostanze di origine naturale sulla P-glicoproteina è di particolare rilievo dal punto di vista clinico, in quanto tale meccanismo potrebbe essere implicato nell’interazione farmaco-alimentazione (Sun J et
al., 2004). L’assunzione di preparazioni di origine naturale, infatti, potrebbe
condizionare la farmacocinetica di farmaci somministrati contemporaneamente. Questo aspetto necessita di essere valutato in maniera più sistematica, al fine di diminuire il rischio di effetti indesiderati (Hansen TS e Nilsen OG, 2009).
Numerosi composti naturali hanno mostrato un’azione inibente sulla P-gp. Tra questi ricordiamo i polifenoli del the verde (flavonoli o catechine, Jodoin J
et al., 2002), la caffeina, la teamina, il resveratrolo del vino rosso, la
curcumina dei rizomi della Curcuma longa (Romiti N et al., 2008), le furano cumarine del pompelmo e la quercetina (Sun J et al.,2004).
Anche composti presenti in estratti di Echinacea, hanno evidenziato una proprietà inibente sulla P-gp.
Romiti N e coll. (2008) analizzando i principi lipofili (due poliacetileni e tre polieni isolati dagli estratti n-esanici) nell’estratto di radice delle tre specie medicinali di Echinacea, evidenziano una significativa capacità inibitoria da parte di alcuni di questi e mostrano come, secondo il loro studio, i composti estratti da E. pallida sono più attivi, rispetto a quelli provenienti dalle altre due specie, nel ridurre la funzione della P-gp.