CAPITOLO 1: INTRODUZIONE
A più di venti anni dalla sua scoperta la sindrome da immunodeficienza acquisita (AIDS), causata dal virus dell’immunodeficienza umana (HIV), continua ad essere una malattia di proporzioni colossali. Secondo dati stimati dall’Organizzazione Mondiale della Sanità ad oggi vi sono 40 milioni di individui infetti nel mondo e circa 16 mila nuovi casi al giorno. Lo sviluppo di un vaccino efficace e sicuro, capace di conferire una protezione duratura ad ampio spettro contro HIV, è perciò un obbiettivo di primaria importanza per controllare questa pandemia. Tuttavia, nonostante molti anni di intense ricerche, questo si rivela ancora un arduo e difficile compito. Molti tentativi di sviluppare un vaccino sono stati rallentati in parte dalla difficoltà di definire chiaramente i meccanismi specifici che intervengono nella risposta immunitaria contro il virus, in parte da caratteristiche specifiche del virus stesso. Ostacoli importanti nello sviluppo di un vaccino sono: la complessa interazione virus-cellula, il ciclo vitale e l’alto tasso di mutazione a cui esso va incontro (Giri et al., 2004). Nel primo caso i siti di legame delle glicoproteine dell’envelope virale per il recettore (CD4) e i corecettori cellulari (CXCR4 e CCR5), che intervengono nel legame e nella fusione del virus con la membrana della cellula ospite sono altamente conservati ma sono anche altamente protetti dal virus proprio perché esplicano un ruolo cruciale nell’infezione cellulare (Carnec et al., 2005; Yi et al., 2005). Questa protezione è data dal fatto che il virus scherma questi siti agli anticorpi neutralizzanti tramite regioni altamente variabili non coinvolte direttamente nell’interazione recettore cellulare-antirecettore virale e tramite regioni altamente glicosilate che oltre a essere poco immunogeniche creano un ingombro sterico che impedisce agli anticorpi di raggiungere quei siti conservati. Nel secondo caso la capacità del virus di integrare il suo genoma all’interno di quello della cellula ospite e di rimanere sotto forma latente
di provirus favorisce l’elusione da parte del sistema immunitario data l’assenza di un’espressione significativa di proteine (Finzi and Siliciano, 1998). Infine l’alto tasso di errore della trascrittasi inversa (RT) durante la retrotrascrizione è causa della grande ipervariabilità del virus (Preston, 1997). È stato stimato infatti che in 10 anni il virus può andare incontro a una variazione genetica pari a quella che un essere umano subirebbe nel corso di milioni di anni (Nowak et al., 1995).Questa variabilità permette al virus di eludere facilmente il sistema immunitario e inoltre dà origine ad un ampio spettro di varianti virali (Korber et al., 2001; McCutchan, 2000) cosa che rappresenta un grosso problema per lo sviluppo di un vaccino efficace contro l’AIDS.
1.1 FIV COME MODELLO ANIMALE PER LO SVILUPPO E
VALIDAZIONE DI APPROCCI VACCINALI
Lo sviluppo di un sistema modello animale è fondamentale per la realizzazione di strategie di vaccinazione efficaci contro il virus oltre per chiarire i meccanismi patogenici della malattia e per sviluppare terapie farmacologiche.
Quando, nel 1987, Pedersen e i suoi collaboratori isolarono dai leucociti di sangue periferico di un gatto domestico un virus (FIV) con caratteristiche simili a HIV immediatamente realizzarono il suo grande potenziale nell’usarlo come modello animale per effettuare studi sul virus dell’immunodeficienza umana (Pedersen et al., 1987).
FIV mostra infatti caratteristiche biochimiche e morfologiche simili a HIV, ne condivide il tropismo in vitro e l’effetto citopatico (ECP) su linfociti T e macrofagi e induce nel gatto, l’ospite naturale, un’infezione che causa una progressiva compromissione delle funzioni immunitarie, culminando in una sindrome analoga all’AIDS, denominata feline-AIDS (FAIDS) (Bendinelli et al., 1995; Yamamoto et al., 1991).
L’uso di FIV come modello animale, rispetto agli altri modelli utilizzati per lo studio delle infezioni da lentivirus, come il virus dell’immunodeficienza della scimmia (SIV), offre numerosi vantaggi quali la reperibilità di ospiti naturalmente infetti, il minor costo per l’acquisto e la stabulazione degli animali e l’assenza di rischio di contagio per il personale dal momento che non è mai stata riportata l’infezione umana da FIV.
Data la notevole diffusione di FIV in tutto il mondo la scoperta di un vaccino potrebbe essere molto importante non solo nella lotta contro l’AIDS ma anche in ambito veterinario.
1.2 ESPERIMENTI DI VACCINAZIONE
I primi approcci vaccinali testati sul modello FIV sono stati approcci convenzionali: infatti i primi esperimenti effettuati hanno previsto l’impiego di virus intero inattivato o cellule infette inattivate (Uhl et al., 2002). Questo tipo di vaccinazione ha mostrato che l’utilizzo di un singolo ceppo di FIV può proteggere l’animale contro un ceppo omologo mentre solo moderatamente contro un ceppo eterologo (Hosie et al., 2000; Elyar et al., 1997). Al contrario alcuni studi hanno mostrato un aumento dell’infezione da FIV (Karlas et al., 1999) anche se le differenze tecniche nella procedura di inattivazione, i tipi cellulari utilizzati per la crescita del virus, gli adiuvanti usati, la dose di vaccino e la variabilità della virulenza fra i diversi ceppi possono influire sui risultati degli studi effettuati (Hosie et al., 2000).
Sia il vaccino con virus intero inattivato, sia con cellule infette inattivate inducono una forte immunità umorale e cellulo-mediata contro il virus: oltre ad alti livelli di anticorpi contro l’envelope e le proteine del core si determina lo sviluppo di una risposta citotossica contro ceppi sfidanti cresciuti in vitro (Flynn et al., 1996). La protezione conferita da simili vaccini sembra efficace nell’indurre risposta immune in vivo (Matteucci
et al., 2000) anche se la protezione conferita è di breve durata e limitata ad un ceppo sfidante omologo (Matteucci et al., 1997). Un approccio recentemente sperimentato prevede l’uso contemporaneo di ceppi FIV appartenenti a diversi sottotipi: la combinazione dei virus inattivati appartenenti ai ceppi A e D ha dimostrato nei gatti una buona protezione sia da virus omologhi sia da virus eterologhi isolati in vivo (Pu et al., 2001). Dopo l’immunizzazione, dai peripheral blood
mononuclear cells (PBMC) dei gatti sono stati testati i livelli di mRNA per
le citochine (IFNγ, IL-2, IL-4, IL-6, IL-10) e le molecole effettrici citotossiche (perforine, FasL, TNFα). Queste molecole sono normalmente prodotte dai linfociti T helper (Th) e citotossici (CTL) come fattori solubili ad azione antivirale e linfoproliferativa. I risultati ottenuti hanno evidenziato che dopo la vaccinazione c’è stato un sostanziale incremento dei livelli di mRNA per le citochine e le molecole citotossiche effettrici rispetto al profilo di queste stesse sostanze misurate prima della vaccinazione, a indicare che questo tipo di vaccinazione duale induce una forte risposta cellulare che coinvolge sia i Th che i CTL (Omori et al., 2004).
Una nuova strategia, recentemente sviluppata, mira a indurre sia una risposta di tipo umorale sia cellulare combinando due o più modalità vaccinali. Questo metodo, denominato prime-boost, combina un priming ovvero una pre-immunizzazione del sistema immune con DNA veicolante l’antigene target, che ha l’obbiettivo di innescare una forte risposta immunitaria di tipo cellulo-mediato, seguita da un boost costituito da peptidi sintetici o un vettore ricombinante ad alta efficienza (Woodland, 2004; McShane, 2002). In generale il priming determina la presentazione dell’antigene target da parte delle antigen
presenting cells (APC) presenti al sito di inoculo che dovrebbero
stimolare le cellule T immature nei linfonodi e guidare l’espansione delle cellule T specifiche; il boosting seguente porta invece alla ripresentazione dello stesso antigene alle APCs che in questo caso portano all’espansione delle cellule T di memoria e, sinergicamente, alla
selezione delle cellule T che hanno maggior avidità per l’antigene target (Woodland, 2004). Questo nuovo modello vaccinale, testato nel modello SIV, ha dato buoni risultati, dimostrando di evocare una risposta immune protettiva contro challenge patogeni (Amara et al., 2001; Letvin et al., 2004; O'Neill et al., 2002).
Un’altra strategia che rispetto alle metodiche classiche presenta numerosi vantaggi (maggior sicurezza, facile preparazione, maggiore risposta cellulare, possibilità di presentare la proteina virale nella conformazione nativa) è rappresentata dalla vaccinazione a DNA che consiste nell’utilizzo di DNA plasmidico codificante per un immunogeno. Una volta iniettato nell’animale viene captato da alcune cellule dove il plasmide rimane sotto forma di episoma; qui può avvenire l’espressione delle proteine codificate e quindi dell’immunogeno, direttamente dalle cellule che presentano l’antigene (APC) in maniera naturale, associato all’ MHC di classe I (Gurunathan et al., 2000; Leitner et al., 1999). La sintesi dell’antigene in vivo può aumentare l’induzione dell’immunità cellulo-mediata e può garantire la sua presentazione nella corretta conformazione e glicosilazione. La risposta immunitaria ottenuta dipende non solo dal tipo di immunogeno ma anche dal tipo di adiuvante usato: particolarmente incoraggianti sono stati i risultati con adiuvanti immunologici naturali fra cui molte citochine e in particolare il granulocyte-macrophage colony-stimulating factor (GM-CSF) il quale sembra costituire un valido ausilio negli approcci di vaccinazione (Warren and Weiner, 2000). Il GM-CSF avrebbe il ruolo di stimolare il differenziamento e la maturazione delle cellule dendritiche (DC) (Haddad et al., 2000) hanno un ruolo fondamentale nell’induzione della risposta immune in quanto hanno la capacità di captare il DNA-vaccino per poter poi esprimere e presentare l’antigene codificato. Questa citochina avrebbe anche effetti simili sui macrofagi, altro tipo di cellule capaci di presentare l’antigene (Tadokoro and de Almeida Abrahamsohn, 2001), quindi favorisce in vivo la captazione e la presentazione dell’antigene da parte delle DC e macrofagi (Sun et al., 2002).
Un altro approccio vaccinale prevede l’impiego di subunità ricombinanti quali proteine virali ricombinanti e peptidi sintetici.
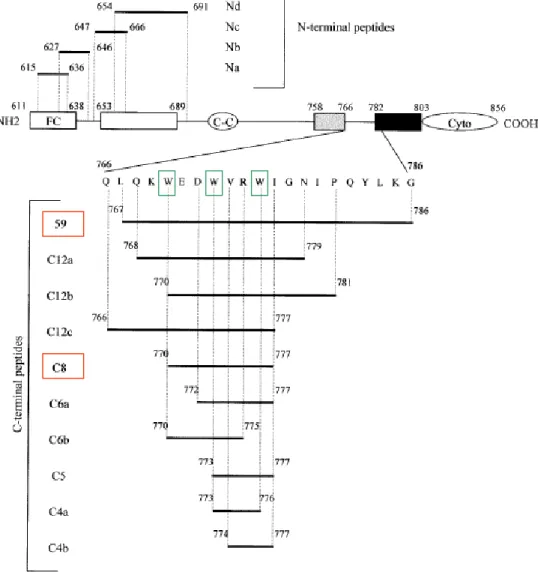
Lo studio di peptidi antivirali derivanti dalla porzione amino-terminale o carbossi-terminale della TM sono attualmente in valutazione sia per il loro potenziale terapeutico che di profilassi. L’utilizzo di questi peptidi come immunogeni può indurre una risposta umorale neutralizzante verso quegli epitopi che sono normalmente inaccessibili e celati agli anticorpi proprio per il loro diretto coinvolgimento nella fusione con la membrana cellulare.
Più di 60 peptidi sintetici di 20-23 aminoacidi, parzialmente sovrapposti e che ricoprono l’intera sequenza delle glicoproteine di superficie (SU) e transmembrana (TM) dell’isolato Petaluma di FIV sono stati usati per investigare i domini dell’Env coinvolti nell’infezione virale (Lombardi et al., 1994). Fra questi alcuni hanno rivelato una notevole azione inibitoria, in particolar modo quelli derivanti dalla regione esterna della TM. Anche in HIV un peptide sintetico, detto DP178, che inibisce la replicazione in vitro è localizzato vicino la regione prossimale della TM (Kilby et al., 1998).
La TM presenta infatti un inusuale cluster di aminoacidi aromatici, in particolare una regione ricca in triptofano (Trp) che è particolarmente conservata in tutti i lentivirus sebbene ci possano essere delle piccole differenze nel numero di residui Trp contenuti, nella lunghezza della regione nella quale sono interspersi, nelle proprietà degli altri aminoacidi presenti e nella distanza fra i residui Trp gli uni dagli altri (Giannecchini et al., 2004) (figura 1)
Figura 1: allineamento della sequenza della regione ricca in Trp della TM dei lentivirus. I riquadri neri indicano i residui Trp, i riquadri grigi altri aminoacidi aromatici oltre ai Trp, i riquadri bianchi gli aminoacidi idrofobici, le lettere in grassetto indicano aminoacidi variabili (da Giannecchini et al., 2004, Virology)
Questo ha fatto ipotizzare che questa regione abbia un ruolo cruciale nelle funzioni esercitate da questa proteina, cioè nella fusione del virus con la membrana cellulare e nella sua entrata all’interno della cellula ospite. A dimostrazione di ciò, in HIV, sono stati effettuati studi che hanno chiaramente dimostrato che delezioni o mutazioni della regione ricca in Trp aboliscono la capacità fusogenica di HIV e ne bloccano l’entrata nella cellula (Munoz-Barroso et al., 1999; Salzwedel et al., 1999; Bar and Alizon, 2004; Dimitrov et al., 2003). In FIV, il motivo Trp consiste di tre Trp egualmente distanziati localizzati alle posizioni 770, 773, 776 che sono conservati in tutti gli isolati sequenziati e che anch’essi, in varia misura, si sono dimostrati essenziali per l’infettività del virus (Giannecchini et al., 2004).
Un altro studio è stato effettuato su peptidi sintetici di 20 aminoacidi ricoprenti l’intera regione prossimale della TM per testare la loro attività antivirale (figura 2). Particolarmente interessante è risultato il peptide 59 e suoi derivati più piccoli che hanno mostrato di inibire la replicazione virale in tutti gli isolati testati (Giannecchini et al., 2003).
Figura 2: rappresentazione schematica della TM di FIV e dei peptidi sintetici da essa derivati (da Giannecchini et al., 2003, Journal of Virology)
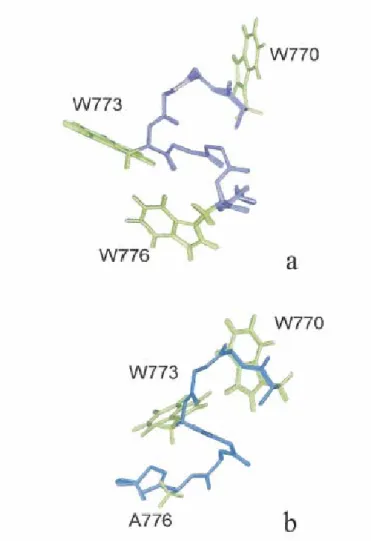
Anche in questo caso gli effetti inibitori sono dipendenti dalla conservazione di una regione contenente dei residui di Trp, in particolare una regione di 8 aminoacidi. L’attività di questo peptide derivato da questa regione, detto C8 (Giannecchini et al., 2003) dipende
dall’integrità del motivo Trp. È stato osservato infatti che sostituendo uno o tutti i residui Trp con Alanina l’attività antivirale di C8 diminuisce o scompare del tutto. Il C8 ha anche una conformazione stabile caratteristica non comune in peptidi di taglia così piccola.
Figura 3: Struttura tridimensionale del peptide C8 (a) e del suo analogo inattivo con Ala in posizione 776 (b) (da Giannecchini et al., 2003, Journal of Virology).
1.3 VETTORI VIRALI
Un approccio vaccinale di recente introduzione e che per altri virus sta dando risultati promettenti (Smith and Torres, 2001) consiste nella veicolazione di geni codificanti gli antigeni vaccinali (immunogeni) mediante vettori virali. L’introduzione dell’ immunogeno in APC può indurre una forte ed efficace risposta immunitaria contro patogeni in grado di eludere facilmente il sistema immunitario.
Questo approccio è reso possibile sfruttando la capacità che i virus hanno acquisito nel corso dell’evoluzione di rilasciare ed esprimere efficacemente il loro genoma all’interno della cellula ospite.
Numerosi tipi di virus, opportunamente modificati in modo da poter esprimere il gene d’interesse nelle cellule ma perdendo le proprietà infettive, sono utilizzabili per questo scopo: sia virus con genoma a DNA quali adenovirus, herpesvirus, virus adeno–associati sia virus a RNA quali i retrovirus (Van Tendeloo et al., 2001).
I vettori retrovirali sono i più studiati in quanto hanno la possibilità di trasportare fino a 10 Kb di DNA eterologo e di garantire un’espressione a lungo termine dei geni eterologhi grazie alla loro capacità di integrarsi stabilmente nel genoma della cellula ospite. Tuttavia, la maggior parte dei retrovirus non è in grado di attraversare la membrana nucleare e l’infezione è limitata alle cellule che vanno incontro a mitosi durante la quale la membrana si disgrega. Per questo motivo i vettori retrovirali possono essere utilizzati per tradurre solo cellule in attiva replicazione, ad esempio nella terapia anticancro ma non per patologie che coinvolgono cellule quiescenti quali il fegato, il tessuto muscolare, le cellule staminali ematopoietiche, il tessuto nervoso, cellule della retina (Naldini et al., 1996; Miyoshi et al., 1998). Questo ostacolo è stato superato tramite l’utilizzo di vettori derivati dai lentivirus: questo genere di retrovirus è in grado di replicare anche in cellule quiescenti poiché
ha evoluto un meccanismo di trasporto attivo al nucleo del complesso di pre-integrazione (Blomer et al., 1997).
Nella costruzione di un vettore lentivirale tutti gli elementi in cis, necessari per l’espressione genica sono mantenuti; i geni gag, pol ed env possono invece essere rimossi e forniti in trans attraverso l’uso di più plasmidi o con l’utilizzo di cellule helper ingegnerizzate (packaging cells) in grado di esprimere le proteine virali necessarie alla formazione della particella virale.
Questo tipo di strategia, che prevede l’impiego di più plasmidi, è necessaria per la sicurezza del vettore in quanto diminuisce il rischio di un evento di ricombinazione che potrebbe ricostituire un genoma replicazione-competente (Chong et al., 1998). È inoltre possibile modificare lo spettro d’ospite del virus fornendo una proteina dell’envelope eterologa nella particella virale, come, ad esempio, la proteina G del virus della stomatite vescicolare (VSV-G) che è capace di legarsi ad un recettore cellulare che è ubiquitario in tutte le cellule. Un’ulteriore garanzia di sicurezza è rappresentata dall’utilizzo di vettori di tipo self-inactivating (SIN) nei quali nella regione U3 dell’LTR in 3’ vengono deleti sia la TATA box sia i siti di legame per i fattori di trascrizione cellulari (Miyoshi et al., 1998). Poiché durante la retrotrascrizione l’U3 deleto al 3’ fa da stampo per generare l’LTR al 5’, il DNA provirale così sintetizzato ha entrambe le LTR inattive e una volta avvenuto il gene delivery non è più in grado di affrontare un altro ciclo di replicazione. L’impiego di vettori SIN diminuisce anche il rischio di indurre mutagenesi inserzionale per l’attivazione di proto-oncogeni cellulari che, in seguito all’inserzione, si vengono a trovare a valle dell’LTR (Trono, 2003) in quanto la delezione in U3 rende appunto le LTR inattive.
Una nuova e interessante alternativa ai vettori lentivirali correntemente usati è data da vettori derivati dai Foamy-Virus (FV) o Spumaretrovirus dato che questi virus non sono patogeni, non causano evidenti segni di malattia negli animali infettati e hanno un ampio spettro d’ospite, con
la capacità di infettare vari tipi di cellule di differenti specie. Queste caratteristiche danno ai vettori FV derivati opportunità uniche per veicolare transgeni in un numero di differenti tipi cellulari in vivo, efficientemente e con sicurezza (Russell and Miller, 1996; Rethwilm, 1995; Lochelt and Flugel, 1996; Bodem et al., 1997; Hill et al., 1999; Lecellier and Saib, 2000; Vassilopoulos et al., 2001).
Vettori replicazione-competenti derivati da FV felini (FFV) sono stati già sviluppati e testati a scopo vaccinale per l’immunizzazione di gatti contro le infezioni dal calicivirus felino (FCV), un virus altamente patogeno per i gatti nei quali induce una grave malattia con elevata mortalità soprattutto fra i cuccioli. Il vettore chimerico FFV-FCV che porta un segmento della proteina E capsidica del calicivirus induce infezioni persistenti e asintomatiche nel gatto e produce immunocompetenti nei quali è stato inoculato e induce una risposta immunitaria umorale contro le proteine dell’FFV e l’antigene capsidico dell’FCV (Schwantes et al., 2003).
1.4 I FOAMY-VIRUS
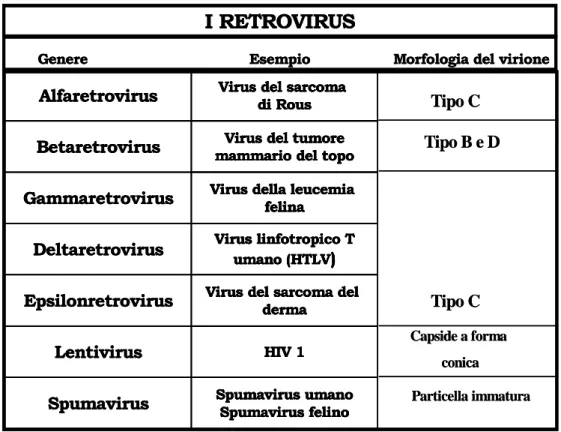
I Foamy-Virus, conosciuti anche come spumavirus o spumaretrovirus, appartengono alla famiglia delle Retroviridae (tabella 1). Da analisi dettagliate condotte in questi ultimi anni questo gruppo ha rivelato notevoli differenze dagli altri retrovirus tanto da essere classificati nella sottofamiglia Spumavirinae, distinta dagli Orthoretrovirinae che comprende tutti gli altri retrovirus conosciuti (Rethwilm, 2003).
Gli spumavirus sono altamente citopatici e mostrano ampio tropismo per diversi tipi cellulari di differenti specie (Hill et al., 1999). L’ampio range di cellule permissive all’infezione da FV riflette probabilmente l’ubiquità del recettore cellulare. In coltura portano ad una rapida formazione di sincizi, vacuolizzazione delle cellule (da qui il nome foamy = schiumoso) e morte cellulare (Linial, 1999).
I RETROVIRUS
Genere Esempio Morfologia del virione
Betaretrovirus Gammaretrovirus Alfaretrovirus Deltaretrovirus Epsilonretrovirus Lentivirus Spumavirus
Virus del tumore mammario del topo Virus della leucemia
felina Virus del sarcoma
di Rous
Virus linfotropico T umano (HTLV)
Virus del sarcoma del derma HIV 1 Spumavirus umano Spumavirus felino Tipo C Tipo B e D Tipo C Capside a forma conica Particella immatura
I RETROVIRUS
Genere Esempio Morfologia del virione
Betaretrovirus Gammaretrovirus Alfaretrovirus Deltaretrovirus Epsilonretrovirus Lentivirus Spumavirus
Virus del tumore mammario del topo Virus della leucemia
felina Virus del sarcoma
di Rous
Virus linfotropico T umano (HTLV)
Virus del sarcoma del derma
HIV 1 Spumavirus umano
Spumavirus felino Virus del tumore mammario del topo Virus della leucemia
felina Virus del sarcoma
di Rous
Virus linfotropico T umano (HTLV)
Virus del sarcoma del derma HIV 1 Spumavirus umano Spumavirus felino Tipo C Tipo B e D Tipo C Capside a forma conica Particella immatura
Tabella 1: classificazione dei retrovirus in base alla morfologia del virione
1.4.1 Epidemiologia
I FV sono molto diffusi e sono stati isolati da una grande varietà di specie di primati: gorilla, chimpanzée, babbuini, scimmie africane e numerosi altri. Mentre la prevalenza del Simian Foamy Virus (SFV) raggiunge oltre il 70% nei primati non umani, manca ancora l’evidenza di un’infezione da FV negli umani: un solo isolato da un individuo umano è disponibile. Questo unico ceppo, detto HFV (Human Foamy Virus) è stato ottenuto dal tessuto di un carcinoma nasofaringeo di un paziente africano. In base a studi immunologici e di sequenza sul ceppo è stato mostrato che HFV era chiaramente simile a un isolato derivato dall’African green monkeys (AGM), una specie di scimmia col quale l’uomo era stato in contatto e dalla quale era stato morso anni prima
(Schweizer et al., 1997). Per questo si suppone che l’infezione sia stata acquisita dalla scimmia dato che tutti i familiari dell’uomo con i quali ha avuto stretti contatti sono risultati non infetti. Oltre al gatto i FV infettano anche specie bovine (Bovine Foamy Virus) e altre specie quali leoni marini e criceti sebbene di questi ultimi non siano correntemente disponibili isolati virali. Nei gatti domestici si ha una sieropositività che varia dal 7 al 100% ed aumenta linearmente con l’età (oltre il 70% dei gatti sopra i 9 anni di età sono sieropositivi) (Winkler et al., 1999). Diverse modalità naturali di trasmissione sono state suggerite per l’infezione da FFV: queste includono la trasmissione verticale dalla madre ai gattini o tramite la saliva. Mentre nell’infezione da FIV si ha una maggiore proporzione di gatti maschi infetti rispetto alle femmine (in accordo con l’ipotesi che la principale modalità di trasmissione di FIV è dovuta dai comportamenti aggressivi, quali morsi, dei gatti maschi), le infezioni da FFV sono simili sia nei maschi che nelle femmine. Questo suggerisce che il modo predominante di trasmissione del FFV non avviene tramite il morso come per FIV ma la trasmissione avviene lentamente tramite contatti sociali intimi tra individui. Questa ipotesi si applica anche alla popolazione di gatti selvatici nei quali si ha una maggiore proporzione di femmine selvatiche infette (52%) rispetto ai maschi (23%) da FFV (Winkler et al., 1999).
1.4.2 Biologia molecolare
Come HIV e HTLV, i foamy virus sono retrovirus complessi nella loro costituzione genetica, nelle strategie di espressione genica e nelle interazioni con l’ospite e le cellule infettate (Lochelt, 2003). Tuttavia dietro queste somiglianze i FV hanno diverse caratteristiche uniche. Il genoma è un filamento lineare a polarità positiva dalle 11 alle 13 Kb ed è uno dei più grandi fra tutti i retrovirus (figura 1.4.3).
U 3 R U 5 PR -R T R H IN E lp SU T M bel 1 bel 2 bet U 3 R U 5 gag pol env LTR-prom oter IP U 3 RR U 5U 5 PR -R T R H IN E lp SU T M bel 1 bel 2 bet bet U 3 R U 5 U 3 RR U 5U 5 gag pol env LTR-prom oter IP
Figura 1.4.2: organizzazione genomica dei FV
In aggiunta ai geni gag, pol ed env e gli elementi regolatori localizzati in entrambe le LTRs, che sono comuni a tutti i retrovirus, il genoma dei FV contiene altre tre open reading frame (bel1, bel2, bet). Queste sono risultanti da eventi singoli o multipli di splicing e sono prevalentemente espresse dal promotore interno (IP) localizzato vicino l’estremità 3’ del gene env .
La presenza di un IP funzionalmente attivo è una caratteristica distintiva dei FV (Lochelt et al., 1993). Sia l’LTR che l’IP richiedono l’espressione di un transattivatore post-trascrizionale, Bel1, per alti livelli di espressione genica e l’infettività. Il promotore interno ha, in confronto al promotore LTR, una più alta attività basale e una più alta affinità per Bel1. Così, dopo l’integrazione del virus nella cellula ospite, l’attività basale dell’IP guida l’espressione di Bel1 che a sua volta trans-attiva l’IP. Quando i livelli di Bel1 raggiungono una soglia critica avviene la transattivazione del promotore LTR che guida l’espressione delle proteine strutturali ed enzimatiche e la sintesi dell’RNA genomico (Meiering and Linial, 2002). A questo scambio nell’utilizzo dei promotori fa seguito uno slittamento temporale nell’espressione genica virale fra le proteine regolatorie precoci e quelle strutturali tardive, cosa che in HIV e HTLV è data dalle proteine regolatorie Rev e Rex (Cullen, 1992).
L’attività e le funzioni della proteina Bet, abbondantemente espressa nel citoplasma non sono completamente chiarite. Bet è codificata da un
evento multiplo di splicing nel quale la porzione N-terminale di Bel1 è
spliced in frame con l’ORF Bel2.
Bet è essenziale per l’infettività dei FFV attraverso meccanismi sconosciuti (Alke et al., 2001) e nei gatti infettati è espressa in differenti cellule dei diversi organi. La presenza di anticorpi contro Bet sono considerati avere valore diagnostico, almeno per HFV e SFVs (Hanh et al., 1994). La funzione di Bel2 è sconosciuta.
Un confronto fra la sequenza di gag dei FV con gli altri retrovirus ha mostrato che mancano due delle caratteristiche delle proteine Gag retrovirali quali la regione di maggiore omologia (MHR) nel dominio capsidico (CA) e i box di cisteina-istidina nel dominio nucleocapsidico (NC). Sebbene la funzione dell’MHR sia sconosciuta, i box Cys-His e i residui basici che li circondano sono importanti per il legame dell’RNA. Inoltre il processamento di Gag differisce da quello degli altri retrovirus: i differenti domini di Gag nelle particelle rilasciate non sono separati dalla proteasi virale, solo un taglio di un peptide C-terminale di 4 Kda viene rimosso (Enssle et al., 1997; Zemba et al., 1998) e solo due forme predominanti di Gag di 78 e 74 Kda sono riscontrabili in cellule infette. Diversamente dagli altri retrovirus, le proteine Pol sono espresse indipendentemente dallo spliced di Gag, non si forma una proteina di fusione Gag-Pol e Pol può essere specificatamente incorporato in un virione neo formato (Lochelt and Flugel, 1996). Un solo taglio avviene ad opera della proteasi virale (PR) ed è fra la trascrittasi inversa (RT) e l’integrasi (IN) che dà origine a due prodotti, PR-RT di 85 Kda e IN di 40 Kda. Questo è in contrasto con quanto avviene negli altri retrovirus nei quali Pol è tagliato nelle proteine PR, RT e IN.
Per i retrovirus convenzionali la sola proteina virale richiesta per la gemmazione da cellule infette è Gag: mutanti nei quali è stato completamente deleto il gene env producono virioni extracellulari che sono infettivi quando fusi in cellule tramite mezzi artificiali, quali il virus Sendai inattivato o polietilenglicole. Per i FV invece le proteine Env sono assolutamente richieste per la gemmazione della particella
(Baldwin and Linial, 1998; Pietschmann et al., 1999). In assenza delle proteine Env le particelle sono sintetizzate all’interno della cellula ma non si ritrovano nel surnatante della coltura. Non è possibile inoltre creare pseudotipi virali con glicoproteine da retrovirus murini quali il virus della leucemia murina (MLV) o con la VSV-G. Quest’ultimo fatto è abbastanza singolare poiché VSV-G è capace di complementare mutanti deficienti nelle glicoproteine dell’envelope di un vasto range di virus. L’analisi di sequenze di genomi di differenti isolati FV hanno rivelato che
pol è il gene maggiormente conservato mentre gag diverge più di env
(Tobaly-Tapiero et al., 2000). In tutti gli altri retrovirus env è invece meno conservato rispetto a gag (Wang and Mulligan, 1999). All’interno di una specie dei FV i genomi sono altamente conservati, solo per i FFV sono conosciuti due sierotipi (Winkler et al., 1998).
La replicazione dei FV differisce da quella degli altri retrovirus in alcuni aspetti: la trascrizione inversa sembra essere un evento tardivo nella morfogenesi virale e le particelle infettive probabilmente hanno genomi a DNA. I virioni maturi non contengono la proteina di matrice, la CA o NC ma sono composte invece di due grandi proteine Gag che differiscono al C-terminale per la rimozione di 3 Kda.
1.4.3 Patogenesi
Nonostante l’elevato effetto citopatico mostrato in vitro, i FV non sono patogenici nei loro ospiti infettati naturalmente o accidentalmente e sebbene l’infezione duri tutta la vita non ci sono i segni evidenti della malattia (Saib, 2003) caratteristica questa che li rende unici e li differenzia dagli altri retrovirus.
Questa particolarità ha aumentato l’interesse verso i FV negli ultimi anni in quanto come citato nel paragrafo precedente sono considerati promettenti candidati come vettori virali per la trasduzione di cellule staminali ematopoietiche o come vettori a scopo vaccinale
(Vassilopoulos et al., 2003; Vassilopoulos et al., 2001; Schwantes et al., 2003).
Un altro vantaggio per la loro utilizzazione come vettori è la loro stabilità genetica e la forte reazione immune virus-specifica a dispetto della mancanza di malattia nell’ospite infettato. La forte risposta umorale avviene contro le diverse proteine strutturali e non: la reazione contro Gag, Pol, Env e Bet comincia subito dopo l’infezione, aumenta nel tempo e rimane relativamente stabile ad alti livelli per un lungo periodo di tempo a indicare che il sistema immune è costantemente e periodicamente cambiato verso tutti gli antigeni virali (Alke et al., 2000). Questa reattività è indicativa di un’espressione genica virale costante, probabilmente associata alla continua produzione di infettività virale. Al contrario, l’immunità umorale contro i lentivirus è diretta inizialmente contro Env e gli anticorpi specifici per gli altri antigeni virali appaiono molto più tardi.