11
CON PERDITA DI SOSTANZA:
recenti acquisizioni
L’osso possiede la capacità intrinseca di rigenerare sia in risposta ad un danno, sia durante lo sviluppo scheletrico accrescitivo e sia nel ricambio tissutale che accompagna tutta la vita (Einhorn, 1998; Bates & Ramachandran, 2007; Khan et al., 2008).
La rigenerazione ossea è un complesso e ben orchestrato processo fisiologico di osteo-induzione e osteo–conduzione coinvolgente un vasto numero di cellule e fattori extra- e intra-cellulari, che si instaura abitualmente durante la guarigione ossea in corso di frattura, allo scopo di ottimizzare la riparazione e il recupero della funzione scheletrica (Johnson & Hulse, 2004). A differenza di altri tessuti, la maggior parte delle lesioni ossee guariscono con una completa “restitutio ad integrum”, ovvero con formazione di un tessuto che possiede esattamente le stesse caratteristiche del tessuto originario, senza formazione di tessuto cicatriziale (Einhorn, 1998). Ci sono, inoltre, delle complesse condizioni cliniche in cui la rigenerazione ossea diviene fondamentale e particolarmente ricercata soprattutto per il trattamento di difetti ossei di grandi dimensioni in esito a traumi, infezioni, resezioni di tumori, anomalie scheletriche o casi in cui è compromesso il fisiologico processo rigenerativo come per le necrosi avascolari e le non unioni atrofiche (Soucacos et al., 2008; Dimitriou et al., 2011).
Per tutti i suddetti casi, in cui il normale processo di rigenerazione ossea è o alterato o semplicemente insufficiente, vi sono attualmente una serie di trattamenti a disposizione del chirurgo, che possono essere usati, da soli o in combinazione, per facilitare la gestione clinica di queste complesse situazioni, che spesso possono essere non-responsive al trattamento e, altrettanto frequentemente,
12 rappresentano una sfida medica e socio-economica (De Long et al., 2007; Dimitriou et al., 2011).
L’approccio standard di maggior impiego, per stimolare e promuovere la rigenerazione ossea in lesioni di grandi dimensioni, include l’osteogenesi per distrazione o trasporto di osso con tecnica di Ilizarov (Green et al., 1992; Aronson, 1997) e l’uso di un ampio numero di innesti ossei quali l’osso autologo (Fleming et al., 2000; Sinibaldi, 2001; Giannoudis et al., 2005; Khan et al., 2008), l’osso allogenico (Carter, 1999; Giannoudis et al., 2005; Khan et al ., 2008), sostituti ossei e fattori di crescita (Giannoudis et al., 2005; Giannoudis & Einhorn, 2009).
DISTRAZIONE OSTEOGENICA E TRASPORTO DI OSSO
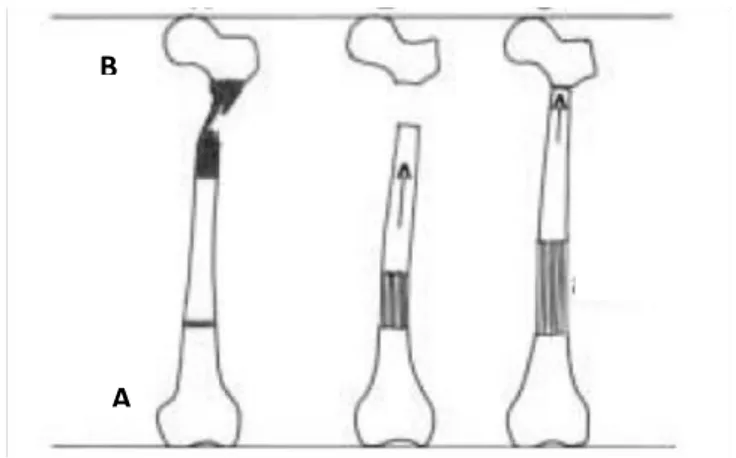
L’osteogenesi per distrazione, o distrazione osteogenica, si ha quando sull’osso corticale viene esercitata una graduale trazione tale da indurre una sollecitazione sufficiente a stimolare e mantenere la formazione di tessuto osseo neoformato (Johnson & Hulse, 2004). La tecnica fu messa appunto da Illizarov (1989) per ottenere l’allungamento osseo in persone affette da acondroplasia. Essa si basa sul principio di osteodistrazione per cui, applicando un graduale allontanamento (1mm al giorno) di un frammento dall’altro, durante il processo di guarigione, si stimola la neoformazione di tessuto osseo con allungamento dell’osso trattato (Green et al., 1992). Tale modello è stato ampiamente valutato per il trattamento di non-unioni, deformità angolari, fratture e altro. Interessante applicazione della metodica di Ilizarov è rappresentato dalla tecnica con trasporto osseo per il trattamento di lesioni ossee caratterizzate da difetti di grandi dimensioni in esito a traumi, infezioni o neoplasie (Aronson, 1997). Questa tecnica si basa sui principi di osteogenesi per distrazione postulati da Ilizarov e prevede l’impiego di fissatori esterni per trasportare gradualmente un frammento di osso da un moncone, cui è saldato, verso l’opposto (Figura I.1) in modo che l’osso neoformatosi per distrazione copra il gap derivante dalla perdita di sostanza (Barbarossa et al., 2001).
13 Sebbene la tecnica di Ilizarov, dalla sua prima applicazione (1969) abbia visto il superamento del problema di osteointegrazione e abbia consentito il trattamento di vari tipi di lesioni ossee, non si presenta scevra di complicazioni rappresentate, principalmente, da:
- Lunghi periodi di disagio per il paziente con controlli frequenti nel tempo per monitorare la stabilità dell’impianto di osteosintesi, l’assenza di segni di sepsi perimplantare, l’evoluzione del processo riparativo e l’esecuzione di una adeguata fisioterapia (Song et al., 1998; Abdel-Aal, 2006);
- Recidive di infezione ossea per scarso debridment dell’osso infetto (in caso di osteomielite) o infezioni dell’impianto con edema dell’arto trattato (Littlewood, 2011);
- Fallimento dell’unione dell’osso “navetta” al moncone di arrivo o ritardato consolidamento dell’osso neoformato (Green et al.,1992; Wiedel, 2002).
A B
Figura I.1 – Rappresentazione schematica tecnica di distrazione osteogenica (Barbarossa et al., 2001)
14
INNESTO OSSEO
La tecnica con impiego di innesto osseo è una procedura di frequente utilizzo in numerosi interventi di chirurgia ortopedica e maxillofacciale per stimolare la rigenerazione ossea (Bauer & Muschler, 2000; Dimitriou et al., 2011).
INNESTO AUTOLOGO
L’innesto di osso autologo (corticale o spongioso) rappresenta il trattamento gold standard in quanto possiede tutte le caratteristiche dell’innesto osseo ideale (Giannoudis et al., 2005; Dimitriou et al., 2011): osteoinduzione, osteoconduzione, osteointegrazione e osteogenesi.
Per osteoinduzione si intende la capacità di supportare la mitogenesi di cellule mesenchimali indifferenziate in cellule osteoprogenitrici (pre-osteoblasti) che porteranno alla formazione di nuovo tessuto osseo per attivazione di una cascata di segnali e di recettori intra- ed extra-cellulari (Cypher & Grossman, 1996; Giannoudis et al., 2005; De Long et al., 2007).
Con osteoconduzione si indica la capacità della matrice di promuovere l’adesione delle cellule pre-osteoblastiche favorendo il corretto orientamento dei vasi sanguinei e la creazione di nuovi sistemi Haversiani (Giannoudis et al., 2005).
L’osteointegrazione rappresenta la perfetta integrazione tra tessuto osseo ospite e impianto (Costantino & Freidman, 1994).
Osteogenesi è un termine relativamente recente, con il quale si intende la capacità da parte dell’innesto di stimolare la formazione di osso a partire da cellule indifferenziate (Cypher & Grossman, 1996; De Long et al., 2007).
Gli innesti autologhi sono considerati il supporto ideale per la rigenerazione in quanto contengono cellule osteogeniche, midollo osseo, una matrice di collagene osteoconduttiva che favorisce l’adesione degli elementi cellulari presenti e neoformati, nonchè proteine e altri fattori osteoinduttivi endogeni (Soucacos et al., 2008). Ulteriore fattore, di importanza tutt’altro che marginale, è la compatibilità che questo tipo di innesto presenta. Essendo, infatti, tessuto prelevato dallo stesso paziente, esso si presenta perfettamente istocompatibile con il sito ricevente e in
15 grado di ridurre al minimo la risposta immunogenica e la trasmissione di patologie infettive (Dimitriou et al., 2011).
L’innesto di osso autologo prevede il trasferimento di tessuto osseo, corticale o spongioso, da un sito donatore a uno ricevente (Sinibaldi, 2001). Il tessuto osseo spongioso ha un impiego maggiormente diffuso, soprattutto per fratture altamente comminute o con segmenti avascolarizzati, in quanto consente una precoce produzione di osso e un altrettanto rapido consolidamento. La tecnica prevede il prelievo, solitamente dalla cresta iliaca che consente un più facile accesso chirurgico, di quantità piuttosto abbondanti di tessuto osseo di buona qualità (Giannoudis et al., 2005; Dimitriou et al., 2011), privo, però, di resistenza meccanica (Sinibaldi, 2001). Il prelievo di osso corticale, non è altrettanto largamente diffuso, ma è da preferire in quelle situazioni in cui sia necessaria una resistenza meccanica maggiore, ad esempio, in caso di fratture con elevato grado di comminuzione, ampie osteotomie correttive in seguito a malunioni, pseudoartrosi, osteomieliti o resezioni di tumori ossei (Sinibaldi, 2001).
Sebbene l’uso di innesti ossei autologhi presenti un’ampia gamma di proprietà favorenti la rigenerazione ossea, altrettanto numerosi sono gli aspetti negativi ad esso legati quali: la necessità di un ulteriore intervento chirurgico per il prelievo dell’innesto e l’instaurarsi di complicazioni nel sito donatore come infezione, dolore cronico, fratture iatrogene o instabilità (Giannoudis et al., 2005); la possibilità del fallimento dell’innesto a causa della perdita degli elementi cellulari osteogenici che non sopravvivrebbero al trapianto (Sandhu et la., 1999); la scarsa presenza di siti donatori (Finkemeier, 2002).
INNESTO ALLOGENICO
Interessante alternativa all’impiego dell’innesto osseo autologo è stata trovata nell’innesto osseo allogenico o allotrapianto, che permette di superare tutte le problematiche legate alla raccolta del campione e della quantità di tessuto prelevato (Dimitriou et al., 2011). Questo tipo di innesto consiste nel prelievo di tessuto osso da un donatore (in vita o da cadavere) appartenente alla stessa specie
16 del ricevente (Carter, 1999; Finkemeier, 2002). Con il crescente interesse per questa tecnica si sono ampiamente sviluppate anche le banche dell’osso, che hanno il compito di analizzare, processare e conservare il tessuto osseo prelevato in modo da controllare la possibile presenza di infezioni limitandone la diffusione; elaborare l’osso in vari tipi di forme (pellets, paste, polveri ecc) e poterlo conservare in modo da fornire al chirurgo ortopedico la più ampia gamma di prodotti pronti per l’innesto sul paziente (Newman-Gage, 2001). L‘osso allogenico può essere, infatti, disponibile in varie preparazioni sotto forma di matrice ossea demineralizzata, di osso spongioso morcellizzato o in chips, di innesti corticali o cortico-spongiosi, di segmenti osteocondrali o porzioni ossee intere a seconda delle esigenze e della conformazione del sito di impianto (Dimitriou et al., 2011). Possiamo, inoltre, trovare allotrapianti in forma fresca, congelata o liofilizzata (Giannoudis et al., 2005).
Per poter essere impiegati, gli innesti allogenici, necessitano di processi di sterilizzazione miranti ad annullare la possibilità di trasmissione di patologie virali, infezioni batteriche, tumori, malattie autoimmuni o tossicosi. Tali processi comportano la devitalizzazione mediante irradiazione o liofilizzazione (Finkemeier, 2002) con conseguente perdita delle capacità osteoinduttive di questi impianti (Bos et al., 1983; Goldberg et al., 1991; Keating & McQueen, 2001; Giannoudis et al., 2005; Dimitriou et al., 2011). Gli allo-impianti freschi, presenterebbero, rispetto ai congelati e ai liofilizzati, capacità osteoinduttive maggiori, ma il loro impiego non presenta una vasta diffusione per l’elevato rischio di risposte immunitarie di rigetto o di trasmissione di patologie (Friedlaender et al., 1999). Gli innesti congelati e liofilizzati, per i processi di sterilizzazione cui vengono sottoposti, presentano minor rischio biologico ma non riescono a fornire i buoni risultati, in termini di rigenerazione, degli innesti autologhi (Giannoudis et al., 2005; De Long et al., 2007).
Matrice Ossea Demineralizzata
La matrice ossea demineralizzata o DBM è prodotta dalla decalcificazione dell’osso corticale allografico e processata per ridurre il potenziale infettivo e la
17 risposta immunogenica dell’ospite (Giannoudis et al., 2005; De Long et al., 2007). Essa, comunque, mantiene la struttura collagene trabecolare del tessuto originario e può, quindi, essere utilizzata come supporto osteoconduttivo biologico nonostante la perdita della resistenza strutturale posseduta dall’osso originario (Einhorn et al., 1984, Giannoudis et al., 2005). Essa mantiene, inoltre, un’ampia gamma di fattori di accrescimento ossei che risultano maggiormente biodisponibili garantendo al prodotto proprietà osteoinduttive maggiori rispetto agli innesti allografici standard (Sandhu et al., 1999; Fleming et al., 2000). L’uso della DBM, in gel, paste e altro, non ha dato risultati clinici uniformemente buoni (Giannoudis et al., 2005; De Long et al., 2007), ciononostante, è ampiamente usate come potenziatore degli impianti ossei, piuttosto che come sostituto osseo tale e quale (Sandhu et al., 1999; Sassard et al., 2000; Cammisa et al., 2004).
18
SOSTITUTI OSSEI
Negli ultimi 20 anni sono stati fatti importanti progressi nello sviluppo di tecniche chirurgiche per la rigenerazione ossea. L’ingegneria tissutale, al contempo, si è affermata come una delle tecniche più promettenti che ha portato allo sviluppo di numerosi sostituti ossei da usare in alternativa ai convenzionali innesti ossei autologhi e allogenici (Hutmacher, 2001; Calvert et al., 2003). Con il termine “sostituti ossei” si intendono strutture tridimensionali, dette anche scaffolds, prodotte con biomateriali sintetici o naturali, in grado di fornire un supporto strutturale al nuovo tessuto in via di formazione e di promuovere la migrazione, la proliferazione e la differenziazione di cellule ossee per la rigenerazione ossea (Giannoudis et al., 2005; Dimitriou et al., 2011).
Un’ampia varietà di polimeri naturali o sintetici è stata valutata per l’allestimento di scaffolds per la rigenerazione ossea (Hutmacher, 2000; Meyer et al., 2005), così come numerosi materiali inorganici quali le ceramiche bioattive sintetiche o naturali (Hench, 1991; Hench & Wilson, 1999).
MATERIALI INORGANICI
I materiali inorganici sono considerati bioattivi quando hanno la capacità di stimolare una risposta sull’interfaccia del materiale stesso, con formazione di un’interazione che stimoli la rigenerazione (Hench, 1991; Hench & Wilson, 1999). Sono considerati materiali inorganici le ceramiche ossee bioattive, in cui la fase di apatite di idrossicarbonato si presenta strutturalmente analoga alla fase minerale dell’osso e provvede a fornire un buon interfaccia per la rigenerazione ossea (Hench, 1991). L’Idrossiapatite (HA), il Tricalcio Fosfato (TCP) e i silicati bioattivi o biovetri sono considerati ceramiche ossee bioattive.
Biovetri
Questo gruppo di materiali vetrosi sono, appunto, dei silicati contenenti biossido di silicio (SiO2), ossido di sodio (Na2O), pentaossido di fosforo (P2O5), ossido di calcio (CaO) e altro che, interagendo con il substrato osseo, creano uno strato di Idrossiapatite carbonata che supporta e sostiene la crescita e l’adesione degli
19 osteoblasti (Gatti et al., 1994; Roether et al., 2002). I prodotti di dissoluzione dei biovetri incrementano l’espressione genica correlata all’osteogenesi e alla produzione di fattori di crescita (Xynos et al., 2000; Xynos et al., 2001). Sono materiali duri, non porosi, con capacità osteointegrative e osteoconduttive (Giannoudis et al., 2005), ma le scarse proprietà meccaniche e di resistenza alla frattura, ne limitano l’impiego per quei casi in cui è necessario sopportare un forte carico (Jones et al., 2006; De Long et al., 2007).
Idrossiapatite e Fosfato Tricalcico
Queste due ceramiche bioattive sono impiegate in ortodonzia e ortopedia sin dal 1980 e sono approvate per l’impiego come dispositivi medici dalla Food and Drug Administration (FDA). Possiedono una struttura chimica simile ai precursori ossei e per questo sono altamente biocompatibili (Giannoudis et al., 2005). Presentano proprietà osteoconduttive di supporto, differenziazione e proliferazione degli osteoblasti, ma non hanno proprietà osteoinduttive o osteogeniche (Lane et al., 1999; Giannoudis et al., 2005; De Long et la., 2007). Entrambe sono caratterizzate da una scarsa resistenza meccanica e da una lentissima degradazione (mesi o anni) con lunghi periodi di rimodellamento osseo (in particolare l’idrossiapatite). Questo ha spinto ad ampliarne l’uso più come promotori della rigenerazione in scaffolds ossei compositi piuttosto che come sostituti ossei veri e propri (Giannoudis et al., 2005; De Long et al., 2007).
POLIMERI NATURALI
Un vasto numero di polimeri di origine naturale sono stati proposti e studiati per l’allestimento di scaffolds per la rigenerazione ossea, soprattutto per il loro costo contenuto, la loro alta biocompatibilità e bassa tossicità (Yannas, 1996).
Collagene
Il collagene è una macromolecola biologica presente in abbondante quantità nella matrice extra-cellulare di numerosi tessuti quali pelle, osso, cartilagine, tendini, denti e altro, ai quali fornisce struttura e supporto meccanico (Lee et al., 2001). Grazie alla sua biocompatibilità, al basso potere antigenico e alla struttura
20 porosa, è stato attentamente valutato per applicazioni di ingegneria tissutale (Lee et al., 2001). È stato, infatti, dimostrato come gli scaffolds a base di collagene risultino in grado di promuovere l’adesione e la proliferazione cellulare e tissutale, e, contemporaneamente, di stimolare la formazione di osso per differenziazione degli osteoblasti (Fleming et al., 2000; Freyman et al., 2001). Il collagene presenta una degradazione piuttosto veloce che determina, altrettanto rapidamente, la perdita delle sue funzioni meccaniche. Questo lo rende scarsamente utilizzabile come materiale di impianto in sé e per sé, ma le sue proprietà sono ampiamente sfruttate quando usato in associazione a proteine morfogenetiche ossee, precursori osteogenetici o idrossiapatite in sostituti ossei compositi (Zerwekh et al., 1992; Chapman et al., 1997; Giannoudis et al., 2005).
Derivati delle fibre della seta
Utilizzate per decenni come suture in applicazioni biomediche, le fibre della seta rappresentano un interessante biomateriale per l’ingegneria tissutale ossea grazie alla loro buona biocompatibilità (Altman et al., 2003), bassa degradabilità (Horan et al., 2005) ed eccellenti proprietà meccaniche (Gosline et al., 1986). Gli scaffolds derivati dalla seta, associati a idrossiapatite o proteine morfogenetiche ossee, hanno mostrato in vitro buone capacità di sostenere e promuovere l’adesione e la proliferazione di cellule staminali mesenchimali (Jin et al., 2004; Li et al., 2006).
Polisaccaridi
Un’altra classe di polimeri naturali, con ampia diffusione nelle applicazioni biomediche, è rappresentata dai polisaccaridi che mostrano eccellenti proprietà di atossicità, solubilità in acqua e stabilità ai diversi pH, anche se, per contro, presentano scarsa resistenza meccanica e instabilità chimica (Barbosa et al., 2005). Rientrano in questa classe:
chitosano e derivati: polimero cationico naturale, biodegradabile, presenta una superficie idrofila che promuove l’adesione, la proliferazione e la differenziazione cellulare (Yannas, 1996). È caratterizzato da un’elevata biocompatibilità e osteoconduttività in vitro
21 e in vivo (Muzzarelli et al., 1994) ma anche da scarse proprietà di resistenza meccanica che ne hanno diffuso l’uso in associazione con altri materiali come l’idrossiapatite, il fosfato tricalcico, l’acido poli-L-lattico o il poli-metil- metacrilato (Hu et al., 2004);
acido ialuronico: polisaccaride lineare con elevato peso molecolare, è il principale componente della matrice extracellulare del tessuto connettivo presente nel cordone ombelicale, nelle sinovie e nell’umor vitreo (Mason et al., 1989). È caratterizzato da biocompatibilità e buone proprietà visco-elastiche, ma non è in grado di promuovere l’adesione cellulare e la proliferazione dei tessuti se non associato ad altri fattori (fibronectina, collagene e altro) (Ghosh et al., 2006);
alginati: estratti da tre tipi di alghe, sono altamente biocompatibili. Il loro impiego in ingegneria tissutale è stato diffuso in forma di gel, soprattutto per migliorare le performance di scaffolds solidi. La limitazione al loro impiego è data dalle difficoltà di sterilizzarli e manipolarli (Hutmacher, 2001);
materiali a base di amido: polisaccaride costituente i tessuti fotosintetici delle piante, è prodotto naturalmente in forma di granuli semi-cristallini di diversa forma e composizione, ed è totalmente biodegradabile (Bastioli, 1995). I materiali a base di amido sono comunemente miscelati con altri polimeri termoplastici per renderli più resistenti alla degradazione termo-meccanica, meno fragili e più malleabili (Salgado et al., 2007). L’allestimento di scaffolds compositi con derivati dell’amido, è stato proposto per numerose applicazioni biomediche fra le quali sostituti ossei e idrogel per il rilascio controllato di farmaci, ma la struttura e le proprietà funzionali di questi materiali sono strettamente legate alla miscela dei componenti, alla tecnica di processazione e alla natura degli additivi impiegati (Gomes et al., 2000; Gomes et al., 2002);
cellulosa: costituisce la più abbondante e rinnovabile risorsa di polimeri disponibile nel mondo. La cellulosa batterica, un nano-materiale
22 sintetizzato per via extracellulare dal batterio Acetobacter xylinum, presenta proprietà particolari di purezza, cristallinità, resistenza tensile e biocompatibilità (Bae & Shoda, 2004; Fang et al., 2009). Recentemente è stata impiegata per diverse applicazioni biomediche (vasi sanguinei e ferite cutanee) dove ha mostrato un buon grado di integrazione col tessuto ospite, senza evidenze di reazioni infiammatorie (Helenius et al., 2006);
destrani: sono omo-polisaccaridi sintetizzati da alcuni batteri lattici acidi (es. Leuconostoc mesenteroides) (Leathers, 2002). Presentano numerosi gruppi idrossilici laterali che li rendono suscettibili a modificazioni chimiche, consentendo l’allestimento di scaffolds con siti specifici per il legame con particolari cellule; per contro, però, presentano bassa resistenza meccanica e alla sterilizzazione (Lévesque et al., 2005; Liu & Chan-Park, 2010). Gli scaffolds compositi a base di destrano hanno mostrato, in vivo, a livello sottocutaneo, una buona biocompatibilità (Möller et al., 2007).
Poliesteri di origine microbica
Sono poliesteri sintetizzati da microorganismi procarioti o eucarioti (Doi & Steinbüchel, 2002).
I Poli(-idrossi-alcanoati) (PHA) sono poliesteri alifatici prodotti da batteri Gram-positivi e Gram-negativi (Schellauf et al., 2001) particolarmente interessanti per le applicazioni di ingegneria tissutale grazie alla loro biocompatibilità, biodegradabilità e maneggevolezza (Chen & Wu, 2005). Presentano, però, proprietà meccaniche limitate (Puppi et al., 2010a).
23 POLIMERI SINTETICI
I polimeri sintetici presentano proprietà chimiche, fisiche e di degradazione prevedibili e riproducibili, che possono essere modificate per soddisfare le esigenze specifiche di diverse applicazioni. Possono, inoltre, assumere forme e dimensioni desiderate ed essere miscelati tra loro o con altri materiali, come bio-ceramiche o materiali bioattivi naturali, in modo da poter ampliare l’ampia gamma delle loro proprietà (Puppi et al., 2010a). I rischi legati alla tossicità, immunogenicità e possibilità di infezioni sono ridotti tanto più il polimero sintetico è puro e con struttura molecolare semplice. Talvolta, però risultano carenti di fattori biologici che possono promuovere la risposta cellulare desiderata (Place et al., 2009).
Poliesteri alifatici saturi a catena corta
I poli-α-idrossiacidi sono polimeri sintetici biodegradabili ampiamente valutati per l’allestimento di scaffolds tridimensionali per la rigenerazione ossea e cartilaginea. Essi comprendono: l’Acido Poli-Glicolico (PGA), l’Acido Poli-Lattico (PLA) e i relativi copolimeri Poli(acido-Lattico-co-Glicolico (PLGA) (Kohn & Langer, 1996).
Tutti questi poliesteri sono stati ampiamente approvati dalla FDA per svariate applicazioni come suture, stents e altro. Possono essere tutti facilmente sottoposti a varie tecniche di processazione, così da poter modificare le loro proprietà fisiche, chimiche e di degradazione. Quest’ultima, procedendo in maniera casuale, per idrolisi dei legami esteri, può comportare, talvolta, il fallimento prematuro dello scaffold. Inoltre, il rilascio di prodotti di degradazione acida, può causare una forte risposta infiammatoria nel sito di impianto (Martin et al., 1996). La cinetica di degradazione di questi polimeri è influenzata da un ampio numero di fattori quali: le dimensioni dell’impianto, la sua composizione chimica e struttura, la fase cristallina o meno del materiale, il tipo di processo cui sono sottoposti per l’allestimento dello scaffold, le condizioni dei tessuti circostanti, la presenza o meno di additivi e l’idrofilicità complessiva (Heidemann et al., 2001; Rezwan et al., 2006).
24 Per contrastare la degradazione acida, che può causare reazioni avverse nei tessuti, e stabilizzare il pH, i polimeri possono essere combinati con composti basici quali le ceramiche bioattive e/o il fosfato tricalcico, che si sono, inoltre, mostrati in grado di incrementare le proprietà osteoconduttive e meccaniche di queste strutture polimeriche (Heidemann et al., 2001), nonché la differenziazione dei pre-osteoblasti (Chou et al., 2005).
Uno dei principali aspetti negativi di questo tipo di polimeri è rappresentato, anche, dalla loro idrofobicità, che può rappresentare uno svantaggio per la rigenerazione tissutale a causa della scarsa interazione cellulare che essa può determinare (Place et al., 2009). Modificazioni alla superficie di interazione col substrato cellulare, mediante inserimento nell’impianto di plasma o polimeri naturali, possono permettere di ovviare a questo problema, così come l’inserimento di idrossiapatite o altri fattori bioattivi (proteine morfogenetiche ossee) (Shen et al., 2009).
Poli-ε-caprolattone
Il Poli-ε-caprolattone (PCL) è un poliestere alifatico lineare in grado di subire idrolisi auto-catalizzata (Puppi et al., 2010a). A causa della sua natura semicristallina e della sua idrofobicità presenta una velocità di degradazione molto lenta (anni) poiché la struttura macromolecolare, ritarda l’ingresso dell’acqua (Pitt, 1990). Una particolare caratteristica del PCL è la sua elasticità che ne determina un’alta permeabilità e quindi la capacità del polimero di poter rilasciare fattori bioattivi (Benoit et al., 1999; Coombes et al., 2004).
Sistemi compositi allestiti in PCL e idrossipatite hanno mostrato un aumento, in vitro, della deposizione di apatite ossea (precursore della matrice ossea) con un buon grado di mineralizzazione (Taddei et al., 2005). Questi scaffolds sono risultati, inoltre, capaci di promuovere l’accrescimento degli osteoblasti differenziati mostrando buone capacità osteoconduttive. Per migliorare le caratteristiche di interazione con il substrato cellulare, numerose tecniche sono state valutate e sono tutt’ora oggetto di studio per incrementare la porosità delle fibre e,
25 conseguentemente, la superficie di adesione delle cellule al polimero (Puppi et al.,2011)
Poliuretani biodegradabili
Gli scaffolds biodegradabili a base di poli-uretano hanno acquistato recentemente un crescente interesse per le loro potenzialità nella rigenerazione ossea e cartilaginea. Le buone proprietà meccaniche consentono loro, infatti, di sopportare le forze di tensione e compressione nel sito di impianto e di stabilire, con il tessuto ospite, un contatto tale da favorire la proliferazione cellulare (Gorna & Gogolewski, 2003). In uno studio condotto nel 2006, Gorna & Gogolowski, hanno dimostrato come questo tipo di polimero sia in grado di fornire il supporto alla proliferazione degli osteoblasti, alla loro differenziazione e alla neoformazione di vasi a partire da cellule endoteliali in coltura, fornendo le basi per lo sviluppo e il miglioramento degli impianti ossei bio-ingegnerizzati. Recenti studi (Henry et al., 2009) hanno inoltre suggerito come scaffolds porosi in Poliuretano, con una architettura regolare, siano meglio tollerati, in confronto a quelli non porosi, evidenziando una adesione cellulare e una neoangiogenesi, influenzate all’architettura della struttura.
Poli-propilene fumarato
È un poliestere lineare sintetico, a rapida degradazione idrolitica. La degradazione acida cui va incontro, al pari di altri polimeri, può favorire una risposta infiammatoria intensa, ma può essere controllata variando i legami della struttura (Hedberg et al., 2005a). Grazie alle sue proprietà meccaniche, che lo rendono idoneo per applicazioni in tessuti sottoposti a carichi, il poli-propilene fumarato è stato ampiamente studiato per applicazioni in ingegneria del tessuto osseo, mostrando capacità di promuovere la rigenerazione sia in vitro, sia in vivo (Peter et al., 2000). Lo sviluppo di scaffolds compositi arricchiti con ceramiche bioattive ha evidenziato il potenziamento delle proprietà osteoconduttive e meccaniche del polimero (Peter et al., 1997).
26 Polifosfazeni
Sono polimeri ibridi inorganici-organici, studiati negli ultimi anni come sistemi a lento rilascio di farmaci e per le applicazioni di ingegneria tissutale. Gli studi condotti sulle capacità di promuovere la rigenerazione ossea hanno messo in evidenza come, questi polimeri, siano in grado di stimolare l’adesione e la proliferazione degli osteoblasti in vitro, evidenziando un tasso di crescita giornaliero costante per tutto il periodo di osservazione (Laurencin et al., 1996). Risultati simili sono stati ottenuti anche dalla valutazione di scaffolds compositi a base di polifosfazeni e PLGA (Deng et al., 2008), Idrossiapatite e fosfato tricalcico (Greish et al., 2005).
27
FATTORI PROMOTORI DI CRESCITA
Con il crescente interesse per la rigenerazione ossea, sono stati identificati anche un’ampia gamma di fattori molecolari che regolano il processo di crescita e riparazione dell’osso (Dimitriou et al., 2011).
PROTEINE MORFOGENETICHE OSSEE
Tra tutti i fattori valutati per comprendere le capacità rigenerative di queste molecole, le più diffuse, sono le Proteine Morfogenetiche Ossee (BMPs). Esse presentano potenti proprietà osteoconduttive in quanto sono in grado di indurre la mitogenesi delle cellule mesenchimali staminali e di altri elementi osteo-progenitori, e di favorirne la differenziazione in osteoblasti (De Long et al., 2007; Dimitriou et al., 2011). I numerosi studi condotti sull’impiego di tali promotori di crescita hanno confermato la loro efficacia nel potenziare le proprietà osteoinduttive di numerosi sostituti ossei impiegati per la rigenerazione ossea (Simpson et al., 2006; Nauth et al., 2010). Le BMPs si sono affermate come fattori vantaggiosi per la rigenerazione ossea, in quanto in grado di accelerare il normale processo di accrescimento osseo con, conseguente, riduzione dei tempi di guarigione delle fratture, ma il loro impiego è ancora controverso per il costo sostenuto, per la possibilità di formazione di osso ectopico, e per il rischio che può comportare il sovraddosaggio (necessario per ottenere effetti osteoinduttivi) (Argintar et al., 2011).
ALTRI PROMOTORI
Altri promotori implicati nel processo di rigenerazione ossea, oltre alle BMPs, con funzioni chemio tattiche, proliferative e angiogenetiche diverse, sono attualmente oggetto di studio e comprendono: i fattori piastrinici, fattori insulino simili, fattori di crescita endoteliale, fattori derivanti dai fibroblasti e altri (Dimitriou et al., 2005). In studi sin ora condotti, sia in vitro che in vivo, tutti hanno presentato risultati piuttosto controversi che ne limitano la diffusione (Nauth et al., 2010).
28 Plasma Ricco di Piastrine
Recenti studi sono mirati a valutare l’applicazione locale di plasma ricco di piastrine (PRP) per stimolare il processo rigenerativo. In caso di frattura, infatti, l’imponente ematoma che si sviluppa nel sito di lesione, determina l’apporto di una vasta gamma di fattori che possono stimolare la formazione di vasi, l’invasione da parte di cellule staminali mesenchimali toti-potenti e macrofagi. Questi fattori non stimolano direttamente la neoformazione di osso ma presentano numerose proprietà osteopromotrici (Marx et al., 1998). Basandosi su tali presupposti, l’applicazione del PRP, contribuendo a liberare un’abbondante quantità di fattori osteopromotori nelle fasi iniziali del processo riparativo, attiverebbe più rapidamente la cascata di eventi che portano alla rigenerazione ossea. Al momento non sono presenti studi basati sull’evidenza scientifica che avvalorino in maniera univoca tale presupposto (De Long et al., 2007), anche se i pochi studi che hanno visti l’impiego di gel a base di PRP, hanno mostrato una certa efficacia nel promuovere il processo rigenerativo (Bibbo et al., 2005).
ASPIRATO DI MIDOLLO OSSEO e CELLULE STAMINALI MESENCHIMALI
L’aspirato di midollo osseo, prelevato dalla cresta iliaca, è considerato un efficace promotore della rigenerazione ossea (Hernigou et al., 2005) in quanto ricco di Cellule staminali mesenchimali (MSCs) e di fattori osteopromotori. Questi, infatti, applicati direttamente nel sito di rigenerazione sono, attualmente il metodo più diffuso per accelerare il processo rigenerativo (Jäger et al., 2001). Ma la concentrazione di MSCs e altri fattori di crescita è correlata a numerose variabili quali, l’età e le condizioni cliniche del soggetto, la tecnica di prelievo, e altro (Huibregtse et al., 2000).
Lo studio sull’impiego di cellule staminali mesenchimali ha avuto ampia diffusione negli ultimi 10 anni. L’uso di queste cellule prevede il prelievo e l’isolamento degli elementi cellulari, la loro espansione in coltura su scaffolds e il successivo impianto nella sede di lesione. Questo comporta, però, costi elevati, numerosi rischi legati alla possibilità di contaminazione batterica o virale delle
29 colture e, non, ultima la necessità di un doppio intervento chirurgico (prelievo e impianto) (McGonagle et al., 2007). È al momento allo studio il prelievo da altre sedi (grasso, vasi sanguinei, muscolo e altro) per la funzionalizzazione degli impianti (Dimitriou et al., 2011).
30
RIGENERAZIONE GUIDATA
In condizioni ottimali, le cellule, prelevate dal tessuto donatore, comprese le cellule staminali adulte, possono essere seminate ed “espanse”in coltura e, successivamente, associate a scaffolds riassorbibili di origine naturale e/o sintetica, per poi essere impiantate nel sito ricevente in modo da determinare la rigenerazione del difetto grazie alla perfetta integrazione tra tessuto ospite e innesto. Questo tipo di trattamento sarebbe in grado eliminare le problematiche legate alla scarsità di siti donatori, di reazioni immunitarie avverse, nonché il trasferimento di patogeni (Calvert et al., 2003). I fattori di crescita o bioattivi possono essere impiegati per stimolare la crescita e la differenziazione dei tessuti. Questi vedono tre possibili modalità di impiego: le cellule possono essere trattate in vitro prima dell’impianto, possono essere incluse nella matrice dello scaffold in modo da stimolare la proliferazione in situ, o ancora possono essere somministrate dopo l’impianto dello scaffold (Puppi et al., 2010b).
Nella rigenerazione guidata con scaffold, quest’ultimo gioca un ruolo fondamentale, in quanto serve da modello per le interazioni cellulari e la formazione della matrice extracellulare (ECM), fornendo, al tempo stesso, un supporto strutturale tridimensionale al tessuto neoformato. La struttura tridimensionale, mimando le funzioni della ECM, è fondamentale per consentire alle cellule di differenziarsi nel proprio fenotipo originario e per costruire un modello strutturale in grado di colmare il difetto tissutale.
Lo scaffold ideale deve essere atossico, biocompatibile, biodegradabile, non deve evocare una risposta immunogenica (Drosse et al., 2008; Puppi et al., 2010a). Esso deve costituire una matrice temporanea per la rigenerazione, e le caratteristiche proprie del materiale sono cruciali per il successo del processo rigenerativo (Drosse et al., 2008).
La macro- e micro-struttura degli scaffolds influisce, non solo sulla sopravvivenza, crescita, propagazione e riorganizzazione delle cellule, ma gioca un ruolo fondamentale nel modulare la forma e le espressioni geniche delle cellule,
31 consentendo il mantenimento del fenotipo del tessuto originario (Leong et al., 2003; Karageorgiou & Kaplan, 2005).
Lo scaffold dovrebbe possedere una diffusa porosità (Maggiore del 90%) che consentirebbe una migliore adesione, crescita e riorganizzazione cellulare in vitro, fornendo il corretto supporto alla neovascolarizzazione in vivo (LeGeroz & LeGeroz, 1995). La stretta connessione tra i pori favorisce la diffusione fisiologica dei nutrienti e dei gas tra le cellule, favorendo la rimozione dei prodotti di demolizione (Vacanti et al., 1998).
La diversa architettura dei tessuti determina l’impiego di scaffolds con un diametro dei pori ottimale. Per il tessuto osseo, alcuni autori, hanno individuato come dimensione dei pori ideale un diametro compreso tra 200 e 400 µm (Boyan et al., 1996; Leong et al., 2003). Quando,infatti il diametro dei pori è troppo piccolo (75-100 µm) le cellule possono provocarne l’occlusione e limitare l’adesione e la penetrazione cellulare nello scaffold (Rout et al., 1988).
Morfologia, idrofilicità, carica di superficie dello scaffold sono risultati, in vitro, fattori in grado di controllare l’adesione, la proliferazione e il mantenimento del fenotipo tissutale originale, mentre in vivo, consentono il reclutamento cellulare e la rigenerazione a livello dell’interfaccia scaffold-tessuto (Boyan et al., 1996; McClary et al., 2000). L’ingegnerizzazione della superficie del polimero è uno aspetto fondamentale per migliorare la funzionalità dello scaffold e allestire materiali bio-mimetici in grado di interagire con i tessuti circostanti (Chu et al., 2002). Le modificazioni della superficie difficilmente innescano risposte cellulari specifiche e indirizzano la formazione di tessuto. Occorre, comunque, una ricaptazione biomolecolare che può essere ottenuta incorporando peptidi cellulari o proteine della matrice extracellulare nello scaffold (Shin & Mikos, 2003).
Il supporto per la rigenerazione ossea, dovrebbe, inoltre, avere caratteristiche di resistenza meccanica sufficienti tali da mantenere: in vitro, lo spazio necessario per garantire l’accrescimento della coltura e la formazione della matrice; in vivo, la resistenza allo stress di carico cui è sottoposto. Per questo motivo il polimero di allestimento delle strutture dovrebbe essere scelto ed allestito
32 in maniera tale da avere un tasso di riassorbimento e una resistenza meccanica delle fibre tali da consentire la rigenerazione completa del tessuto e il suo rimodellamento (Hutmacher, 2000). Studi comparativi riguardanti la degradazione rapida e lenta di scaffolds tridimensionali in poliestere hanno mostrato come una degradazione lenta veloce influenzi negativamente la vitalità cellulare e la colonizzazione dello scaffold sia in vitro sia in vivo (Sung et al., 2004). La conformazione e la velocità di degradazione influiscono, inoltre, sul rilascio di fattori bioattivi caricati nelle fibre dello scaffold o sulla sua superficie (Chen & Mooney, 2003; Tessmar & Göpferich, 2007).