1
CAPITOLO 1
1.1
IL RENE
Il rene è l’organo responsabile dell’emofiltrazione, della formazione ed escrezione urinaria; oltre a ciò svolge altre importanti funzioni metaboliche.
Tra le più importanti si menzionano:
La regolazione dell’osmolalità e del volume dei liquidi corporei . La regolazione dell’equilibrio elettrochimico.
La regolazione dell’equilibrio acido-base, attuata da sistemi tampone dei liquidi corporei e dall’azione coordinata dei polmoni e dei reni.
L’escrezione dei prodotti terminali del metabolismo e delle sostanze estranee; tra cui l’urea (derivata dal metabolismo degli aminoacidi), l’acido urico (derivato dal metabolismo degli acidi nucleici), la creatinina (derivata dal metabolismo della creatina), i prodotti terminali del metabolismo dell’emoglobina, e i metaboliti degli ormoni.
Tutte queste funzioni vengono espletate tramite la produzione di urina, che viene formata dal rene con tre meccanismi: l’ultrafiltrazione glomerulare, il riassorbimento tubulare, con passaggio selettivo di sostanze utili (come acqua ed elettroliti) dall’ultrafiltrato al sangue e la secrezione
tubulare, con passaggio di sostanze dal sangue nell’ultrafiltrato.
Oltre a ciò, i reni hanno anche importanti funzioni endocrine, in quanto secernono diversi ormoni ad azione sistemica, quali:
renina, per la regolazione della pressione arteriosa sistemica; eritropoietina, principale regolatore dell’eritropoiesi;
calcitriolo, forma attiva della vitamina D3, importantissimo ormone regolatore del
2
1.1 IL NEFRONE
Le funzioni renali vengono attuate dal nefrone; l’unità funzionale del rene. [Berne and Levy. 2001]. Ciascun rene possiede circa un milione di nefroni, ognuno dei quali è capace di formare urina, raggruppati in numerose formazioni regolarmente disposte, chiamate, per la loro forma, piramidi renali.
Il nefrone è costituito da due componenti fondamentali:
1) il glomerulo e la capsula di Bowman, che insieme costituiscono il corpuscolo del Malpigli e sono connessi alla prima rete capillare;
2) i sistemi tubulari renali corticale e midollare, associati alla seconda rete capillare, e a loro volta suddivisi in diversi diversi dotti (tubulo contorto prossimale, ansa di Henle, tubulo distale e dotto collettore) che in successione trasportano e modificano il liquido filtrato a livello del glomerulo fino alla pelvi renale.
Man mano che l’ultrafiltrato glomerulare scorre attraverso i tubuli, oltre il 99% della sua acqua e quantità variabili dei suoi soluti vengono normalmente riassorbiti nel sistema vascolare; piccole quantità di alcune sostanze vengono, inoltre, secrete nei tubuli. L’acqua tubulare residua con le sostanze in essa disciolte diventano urina.
Il primo elemento del nefrone sul percorso del microcircolo è il glomerulo (Fig. 1), sede della filtrazione del sangue proveniente dalle arteriole afferenti.
Le arteriole afferenti penetrano nel glomerulo dal polo vascolare e si suddividono in circa cinque rami maggiori: da ogni ramo si sviluppa una singola rete capillare, supportata da un proprio tralcio di mesangio per poi convergere in un’unica arteriola efferente, che lascia il glomerulo presso lo stesso polo vascolare da dove era penetrata l’arteriola afferente.
3
invagina in un bulbo cavo, la capsula di Bowman, che rappresenta il fondo cieco di un lungo sistema di dotti tubulari ed è costituita da uno strato di cellule epiteliali.
Fig. 1
Ciò significa che le cellule endoteliali si rivestono esternamente di uno strato epiteliale in continuità, presso il polo vascolare, con le cellule che costituiscono la capusula di Bowman [Cattaneo., 1986].
Le cellule della capsula di Bowman sono pavimentose e molto semplici come struttura, mentre le cellule epiteliali che rivestono il gomitolo dei capillari glomerulari sono più grandi e specializzate, caratterizzate da prolungamenti (pseudopodi) che prendono contatto con la membrana basale; per queste caratteristiche sono chiamate podociti. Lo spazio virtuale tra l’epitelio che riveste il reticolo capillare glomerulare e quello della parete della capsula di Bowman è detto spazio urinifero ed è in continuità con il lume dell’esteso sistema tubulare del nefrone. Il sangue proveniente dall’arteriola afferente fluisce nel reticolo capillare glomerulare dove si verifica la sua ultrafiltrazione; il filtrato passa nello spazio urinifero e da qui nel sistema tubulare. Il sangue parzialmente filtrato lascia il glomerulo attraverso l’arteriola efferente e procede a garantire l’adeguato apporto di ossigeno al sistema tubulare.
4
glomerulari, nel cui ambito si individua la barriera di filtrazione glomerulare costituita da:
- endotelio capillare (strato interno);
- membrana basale dei capillari glomerulari particolarmente spessa; - podociti (strato epiteliale esterno).
La membrana basale glomerulare è molto più spessa della membrana basale dei capillari normali e ha uno spessore medio di 310-350 nm nei soggetti sani. Proprio per il suo spessore funziona come barriera fisica contro il passaggio delle grosse molecole dal sangue allo spazio urinifero, inoltre sia la superficie della membrana che la superficie di alcuni pedicelli dei podociti espongono residui carichi negativamente (polianioni), costituiti da glicosaminoglicani, in particolare eparan-solfato, mentre sui podociti si trova la podocalicina, sostanza ricca di residui di acido sialico. La presenza di queste molecole polianioniche crea una barriera carica negativamente, capace di impedire il passaggio alle molecole cationiche.
Il mesangio è il tessuto di sostegno per la rete capillare del glomerulo ed è costituito da due componenti: le cellule del mesangio e la matrice mesangiale extracellulare.
Le cellule mesangiali sono di forma irregolare e dotate di un gran numero di prolungamenti citoplasmatici che si estendono in modo apparentemente disordinato nell’ambito della matrice del mesangio.
La matrice del mesangio è una sostanza amorfa prodotta dalle stesse cellule mesangiali che vi sono immerse e l’attraversano con i loro prolungamenti [Stevens Al. and Lowe J., 1993].
5
CAPITOLO 2
2.1 INSUFFICIENZA RENALE ACUTA (IRA)
L’insufficienza renale acuta (IRA) è una sindrome clinica associata ad alta morbilità e mortalità; ed è potenzialmente reversibile se i pazienti sopravvivono all’insulto iniziale [Schrier RW et al., 2004]. L’IRA costituisce una delle complicanze più temute in corso di sepsi, di cui è spesso una espressione iniziale che precede la sintomatologia clinica conclamatata [Schor N., 2002].
Nonostante i miglioramenti nel trattamento, che include, oltre al supporto farmacologico, tecniche sempre più sofisticate di depurazione extracorporea continua, l’insufficienza renale acuta presenta ancora oggi una mortalità elevata (30-60 %) fino a raggiungere il 50-90% in pazienti già in dialisi [Grams ME. et al., 2011].
Le caratteristiche cliniche dell’IRA variano a seconda della causa, della gravità del danno renale e della velocità con cui si sviluppa l’insufficienza renale; quelle principali sono:
1) l’aumento in circolo dei cataboliti azotati (iperazotemia, ipercreatinemia)
2) la contrazione della diuresi al di sotto di 400 ml al giorno (oliguria) fino alla completa scomparsa dell’emissione di urina (anuria).
Inoltre, ci possono essere i sintomi legati alla causa sottostante o le complicanze cliniche o biochimiche dell’uremia.
Le cause e i meccanismi che determinano l’IRA possono essere ricondotte a tre diverse situazioni: 1) IRA PRERENALE (funzionale): dovuta a condizioni patologiche sistemiche che
determinano una riduzione della perfusione renale, come l'ischemia di breve durata e rapidamente corretta.
Negli anziani la perdita del meccanismo regolatore della sete, associata alla ridotta capacità di conservare i sali e di concentrare le urine, aumenta notevolmente l’incidenza dell’IRA
6
prerenale. La maggior parte dei casi è dovuta alla perdita di liquidi (disidratazione, deplezione di volume), alla loro ridistribuzione interna (ipoproteinemia), alla riduzione della gittata cardiaca o ad alcuni farmaci (diuretici, inibitori dell’enzima di conversione dell’angiotensina, FANS), spesso somministrati in associazione.
2) IRA POSTRENALE (ostruttiva): dovuta ad affezioni morbose delle vie escretrici urinarie, caratterizzate da ostacolo meccanico al deflusso dell’urina;
3) IRA RENALE (organica): consegue ad alterazioni patologiche che colpiscono il parenchima renale in uno o più dei suoi componenti (glomeruli, tubuli, vasi, interstizio) [Schena and
Selvaggi., 1992], tra le quali la necrosi tubulare acuta (Acute Tubular Necrosis, ATN), la
glomerulonefrite acuta, la pielonefrite acuta e la nefrite interstiziale acuta.
La necrosi tubulare acuta (ATN), causata dalla scarsa perfusione renale, con la malattia prerenale appare come la causa più comune di IRA [Esson ML. and Schrier RW., 2002], ed ha come principale causa l’ipossia indotta dall’ischemia-riperfusione (I/R), che può derivare da condizioni cliniche, come emorragia, sepsi o shock [Mehta R., 2003]. Nell’IRA vengono individuate una fase di avvio, una fase di estensione e una di mantenimento.
Fase di avvio, è caratterizzata da un ridotto flusso ematico renale, che danneggia le cellule epiteliali e vascolari e diminuisce la velocità di filtrazione glomerulare. In questa fase, si assiste all’attivazione di cascate del segnalale che alimentano i fenomeni molecolari e cellulari tipici della flogosi, oltre a determinare una alterazione delle funzioni d’organo [Sutton TA. et al.,2002].
Fase di estensione, segue la fase di avvio ed è caratterizzata dalla persistente ipossia e dalla risposta infiammatoria. Durante questa fase si osservano estese aree di necrosi a carico delle cellule epiteliali ed endoteliali danneggiate, principalmente nella regione corticomedullare del rene [Molitoris BA. and Sutton TA., 2004].
7
correttivi facilitano la riparazione, la divisione, e la ridifferenzazione cellulare [Sutton TA.
et al., 2002].
La ATN, caratterizzata dalla necrosi dell’epitelio tubulare renale viene suddivisa in due forme: A. Forma Ischemica: con localizzazione delle lesioni necrotiche a livello della zona midollare
esterna; interessamento della porzione terminale del tubulo prossimale e della porzione ascendente spessa midollare dell’ansa di Henle;
B. Forma Tossica: corticale: con interessamento dei tubuli prossimali.
2.1.1 IRA Ischemica
L’IRA ischemica, dovuta a ipoperfusione renale si ha più frequentemente dopo chirurgia cardiovascolare, trauma, emorragia, sepsi o disidratazione. Questo tipo di IRA è caratterizzato da: diminuzione di filtrazione e perfusione glomerulare; estrusione del flusso urinario nei tubuli a causa di cellule e detriti derivati dall’epitelio tubulare ischemico; retrodiffusione del filtrato glomerulare attraverso l’epitelio tubulare ischemico.
L’ischemia delle cellule endoteliali può determinare una consistente riduzione del flusso sanguigno renale, della pressione di ultrafiltrazione glomerulare e della superficie di filtrazione in seguito alla ridotta/assente produzione di molecole ad attività vasodilatante e rilascio di vasocostrittori da parte delle stesse cellule.
L’ipoperfusione renale provoca ischemia delle cellule tubulari renali, in particolare della parte rettilinea del tubulo prossimale e del tratto ascendente dell’ansa di Henle, regioni che attraversano la giunzione corticomidollare e la midollare esterna, zone che risultano relativamente ipossiche se paragonate alla corticale renale e per questo motivo maggiormente sensibili al danno da I/R. Pertanto, qualsiasi difetto nel sistema vascolare va a perturbare l'elevata esigenza metabolica delle cellule epiteliali tubolari e può promuovere la morte cellulare.
8
La progressiva perdita di cellule endoteliali intraglomerulari e / o capillari peritubulari può essere un fattore primario per lo sviluppo di insufficienza renale cronica [Kang DH. et al., 2002; Kang
DH. et al., 2001; Sugimoto H. et al.,2003].
L’epitelio tubulare necrotico può dare retrodiffusione di soluti filtrati, inclusi creatinina, urea e altri prodotti azotati di rifiuti, rendendo così inefficiente la filtrazione glomerulare.
2.2 DANNO DA RIPERFUSIONE A LIVELLO RENALE
La IRI (IRI, ischemia-reperfusion injury) è la più comune causa di insufficienza renale acuta (IRA), caratterizzata da alta morbilità e mortalità [Safirstein RL. 2004; Versteilen AM. et al, 2004] in seguito alla presenza di estese aree di necrosi e apoptosi delle cellule epiteliali tubulari renali [Padanilam BJ. 2003; Qiao X. et al, 2005; Saikumar P. and Venkatachalam MA. 2003].
Fig.2 Principali eventi molecolari durante la fase iniziale di insufficienza renale da I/R.
A livello cellulare la fase di ischemia come mostra la Fig.2 è caratterizzata da : esaurimento intracellulare di ATP, diminuzione nei tessuti di ossigeno e contenuto di glucosio con un concomitante aumento intracellulare di calcio [Daemen MA. et al, 2002; Padanilam BJ., 2003;
9
Ratych RE. et al, 1986; Versteilen AM. et al 2004]. Si verifica inoltre la riduzione dell’attività degli
enzimi antiossidanti in proporzione alla severità dell’insulto ischemico. La ripresa dell’attività enzimatica è parallela alla rigenerazione tubulare. La severità del danno dipende dalla durata dell’ischemia, anche se, paradossalmente è la riperfusione ad essere associata al maggior danno tessutale. Come noto, la fase di riperfusione, è associata con la produzione di specie reattive dell’ossigeno e una maggiore morte cellulare per apoptosi [Ortiz A. et al, 2003; Padanilam BJ.
2003; Qiao X. et al, 2005; Saikumar P. and Venkatachalam MA. 2003; Schumer M. et al, 1992].
Difatti, dopo l’ischemia le cellule sono impoverite di energia, ma non si formano radicali tossici perché nei tessuti non c’è ossigeno. Se, per un ripristino della circolazione, il tessuto anossico viene riperfuso, vengono generate enormi quantità di radicali tossici, a carico dei mitocondri e dell’enzima xantino ossidasi. Queste forme reattive hanno molti effetti lesivi:
perossidano i lipidi delle membrane cellulari, aumentando la permeabilità;
attaccano i gruppi tiolici delle proteine, alterando così alcune proteine critiche, quali le pompe Na/K attivate;
causano una deplezione di NADPH nei mitocondri e rilasciano calcio libero nel citosol attivando in maniera non controllata enzimi.
Quando ciò si verifica, i meccanismi di neutralizzazione (gli antiossidanti, la glutatione perossidasi, la superossido dismutasi e la catalasi) sono in breve tempo esauriti, per cui la cellula va incontro a danno grave e morte cellulare [Stevens A. and Lowe J., 2001].
Oltre al danno strettamente ossidativo, il danno ischemico si associa alla flogosi con produzione di citochine (prodotti polipeptidici di linfociti e monociti attivati) e aumento dell’espressione di molecole di adesione da parte delle cellule ipossiche tissutali e delle cellule endoteliali
[Anya-PradoR. et al. 2002 and Thiagarajan RR. et al 1997]: queste molecole reclutano i polimorfonucleati
circolanti nella sede di riperfusione e il processo infiammatorio che ne consegue causa danni aggiuntivi [Daemen MARC. et al. 2002 and Kamiski KA. et al. 2002].
10
Durante il processo infiammatorio l’endotelio, che in condizioni normali fornisce una superficie che previene l’aggregazione e degranulazione delle piastrine, aumenta la sintesi del PAF (fattore attivante le piastrine) e di NO (monossido di azoto), aumentando così la permeabilità e promuovendo la dilatazione vasale [Stewens and Lowe, 2001].
L'eziologia della IRI è complessa, andando ben oltre la generazione di ROS. E’ stato dimostrato non solo un aumento della produzione di radicali liberi (e quindi stress ossidativo), ma anche l’innesco delle risposte infiammatorie e l'attivazione di pathways apoptotici [Daemen MA. et al., 2002; Qiao
X. et al., 2005; Versteilen AM. et al., 2004].
In seguito all’IRI, marcatori morfologici di morte cellulare per apoptosi sono stati trovati in vari segmenti del tubulo renale [Kishino M. et al., 2004; Oberbauer R. et al., 2001; Tanaka T. et al.,
2004]; di contro l'inibizione di alcuni elementi mitocondriali legati al pathway apoptotico sembra
migliorare IRI renale [Castaneda MP. et al., 2003; Chiang-Ting C. et al., 2005; Padanilam BJ.
2003; Versteilen AM. et al., 2004]. Questi risultati suggeriscono che sia l’apoptosi che la necrosi
svolgano un ruolo significativo nella patogenesi del danno renale indotto dall’ischemia da riperfusione a livello delle cellule tubulari.
Infine il danno da riperfusione renale è associato all’incremento delle resistenze vascolari renali (RVR), alla diminuzione del flusso sanguigno renale (RBF), ad un indebolimento dell’effetto vasodilatante dell’Acetilcolina ed alla liberazione di agenti vasocostrittori, quali l’Angiotensina II e l’Endotelina I; per questo nella circolazione renale compromessa è di notevole importanza il rilascio di metaboliti vasodilatatori endotelio-derivati come l’NO, formazione che potrebbe rappresentare un meccanismo endogeno di difesa per mantenere un sufficiente RBF.
11
CAPITOLO 3
3.1 ATTIVITA’ DEI COMPOSTI FENOLICI
I polifenoli naturali sono stati largamente oggetto di studio, non solo per le loro forti capacità antiossidanti ma anche, recentemente, per altre proprietà che conferiscono loro la capacità di modulare diverse attività cellulari.
I polifenoli, presenti in alimenti di origine vegetale quali frutta verdura, olio, vino, tè, cioccolato ed altri prodotti a base di cacao [Manach C. et al., 2004], costituiscono un gruppo molto ampio ed eterogeneo di composti suddivisi in classi, quali acidi idrossibenzoici, acidi idrossicinnamici, stilbeni, lignani e flavonoidi; questi ultimi sono a loro volta suddivisi in antocianine, flavonoli, flavoni, flavanoli, flavanoni ed isoflavoni. Sebbene la biodisponibilità di questi composti rappresenti un problema che ancora non ha trovato una risposta univoca e convincente, studi epidemiologici hanno evidenziato che all’aumento del consumo di polifenoli si associa una riduzione del rischio di malattie cardiovascolari, di tumori e di disordini neurodegenerativi [Huxley
RR. et al., 2003; Hertog MGL. et al., 1996; Arts IC. and Hollman PC., 2005; Sesso HD. et al., 1999; Yochum L. et al., 1999; Hertog MG. et al., 1996], suggerendo che gli effetti benefici siano da
attribuirsi, soprattutto, alla capacità dei polifenoli di combattere lo stress ossidativo che caratterizza e accomuna queste patologie.
Il potere antiossidante di questi composti dipende dal numero di anelli fenolici, dal numero e posizione di gruppi idrossilici e di doppi legami presenti nella molecola; l’attività scavenger è dovuta in particolare alla presenza di un anello-B diidrossilato (gruppo catecolico), di un doppio legame C2-C3 associato ad un gruppo 4-carbonilico nell’anello-C e di gruppi funzionali capaci di
chelare i metalli di transizione [Bors W. et al., 2001; Spencer JPE. et al., 2003]. Inoltre, le differenze strutturali determinano differenze nella biodisponibilità di questi composti, sia in termini
12
di assorbimento nel tratto gastroenterico che di metabolismo e distribuzione in tessuti e organi. Oltre alla classica azione antiossidante sono state descritte anche azioni proossidanti dei polifenoli [Elbling L. et al., 2005], che possono, quindi, avere effetti opposti sui processi fisiologici cellulari di base. Infatti, se è vero che grazie all’azione antiossidante possono aumentare la sopravvivenza cellulare, come proossidanti possono indurre apoptosi, necrosi o arresto della proliferazione [Lambert JD. et al., 2005]. Le proprietà antiossidanti sono state considerate per molto tempo la principale funzione dei polifenoli [Luximon-Ramma A. et al., 2002], ma, alla luce di nuovi dati sperimentali, questo sembra essere un modo troppo semplice e riduttivo di considerare la loro attività [Azzi A. et al., 2004].
Nei sistemi biologici complessi, i polifenoli possono avere una serie di effetti non ascrivibili alla sola attività antiossidante [Allen RG. and Tresini M., 2000; Torres M. and Forman HJ., 2003;
Kwon YW. et al., 2003]. Questa argomentazione è sostenuta per lo meno da due osservazioni:
innanzi tutto essi vengono metabolizzati in vivo dando origine a sostanze che spesso perdono il potenziale antiossidante originale, inoltre la concentrazione dei polifenoli e dei loro metaboliti, nel plasma o nei tessuti, è molto bassa rispetto a quelle di altri antiossidanti, come l’acido ascorbico e l’α-tocoferolo, rendendo improbabile che i polifenoli possano competere con essi [Donovan JL. and
Waterhouse AL., 2003; Spencer JPE. at al., 2004; Manach C. et al., 2005; Williamson G. and Manach C., 2005]. Viceversa, a tali concentrazioni, potrebbero avere altre attività farmacologiche e
modulare varie funzioni cellulari. Questo trova conferma nel fatto che i polifenoli sono in grado di modulare l’espressione e/o l’ attività di enzimi come telomerasi [Naasani I. et al., 2003], ciclossigenasi [Laughton MJ. et al., 1991; O’Leary KA. et al., 2004; Hussain T. et al., 2005], lipossigenasi [Schewe T. et al., 2001; Sadik CD. et al., 2003], xantina ossidasi [Van Hoorn DEC. et
al., 2002], metalloproteinasi [Isemura M. et al., 1999; Oak MH. et al., 2004], enzima di conversione
dell’angiotensina [Actis-Goretta L. et al., 2003], protein chinasi [Agullo G. et al., 1997;
13
[Wiseman S. et al.,2001; Kong An. et al., 2000; Spencer JP. et al., 2003], con i recettori cellulari [Rosenkranz S. et al., 2002; Mueller So. et al., 2004], con le vie apoptotiche caspasi-dipendenti [Way TD. et al., 2005; Monasterio A. et al., 2004; Sergeev IN., 2004], con la regolazione del ciclo cellulare [Fischer PM. and Lane DP., 2000], e con l’induzione di enzimi detossificanti [Birt DF. et
al., 2001]. Essi inoltre aumentano la produzione di vasodilatatori, come l’ossido nitrico [Aldini G. et al., 2003; Wallerath T. et al., 2003], influenzano la funzione delle piastrine [Murphy KJ. et al., 2003] e competono con il glucosio nel trasporto attraverso la membrana [Vera JC. et al., 1996].
14
3.2
IL RESVERATROLO
Il Resveratrolo (3, 5, 4' triidrossistilbene) appartiene alla famiglia degli stilbeni (C6-C2-C6), composti fenolici a basso peso molecolare, caratterizzati dalla presenza di due anelli aromatici uniti da un etano o da un ponte etenico (fig.3)
Fig. 3 Struttura chimica degli isomeri cis e trans-resveratrolo (3,4’,-5-triidrossistilbene).
Il resveratrolo (trans-3,4’,5 triidrossistilbene), trovato negli acini di uva e nel vino rosso, presenta un’ ampia varietà di proprietà farmacologiche ed è stato chiamato in causa per spiegare il “Paradosso Francese”, risalente a studi epidemiologici condotti negli anni ’70 che hanno rivelato una correlazione inversa tra il consumo di vino rosso e lo sviluppo di malattie cardiovascolari in Francia, un paese dove è notoriamente alto il consumo di grassi saturi.
Tutti questi aspetti contribuiscono a diminuire il rischio cardiovascolare per cui il resveratrolo anche un agente cardioprotettivo oltre ad essere protettivo nei confronti del danno indotto dall’I/R
3.2.2
BIODISPONIBILITÁ DEL RESVERATROLO
La concentrazione di resveratrolo, sia nel vino rosso che negli altri alimenti è molto bassa, ragion per cui il potenziale effetto attribuito a questo composto è stato spesso criticato. Gli studi sulla biodisponibilità e sulla biotrasformazione del resveratrolo, e dei polifenoli in generale, sono quindi
15
importanti per chiarire i presupposti indispensabili, ovvero se le concentrazioni che si raggiungono nell’ organismo che assume resveratrolo per via orale siano sufficienti a spiegare gli effetti salutistici ad essi attribuiti; questi studi sono tuttora incompleti. L’assorbimento e il trasporto del resveratrolo sono stati studiati nei ratti e nei topi dopo somministrazione orale del resveratrolo; sono stati condotti studi anche su cellule umane di carcinoma del colon (Caco-2 cells), e su epatociti umani.
Essendo presente nel vino rosso soprattutto nella forma glicosidata trans e cis, il gluresveratrolo può essere idrolizzato da glicosidasi nel tratto gastrointestinale umano a trans e cis–resvesratrolo. Nei ratti è stato dimostrato che il resveratrolo è assorbito nell’intestino in forma glucoronidata [Kuhnle
G., et al 2000].
Per quanto riguarda la distribuzione tissutale, Vitrac e collaboratori [Vitrac et. al. 2003] hanno dimostrato che, a seguito di somministrazione orale nei topi o nei ratti di 14C-trans-resveratrolo, la radioattività del 14C-trans-resveratrolo si rileva in vari organi, quali fegato, reni ed, in minore misura, nel cervello, cuore, polmoni e testicoli; nel fegato di ratto il resveratrolo si accumula in forma coniugata, glucoronidata o solfatata. Anche studi in vivo di farmacocinetica hanno indicato che il resveratrolo mostra una forte affinità per il fegato [Bertelli AA. et al 1996].
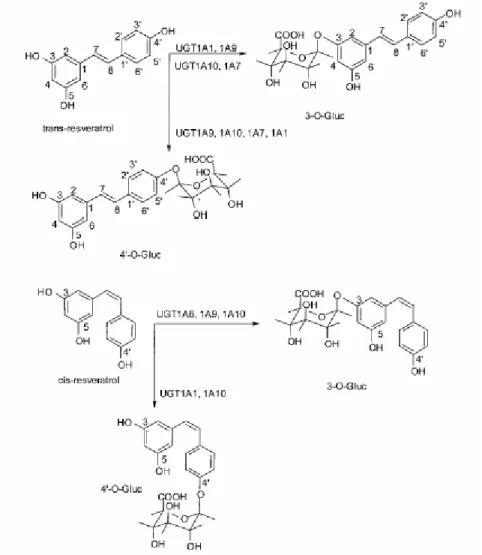
Asensi e collaboratori [Asensi M. et. al, 2002] hanno dimostrato che il trans-resveratrolo è rapidamente metabolizzato dalle cellule parenchimali del fegato; epatociti di ratto incubati in presenza di 20 μM trans-resveratrolo metabolizzano circa l’ 80% di questo composto in appena 20 minuti. Poiché quest’organo è il maggiore sito per la glucuronidazione di xenobiotici, Aumont e collaboratori hanno concluso che il fegato può attivamente partecipare al metabolismo del resveratrolo attraverso la reazione di glucuronidazione (Fig. 4).
In vitro, nei microsomi di fegato umano è stato visto che il trans- e il cis-resveratrolo possono essere glucoronidati con la formazione di due monoglucoronidi, 3-O- e 4’-O-glucuronide, mentre nell’urina di ratto e nel siero di topo sono stati scoperti sia il trans-resveratrolo-3-glucuronide che il
16
trans-resveratrolo-3-solfato [Yu C. et al, 2002]. La formazione del resveratrolo glucuronide è catalizzata dalla UDP-glucuroniltransferasi (UGT), che si distinguono in almeno due famiglie di enzimi (famiglia 1A e 2B) e trasferiscono acidi glucuronici da acidi UDP-glucuronici a vari accettori includendo gruppi idrossilici, carbossilici, aminici e tiolici e portando alla formazione di glucuronidi polari escreti poi nella bile o nell’ urina [Radominska-Pandya, et al 1999].
Fig. 4 Regio- e stereo-glucuronidazione di trans- e cis-resveratrolo nell’uomo: implicazione delle isoforme della UGT. [Aumont V. et al., 2001].
Per stabilire l’ emivita di questa molecola ed il tempo di massima concentrazione nel plasma sono stati condotti studi su animali alimentati con trans-resveratrolo puro.
17
Questi studi sono stati programmati somministrando per via intragastrica 20 mg/Kg animale di trans-resveratrolo (una dose che rappresenta per un uomo adulto circa 140 volte la quantità di resveratrolo presente in un litro di vino rosso); la concentrazione nel plasma (42.8 ± 4.4 μM, 5 minuti dopo la somministrazione) decresce molto rapidamente a 0.9 ± 0.2 μM (0.2 mg/l) in 60 min. Quando la stessa quantità di trans-resveratrolo è somministrata oralmente la concentrazione presente nel plasma dopo 5 minuti è nettamente più bassa (2–3 μM in topi e circa 1 μM in conigli o ratti) ed è seguita da un forte discesa (meno di 0.1 μM) in 60 min. [Asensi M. et. al, 2002]. Il rapido decremento della concentrazione plasmatica di resveratrolo potrebbe dipendere da vari fattori: dal suo metabolismo, dalla rapida captazione di specifici tessuti e/o organi; molti studi hanno dimostrato che il fegato può rimuovere la maggior parte del resveratrolo circolante.
3.2.2
ATTIVITÁ BIOLOGICHE DEL RESVERATROLO
Azione antiossidante e antiinfiammatoria
Tra le attività biologiche più importanti del resveratrolo (RSV) nella cardioprotezione, si può menzionare l’inibizione dell’ ossidazione delle LDL; quest’inibizione risulta ridurre il rischio cardiovascolare dato che le LDL ossidate (ox-LDL) possono stimolare l’aggregazione piastrinica [Aviram M. et al.1989], promuovendo un’attività procoagulante sulla superficie dei monociti/macrofagi umani ed aumentando l’attività tromboplastinica nel tessuto [Schuff-Werner P.
et al.1989].
Tra i sistemi enzimatici presenti nelle cellule endoteliali e nei macrofagi ed implicati nell’ ossidazione delle LDL, vi sono la NADPH-ossidasi, la ipoxantina/xantina ossidasi, la mieloperossidasi (MPO) e l’ enzima ossido nitrico sintetasi (NOS) [Meyer J.W. et al. 2000; Carr
18
in quanto oltre ad ossidare le LDL, stimolano la NADPH-ossidasi, il rilascio di citochine pro-infiammatorie e inibiscono l’enzima endoteliale ossido nitrico sintetasi (eNOS) implicata nell’ attività vasorilassante [Parthasarathy, S. et al. 1989]. Si è visto che il resveratrolo agisce su questi enzimi non solo come scavenger dei ROS, ma anche inibendo la cicloossigenasi COX-2 ed inducendo l’attività vasorilassante di eNOS [Rankin S.M. et al.1991].
Diversi studi hanno dimostrato che il resveratrolo, oltre ad essere un inibitore dell’aggregazione piastrinica, inibisce la produzione degli eicosanoidi nelle piastrine e nei neutrofili [Bertelli A.A.E.,
et al. 1996], inibisce l’espressione delle molecole di adesione endoteliali [Ferrero M.E., et al. 1998]
e l’attività delle COX-2 [Subbaramaiah K., et al. 1998]. Il RSV è inoltre in grado di indurre apoptosi in cellule cancerogene [Surh YJ. et al. 2003], così come di inibire gli eventi associati all’iniziazione, promozione e progressione dei tumori [Jang M., et al. 1997].
Un altro meccanismo d’azione dei polifenoli, è quello di modulare positivamente l’attività del CYP renale indotta dall’etanolo, prevenendo lo stress ossidativo nel rene [Orellana M. et al., 2002].
Azione nefroprotettiva
Oltre alle azioni cardioprotettive, il resveratrolo è protettivo a livello renale: è infatti in grado di ridurre la proteinuria, l’ipoalbuminemia e l’iperlipidemia in modelli sperimentali di glomerulonefrite [Nihei et al., 2001] e migliorare i livelli di creatinina sierica e di collasso glomerulare in un modello di ischemia-riperfusione nel ratto andando a ridurre la mortalità dal 50% al 10% grazie all’attivazione dell’enzima eNOS e l’aumento dei livelli di NO [Giovannini et al.,
2001]. La somministrazione di resveratrolo è cruciale per proteggere le cellule renali contro il
danno da ischemia riperfusione [Bertelli et al., 1996; Bhat et al., 2001] dato che non solo l'endotelio vascolare renale, ma anche altre cellule renali, come mesangio, macula densa e cellule tubulari sono in grado di generare NO [Mundel et al.,1992].
19
L’inibizione dell’angiotensina 2, assieme all’aumentata sintesi dell’ossido nitrico, operate dal resveratrolo potrebbero, in parte spiegare gli effetti nefroprotettivi [Chander et al., 2006] e di riduzione della pressione sanguigna da parte di questo stilbene in alcuni modelli renali [Miatello et
al.,2005].
Precondizionamento farmacologico
Il RSV può funzionare come agente di precondizionamento farmacologico contro l’insulto ischemico, mimando l’evento ischemico: questo meccanismo di protezione e simile a quello indotto da ischemia di lieve durata che rende i tessuti più tolleranti ad una successivo danno da ischemia riperfusione, normalmente letale nel cuore, nel rene e nel cervello [Chander et al., 2005; Raval et
al., 2008; Das et al., 2007].
Numerosi studi, dimostrano come il RSV protegga anche altri organi di vitale importanza come cervello, cuore e reni dal danno di ischemia riperfusione [Das et al., 1999; Ray et al., 1999;
Giovannini et al., 2001; Hung et al., 2000; Bastianetto et al.,2000], caratterizzato da danni diretti ai
tessuti e dall’attivazione di una cascata di risposte cellulari che portano all’infiammazione, alla morte cellulare ed all’insufficienza d’organo [Connor et al., 1992 ; Sumimoto et al., 1996].
Diversi pathway e cofattori sono coinvolti nell’induzione del precondizionamento ischemico; tra questi l’apertura di canali al potassio ATP dipendenti, l’attivazione dei recettori dell’adenosina, o entrambi [Van Winkle et al., 1994] , l’NO [Imagawa et al., 1999], un leggero stress ossidativo [Dirnagl et al., 2003], l’ attivazione della proteina chinasi C [Mitchell et al., 1995] e la downregulation di pathway apoptotici [Das et al., 2007; Yadav et al., 1999].
Un concetto emergente è che il precondizionamento ischemico attivi una rete di pathway di segnalazione protettivi, all’interno della quale molti percorsi sono condivisi dal resveratrolo e dal precondizionamento ischemico.
20
appartenente alla classe degli HDAC NAD+-dipendenti; il resveratrolo potrebbe mimare il precondizionamento ischemico attivando la SIRT-1 [Raval et al., 2008], proprio perché a seguito del precondizionamento ischemico aumenta il rapporto NADH/NAD+ [Centeno et al., 1999], responsabile dell’attivazione dell’enzima SIRT-1 [Lim et al., 2010], così come dopo somministrazione di resveratrolo [Howitz et al., 2003].
Un’ altra via di segnalazione comune al resveratrolo e al precondizionamento coinvolge l’NO: nell’infarto del miocardio in topi knockout per la forma inducibile della NOS (iNOS) [Imamura et
al., 2002] dopo precondizionamento (tre brevi periodi di ischemia 2 minuti) o pretrattamento con
resveratrolo, mostrano una evidente protezione da I/R con modalità NO-dipendenti [Chander et al.,
2005].
Un’ ulteriore via di segnalazione comune al resveratrolo e al precondizionamento ischemico coinvolge l’ AMPK (AMP-activated protein kinase), una serina / treonina protein chinasi attivata in risposta a diversi tipi di stress patologici che portano ad un consumo di energia (ed aumentano l’ AMP citosolico libero) [Holmes et al., 1999; Hardie et al., 2003; Winder, 2001; Dyck et al., 2002]; tra i vari eventi stressanti viene rammentata l’ ipossia, lo stress ossidativo, la deprivazione di glucosio, l'esercizio fisico e gli ormoni alimentari come la leptina e l’adiponectina [Peralta et al.,
2001; Hardie et al., 1999; Kahn et al., 2005]. L’AMPK è presente in molti tessuti, tra cui fegato,
cuore, cervello e muscoli scheletrici, in cui svolge azioni di mantenimento del bilancio energetico come glicolisi, ossidazione degli acidi grassi, lipolisi ,e secrezione di insulina [Carling et al., 2004]. Questa ipotesi è sostenuta dal fatto che il resveratrolo, attivando molecole segnale come eNOS e Akt attraverso il pathway di AMPK, risulta essere in parte responsabile delle attività regolate dallo stesso AMPK durante il precondizionamento ischemico [Penumathsa et al., 2008], risultando elemento chiave nella protezione nella protezione dei cardiomiociti contro i danni da ischemia riperfusione in seguito a fenomeni di precondizionamento [Terai et al., 2005; Russell et al., 2004]. Sudi recenti confermano che SIRT-1, NO, AMPK e p38 MAPK giocano un ruolo importante
21
nell’effetto del resveratrolo sul precondizionamento ischemico [Chander et al., 2005; Hattori et al.,
2002].
Azione Antiaging
Il resveratrolo rallenta l'invecchiamento ed aumenta la durata della vita negli eucarioti semplici (S. cerevisiae, C. elegans, D. melanogaster).Gli effetti osservati sono simili a quelli della restrizione calorica (CR), per cui il RSV funziona da mimetico della restrizione calorica [Baur et al., 2006;
Lagouge et al., 2006; Barger et al., 2008]. Tuttavia l’attività biologica in grado di spiegare questi
effetti anti-invecchiamento del resveratrolo e che ha destato maggiore attenzione resta quella di funzionare da attivatore delle Sirtuine [Howitz et al., 2003; Borra et al., 2005; Kaeberlein et al.,
2005].
Fig.5 Schema riassuntivo
delle molteplici azioni del Resveratrolo
22
CAPITOLO 4
4.1 LE SIRTUINE
Le Sirtuine (SIRT, Silent Information Regulator Two) sono enzimi appartenenti alla famiglia degli istoni deacetilasi (HDAC). Queste proteine sono coinvolte in molteplici processi cellulari, che nell’insieme favoriscono la sopravvivenza cellulare [North et al., 2004; Sinclair et al., 2006; Finkel
et al., 2009]. Dato il loro coinvolgimento in numerose attività cellulari, recentemente è stata
avanzata l’ipotesi di un loro utilizzo come bersaglio terapeutico nella cura di malattie metaboliche, neurodegenerative e proliferative [Yamamoto et al., 2007; Kucińska et al., 2010]. Il capostipite di questa famiglia di proteine è Sir2 [Frye, 1999], isolato in Saccharomyces cerevisiae ma nei mammiferi sono stati ad oggi identificati sette omologhi denominati SIRT 1, 2, 3, 4, 5, 6, 7; queste sette isoforme hanno diverse localizzazioni a livello cellulare: SIRT1 si trova nel citoplasma [Moynihan et al., 2005] e nel nucleo, SIRT3-4-5 nei mitocondri, SIRT2 ha localizzazione citoplasmatica e SIRT6 e SIRT7 si trovano nel nucleo [Yamamoto et al.,2007]. All’interno della grande famiglia delle HDACs, le sirtuine appartengono alla classe III, poiché a differenza delle classi I e II convertono la proteina substrato acetilata, con l’uso di NAD+, in una proteina deacetilata ed inoltre non sono inibite dalla tricostatina A [Landry et al., 1997].
Le Sirtuine catalizzano una reazione unica (Fig. 6) che richiede la presenza del coenzima NAD+. In questa reazione, la NAM è liberata da NAD+ e il gruppo acetile della proteina substrato, viene trasferito su NAD+, generando a sua volta il metabolita O-acetil-ADP-ribosio [Sauve et al., 2006].
23
Fig.6 La reazione di deacetilazione delle proteine da parte delle sirtuine [Hao C. and Haase V.,
2010].
Gli istoni H1, H3, H4, che sono i maggiori componenti della cromatina, sono substrati fisiologici delle SIRT; in particolare la Lys 4 sull’istone H4 sembra essere il residuo più critico [Vaquero et
al., 2004].
L’acetilazione degli istoni è uno degli eventi importanti per l’attivazione dell’espressione genica: l’acetilazione delle Lisine, che si trovano nel core degli istoni, è associata all’attività di trascrizione in quanto induce un cambiamento di conformazione della cromatina, che consente l’accesso ai promotori genici [Cheung et al., 2000]; la deacetilazione, invece, sposta la bilancia verso la condensazione della cromatina e il silenziamento dell’espressione genica [Nakahata et al., 2008]. L’attività deacetilasica sugli istoni è importante nella sopravvivenza cellulare in quanto bilancia il processo di acetilazione istonica. L’acetilazione, è infatti un evento che si verifica normalmente a livello cellulare in quanto necessario per la trascrizione genica; tuttavia a lungo andare l’accumulo di siti acetilati risulta dannoso per la cellula. Questa modificazione può verificarsi anche in seguito ad un danno cellulare che, insieme ad altri eventi, conduce la cellula alla morte cellulare programmata[Koprinarova et al., 2010].
24
questi enzimi appare sempre più complessa con il procedere della ricerca scientifica.
4.2 SIRT1
SIRT1, una delle prime sirtuine studiate negli eucarioti, ortologo diretto di Sir2, è localizzata sia nel nucleo che nel citoplasma ed è espressa in tutti gli organi, anche se prevalente nei tessuti ad alto metabolismo energetico [Michishita et al., 2005].
Tra le sirtuine, SIRT-1 è quella col maggior numero di funzioni, ed ha un’ampia gamma di substrati [Yamamoto et al., 2007], anche se la sua azione è finalizzata alle attività cellulari che proteggono la cellula e ne favoriscono la sopravvivenza. Tra le diverse azioni, risalta la difesa nei confronti di eventi di stress, come quello ossidativo, lo shock termico, le radiazioni; oltre a promuovere la mobilizzazione dei grassi dal tessuto adiposo [Nakahata et al., 2008].
SIRT1 e la cromatina
A livello della cromatina, l’attività di SIRT1 si esplica prevalentemente sugli istoni H3 ( Lys 9 e 14) e su H4 (Lys 16) [Imai et al., 2000]. A differenza di altre classi I e II di HDAC, SIRT1 è molto più di un istone deacetilasi: grazie alla sua notevole capacità di legare numerosi fattori ed interessare molti substrati, SIRT1 è in realtà un coordinatore nella formazione di eterocromatina [Vaquero et
al., 2004; Vaquero et al., 2007].
Uno studio recente suggerisce che SIRT1 è coinvolta in entrambe le forme di eterocromatina, sia in quella costitutiva (CH) che in quella facoltativa (FH). CH si riferisce alle regioni che sono sempre mantenute come eterocromatina, porzioni ampiamente estese del cromosoma che hanno un ruolo piuttosto strutturale, contengono pochi geni e sono situate prevalentemente nelle regioni pericentromerica e nei telomeri. Invece, FH si riferisce a quelle regioni dove l’eterocromatina si
25
forma in determinate situazioni (ad esempio certe fasi del programma di sviluppo, e il ciclo cellulare), ma che possono tornare a eucromatina non appena è necessario; si tratta di regioni che possono estendersi per un paio di kilobasi o un intero cromosoma e che possono avere un’alta densità di geni [Craig, 2005; Trojer et al., 2007].
In particolare SIRT1 determina una serie di eventi che portano a formare l’eterocromatina [Vaquero, 2009], ad esempio deacetila la lisina K9 sull’istone H3 e la lisina K16 sull’istone H4, ed interagisce e recluta l’istone linker H1 [Vaquero et al., 2004], un fattore chiave nella formazione della fibra di 30 nm (avvolgimento eterocromatinico) [Hansen, 2002].
La principale forma biologica di SIRT1 è un omotrimero di ca. 350 kDa [Vaquero et al., 2004]. Come le altre sirtuine , SIRT1 manca della capacità di legare direttamente il DNA e deve essere reclutato nelle regioni bersaglio del DNA.
Sebbene numerosi geni che sono bersaglio di SIRT1 non sono stati ancora identificati, tutti i dati suggeriscono che SIRT1 partecipa nella regolazione di molti geni attraverso la formazione di FH coordinando diversi eventi [Vaquero et al., 2004].
Attivazione di SIRT-1
Studi condotti su colture di cellule di mammifero evidenziano il ruolo “emergenzionale” di SIRT1 che è attivata in risposta alla deprivazione dei fattori di crescita ed all’aumentato stress ossidativo [Denu, 2003]. L’attività deacetilasica di Sir2 e dei suoi omologhi è controllata da cambiamenti nello stato redox della cellula (come quelli che si hanno durante l’ipossia od il precondizionamento ischemico), in particolare nella concentrazione di NAD + o nel rapporto di concentrazione tra NAD+ e la sua forma ridotta NADH [Denu, 2003].
SIRT1 e la sopravvivenza cellulare
26
al., 2004; Guarente et al., 2006], andando a interagire e deacetilare fattori chiave coinvolti nella
risposta allo stress, compreso NF-k B [Yeung et al., 2004] e la famiglia Forkhead Box Class O (FOXO) [Brunet et al., 2004; Motta et al., 2004; van der Horst et al., 2004], modulandone l’attività trascrizionale.
In particolare i fattori FOXO sono una famiglia di fattori di trascrizione che regolano il destino della cellula modulando l'espressione di geni coinvolti nell’apoptosi, le transizioni del ciclo cellulare, la riparazione del DNA, lo stress ossidativo, la longevità, il controllo della crescita muscolare, la differenziazione cellulare e il metabolismo del glucosi [Accili et al., 2004; Barthel et al., 2005;
Greer et al., 2005].
Le proteine FoxO attivate svolgono un ruolo chiave nel favorire la sopravvivenza cellulare [Haojie
Huang, et al.; 2006], legandosi ad esempio ai promotori dei geni codificanti per la superossido
dismutasi (SOD) e la catalasi, con conseguente aumento della resistenza cellulare allo stress ossidativo e ai segnali di apoptotici [Brunet et al., 2004; Balaban et al., 2005; Kops et al. 2002 ;
Nemoto et al.,2002; Dioum et al.;2009].
Un chiaro esempio si ha dall’interazione di SIRT1 con FOXO3a: in seguito alla deacetilazione indotta da SIRT-1 in risposta allo stress ossidativo, FOXO3a trasloca dal citoplasma a livello nucleare [Brunet et al., 2004], dove deacetilato, si lega alla SIRT1 formando un complesso che induce l’arresto del ciclo cellulare ed aumenta la resistenza allo stress ossidativo, oltre ad inibire l’apoptosi FOXO3a mediata [Frescas et al., 2005].
Protezione dal danno ipossico
Studi recenti dimostrano che SIRT1 è protettiva nei confronti del danno ipossico grazie anche all’attivazione dei fattori di trascrizione HIF [Dioum et al., 2009; Lim et al., 2010].
27
2000] in quanto in condizioni di normossia sono instabili e poco attivi per effetto di una
modificazione post traduzionale operata da idrossilasi specifiche [Bruick et al., 2001; Epstein et al.,
2001; Mahon et al., 2001]; quando la concentrazione di ossigeno diminuisce, l’attività delle
idrossilasi diminuisce ed aumenta la forma attivata di HIF. Un aspetto interessante è pero che le due forme proteiche HIF presenti a livello cellulare e denominate HIF1 e HIF2 hanno peculiarità regolatorie diverse, infatti mentre l’attivazione del fattore HIF-1α è esclusivamente ossigeno dipendente [Wang et al., 1995; Sperandio et al., 2009; Rius et al., 2008], HIF-2α è regolato anche e soprattutto da altri fattori, tra i quali c’è anche l’attività deacetilasica.
L’attivazione diHIF-2α, in seguito a deacetilazione è in grado di interagire a livello nucleare e attivare numerosi geni, tra cui Sod2, che codifica per la super ossido dismutasi, VegfA, che codifica per il fattore di crescita endoteliale VEGF ed Epo, che a sua volta codifica per l’eritropoietina; tutti questi sono fattori importanti di difesa cellulare soprattutto in tessuti e organi particolarmente suscettibili agli insulti di tipo ipossico, quali ad esempio rene, cuore ed encefalo [Dioum et al.;2009].
SIRT1 e Heat shock
Un recente studio condotto da Westerheide ha dimostrato che anche l’attività del fattore di trascrizione Heat Shock Factor (HSF1) è regolato dall’enzima SIRT1 [Westerheide et al., 2009].
HSF-1 esiste come monomero in cellule sane, mentre in risposta a stress quali calore, ipossia, radicali liberi o deplezione di ATP, si trasforma in un trimero e trasloca nel nucleo, dove, una volta fosforilato, si lega ai promotori di geni che codificano per le shock proteins (HSP) [Pirkkala et al.,
2001]. In risposta allo stress, HSF-1 viene acetilato dall’enzima istone acetiltrasferasi p300, e si
dissocia dal suo legame alla sequenza bersaglio; l’attivazione di SIRT1 riduce l’acetilazione di HSF1, prolungandone pertanto il legame ai promotori e aumentando la risposta al calore
28 [Westerheide et al., 2009].
Controllo della proliferazione cellulare e dell’apoptosi
Molti fattori che guidano la proliferazione cellulare e l’apoptosi sono substrati della SIRT1. Tra questi uno dei più studiati è p53 [Langley et al., 2002], che nella sua forma iperacetilata innesca l’apoptosi ed arresta il ciclo cellulare [Appella et al., 2001], pertanto la deacetilazione di p53 ad opera di SIRT1 inibisce l’attività pro-apoptotica di p53 e la senescenza cellulare [Luo et al. 2001;
Vaziri et al., 2001].
SIRT-1, inoltre si lega e deacetila anche i fattori NBS1 (Nijmegen Breakage Syndrome 1) e Ku70, entrambi coinvolti nella riparazione del DNA. Nello specifico, NBS1 svolge un importante ruolo nel rilevare la presenza di danni al DNA e di regolarne la riparazione [Yuan et al., 2007], mentre Ku70 opera nella riparazione delle rotture a doppio filamento e sequestra il fattore proapoptotico Bax impedendo che quest’ultimo eserciti la sua azione nel mitocondrio [Cohen et al., 2004]. L’interazione di SIRT1 potrebbe pertanto avere implicazioni nella riparazione delle rotture a doppio filamento del DNA [Uhl et al., 2010], dato che il reclutamento della SIRT1 a livello genomico avviene anche nei siti danneggiati, evento che correla con la compattazione della cromatina e con il silenziamento di queste regioni [O’ Hagan et al., 2008].
Per quanto riguarda la regolazione del ciclo cellulare, il coinvolgimento di SIRT1 trova conferma nel fatto che all'uscita del ciclo cellulare [Sasaki et al., 2006] si osserva una sua inibizione. I dati attuali suggeriscono che SIRT1 regoli alcuni principali attori nel controllo del ciclo cellulare, come il fattore del retinoblastoma (Rb), un oncosoppressore che controlla la transizione G1/S tramite il legame al fattore di trascrizione E2F [Wong et al., 2007; Weinberg R. A, 1995]. La deacetilazione del fattore Rb ad opera della SIRT1 fa si che si generi un’efficiente fosforilazione di Rb che a sua volta causa la dissociazione del complesso Rb-E2F, abilitando la trascrizione E2F
29
dipendente dei geni che mediano la fase S del ciclo cellulare, inducendo così la progressione del ciclo cellulare [Mittnacht S., 1998;Brown V. D. and Gallie B. L., 2002].
Recentemente è stato suggerito che SIRT1 promuova l’autofagia, un meccanismo coinvolto nella degradazione delle proteine e degli organelli danneggiati. Questo meccanismo, la cui alterazione potrebbe essere una chiave di lettura dei fenomeni di invecchiamento cellulare, è in effetti intimamente legato alla presenza ed attività di SIRT1, come evidenziato dal fatto che fibroblasti isolati da embrioni di topo SIRT1-/- non sono in grado di attivare l’autofagia nelle condizioni di stress [Lee et al., 2008].
SIRT1 - sviluppo e differenziazione cellulare
Uno studio condotto su cellule staminali embrionali di topo ha dimostrato che i livelli di SIRT1 sono elevati in cellule non differenziate, ma diminuscono nella differenziazione [Kuzmichev et al.,
2005]. Il ruolo di SIRT1 nell’antagonizzare il differenziamento cellulare è dipendente anche dallo
stato metabolico, ad esempio nelle cellule della muscolatura scheletrica e del tessuto adiposo bianco, l’attivazione di SIRT1 si verifica durante il digiuno, andando a silenziare l’espressione di geni chiave nello sviluppo di entrambi i tipi di tessuto [Picard et al., 2004].
Anche nel tessuto nervoso la differenziazione è dipendente da cambiamenti metabolici regolati da SIRT1: in caso di stress ossidativo, cellule progenitrici neurali (NPC) smettono di proliferare e si differenziano in cellule astro-gliali (anziché neuroni) [Prozorovski et al., 2008].
Ancora, SIRT1 è coinvolta anche nella fase differenziativa della gametogenesi: topi knockout SIRT1 -/- sia maschi che femmine risultano infatti sterili, con esaurimento progressivo delle cellule germinali differenzianti [McBurney et al., 2003].
30
Controllo dell’attività metabolica
Come già riportato, SIRT1 è particolarmente espressa nei tessuti muscolare ed adiposo ed è fondamentale per il metabolismo in condizioni di digiuno [Picard et al, 2004]. Durante questa fase l’attivazione di SIRT1 è determinante nella modulazione di alcuni enzimi del metabolismo intermedio (ad esempio l'isoforma citosolica di acetil-CoA sintetasi coinvolto nella formazione di acidi grassi da acetato) [Hallows et al., 2006] e attraverso la regolazione di segnali endocrini, in particolare del metabolismo dei carboidrati e dei lipidi.
Particolarmente importante è il ruolo di SIRT1 nell'omeostasi del glucosio, attraverso il suo effetto combinato sul pancreas, fegato e tessuto adiposo bianco [Amat et al., 2007; Feige et al., 2008]. Esso promuove una serie di effetti:
- la produzione di insulina in cellule pancreatiche [Bordone et al., 2006],
- la gluconeogenesi epatica e la fuoriuscita di glucosio epatico [Rodgers et al., 2005]
- la mobilizzazione dei grassi, l'inibizione della adipogenesisi e della differenziazione degli adipociti [Picard et al., 2004]
- attivazione di AMPK [Baur et al., 2006].
E’ stato proposto che AMPK, che rileva le alterazioni dei livelli di energia cellulare attraverso il monitoraggio del rapporto AMP/ATP, possa partecipare alle risposte innescate dalla restrizione calorica attraverso i suoi effetti sulla biogenesi mitocondriale [Hardie DG., 2011], e da alterazioni delle vie anaboliche e cataboliche, in quanto risulta essere attivata nei neuroni ipotalamici e negli epatociti in risposta a una restrizione dietetica [Pallottini et al., 2004; Minokoshi et al., 2004;
Terai et al., 2005].
Recentemente è stato riscontrato come l’interazione del resveratrolo con SIRT1 regoli almeno parte di queste ultime attività metaboliche visto che, somministrato ad alte dosi a topi obesi con caratteristiche simili alla sindrome metabolica umana, sposta la loro fisiologia verso la condizione
31
di topi non obesi con una dieta standard [Baur et al., 2006]; i meccanismi principali modulati sono risultati essere l’aumento della sensibilità insulinica, la riduzione dei livelli di insulin-like growth factor-1 (IGF-I), l’aumento dell’attività di AMPK e di PGC-1alfa, l’aumento del numero e della funzione motrice dei mitocondri [Baur et al., 2006]. L’attivazione di AMPK potrebbe pertanto essere un importante mediatore delle azioni del resveratrolo, visto che fra le molte azioni del resveratrolo che mimano quelle osservate in risposta all’attivazione dell’AMPK, vi è anche la biogenesi mitocondriale [Dasgupta et al., 2007].
Restrizione calorica, SIRT-1 e RSV
La restrizione calorica (CR) è un regime dietetico che limita l'assunzione di calorie ed estende significativamente la durata della vita in numerosi organismi dal lievito, ai nematodi, ai roditori e verosimilmente ai primati [Lin et al., 2000; Barger et al., 2003; Ingram et al., 2004; Bordone et al.,
2005].
Nei mammiferi ritarda molti aspetti di processi di invecchiamento, inclusi mortalità età-correlata, cancerogenesi, declino fisiologico [Weindruch R et al., 1988], aterosclerosi e diabete [Masoro,
2000] e lo stabilirsi di profili trascrizionali eta-correlati [Lee et al., 1999].
Gli effetti benefici che derivano dalla restrizione calorica assomigliano a quelli che sono indotti dal resveratrolo compresi il rallentato dell’invecchiamento e la ritardata insorgenza di malattie croniche [Wood., 2004], suggerendo che i pathway molecolari attraverso cui agisce il resveratrolo sono quelli attivati dalla restrizione calorica.
Del resto, l’importante ruolo anti-aging del resveratrolo si deve principalmente alla sua funzione agonista per SIRT1, oltre alla capacità di mimare la restrizione calorica ed aumentare la durata della vita, esercitando complessivamente effetti antiinvecchiamento [Howitz et al., 2003; Kaeberlein et
al., 2005].
32
dell’ insulina / IGF e l’aumento della biogenesi mitocondriale [Baur et al., 2006; Zhang et al.,
2006]. È interessante notare come le alterazioni della segnalazione dell'insulina e dell'attività
mitocondriale derivano anche dall’attivazione dell’AMPK [Wang et al., 2005; Bergeron et al.,
2001; Kukidome et al., 2006].
Recentemente è stato suggerito che le sirtuine potrebbero essere proprio il denominatore comune che spiega entrambi gli effetti del resveratrolo e della restrizione calorica [Yamamoto et al., 2007]; peraltro è ampiamente documentato che SIRT1 aumenta la durata della vita nel lievito con una modalità simile alla restrizione calorica [Lin et al., 2000; Anderson et al., 2003].
Alcuni studi hanno dimostrato che la restrizione calorica è in grado di attivare eNOS e determinare la biogenesi mitocondriale grazie ad un aumento dell’espressione e dell’attivazione della SIRT1 [Nisoli et al., 2005].
Dall’analisi funzionale dei profili dell’espressione genica in diversi tessuti tra cui cervello, muscolo scheletrico e cardiaco, è stato riscontrato che la restrizione calorica ed il resveratrolo sembrano avere un impatto maggiore sull’espressione di geni coinvolti nel rimodellamento della cromatina, oltre a modificare l’espressione di molti geni codificanti istoni [Barger et al., 2008]; questi aspetti suggeriscono un possibile meccanismo comune per l’azione del RSV e della CR, che potrebbe innescarsi in risposta a segnali di stress metabolico [et al., 2007].
Probabilmente la restrizione calorica ed il resveratrolo promuovono la stabilità genomica e ritardano l’invecchiamento attraverso un meccanismo simile che può coinvolgere altri “cromatin modifier”, tra cui SIRT1.
L’alterazione nella struttura cromosomica e nella trascrizione potrebbe inoltre promuovere pathways che mantengono la stabilità genomica, o prevengono le alterazioni epigenetiche e ritardano qualche aspetto dei processi di invecchiamento a lungo termine [Barger et al.,2008].
33
4.3 SIRT1 E NEFROPROTEZIONE
Studi condotti su topi hanno dimostrato la presenza della SIRT1 nel rene, in particolare come l’espressione sia significativamente maggiore nella zona midollare rispetto a quella corticale. Essendo questa la zona sottoposta maggiormente a condizioni di stress ossidativo, tale presenza fa supporre un ruolo antiossidante della SIRT1. Infatti, gli stessi autori He et al hanno voluto indagare il ruolo della SIRT1 nella protezione da questo tipo di danno: In un primo momento hanno valutato la capacità del resveratrolo (alla concentrazione 5µM) di proteggere in presenza di uno stimolo ossidativo (H2O2 250µM, 12h). Trovando conferma di tale capacità dall’aumento della
sopravvivenza cellulare, hanno silenziato le cellule per il gene sirt1 e poi esposte a stress ossidativo (H2O2 250µM, 12h) sia in presenza che in assenza del resveratrolo (5µM). E’ emerso che nelle
cellule silenziate per la SIRT1 la sopravvivenza cellulare in presenza dello stimolo ossidativo era significativamente ridotta rispetto a quelle non silenziate; in queste ultime la presenza del resveratrolo, dotato tra l’altro di attività antiossidante, non riusciva a proteggere le cellule, né ad aumentare la sopravvivenza cellulare. Quanto osservato dimostra un ruolo antiossidante da parte della SIRT1 [He W. et al, 2010], a conferma dei dati di un altro lavoro [Hasegawa et al.,2008] in
vitro su cellule del tubulo prossimale renale nel quale gli autori hanno dimostrato come uno stimolo
di natura ossidativa (H2O2) a concentrazioni crescenti, determinasse un aumento concentrazione
dipendente dell’espressione della SIRT1.
Questo aspetto trova conferma nella natura “emergenziale” di SIRT1. Per confermare il ruolo critico di SIRT1 anche in questo tipo di danno cellulare, le cellule sono state trasfettate per over-esprimere la SIRT1, quindi incubate con H2O2 e valutata l’apoptosi: nelle cellule trasfettate si
osservava una marcata riduzione significativa del numero di cellule apoptotiche.
Un altro studio interessante condotto nell’ultimo anno, che ha messo in evidenza la funzione protettiva della sirt1 a livello renale sia in vivo che vitro è quello di Duk Hoon kim et al., 2011. Gli
34
autori hanno dimostrato il ruolo dell’espressione e attivazione della SIRT1 nel danno nefrotossico indotto dal cisplatino, responsabile di un danno citotossico di tipo radicalico, con estesa apoptosi delle cellule tubulari.
In vitro è stata osservata una riduzione sia dell’attività che dell’espressione della SIRT1 dopo
incubazione con il cisplatino (20 µg/ml); viceversa l’incubazione con resveratrolo (100µM per 30 minuti) prima dell’incubazione con il cisplatino, determinava un aumento di questo enzima e una conseguente riduzione del numero di cellule apoptotiche. Questo è stato confermato anche dallo studio condotto in vivo dove il resveratrolo oltre a ridurre l’apoptosi migliorava la funzionalità renale.
Ad oggi l’NO è principale induttore cellulare dell’attività enzimatica di SIRT-1. Questo spiega perché il RSV è considerato un attivatore naturale di SIRT-1. Il legame tra RSV e SIRT-1 permette inoltre di spiegare molti effetti cellulari dovuti al RSV e mediati dall’attivazione di SIRT-1, come la biogenesi mitocondriale [Nisoli N. et al., 2005], il precondizionamento ischemico [Morris KC. et
al., 2011, Hong KS. et al., 2012] e la restrizione calorica [Howitz KT. et al., 2003].
Tuttavia questi ultimi lavori su linee cellulari renali trasfettate per overesprimere SIRT-1 lasciano ipotizzare che non tanto un aumento dell’attivazione di questo enzima quanto l’aumento dei suoi livelli di espressione potrebbero giocare un ruolo chiave nel destino cellulare di popolazioni renali sottoposte a stimoli citotossici di natura ossidativa.
Fig.7 Effetto del RSV nell’ I/R
L-NAME
eNOS