3.3
Sistemi elettroforetici microfabbricati
L’obiettivo della microingegneria è produrre un sistema integrato completo (microsistema), costituito sia da circuiti microelettronici che da dispositivi e strutture tridimensionali le cui dimensioni sono dell’ordine del micron. Con micromachining si intendono le tecniche utilizzate per produrre le strutture di un microsistema. Le tecniche inizialmente sviluppate dall’industria della microelettronica (come fotolitografia o
etching chimico) vengono utilizzate per l’integrazione di dispositivi, per
esempio sensori o sistemi meccanici, con l’elettronica di controllo.
Le proprietà fisiche del silicio fanno si che esso possa essere impiegato nella costruzione di diverse strutture microfabbricate ma è anche possibile utilizzare tecniche ibride in cui diverse parti vengono realizzate su diversi substrati (per esempio di vetro) e poi connesse insieme. Il vantaggio risiede nell’ottimizzazione delle singole parti e nella possibilità di svilupparle senza pericolo di danneggiare i componenti già presenti sul substrato. I dispositivi monolitici sono tipicamente molto più compatti, affidabili e meno costosi rispetto ai dispositivi ibridi. Infatti l'interconnessione dei vari moduli, oltre a essere un costo aggiuntivo, è un momento delicato in cui si rischia di danneggiare il dispositivo.
L’ estrapolazione del genoma umano richiede oltre 50 milioni di reazioni di sequenziamento differenti: è impensabile affrontare un problema di questo tipo con le tecniche tradizionali presentate nel capitolo 2 [21]. Occorre automatizzare e velocizzare le complicate procedure di analisi. Questo appare possibile pensando a un processo di fusione tra domini e competenze molto diverse. Le tecniche di microfabbricazione permettono di trasportare gli ingombranti e costosi dispositivi impiegati per i test
diagnostici del DNA su chip, integrando diversi componenti in un unico dispositivo che risolve le procedure biochimiche. La miniaturizzazione permette di realizzare dispositivi compatti molto veloci, affidabili e talvolta utilizzabili in architetture parallele permettendo una elevata elaborazione di dati contemporaneamente. Le piccole dimensioni del dispositivo permettono inoltre una significativa riduzione dei reagenti di consumo (in qualche caso anche cancerogeni come l’acrilamide) riducendo sia i rischi per la salute dei ricercatori che i costi di sequenziamento.
I microsistemi attualmente più usati non sono completamente autonomi; tipicamente sostituiscono alcune parti del dispositivo di analisi, mentre il resto rimane inalterato. Si tratta soprattutto di dispositivi ibridi in cui il biochip è tipicamente realizzato in vetro. L’utilizzo di materiali non costosi, come la plastica, potrebbe portare alla fabbricazione di strumenti monouso precaricati con materiali di setaccio [22].
I metodi principali per la costruzione di microstrutture sono due: la tecnica bulk micromachining in cui le strutture vengono ricavate dal substrato tramite attacchi chimici, e la surface micromachining dove le microstrutture vengono formate dalla deposizione e lavorazione di strati deposti sul substrato.
3.3.1
Sequenziamento del DNA usando array
microfabbricati per elettroforesi capillare
Come precedentemente visto, l’elettroforesi capillare (CE) è la tecnica migliore per le analisi di DNA ed è stata usata per la misurazione di frammenti di restrizione, per l’analisi di prodotti di PCR, per il sequenziamento di DNA…
Le separazioni CE sono più veloci delle tradizionali elettroforesi slab
gel (per esempio la configurazione detta “gel sottomarino” vista
precedentemente) in quanto è possibile applicare elevati campi elettrici; tuttavia le CE convenzionali hanno lo svantaggio di permettere l’analisi di un solo campione per volta.
È nata quindi l’esigenza di sviluppare array per elettroforesi capillare (“Capillary Array Electrophoresis”, CAE) in cui le separazioni sono realizzate usando un insieme di capillari di silice paralleli ed è stato dimostrato essere possibile il loro uso per sequenziare il DNA [23]. Successivamente, dopo l’introduzione nel 1992 da parte di Manz e Harrison dell’uso della microfabbricazione per produrre capillari per separazioni elettroforetiche, è stata possibile la realizzazione micro-array di capillari su chip di vetro per separazioni elettroforetiche (µCAE).
Lo schema semplificato di un capillare per elettroforesi su chip è presentato in figura 3.15.
Il capillare è formato da due rami che si intersecano, alle cui estremità sono posizionati serbatoi e al cui interno è presente una matrice setaccio per la separazione. Il ramo più lungo è quello su cui avviene la corsa elettroforetica e collega i serbatoi 2 e 4, mentre quello più corto è usato per iniettare il campione da analizzare all’interno del dispositivo e collega i
Figura 3.15: schema a “croce” del capillare per elettroforesi su chip (visione dall’alto). I numeri indicano i diversi serbatoi.
serbatoi 3 (“Sample”) e 1 (“Waste”). I campioni da sequenziare sono ottenuti usando la chimica standard di sequenziamento didesossi (tecnica di Sanger) e sono opportunamente marcati.
La procedura di analisi prevede una fase di iniezione del campione, seguita dalla fase di corsa elettroforetica (fig. 3.16). Durante la fase di iniezione viene applicato, per un tempo prestabilito, un potenziale fra i punti 1 e 3, che ha come effetto la migrazione del DNA, precedentemente posizionato nel serbatoio 3, verso il serbatoio 1 (fig. 3.16 in alto). Quindi, dopo aver equilibrato i potenziali tra 1 e 3, si applica un potenziale fra i punti 4 e 2 che fa si che il campione di DNA che si trova all’incrocio fra i due rami migri verso il serbatoio 4 (fig. 3.16 in basso). Un sistema di rivelazione nei pressi del punto 4 evidenzia infine i risultati della corsa effettuata.
Fra i problemi da affrontare nell’elettroforesi ci sono quello costituito dalla presenza sulle pareti interne dei capillari di gruppi silanolo, che possono interagire con gli analiti sotto esame, e quello del fenomeno del flusso elettroosmotico (EOF), che in casi estremi può addirittura causare la fuoruscita del campione sotto analisi dal capillare a causa degli alti potenziali applicati [24]. Per evitare le interazioni e l’EOF, che causano una perdita di efficienza nella separazione e irriproducibilità, è preferibile rendere le analisi dei campioni indipendenti da questi potenziali fattori di
Iniezione
“corsa”
Figura 3.16: descrizione della fase di iniezione e di corsa elettroforetica del campione.
disturbo e quindi le pareti interne dei capillari sono rivestite seguendo opportune procedure, tra le quali quella di Hjerten, che per primo ha trovato il modo di eliminare tali effetti potenzialmente negativi.
L’uso della configurazione a croce dei canali trova giustificazione nel fatto che l’iniezione mediante elettroforesi del campione produce una sua parziale pulizia in quanto con la scelta di un tempo di iniezione opportuno (di solito circa 60 s), solo i campioni desiderati finiranno nel ramo di “corsa” vero e proprio. Infatti le molecole più grandi che non devono essere analizzate, come gli stampi di DNA e la DNA polimerasi usate per la clonazione dei campioni o eventuali contaminanti enzimatici, avendo mobilità elettroforetica minore e non essendo quindi sull’incrocio fra i rami quando viene applicato il secondo potenziale, rimangono escluse dalla corsa elettroforetica [25].
Nel corso degli anni innumerevoli modifiche sono state fatte alla struttura base sopra presentata mirate a ottenere un miglioramento delle prestazioni del dispositivo e un maggior impacchettamento con l’introduzione di percorsi elettroforetici a “serpentina” che permettono un’occupazione migliore degli spazi consentendo corse elettroforetiche più lunghe pur occupando una ridotta superficie del chip (fig. 3.17) [26].
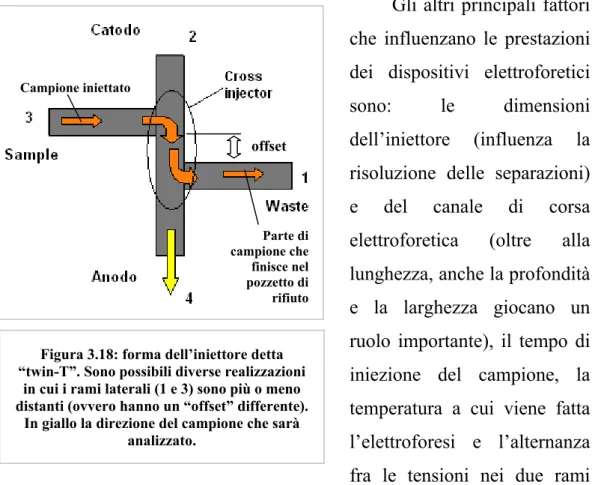
Anche la fase di iniezione è stata modificata rispetto agli studi iniziali introducendo l’iniettore detto “twin-T” (fig. 3.18). Diversi esperimenti hanno dimostrato che realizzando un “offset” fra i rami 3 e 1, si migliorano le prestazioni della corsa elettroforetica iniettando nel canale di corsa un maggior quantitativo di campione da analizzare [27]. Valori tipici di tale offset sono in un range di 100 e 500 µm a seconda del dispositivo che viene realizzato13.
Gli altri principali fattori che influenzano le prestazioni dei dispositivi elettroforetici sono: le dimensioni dell’iniettore (influenza la risoluzione delle separazioni) e del canale di corsa elettroforetica (oltre alla lunghezza, anche la profondità e la larghezza giocano un ruolo importante), il tempo di iniezione del campione, la temperatura a cui viene fatta l’elettroforesi e l’alternanza fra le tensioni nei due rami che determinano le fasi di caricamento e di corsa.
In figura 3.19 è presentata una tipica sezione trasversale di un canale di corsa. Come mostrato nei grafici, la profondità ha una notevole influenza sulla sensibilità di rivelazione. Si osserva che aumentando la profondità del canale, aumenta anche l’intensità di fluorescenza relativa raccolta dal
13 Tutti i valori indicati in questo paragrafo sono dati per fornire ordini di grandezza dei differenti elementi. La grande varietà delle applicazioni in questo settore impedisce di fornire range di grandezze più piccoli o dati più precisi, se non per specifici esempi.
Figura 3.18: forma dell’iniettore detta “twin-T”. Sono possibili diverse realizzazioni
in cui i rami laterali (1 e 3) sono più o meno distanti (ovvero hanno un “offset” differente).
In giallo la direzione del campione che sarà analizzato. offset Campione iniettato Parte di campione che finisce nel pozzetto di rifiuto
rivelatore (che è posizionato sotto il canale). Nell’esempio considerato (lunghezza effettiva del canale di separazione circa 6-7 cm e iniettore “twin-T” con offset di 250 µm), i risultati migliori si hanno per una profondità di 55 µm; oltre tale valore non sono apprezzabili ulteriori miglioramenti (si ha un effetto plateau) e in più si riscontra un incremento dell’effetto Joule: ciò consiglia l’utilizzo di una profondità di circa 50 µm.
La temperatura influenza la risoluzione e il tempo di sequenziamento. Esiste una temperatura ottimale per il chip che aumenta la risoluzione, oltre la quale si ha una diffusione delle bande e quindi una degradazione della separazione. Il numero di basi sequenziate è fortemente dipendente dalla temperatura; per esempio, a parità di strumento, a 20°C possono essere sequenziate in 12 min circa 600 bp, mentre a 65°C, gli stessi frammenti sono sequenziati in meno di 7 min [25].
Figura 3.19: in alto, sezione tipica di un canale di corsa; in basso: relazioni fra
profondita di canale e intensità di fluorescenza rilevata. [27, 25]
Per analisi genetiche su larga scala è necessario realizzare µCAE (“micro Capillary-Array electrophoresis”) con più canali per effettuare più corse elettroforetiche contemporaneamente.
In figura 3.20 è presentato il progetto di un micropiano per µCAE radiale con 96 canali. Tale sistema ha un anodo comune posto nel centro di un wafer di vetro “Boroflat” di diametro di 10 cm e un array di 96 canali che dalla periferia convergono verso il centro [28]. I canali sono realizzati usando la maschera di figura 3.20 tramite
etching isotropo e sono larghi
110 µm, profondi circa 50 µm, e hanno una iniezione di tipo “twin-T” che dista 33 mm dal rivelatore.
Il sistema è costituito da 48 unità, ciascuna composta da due canali con serbatoi per il campione indipendenti e catodo e serbatoio di rifiuto (“waste”) comuni; in questo modo il numero di serbatoi (193) è ridotto circa della metà rispetto a un sistema che prevede quattro serbatoi per ogni canale.
Questo tipo di struttura, con canali di corsa elettroforetici diritti, è particolarmente indicata per rapide analisi di genotipi con alte prestazioni, mentre una struttura come quella di figura 3.21, con percorsi dei canali
Figura 3.20: modello di maschera per la realizzazione di un micropiano per elettroforesi capillare a 96 canali . I canali di
separazione hanno una iniezione di tipo “twin-T” con offset di 200 µm e canali profondi 50 µm. La distanza dal punto di
inserzione al rivelatore è di 33 mm. Il substrato ha un diametro di 10 cm. [28]
tortuosi, è maggiormente indicata per lunghe letture di sequenziamento del DNA [29].
Il protocollo di fabbricazione per il wafer di vetro “Boroflat” di 150 mm di figura 3.19, è simile a quello usato nell’industria dei semiconduttori [30]. Dopo aver rivestito il wafer con uno strato di 2000 Å di silicio, segue la fase di stesura del fotoresist e l’esposizione ai raggi UV attraverso una maschera. Dopo lo sviluppo, il modello è trasferito allo strato di silicio tramite
reactive ion etching con plasma di SF6.
La formazione dei canali è realizzata con un etching in un bagno chimico isotropo del vetro in HF concentrato per circa 4 min; in questo caso la profondità dei canali è di circa 30 µm. Dopo la rimozione del fotoresist, vengono realizzati, con un trapano a punta di diamante, i 193 serbatoi di diametro 1.5 mm e viene rimosso dal wafer il silicio restante con reactive ion
etching. I microcanali sono quindi
isolati dall’ambiente esterno tramite sovrapposizione di un altro wafer di vetro, opportunamente forato in corrispondenza dei serbatoi. Prima di effettuare la separazione elettroforetica, i canali sono rivestiti secondo il protocollo di Hjerten e riempiti con opportuno buffer e matrice di separazione di poliacrilamide.
Figura 3.21. A) visione globale dell’insieme di microcanali. B) sezione verticale. C) visione ingrandita dell’iniettore e D) della
Nel caso di figura 3.21, ciascun canale di separazione è largo 200 µm, profondo 30 µm e ha una lunghezza effettiva di 15.9 cm, ottenuta usando quattro “iper-curve”.
Le curve nei canali sono necessarie per facilitare l’integrazione su wafer. Quando un canale per elettroforesi è usato per separazioni con bassa risoluzione, le curve hanno un piccolo impatto sulla qualità della separazione. Tuttavia, quando le curve sono usate per aumentare la lunghezza della colonna per realizzare separazioni ad alta risoluzione, la qualità della separazione può essere notevolmente compromessa in quanto la curva produce un allargamento della banda, che dipende direttamente dall’angolo di curva e dalla larghezza del canale di separazione [31]. L’efficienza ridotta è dovuta alla differenza di lunghezza di percorso tra le molecole che si muovono lungo il raggio esterno della curva e quelle che si muovono lungo il raggio interno. Questo problema è ulteriormente inasprito in situazioni che coinvolgono il trasporto elettrocinetico, dove la velocità molecolare è determinata dalla forza di campo elettrico. Poiché la lunghezza del percorso è maggiore lungo il raggio esterno, il campo elettrico lungo la traiettoria esterna è più piccolo e quindi le molecole avranno una più bassa velocità elettroforetica.
Sono state fatte ricerche considerando i parametri che causano la diffusione delle bande usando varie forme di canali (fig. 3.22). È stato visto che la fabbricazione di curve “assottigliate”, in cui la larghezza del canale nella curva è ridotta con l’obiettivo di ridurre la differenza di lunghezza del percorso tra i raggi interno ed esterno (ri e ro, in fig. 3.23), porta benefici al problema della diffusione.
Sono quindi stati analizzati gli effetti del raggio di curvatura della curva
Figura 3.22: differenti forme di canali studiate. [31]
(Rc), della lunghezza della regione
affusolata e della larghezza del
canale nella curva (Wt).
Sperimentalmente, si è osservato che i risultati migliori si hanno con un piccolo Rc (ovvero nell’esempio di
figura 3.19, Rc di circa 250 µm), una
piccola lunghezza di assottigliamento (circa 100 µm) e una piccola larghezza del canale in curva (65 µm), in modo tale che il rapporto di assottigliamento (n in figura 3.23) sia il più alto possibile (valore limite n=4; nell’esempio precedente, n è circa uguale a 3).
L’operazione di analisi elettroforetica di un sistema come quello di figura 3.21, comincia con il caricamento dei campioni, marcati con quattro colori diversi, mediante apposita apparecchiatura [28]; tale operazione viene effettuata su un piano scaldato a 50°C posizionato sopra lo scanner che effettuerà la rivelazione. Un array ad anello di elettrodi è posto sopra il chip per fornire le tensioni ai vari serbatoi (fig. 3.25).
Ciascun campione (circa 2 µl) viene quindi iniettato mediante elettroforesi dal deposito “sample” verso l’intersezione di iniezione applicando un campo elettrico di 500 V/cm per 60 s. Durante questo periodo non viene applicato alcun potenziale né all’anodo né al catodo.
La quantità di campione che si trova nel tratto di offset di 250 µm, viene spinta nella colonna di separazione a 200 V/cm, mentre un campo elettrico inverso di 200 V/cm è applicato ai serbatoi “waste” e “sample”;
Figura 3.23: definizione dei parametri che caratterizzano una curva che si assottiglia a una estremità in un canale
ciò consente di ritirare l’eccesso di campione dalla colonna di separazione e prevenirne la fuoruscita dai serbatoi. Queste condizioni sono applicate per 420 s. La forza del campo elettrico di separazione viene quindi portata a 240 V/cm mentre i potenziali sui serbatoi sono lasciati flottanti. L’analisi elettroforetica dei 96 campioni è completata in 24 min.
Per rivelare i frammenti di DNA etichettati fluorescentemente che sono separati nei microcanali, viene usato uno scanner a fluorescenza a eccitazione laser, con un percorso di scansione circolare. Lo schema di funzionamento dello scanner è rappresentato in figura 3.24: un raggio di eccitazione a 488 nm da un laser a ioni argon (Ar+) è indirizzato su un filtro dicroico (m1) a 45° che lo devia su uno specchio m2. Aggiustando
opportunamente lo specchio m2, il raggio è centrato nella parte inferiore di
un albero tubolare verticale che è mantenuto in rotazione da un motore a passo. Alla sommità dell’albero, il raggio è traslato di 1 cm rispetto all’asse di rotazione con un prisma a rombo e quindi focalizzato sui canali su cui avviene l’elettroforesi per mezzo di un obiettivo di microscopio.
Una terminazione di una fibra ottica è posizionata tra i microcanali nel percorso di scansione. L’altra terminazione della fibra è accoppiata a un fotodiodo che da inizio all’acquisizione dei dati quando il raggio focalizzato colpisce la fibra ottica.
La fluorescenza dei campioni è quindi raccolta dall’obiettivo del microscopio e compie il percorso ottico inverso passando per il filtro dicroico ed è centrato nelle aperture a3 e a4 del rivelatore a quattro colori
tramite un aggiustamento degli specchi m3 e m4.
Il sistema di rivelazione a quattro colori consiste di quattro unità modulari di tubi fotomoltiplicatori (PMT) sequenziali ed è capace di misure di fluorescenza da quattro regioni spettrali differenti, corrispondenti ai quattro colori di marcatura usati. Solitamente i colori usati sono il blu (regione spettrale 510-540 nm) associato alla citosina (C), il verde (545-570 nm) per l’adenina (A), il giallo (570-590 nm) per la guanina (G) e il rosso (590-660 nm) per la timina (T). Il segnale di fluorescenza nelle prime tre regioni spettrali è stato filtrato con un filtro passa banda, mentre la quarta regione con filtro passa basso e un filtro passa alto, la cui frequenza di taglio corrisponde a una lunghezza d’onda di 660 nm, necessario per ridurre la fluorescenza di fondo del vetro; la fluorescenza viene inoltre filtrata spazialmente in tutti e quattro i canali spaziali prima della rivelazione con fotomoltiplicatori. L’uscita analogica dei fotomoltiplicatori viene quindi filtrata con un filtro passa basso e digitalizzata con ADC a 16 bit, uno per ciascuna regione spettrale (fig. 3.25).
Per l’interpretazione dei risultati, sono usati opportuni software per il riconoscimento delle basi (per esempio il software BASEFINDER).
I risultati possono essere presentati in un formato simile a quello di un sequenziamento su gel, dove ogni banda su ciascuna linea rappresenta una base sequenziata (fig. 3.26). Il software consente inoltre sia una presentazione espansa di ciascuna linea sia la sostituzione del colore giallo col nero, per una migliore lettura delle basi (fig. 3.27).
Figura 3.26: risultati di 96 linee di sequenziamento. L’immagine contiene 41 kb sequenziate in 24
min, con una accuratezza > del
99 %. [30] Figura 3.25: schema completo dello scanner confocale rotatorio a 4 colori
L’uso di questa apparecchiatura µCAE produce una lunghezza di lettura media di 430 basi consecutive e consente il sequenziamento di 1.7 kbp/min., usando volumi di campioni e reagenti notevolmente ridotti.
Il sistema presentato è stato ulteriormente modificato con l’introduzione nell’iniettore di una “camera di cattura” che consente la purificazione del campione caricato direttamente sul dispositivo prima della corsa elettroforetica di rivelazione (fig. 3.28) [32, 33].
Infine è stato sviluppato (fig. 3.29) un sistema capace di eseguire 384 corse elettroforetiche contemporaneamente ed è
Figura 3.27: elettroferogramma di una delle 96 linee di sequenziamento di fig. 3.23. Le tre sezioni mostrano dati provenienti da tre diverse zone della colonna di separazione. Il numero
della base è indicato sopra il nome della base stessa. Una trasformazione software sostituisce il colore giallo rivelo col nero, per una migliore lettura dei dati. [30]
Figura 3.28: iniettore modificato per includere una camera di
indicato per rapide analisi di genotipi.
Il wafer usato in questa realizzazione ha un diametro di 200 mm, i canali di separazione hanno una lunghezza di 8 cm; la maggiore integrazione è ottenuta con la modifica dell’iniettore che consente il caricamento di quattro campioni per ogni unità [34].
Figura 3.29: schema del dispositivo µCAE a 384 linee. Ciascuna linea è larga 60 µm e profonda 30µm. Nel riquadro C) è evidenziata la presenza dei 4 serbatoi per i


![Figura 3.17: possibili modifiche per aumentare la lunghezza del canale. [26]](https://thumb-eu.123doks.com/thumbv2/123dokorg/5635268.69270/5.892.180.759.787.1168/figura-possibili-modifiche-aumentare-lunghezza-canale.webp)




![Figura 3.24: schema dello scanner usato per rivelare le separazioni nel µCAE radiale. [28]](https://thumb-eu.123doks.com/thumbv2/123dokorg/5635268.69270/12.892.230.716.324.844/figura-schema-scanner-usato-rivelare-separazioni-µcae-radiale.webp)
