Capitolo
2
Tecniche di Produzione
La produzione dell’idrogeno, il cui utilizzo, come precedentemente accen-nato, `e circoscritto al settore chimico ed industriale, `e una problematica su cui si stanno concentrando gli sforzi di molte nazioni industrializzate; que-sta tendenza `e giustificata dal fatto che con l’imposizione della riduzione di emissione di gas serra ed inquinanti di varia natura, regolarizzata dal proto-collo di Kyoto, tutte le nazioni interessate si stanno impegnando al fine di rientrare nei parametri imposti, e quindi necessariamente trovare mezzi di produzione di energia alternativi agli idrocarburi.
Considerando l’attuale evoluzione del settore energetico internazionale, `e le-cito attendersi un incremento significativo della richiesta di produzione di tale combustibile.
La produzione di idrogeno incontra nella pratica numerosi problemi soprat-tutto riguardo l’alto costo e la selezione dei migliori processi di produzione e immagazzinaggio, le principali metodologie di produzione dell’idrogeno sono:
• Steam Reforming del Metano (SMR).
• Gassificazione del carbone. 24
25 2.1. Steam Reforming (SMR) • Gassificazione e pirolisi delle biomasse.
• Dissociazione Termica (Termolisi).
• Elettrolisi dell’acqua.
Oltre ai suddetti metodi, gi`a sfruttati commercialmente, l’attenzione della ricerca `e anche rivolta a metodi innovativi quali processi di fotoconversione come sistemi fotobiologici e fotoelettrochimici, oltre a processi termochimici come gassificazione e pirolisi (National Renewable Energy Laboratory).
Non a caso l’Elettrolisi dell’acqua `e stata collocata all’ultimo posto nella graduatoria delle metodologie di produzione. Infatti tale processo non co-stituisce la soluzione migliore sotto il profilo economico (come vedremo in seguito), ma trova impiego soltanto nei processi che richiedano un alto grado di purezza dell’idrogeno oppure nello sfruttamento di fonti rinnovabili alea-torie. Di seguito si riportano, a titolo indicativo, le descrizione dei processi commerciali di produzione summenzionati.
2.1
Steam Reforming (SMR)
Lo steam reforming del metano `e un processo ben sviluppato ed altamente commercializzato e attraverso il quale si produce circa il 48% dell’idrogeno mondiale. Tale metodo pu`o essere applicato anche ad altri idrocarburi come l’etano e la nafta. Non possono essere utilizzati idrocarburi pi`u pesanti perch´e essi potrebbero contenere un quantitativo eccessivo di impurit`a.
2.1. Steam Reforming (SMR) 26
Figura 6 - Steam Reforming del Metano Fonte: Johnson Matthey Catalysts in Hydrogen
http://www.synetix.com/
Il processo principale consiste nel far reagire del vapore acqueo con l’i-drocarburo, ad una temperatura di circa 750-800◦C ed una pressione di circa
25 bar, tuttavia prima di tale processo il metano subisce altri trattamenti, al fine di ridurre le impurit`a che inevitabilmente esso trascina con se, come solfati e cloruri
Figura 7 - Purificazione del Metano Fonte: Johnson Matthey Catalysts in Hydrogen
27 2.1. Steam Reforming (SMR) Il processo principale (steam reforming) che costituisce il cuore del gene-ratore di idrogeno, `e governato dalla seguente reazione, valida, in generale, per molti idrocarburi:
CxHy+ H2O → xCO+ (x + 1 2y)H2
Nel caso particolare del metano (x=1 , y=4), si ha:
CH4+ H2O → CO+ 3H2
Si noti che questa reazione, ha come prodotto il monossido di carbonio, che `e un gas altamente tossico, per questo motivo il processo viene completato con un’altra fase, denominata “shift reaction” (che nell’impianto di figura avviene a due diversi livelli di temperatura).
Questo processo permette di eliminare il monossido di carbonio, consentendo la conseguente ulteriore produzione di idrogeno:
CO+ H2O → CO2+ H2
Il contenuto energetico dell’idrogeno prodotto `e pi`u elevato di quello del metano utilizzato ma l’enorme quantit`a d’energia richiesta per il funzio-namento degli impianti fa scendere il rendimento del processo a circa 65% (Morgan e Sissine, 1995). Tramite assorbimento o separazione con mem-brane, il biossido di carbonio `e separato dalla miscela di gas, la quale viene ulteriormente purificata per rimuovere altri componenti. Il gas rimanente, formato per circa il 60% da parti combustibili, `e utilizzato per alimentare il reformer (Zittel e Wurster, 1996). I processi di questo tipo su scala industriale
2.1. Steam Reforming (SMR) 28 avvengono alla temperatura di 200◦C o superiore, e richiedono l’impiego di
calore per dare avvio al processo. Dato che il rendimento complessivo del processo `e oltremodo lontano dall’essere unitario, appare ingiustificato l’uti-lizzo del metano (combustibile dalle innumerevole ottime caratteristiche) per produrre idrogeno, sprecando il 35% dell’energia, quando invece utilizzandolo direttamente si avrebbe a disposizione oltre il 90% dell’energia termica svi-luppata dalla combustione diretta. La motivazione principale che potrebbe giustificare questo processo, va ricercata all’interno del contesto ambientale: la combustione diretta del metano per la locomozione, per la produzione di energia elettrica (Turbogas) o per altre applicazioni, genera tra le altre so-stanze, l’anidride carbonica (CO2) che `e la principale responsabile dell’effetto
serra nel nostro pianeta, e non vi `e modo di evitare che questo gas sia im-messo in atmosfera.
Al contrario, la produzione di idrogeno attraverso il processo di steam reforming, permette di separare il combustibile (H2) dalla
CO2 (e da tutte le altre sostanze inquinanti); ci`o consente quindi di
confinare e stoccare l’anidride carbonica, evitando di immetterla direttamente in atmosfera.
Infatti, mentre l’operazione di estrazione della CO2 dai gas di scarico
(esau-sti) `e estremamente difficoltosa, a causa dell’elevata diluizione dei vari gas, nonch`e costosa, quella eseguita preventivamente, mediante il processo di steam reforming, `e estremamente pi`u vantaggiosa sia sotto il profilo eco-nomico che tecnologico.
Tuttavia il confinamento e lo stoccaggio dell’anidride carbonica, non `e an-cora pratica usuale per questo genere di impianti, data la piccola mole di
29 2.1. Steam Reforming (SMR) produzione e gli alti costi delle operazioni di stoccaggio; per cui il gas serra `e direttamente immesso in atmosfera.
Uno degli obbiettivi della ricerca `e quello di migliorare il tradizionale processo SMR con il perfezionamento di un nuovo processo denominato Sorbtion En-hanced Reforming (SER). Rispetto al tradizionale SMR tale processo implica la produzione di idrogeno a temperatura particolarmente bassa e l’abbina-mento di un processo di rimozione selettiva dell’anidride carbonica rilasciata durante la fase di reforming. Il vantaggio principale del SER quindi, consi-ste nell’ottenere direttamente dei flussi separati, estremamente puri, sia di idrogeno che di CO2 senza ricorrere a costosi sistemi di purificazione. Que-sto nuovo processo ha dunque la possibilit`a di prevalere rispetto ai processi convenzionali, e di favorire l’introduzione a breve termine dell’idrogeno, non solo per i ridotti costi operativi che esso comporta ma anche per il contributo alla riduzione della concentrazione dei gas serra nell’atmosfera.
Le attivit`a di ricerca sono ovviamente volte all’individuazione dei materiali pi`u idonei all’assorbimento di CO2, alla dimostrazione della validit`a tecnica dei sistemi sperimentali e all’analisi dei relativi vantaggi economici.
Anche il tradizionale processo di cracking dei combustibili fossili sta su-bendo delle notevoli innovazioni. Le nuove tecnologie di decomposizione ter-mocatalitica degli idrocarburi, in assenza di aria o ossigeno, eviteranno di sostenere costi per la purificazione dell’idrogeno prodotto tramite l’elimina-zione della produl’elimina-zione degli ossidi di carbonio. Ci`o avverr`a tramite l’iden-tificazione e la modificazione di opportuni catalizzatori a base di carbonio e
2.2. Gassificazione del Carbone 30 la successiva ottimizzazione del processo di produzione tramite l’impiego di combustibili liquidi o gassosi. L’obbiettivo primario `e, inizialmente, quello di aumentare il contenuto di idrogeno a pi`u dell’85% e di ridurre notevolmente le emissioni di gas inquinanti (http://www.eren.doe.gov).
2.2
Gassificazione del Carbone
Consiste in una ossidazione parziale con ossigeno seguita da una reazione di shift dell’acqua per produrre idrogeno ed anidride carbonica. La necessit`a di introdurre il processo di separazione dell’aria per produrre l’ossigeno ne penalizza l’efficienza energetica che risulta leggermente inferiore al 60%.
Figura 8 - Gassificazione del Carbone Fonte: [15]
Tramite la gassificazione il carbone viene convertito, parzialmente o com-pletamente, in combustibile gassoso il quale, dopo essere stato purificato viene utilizzato come combustibile, per processi chimici o per la produzione dei fertilizzanti.
31 2.2. Gassificazione del Carbone La produzione di idrogeno mediante gassificazione del carbone `e una tecno-logia che trova numerose applicazioni commerciali, ma `e competitiva con la tecnologia SMR solo dove il costo del gas naturale `e molto elevato (per esem-pio: Repubblica Popolare di Cina e Sud Africa) ed al contempo il carbone risulti presente in grandi quantit`a. Nel settembre del 2000 `e stato siglato dall’ENEA e dal Ministero della Scienza e della Tecnologia (MOST) della Repubblica Popolare di Cina, un Accordo Tecnico di collaborazione tecnico-scientifica per lo sviluppo congiunto della ricerca sull’idrogeno, a seguito degli accordi stipulati dai due organismi a Pechino. Come ben noto, nella Repubblica Popolare di Cina, i problemi associati all’inquinamento atmosfe-rico all’interno delle citt`a e, pi`u in generale, l’ingente quantit`a di emissioni di CO2 legato all’uso massiccio del carbone, sono estremamente gravi ed ur-genti. Si prevede infatti che nel 2020 la Repubblica Popolare di Cina brucer`a ben tre miliardi e mezzo di tonnellate di carbone all’anno, contribuendo a pi`u di un quarto delle emissioni planetarie di anidride carbonica. Nel programma di cooperazione con l’ENEA, il carbone, in presenza di acqua, `e trasformato in idrogeno e CO2. L’idrogeno `e poi bruciato con emissioni zero, mentre la CO2 `e “sequestrata” permanentemente in forma liquida nelle profondit`a della terra, senza apprezzabili emissioni nell’atmosfera. E’ quindi possibile trasformare anche il carbone in un combustibile pulito e quasi ad “emissioni zero”.
Per quanto riguarda la gassificazione, vengono utilizzati principalmente tre metodi: fixed-bed (letto fisso), fluidized-bed (letto fluidificato) e entrained-bed (letto trascinato) ([13]). Tutti questi metodi impiegano vapore, ossigeno o aria, per ossidare parzialmente il carbone ed ottenere come risultato del gas. I gassificatori a letto fisso producono, a basse temperature (425-650
2.2. Gassificazione del Carbone 32
◦C), un gas contenente prodotti devolatilizzati come metano, etano ed un
flusso di idrocarburi liquidi contenente nafta, catrame, oli e fenolici. I gas-sificatori a letto trascinato producono gas ad alta temperatura (≥ 1260◦C),
che essenzialmente elimina i prodotti devolatilizzati dal flusso di gas e dagli idrocarburi liquidi. Questo metodo, infatti, consente di ottenere un prodotto composto quasi interamente da idrogeno, monossido di carbonio e biossido di carbonio. I gassificatori a letto fluidificato, infine, producono pressappoco dei prodotti intermedi, nella composizione, rispetto ai due precedenti ed agi-scono a temperature medie (925-1040◦C).
Figura 9 - Esempio di Centrale IGCC (Integrated Coal Gasification Combined Cycle)
World Energy Council 18th Congress, Buenos Aires, October 2001 Il calore necessario per la gassificazione `e fornito principalmente dall’os-sidazione parziale del carbone. Generalmente le reazioni di gassificazione del carbone sono esotermiche, cos`ı al gassificatore vengono di solito abbinate delle caldaie per il riscaldamento dei rifiuti da smaltire. La temperatura, e quindi la composizione del gas prodotto, dipendono dalla quantit`a dell’agente
33 2.2. Gassificazione del Carbone ossidante e del vapore, nonch´e dal tipo di reattore utilizzato nell’impianto di gassificazione.
I gassificatori producono delle sostanze inquinanti (principalmente ceneri, os-sidi di zolfo e osos-sidi di azoto) che devono essere eliminate prima che entrino a far parte del gas prodotto. Il loro livello dipende sia dal gassificatore uti-lizzato sia dalla composizione del combustibile. Esistono due tipi di sistemi per la separazione delle impurit`a: sistemi a caldo e sistemi a freddo. La tec-nologia di separazione a freddo `e sfruttata commercialmente e sperimentata da diversi anni mentre i sistemi a caldo sono ancora in fase di sviluppo. La ripulitura dei gassificatori a letto trascinato, comporta una serie di operazioni in base alla diversa natura dei residui con una perdita di efficienza, affidabi-lit`a ed un aumento rilevante dei costi di questi sistemi (http://www.fetc.gov).
Per questa tecnologia, il costo della materia impiegata raggiunge quasi il 25% del prezzo dell’idrogeno prodotto. Costo del capitale, manutenzione dell’impianto e smaltimento dei rifiuti solidi, costituiscono altri costi da so-stenere. Rispetto alle altre tecnologie quindi, sempre escludendo l’elettrolisi, i costi sono leggermente pi`u elevati ed, allo stato attuale, non `e ancora pos-sibile realizzare delle particolari economie di scala.
Tuttavia la presenza di numerose riserve e la omogenea distribuzione in tutto il territorio mondiale, a differenza delle riserve petrolifere fondamentalmente concentrate nel medio oriente, fa del carbone il possibile sostituto di gas natu-rale ed olio combustibile, come materia prima per la produzione di idrogeno.
2.3. Gassificazione e pirolisi delle biomasse 34
2.3
Gassificazione e pirolisi delle biomasse
Come la gassificazione, anche la pirolisi, o distillazione secca, `e un processo che per mezzo della decomposizione termica, spezza le molecole complesse delle sostanze organiche in elementi semplici, separati. Essa consiste nel ri-scaldare la sostanza a 900-1000◦C, in assenza di aria, in opportuni impianti,
con ottenimento di sostanze volatili e di un residuo solido (Chiacchierini, 1992).
L’applicazione di calore alle biomasse (legno, grassi e rifiuti agricoli) produce numerosi differenti gas, tra cui l’idrogeno. La composizione dei gas dipende dal tipo di materiale, dalla presenza di ossigeno, dalla temperatura della rea-zione e da altri parametri. La ricerca sull’idrogeno `e incentrata attualmente sui gas dalle biomasse, a medio potere calorifico, da utilizzare principalmente come combustibili . La gassificazione delle biomasse, prevede l’impiego sia di materiale derivato dai rifiuti solidi urbani (RSU) sia materiali specifici appositamente coltivati per essere impiegati come fonte d’energia. Gassifica-tori di biomasse sono stati sviluppati utilizzando tecnologie di combustione fixed-bed, fluidized-bed, entrained-bed.
Le biomasse possono essere gassificate utilizzando metodi indiretti e diretti. La gassificazione indiretta, come avviene negli impianti della Battelle-Columbus Laboratoires and Future Energy Resource Corporation (BLC/FERCO), usa un veicolo, come la sabbia, per trasferire calore dal bruciatore alla camera di gassificazione. Nella gassificazione diretta il calore alla camera di gas-sificazione `e fornito dalla combustione di una parte delle biomasse ([13]). In generale, il costo dell’idrogeno prodotto tramite gassificazione indiretta `e leggermente minore di quello dell’idrogeno ottenuto per gassificazione diretta.
35 2.3. Gassificazione e pirolisi delle biomasse
Un metodo alternativo di produzione dell’idrogeno dalle biomasse `e la com-binazione di pirolisi e processo di steam reforming. Tale metodo, applicato alle biomasse, genera vapori reattivi che possono, quindi, essere convertiti in idrogeno, monossido di carbonio e biossido di carbonio usando vapore in ambiente catalitico.
Tramite questo processo le biomasse vengono decomposte termicamente ad alte temperature (400-450◦C), in atmosfera inerte, per formare un bio-olio
costituito da sostanze organiche ossigenate, per l’85%, e acqua, per il 15% . Il “bio-olio”, quindi, viene sottoposto al processo usuale di steam refor-ming per la produzione di idrogeno. In particolare, sono stati compiuti degli studi sul trattamento dei residui della separazione del “bio-olio” in derivati della lignina, utilizzati per la produzione di resine fenoliche o additivi per combustibili, e derivati dei carboidrati, eventualmente sottoposti allo steam reforming.
Questo sistema ha numerosi vantaggi rispetto alla tradizionale tecnologia di gassificazione delle biomasse, innanzitutto il “bio-olio” pu`o essere traspor-tato pi`u facilmente delle biomasse e quindi la pirolisi ed il reforming possono essere realizzati in luoghi diversi, con eventuale riduzione dei costi. Per esem-pio una serie di pirolisi di piccole quantit`a di materiali, pu`o avvenire dove essi sono disponibili ad un costo non elevato. Successivamente, l’olio pu`o es-sere agevolmente trasportato in un impianto di reforming, situato dove siano presenti impianti d’immagazzinaggio ed infrastrutture per la distribuzione. Il secondo vantaggio `e, ovviamente, il notevole potenziale derivante dal re-cupero dei materiali derivati. Questo `e stato dimostrato con l’utilizzo di
2.3. Gassificazione e pirolisi delle biomasse 36 un reattore a letto fluidificato, con del nichel come catalizzatore, sviluppato per il trattamento di gas naturale e nafta, con cui `e stato possibile ottenere sostanze composte il cui contenuto di idrogeno approssima o supera il 90% (Czernik et al., 2000).
Questo processo potenzialmente pu`o divenire una delle tecnologie di pro-duzione meno costose, ma `e ancora ai primi stadi della ricerca. I ricercatori sono impegnati nella ricerca di un catalizzatore ottimale per la fase di re-forming ed alla valutazione della fattibilit`a economica e della sostenibilit`a ambientale dell’intero processo ([13]).
La produzione dell’idrogeno dalle biomasse, sia tramite gassificazione sia tramite pirolisi, possiede notevoli possibilit`a di sviluppo tra i processi che utilizzano fonti rinnovabili di energia (National Renewable Energy Labora-tory, 1995). Un importante vantaggio ambientale dell’utilizzo delle biomasse come fonte di idrogeno `e che il biossido di carbonio, una delle principali emis-sioni responsabili dei cambiamenti climatici, emesso nella conversione delle biomasse, non contribuisce ad aumentare la quantit`a totale di gas nell’atmo-sfera. Il biossido di carbonio `e consumato dalle biomasse durante la crescita e solo la stessa quantit`a viene restituita all’aria durante il processo di conver-sione. Purtroppo, per`o, il contenuto d’idrogeno `e solo del 6%-6.5%, rispetto al 25% del gas naturale.
Per questa ragione i costi sono ancora molto elevati e ci`o non consente a questi sistemi di essere competitivi con altre tecnologie come, per esempio, il reforming del metano. Di gran lunga, i maggiori costi operativi per questa tecnologia sono legati alla materia da impiegare e quindi sono particolarmente
37 2.3. Gassificazione e pirolisi delle biomasse alti per processi che utilizzano biomasse costituite da materiali specifici men-tre possono scendere nel caso si impieghino biomasse da rifiuti.
Anche in questo caso, come per i sistemi fotovoltaici ed eolici, trattandosi di fonti di energia rinnovabili, i costi sono ancora sensibilmente elevati. In questi casi, infatti, le tecnologie non sono ancora perfezionate, mancano dei sistemi specifici d’immagazzinaggio e applicazione dell’energia prodotta per cui non `e ancora possibile realizzare economie di scala che ne consentano un possibile largo impiego. D’altro canto il ridotto impatto ambientale, riveste un importante ruolo per la ricerca.
Inoltre, gli oli vegetali hanno un potenziale per la produzione di idrogeno, maggiore delle sostanze che contengono cellulosa o lignina, ma il loro costo `e ancora notevolmente alto e probabilmente gli oli necessari saranno acquistati su di uno specifico mercato previsto per il futuro. Quindi, solo un processo integrato, che preveda il riutilizzo delle sostanze derivate dalle biomasse, pu`o consentire una alternativa economicamente valida (Czernik et al., 2000).
Affinch´e le biomasse diventino una fonte di idrogeno con costi accessibili, la ricerca deve ancora compiere notevoli passi. Le tecniche per la sepa-razione e la purificazione dell’idrogeno tramite delle membrane selettive o processi catalitici, devono essere migliorate. Nuove idee per la purificazione dei gas (rimozione di catrame ed oli) necessitano una migliore valutazione. Una delle principali priorit`a della ricerca `e un concetto avanzato di gassi-ficazione catalitica che consenta di ottenere risultati quando il gassificatore agisce continuamente (National Renewable Energy Laboratory, 1999) men-tre altri settori della ricerca si stanno occupando della messa a punto di un nuovo sistema di gassificazione. Esso, agendo ad elevate temperature e con
2.4. Dissociazione Termica 38 particolari catalizzatori al carbonio, consente la produzione di idrogeno da materiali con un alto contenuto di umidit`a. Le biomasse, infatti contengono circa il 50% d’acqua e sono stati messi a punto diversi processi termici per eli-minarla. Questo nuovo processo di gassificazione invece, eliminando il ricorso a strumenti di essiccazione non pone particolari limiti al tipo di biomassa da impiegare. Inoltre, ottenendo il reforming completo delle biomasse impiegate dal processo non si hanno residui di combustione. I primi reattori di questo genere sono stati costruiti recentemente mentre l’intera tecnologia deve essere ancora testata e verificata nei prossimi anni (http://www.eere.energy.gov/).
2.4
Dissociazione Termica
Pi`u comunemente conosciuto come “Termolisi”, `e un processo termico at-traverso il quale, ad altissime temperature, un composto subisce la scissione (cracking) nei suoi elementi costituenti, senza la necessit`a di utilizzare cata-lizzatori o far avvenire reazioni chimiche di altra natura.
Anche se questa metodologia di produzione di idrogeno `e ad oggi scarsa-mente utilizzata a causa degli alti costi, essa attira ancora l’attenzione dei ricercatori, soprattutto per quanto riguarda la termolisi solare dell’acqua e dell’acido solfidrico (H2S).
Con l’ausilio di specchi parabolici in grado di concentrare i raggi solari, si possono ottenere temperature molto alte (2500K); a queste temperature, sia l’acqua che l’acido solfidrico subiscono una spontanea scissione:
39 2.4. Dissociazione Termica
Figura 10 - Principio della Termolisi Solare Fonte: E.T.H.
vediamo in dettaglio i due processi:
2.4.1
Termolisi dell’acqua
Uno dei primi processi di Termolisi Solare ha avuto come protagonista la scissione dell’acqua, secondo la reazione:
H2O+ Energia Termica 7→ H2+
1 2O2
per la realizzazione di tale processo `e utilizzata una superficie opportuna di Zirconio irradiata dai raggi del sole concentrati.
2.4. Dissociazione Termica 40 Si `e in grado, in questo modo, di ottenere una temperatura uguale o su-periore ai 2500K (2227◦C), alla quale sottoporre un flusso di vapor d’acqua.
I prodotti gassosi ottenuti dalla termolisi necessitano di essere separati l’uno dall’altro, ad alte temperature, al fine di evitare la loro ricombinazione, o la formazione di miscele esplosive; tale operazione, date le alte temperature risulta estremamente pericolosa.
Tra le varie proposte per la separazione dell’H2 dal resto delle sostanze,
spiccano:
• la separazione per Effusione1
(Fletcher and Moen, 1977;Kogan, 1998). • La separazione Elettrolitica (Ihara, 1980; Fletcher, 1999).
Un’altra alternativa `e quella di iniettare del gas pi`u freddo nella miscela calda, o attraverso l’espansione di quest’ultima, al fine di permettere la sepa-razione a temperatura pi`u bassa. Tale tecnica (Diver et al., 1983; L´ed´e et al., 1987) risulta pi`u semplice `e pi`u fattibile rispetto alle due precedenti, ma tuttavia introduce un forte calo dell’efficienza exergetica del processo. Le alte temperature, inoltre, decretano un alto livello di dispersione della radiazione solare con la conseguente riduzione dell’efficienza exergetica; tali problematiche hanno spinto la ricerca verso lo studio di cicli termo-chimici (che non saranno descritti) di separazione dell’acqua, attraverso i quali `e possibile bypassare la fase di separazione dell’ossigeno dall’idrogeno, con un conseguente miglioramento dell’efficienza del ciclo.
2.4.2
Termolisi dell’Acido Solfidrico
L’Acido Solfidrico (H2S), `e un gas (dal classico odore di “uova marce”),
estre-mamente tossico, prodotto in grandi quantit`a dall’industria che si occupa 1
41 2.4. Dissociazione Termica della purificazione del gas naturale, e della rimozione dei composti organici solforati dal petrolio e dal carbone.
Nel mondo risulta presente una enorme quantit`a di gas naturale, che tuttavia non viene utilizzato a causa dell’eccessiva presenza di acido solfidrico in esso disciolta; per questo motivo il processo di scissione dell’acido solfidrico, al fine di ottenere idrogeno, sta suscitando un discreto interesse nella ricerca, se non altro a motivo del fatto che, oltre ai benefici energetici, si apporterebbe un notevole contributo ecologico, trasformando un gas tossico in un combu-stibile ecologicamente innocuo.
In tale processo, l’H2S viene introdotto in un reattore termico ad energia
solare operante alla temperatura di circa 1800K (1527◦C) e pressione di
0.03 ÷ 0.5 bar; a queste condizioni l’acido `e scisso in idrogeno e zolfo, secondo la seguente reazione:
H2S+ Energia Termica 7→ H2+
1 2S2
La mistura di gas viene convogliata all’uscita del reattore termico e quindi ad uno scambiatore di calore ad acqua, dove lo zolfo subisce la liquefazione e quindi la solidificazione, permettendo cos`ı la separazione dall’H2.
Esperimenti di tale processo2
evidenziano l’estrema facilit`a di esecuzione di tale pratica, considerando anche che la reazione inversa `e del tutto trascu-rabile a temperature di 1500K.
Studi recenti indicano che la cinetica chimica della reazione di decompo-sizione dell’H2S `e significativamente elevata in reattori di alluminio, in un
range di temperatura di 1350 ÷ 1600K (Harvey et al., 1998), inoltre un’a-nalisi economica (Diver and Fletcher, 1985) evidenzia che, attribuendo un
2
2.5. Elettrolisi dell’Acqua 42 valore nullo all’H2S ed un prezzo dell’energia elettrica pari a 0.05$/kWh, si
potrebbe avere un tempo di recupero dell’investimento relativo all’impianto di appena 6.3 anni.
2.5
Elettrolisi dell’Acqua
E’ il metodo pi`u conosciuto per la produzione di Idrogeno, ma anche il meno utilizzato in ambito industriale a causa della limitata quantit`a di idrogeno prodotta e per i costi ancora troppo elevati, dovuti all’impiego diretto di elettricit`a (forma pi`u pregiata di energia).
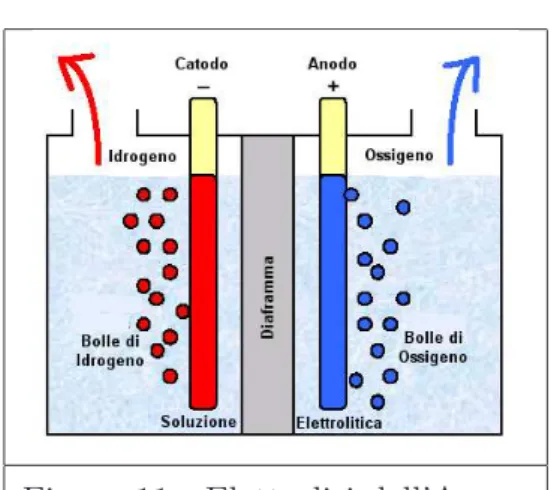
Esso consiste nel far passare della corrente elettrica attraverso una solu-zione (di solito alcalina) acquosa. L’energia elettrica rompe i legami chimici della molecola dell’acqua creando particelle elettricamente cariche, denomi-nate ioni, i quali sono attratti dagli elettrodi; raggiunta la superficie dell’elet-trodo, ciascun ione cede od acquista elettroni trasformandosi in una molecola neutra, che abbandona la soluzione, in forma gassosa.
In particolare gli ioni di idrogeno si addensano nel catodo (elettrodo nega-tivo), mentre l’ossigeno nell’anodo (elettrodo positivo):
43 2.5. Elettrolisi dell’Acqua
Figura 11 - Elettrolisi dell’Acqua
teoricamente la quantit`a di energia elettrica richiesta per la produzione, di 1kg di idrogeno, partendo da acqua liquida a pressione atmosferica, dovrebbe eguagliare il potere calorifico superiore (HHV) dell’idrogeno, ovvero: 141.9 MJ/kg. In realt`a l’energia richiesta per produrre 1 kg di H2, `e maggiore di tale
valore, in quanto
il passaggio di corrente elettrica, inevitabilmente comporta perdite per effetto Joule. Una parte di questa energia termica `e dispersa nell’ambiente, un’altra parte `e accumulata dal sistema sottoforma di energia interna, men-tre un’altra parte ancora, `e assimilata dal gas che si forma agli elettrodi, il quale espandendosi la dissipa.
I pi`u moderni Elettrolizzatori industriali sfruttano fondamentalmente tre tecnologie diverse per la produzione dell’idrogeno: due utilizzano una solu-zione acquosa di idrossido di potassio (KOH), usato per la sua alta condut-tivit`a, e rientrano nella categoria degli Elettrolizzatori Alcalini, i quali possono essere unipolari o bipolari.
Gli elettrolizzatori Unipolari hanno struttura simile a dei contenitori (tank) ed hanno gli elettrodi collegati in parallelo; una membrana separa il catodo dall’anodo, dividendo i due gas prodotti, ma permettendo il passaggio degli ioni.
2.5. Elettrolisi dell’Acqua 44 La struttura Bipolare somiglia di pi`u ad un filtro: le celle elettrolitiche sono connesse in serie, quindi l’idrogeno `e prodotto da un lato della struttura, mentre l’ossigeno dall’altro; anche in questo caso gli elettrodi sono separati da una apposita membrana.
La terza tipologia di Elettrolizzatore `e denominata “Solid Polymer Elec-trolyte (SPE)”.
In questa unit`a l’elettrolita `e costituito da una membrana solida conduttrice di ioni, contrariamente alla soluzione acquosa utilizzata negli elettrolizzatori alcalini; tale membrana permette agli ioni H+
di passare dall’anodo al catodo dove si forma l’idrogeno gassoso.
Uno schema rappresentativo del processo di elettrolisi, mediante unit`a al-caline, potrebbe essere il seguente:
Figura 12 - Diagramma di flusso del processo Elettrolizzatore Alcalino (Fonte: [7])
In questo caso le reazioni che avvengono agli elettrodi sono:
• Produzione di Idrogeno al Catodo: 2H2O+ 2e− 7→H2 + 2OH−
• Produzione di Ossigeno all’Anodo: 2OH−7→ 1
45 2.5. Elettrolisi dell’Acqua Di seguito si riportano alcune tabelle che rappresentano i parametri pi`u significativi, di alcuni modelli di elettrolizzatore attualmente commercializ-zati:
Tabella 4 - Bilancio Energetico Fonte: [7]
Si noti la differenza tra Energia Richiesta dal sistema e quella richiesta dal solo elettrolizzatore.
Per sistema si intende tutto l’apparato di produzione, comprensivo di gruppo raddrizzatori3
e di servizi ausiliari.
Tabella 5 - Efficienza di Conversione Fonte: [7]
3
2.5. Elettrolisi dell’Acqua 46 Col termine Efficienza di Conversione `e inteso il rapporto tra la quan-tit`a ponderale di acqua introdotta nel sistema (nell’unit`a di tempo) e la somma tra la quantit`a di idrogeno ed ossigeno prodotto; in virt`u del fatto che non tutta l’acqua introdotta pu`o essere scissa nei suoi costituenti, a causa della limitatezza della superficie degli elettrodi.
Tabella 6 - Efficienza Energetica 1 psi ≃ 0.069 bar - Fonte: [7]
L’Efficienza Energetica `e intesa come rapporto tra il potere calorifico superiore4
dell’idrogeno (HHV), e l’energia richiesta per produrne 1 kg: Si ribadisce che il valore dell’efficienza energetica riportato in ta-bella, non riguarda soltanto l’elettrolizzatore, ma l’intero sistema comprensivo di ausiliari e di sistema di compressione.
Si noti che l’efficienza pi`u alta riguarda gli elettrolizzatori commercializzati dalla Stuart e dalla Norsk Hydro (73%), entrambi elettrolizzatori
alcalini bipolari. 4
Si usa il p.c.s., e non il p.c.i., in quanto l’acqua introdotta nel sistema `e allo stato liquido, quindi nel bilancio energetico `e compresa l’energia di vaporizzazione
47 2.5. Elettrolisi dell’Acqua
2.5.1
Elettrolisi ad Alta Temperatura (HTE)
L’elettrolisi ad alta temperatura, o come spesso viene denominata “Elettro-lisi del Vapore”, `e una variante del processo di elettro“Elettro-lisi tradizionale. Parte dell’energia richiesta per la scissione della molecola dell’acqua, viene sommi-nistrata al sistema sottoforma di calore, invece che di sola elettricit`a; questo provoca una riduzione dell’energia elettrica richiesta, e conseguentemente un incremento dell’efficienza elettrica.
Appare evidente che tale processo risulta vantaggioso nel caso in cui la sor-gente di calore sia direttamente disponibile in loco (per esempio in prossimit`a di una centrale nucleare)
Figura 13 - High Temperature Electrolysis Fonte: Steve Herring (Maggio 2002)
2.5. Elettrolisi dell’Acqua 48 Il vapore ad alta temperatura viene introdotto nell’unit`a elettrolitica, dove la molecola H2O viene scissa dal campo elettrico; lo ione di ossigeno
passa attraverso una membrana (Ossido di Zirconio) che ne permette il pas-saggio, mentre la miscela di vapore residuo e di idrogeno viene convogliato in un sistema di condensazione, che provvede alla separazione dell’H2 dal
vapore.
Figura 14 - Elettrolisi dell’Acqua
A differenza degli elet-trolizzatori tradizionali, in cui l’acqua `e in forma liquida, negli HTE si ha vapore ad alta tempe-ratura, quindi per il cal-colo dell’efficienza `e ne-cessario fare ricorso al potere calorifico inferiore (LHV=119.9 MJ/kg)
Il bilancio energetico per il processo di elettrolisi ad alta temperatura `e di seguito riportato:
49 2.6. Idrogeno Biologico
Figura 15 - Elettrolizzatore HTE
Fonte: The Idaho National Engineering and Environmental Laboratory Si pu`o osservare che per una temperatura di 900◦C, la produzione di
1kg di idrogeno richiede un quantitativo di energia pari a circa 125MJ; corrispondente ad una efficienza (LHV) pari a
η = 119.9
125 = 95.9%
Tale valore dell’efficienza `e riferito esclusivamente all’elettrolizzatore.
2.6
Idrogeno Biologico
Per ottenere idrogeno puro, come si `e visto, `e necessario produrre energia sufficiente a “strapparlo” da altre molecole e questa energia, escludendo l’eo-lico l’idrico ed il fotovoltaico, proviene ancora in massima parte da quelle fonti che dovrebbe andare a sostituire, ma la ricerca `e a caccia di metodiche di estrazione dell’idrogeno che abbiano sull’ambiente impatto zero. Ed ecco che i batteri, i funghi, i lieviti ma anche le alghe escono dal loro anonimato per salire alla ribalta delle nuove tecnologie. In natura viene prodotto idro-geno puro da tappe specifiche della fermentazione microbica e della ben nota
2.6. Idrogeno Biologico 50 fotosintesi clorofilliana. Da qui gli studi effettuati presso numerosi labora-tori di ricerca per convincere microrganismi di ogni sorta a velocizzare i loro consueti processi per ottenere idrogeno pi`u in fretta, in quantit`a maggiori e per giunta a basso costo.
Figura 16 - Produzione Biologica di Idrogeno Fonte: (Laura Som`a)
http://www.ilrasoiodioccam.it/articoli/idrogeno.html
Una minuscola alga verde del genere Chlamydomonas `e oggetto di atten-zioni da parte di un gruppo di ricercatori dell’Universit`a di Padova che lavora al progetto “Metodologie innovative per la produzione di idrogeno da processi biologici”, in collaborazione con Enea e Cnr. L’idea consiste nell’utilizzare il normale processo fotosintetico dell’alga stimolando il suo corredo enzimatico a una maggiore reattivit`a alla luce in modo da accrescere la produzione del prezioso idrogeno. Bisogna solo fornire all’alga acqua, anidride carbonica e luce solare. Nella prima parte del processo l’acqua viene scissa in idrogeno e ossigeno e nella seconda fase l’anidride `e trasformata in glucosio, il nutri-mento vero e proprio dei vegetali. Al monutri-mento l’efficienza di conversione
51 2.6. Idrogeno Biologico (rapporto tra idrogeno prodotto e luce solare fornita) `e piuttosto bassa e si aggira intorno al 5%.
Un intoppo `e rappresentato dall’intolleranza del sistema biologico all’ossi-geno prodotto nella scissione dell’acqua. Un trucco per aumentare la produ-zione consiste nell’allontanare subito il gas concorrente o nel selezionare tipi cellulari tolleranti all’ossigeno.
Alcuni ricercatori del National Renewable Energy Laboratory di Golden in Colorado ci hanno provato con un batterio fotosintetico: il Rhodospirillum rubrum, capace di sviluppare idrogeno dall’acqua anche in presenza di ossi-geno grazie alla sua portentosa idrogenasi, un particolare enzima produttore di idrogeno. Tramite manipolazioni genetiche si sta cercando di inserire tale vantaggioso enzima in altre cellule batteriche o addirittura in alghe verdi: l’efficienza aumenterebbe fino al 10 − 12%.
Accanto all’allevamento in cattivit`a di sistemi cellulari cosiddetti whole-cell (“a cellula intera”) un’ulteriore fase di ricerca sta tentando la realizzazione di sistemi cell-free (“privi di cellule”) che utilizzano i soli enzimi specifici. In questo modo si ovvierebbe al problema di mantenere in vita gli organismi e la produzione di idrogeno sarebbe pi`u costante e pi`u efficace, raggiungendo punte del 25%. In alcuni casi si `e sostituita del tutto la natura con processi esclusivamente elettrochimici.
Negli anni Novanta, presso l’Istituto Federale Svizzero, comincia la speri-mentazione della “foglia artificiale”, nella quale al posto della clorofilla si utilizza un pigmento bianco, il biossido di titanio, sostanza facilmente
rin-2.6. Idrogeno Biologico 52 tracciabile nell’etichetta di paste dentifricie, pastiglie medicinali e vernici. Il sistema (vagamente assimilabile al fotovoltaico) `e costituito da larghi modu-li e pannelmodu-li che mimano il processo fotosintetico producendo , invece che glu-cosio, idrogeno ed elettricit`a. La resa sarebbe del 7% con luce solare diretta e dell’11% con luce diffusa. Ed ecco un nuovo problema.
Tutte le modalit`a finora passate in rassegna non possono fare a meno di un formidabile alleato: il Sole. Ma che succede se la giornata `e nuvolosa o peggio ancora di notte? Si sono identificate per questa ragione circa 400 spe-cie di batteri capaci di combinare, nell’oscurit`a pi`u completa, monossido di carbonio e acqua per produrre quantit`a piuttosto elevate di idrogeno. Alcune specie di cianobatteri (chiamati anche alghe blu) si sono mostrate finora le migliori candidate all’esperimento.
In una sorta di reazione inversa che pu`o fare completamente a meno della luce, presso l’Universit`a del Wisconsin vengono impiegati microrganismi che a partire dal prodotto zuccherino finale della fotosintesi (glucosio ma anche xilosio, lattosio e saccarosio) liberano idrogeno, questa volta tramite l’azione di enzimi decompositori, raggiungendo un’efficienza del 50%.
I protagonisti principali sono due batteri ipertermofili (quelli che muoiono di freddo se la temperatura scende al di sotto degli 80◦C) dai significativi nomi:
Thermoplasma acidophilum e Pyrococcus furiosus.
Anche l’Escherichia coli, il comune costituente della nostra flora batte-rica intestinale, si `e dimostrato un candidato promettente. Essendo di bocca buona, grazie alla capacit`a di far andare in decomposizione la materia orga-nica, `e stato alimentato a torsoli di mela, bucce di banana e rifiuti di cucina in genere, per produrre idrogeno.
53 2.6. Idrogeno Biologico Con questo vivace microbo basterebbe una fornitura di soli 50 grammi di zuc-chero per tenere accesa una lampadina da 40 watt per un tempo leggermente inferiore alle 8 ore!

![Figura 8 - Gassificazione del Carbone Fonte: [15]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7229391.78317/7.892.185.771.569.910/figura-gassificazione-del-carbone-fonte.webp)


![Figura 12 - Diagramma di flusso del processo Elettrolizzatore Alcalino (Fonte: [7])](https://thumb-eu.123doks.com/thumbv2/123dokorg/7229391.78317/21.892.216.742.665.919/figura-diagramma-flusso-processo-elettrolizzatore-alcalino-fonte.webp)
![Tabella 4 - Bilancio Energetico Fonte: [7]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7229391.78317/22.892.148.682.301.655/tabella-bilancio-energetico-fonte.webp)
![Tabella 6 - Efficienza Energetica 1 psi ≃ 0.069 bar - Fonte: [7]](https://thumb-eu.123doks.com/thumbv2/123dokorg/7229391.78317/23.892.189.771.401.672/tabella-efficienza-energetica-psi-bar-fonte.webp)

