4
Il ruolo della GSK3 nella omeostasi del glucosio e nello sviluppo
della resistenza all’insulina
(1)La GSK3 è stata inizialmente identificata nel 1984 come un regolatore chiave nella sintesi del glicogeno. La successiva purificazione e la clonazione molecolare hanno permesso di identificare due isoforme provenienti da due prodotti genetici. Sebbene la GSK3α abbia un peso molecolare leggermente superiore rispetto alla GSK3β (Fig. 1), le due isoforme sono molto simili tra loro come è possibile giudicare della elevata omologia della sequenza amminoacidica (86% del totale e 97% del dominio chinasico) e dalle caratteristiche biochimiche. Tuttavia, la loro funzione fisiologica non può essere totalmente compensata l’una dall’altra.
Fig. 11. Schematic structures of GSK3 and GSK3β. Serine and tyrosine phosphorylation sites are indicated.
Entrambe le chinasi presentano un sito inibitorio di fosforilazione Ser all’estremità N-terminale (S21 per α e S9 per β) ed un sito facilitatore Tyr nell’ansa catalitica (Y279 per α e Y216 per β) (Fig. 1). La fosforilazione dei siti Ser con AKT inibisce l’attività chinasica del GSK3, mentre la mutazione di questi siti ad Ala conduce ad una GSK3 chinasi costitutivamente attiva. Con riferimento al sito Tyr, mentre la sua mutazione ad Ala compromette la completa attivazione dell’attività chinasica dellaGSK3, non si è ancora ben compreso come sia regolata la fosforilazione. Alcuni studi suggeriscono persino che la fosforilazione in questo sito sia costitutiva.
La GSK3 possiede diverse caratteristiche uniche in confronto ad altre chinasi: (1) la GSK3 presenta un’attività basale e lo stimolo extracellulare inibisce l’attività chinasica della
1
5
GSK3, mentre altre chinasi sono attivate da ligandi; (2) la fosforilazione della Ser21 per GSK3α e della Ser9 per GSK3β inibisce la chinasi GSK3, mentre la maggior parte delle altre chinasi sono attivate dalla fosforilazione; (3) in generale, la GSK3 richiede un’idonea fosforilazione dei suoi substrati da parte di altre chinasi prima che la GSK3 possa fosforilarli, ad eccezione di quei casi che comprendono la β-catenina e l’Axin; (4) la GSK3 svolge principalmente un ruolo di regolatrice negativa nella processazione del segnale, ad eccezione della via del NFκB (Figura 1). Sebbene la GSK3 rappresenti la chinasi per la sintesi del glicogeno, è anche coinvolta in molte vie di segnale diverse, compresa quella del Wnt e del NFκB. I suoi ruoli in queste cascate, soprattutto nel segnale dell’insulina e nello sviluppo della resistenza all’insulina sono discussi di seguito.
Ruolo dell’insulina
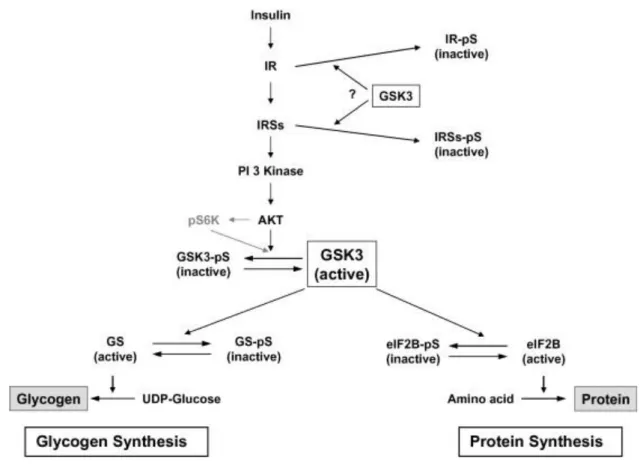
L’insulina regola l’omeostasi del glucosio attraverso l’aumento dell’assorbimento e del deposito del glucosio. La forma maggiore di deposito del glucosio è il glicogeno ed i livelli di glicogeno nelle cellule sono strettamente regolati della glicogeno sintetasi (GS) (sintesi) e dalla glicogeno fosforilasi (lisi). Mentre l’insulina sembra regolare l’attività sia della GS che della glicogeno fosforilasi, la sua regolazione della GS è meglio compresa. Nelle condizioni basali, la GSK3 inibisce la sintesi del glicogeno mediante la inibizione della GS attraverso la fosforilazione inibitoria (Fig. 2). Sulla stimolazione dell’insulina, tuttavia, l’attivazione della cascata lineare del segnale IR/IRSs/PI3K/Akt conduce alla fosforilazione della GSK3 al residuo regolatorio Ser21 o 9 (rispettivamente α e β), e l’attività chinasica della GSK3 risulta inibita. Questa attiva la GS e quindi anche la sintesi del glicogeno. Inoltre, la GSK3 regola la sintesi proteica attraverso il controllo dell’attività di iniziazione del fattore 2B (eIF2B) nello stesso modo della GS. Nelle condizioni basali, la GSK3 fosforila ed inattiva il eIF2B, ma sulla stimolazione dell’insulina, l’inibizione della GSK3 induce la defosforilazione e l’attivazione del eIF2B (anche se alcuni studi suggeriscono che la chinasi p70 S6 piuttosto che la Akt può essere responsabile della fosforilazione ed inibizione della GSK3 in questa via.
6
Fig. 22. Regulation of GSK3 in insulin signaling. Upon insulin stimulation, linear activation of IR/IRS-1/Akt inactivates GSK3, resulting in the dephosyphorylation of glycogen synthase and eIF2B. This, in turn, increases glycogen synthesis and protein synthesis. IR, insulin receptor; IRS, insulin receptor substrate..
2
7
Segnali Wnt
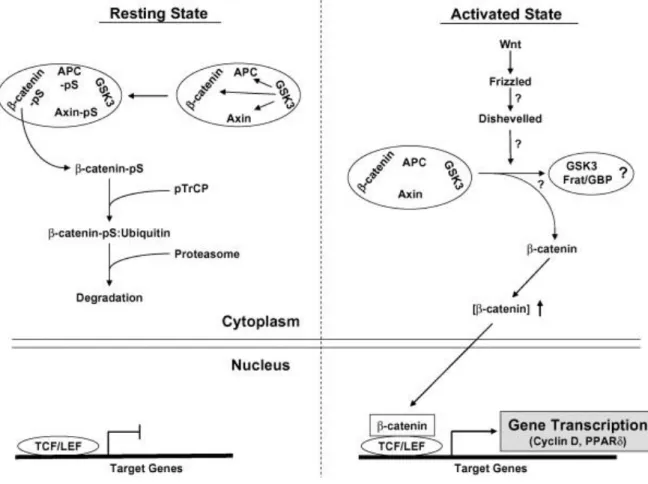
Studi genetici su Xenopus e Drosophila hanno mostrato che il GSK3 svolge un ruolo importante nella cascata del segnale del Wnt (Fig. 3). La GSK3 forma un complesso con la β-catenina, APC e l’impalcatura della proteina, Axin. Come nel segnale dell’insulina, la GSK3 è attiva nella stato basale, e fosforila la β-catenina, APC e Axin. (Figura 2,3) Per la fosforilazione dell’Axin e della β-catenina della GSK3 non sembra essere necessaria l’idonea fosforilazione di queste proteine come nella via del segnale dell’insulina. La fosforilazione dell’APC e dell’Axin stabilizzano il complesso ed aumentano l’affinità per la β-catenina, mentre la fosforilazione della β-catenina lo dirige verso la degradazione ubiquitina-dipendentein relazione alla ubiquitina ligasi, pTrCP. Tutto questo determina la riduzione della quantità della β-catenina ed il blocco della cascata del segnale del Wnt. Quando il segnale del Wnt è attivato, la GSK3 è dissociata dall’Axin, e la sua attività chinasica è inibita. Sebbene non sia ben compreso come la GSK3 sia dissociata ed inibita, è risaputo che il legame della piccola proteina, Frat/GBP, con la GSK3 è il fattore attivante di questi processi. Sembra che non siano coinvolte altre chinasi in questi processi, dato che la fosforilazione al residuo di Ser inibitorio (21 per α e 9 per β) non è stato identificato dopo la stimolazione del Wnt. L’inibizione della GSK3 blocca la degradazione ubiquitina-dipendente della β-catenina, e aumenta la quantità citoplasmatica della β-catenina, che risulta nella traslocazione della β-catenina nel nucleo. Congiuntamente a TCF/LEF, questo stimola il gene di trascrizione β-catenina-dipendente. Sebbene le cascate del segnale del Wnt siano ben conservate nelle diverse specie, c’è un’importante divergenza tra i vertebrati e le specie minori; nella Xenopus e Drosophila, il segnale Wnt è importante per lo sviluppo dell’asse, mentre nei vertebrati, l’attivazione incontrollata del segnale del Wnt è stata strettamente associata con lo sviluppo del cancro negli uomini e meno evidente con processi di sviluppo. Dovrebbe essere consideratp che l’insulina non può attivare la via del segnale del Wnt e Wnt non può aumentare la sintesi del glicogeno negli adipociti L1, suggerendo che ci sono almeno due gruppi di GSK3 in risposta ad ogni ligando indipendente.
8
Fig. 33. Role of GSK3 in the Wnt signaling pathway. In resting state, GSK3 phosphorylates β-catenin, Axin, and APC, leading to the ubiquitin-mediated degradation of β-catenin. Upon Wnt activation, GSK3 is dissociated from β-catenin complex and its activity is suppressed. Then, β-catenin is translocated into nucleus and complex with TCF/LEF, leading increased gene transcription. APC, adenomatous polyposis coli; Frat/GBP, frequently rearranged in advanced T cell lymphoma/GSK3 binding protein; PPARδ, peroxisome proliferator-activated receptor δ.
3
9
Segnale NFκB
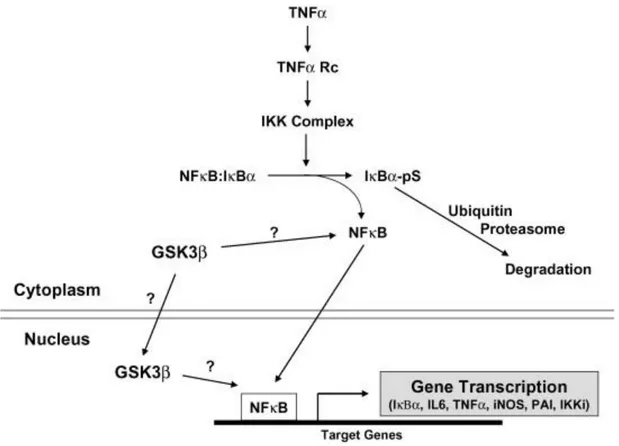
I topi knockout per il gene della GSK3β hanno rivelato un ruolo aggiuntivo della GSK3β. Il segnale della NFκB gioca un ruolo importante nella sopravvivenza della cellula, nella sua immunità e nell’infiammazione. Nello stato basale, NFκB è associato ad una proteina inibitoria chiamata IκBα. Quando le cellule sono stimolate con ligandi appropriati, compresi TNFα, lipopolisaccaride (LPS) e stress ossidativi, la IκBα è fosforilata dai complessi IKK, ubiquitinizzato e degradato da proteosomi (Fig. 4). Il complesso NFκB libero viene traslocato nel nucleo dove attiva il gene bersaglio della trascrizione. La delezione dei geni coinvolti in questa via, compresi IKKβ e la subunità p50 del NFκB, nei topi causa mortalità embrionale a causa dell’importante apoptosi del fegato e questo fenotipo è considerato un marchio del segnale del NFκB danneggiato. La delezione omozigote della GSK3β mostra lo stesso fenotipo, mortalità embrionale a causa dell’importante apoptosi del fegato. Quando GSK3β-/-MEFs fu stimolato con TNFα, il gene di trascrizione NFκB-dipendente fu bloccato. Tuttavia, l’attivazione del IKK, la degradazione del IκBα e la traslocazione del NFκB risultavano normali. Il meccanismo molecolare della regolazione della GSK3β sull’attivazione del gene NFκB, sia che avvenga nel citoplasma che ne nucleo, non è stato ancora identificato, anche se alcuni studi suggeriscono che la GSK3 può essere trovata nel nucleo coinvolta in altre vie. Inoltre, è stato mostrato che la GSK3β può fosforilare direttamente la subunità p65 del NFκB in vitro. Diversamente dalle vie del segnale dell’insulina e del Wnt, la GSK3β gioca un ruolo positivo nell’attivazione del NFκB, e non è chiaro se la GSK3, nel segnale del NFκB, è regolata dalla fosforilazione inibitoria della Ser come nel segnale dell’insulina. Dovrebbe inoltre essere notato che nei topi knock-out per il gene della GSK3β, il segnale del Wnt è normalmente dovuto alla compensazione della GSK3α, mentre la GSK3α fallisce nel mantenere l’attivazione del NFκB causata dalla delezione della GSK3β, suggerendo un ruolo diverso per le due isoforme.
10
Fig. 44. Role of GSK3 in NFκB signaling. GSK3β plays a positive role in NFκB activation. See text for details. TNF, tumor necrosis factor; IKK, IκB kinase; IκB, inhibitor of NFκB; IL-6, interleukin-6; iNOS, inducible nitric oxide synthase; PAI, plasminogen activator inhibitor.
4
11
Coinvolgimento del GSK3 nel fattore di trascrizione nucleare
Mentre la GSK3 è più comunemente conosciuto nel campo dell’insulina per il suo ruolo nella regolazione della sintesi del glicogeno, si è inoltre dimostrata importante in altre cascate di segnale. La GSK3 può fosforilare categorie multiple di proteine: enzimi metabolici (GS, ACC, ecc.), proteine strutturali (MBP, tau, ecc.), proteine di segnale (IRS-1, Cyclin D, ecc.) e fattori di trascrizione (Tabella 1). Di queste attività alternative della GSK3, la più estesamente studiata è quella che coinvolge la regolazione dei fattori di trascrizione. I fattori di trascrizione che sono regolati dalla GSK3 sono NFκB, β-catenina, AP-1, compreso c-Jun, CREB, C/EBP, ADD/SREBP1c, GATA4, HSF-1, Mash 1, MITF, c-Myb, c-Myc, neuro, NFAT, Notch, p53 e TCF.
Come in molte altre vie di segnale, GSK3 regola negativamente i fattori di trascrizione per mezzo della fosforilazione. Per esempio, GSK3 fosforila il dominio di legame del DNA del Jun, il quale riduce la propria attività di legame del DNA. In un altro esempio, la fosforilazione della β-catenina da parte della GSK3 induce la degradazione ubiquitina-dipendente della proteina, [tabella 1] di conseguenza si spegne il segnale del Wnt. Inoltre, la fosforilazione mediata dalla GSK3 del NFAT induce l’esportazione del NFAT dal nucleo, spegnendo effettivamente il gene di regolazione del NFAT. Così, anche se la fosforilazione GSK3-mediata risulta in molte conseguenze diverse, i risultati sono gli stessi: lo spegnimento dell’espressione del gene. Ad ogni modo, non tutti i fattori sono regolati negativamente dalla fosforilazione GSK3-dipendente. Un esempio è il NFκB.
12
Ruolo giocato dalla GSK3 nella resistenza all’insulina
Dal momento che la GSK3 è un enzima chiave nella regolazione della sintesi del glicogeno, si è generalmente pensato che la GSK3 partecipi principalmente nello sviluppo della resistenza all’insulina attraverso l’inibizione dell’attività della GS, sopprimendo di conseguenza la sintesi del glicogeno stimolata dall’insulina. Per questo motivo, gli studi sul ruolo della GSK3 nella resistenza all’insulina si sono storicamente focalizzati nella regolazione dell’attività della glicogeno sintesasi o nella sintesi del glicogeno. È stato visto che il diabete di tipo 2 (T2D) è strettamente associato con la diminuzione dell’attività della GS stimolata dall’insulina e sintesi del glicogeno unitamente all’aumento dei livelli di GSK3 nel muscolo.
Ad ogni modo, gli studi sulla regolazione della GSK3 nella sintesi del glicogeno e nella resistenza all’insulina sono limitati. Nei topi C57/BL6 nutriti con una dieta ad elevato apporto di grassi, l’attività chinasica della GSK3 nei grassi è più elevata rispetto a quella dei topi nutriti normalmente, ma l’attività chinasica nel fegato e nel muscolo è invariata. D’altra parte, nei campioni di muscolo da T2D presentano un’elevata quantità di GSK3 senza una modifica nell’attività chinasica specifica della GSK3β. Perciò, il totale netto dell’attività della GSK3 nei T2D è aumentata e la sintesi del glicogeno è diminuita. Queste scoperte conducono verso l’ipotesi che l’aumento dell’attività chinasica della GSK3 causa resistenza all’insulina, riducendo quindi la clearance del glucosio dal sangue.
Alcuni studi che hanno utilizzato inibitori della GSK3 si sono focalizzati su questa scoperta gli inibitori della GSK3, come il Li2+ e composti organici a basso peso molecolare più specifici sono stati usati in animali insulino-resistenti. Le scoperte iniziali di questi studi sono promettenti, tra cui l’aumento della sensibilità del corpo all’insulina accompagnata dell’aumento dell’attività epatica della glicogeno sintetasi e della sintesi del glicogeno.
Tuttavia, alcune scoperte suggeriscono che la GSK3 potrebbe mediare la resistenza all’insulina attraverso la regolazione di altre vie rispetto a quella della sintesi del glicogeno. Primo, anche se la sintesi del glicogeno del muscolo non risulta modificata dagli inibitori, l’assorbimento del glucosio da parte del muscolo ex-vivo risulta migliorato dal trattamento. Secondo, i livelli di espressione del PEPCK e G6Pase sono soppressi dal trattamento. PEPCK e G6Pase partecipano ad una via che è regolata dall’insulina ma indipendente dalla sintesi del glicogeno. Terzo, la wortmannina PI3 chinasi inibitore può
13 inibire l’assorbimento del glucosio indotto dal Li2+
ma non la sintesi del glicogeno negli adipociti, suggerendo che l’inibizione della GSK3 moduli il segnale prossimale dell’insulina indipendentemente dal suo ruolo nella regolazione della sintesi del glicogeno. Infine, il trattamento delle colture di cellule di muscolo con inibitori della GSK3 aumenta la quantità di proteina IRS-1, suggerendo che la GSK3 partecipa nella regolazione post-trascrizionale di componenti del segnale dell’insulina.
Inoltre, molti modelli animali di enzimi coinvolti nella via metabolica del glicogeno hanno recentemente mostrato che l’aumento o la riduzione della sintesi del glicogeno o dei livelli di glicogeno non sono necessariamente associati con lo sviluppo di resistenza all’insulina. Per esempio, anche se la sovraespressione di proteine target del glicogeno (PTG) fegato-specifiche e mediate da adenovirus aumenta i livelli di glicogeno a digiuno più di 100 volte rispetto ai topi infettati con il virus di controllo, il glucosio a digiuno ed i livelli di insulina non sono differenti. Mentre in questo caso particolare i topi infettati con l’adenovirus esprimente PTG non hanno mostrato riduzione della tolleranza del glucosio, questo sembra essere dovuto all’elevato aumento della sintesi di glicogeno nel fegato. Similarmente, la sovraespressione della glucochinasi nel fegato o della GS nel muscolo, o eliminazione (knocking out) della fosfatasi specifica del muscolo PP1G/RGL, determinano livelli di glicogeno alterati senza influenzare la resistenza all’insulina dei topi. Anche se alcuni modelli genetici come quelli del corpo intero senza (knock-out) la PTG hanno mostrato una sintesi del glicogeno danneggiata insieme al segnale dell’insulina difettoso e lo sviluppo di resistenza all’insulina, gli studi descritti sopra suggeriscono chiaramente che le modifiche al metabolismo del glicogeno non alterano la resistenza all’insulina. Oltretutto, è stato mostrato che la sintesi del glicogeno nel muscolo è limitata dall’assorbimento del substrato (glucosio) insulino-stimolato. Così, il cambio della sintesi del glucosio nel diabete di tipo 2 e la resistenza all’insulina non possono causare queste malattie; piuttosto, potrebbe semplicemente essere un marker surrogato dello sviluppo dello stato di resistenza all’insulina che è dovuto invece, per esempio, all’assorbimento del glucosio stimolato dall’insulina danneggiato.
È stato inoltre suggerito che la GSK3β può attenuare la fosforilazione stimolata dall’insulina dei residui di Tyr in IR e IRS-1 grazie alla fosforilazione diretta di queste proteine ai residui Ser. Questo suggerisce che la GSK3β è una chinasi potenziale che induce la resistenza all’insulina. Ad ogni modo, uno studio che ha usato un adenovirus negli adipociti 3T3-L1 ha mostrato che mentre l’espressione della GSK3β aumenta la
14
fosforilazione del IRS-1, e lo fa senza danneggiare l’attivazione della Akt stimolata dall’insulina e dell’assorbimento del glucosio. Perciò, l’effetto direttamente modulante della GSK3 sui componenti del segnale dell’insulina può causare la resistenza all’insulina, ciò deve essere ancora provato.
Si dovrebbe notare che molti dei fattori di trascrizione regolati dalla GSK3 sono conosciuti per la loro capacità di regolare i segnali dell’insulina e dell’omeostasi del glucosio. Per esempio, NFκB partecipa alla resistenza all’insulina indotta dall’infiammazione, la funzione della β-catenina e C/EBP nell’adipogenesi, e servizi del CREB nella gluconeogenesi epatica. Questi studi hanno chiaramente sollevato le possibilità che la GSK3 possa mediare lo sviluppo della resistenza all’insulina attraverso la regolazione dell’attivazione e dei fattori di trascrizione.
Complessivamente, queste scoperte suggeriscono che la GSK3 potrebbe regolare la resistenza all’insulina in molti passaggi di molte vie di segnale.
Le GSK3α e β sono funzionalmente equivalenti?
L’analisi della via che coinvolge la GSK3 ha generalmente mostrato il ruolo che l’isoforma GSK3β gioca in queste vie. Senza molte evidenze in supporto, viene generalmente assunto che la GSK3α e β hanno la stessa funzione biochimica e fisiologica. Ad ogni modo, le evidenze accumulate suggeriscono ora che la GSK3α e β non siano funzionalmente identiche. Uno dei primi segni di questo derivava da studi genetici della cascata del segnale di Wnt nella Drosophila. La Drosophila ha una sola chinasi GSK3 che è l’omologo della GSK3β umana. Quando la GSK3α o β umane sono sovraespresse nella mosca Drosophila shagghy knock-out, la GSK3β umana ma non la non umana GSK3α può salvare il danneggiamento del segnale Wnt, il che suggerisce che le GSK3α e β umane possano avere proprietà fisiologiche abbastanza diverse. Inoltre, i topi knock-out per GSK3β mostrano chiaramente che la GSK3α non può compensare completamente la perdita della GSK3β, visto che malgrado i normali livelli di espressione della GSK3α e la sua attività chinasica, i topi GSK3β-/- muoiono durante l’embriogenesi a causa dell’importante apoptosi del fegato causata dal segnale del NFκB danneggiato. Un’altra prova venne dallo studio della fosforilazione GSK3β-mediata dei precursori proteici amiloidi (APP) che ha permesso la sua proteolisi e la produzione del peptide amiloide β,
15
che si crede essere importante per lo sviluppo del morbo di Alzheimer. Il Li2+ può inibire la fosforilazione dell’APP GSK3β-mediata. Ad ogni modo, la soppressione mediata da siRNA di entrambe le isoforme ha rivelato che solo la soppressione della GSK3α e non della GSK3β, riduce la fosforilazione dell’APP. Studi recenti hanno mostrato che la GSK3β ma non la GSK3α regola negativamente la permeabilità mitocondriale dei pori nei cardiomiociti e l’attivazione del JNK nelle cellule fornisce prove ulteriori in aiuto alla nozione ce le GSK3α e β hanno funzioni diverse. Così, mentre le GSK3α e β possono condividere alcune funzioni biologiche fisiologiche, possono giocare ruoli fisiologicamente anche molto divergenti in alcune vie di segnale, comprese quelle per la regolazione dell’omeostasi del glucosio e dello sviluppo della resistenza all’insulina.
Studi futuri
Storicamente la GSK3 è stata coinvolta nella mediazione dello sviluppo della resistenza all’insulina, principalmente per la regolazione della sintesi del glucosio. Ad ogni modo, scoperte recenti hanno suggerito che la GSK3 possa mediare l’omeostasi del glucosio e lo sviluppo della resistenza dell’insulina in multiple vie di segnale, compresa in quella dell’infiammazione, dell’adipogenesi e della trascrizione genica. Oltretutto, le evidenze biochimiche e genetiche suggeriscono che le GSK3α e β possano giocare un ruolo diverso nella regolazione del metabolismo. Tutte queste complessità rendono difficile la comprensione di come le GSK3α e β regolino l’omeostasi del glucosio e lo sviluppo della resistenza all’insulina in vivo. D’altra parte, gli studi inibitori negli animali hanno mostrato chiaramente che la GSK3 può essere un buon bersaglio terapeutico per il trattamento della resistenza all’insulina e diabete di tipo 2 senza lo sviluppo di alcun significativo effetto collaterale. Questo evidenzia chiaramente per determinare le cascate dei segnali delle GSK3α e β nello sviluppo della resistenza all’insulina. Alcuni studi con i topi knock-out GSK3α e β compresi topi knock-out condizionali potranno aiutare a scoprirlo. Studi biochimici per identificare i specifici substrati delle GSK3α e β potranno anche rivelare le potenziali funzioni fisiologiche del GSK3 nell’omeostasi del glucosio. Questi studi forniranno ulteriori giustificazioni per lo sviluppo di specifici inibitori delle isoforme specifici per GSK3α e β e per testare questi inibitori per il trattamento della resistenza all’insulina e diabete di tipo 2.