CAPITOLO 2
STUDIO DELLA DIFFUSIONE MEDIANTE
IMMAGINI DI RISONANZA MAGNETICA
2.1 NMR e diffusione molecolare in tessuti
biologici
Con il termine diffusione si indica il moto caotico e disordinato delle molecole di un sistema dovuto all’agitazione termica.
I tessuti biologici possono svolgere le loro funzioni vitali all’interno di un range di temperature che va da 273°K a 315°K : in tali condizioni la maggior parte degli elementi biologici si presenta allo stato liquido o in soluzione acquosa. La diffusione riveste perciò un ruolo primario nei processi di trasporto che avvengono in ambito metabolico; il principale mezzo di trasporto in tali processi è l’acqua, che rappresenta circa il 70% in volume dei tessuti biologici.
I tessuti, a livello microscopico, non presentano una struttura omogenea: le membrane cellulari ed i vari organelli formano ostacoli al movimento dell’acqua e delle altre molecole biologiche. Misure riguardanti la mobilità delle molecole d’acqua possono quindi fornire rilevanti informazioni sulla struttura dei tessuti e sulla presenza di eventuali alterazioni patologiche.
2.1.1 Processo di diffusione molecolare
Le tecniche tradizionali per lo studio di processi diffusivi utilizzano un tracciante, iniettato nella zona di interesse, di cui registrano i profili spazio-temporali di concentrazione. Per un mezzo isotropo vale la legge di Fick , in base alla quale il flusso di tracciante risulta: 1a
J = - D∇C (2.1)
dove C è la concentrazione molecolare di tracciante e D il “coefficiente di diffusione” del mezzo. Quindi è possibile determinare D a partire dal rapporto tra J e , dove queste ultime grandezze possono essere misurate mediante opportuni metodi di natura fisica o chimica.
C ∇
Secondo il Sistema Internazionale si utilizzano le seguenti unità di misura:
J = [moli/sec · m ] , 2 ∇C = [moli/m ] , D = [4 m /sec ] 2
Sostituendo l’eq.(2.1) nell’equazione di conservazione della massa, data da:
t ∂
∂C = - ∇ · J (2.2)
si ottiene l’equazione di diffusione:
t ∂ ∂C
= ∇ · (D∇C) (2.3)
Nel caso in cui D sia uniforme nello spazio, il mezzo sia infinito (ossia il flusso non è ostacolato) ed il profilo iniziale di concentrazione sia:
C(r,t) = δ(r - ) r0
l’eq. (2.3) ha una soluzione data da: ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ − ⋅ − ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ π = 4Dt ) ( ) ( -exp Dt 4 1 t) C( 3 0 0 r r r r , r (2.4)
Utilizzando l’equazione di diffusione e ricorrendo all’ausilio di traccianti radioattivi o fluorescenti è possibile perciò determinare il coefficiente di diffusione del sistema in esame.
Si può notare, poi, che il coefficiente D definito sopra coincide con quello presente nella relazione ricavata da Einstein:
(r - ) · (r - ) = 6Dt (2.5) 〈 r0 r0 〉
che esprime la varianza del processo stocastico P(r/r0,t), il quale fa riferimento alla
probabilità di trovare una molecola in una posizione r ad un istante t partendo da una posizione iniziale . La (2.5) è valida in caso di diffusione libera (senza ostacoli). r0
In accordo alla relazione di Einstein esiste una proporzionalità diretta tra la distanza di diffusione (cioè il cammino medio percorso da una molecola in movimento diffusivo) ed il tempo di percorrenza: andando a disegnare su un piano cartesiano tale relazione, la pendenza della retta ottenuta è una misura del coefficiente di diffusione della specie in esame.
Le tecniche che utilizzano traccianti operano in situazioni di non equilibrio e riescono difficilmente a sondare strutture inferiori al millimetro. Per studi di diffusione a livello microscopico si utilizzano tecniche di scattering laser o neutronico, arrivando anche a risoluzioni dell’ordine del nanometro; tali procedure sono però molto invasive e quindi difficilmente applicabili per studi in vivo e sull’uomo.
2.1.2 NMR e diffusione
La tecnica NMR rappresenta l’unica metodica totalmente non invasiva che ci permetta di eseguire studi di diffusione molecolare a livello cellulare.
Il principio su cui si basa tale procedura è quello dell’effetto IVIM (Intra Voxel Incoherent
Motion): in condizioni di equilibrio il flusso macroscopico molecolare in un mezzo diffusivo
è nullo, anche se a livello microscopico le singole molecole sono soggette ad un moto incoerente e casuale.
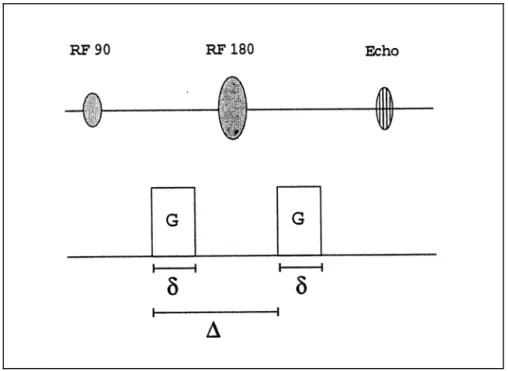
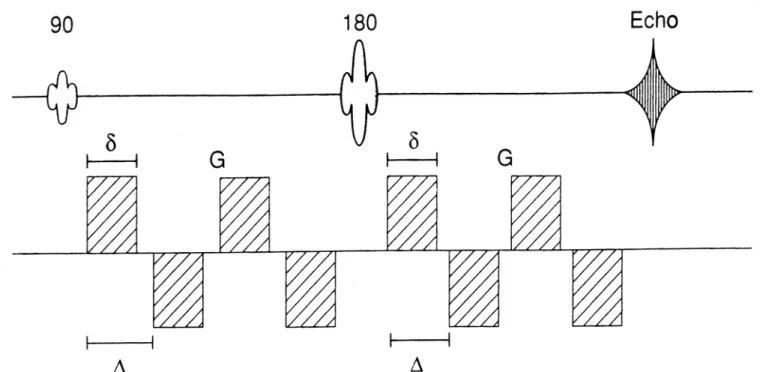
In NMR è possibile implementare specifiche sequenze sensibili al moto incoerente delle molecole, ottenendo una perdita di segnale FID nelle zone a maggior diffusione. L’idea è quella di utilizzare un gradiente bipolare come quello di fig. 2.1 (sequenza di Stejskal-Tanner): in pratica si tratta di una sequenza Spin-Echo cui si aggiungono due gradienti di campo magnetico, di ampiezza G, intervallati dall’impulso a 180°. Il tempo di applicazione di ogni gradiente è pari a δ, mentre il tempo che intercorre tra le applicazioni dei due gradienti è ∆. I due gradienti, detti “gradienti di diffusione”, per distinguerli da gradienti utilizzati per altre funzioni (tipo l’imaging), hanno lo scopo di marcare magneticamente gli
spin.
Figura 2.1: Sequenza di Stejskal – Tanner con i due gradienti di diffusione, G, applicati per un intervallo di tempo pari a δ e distanziati a loro volta di un intervallo ∆.
Il primo gradiente induce uno sfasamento φ della magnetizzazione trasversale che 1 dipende dalla posizione del singolo spin. Se il gradiente è applicato lungo l’asse z si ha:
1 (2.6) 0 1 1
∫
Gz dt γGδz δ = = φdove è la posizione dello spin , che viene supposta costante durante l’intervallo δ. z1 Lo sfasamento prodotto dal secondo gradiente di diffusione (applicato ancora lungo la direzione z) è dato similmente da:
2 (2.7) 2 2
∫
Gz dt γGδz δ + ∆ ∆ = = φdove z2 è la posizione dello stesso spin all’istante di applicazione del secondo gradiente. Tenendo conto che il secondo gradiente di diffusione è applicato dopo l’impulso a 180°, che inverte la magnetizzazione trasversale , otteniamo uno sfasamento totale dato da:
δ
( )
φ =φ1−φ2 =γGδ(
z1−z2)
(2.8) Per spin statici si ha e lo sfasamento prodotto dai due gradienti è nullo. Al contrario, per gli spin in movimento si ha uno sfasamento globale diverso da zero, che dipende dal moto molecolare durante l’intervallo ∆, ossia dai processi di diffusione nel mezzo in esame. Possiamo anche notare come lo sfasamento ottenuto sia indipendente dalla posizione dei due gradienti in termini temporali rispetto all’impulso a 180°.2
1 z
z =
La magnetizzazione che noi andiamo a misurare è data dalla somma dei momenti magnetici di ogni singolo spin, ognuno con le sue caratteristiche di moto. Otteniamo perciò la seguente relazione: =
∑
(
δ( )
φ j j 0 i exp M M)
(2.9)dove M0 è la magnetizzazione di equilibrio.
Se indichiamo con la probabilità condizionata di trovare uno spin, inizialmente in posizione , compreso tra le posizioni e ( +d ) dopo un intervallo di tempo ∆, otteniamo:
(
z2 z1)
dz2 P | ,∆ 1 z z2 z2 z2∫ ∫
(
(
)
) (
)
+∞+∞ − δ γ = 0 0 0 2 1 1 2 2 1 z Pz z ∆ dz dz z G i exp M M , | (2.10)Nel caso di diffusione libera ed unidirezionale (come quello analizzato sin qui) la probabilità condizionata è data da:
(
)
(
)
⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ ∆ ∆ π = − 4D z z -exp D 4 1 ∆ z z P 2 2 1 1 2 | , (2.11)dove D è il coefficiente di diffusione.
Sostituendo la (2.11) nella (2.10) si ottiene:
=exp
(
-(
γGδ)
D∆ M M 2 0)
(2.12) o, in forma logaritmica: ⎟⎟=−(
γ δ)
∆ ⎠ ⎞ ⎜⎜ ⎝ ⎛ D G M M ln 2 0 (2.13)in cui si ottiene una relazione diretta tra il coefficiente di diffusione (detto anche “diffusività”) ed il logaritmo naturale dell’attenuazione pesata di segnale.
La (2.13) rappresenta la relazione base per misure di diffusione utilizzanti tecniche NMR. Nella pratica si utilizza un certo numero di sequenze di Stejskal-Tanner, ognuna con una sua coppia di valori di G e δ, ricavando per ogni sequenza applicata il valore logaritmico dell’attenuazione pesata di segnale; su un piano cartesiano si riporta la retta di
interpolazione per ln(M/M0) in funzione di
( )
Gδ 2 e la pendenza di tale retta è proprio unamisura di D.
Rimangono a questo punto due problemi derivanti da alcune ipotesi semplificative fatte in precedenza. Per prima cosa si è supposto che δ<<∆ e che quindi i processi diffusivi durante l’applicazione dei due gradienti di diffusione fossero trascurabili: nella pratica ciò non è vero, in quanto molto spesso nelle indagini MRI si hanno a disposizione gradienti di ampiezza piccola, che richiedono una certa durata in modo da poter avere misure consistenti di diffusione.
Inoltre dobbiamo tener conto dell’effetto provocato da altri gradienti (ad esempio quelli necessari per l’imaging) presenti in ogni indagine.
2.1.3 Equazione di Bloch per mezzi diffusivi
Per una trattazione completa dei processi di diffusione e dei loro effetti in MRI è necessario far ricorso all’equazione di Bloch per mezzi diffusivi, data da:
+ ⎟ ⎟ ⎟ ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎜ ⎜ ⎜ ⎝ ⎛ + ⎟ ⎟ ⎟ ⎟ ⎟ ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎜ ⎜ ⎜ ⎜ ⎜ ⎝ ⎛ − Λ γ = ∂ ∂ 1 T 1 0 0 T 1 0 0 0 T 1 0 0 0 T 1 t 1 2 2 0 M M B M M ∇ ·(D∇ M) (2.14)
dove D è il tensore di diffusione, M la magnetizzazione misurata, la magnetizzazione di equilibrio, e i tempi di rilassamento longitudinale e trasversale, B il campo magnetico totale prodotto dal campo statico e dall’insieme dei gradienti G, di imaging e diffusione, applicati. La soluzione generale di tale equazione è la seguente:
0
M
1
( )
( )
( )
( )
⎟⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ −∫
= t 0 T du u u exp t M t M * k Dk (2.15)dove rappresenta la magnetizzazione in assenza di processi diffusivi e k(t) è dato da:
( )
t M*( )
=γ∫
t( )
(2.16) 0 dt' t' t G kdove tutti i gradienti applicati dopo un eventuale impulso a 180° si intendono cambiati di segno.
In una generica sequenza in campo MRI si utilizzano opportune configurazioni per i gradienti di imaging in modo da rendere k(t) il più possibile vicino a zero, così da poter trascurare eventuali effetti provocati da processi diffusivi. L’idea è quella di applicare gradienti di media intensità per brevi intervalli di tempo; inoltre lo sfasamento prodotto da ciascun gradiente è compensato applicando un secondo gradiente di pari intensità avente polarità opposta. Operando in tal modo si riesce a rendere l’attenuazione di segnale dovuta a processi diffusivi inferiore al 2%.
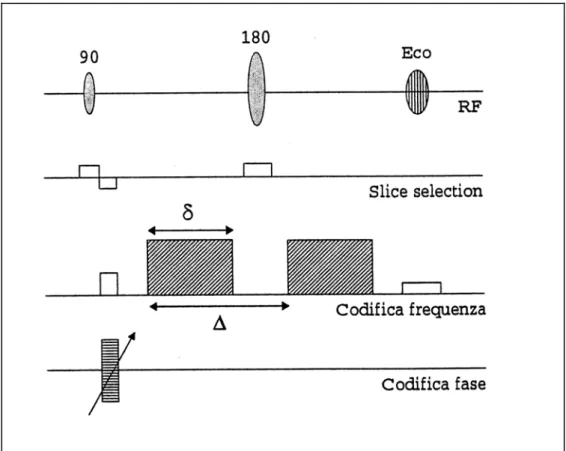
In campo DWI (Diffusion Weighted Imaging), oltre ai gradienti di imaging, si utilizzano gradienti bipolari di notevole intensità ed aventi periodi di applicazione sufficienti a
realizzare un adeguato sfasamento degli spin. La sequenza base utilizzata in tali tecniche è quella di Stejskal-Tanner con l’aggiunta dei gradienti di imaging:
Figura 2.2: Sequenza Spin - Echo accoppiata con una sequenza di Stejskal - Tanner pesata in diffusione lungo l’asse di codifica in frequenza.
Tornando alla formula (2.15), per un mezzo isotropo il tensore di diffusione è una matrice diagonale con gli elementi sulla diagonale uguali fra loro e coincidenti con il coefficiente di diffusione. In tal caso, supponendo anche di utilizzare una sequenza come quella in fig. 2.2, abbiamo una soluzione semplificata, data da:
( )
exp(
-bD M TE M 0 =)
(2.17) dove M(TE) è la magnetizzazione trasversale misurata al tempo di eco, è la magnetizzazione trasversale al tempo t = subito dopo l’applicazione dell’impulso a 90°, mentre il termine b è dato da:0
M
+
=TE
∫
( ) ( )
⋅ (2.18) 0 dt' t' t' b k ke viene detto “b value” o “b factor”.
Risolvendo tale espressione per la sequenza in esame otteniamo:
b=(γGδ)2(∆-δ/3) (2.19)
Per δ<<∆ la (2.17) coincide con la (2.12).
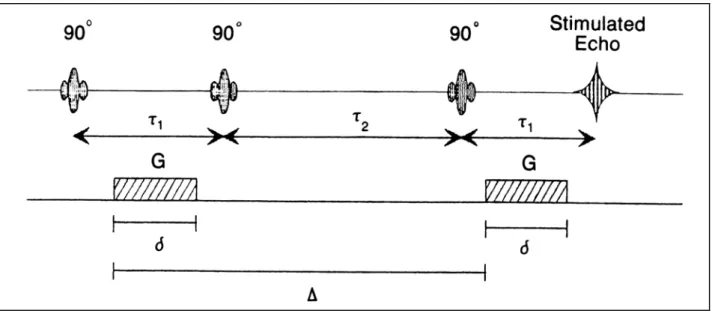
La sequenza di Stejskal-Tanner va bene fino a che non si ha a che fare con mezzi diffusivi aventi un tempo di rilassamento trasversale molto piccolo: in tal caso avremmo bisogno di tempi TE molto piccoli, che però porterebbero ad avere un’attenuazione di segnale non sufficientemente consistente. In tali casi si fa ricorso ad una sequenza di indagine come la seguente, detta “Stimulated Echo Sequence”:
2
T
Figura 2.3: Stimulated Echo Sequence
In questo caso alla fine del secondo impulso a 90° metà della magnetizzazione trasversale viene trasposta come magnetizzazione longitudinale, che avrà un’attenuazione dipendente da , che nei tessuti biologici è maggiore di di qualche ordine di grandezza. Viene così risolto il problema del basso valore di , anche se viene introdotta una riduzione di segnale di un fattore 1/2 non dovuta ai processi diffusivi.
1
T T2
2
T
Nella pratica, comunque, in campo DWI si opererà utilizzando la sequenza di Stejskal-Tanner e tecniche di acquisizione veloce dell’immagine.
2.1.4 Diffusione anisotropa
La diffusione è un processo tridimensionale ed inoltre la mobilità molecolare non può essere la stessa in ogni direzione. Questa anisotropia può essere dovuta a vari fattori, tra cui la presenza di ostacoli e la configurazione strutturale del mezzo.
In mezzi anisotropi la relazione (2.17) è sostituita dalla seguente:
( )
⎟⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ =∑∑
= = 3 1 i 3 1 j ij ij 0 D b -exp M TE M (2.20)dove i Dij sono gli elementi del tensore di diffusione e bij, dato da:
=TE
∫
( ) ( )
(2.21) 0 dt' t' k t' k bij i jrappresenta l’elemento generico della matrice b , detta “b-matrix”.
Gli elementi diagonali del tensore di diffusione rappresentano le correlazioni del movimento degli spin molecolari lungo una stessa direzione, mentre gli elementi non diagonali fanno riferimento alle correlazioni lungo direzioni ortogonali. Gli elementi bij
dipendono dalla particolare sequenza utilizzata e sono quindi funzione dei gradienti di diffusione e di quelli di imaging.
2.1.5 Diffusione nei sistemi biologici
I tessuti biologici differiscono in modo sostanziale da un mezzo infinito ed omogeneo, come abbiamo considerato fino ad ora. I vari tessuti, infatti, presentano una struttura eterogenea e sono suddivisi in molteplici compartimenti (microstrutture); inoltre, tenendo conto della permeabilità delle barriere che separano i singoli compartimenti, dobbiamo anche prendere in esame possibili fenomeni di scambio e di trasporto. In tale ottica un trattamento del segnale NMR come in precedenza non rifletterebbe propriamente la struttura e le proprietà del tessuto, ed una misura del coefficiente di diffusione potrebbe risultare priva di significato, a meno che non siano specificate la scala temporale (∆), la direzione e l’intensità dei gradienti di diffusione applicati.
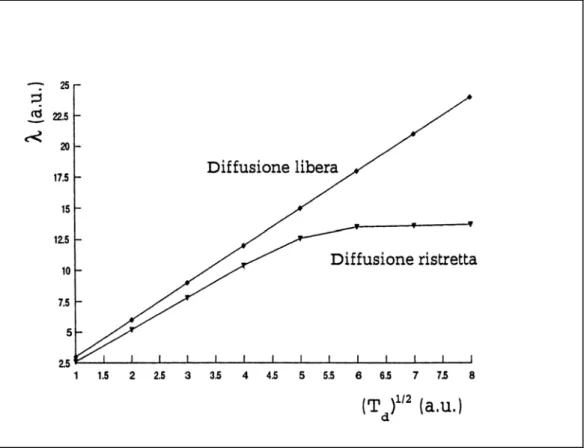
La diffusione viene detta “ristretta” se il mezzo possiede barriere che non sono attraversabili dalle molecole in movimento: tali barriere si comportano perciò come ostacoli impermeabili. Nel caso in cui si considerino tempi di diffusione brevi, la maggior parte delle molecole non riesce a raggiungere le barriere e la diffusione può essere considerata libera. All’aumentare del tempo di diffusione, invece, gran parte delle molecole in moto andrà a colpire tali barriere e la misura dei coefficienti di diffusione risulta da ciò condizionata. Il cammino libero medio in una direzione, calcolato mediante la formula di Einstein per la diffusione libera, è dato da:
〈z2〉 = 2DTd (2.22)
In caso di diffusione libera il cammino libero medio, detto anche “distanza di diffusione”, è proporzionale a T ; in presenza di diffusione ristretta, invece, esso tende ad un valore d asintotico dell’ordine delle dimensioni caratteristiche del particolare compartimento. Questi effetti dipendono, oltre che dal tipo di barriera, anche dalla forma (sferica, cilindrica,..) della barriera stessa e dal tipo di gradienti (costanti, pulsati,..) utilizzati nell’indagine sperimentale. In linea teorica, quindi, si potrebbero sfruttare misure di diffusione per ottenere informazioni sulla struttura dei tessuti e per risalire alle dimensioni dei compartimenti.
Figura 2.4: Diffusione libera e diffusione ristretta in un mezzo biologico. Nel primo caso λ è proporzionale a d
T , mentre nel secondo λ tende ad un valore asintotico con l’aumentare del periodo di diffusione.
In condizioni di diffusione ristretta con barriere impermeabili i coefficienti di diffusione risultano inferiori a quelli che si hanno in caso di diffusione libera ed inoltre diminuiscono all’aumentare del tempo di diffusione secondo la formula:
( )
d 2 d 2T T D = ζ (2.23)dove ζ è un parametro che rappresenta il valore della dimensione caratteristica del compartimento in esame.
In un’indagine DWI, come già accennato, per evitare la comparsa di processi legati alla diffusione ristretta è opportuno ridurre il tempo di diffusione Td
( )
∆ in modo tale da rendere la distanza di diffusione inferiore alla dimensione caratteristica del compartimento in esame. Il problema a cui si va incontro, però, riguarda la diminuzione dell’attenuazione dovuta a processi diffusivi. Per tentare di risolvere anche quest’ultima cosa si può pensare di far ricorso a più coppie di gradienti bipolari di diffusione: in questo modo, se da una parte il b factor subisce una diminuzione a causa del ridotto valore di ∆, dall’altra aumenta per la presenza di più coppie di gradienti bipolari.
Lo svantaggio di questa procedura di indagine è che, comunque, si ha a che fare globalmente con un b factor n volte più piccolo di quello ottenuto utilizzando un solo paio di gradienti di diffusione bipolari (sequenza di Stejskal-Tanner), dove n è il numero di coppie di gradienti utilizzate.
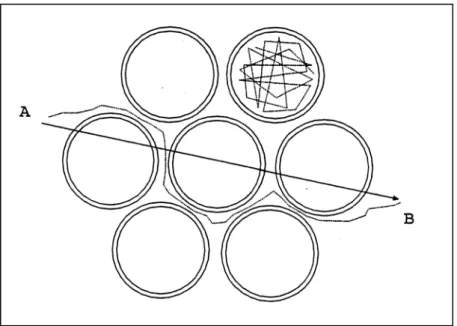
Nei tessuti biologici la diffusione può essere, oltre che “ristretta”, anche “ostacolata”. Data la presenza di ostacoli quali fibre, macromolecole ed organelli, le molecole che diffondono percorrono sempre un cammino maggiore dell’effettivo spostamento: le molecole non possono, infatti, diffondere in linea retta, ma intorno alle strutture per loro impermeabili. Tutto questo si traduce in un maggior tempo di diffusione per diffondere da una regione ad un’altra. Il coefficiente di diffusione in caso di diffusione ostacolata può essere espresso come:
D Dfree2
ζ
= (2.24)
dove Dfree è il coefficiente di diffusione in assenza di ostacoli e ζ è un coefficiente di tortuosità.
Figura 2.6: Diffusione ristretta (compartimento in alto) e diffusione ostacolata. Le varie strutture all’interno
dei tessuti impediscono alle molecole di seguire un percorso rettilineo da A a B, costringendole ad effettuare un cammino tortuoso.
Un altro tipo di diffusione è quello che si ha in presenza di barriere parzialmente permeabili alle molecole in movimento. In tal caso il coefficiente di diffusione decresce all’aumentare del tempo di diffusione, come per la diffusione ristretta, ma al contrario di essa raggiunge un valore asintotico dato da:
(
)
ka D -1 D D 0 0 asymp = (2.25)dove è il coefficiente di diffusione libera, k la costante di permeabilità della barriera ed a un parametro funzione della forma e delle dimensioni del compartimento in esame.
0
D
In molti tessuti biologici la diffusione è un processo tridimensionale e, in genere, anisotropa. L’anisotropia può essere dovuta alla presenza di strutture direzionali od ostacoli che limitano la diffusione. Sono inoltre possibili casi di diffusione anisotropa e non ristretta o viceversa. Tessuti che sono caratterizzati da fenomeni di diffusione anisotropa sono la sostanza bianca, il rene, i muscoli scheletrici ed i muscoli cardiaci.
2.1.6 Coefficiente di diffusione apparente (ADC)
Considerando la presenza di fenomeni di diffusione ristretta, ostacolata ed anisotropa, misure di diffusione nei tessuti biologici possono dipendere dalle relative procedure sperimentali e sono significative soltanto se correlate ad esse. Poiché, inoltre, i tessuti si presentano come strutture molto eterogenee, non sono possibili misure di diffusione locale, se non una determinazione dei valori medi all’interno della zona di interesse. Dopo aver precisato questa limitazione, è preferibile non parlare di diffusione assoluta ed utilizzare il termine “coefficiente di diffusione apparente (ADC)”. In MRI non è possibile risalire ai valori di ADC per zone di interesse di dimensioni inferiori a quelle del voxel. All’interno di un voxel sono presenti più microstrutture e compartimenti, basti pensare alle regioni intracellulare ed extracellulare. Nell’ipotesi che i tempi di diffusione siano piccoli da
poter trascurare i fenomeni di scambio tra i vari compartimenti e considerare una diffusione non ristretta in ognuno di essi, l’attenuazione del segnale misurato è data da:
=
∑
(
i i iexp-bD p M M 0)
(2.26) dove Di e pi sono rispettivamente il coefficiente di diffusione e la frazione di molecole chediffondono nell’i-esimo compartimento.
In questo caso il coefficiente di diffusione apparente che andiamo a misurare è funzione di b: misure con bassi valori di b sono più sensibili alle componenti a rapida diffusione. L’approccio ideale sarebbe quello di separare i vari sottocompartimenti eseguendo un fit multi-esponenziale: sfortunatamente i valori di sono spesso non elevati e non molto differenti l’uno dall’altro. La procedura richiederebbe quindi grandi valori di b ed alti rapporti segnale-rumore; inoltre dovrebbero essere tenuti in considerazione anche effetti di rilassamento se i vari compartimenti avessero tempi di rilassamento diversi. La situazione cambia se si aumenta il tempo di diffusione: la diffusione inizia ad essere ristretta nei compartimenti più piccoli e possono non essere più trascurabili fenomeni di scambio molecolare fra compartimenti comunicanti. Applicando il teorema del limite centrale su di una distribuzione statistica di compartimenti per lunghi tempi di diffusione è possibile giustificare l’utilizzo di un unico coefficiente di diffusione apparente, dato da:
i D =
∑
(2.27) i i iD p ADCUn’analisi delle varie curve di attenuazione registrate con differenti tempi di diffusione consentirebbe di ricavare un’accurata descrizione della microstruttura del mezzo in esame: nella pratica, comunque, studi con tempi di diffusione molto piccoli sono sperimentalmente molto difficili da realizzare, in quanto in tali casi avremmo bisogno di intensi gradienti di diffusione, che non sono facilmente ottenibili.
Quando si parla di diffusione molecolare in tessuti biologici ci si riferisce sempre indirettamente alla diffusione protonica o dell’acqua: i compartimenti all’interno dei tessuti sono totalmente o parzialmente permeabili all’acqua. Valori medi di ADC delle molecole d’acqua in tessuti biologici
alla temperatura corporea sono dell’ordine di 1 mm2 sec: tale valore è circa un terzo di quello del coefficiente di diffusione in acqua libera, così da confermare gli effetti della diffusione ristretta, ostacolata ed anisotropa. Dall’eq. (2.5) si ricava quindi che le molecole d’acqua compiono un cammino medio di 5 µm in circa 4 ms: stimando le dimensioni cellulari pari a poche decine di µm allora il confine fra tempi di diffusione brevi e lunghi può essere posto intorno a 5 ms.
Una maggiore specificità dei vari compartimenti sarebbe possibile con studi di diffusione di macromolecole come metaboliti del fluoro o del fosforo; il limite di un tale approccio è rappresentato dalla bassa concentrazione di tali metaboliti e, quindi, dai deboli segnali misurabili.
2.2 Immagini pesate in diffusione (DWI) e
mappe ADC
L’ MRI rappresenta di per sé una tecnica d’indagine multi-parametrica, in quanto il contrasto delle immagini ottenute è governato da una serie di parametri intrinseci ( , , , densità protonica e processi diffusivi). Esiste quindi la possibilità di regolare maggiormente tale contrasto in funzione di uno o più di tali parametri. Le tecniche DWI fanno appunto riferimento ad immagini maggiormente pesate in diffusione: quest’ultimo parametro permette di fornire informazioni complementari a quelle derivanti da indagini MRI convenzionali (immagini pesate in o ) ed inoltre rappresenta un parametro fisico assoluto, essendo indipendente dal valore di e da eventuali disomogeneità di campo magnetico applicato.
1 T T2 * 2 T 1 T T2 0 B
Tutto questo giustifica i numerosi sforzi effettuati in campo clinico per mettere a punto efficienti tecniche MRI basate su studi di processi diffusivi.
2.2.1 Utilizzo di sequenze ultraveloci: problemi e possibili
soluzioni
Per la realizzazione di immagini DWI è necessario mettere a punto una sequenza di Stejskal - Tanner che vada ad aggiungersi alla convenzionale sequenza MRI. Operando in tal modo l’immagine risultante è sensibile non solo ai moti microscopici di diffusione molecolare nella zona di indagine, ma anche ad altri movimenti fisiologici come il ciclo cardiaco ed il flusso cerebro-spinale. Ne segue che non solo il paziente dovrebbe essere praticamente immobilizzato, ma l’intero complesso hardware utilizzato richiederebbe la massima stabilità in modo da evitare che l’immagine sia contraffatta da artefatti causati
da tali movimenti, che, distribuiti lungo la direzione del gradiente di fase, renderebbero problematica la normale visualizzazione di immagini DWI.
Questi tipi di problemi possono essere completamente evitati mediante l’utilizzo di sequenze ultraveloci (vedi cap. 1.1.3) e di un hardware un po’ più sofisticato. Quest’ultimo è costituito da gradient coils1 schermate e fornite di guide per le alte correnti di dispersione, oppure da gradient coils di piccolo diametro. Tali correnti, situate nelle strutture conducenti circostanti e causate da disomogeneità di campo magnetico, possono seriamente compromettere l’interpretabilità dell’immagine: infatti correnti parassite con piccole costanti di tempo vanno a contrastare l’efficacia di qualsiasi tipo di sequenza ultrarapida.
Ciò che ci spinge ad utilizzare queste sequenze è il grande vantaggio che risulta dall’acquisizione di oltre 10 immagini complete al secondo e dalla grande accuratezza con cui è possibile ricavare da esse le mappe ADC. Con una convenzionale sequenza EPI ogni immagine è acquisita in un periodo di 25-100 ms : conseguentemente si dovrà avere un valore di slew rate per i gradienti di diffusione molto alto (tipicamente 120-150 T/m/s) ed un periodo di switching relativo molto piccolo (valori inferiori a 0.4 ms).
L’utilizzo di sequenze ultraveloci implica anche che il tempo δ di applicazione dei gradienti di diffusione non sia superiore a 40-50 ms. Da ciò deduciamo che, per ottenere valori di bvalue elevati e consistenti attenuazioni di segnale anche nelle zone a bassa diffusività, sono necessari gradienti di diffusione di notevole intensità.
Il tomografo in dotazione è un Signa Horizon GE 1,5 T a magnete superconduttore : i gradienti disponibili hanno un’ampiezza massima di 25 mT/m ed uno slew rate massimo di 120 T/m/s.
2.2.2 Sequenza EPI utilizzata in studi di diffusione
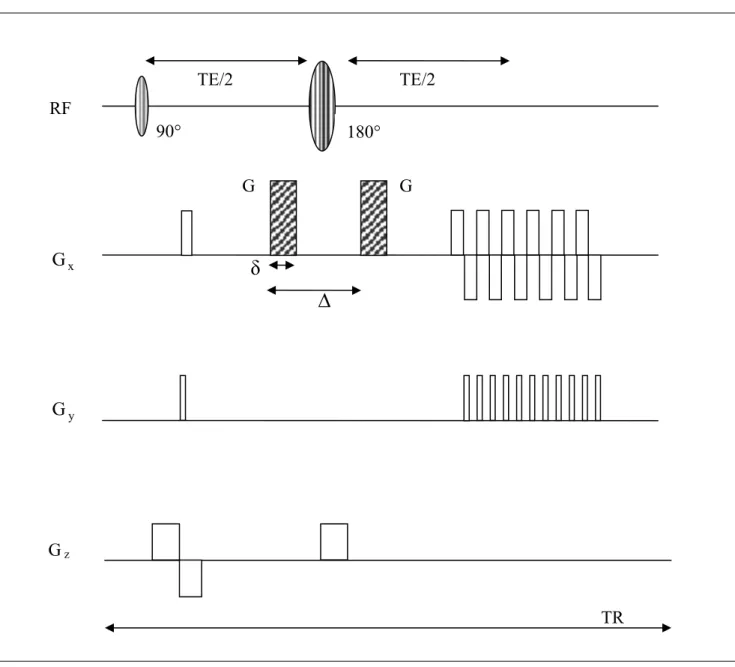
La sequenza utilizzata per studi di diffusione cerebrale è una classica sequenza EPI Spin-Echo a cui è stato aggiunto un gradiente bipolare di diffusione come quello che si ritrova in una tipica sequenza di Stejskal-Tanner.
Lo schema base di tale sequenza è il seguente:
Figura 2.7: Sequenza EPI pesata in diffusione.
RF x G TE/2 TE/2 90° 180° G G
δ
∆
y G G z TRLa pesatura in diffusione può essere effettuata lungo una direzione qualsiasi con bvalue compresi tra 0 e 3000 sec/mm2. Il valore di b è impostato secondo la relazione già vista
nel paragrafo precedente:
b=
(
γGδ) (
2 ∆−δ/3)
(2.28) Ad un valore di b fissato è possibile utilizzare gradienti di diffusione di intensità compresa tra 0 ed il valore massimo disponibile di 25 mT/m: ciò consente, a parità di b, di ottenere sequenze aventi tempi di applicazione dei gradienti (δ) e tempi di diffusione (∆) differenti.2.2.3 Esempi di immagini di diffusione (DWI)
Utilizzando la sequenza vista sopra si ottengono quindi immagini DWI relative al parenchima cerebrale.
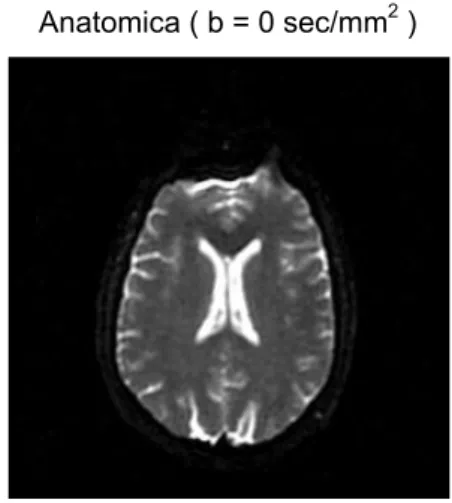
Anatomica ( b = 0 sec/mm2)
Figura 2.8: Immagine anatomica (b=0). (TR = 6000 ms , FOV =24x24 cm , matrice 128x128 , spessore
L’immagine precedente fa riferimento ad un’unica slice di acquisizione di uno stesso paziente. La parte centrale molto luminosa rappresenta il liquor, mentre il contorno è formato da sostanza grigia e sostanza bianca. Scelta una direzione di applicazione dei gradienti di diffusione, vediamo le immagini DWI relative a tale slice ottenute per alcuni valori di b-value.
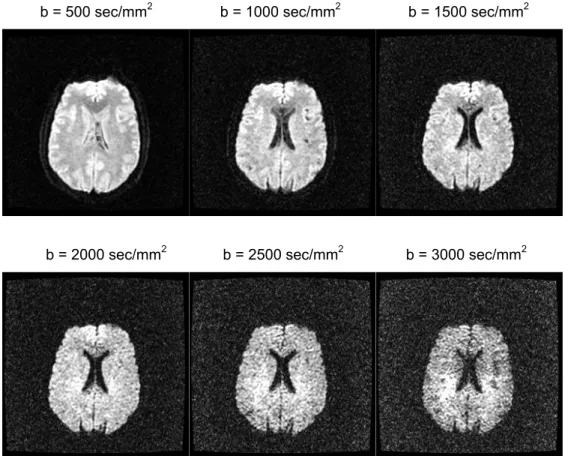
b = 500 sec/mm2 b = 1000 sec/mm2 b = 1500 sec/mm2
b = 2000 sec/mm2 b = 2500 sec/mm2 b = 3000 sec/mm2
Figura 2.9: Immagini pesate in diffusione lungo una direzione 1 a vari bvalue. (TR = 6000 ms , FOV =24x24 cm , matrice 128x128 , spessore slice 4 mm , spaziatura tra slice 1 mm , 24 slice , 1 acquisizione , Gd=20 mT/m).
In DWI le zone in cui si ha una prevalenza di moti diffusivi appaiono ipointense, mentre le zone a minor diffusione risultano iperintense (§ 2.1, eq. 2.17). Tutto questo trova conferma nella notevole ipointensità del liquor, dove siamo in presenza di diffusione libera. La sostanza grigia appare anch’essa ipointensa, seppur in modo molto meno
marcato: ciò è dovuto alla presenza di barriere cellulari che ostacolano i moti diffusivi in tale ambiente. Nella sostanza bianca abbiamo fasci di fibre che risultano ipointensi o iperintensi a seconda della direzione di applicazione dei gradienti di diffusione: se essa è parallela ai fasci questi ultimi appariranno ipointensi in DWI, il viceversa vale se tale direzione di applicazione è ortogonale ai fasci. Infatti il rivestimento mielinico dei fasci di sostanza bianca rende molto più ristretti i moti molecolari in direzione perpendicolare al fascio stesso, con l’aggiunta della presenza di numerosi ostacoli conseguenti alla struttura fortemente direzionale dei fasci.
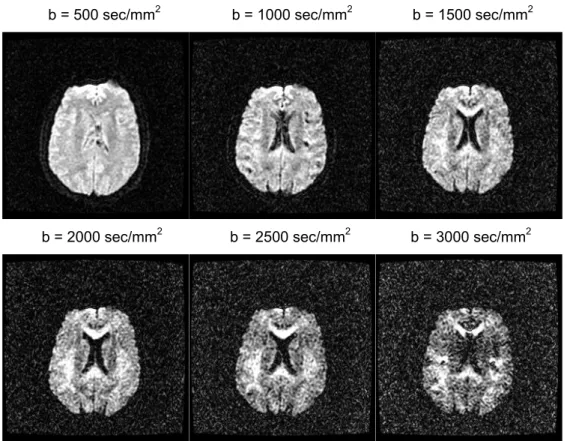
Queste ultime cose risultano evidenti se proviamo a cambiare la direzione di applicazione dei gradienti di diffusione, notando che per direzioni che si avvicinano a quelle dei fasci questi ultimi risulteranno meno intensi.
b = 500 sec/mm2 b = 1000 sec/mm2 b = 1500 sec/mm2
b = 2000 sec/mm2
b = 2500 sec/mm2 b = 3000 sec/mm2
Figura 2.10: Immagini pesate in diffusione lungo una direzione 2 a vari bvalue. (TR = 6000 ms , FOV
=24x24 cm , matrice 128x128 , spessore slice 4 mm , spaziatura tra slice 1 mm , 24 slice , 1 acquisizione , Gd=20 mT/m).
b = 500 sec/mm2 b = 1000 sec/mm2 b = 1500 sec/mm2
b = 2000 sec/mm2 b = 2500 sec/mm2 b = 3000 sec/mm2
Figura 2.11: Immagini pesate in diffusione lungo una direzione 3 a vari bvalue. (TR =6000 ms , FOV =24x24 cm , matrice 128x128 , spessore slice 4 mm , spaziatura tra slice 1 mm , 24 slice , 1 acquisizione , Gd=20 mT/m).
Come già detto sopra, tramite immagini DWI è possibile studiare l’andamento dei fasci di fibre di sostanza bianca: il metodo prevede di confrontare immagini di una stessa slice acquisite con lo stesso b-value lungo direzioni diverse. Il problema rimane nella scelta del valore di b-value ideale per il confronto: immagini ad alti valori di b (da 2000 sec/mm2 in poi) consentono un’ottima pesatura in diffusione di tutte le strutture del parenchima cerebrale e quindi anche del percorso dei grandi fasci di fibre di sostanza bianca. Come svantaggio, però, immagini ad alti valori di b risultano molto più rumorose. In genere, quindi, si utilizzano valori di b intermedi (1000-1500 sec/mm2).
direzione 1 direzione 2 direzione 3
Figura 2.12: Immagini pesate in diffusione a bvalue=1000 sec/mm2 lungo 3 direzioni di acquisizione
differenti. (TR=6000 ms , FOV =24x24 cm , matrice 128x128 , spessore slice 4 mm , spaziatura tra slice 1 mm , 24 slice, 1 acquisizione , Gd=20 mT/m).
direzione 1 direzione 2 direzione 3
Figura 2.13: Immagini pesate in diffusione a bvalue=1500 sec/mm2 lungo 3 direzioni di acquisizione
differenti. (TR=6000 ms , FOV =24x24 cm , matrice 128x128 , spessore slice 4 mm , spaziatura tra slice 1 mm , 24 slice, 1 acquisizione , Gd=20 mT/m).
E’ importante sottolineare come mediante immagini pesate in diffusione sia possibile evidenziare alcune patologie in fase acuta (periodo di insorgenza di 6-48 ore) o iperacuta (periodo di insorgenza di 0-6 ore), ciò che era improponibile utilizzando tecniche tradizionali come la TAC o la MRI pesata in T1 o T2.
Una diagnosi precoce di un’ischemia cerebrale, ad esempio, è fondamentale per l’applicazione di una corretta terapia e per aumentare le possibilità di recupero del paziente. L’elevata sensibilità in DWI in tale campo è dovuta all’alterazione dei processi diffusivi molecolari durante l’evoluzione temporale del fenomeno ischemico. In seguito al
mancato afflusso di sangue nella regione anatomica colpita, il ridotto apporto energetico e di ossigeno va ad interrompere il normale funzionamento della pompa sodio-potassio: da ciò segue la comparsa dell’edema citotossico e le cellule si rigonfiano di acqua a scapito del liquido interstiziale. L’effetto prodotto è una riduzione dei coefficienti ADC nella zona ischemica: la diffusione intracellulare, infatti, è più ristretta ed ostacolata dal rigonfiamento della cellula. Tutto questo spiega anche le iperintensità in DWI della regione colpita da ischemia in fase iperacuta. A partire dalla fase acuta si ha lo sviluppo dell’edema vasogenico, con conseguente aumento del liquido extracellulare e la possibilità di rivelare la patologia anche in MRI. Nella fase subacuta (periodo di insorgenza di 3-10 giorni) e cronica (periodo di insorgenza superiore a 10 giorni) si ha un ulteriore sviluppo dell’edema vasogenico e la conseguente necrosi cellulare, con relativo disgregamento delle membrane cellulari. I valori di ADC tendono, perciò, a risalire a livelli normali, per poi stabilizzarsi definitivamente (nella fase cronica) a valori vicini a quelli dell’acqua libera: in quest’ultima fase la lesione appare ipointensa in DWI ed iperintensa in MRI. Vista la differente mobilità molecolare in fase acuta e cronica, le immagini ottenute in DWI permettono di discriminare lesioni ischemiche recenti da altre più datate.
Allo stesso modo immagini pesate in diffusione consentono di avere informazioni migliori di quelle ottenute in MRI riguardo a traumi cranici in fase acuta o subacuta (si riescono a rivelare meglio lesioni di minore entità), tumori (si riescono a distinguere, in caso di lesioni neoplastiche, le componenti cistiche e/o necrotiche da quelle solide), sclerosi multipla (si riescono ad evidenziare aspetti particolari della malattia), processi di mielinizzazione (è possibile una diagnosi differenziale tra malattia di Pelizaeus-Merzbacher, malattia di Krabbe e malattia di Alexander).
Anatomiche
b = 1000 sec/mm2
Figura 2.14: Immagini anatomiche (pesate in T2) e corrispondenti immagini DWI a bvalue = 1000 sec/mm2
di un paziente affetto da lesione ischemica acuta. (TR =6000 ms , FOV =24x24 cm , matrice 128x128 , spessore slice 4 mm , spaziatura tra slice 1 mm , 24 slice , 1 acquisizione , Gd=20 mT/m).
Come spiegato sopra la lesione ischemica (presente nella parte destra dell’immagine) appare iperintensa e chiaramente visibile in DWI, mentre nelle immagini anatomiche è molto meno demarcata.
2.2.4 Mappe ADC
Le immagini DWI rappresentano un utile mezzo per l’analisi e lo studio dei processi di diffusione cerebrale. In particolare, immagini DWI come quelle viste in precedenza consentono di ottenere informazioni di tipo qualitativo in applicazioni morfo-funzionali (localizzazione di distorsioni, malformazioni, degenerazioni, ...) o cliniche (lesioni vascolari, tumori, patologie infettive o infiammatorie, ...).
I limiti di tali indagini è quello di non permettere analisi di tipo quantitativo. In DWI, inoltre, risulta ineliminabile una pur minima pesatura in T2 intrinseca nella metodica.
Su questa base è stata messa a punto una procedura per la realizzazione di mappe ADC del parenchima cerebrale, nelle quali ad ogni pixel dell’immagine è associato il coefficiente ADC del corrispondente voxel della slice di acquisizione. Le informazioni ottenute mediante queste mappe consentono di classificare le varie strutture cerebrali ed eventuali lesioni in funzione del relativo valore di ADC: mediante l’evoluzione temporale di quest’ultimo si può inoltre seguire l’evoluzione temporale di possibili patologie.
La realizzazione di mappe ADC prevede l’acquisizione di una serie di immagini di diffusione ed una loro successiva elaborazione software.
Sappiamo che in DWI vale la seguente relazione:
S
( ) ( ) (
b =S0 exp −b⋅ADC)
(2.29) dove b è il valore di bvalue di pesatura e S(0) il segnale per b = 0. Acquisendo immagini DWI lungo una stessa direzione con due diversi valori di bvalue ( , ) si ottiene (risolvendo un semplice sistema):1 b b2
( )
( )
⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ − = 2 1 1 2 Sb b S ln b b 1 ADC (2.30)Mediante tale relazione è quindi possibile ottenere il valore di ADC per ogni voxel grazie all’acquisizione di due sole immagini DWI caratterizzate da due diversi valori di bvalue.
In genere le immagini DWI vengono acquisite mediante la sequenza vista nel paragrafo (2.2.2) e si sceglie = 0 sec/mmb1 2, mentre rappresenta il valore di bvalue a cui vengono realizzate le mappe ADC. Le immagini DWI sono successivamente elaborate e visualizzate mediante il pacchetto software DPtools.
2
b
Chiaramente, a differenza delle immagini DWI delle stesse slices dello stesso oggetto, in una mappa ADC le zone a maggior diffusione risultano iperintense, mentre le zone a bassa diffusione appaiono ipointense. Le mappe ottenute per grandi valori di bvalue (da 2000 sec/mm2 in poi) sono molto più rumorose di quelle a bvalue inferiori: ciò è in relazione al basso rapporto segnale-rumore delle immagini pesate in diffusione a bvalue
maggiori di 2000 sec/mm2. In questi casi, per migliorare il valore di tale rapporto, si ricorre ad un numero maggiore di acquisizioni. Per valori di bvalue pari a 500 sec/mm2 il valore del rapporto segnale-rumore è abbastanza alto, ma le strutture anatomiche risultano morfologicamente non ben definite: quest’ultimo aspetto ha origine dalla non considerevole pesatura in diffusione a bvalue uguale a 500 sec/mm2 .
Vediamo adesso alcuni esempi di mappe ADC.
Nel primo caso le immagini DWI vengono acquisite lungo 6 direzioni spaziali, nel secondo lungo 25 direzioni e su un paziente diverso. Nel prossimo capitolo vedremo il significato di questi parametri: per adesso è sufficiente sapere che per avere un’informazione spaziale consistente riguardo alla diffusione per ogni singolo voxel è necessario acquisire dati relativi ad almeno 6 direzioni . Tutte le mappe che seguono sono calcolate per bvalue uguale a 1000 sec/mm2.
Anatomica ADC (X)
ADC (Y) ADC (Z)
Figura 2.15: Mappe ADC lungo le direzioni dei tre assi del sistema di riferimento del laboratorio. Le
immagini si riferiscono ad un’unica slice di uno stesso paziente. (TR = 6000 ms , FOV =24x24 cm , matrice 128x128 , spessore slice 4 mm , spaziatura tra slice 1 mm , 24 slice , 1 acquisizione , 6 direzioni di acquisizione , Gd=20 mT/m).
Nella figura 2.15 le mappe ADC si riferiscono alle 3 direzioni lungo gli assi del sistema di riferimento fisso del laboratorio. Nella figura seguente vedremo il tutto applicato nel caso di acquisizione lungo 25 direzioni.
ADC (X) Anatomica
ADC (Y) ADC (Z)
Figura 2.16: Mappe ADC lungo le direzioni dei tre assi del sistema di riferimento del laboratorio. Le
immagini si riferiscono ad un’unica slice di uno stesso paziente. (TR = 6000 ms , FOV =24x24 cm , matrice 128x128 , spessore slice 4 mm , spaziatura tra slice 1 mm , 9 slice , 1 acquisizione , 25 direzioni di acquisizione , Gd=20 mT/m).
Vediamo adesso un confronto diretto tra mappe ADC ed immagini pesate in diffusione in entrambi i casi (6 e 25 direzioni di acquisizioni).
DWI (b =1000 sec/mm2) ADC (X) ADC (Y) ADC (Z)
DWI (b = 1000 sec/mm2) ADC (X) ADC (Y) ADC (Z)
Figura 2.18: Immagine pesata in diffusione e mappe ADC. Le immagini si riferiscono ad un’unica slice di uno
stesso paziente. (TR = 6000 ms , FOV =24x24 cm , matrice 128x128 , spessore slice 4 mm , spaziatura tra slice 1 mm , 9 slice , 1 acquisizione , 25 direzioni di acquisizione , Gd=20 mT/m).
Figura 2.17: Immagine pesata in diffusione e mappe ADC. Le immagini si riferiscono ad un’unica slice di uno
stesso paziente. (TR = 6000 ms , FOV =24x24 cm , matrice 128x128 , spessore slice 4 mm , spaziatura tra slice 1 mm , 24 slice , 1 acquisizione , 6 direzioni di acquisizione , Gd=20 mT/m).
Qualitativamente le mappe ADC risultano il “negativo” delle immagini DWI ; a differenza di queste ultime, però, non risultano influenzate dalla pesatura in T2 e forniscono,
mediante un parametro fisico, un’informazione quantitativa sui processi di diffusione molecolare.
Sfruttando questa informazione quantitativa contenuta nelle mappe ADC si è cercato di dare una classificazione delle principali strutture del parenchima cerebrale in funzione del corrispettivo coefficiente di diffusione apparente. In soggetti non patologici i valori massimi di ADC si ritrovano nel liquor e nel CSF (intorno a 3 x 10-3 mm2/sec), mentre i
valori minimi sono quelli corrispondenti alle strutture ossee. La materia grigia presenta valori di ADC intorno a 0,9 x 10-3 mm2/sec, mentre per la materia bianca occorre distinguere tra le situazioni in cui il gradiente di diffusione è applicato in direzione parallela o ortogonale alle fibre. Nel primo caso la mobilità molecolare è almeno il doppio che nell’altro, a causa dell’effetto della diffusione ristretta ed ostacolata in direzione perpendicolare ai fasci di fibre. Come valori medi di ADC in soggetti non patologici troviamo 1,2 x 10-3 mm2/sec nel primo caso e 0,5 x 10-3 mm2/sec nel secondo.