1. INTRODUZIONE
Il carcinoma della tiroide è il tumore endocrino più frequente. Tuttavia è una neoplasia rara, rappresenta approssimativamente lo 0.6% di tutti i tumori maligni del sesso maschile e l’1.6% nel sesso femminile1. La percentuale dei decessi per neoplasia tiroidea è pari allo 0.16% nei maschi e allo 0.24% nelle femmine2. E’ raro negli adolescenti e nei bambini e poco frequente nell’anziano, l’età media in cui si manifesta è compresa tra i 45 ed i 50 anni1.
Il carcinoma della tiroide comprende un gruppo di tumori con caratteristiche molto differenti. I principali tipi istologici sono rappresentati dal carcinoma tiroideo papillare (o CTP) che è il più frequente (80%), il carcinoma tiroideo follicolare (o CTF) ed il carcinoma a cellule di Hürtle, tumori che originano dalle cellule follicolari e rappresentano il gruppo dei carcinomi tiroidei differenziati (o CTD)3. La gestione dei CTD è molto simile anche se esistono delle importanti differenze nella diagnosi, nella terapia e nella prognosi di tutti e tre i tipi di tumore.
Le altre due maggiori forme di cancro tiroideo sono rappresentate dal carcinoma tiroideo midollare (o CTM) che origina dalle cellule tiroidee C che secernono calcitonina ed il carcinoma tiroideo anaplastico o indifferenziato (o CTA)4.
Infine vi è una piccola percentuale di casi (1-2%) in cui la tiroide può essere interessata da colonizzazioni metastatiche di neoplasie primitive di derivazione non epiteliale, come ad esempio i linfomi o i sarcomi e da metastasi che provengono da altre neoplasie (melanomi, carcinomi polmonare, mammario o dell’esofago).
Il CTD è il risultato di un insieme di fattori genetici (mutazioni dell’oncogene ras, attivazione dei proto-oncogeni ret e trk, espressione dell’oncogene met,
perdita di funzione del p53) ed ambientali (per esempio la forma follicolare è più frequente nelle aree geografiche iodocarenti) che interferiscono sulla proliferazione cellulare. Alcuni di questi fattori sono detti “iniziatori” ed hanno la capacità di indurre la comparsa del tumore, l’unico iniziatore riconosciuto sono le radiazioni esterne ionizzanti1. Precedenti terapie radianti o esposizioni ad alte dosi di radiazioni (per esempio l’incidente nucleare di Chernobyl) o esposizioni di tipo professionale, aumentano il rischio di sviluppare noduli tiroidei che potrebbero trasformarsi in maligni e le forme istologiche indotte da radiazioni sono quelle ben differenziate.
Un fattore ereditario genetico non è stato ancora determinato per quanto riguarda i CTD anche se il 3% circa di casi di carcinomi papillari sono familiari. Questa forma familiare si può presentare isolata o associata ad altre sindromi (per esempio la poliposi adenomatosa familiare, la sindrome di Cowden, la sindrome di Gardner, la sindrome di Carney). Infine è stato riscontrato anche un aumento della prevalenza nei pazienti affetti da MEN1 e si presenta clinicamente più aggressivo rispetto alle forme sporadiche.
1.1 Prognosi e trattamento del carcinoma tiroideo differenziato
La prognosi dei pazienti affetti da carcinoma tiroideo differenziato è sostanzialmente favorevole. Infatti, la percentuale di recidiva loco-regionale di malattia è molto bassa (circa il 10-20% dei casi), mentre quella delle metastasi a distanza (in genere a livello polmonare ed osseo) è del 10-15%2.
I fattori più importanti che condizionano la prognosi dei pazienti affetti da CTD sono rappresentati da fattori legati al tumore come3:
• istologia: i pazienti affetti da CTD hanno una prognosi migliore rispetto ai pazienti affetti da CTM o CTA5;
• grandezza del tumore: il rischio di sviluppare metastasi a distanza e la mortalità legata al tumore aumentano con l’aumentare della grandezza del tumore.
Tumori di grandezza <1.5 cm hanno una percentuale di mortalità, a 30 anni, dello 0.4% mentre tumori di grandezza >4.5 cm hanno una percentuale di mortalità del 22%6;
• presenza di metastasi linfonodali: in alcuni studi è stato dimostrato7 che la loro
presenza comporta un aumento del rischio di recidive ed una riduzione della sopravvivenza. Il fattore determinante è l’età, infatti nei pazienti di età ≥45 anni la presenza di metastasi linfonodali è associata ad un aumento del 46% del rischio di morte;
• estensione extratiroidea: l’estensione del cancro extratiroidea nei tessuti circostanti è stata riscontrata nel 30% circa dei pazienti con PTC6,7
e l’estensione nella muscolatura, nell’esofago o nella trachea è associata ad un alto rischio di recidive di malattia loco-regionali. Un’estensione microscopica oltre la capsula tiroidea è associata ad un più alto rischio di recidiva, ad una più alta probabilità di sviluppare metastasi linfonodali e ad un aumento della mortalità6
rispetto ai pazienti che non presentano invasione extracapsulare. Infine l’invasione del tumore oltre la capsula linfonodale è associata ad un aumento del rischio di persistenza e di recidiva di malattia;
• metastasi a distanza: il 10-15% dei pazienti circa con DTC sviluppa metastasi a distanza con una mortalità del 50% dopo 20 anni. La principale causa di morte nel CTP per esempio sono proprio le metastasi a distanza che fortunatamente si manifestano solo nel 5-10% dei casi alla presentazione iniziale mentre un 2.5-5% di pazienti sviluppa metastasi a distanza dopo ablazione con radioiodio8,9
. In più del 50% dei casi le metastasi a distanza più frequenti sono polmonari, nel 25% dei casi sono scheletriche, nel 20% dei casi sono presenti entrambe e nel rimanente 5% vi possono essere metastasi in altre sedi differenti da osso e polmone come nel mediastino, nel cervello e nel fegato, ma sono rare. La mortalità è alta in presenza di metastasi a distanza con il 50% di sopravvivenza a 3.5 anni secondo recenti studi. La sopravvivenza è migliore nei giovani, nei pazienti con malattia microscopica e nei pazienti con tumori iodocaptanti9
;
• oncogeni: nei recenti anni, dopo numerosi studi in biologia molecolare, sono state riscontrate mutazioni coinvolgenti diversi geni nella patogenesi del
carcinoma tiroideo. Tra questi oncogeni il più studiato è il B raf proto-oncogene (BRAF), ha un’incidenza variabile a seconda della regione di campionamento ma l’insieme dei risultati suggeriscono che il 39% circa dei tumori della tiroide presenta questa mutazione3. Comunque il significato clinico di queste
mutazioni è controverso. In una recente analisi, nei pazienti con CTP, è stata riscontrata una correlazione significativa tra queste mutazioni, persistenza di malattia e morte10. E’ stato visto infatti che la presenza della mutazione BRAF è
associata ad invasione extratiroidea, multifocalità, presenza di metastasi linfonodali e ad una più alta incidenza di recidive e/o persistenza di malattia. Al contrario, altri studi non avevano mostrato una significativa relazione tra la presenza di mutazione BRAF ed il risultati clinici. Sono necessari pertanto studi futuri per fare chiarezza su queste problematiche10,11.
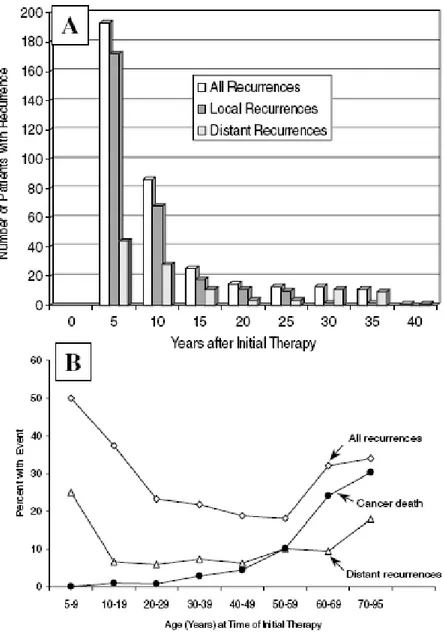
Per esemplificare quanto detto sulle recidive del carcinoma tiroideo, nella seguente figura è rappresentato uno studio effettuato su 1528 pazienti dopo una mediana di 16.6 anni di follow-up (Mazzaferri&Kloos)12.
In questo studio è stato riscontrato che 2/3 dei casi di recidive tumorali erano diagnosticate nell’intervallo di 10 anni di trattamento (Fig.1A) ed i restanti casi si manifestavano nelle decadi successive. Le recidive, includendo anche le metastasi a distanza, erano più comuni nei pazienti di età <20 anni e in quelli di età >60 anni (per età dei pazienti si intende quella al momento del trattamento iniziale) (Fig.1B). Furono riscontrate 358 recidive (23.8% dei pazienti). Le recidive locali (n=272; 17.8%) erano cervicali o mediastiniche; le recidive a distanza (n=114; 7.5%) erano in sedi anatomiche differenti dal collo.
Figura 1 Nel grafico A della figura 1 è rappresentato il
numero di pazienti con recidive ad intervalli di 5 anni; nel grafico B è rappresentata invece la percentuale cumulativa di recidive locali, a distanza e le morti per cancro su 40 anni stratificati per età al tempo del trattamento iniziale.
I fattori più importanti legati invece alle variabili dei pazienti sono rappresentati da:
• età: pazienti con età >40 anni hanno una più alta incidenza di recidive; nei bambini e negli adolescenti di età <20 anni nel 64% dei casi presentano metastasi ai linfonodi latero-cervicali e nel 23% dei casi sono presenti metastasi a distanza6
sopravvivenza in quanto rispondono bene alla terapia con radioiodio fatta eccezione per i bambini di età ≤10 anni nei quali la malattia è più aggressiva, questi pazienti presentano metastasi linfonodali nell’83% dei casi e polmonari nel 67% dei casi e hanno un’alta mortalità13;
• sesso: nelle donne c’è una maggiore incidenza del tumore tiroideo rispetto agli uomini che però presentano un più alto tasso di mortalità, una più alta incidenza di recidive, di invasione extratiroidea, di metastasi ai linfonodi loco-regionali e a distanza rispetto alle donne3.
Infine nella prognosi dei pazienti con CTD bisogna prendere in considerazione le variabili del trattamento che sono rappresentate da:
• ritardo nel trattamento: è stato osservato che il tasso di mortalità a 30 anni era raddoppiato quando la terapia era ritardata di un anno, allo stesso modo, una interpretazione ed una valutazione diagnostica corretta è cruciale per assicurare la corretta tempistica nel trattamento. Tra le metodiche diagnostiche più usate per il carcinoma della tiroide, l’ecotomografia cervicale rimane sempre e comunque la metodica di prima scelta, in quanto ci permette di valutare l’estensione della lesione, le sue caratteristiche strutturali nonché i rapporti con le strutture cervicali (vasi, piani muscolari, catene linfatiche, vie aeree) e ci permette di individuare eventuali metastasi laterocervicali14. L’FNA o fine needle
aspiration è l’esame citologico mediante agoaspirazione eco-guidata del nodulo con ago sottile, rappresenta una metodica molto sensibile e specifica e costituisce il “gold standard” diagnostico che ci permette di differenziare un nodulo benigno da uno maligno. Importante è inoltre la sua interpretazione, in uno studio è stato visto che un ago-aspirato falso-negativo porta ad un ritardo nella chirurgia di 28 mesi ed i pazienti con una citologia falso-negativa avevano una più alta incidenza di invasione vascolare e capsulare e di recidive15 nel
follow-up;
• estensione della chirurgia: per molti anni la lobectomia è stata considerata sufficiente nel trattamento del carcinoma tiroideo invece secondo recenti studi, è stato visto che una tiroidectomia totale associata o no ad una linfoadenectomia loco-regionale, comporta numerosi vantaggi per il paziente: innanzitutto un minor tasso di recidive locali, elimina l’eventuale multifocalità
del tumore, aumenta l’efficacia del trattamento con 131I, aumenta la sensibilità
nella scintigrafia total-body con 131I (WBS) diagnostica e nel dosaggio della
tireoglobulina per la ricerca di recidive e/o eventuali residui di malattia6;
• ablazione dei tessuti tiroidei con radioiodio: rappresenta la seconda modalità di terapia coadiuvante usata dopo la tiroidectomia in presenza di un residuo tiroideo non molto grande. La sua funzione primaria è quella di determinare la distruzione di focolai microscopici di carcinoma eventualmente presenti nel residuo tiroideo, da parte dello 131I che è attivamente captato dalle cellule
normali16
. In genere l’attività da somministrare per la terapia ablativa varia dai 100-150 mCi (3700-5550 MBq), a seconda dei casi. Nei pazienti “a basso rischio” può non essere impiegata mentre il suo uso è raccomandato nei pazienti “ad alto rischio” (per esempio quelli di età >45 anni o con uno stadio di malattia T3 o T4), in quelli dove è presente una estensione extratiroidea o
metastasi a distanza, in presenza di istotipi più aggressivi (per esempio le varianti “tall cells”, “columnar cells” del carcinoma papillare, la presenza di sclerosi diffusa, il carcinoma follicolare scarsamente differenziato o il carcinoma a cellule di Hürtle). Nei pazienti con CTP l’ablazione dei residui tiroidei riduce la mortalità. Secondo alcuni studi il suo utilizzo ha effetti benefici sulle recidive, sulle metastasi a distanza e sulla mortalità mentre altri studi non hanno dimostrato tali effetti6;
• terapia ormonosoppressiva: ha l’obiettivo di determinare la soppressione della produzione del TSH e viene praticata con la somministrazione di dosi soprafisiologiche per via orale di levotiroxina (L-T4) in ragione di 2-2.5 mcg/Kg di peso corporeo/die. L’ormonosoppressione ha come scopo principale quello di trattare l’ipotiroidismo post-chirurgico e quello di sopprimere la produzione del TSH che depriverebbe le cellule, potenzialmente tumorali, dipendenti da questo ormone, di un fattore di crescita importante. Gli effetti che determina sono una riduzione della mortalità specifica nei pazienti con CTP e una riduzione delle recidive in quelli con CTF17
. Davanti ad un paziente rientrante nella categoria “ad alto rischio” o che presenti una recidiva che non si possa rimuovere chirurgicamente o con radioiodio, bisogna mantenere i valori di TSH al di sotto dello 0.1 mU/L. Nei pazienti con carcinoma papillare “a basso rischio” il valore basale di TSH può essere mantenuto anche tra 0.1 e 0.4 mU/L.
Infine un’accurata stadiazione del tumore è importante per impostare decisioni terapeutiche più adeguate ai diversi casi clinici. La stadiazione TNM tuttora adottata, tiene conto di tre fattori principali: l’estensione del tumore primitivo (Tumor o T), l’assenza o la presenza di metastasi ai linfonodi regionali (Node o N) o a distanza (Metastasis o M). Questa stadiazione ci aiuta non solo a dare utili informazioni sulla prognosi di ogni singolo paziente ma anche a capire qual’è il trattamento più adeguato per ogni paziente3. Infatti pazienti considerati “a basso rischio” riceveranno un trattamento meno aggressivo rispetto a quei pazienti considerati “ad alto rischio”. A tale proposito sono considerati “a basso rischio” pazienti con età <45 anni, i casi in cui il tumore macroscopico sia stato tutto resecato e appartiene a varianti istologiche meno aggressive, i casi in cui non sia presente invasione vascolare, metastasi loco-regionali e/o a distanza ed infine quando non c’è iodocaptazione al di fuori del letto tiroideo nella scintigrafia total-body post-dose terapeutica con 131I. Mentre i pazienti cosiddetti “ad alto rischio” sono quelli che presentano invasione macroscopica del tumore, i casi dove non c’è stata una dissezione chirurgica completa, quelli in cui sono presenti metastasi a distanza o quando vi sono elevati livelli di tireoglobulina18. Tra queste due categorie di pazienti vi sono poi quelli a “rischio intermedio” che sono i casi in cui sia presente invasione microscopica del tumore nel tessuto peritiroideo al trattamento chirurgico iniziale, i casi in cui vi siano metastasi ai linfonodi cervicali o captazione al di fuori del letto tiroideo nella scintigrafia post-dose terapeutica con 131I o tumore con istologia aggressiva o presenza di invasione vascolare3.
Le sottostanti tabelle rappresentano rispettivamente la classificazione TNM (tabella 1) della American Joint Commission on Cancer e International Union Against Cancer raccomandata dalla European Thyroid Association (ETA) e dalla American Thyroid Association (ATA)3,19 e la stratificazione di rischio (tabella 2) di tutte le variabili cliniche che influenzano le recidive tumorali e le morti per cancro della tiroide18.
Tabella 1
Stage < 45 years old ≥ 45 years old Medullary
I M0 T1 T1
II M1 T2-3 T2-4
III T4 or N1 N1
IV M1 M1
T1: tumore <2cm; T2: tumore tra i 2 e i 4 cm; T3: tumore >4 cm; T4: tumore
esteso oltre la capsula tiroidea.
Tabella 2
1.2 Follow-up del carcinoma tiroideo differenziato
Per il follow-up dei pazienti con CTD trattati con tiroidectomia totale e con ablazione dei residui con 131I, sono utilizzati tre importanti strumenti diagnostici che comprendono: il dosaggio sierico della tireoglobulina (Tg), basale e dopo
stimolo con rhTSH (TSH ricombinante); la scintigrafia diagnostica con 131I (WBS) e l’ecografia del collo20.
Per quanto riguarda la Tg è una glicoproteina prodotta dalle cellule follicolari tiroidee, agisce come pro-ormone nella sintesi della Tiroxina (T4) e della Triiodiotironina (T3) all’interno della tiroide. I livelli circolanti di Tg possono essere elevati in tutte le malattie tiroidee pertanto il suo dosaggio non è utile nella diagnosi differenziale della patologia nodulare tiroidea. Dopo tiroidectomia totale e ablazione dei residui tiroidei, non rimanendo teoricamente tessuto capace di produrla, se non si ha azzeramento del suo valore, si deve ricercare la presenza di recidiva di malattia in quanto anche il CTD produce Tg21, essa rappresenta pertanto il marker più sensibile e specifico per questo tumore, infatti elevati livelli sierici di Tg sono stati riscontrati nei pazienti con presenza di recidiva di malattia o di metastasi20.
Come già detto nei pazienti con CTD dopo tiroidectomia totale viene somministrata terapia tireosostitutiva con L-tiroxina che deve essere ottimizzata per ottenere il livello di TSH circolante inferiore alla norma21. Infatti a bassi livelli di Tg circolante le cellule che possono produrre Tg (cellule follicolari tiroidee o cellule dei tumori papillari e follicolari tiroidei) sono tenute in “riposo” metabolico in modo che non producono la Tg; ogni volta che si valuta il valore della Tg si deve tenere in considerazione il valore dell’ormone tireotropo (TSH)22. E’ stato visto che valori di Tg in sospensione di terapia con L-tiroxina possono aumentare di 5-10 volte rispetto a quelli dosati in terapia20. Misurando il valore della Tg in corso di terapia (Tg-on) valori azzerati non ci danno certezza di assenza di malattia in quanto nel 10% circa dei casi con recidiva i valori di Tg possono essere non dosabili, bisogna quindi aumentare la sensibilità dell’indagine e ciò si può ottenere controllando la Tg a TSH elevato (>35 mU/L). Questa condizione si ottiene o con adeguata sospensione della terapia (Tg-off) o somministrando TSH ottenuto con tecnologia ricombinante (rhTSH).
Ancora oggi però non esiste una standardizzazione dei metodi per dosare la Tg, attualmente nella maggior parte dei laboratori, la Tg è misurata con metodi immunometrici automatizzati (IMA) per praticità e velocità nel dosaggio. In principio la Tg era misurata con metodi radioimmunologici (RIA) sostituiti da più pratici saggi non competitivi immunoradiometrici (IRMA) e vi sono diverse problematiche analitiche legate al dosaggio della Tg tra cui l’interferenza degli Autoanticorpi (AbTg)23,24 che possono quindi dare risultati falsamente negativi o sottostimati. Infatti la specificità e la sensibilità della Tg sierica è del 55-78% in presenza di autoanticorpi e del 76-78% in loro assenza21. Gli AbTg sono presenti nel siero del 25% dei pazienti affetti da CTD e del 10% della popolazione generale12, il titolo anticorpale è correlato con la presenza del tumore, diminuisce nel tempo e nel corso di mesi o anni la sua interferenza viene meno. Nessuno dei metodi per il dosaggio della Tg è esente dal rischio di tale interferenza pertanto le linee guida sottolineano l’importanza di misurare la concentrazione degli AbTg con metodi immunometrici e di considerare inattendibili i risultati ottenuti nei sieri in cui gli AbTg siano positivi. E’ utile dosare insieme agli AbTg anche la Tg e considerare sospetti per malattia quei pazienti con elevati livelli di AbTg pur avendo Tg indosabile. La sensibilità della Tg nel follow-up è pari al 93.9% e la specificità intorno al 45%25.
Qualsiasi valore dosabile di Tg è considerato sospetto per recidiva di malattia ed il valore cut-off è pari a 2 ng/mL21; molti autori affermano che livelli sierici di Tg che non aumentino dopo stimolo con rhTSH sono stati riscontrati in quei pazienti liberi da malattia18 (Pacini et al., Haugen et al., Mazzaferri&Kloos). Aumenti sierici della Tg >2 ng/mL sono invece suggestivi di recidive o persistenza di malattia25.
Secondo recenti linee guida una Tg >1 ng/mL sotto terapia con L-tiroxina o >2 ng/mL dopo stimolo con rhTSH ci permette di individuare la presenza di residuo tiroideo o metastatico26.
Dopo 6-12 mesi dal trattamento iniziale, il dosaggio sierico della Tg dopo stimolo con rhTSH serve come guida per selezionare i pazienti che devono
essere solo monitorati da quelli che invece devono subire un nuovo trattamento terapeutico.
Il follow-up iniziale dei pazienti “a basso rischio” con CTD sottoposti a trattamento chirurgico e con radioiodio, prevede quindi la valutazione della Tg durante terapia con L-tiroxina (Tg-on) seguita dall’esecuzione di un’ecografia del collo e se questi test sono negativi si esegue un dosaggio della Tg dopo sospensione da terapia (Tg-off) o dopo stimolo con rhTSH.27 Il 20% circa dei pazienti con Tg indosabile durante terapia con L-tiroxina e assenza di evidenza clinica di malattia, presentano una Tg >2 ng/mL dopo stimolo, in un terzo dei casi si può rilevare persistenza di malattia con altre metodiche di imaging, questo a conferma che il cut-off di 2 ng/mL dopo stimolo con rhTSH è sensibile nell’identificare pazienti con residuo di malattia18. La Tg sierica deve essere misurata durante il follow-up dei pazienti con DTC sottoposti a tiroidectomia totale e ablazione con radioiodio ogni 6-12 mesi mentre nel caso dei pazienti che sono stati trattati solo chirurgicamente si procede alla misurazione periodica della Tg, anche in questi casi il cut-off è di 2 ng/mL. Nei pazienti invece sottoposti sia a chirurgia che a terapia radiometabolica, con una Tg negativa in terapia soppressiva ed ecografia del collo negativa, si deve eseguire anche un nuovo dosaggio della Tg dopo stimolo con rhTSH a distanza di 6-12 mesi dal trattamento iniziale, se questa misurazione è negativa non serve eseguire nuovo dosaggio della Tg entro 3-5 anni a condizione che la Tg basale e l’ecografia del collo siano negative.
Come già detto, il trattamento standard del CTD prevede l’asportazione chirurgica seguita da ablazione del residuo tiroideo post-chirurgico con radioiodio ed eventuale successiva terapia radiometabolica in caso di persistenza o recidiva di malattia loco-regionale e/o presenza di metastasi a distanza. La scintigrafia corporea total-body con 131I (WBS) è un’indagine
ad elevata specificità che si basa sul fatto che lo 131I è captato dalla maggior parte delle metastasi. Viene eseguita dopo circa 7-10 giorni dalla terapia radiometabolica e a distanza di 6-12 mesi dal trattamento ablativo per
verificarne il risultato e per cercare l’eventuale presenza di metastasi a distanza (WBS diagnostico).
Requisito indispensabile all’esecuzione del WBS diagnostico è il livello ematico elevato di TSH (>30-50 mU/L), in quanto il TSH stimola l’espressione del trasportatore specifico necessario per la captazione dello ioduro (NIS, Natrium Iodide Symporter) e delle proteine necessarie per la sua organificazione (tireoperossidasi e tireoglobulina), ciò si può ottenere o preparando il paziente con somministrazione esogena di rhTSH (0,9 mg i.m. due giorni prima l’assunzione dello 131I) o facendogli sospendere la terapia con L-tiroxina dalle 4 alle 6 settimane prima di eseguire l’esame. L’acquisizione scintigrafica viene eseguita dopo 48 ore dall’assunzione per os di una dose di 131I con una bassa attività (3-5 mCi) nel primo caso e 72 ore dopo nel secondo caso.
Si suggerisce in genere di non somministrare più di 5 mCi (185 MBq) per evitare il fenomeno dello stunning (stordimento funzionale) prodotto dagli effetti radiobiologici legati all’emissione β- del 131I sulle cellule tiroidee. Questo è un importante fattore in quanto potrebbe limitare l’entità di concentrazione del 131I somministrato per la terapia radiometabolica se effettuata in un arco di tempo ravvicinato al WBS diagnostico. La scintigrafia diagnostica può essere eseguita anche impiegando lo 123I che non genera l’effetto di stunning ed ha una dosimetria più favorevole (in questo caso l’acquisizione scintigrafica è eseguita 24 o al massimo 48 ore dopo la sua somministrazione). E’ poco usato però nella pratica clinica per il suo alto costo.
Nel WBS con 131I la rilevazione di aree iodocaptanti successivamente alla completa siderazione dei tessuti residui tiroidei in aree diverse da quelle della fisiologica distribuzione di 131I (tessuto rinofaringeo, ghiandole salivari, stomaco, tubo digerente, vescica e residui di tessuto tiroideo normale), è quasi sempre associata a presenza di tessuto neoplastico residuo o recidivante28. Mentre nei pazienti con CTD a basso rischio sottoposti a terapia chirurgica ed ablativa con Tg negativa in terapia soppressiva non è necessario eseguire un WBS nel follow-up, per i pazienti con Tg >2 ng/mL dopo stimolo con rhTSH è
raccomandabile eseguire un WBS in quanto ad elevati livelli di Tg corrisponde positività scintigrafica21. In quest’ultimo caso si sottoporrà il paziente a nuovo ciclo di terapia radiometabolica.
Per quanto riguarda l’ecografia del collo rappresenta una metodica sensibile (94%) nella rilevazione di tessuto tumorale persistente o per metastasi linfonodali in sede latero-cervicale20.
L’esame richiede l’uso di un ecografo dotato di sonda ad alta risoluzione (7.5 mHz) e con la metodica color-doppler si può studiare anche il flusso ematico intraparenchimale e dei grossi vasi tiroidei. Il suo uso è raccomandato 6-12 mesi e poi ogni anno dopo terapia chirurgica e per un periodo di tempo dipendente dal rischio di recidiva del paziente e dallo stato della Tg.
Nel 60-70% dei casi le recidive a livello del collo sono linfonodali ed i linfonodi più interessati sono quelli del compartimento centrale paratracheale nel 50% dei casi27 (Livello VI), seguiti da quelli del compartimento medio-giugulare (Livello III), sopraclavicolare (Livello IV) e i linfonodi sub digastrici (Livello I)29.
L’ecografia non ci può dare informazioni sulla presenza di metastasi mediastiniche e polmonari, da qui è nata l’esigenza dell’utilizzo di altre metodiche di imaging come la TC spirale e la RMN utili tra l’altro anche per la identificazione delle metastasi ossee che nel carcinoma tiroideo sono quasi sempre di tipo osteolitico e quindi, non ben visibili alla scintigrafia ossea con difosfonati marcati con 99mTc.
1.3 Ruolo della PET nel management del CTD
Il dosaggio sierico della Tg ed il WBS post-terapeutico giocano un ruolo molto importante nel follow-up del CTD per identificare la persistenza di malattia o la presenza di metastasi in quanto ad elevati livelli di Tg (>10 ng/mL) corrisponde un WBS positivo, ma non è sempre così, infatti vi è una percentuale di casi in cui il WBS post-terapeutico non mette in evidenza la presenza di lesioni mentre
i livelli di Tg sono elevati30. Questa percentuale che dipende dal tipo e dalle varietà istologiche varia dal 30 al 70% dei casi e può essere una caratteristica biologica già presente all’esordio di malattia (come nel caso del carcinoma follicolare a cellule di Hürtle) oppure può essere dovuta ad altre motivazioni. A tale riguardo sono state avanzate due ipotesi: la prima è che il volume del tumore possa essere troppo piccolo per essere rilevato con la scintigrafia; la seconda è che per un processo di differenziazione le cellule tumorali possano perdere la capacità di captare lo Iodio ma non quella di secernere la Tg31. In questi casi in passato, prima della PET, oltre alle metodiche di imaging convenzionale quali l’ecografia, la TC, la RMN, sono state usate altre metodiche di imaging usando radiofarmaci oncotropi come il 201Tl, il 99mTc-Sestamibi e la 99mTc-Tetrofosmina che hanno un meccanismo di accumulo diverso da quello dello 131I, pertanto prima di effettuare la scintigrafia non è necessario sospendere la terapia ormonale. Per quanto riguarda il primo tipo di scintigrafia, si basa sul meccanismo di accumulo del 201Tl che appare correlato con il flusso ematico e con la concentrazione di potassio nelle cellule tumorali. Il 201Tl penetra nella cellula con un meccanismo legato all’attività ATPasica dipendente dalla pompa Na/K21. E’ stato visto che il 201Tl aveva una sensibilità maggiore per studiare metastasi linfonodali mediastiniche e del collo ma la captazione epatica rendeva difficile lo studio addominale. Il 99mTc-Sestamibi e la 99mTc-Tetrofosmina sono traccianti che si legano con meccanismo attivo ai mitocondri, di cui il tessuto neoplastico è ricco soprattutto se poco differenziato, in particolare il 99mTc-Sestamibi rappresenta il tracciante di prima scelta per studiare le recidive del carcinoma tiroideo a cellule di Hürtle28. Queste scintigrafie sono complementari alla scintigrafia corporea totale con 131I e sono più sensibili per studiare i carcinomi tiroidei poco differenziati ma presentano una sensibilità e una specificità bassa tale che in alcuni casi è necessario fare una diagnosi citologica per confermare la natura neoplastica dell’area captante il radiofarmaco28.
Nel corso degli anni si è andato ad affermare sempre più il ruolo della PET nel follow-up del CTD, già nel 1999 infatti, Grünwald et al.32 effettuarono uno studio di confronto tra la PET con [18F]FDG, il WBS con 131I, la scintigrafia con 99mTc-Sestamibi e la scintigrafia con 201Tl, dimostrando la maggiore sensibilità della metodica PET (75%) rispetto alle altre scintigrafie, in particolare quella con il 201Tl e con il 99mTc-Sestamibi (50%)30. Sono stati effettuati inoltre numerosi studi a conferma dell’importante ruolo della PET nel follow-up del CTD per la ricerca di lesioni metastatiche linfonodali (Wang et al., Stokkel et al.)27 e a distanza, in particolare in quei casi con WBS negativo ed elevati livelli di Tg (Wang et al.)33. Sin dal primo caso in letteratura di captazione del [18F]FDG da parte del CTD metastatico (1987), sono stati considerati un certo numero di usi della PET nel cancro della tiroide.
Nella tabella 3 sono mostrate le potenziali indicazioni per eseguire una PET nel cancro della tiroide34 (Hall&Kloos):
Tabella 3
Potential indications for PET scanning in thyroid cancer. [Adapted from Larson and Robbins ]
Strongest Indications for PET Imaging
Thyroglobulin positive with unknown tumor location.
High-risk patients to determine the extent of disease (including those with known metastatic disease who may have additional metastases).
To determine long-term prognosis. Post-treatment response assessment.
Hürthle cell carcinoma evaluation and management .
Selection of patients with aggressive distant metastases for experimental therapies Weaker Indications for PET Imaging
Low-risk patients to determine extent of disease.
Known metastases to determine their extent and relationship to vital structures.
Lesional dosimetry (124I; half-life ~4 days) allowing both scatter and attenuation correction . Evaluation of the thyroid nodule .
La figura seguente mostra invece il nuovo paradigma per il follow-up del DTC (Mazzaferri&Massoll)18:
Figura 2. Follow-up del DTC
E’ importante sottolineare che la PET deve essere considerata non in sostituzione del WBS, ma in associazione ad esso. Per la determinazione delle
metastasi la PET ha una sensibilità del 50% versus 61% del WBS mentre quella delle due metodiche in associazione sale all’86%21.
In un recente studio (Caleo et al.) è stato osservato un gruppo di 13 pazienti affetti da CTD e trattati con tiroidectomia totale o subtotale e linfoadenectomia dei linfonodi metastatici35. Questi pazienti sono stati studiati con: ecografia, scintigrafia con 131I e PET con [18F]FDG (queste ultime effettuate dopo sospensione della terapia con L-tiroxina). Nel 91% dei casi le tre metodiche hanno mostrato una concordanza dei risultati nella valutazione di diverse regioni del collo e nella identificazione dei siti di malattia a distanza (77%). L’ecografia ha mostrato maggiore sensibilità nella valutazione della regione del collo (loggia tiroidea, regioni latero-cervicali e sovra-claveari) e nella valutazione delle linfoadenopatie loco-regionali36. Il WBS si è dimostrato importante per la caratterizzazione della differenziazione tessutale delle lesioni tumorali, per quantizzare e valutare il residuo ghiandolare e per identificare le metastasi a distanza. Mentre la PET con [18F]FDG ha mostrato un ruolo importante per valutare le recidive e le metastasi loco-regionali e/o a distanza nei casi di CTD che nel corso del follow-up sono andati incontro a differenziazione (Tg positiva e WBS negativo).
Diversi studi hanno inoltre mostrato una variabile captazione dello 131I e del [18F]FDG da parte delle metastasi da CTD37, non è raro infatti osservare metastasi che captano lo 131I ma non il [18F]FDG ed altre che captano solo il [18F]FDG. Questa differenza di captazione è stata definita fenomeno flip-flop38 ed è dovuta al fatto che con la de-differenziazione delle cellule neoplastiche tiroidee, parallelamente alla perdita di concentrazione dello iodio, si ha la comparsa dell’ipercaptazione di [18F]FDG per un’aumentata espressione del GLUT-1, questa condizione si traduce nella possibilità di impiegare la PET con [18F]FDG per identificare le sedi di ripresa di malattia in questa situazione clinica39. Vedi figura 3.
Pertanto da questo studio è emersa non solo l’importanza del ruolo integrato delle tre tecniche diagnostiche nel follow-up del DTC ma anche la
complementarietà e l’efficacia delle due metodiche scintigrafiche, WBS con 131I e PET con [18F]FDG, nella ricerca delle metastasi a distanza a conferma anche dell’eterogeneità di captazione dei due traccianti35. Infine l’uso della più recente metodica ibrida PET/TC ha portato ad un aumento della accuratezza diagnostica fornendo informazioni da un punto di vista metabolico ed anatomico40.
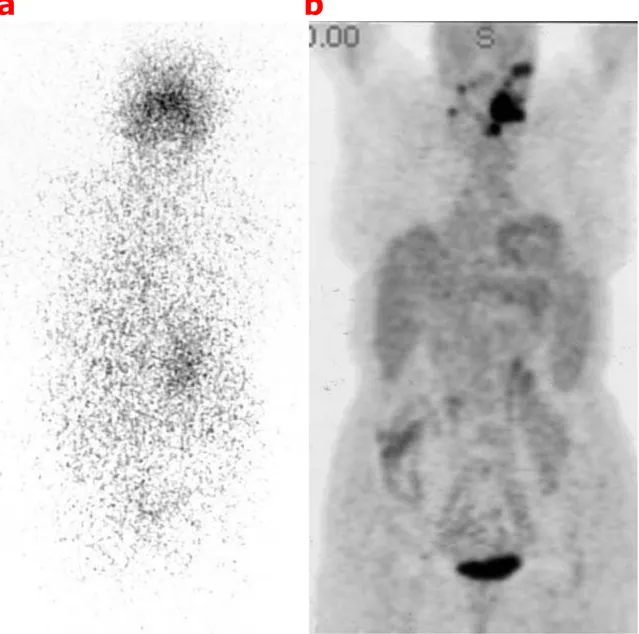
a b
Figura 3. Caso clinico n.11 (Caleo et al.): paziente in cui il WBS (a) e la PET
con [18F]FDG (b) hanno mostrato una concordanza di risultati, l’accumulo dei
due traccianti, 131I e [18F]FDG, si evidenziava infatti nello stesso sito
anatomico (cresta iliaca destra e regione polmonare destra), dove anche la TC ha dimostrato la presenza di lesioni35;
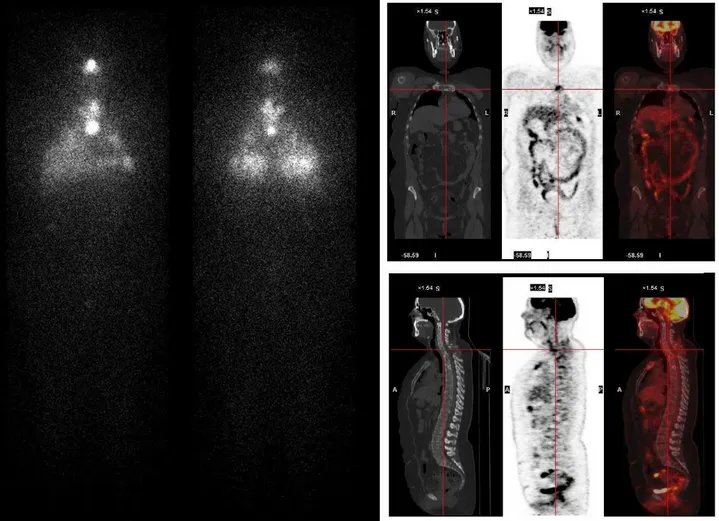
a b
Figura 4. Caso clinico n.10 (Caleo et al.): caso in cui invece le immagini hanno
mostrato una discordanza tra i risultati ottenuti dal WBS (a) che non mostrava significative aree di iodofissazione e PET con [18
F]FDG (b) che invece mostrava lesioni linfonodali metastatiche in sede latero-cervicale sinistra confermate poi dall’esame ecografico35.
Nelle figure 5 e 6 sono riportati invece due esempi clinici rilevati presso il Centro Regionale di Medicina Nucleare della Azienda Ospedaliero Universitaria Pisana.
Figura 5. carcinoma poco differenziato con aree papillari solide, insulari, trabecolari del lobo
sinistro della tiroide (diametro massimo 10 cm), infiltrante la capsula della neoplasia con emboli neoplastici e metastasi linfonodali, mediastiniche, polmonari ed ossee trattato con tiroidectomia totale e terapia ablativa con radioiodio. La scintigrafia con 131I (a sinistra) e la
PET/TC con [18F]FDG (a destra) hanno dimostrato concordanza di risultati per le lesioni ossee
rilevate a livello del manubrio sternale, del rachide cervico-dorsale (C1, C7, tratto D1-D4) mentre le lesioni polmonari bilaterali si mostravano captanti solo lo 131I e non il [18F]FDG
Figura 6. Paziente con carcinoma papillare del lobo destro tiroideo (diametro massimo 1,5 cm)
con metastasi ai linfonodi peritiroidei, latero-cervicali di destra e pararetrotracheali di destra trattato con tiroidectomia totale, linfoadenectomia latero-cervicale destra in due tempi e terapia ablativa con radioiodio. Questo è un caso di discordanza di risultati scintigrafici e PET/TC, infatti nonostante il sospetto clinico di presenza di recidiva e/o metastasi per aumento dei valori della Tg (189 ng/mL dopo stimolo con rhTSH) l’indagine scintigrafica si mostrò negativa (a sinistra) al contrario delle immagini PET/TC (a destra) dove si evidenziava invece una lesione linfonodale confermata poi anche da indagine ecografica.
1.4 Principi dell’uso della PET/TC con [18F]FDG
La PET (Positron Emission Tomography) è una metodica di imaging medico-nucleare basata sulla somministrazione di radiofarmaci marcati con radionuclidi emittenti positroni41.
Attualmente oltre il 90% degli studi oncologici PET sono effettuati utilizzando come radiofarmaco un analogo del glucosio, il 2-deossiglucosio marcato con Fluoro-18 ([18F]FDG) il quale una volta somministrato per via endovenosa, si
distribuisce nei tessuti in misura proporzionale al flusso ematico distrettuale e viene trasportato nell’ambiente cellulare con un meccanismo di trasporto transmembrana facilitato tramite un sistema di trasporto comune con il glucosio nativo, basato su proteine transmembrana definite trasportatori di glucosio, di questi sono noti almeno 12 diversi tipi detti “glucose transporter 1” o GLUT1, GLUT2 e così via. Nella cellula il [18F]FDG segue lo stesso destino metabolico del glucosio endogeno ed è fosforilato dall’enzima esochinasi-II a formare il [18F]FDG-6-P il quale per la presenza del Fluoro al posto del gruppo ossidrile in posizione 2, non può proseguire nella cascata metabolica e si accumula nelle cellule permettendo quindi di visualizzare la sede di accumulo più agevolmente. L’azione della glucosio-6-fosfatasi induce una rapida uscita del tracciante dal compartimento intracellulare, questa uscita è invece molto lenta nel caso del [18F]FDG-6-P per il quale il passaggio transmembrana in senso intra—›extracellulare è trascurabile41. Pertanto circa 50-60 minuti dopo la somministrazione endovena del radiofarmaco si raggiunge una fase di plateau (ovvero una fase di più lento accumulo del tracciante che può durare fino a 3 ore) durante la quale la radioattività intracellulare è riferibile interamente al [18F]FDG-6-P42,43. In questa fase il pool ematico del 18F-FDG è ridotto e si realizza un migliore rapporto [18F]FDG-6-P/[18F]FDG libero; l’attività registrata in un distretto corporeo rappresenta un indice affidabile dell’effettivo consumo di glucosio da parte di quel distretto44.
L’aumento della domanda energetica che caratterizza la divisione cellulare intrinseca di un tumore in crescita, richiede un aumento della disponibilità del glucosio attraverso una rapida ed efficiente distribuzione della stesso a sostegno della rapida crescita. Questo comporta all’inizio un aumento dei trasportatori GLUT per favorire l’arrivo del glucosio all’interno della cellula ed un aumento dell’attività dell’esochinasi per determinare un aumento della produzione di energia.
Il risultato sarà quindi un aumento del metabolismo del glucosio nelle cellule tumorali rispetto a quelle normali45.
L’esame PET viene eseguito a digiuno (da almeno 4 ore) in quanto, in condizioni di digiuno i tessuti del corpo (eccetto il cervello), usano gli acidi grassi liberi come substrati energetici preferenziali e si avrà così la creazione di un contrasto tra cellule normali e cellule neoplastiche poiché il [18F]FDG viene captato dalle cellule neoplastiche che spesso non sono capaci di usare altri substrati oltre ai carboidrati per produrre energia45.
Prima di effettuare l’iniezione del tracciante sono controllati i livelli di glicemia che devono essere 200 mg/dL. Elevati livelli di glicemia possono essere causa di reperti falsamente positivi. L’esame inizia dopo 50-60 minuti dall’iniezione del [18F]FDG e durante questo periodo bisogna idratare adeguatamente il paziente per accelerare l'eliminazione urinaria del radiofarmaco41. Il [18F]FDG essendo un analogo del glucosio, mostra un accumulo fisiologico in alcuni tessuti normali e negli organi emuntori (corteccia cerebrale, muscolo striato in attività, miocardio, reni e vie urinarie, tratto gastrointestinale), inoltre esso si accumula anche in diversi istotipi cellulari non neoplastici (fibroblasti, tessuto infiammatorio) che proliferando hanno un’elevata attività glicolitica28.
L'indagine fornisce informazioni sulla sede, sull’estensione della malattia neoplastica e sulla caratterizzazione biologica in termini di aggressività del tumore utilizzando metodi di analisi quantitativa o semiquantitativa.
Nell'impiego clinico si impiega comunemente un metodo semiquantitativo che comporta il calcolo del cosiddetto “Standardized Uptake Value” (SUV), espresso con la seguente formula:
SUV = Attività rilevata mCi / gr di tessuto Attività iniettata mCi / peso corporeo gr
Il SUV esprime il rapporto fra la quantità di tracciante accumulata in una lesione (definita come volume in mL o peso in grammi) e la quantità di tracciante che ipoteticamente è presente in una regione di uguale volume se il tracciante fosse distribuito omogeneamente in tutto il corpo.
Un valore SUV > 1 indica un accumulo preferenziale in una certa lesione, un valore SUV < 1 indica un ridotto accumulo rispetto alla concentrazione radioattiva di fondo. Vi sono altre elaborazioni del SUV nelle quali sono introdotti parametri di correzione come la massa corporea magra (SUVLBM) o la superficie corporea (SUVBSA), queste correzioni però sono poco usate nella pratica clinica39.
I tessuti con un elevato SUV hanno un elevato metabolismo ed i tumori con un SUV elevato sono più proliferanti ed aggressivi. Il valore del SUV è principalmente utilizzato ne monitoraggio nel tempo di una determinata lesione tumorale. Come mostrato nella sottostante tabella (tabella 4), la Organizzazione Europea per la Ricerca e Cura del Cancro (EORTC) raccomanda l’uso del SUV per stimare la completezza o meno della risposta al trattamento della patologia in esame46:
Tabella 4
EORTC recommendations for evaluating tumour response to
treatment by[18
F]FDG PET Progressive disease: SUV increase>25%
Visible increase in tumour volume (>20% greater axis) Appearance of new metastases
Stable disease:
SUV increase SUV<25% SUV reduction <15%
No visible detectable increase in tumour volume Partial response:
SUV reduction 15-25% after first cycle of therapy SUV reduction>25% after following cycles after the first Complete response:
Disappearance of uptake at [18F]FDG PET
Analisi più complesse che mirano alla stima quantitativa assoluta del metabolismo glucidico della lesione neoplastica sono in genere riservate per ricerca e non si adattano alla pratica clinica in quanto le modalità di acquisizione e di analisi dei dati sono laboriose e “time comsuming”41.
1.5 Usi clinici della PET/TC con [18F]FDG
Nel corso degli anni l’utilizzo della [18F]FDG PET/TC in campo oncologico si è andato sempre più affermando fino ad assumere un ruolo preminente fra le applicazioni di questa metodica a scopo clinico. Attualmente gli esami PET in ambito oncologico rappresentano il 90% di tutti gli esami effettuati in tutti i centri PET41.
In particolare l’uso della PET/TC con [18F]FDG è andato sempre più ad affermarsi aiutando così il clinico a stadiare, valutare l’estensione delle neoplasie, a porre diagnosi differenziale tra lesioni benigne e lesioni maligne, a fare diagnosi differenziale tra recidiva neoplastica e fibrosi post-chirurgica o post-radioterapica, nonché a valutare la risposta terapeutica47,48.
La PET/TC permette inoltre di valutare il grado di malignità del tumore e di attività metabolica fornendo così un’indicazione prognostica, di effettuare una
valutazione precoce della risposta al trattamento, di localizzare la sede di biopsia (biopsia PET-guidata) e di pianificare il trattamento radioterapeutico28.
1.6 PET/TC con 18F-FDG nel CTD
Dopo la dimostrazione sperimentale di elevato metabolismo glucidico nelle cellule normali, soprattutto se stimolate con il TSH, sono stati effettuati numerosi studi che hanno dimostrato che la somministrazione dell’rhTSH aumenta l’uptake di [18F]FDG nelle cellule tiroidee in vitro21.
Già nel 1987 Filetti et al. infatti dimostrarono che il TSH attivava il trasporto delle cellule FRTL-5 (linea cellulare di ratto) in quanto induceva un aumento dei livelli di mRNA GLUT1, aumentando così le proteine di membrana, come appunto la GLUT1, deputate al trasporto del glucosio49. Sono stati pertanto effettuati numerosi studi da diversi autori, per affermare la validità della PET/TC con [18F]FDG nella diagnosi di persistenza e/o recidiva di malattia in quella categoria di pazienti affetti da CTD che hanno livelli di Tg elevati associati ad un WBS negativo50. Questa situazione, che rappresenta il 10-15% circa dei casi, può essere gestita utilizzando altre metodiche di imaging (ecografia, TC, RMN, scintigrafia con 201Tl, 99mTc-Sestamibi, 99mTc-Tetrofosmina) che però hanno mostrato un’accuratezza inferiore rispetto alla PET/TC con [18F]FDG50.
Come già detto, la sensibilità della scintigrafia corporea con 131I e del dosaggio sierico della Tg è ottimale se questi esami sono effettuati in condizioni di stimolazione da parte del TSH (il quale stimola il metabolismo, il trasporto del glucosio e la glicolisi dei tireociti)50 ottenuta o tramite sospensione della terapia tireo-soppressiva con L-tiroxina (L-T4) o tramite stimolo esogeno con rhTSH.
E’ invece ancora dibattuto il ruolo dei livelli sierici aumentati di TSH (se ottenuti da sospensione della terapia e da stimolo con rhTSH) sulla sensibilità diagnostica della PET/TC con [18F]FDG51,52.
Diversi parametri, come il consumo di glucosio, l’espressione di diversi geni del trasporto intracellulare del glucosio e l’attività dell’esochinasi possono influenzare l’uptake di [18F]FDG da parte delle cellule tumorali. Già nel 1995 Matthaei et al.53 osservarono in adipociti di ratto, un aumento dell’attività dei trasportatori del glucosio, in particolare il GLUT-4, ma una riduzione del numero degli stessi trasportatori in condizioni di ipotiroidismo.
Lazar et al.54 osservarono in un numero limitato di pazienti una correlazione inversa tra aumentata espressione del GLUT-1 e capacità di captare lo 131I da parte delle metastasi da CTD.
Borner et al.55 dimostrarono che un aumento della captazione di [18F]FDG negli adenomi tossici non chiarendo però, se questo fenomeno era legato ad un’alterazione primitiva dei recettori per il TSH o ad una soppressione secondaria dei livelli circostanti di TSH in questa patologia caratterizzata da iperproduzione degli ormoni tiroidei. Comunque, non è ancora noto quali di questi meccanismi giochi un ruolo decisivo nel processo di uptake di [18F]FDG da parte delle cellule tumorali derivate dall’epitelio follicolare tiroideo.
In generale, possiamo dire che è il grado di differenziazione del tumore che condiziona il grado di influenza del TSH sul processo di uptake. Questo si può dimostrare infatti nei tumori poco differenziati che sono meno dipendenti dal TSH per la perdita dell’integrità dei recettori per il TSH.
Nella risposta alla stimolazione da parte del TSH bisogna considerare la Tg, la cui misurazione dipende principalmente da tre variabili: la massa del tessuto tiroideo presente (benigno o neoplastico); il grado di stimolazione dei recettori della tireotropina e l’abilità intrinseca del tumore a sintetizzare e secernere la Tg. La misurazione della Tg può essere interpretata relativamente allo stato del TSH del paziente, quando il TSH è basso (come si ha durante la terapia con L-T4), il dosaggio sierico basale della Tg può essere non rilevabile e bisogna somministrare rhTSH per rendere la Tg misurabile. La risposta alla somministrazione dell’rhTSH è un indice della sensibilità del tumore al TSH. In
risposta allo stimolo con rhTSH i livelli di Tg hanno un aumento superiore in condizioni fisiologiche e nei pazienti con CTD rispetto ai pazienti con carcinomi tiroidei scarsamente differenziati56.
Bläser et al.57 in un recente studio in vitro sulle cellule FRTL-5 di ratto, evidenziò un aumento della captazione di [18F]FDG nelle cellule stimolate con TSH attraverso un diverso meccanismo di trasduzione intracellulare del segnale (PI3-kinase) differente rispetto a quello che influenza l’accumulo del radioiodio (PKA), offrendo una spiegazione possibile del fenomeno flip-flop e cioè la presenza di metastasi di CTD non iodofissanti ma con captazione di [18F]FDG TSH-dipendente.
Oltre il TSH bisogna però anche considerare il ruolo svolto dagli ormoni tiroidei nell’influenzare la distribuzione intra ed extracellulare del [18F]FDG: l’attività metabolica infatti si riduce in condizioni di ipotiroidismo, fenomeno che si verifica anche nelle cellule neoplastiche, come dimostrato dall’aumento del rapporto tumore/fondo del [18F]FDG dopo correzione delle condizioni di ipotiroidismo58,59.
Nonostante queste premesse fisiopatologiche, i dati clinici riguardanti gli effetti del TSH endogeno sulla sensibilità della PET nei pazienti con CTD sono ambigui.
In uno studio multicentrico (Grünwald et al.) condotto su 222 pazienti affetti da CTD, la sensibilità della PET con [18F]FDG era più alta (91%) nei pazienti con TSH soppresso rispetto a quelli con TSH elevato da ipotiroidismo indotto tramite sospensione della L-tiroxina (67%)60. A questa ridotta sensibilità però corrispondeva una maggiore specificità in condizioni di stimolo con TSH (94% versus 74%). E’ stato visto inoltre che la sensibilità globale della PET con [18F]FDG (considerando tutti i pazienti arruolati nello studio e cioè sia quelli in tireo-soppressione che quelli in ipotiroidismo con TSH alto), era del 75% (85% nei casi con WBS negativo e 65% nei casi con WBS positivo) e più alta nei pazienti con carcinomi scarsamente differenziati (68.2% versus 29.4%).
Wang et al.61 riscontrarono che la sensibilità della PET con [18F]FDG nel rilevare le metastasi in 37 pazienti con Tg elevata e WBS negativo, non era aumentata dalla sospensione della terapia con L-T4 tale da indurre alti livelli di TSH endogeno; in questi pazienti con carcinomi tiroidei a diversi gradi di differenziazione, la PET con [18F]FDG aveva un valore predittivo positivo del 92% ed un valore predittivo negativo del 93%.
In un altro studio (Sisson et al.) in contrasto con questi dati, la PET con [18F]FDG è stata effettuata (pur se in un solo paziente) prima in condizioni di ipotiroidismo poi durante terapia tireo-soppressiva, fu riscontrato che la stimolazione da parte del TSH endogeno induceva una maggior captazione di [18F]FDG62.
Moog et al63. riportarono risultati intraindividuali di pazienti con CTD confrontando gli studi [18F]FDG PET in condizioni di ipotiroidismo da sospensione della terapia con L-T4 (TSH endogeno elevato) con quelli durante soppressione del TSH. Osservarono un più alto rapporto tumore/fondo (5.84 versus 3.85) durante stimolazione con TSH che durante tireo-soppressione. In 3 pazienti su 10, furono identificate nuove lesioni e lesioni già note furono classificate come neoplastiche solo dopo sospensione dell’ormone tiroideo.
Van Tol et al. ottennero risultati simili confermando che il numero delle lesioni identificate e la captazione di [18F]FDG erano più alti dopo stimolazione da parte del TSH endogeno (indotto da sospensione della terapia con L-T4) che durante terapia tireo-soppressiva64.
Petrich et al.65 valutarono per primi l’accuratezza diagnostica della PET con [18F]FDG in pazienti con CTD recidivante (Tg positiva e WBS negativo), confrontando i risultati ottenuti in condizioni di TSH soppresso con quelli ottenuti dopo stimolazione con rhTSH. Riscontrarono che la [18F]FDG PET effettuata dopo stimolazione con rhTSH identificava più lesioni (78 versus 22) in una frazione maggiore di pazienti (19/30 versus 9/30) e con più alti valori
sia del rapporto tumore/fondo (5.5 versus 2.5) sia del SUV (2.77 versus 2.05) rispetto ai risultati ottenuti in tireo-soppressione.
Analoghi risultati sono stati descritti da Chin et al.66 in uno studio prospettico randomizzato di confronto dopo stimolo con rhTSH ed in corso di soppressione con L-T4 in pazienti con CTD non iodocaptante ma con elevati livelli di Tg e quindi sospetta malattia residua e/o recidive occulte.
Di recente Leboulleux et al.67 hanno comparato le immagini PET/TC eseguite prima (PET basale) a quelle eseguite dopo 24-48 ore dalla somministrazione di rhTSH (rhTSH PET) in 63 pazienti e videro che l’utilizzo dell’rhTSH per la PET/TC con FDG determinava un significativo incremento del numero delle lesioni trovate, ma il numero dei pazienti nei quali ogni lesione era stata trovata non erano diversi tra le scansioni PET basali e quelle dopo rhTSH.
I dati emersi dalla Letteratura Scientifica mostrano quindi una certa contraddittorietà per quanto riguarda l’effetto indotto dal TSH endogeno (per sospensione della terapia con L-T4) sulla sensibilità della PET/TC con [18F]FDG nella identificazione delle recidive e/o metastasi nei pazienti con CTD non iodocaptante.
Per quanto riguarda invece la PET/TC con [18F]FDG effettuata dopo stimolazione con rhTSH, anche se i dati in Letteratura sono scarsi e basati su piccoli gruppi di pazienti, vi è una tendenza per una maggiore sensibilità dell’esame condotto dopo somministrazione di rhTSH rispetto alle condizioni basali di tireo-soppressione. Quindi l’utilizzo dell’rhTSH nella preparazione PET oltre ad aumentare l’uptake del glucosio e l’attività glicolitica e quindi la sensibilità e la specificità della [18F]FDG PET/TC nel localizzare e quantificare gli eventuali residui di malattia e/o metastasi, ha anche un altro vantaggio cioè quello di ovviare alla morbidità data dall’ipotiroidismo e al rischio di progressione del tumore associato alla temporanea discontinuità dell’ormonoterapia66.

![Figura 3. Caso clinico n.11 (Caleo et al.): paziente in cui il WBS (a) e la PET con [ 18 F]FDG (b) hanno mostrato una concordanza di risultati, l’accumulo dei due traccianti, 131 I e [ 18 F]FDG, si evidenziava infatti nello stesso sito](https://thumb-eu.123doks.com/thumbv2/123dokorg/7534503.107436/19.892.156.741.325.917/paziente-mostrato-concordanza-risultati-accumulo-traccianti-evidenziava-infatti.webp)